Открытый артериальный проток
| Вид материала | Документы |
СодержаниеКлиника, диагностика. Т в левых грудных отведениях могут быть отрицательными и интервал ST Дифференциальный диагноз Течение, лечение. |
- 4. Артериальный (боталлов) проток: а) функционирует в пренатальном онтогенезе; б) соединяет, 341.31kb.
- Медицинские показания и противопоказания для направления на санаторно-курортное лечение., 70.77kb.
- Лекция 28: Мужская половая система, 172.99kb.
- Открытый школьный доклад, 559.63kb.
- Открытый школьный доклад, 335.6kb.
- Председатель Управляющего Совета «12» сентября 2011 г. /Маргушева З. М./ Открытый информационный, 914.73kb.
- Удк 556. 55 Деякі проблеми еколого-гідроморфологічного зонування урбанізованих водойм, 281.23kb.
- Положение Опроведении спортивного мероприятия открытый всероссийский, 145.57kb.
- На конкурс представляются законченные научно-исследовательские работы студентов, 103.34kb.
- М. В. Гусева посвящается биополитика открытый междисциплинарный семинар, 578.2kb.
Р О С С И Й С К А Я Ф Е Д Е Р А Ц И Я
Министерство здравоохранения Забайкальского Края
----------------------------------------------------------------------------------------------------
Государственное учреждение здравоохранения
КРАЕВАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА
Коханского ул., д. 7, г. Чита, 672038, тел. 31-43-23, факс. (302-2) 31-43-24
E-mail: okboffice@mail.ru
_________________________________________________________________
№_406-о__ «__18___»__07__ 2011г.
«Утверждаю»
Главный врач ККБ__________________________
Лиханов И.Д.
Информационное письмо
ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Врач ОФД ККБ С.В. Воронцова
Открытый артериальный проток ( dustus arteriosus, боталлов проток ) — сосуд, соединяющий аорту и легочную артерию, сохранивший нормальную для плода структуру после истечения срока его закрытия. Порок описан Галеном во II веке, но первое сообщение принадлежит G . Aranzio (1564). Название дано в честь итальянского врача Л . Боталло, описавшего порок немного позже.
Открытый артериальный проток ( ОАП ) является одним из наиболее распространенных пороков : по клиническим данным частота его составляет 10 — 18 % от всех ВПС, по паталогоанатомическим данным — 3% от всех ВПС , среди популяции — 0,3 %. Частота ОАП у недоношенных новорожденных составляет 15 — 80%; при массе менее 1000г максимальная частота 80%, при 1500 2000 г — 10 15 %.
ОАП располагается в верхнем отделе переднего средостения и прикрыт листком париетальной плевры. Проток отходит от аорты на уровне левой подключичной артерии и в большинстве случаев впадает в ствол легочной артерии в месте его деления на две ветви или в начальную часть левой ветви; реже встречается право - или двусторонний проток. Он может быть изолированным или в 5 — 10% сочетаться с другими ВПС ( ДМЖП, коарктация аорты, ДМПП, недостаточность митрального клапана), нередко проток выполняет функцию компенсирующего сообщения при так называемых дуктусзавнсимых пороках (атрезия легочной артерии, крайняя форма тетрады Фалло, атрезия аорты и др.), при которых если ОАП закрывается, жизнь во внеутробном периоде становится невозможной. ОАП имеют в течение нескольких месяцев жизни 50 % детей, рожденных с массой менее 1700г; у 20 % он остается незакрытым

в течение 1 — 2 лет. Практически не закрывается проток у новорожденных с синдромом острых дыхательных расстройств (функционирует в 80 % случаев), что значительно утяжеляет течение основного заболевания и иногда заставляет прибегать к срочному хирургическому вмешательству. Проток может быть длинным, узким и извилистым или коротким и широким, диаметр его составляет от 2 — 3 до 30мм, чаще 3 — 15мм, длина 3-25 мм, Систолодиастолический шум слышен, если диаметр протока превышает 4мм.
В зависимости от формы протока существуют различные анатомические типы порока: цилиндрический, воронкообразный, окончатый, аневризматический. При длительном существовании протока может возникать его кальциноз с переходом на аорту. На аутопсии в 15 % случаев обнаруживают сопутствующие пороки развития внутренних органов (желудочно-кишечного тракта, мочеполовой системы и др.).
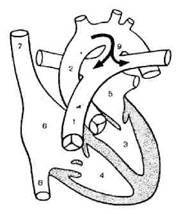
Гемодинамика (рис . 4). В период внутриутробного развития основное количество крови у плода из правого желудочка (4) и легочного ствола поступает через артериальный проток в аорту. После рождения, с первым вдохом легочное сопротивление падает и поднимается давление в аорте, что способствует возникновению обратного сброса (из аорты в легочную артерию). Высокое насыщение крови кислородом после включения легочного дыхания вызывает спазм протока; шум исчезает в течение 15 — 20 ч (функциональное закрытие); у недоношенных детей боталлов проток остается открытым более длительно из-за снижения чувствительности к кислороду констрикторного рефлекса. Окончательная облитерация и превращение протока в ligamentutn arteriosum происходит в период от 2- й до 10- й недели внеутробной жизни. Артериальный проток считается аномалией, если по клиническим данным он функционирует спустя 1 — 2 нед после рождения. Закрытие протока начинается в месте его отхождения от легочной артерии, где имеется большое количество гладкомышечных клеток. Возможно, что незакрытие артериального протока связано с дефицитом или недоразвитием гладкомышечных клеток или эластических волокон в его стенке. Увеличенное насыщение крови кислородом является главным стимулом для сокращения гладкомышечных клеток. Выделяющиеся при этом брадикинин и ацетилхолин способствуют сокращению протока, тогда как простагландин Е поддерживает его в состоянии дилатации. В тех случаях, когда проток не закрывается, эластическая ткань стенки замещается мышечной.
При ОАП (9) происходит сброс окснгенированной крови из аорты (2) в легочную артерию ( I ), поэтому это порок бледного типа. Сброс из аорты происходит и во время систолы, и в период диастолы, так как в обе эти фазы давление в аорте превышает таковое в легочной артерии. У детей первых месяцев жизни часто отсутствует диастолический градиент давления между аортой и легочной артерией, поэтому сброс происходит только в систолу. Отсутствие в первые недели жизни большой разницы в давлении между малым и большим кругами кровообращения приводит к тому, что при крике, ОРВИ или пневмонии возникает обратный (веноартериальный) сброс крови через ОАП, появляется цианоз. Клинически тяжесть течения порока определяется следующими факторами: 1) размерами протока; 2) углом отхождения его (более благоприятно, если он отходит от аорты под острым углом, хуже — если под тупым, поскольку это способствует большему сбросу; 3) величиной общелегочного сопротивления. При большом протоке значительное количество крови поступает в легочную артерию, затем в левые отделы (3, 5), вызывая их объемную перегрузку. Кроме того, давление в аорте передается непосредственно через проток в легочную артерию, что способствует раннему развитию легочной гипертензии. В таких случаях, если сопротивление в малом круге кровообращения будет превышать таковое в большом, возникает обратный веноартериальный сброс и появляется цианоз. Гемодинамические нарушения при артериальном протоке обусловливают расширение преимущественно левых отделов сердца, но при развитии легочной гипертензии, особенно в ее склеротической стадии, преобладает дилатация и гипертрофия правого желудочка.
Клиника, диагностика. ОАП чаще встречается у девочек, чем у мальчиков (2- 3:1), что свидетельствует о его мультифакториальном наследовании. Описаны семейные случаи порока. При сборе анамнеза следует обратить внимание на заболевание матери краснухой во время беременности, недоношенность, повторные пневмонии. Течение порока может быть различным : от бессимптомного до появления крайне тяжелых форм. При больших размерах протока ( относительно диаметра аорты ) он проявляет себя уже с первых дней и месяцев жизни. Клиническая картина включает признаки сердечной недостаточности (одышка, тахикардия, гепатоспленомегалия), отставание в физическом и моторном развитии, снижение толерантности к физической нагрузке (при кормлении, ходьбе, беге). При небольших и средних размерах протока течение порока длительно может быть бессимптомным. Подростки и взрослые больные с ОАП часто не отстают от сверстников в физическом развитии. Ухудшение возникает в пубертатный период или позже (после родов, значительных физических перегрузок на работе, в спорте). Постепенно увеличиваются размеры сердца, появляется цианоз вначале при нагрузке, затем в покое (признак веноартериального сброса и высокой легочной гипертензии), медленно развивается сердечная недостаточность.
Крайне тяжелое течение порока типично для недоношенных. Дети с фетальным возрастом до 30 недель имеют небольшое сопротивление в легочных сосудах и поэтому сброс бывает значительным. ОАП у них не сокращается и долго сохраняет большие размеры. Изучение мозгового кровотока у новорожденных с широким ОАП показало его замедление, что способствует гипоксии ЦНС.
Со стороны сердечно - сосудистой системы при боталловом протоке с кардиомегалией рано развивается парастернальный сердечный горб. Верхушечный толчок приподнимающийся, разлитой, смещен книзу. При пальпации определяется дрожание у основания сердца слева: оно отсутствует или исчезает у больных с небольшим протоком или при развитии высокой легочной гипертензии. Сразу после рождения ребенка шум отсутствует. К концу первой недели жизни появляется систолический шум, так как разница в давлении между большим и малым кругами кровообращения в этот период небольшая, и перекрестный сброс происходит только в период систолы. В дальнейшем шум становится типичным систолодиастолическим ( шум мельничного колеса, машинный шум) и лучше выслушивается во втором межреберье слева у грудины и на спине. Иногда у детей первых месяцев жизни он определяется ниже, в третьем - четвертом межреберье, и тогда он трудно отличим от дефекта межжелудочковой перегородки и аортолегочного свища. При тяжелом течении ОАП у новорожденных систолодиастолический шум может появиться только после назначения сердечных гликозидов. У взрослых больных интенсивность шума меньше. Над верхушкой сердца может выслушиваться шум недостаточности митрального клапана (митрализация порока, свидетельствующая о дилатации левого желудочка), тогда как мезодиастолический шум определяется редко даже при большом левоправом сбросе. II тон над легочной артерией усилен, может быть расщеплен или заглушён шумом. Следует помнить, что при повышении давления в системе легочной артерии диастолический компонент шума уменьшается, а затем вовсе исчезает. В таких случаях аускультативная картина ОАП состоит из короткого систолического шума во втором межреберье слева у грудины и резкого акцента II тона над легочной артерией. В дальнейшем при выравнивании систолического и диастолического давлений в аорте и легочной артерии может исчезнуть и систолический шум. В это время появляется цианоз, вначале только при физической нагрузке, а затем постоянный. Цианоз в большей мере выражен на нижних конечностях, чем на лице и верхних конечностях. Все это свидетельствует о высокой легочной гипертензии и невозможности оперативной коррекции порока.
Для ОАП характерен высокий, быстрый пульс. При этом определяется нормальное или несколько повышенное систолическое и низкое диастолическое ( до 30 — 40мм рт . ст .) АД вплоть до появления феномена нулевого диастолического давления, что приводит к увеличению пульсового давления . Последнее не изменено при небольших размерах протока, а также при высокой легочной гипертензии. Определение пульса на бедренных артериях, измерение АД на ногах является обязательным из - за частого сочетания открытого артериального протока с коарктацией аорты.
Признаком большого левоправого сброса через проток является сердечная недостаточность, как правило, смешанного характера (лево- и правожелудочковая): стойкая тахикардия, тахипноэ, увеличение печени и селезенки. Следует подчеркнуть, что спленомегалия у детей первых месяцев и лет жизни при сердечной недостаточности встречается часто и не обязательно является признаком другой патологии, например сепсиса. Появление сердечной недостаточности у взрослых больных с боталловым протоком прогностически неблагоприятный признак.
Осмотр и аускультация больных с ОАП требуют внимания также и потому, что он нередко сочетается с другими ВПС бледного типа или маскируют пороки с цианозом (например, в случаях резкого стеноза или атрезии легочной артерии). При сочетании боталлова протока с дефектом межжелудочковой перегородки дополнительно прослушивается грубый систолический шум в третьем — четвертом межреберье слева у грудины; при высоких дефектах систолический шум может перекрывать систолодиастолический шум боталлова протока (особенно при небольших его размерах). Более затруднено выявление двух пороков при больших их размерах и легочной гипертензии, которая изменяет аускультативную картину обоих ВПС. В таких случаях выслушивается только средней интенсивности систолический шум и в диагностике решающее значение имеют доплер - эхокардиография и рентгенохирургическое обследование.
Заподозрить наличие коарктации аорты помогает снижение или отсутствие пульсации и АД на бедренных артериях, высокое АД на руках, грубый систолический шум на основании сердца и спине. При предуктальной коарктации аорты может наблюдаться симптом дифференцированного цианоза — наличие его на нижних конечностях и отсутствие на верхних. Подтвердить стеноз аорты при ОАП помогают систолическое дрожание и самостоятельный грубый систолический шум во втором межреберье справа у грудины, эхокардиография. ОАП нередко является причиной относительно благоприятного течения выраженного стеноза легочной артерии, восполняя сниженный легочный кровоток; заподозрить компенсирующее значение протока позволяют данные рентгенографии и ЭКГ, когда ведущим является увеличение правого желудочка, тогда как при изолированном ОАП увеличивается левый желудочек. У больных с синдромом врожденной краснухи боталлов проток может сочетаться с периферическим стенозом легочной артерии. Необходимо помнить о возможности сочетания ОАП с недостаточностью митрального клапана разного генеза. При больших размерах протока появление шума недостаточности митрального клапана связано с дилатацией полости левого желудочка и кольца митрального клапана; в таких случаях после операции устранения протока этот шум уменьшается, а затем и вовсе исчезает. В случаях врожденной недостаточности митрального клапана систолический шум на верхушке и дилатация левых отделов сердца сохраняются, в дальнейшем может потребоваться пластика створок митрального клапана. Редко, но возможно при этом развитие фиброэластоза эндокарда, для подтверждения этого показана биопсия сердца; подтвердить дефект створок митрального клапана помогает эхокардиография.
Одним из возможных осложнений при ОАП является бактериальный эндокардит, точнее эндартериит, который встречается с частотой 3,3 случая на 1000 больных, чаще при небольших размерах протока. Вегетации находят в просвете протока со стороны легочной артерии, поэтому возможна эмболия в нее. Клиника бактериального боталлита включает подъем температуры, нередко с ознобом, ухудшение общего состояния и появление признаков интоксикации, болей в сердце, возможны проявления тромбоэмболического синдрома в большом круге кровообращения (при распространении процесса на митральный и аортальный клапаны). Как правило, имеются ярко выраженные лабораторные показатели. Входными воротами инфекции являются полость рта (заболевание зубов, их удаление, ангины), отиты, гайморит. Возможны латентные формы эндартериита.
Другим осложнением могут быть развитие аневризмы протока и ее разрыв. В одних случаях это связано с особенностями анатомического строения, в других с легочной гипертензией или бактериальным эндартериитом (тогда аневризма является микотической, т. е. септической, по происхождению); в редких случаях аневризма протока — составная часть синдрома Марфана, тогда расслоение стенки артериального протока происходит вследствие повышенного содержания гликозамингликанов. У взрослых с ОАП может развиться аневризма легочной артерии.
Нормальная ЭКГ регистрируется у 1/3 больных с ОАП. Электрическая ось сердца чаще расположена нормально, реже отклонена вправо (при высокой легочной гипертензии) или влево. На ЭКГ ведущими являются признаки гипертрофии миокарда левого желудочка (рис. 5). Увеличение левого предсердия встречается в 5 — 10 % случаев. По мере увеличения сброса и повышения давления в легочной артерии появляются, а затем
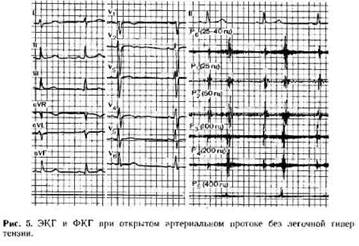
могут стать ведущими признаками гипертрофии миокарда правого желудочка. При большом сбросе зубцы Т в левых грудных отведениях могут быть отрицательными и интервал ST смещен вниз — признак перегрузки миокарда левого желудочка; реже зубцы Т V4 высокие, пикообразные. При интерпретации ЭКГ недоношенных детей следует учитывать гестационный и хронологический возраст ребенка, так как у них больше выражены признаки перегрузки левого желудочка, чем у доношенных детей. У взрослых больных с ОАП может появиться мерцательная аритмия ( при дилатации полости левого предсердия).
При ОАП на ФКГ во втором - третьем межреберье слева часто фиксируется классический шум (см. рис. 5): сразу или через небольшой промежуток от 1 тона определяется систолический шум, нарастающий ко II тону, перекрывающий его и постепенно убывающий в диастоле. Над верхушкой сердца у 1/3 детей с большим сбросом через проток регистрируется ромбовидной формы систолический шум средней амплитуды. При повышении давления в легочной артерии на ФКГ полностью исчезает диастолическая часть шума, нет раздвоения II тона, который выглядит единым и резко увеличенным, может появиться диастолический шум над легочной артерией (шум Грэхема—Стилла), систолический тон изгнания, который фиксируется в начале систолы и является следствием удара струи крови о стенку расширенной и уплотненной легочной артерии.
При ОАП на рентгенограмме отмечаются усиление легочного рисунка, соответствующее величине артериовенозного сброса,
расширение или выбухание ствола легочной артерии с увеличением диаметра лобарных и сегментарных сосудов легкого, увеличение тени сердца от незначительного до резкого (кардиоторакальный индекс составляет 55 — 60 %) за счет вначале левого, а затем обоих желудочков и левого предсердия. С возрастом отмечается расширение восходящей аорты. При отсутствии легочной гипертензии изменения на рентгенограмме могут отсутствовать. Признаками легочной гипертензии является так называемый обрубленный (ослабление его на периферии) или асимметричный легочный рисунок в сочетании с выбуханием дуги легочной артерии. Если легочная гипертензия при этом носит сбросовый характер, объем сердца увеличен значительно; при высоком общелегочном сопротивлении из-за развития склеротических изменений в легочных сосудах и снижения сброса объем сердца уменьшается. У взрослых больных на рентгенограмме бывает, видна кальцификация протока.
Специфических признаков ОАП на эхокардиограмме нет, поэтому используются косвенные. Характерно увеличение полости левого желудочка и изменение отношения размера левого предсердия к диаметру аорты. В норме размер левого предсердия равен диаметру аорты или несколько меньше его. При ОАП отношение этих параметров может составить 1,2 и более. Как проявление объемной перегрузки левого желудочка отмечено увеличение скорости движения передней створки митрального клапана в период диастолы. У новорожденных ОАП может быть диагностирован при помощи контрастной эхокардиографии: при введении контраста в пупочную артерию видно поступление его из аорты в легочную артерию.
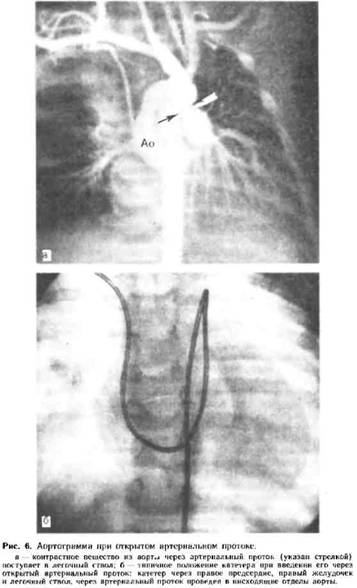
Как правило, диагноз открытого артериального (боталлова) протока можно с уверенностью поставить по клиническим симптомам, и только в сомнительных случаях следует прибегать к рентгенохирургическому обследованию. При зондировании правых отделов сердца косвенным признаком порока может быть повышение насыщения крови кислородом на уровне легочной артерии, увеличение давления в ней. Наиболее достоверным является проведение катетера из легочной артерии в аорту, когда он описывает своеобразную кривую в виде греческой буквы ср. (рис. 6, б). Во время удаления катетера регистрируется кривая аортального, затем легочного давления. При аортографии виден сброс контрастированной крови из аорты в легочную артерию (рис.6,а) и можно оценить размеры протока. Для диагностики ОАП высокоинформативной является дигитальная субтракционная ангиография, которая менее травматична и может быть выполнена в амбулаторных условиях. В случаях высокой легочной гипертензии при катетеризации сердца выявляют систолическое давление в легочной артерии, равное или превышающее давление в аорте, констатируют перекрестный сброс крови или сброс крови справа налево.
Дифференциальный диагноз боталлова протока следует проводить с функциональным систолодиастолическим шумом волчка на сосудах шеи, вызывающим особые трудности в распознавании порока при локализации слева; в таких случаях интенсивность функционального шума меняется при перемене положения тела и при дыхании. Иногда возникают трудности при дифференциации с дефектом меж желудочковой перегородки с аортальной недостаточностью, легочными артериовенозными свищами, дефектом аортолегочной перегородки, разрывом аневризмы синуса Вальсальвы, коронарной фистулы с легочным стволом или выводным отделом правого желудочка.
Течение, лечение. Представляют интерес данные о естественном течении ОАП. У взрослых порок встречается реже, чем у детей, что связано с оперативным и самопроизвольным закрытием протока (ежегодно спонтанно закрывается 0,6% ОАП), летальностью в первые годы жизни при тяжелом течении. Средняя продолжительность жизни больных с ОАП составляет 39 лет : к 30 годам умирает 20 % больных, к 45 годам — 42 %, к 60 годам -60 %. Описаны единичные случаи, когда больные доживали до 70 — 79 лет (диаметр протока у них не превышал 3мм). Больные, которым проводилось хирургическое закрытие порока, имеют большую продолжительность жизни и лучшие показатели гемодинамики. Следовательно, ОАП даже небольших размеров ведет к преждевременной смерти, что связано со снижением компенсаторных возможностей миокарда и сосудов малого круга кровообращения, присоединением различных осложнений (пневмония, легочная гипертензия, бактериальный эндартериит, сердечная недостаточность, разрыв аневризмы и др.) чаще в возрасте после 40 лет.
Показаниями к хирургическому лечению порока в раннем возрасте являются сердечная недостаточность, не купирующаяся медикаментозно, гипотрофия, прогрессирующая легочная гипертензия, рецидивирующие пневмонии. У детей старше 6 — 12 мес. установление диагноза ОАП — показание к операции. У взрослых больных возраст не должен служить противопоказанием к хирургическому лечению, хотя у них оно сопряжено с большим риском и технически сложнее ( проток часто истончен , инфицирован, склерозирован ).
В случаях тяжелого течения ОАП показано назначение дигоксина, мочегонных препаратов. У недоношенных детей незакрытию протока способствуют недоразвитие мышечного слоя в легочной артерии, снижение чувствительности к кислороду, гипоксия (анемия, ацидоз), требующая коррекции, а также незрелая констрикторная реакция со стороны ОАП. Общее количество вводимой жидкости таким детям не должно превышать 70 — 100 мл /( кг – сут.). Показано переливание крови для поддержания уровня гемоглобина не менее 120г / л, гематокрита— 40 — 45 %. Оксигенотерапия способствует поддержанию Р 02 от 60 до 85%; более низкое насыщение крови кислородом препятствует закрытию протока , более высокое способствует развитию ретролентальной фиброплазии.
В последние годы появилось много работ о закрытии ОАП у новорожденных детей с помощью индометацина, который является ингибитором простагландинов Е и M, способствует спазму протока с последующей его облитерацией. Индометацин назначают в дозе 0.1 мг / кг 3 — 4 раза в день внутривенно. Эффект тем лучше, чем меньше возраст ребенка (желательно проводить лечение в первые 8 — 14 дней жизни). Иногда у детей с низкой массой тела при рождении после применения индометацина вновь отмечается функционирование ОАП. Это можно объяснить различиями в продукции и клиренсе простагландинов или в чувствительности протока к действию простагландинов у детей с рецидивами и со стойкой констрикцией протока. Осложнениями при лечении индометацином являются транзиторная ренальная дисфункция, гипонатриемия, снижение агрегации тромбоцитов, гастроинтестинальные и внутричерепные кровотечения. Если у недоношенных, несмотря на проведенные медикаментозные вмешательства, ОАП протекает с сердечной недостаточностью, показано хирургическое лечение.
В СССР первую операцию перевязки ОАП произвел в 1948г. академик АМН СССР А. Н. Бакулев. Закрытие протока производится различными методами. Чаще проводят перевязку ОАП 2 — 3 шелковыми лигатурами, реже — пересечением с ушиванием аортального и легочного концов. Особого внимания заслуживают случаи, когда ОАП сочетается с легочной гипертензией. При этом наблюдается высокая операционная и послеоперационная летальность, а нередко и прогрессирование легочной гипертензии в послеоперационном периоде, остановить которую не представляется возможным. При легочной гипертензии в целях профилактики прорезывания лигатур или неполной перевязки протока, ведущей к реканализации, применяют управляемую системную гипотензию (снижение АД до 80мм рт. ст.). При наличии двунаправленного сброса операция возможна только, если превалирующим является левоправый сброс, а при пробном пережатии протока происходит хотя бы незначительное снижение давления в легочной артерии; летальность в этой группе больных составляет 25 %. Вместе с тем благоприятный прогноз с точки зрения нормализации давления в легочной артерии у этой группы больных сомнителен. Больным со стойким праволевым сбросом на уровне протока оперативное лечение не показано, так как проток в этих условиях гемодинамики выполняет роль разгрузочного клапана для правого сердца.
Хирургическое лечение ОАП, сочетающегося с другими ВПС, определяется размерами протока (т. е. долей его участия в нарушениях гемодинамики), вариантом и степенью тяжести сопутствующего порока, а также квалификацией хирургов в кардио- хирургической клинике . Коррекция пороков может быть выполнена одномоментно или двухэтапно. Не вызывает сомнений возможность одновременной ликвидации ОАП И коарктации аорты, выполняемой с использованием бокового левостороннего доступа. Методом выбора коррекции ОАП, сочетающегося с аортальным стенозом, ДМЖП, ДМПП или митральной недостаточностью, также является их одномоментное устранение. В тех случаях, когда ведущим в нарушениях гемодинамики является ОАП, а также у детей раннего возраста, у которых могут иметься ограничения технических возможностей коррекции пороков, операция может быть выполнена в 2 этапа: первым этапом производят закрытие протока, вторым - коррекцию сопутствующих ВПС (в определенные сроки при наличии показаний).
Бактериальный эндартериит не является противопоказанием к хирургическому лечению, к тому же полное излечение от эндокардита невозможно без закрытия протока. Перед операцией необходимо провести 3-4 недельный курс консервативного лечения. Длительная медикаментозная терапия при боталлите может снизить активность процесса, но не вызвать полного излечения; прогрессирование процесса ухудшает и послеоперационный прогноз. Поэтому в таких случаях не рекомендуется затягивать хирургическое лечение в надежде на эффективность антибактериальной терапии.
Отдаленные результаты при хирургическом лечении ОАП в большинстве случаев хорошие. Эффективность его определяется выраженностью легочной гипертензии, которая зависит от исходного состояния сосудов малого круга кровообращения, поэтому оперативное вмешательство должно быть проведено как можно раньше. Хирургическая летальность при ОАП небольшая. В Горьковском межобластном кардиохирургическом центре на 2500 операций по поводу ОАП у больных в возрасте от 3 мес. до 48 лет летальность составила 1,1 %, причем у лиц без легочной гипертензии летальных исходов не было, а при легочной гипертензии. Реканализация протока после операции, как правило, связана с неполной его перевязкой либо ослаблением лигатур в результате воздействия на них системной гипертензии, нередко возникающей в послеоперационном периоде после перевязки широких протоков.
Все больные I — II гемодинамических групп по величине легочной гипертензии после операции через 2 — 4 года ведут обычный образ жизни, занимаются физкультурой без ограничения. Изучение эволюции легочной гипертензии после операции у больных с ОАП Ша гемодинамической группы показало нормализацию гемодинамики и обратное развитие патологического процесса в системе сосудов легочной артерии в тех случаях, когда преобладал функциональный компонент гипертензии. Сохранение повышенного давления в легочной артерии из - за высокого общелегочного сопротивления или еще большее его увеличение в отдаленные сроки после операции у больных IIIб группы обусловлено необратимыми изменениями в легочных сосудах, причем этот процесс прогрессирует, несмотря на устранение порока. Через 3-6 лет у этих больных сохраняется отставание в физическом развитии, снижение толерантности к нагрузкам. Обратное развитие электрокардиографических и рентгенологических признаков гипертрофии и дилатации миокарда желудочков происходит медленно, иногда в течение нескольких лет. Если давление в легочной артерии и общелегочное сопротивление остаются повышенными, изменения на ЭКГ и рентгенограмме в виде гипертрофии миокарда правого желудочка сохраняются, несмотря на клиническое улучшение и положительные сдвиги в гемодинамике. У больных IIIб гемодинамической группы существенных изменений гемодинамики и данных клинико-инструментальных методов исследования не наступает, что указывает на неэффективность оперативного вмешательства.
Учитывая, что хирургическое лечение ОАП связано с торакотомией, кровопотерей и эндотрахеальным наркозом, в настоящее время все шире используется эндоваскулярная окклюзия, основанная на введении в сосуд через катетер различных материалов, временно или постоянно обтурирующих просвет сосуда. В 1967г . W. Porstmann и соавт. впервые осуществили обтурацию ОАП с помощью эндоваскулярной катетерной техники. В нашей стране эндоваскулярная окклюзия протока по этой методике выполнена в 1981г. Ю. Ф. Неклассовым. А в 1988г. С.В.Савельевым предложена модификация метода эндоваскулярная окклюзия чрескожным трансвенозным доступом без торакотомии, когда производится закрытие ОАП боталлокклюдером, состоящим из пенистого полиуретана, армированного металлическим каркасом с фиксаторами. Подобранный соответственно размерам протока боталлокклюдер устанавливается в нем через катетер, который вводится в правые отделы сердца, легочную артерию, боталлов проток бедренным трансвенозным доступом. Показаниями к проведению эндоваскулярной окклюзии являются: наличие изолированного ОАП или комбинированных ВПС, при которых боталлов проток требует дополнительного этапа хирургического вмешательства. Противопоказаниями к проведению этого метода могут быть состояние гемодинамики (легочная гипертензия с перекрестным сбросом крови или сбросом справа налево) и особенности рентгеноанатомии порока; если наименьший диаметр протока более 1см, то использование катетера большого диаметра (более 8мм) повышает риск катетеризации из -за опасности повреждения бедренной вены и клапанов сердца; если наименьший диаметр протока менее 0.2см; если соустье между аортой и легочной артерией короткий проток - не позволяет прочно фиксировать боталлокклюдер, то существует опасность миграции его в легочную артерию; если имеется аневризма протока; если диагностирован септический боталлит. Отдаленные результаты (в течение 15 лет) подтверждают эффективность предложенного метода, если соблюдены показания и противопоказания и он находится в руках опытного хирурга.
