Общая характеристика работы
| Вид материала | Документы |
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Задачи физического воспитания детей дошкольного возраста. Общая характеристика средств, 34.6kb.
- Реферат по курсу: экология на тему: Общая характеристика экосистем, как, 726.64kb.
- Научная работа студентов, 2153.55kb.
- Научная работа студентов, 2114.42kb.
- Общая характеристика работы актуальность работы, 487.01kb.
Общая характеристика работы
Актуальность работы. Разработка и внедрение новых технологических процессов и методов получения материалов с заданными свойствами требует знания физико-химических характеристик бинарных жидких систем и характера межмолекулярных взаимодействий в них. Особый интерес представляют системы, содержащие протонные кислоты (например, ортофосфорная кислота), так как многие особенности в их поведении связаны с различными процессами переноса протона.
Интерес к растворам ортофосфорной кислоты связан как с ее широким использованием в пищевой, текстильной, фармацевтической промышленности, при приготовлении протон-проводящих полимерных электролитов для топливных ячеек, так и с развитием теории кислотно-основных взаимодействий и изучением механизмов переноса протона. Если водные растворы фосфорной кислоты исследованы достаточно хорошо, то ее смеси с органическими растворителями практически не изучены. Необходимо отметить, что в зависимости от природы растворителя и концентрации кислоты она может участвовать в процессах диссоциации, комплексообразования, полимеризации. Поэтому для изучения этих процессов требуется привлечение различных экспериментальных методов и подходов, так как одни из них наиболее чувствительны к ион-ионным взаимодействиям (например, кондуктометрия), а другие – к межмолекулярным (спектральные методы, вискозиметрия).
При изучении механизма кислотно-основного взаимодействия фосфорной кислоты с различными органическими растворителями наибольший интерес представляют апротонные растворители (например, N,N-диметилформамид), так как они обладают основными свойствами.
Диссертационная работа выполнена в соответствии с научным направлением Института химии растворов РАН “Структура и динамика молекулярных и ион-молекулярных смесей” (номер госрегистрации 01.2.00 1 02458).
Цель работы. Изучение состояния ортофосфорной кислоты и характера межчастичных взаимодействий в системе Н3РО4 - N,N-диметилформамид.
Для ее выполнения требовалось решить следующие задачи:
- в интервале температур 25–650С исследовать физико-химические свойства (вязкость, плотность, электропроводность) системы во всей области составов;
- определить энтальпии растворения и смешения компонентов во всей области составов;
- изучить механизм взаимодействия в системе фосфорная кислота – N,N-диметилформамид методами ИК- и КР-спектрометрии;
- определить константу диссоциации фосфорной кислоты в N,N-диметилформамиде.
Научная новизна. Впервые с привлечением современных физико-химических методов проведено комплексное исследование растворов ортофосфорной кислоты в N,N-диметилформамиде во всей области составов. Обнаружено, что в изученной системе существуют сильные межмолекулярные взаимодействия, приводящие к образованию устойчивого комплекса состава 2Н3РО4:ДМФА. Предложен механизм процесса комплексообразования между фосфорной кислотой и диметилформамидом. Показано, что при концентрациях кислоты до 0,7 м.д. образование комплекса осуществляется за счет образования водородной связи, а при более высоких концентрациях образуются комплексы с переносом заряда. Оценена константа диссоциации фосфорной кислоты в N,N-диметилформамиде. Впервые получено значение стандартной энтальпии растворения фосфорной кислоты в ДМФА. Проведенное исследование позволяет предположить, что фосфорная кислота в смесях с ДМФА существуют в димерной форме.
Практическая значимость. Полученные данные могут быть использованы для развития теории кислотно-основных взаимодействий с участием слабых кислот, представлений о механизмах межмолекулярных взаимодействий и переносе протона в неводных средах. Кроме того, результаты могут использоваться как для подбора оптимального состава растворителя для прямого растворения целлюлозосодержащего сырья, так и для получения протон-проводящих полимерных электролитов для топливных ячеек.
Апробация работы. Основные положения, результаты и выводы, содержащиеся в диссертации, докладывались на 17th IUPAC Conference on Chemical Thermodynamics, (Rostock, Germany, 2002); XIV Международной конференции по химической термодинамике, (С.-Петербург, 2002г.); VIII Международной конференции «Проблемы сольватации и комплексообразования в растворах» (Иваново, 2001г.); 27th International Conference on Solution Chemistry (27ICSC) (Vaals, Netherlands, 2001); Международной научной конференции студентов, аспирантов и молодых ученых “Молодая наука – XXI веку” (Иваново, 2001г.); Межвузовской научно-технической конференции аспирантов, магистров и студентов «Молодые ученые – развитию текстильной и легкой промышленности» (Иваново, 2000г.).
Структура и объем диссертации. Диссертация изложена на 134 страницах, состоит из введения, обзора литературы, экспериментальной части, обсуждения результатов, выводов, списка цитируемой литературы, содержит 20 таблиц, 51 рисунков.
По теме диссертации опубликовано 7 работ, в том числе 1 статья и 6 тезисов докладов.
Краткое содержание работы
Во введении обоснована актуальность работы, сформулированы ее цели, охарактеризована научная новизна и практическая значимость.
Первая глава содержит обзор имеющихся в литературе представлений о природе иона водорода и анализ данных по свойствам протона в различных растворителях.
Проанализированы возможные механизмы реакций переноса протона в растворах кислот в зависимости от свойств среды (основное внимание было уделено взаимодействиям между кислотой и растворителем), а также рассмотрены количественные характеристики протолитических равновесий в растворах кислот.
Представлен анализ литературных данных по термодинамическим свойствам водных растворов фосфорной кислоты. Показано, что для водных растворов фосфорной кислоты получены достаточно надежные термодинамические характеристики, такие как константы диссоциации кислоты и коэффициенты активности различных ее форм, однако влияние ионной силы и температуры на эти величины изучено не достаточно. Отмечено, что результаты термохимических исследований этих растворов, проведенных различными исследователями, достаточно сильно отличаются. Проведено сравнение ион-молекулярного состава водных растворов фосфорной кислоты полученного на основе различных модельных представлений.
Из данным по свойствах фосфорной кислоты в органических растворителях рассчитаны избыточные молярные характеристики, но основе которых сделаны выводы о специфики взаимодействия кислоты с неводными растворителями. Отмечено, что имеющиеся на данный момент данные по неводным растворам фосфорной кислоты не позволяют однозначно определить механизм взаимодействия компонентов, объяснить влияние на него природы растворителя, а также однозначно описать состояние кислоты в неводных растворителях.
Проведен анализ методов исследования ион-ионных, ион-молекулярных и межмолекулярных взаимодействий в растворах кислот.
В экспериментальной части приводится описание методов очистки N,N-диметилформамида и приготовления 100%-ной фосфорной кислоты, схем экспериментальных установок, методик расчета вязкости, электропроводности, энтальпий смешения и растворения. Представлены экспериментальные данные и оценены погрешности их определения.
Плотность смесей измерялась с помощью проточного вибрационного денсиметра с точностью 1·10-4 г/см3.
Так как вязкость изученной системы изменялась в широких пределах, то для ее определения использовались вискозиметры с висячим уровнем с различным диаметром капилляров, а также ротационный вискозиметр BROOKFIELD марки DV-II. Погрешность определения вязкости составляла 1-1,5%.
Для определения удельной электропроводности использовалась контактная ячейка с плоскими платиновыми электродами, покрытыми платиновой чернью. Погрешность измерения не превышала 1,5%.
Измерение тепловых эффектов растворения проводилось на изопериболическом калориметре с погрешностью 1,5-2,0%.
ИК-спектры регистрировали на ИК-Фурье-спектрофотометре Nexus фирмы “Nicolet” в области частот 4000-400 см-1 с разрешением 2 см-1 между пластинами KBr (эксперимент проводился в ИОНХ им. Курнакова Н.С. РАН, г. Москва, в рамках ФЦП «Интеграция»).
КР-спектры регистрировали на ИК-Фурье-спектрофотометре (IFS 166), связанном с КР-модулем FRA 166 в области частот 500 – 4000 см-1 с разрешением 2 см-1 в кварцевой ячейке (спектры были записаны в лаборатория химической технологии (UCP laboratory), ENSTA, Париж).
Транспортные свойства системы фосфорная кислота – N,N-диметилформамид
Основной задачей нашей работы являлось изучение характера межчастичных взаимодействий в системе фосфорная кислота – N,N-диметилформамид, в том числе и возможных ион-молекулярных равновесий. В связи с этим одним из методов исследования был выбран кондуктометрический, так как он достаточно чувствителен к ассоциативно-диссоциативным равновесиям с участием заряженных частиц. Экспериментальные исследования были выполнены во всей области составов, но особенно тщательно в разбавленной области, потому что именно из этой области концентраций можно получить термодинамические константы диссоциации.
В водных растворах фосфорная кислота является кислотой средней силы. При переходе к органическому растворителю можно ожидать уменьшения константы диссоциации кислоты, прежде всего из-за снижения диэлектрической проницаемости.
Значения молярной электропроводности Н3РО4 в диметилформамиде в разбавленной области концентраций представлены на рис. 1. Как видно из рисунка, зависимость имеет вид, характерный для очень слабых электролитов, для которых невозможно использование даже уравнений Фуосса-Крауса или Шидловского, используемых для слабых электролитов, и проведение экстраполяционной процедуры проблематично.
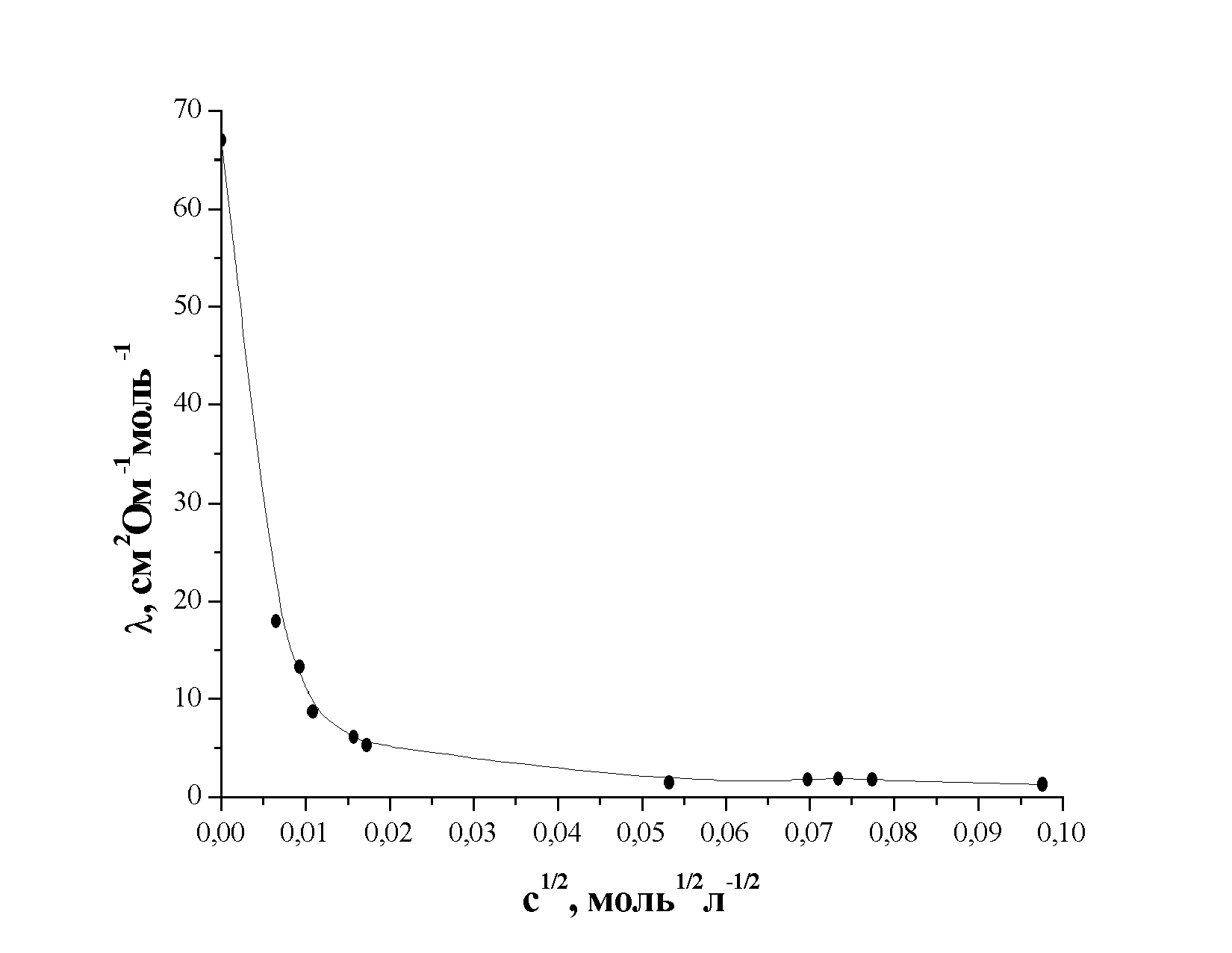 | Рис. 1. Концентрационная зависимость молярной электропроводности фосфорной кислоты в N,N-диметилформамиде при 298 К. |
Мы попытались оценить величину предельной молярной электропроводности фосфорной кислоты в ДМФА. Из литературы известно, что предельная мольная электропроводность иона Н+ в ДМФА равна 35 см2Ом-1моль-1. Так как аналогичное значение для иона
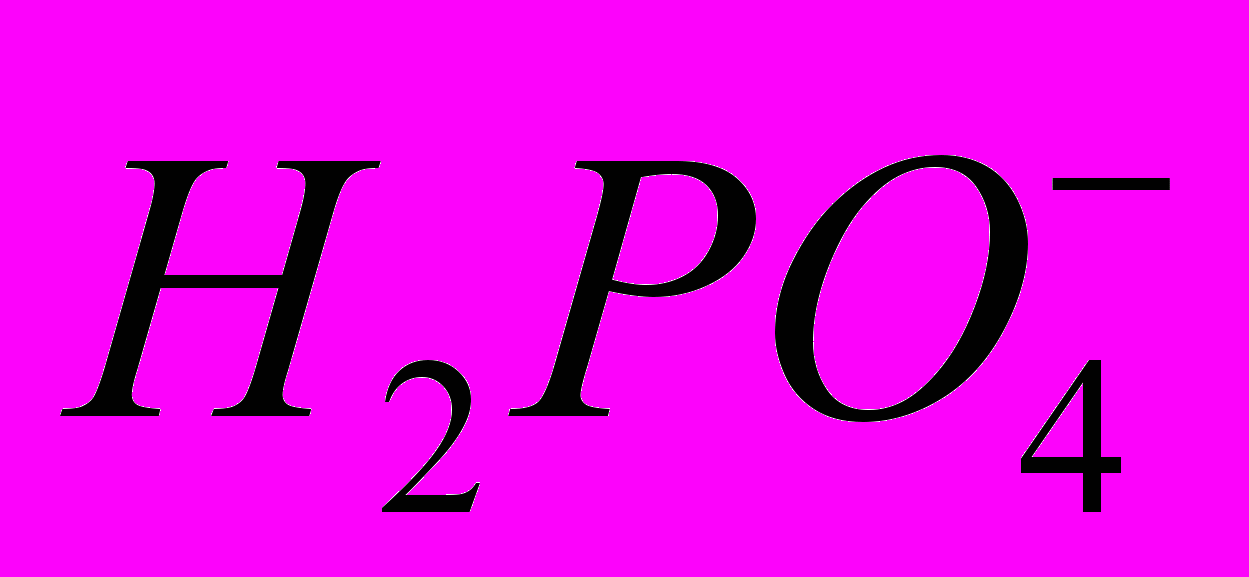 найти не удалось, то мы оценили его, используя известные значения предельной электропроводности анионов протонных кислот в ДМФА. Анализ литературных данных показал, что отношения
найти не удалось, то мы оценили его, используя известные значения предельной электропроводности анионов протонных кислот в ДМФА. Анализ литературных данных показал, что отношения 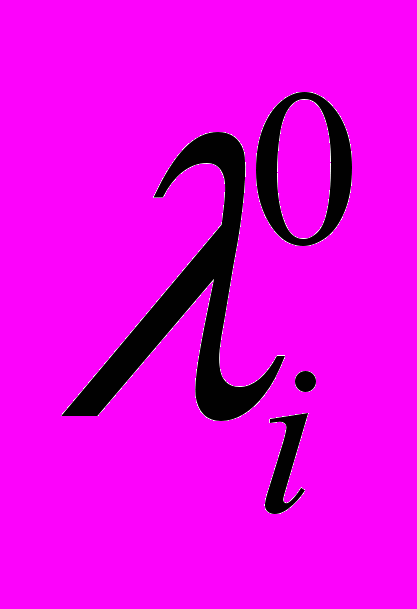 (H2O)/
(H2O)/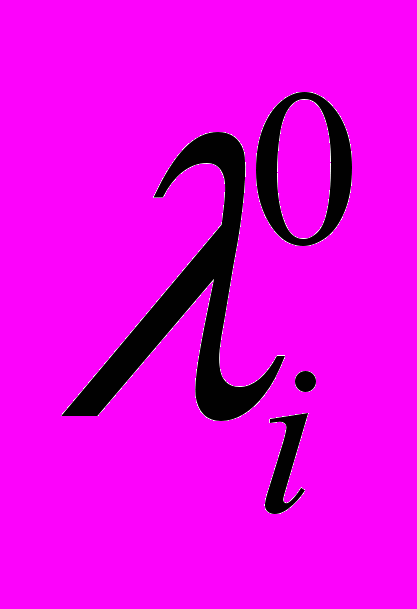 (ДМФА) таких ионов находятся в интервале 1,1÷1,4. Если предположить, что для аниона Н2РО4- величина
(ДМФА) таких ионов находятся в интервале 1,1÷1,4. Если предположить, что для аниона Н2РО4- величина 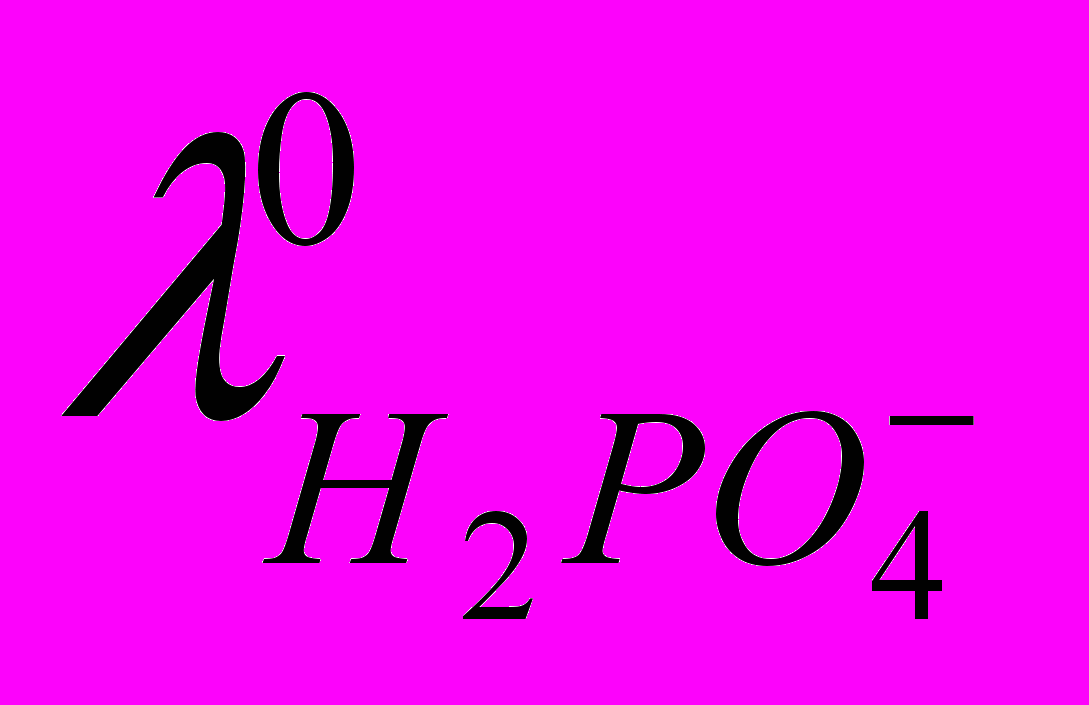 (H2O)/
(H2O)/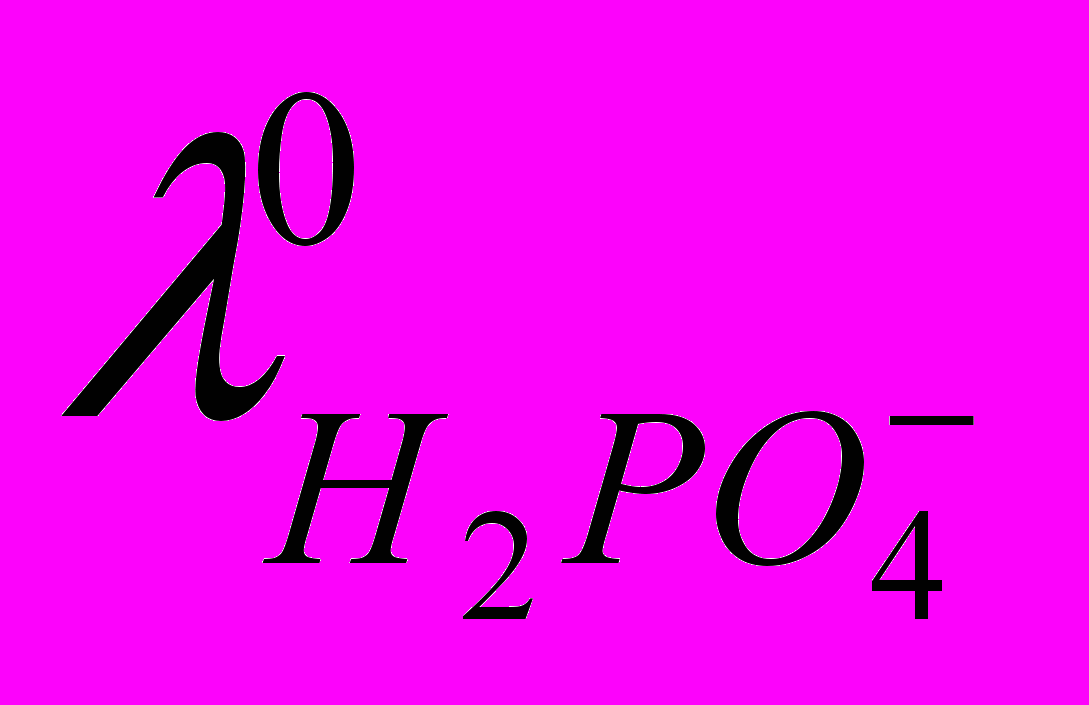 (ДМФА) будет лежать в этих же пределах, то, используя известное значение
(ДМФА) будет лежать в этих же пределах, то, используя известное значение 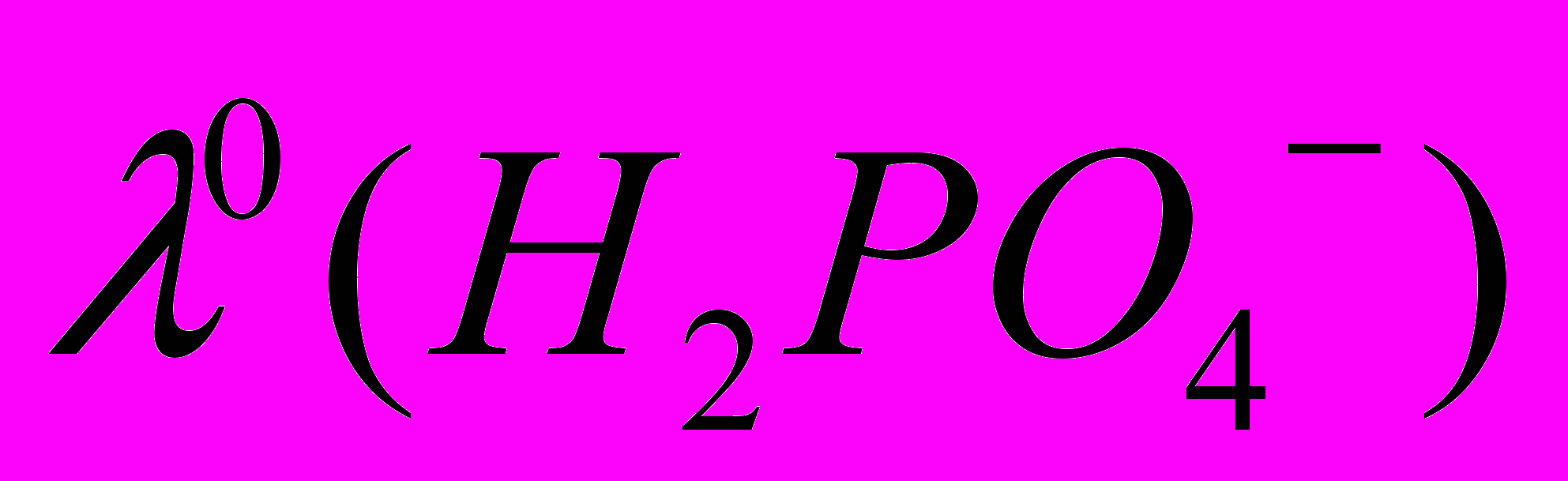 в воде 36 см2Ом-1моль-1, получаем
в воде 36 см2Ом-1моль-1, получаем 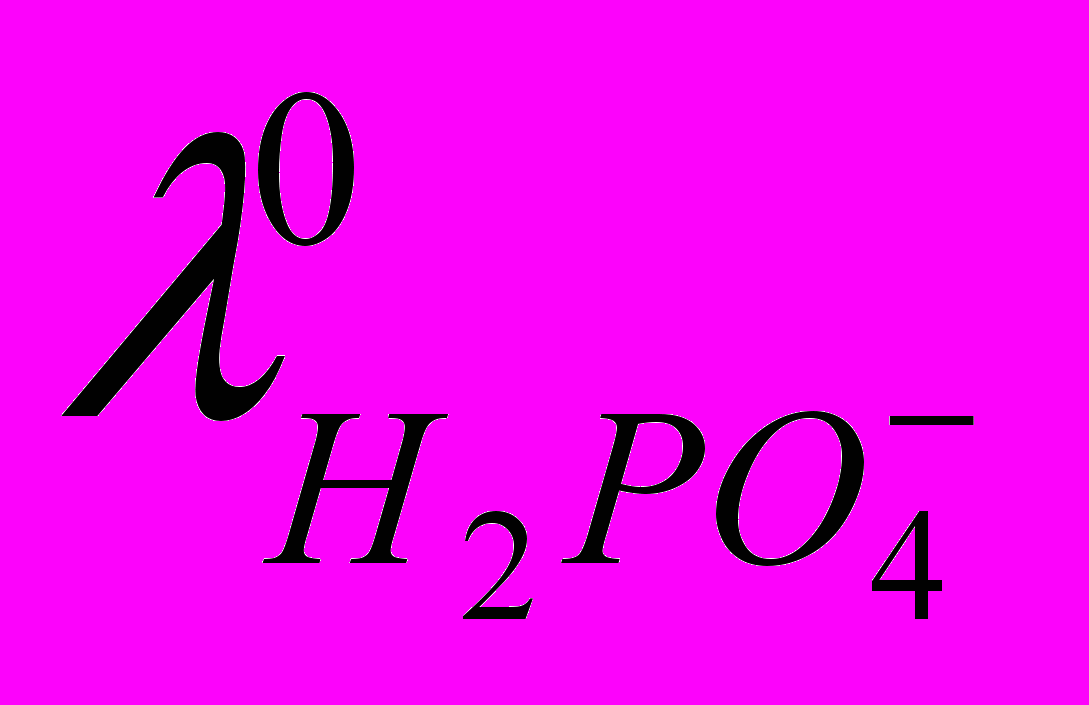 (ДМФА) 26÷32 см2Ом-1моль-1. В этом случае предельная мольная электропроводность фосфорной кислоты в ДМФА будет лежать в пределах
(ДМФА) 26÷32 см2Ом-1моль-1. В этом случае предельная мольная электропроводность фосфорной кислоты в ДМФА будет лежать в пределах 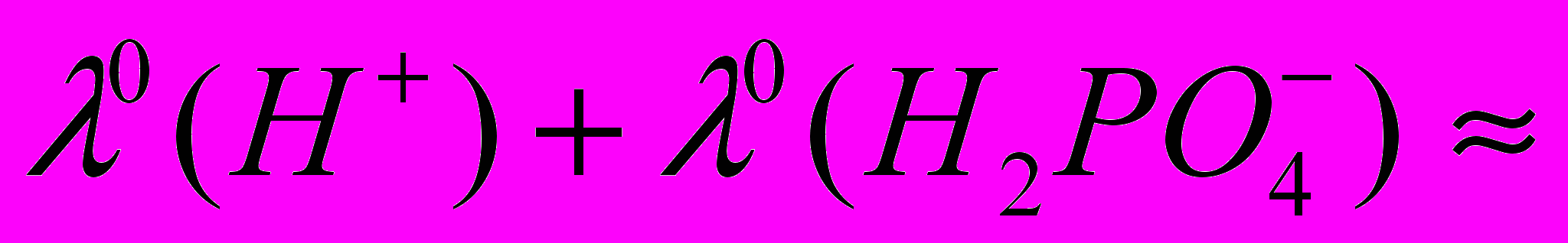 61÷67 см2Ом-1моль-1. Сопоставляя эту величину с экспериментально полученными данными (рис. 1.), можно сделать заключение, что диссоциация фосфорной кислоты в ДМФА протекает настолько слабо, что кондуктометрический эксперимент не позволяет корректно получить количественные характеристики ионных равновесий. Тем не менее, используя экспериментальные данные по
61÷67 см2Ом-1моль-1. Сопоставляя эту величину с экспериментально полученными данными (рис. 1.), можно сделать заключение, что диссоциация фосфорной кислоты в ДМФА протекает настолько слабо, что кондуктометрический эксперимент не позволяет корректно получить количественные характеристики ионных равновесий. Тем не менее, используя экспериментальные данные по 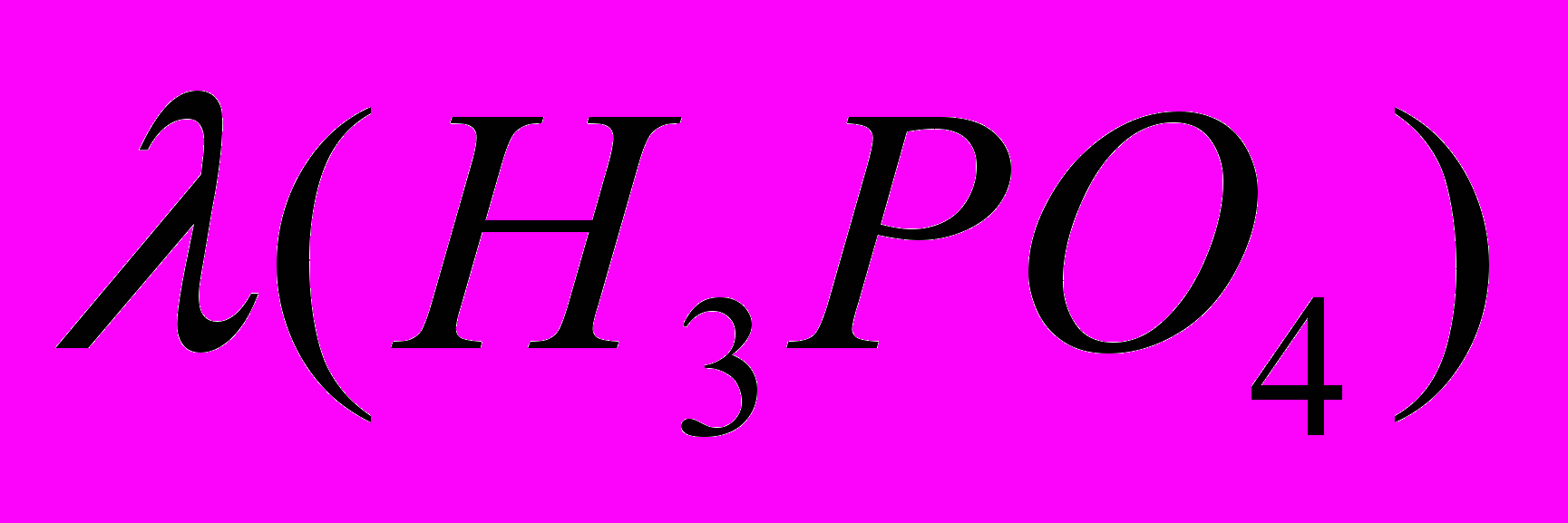 и оценочное значение
и оценочное значение 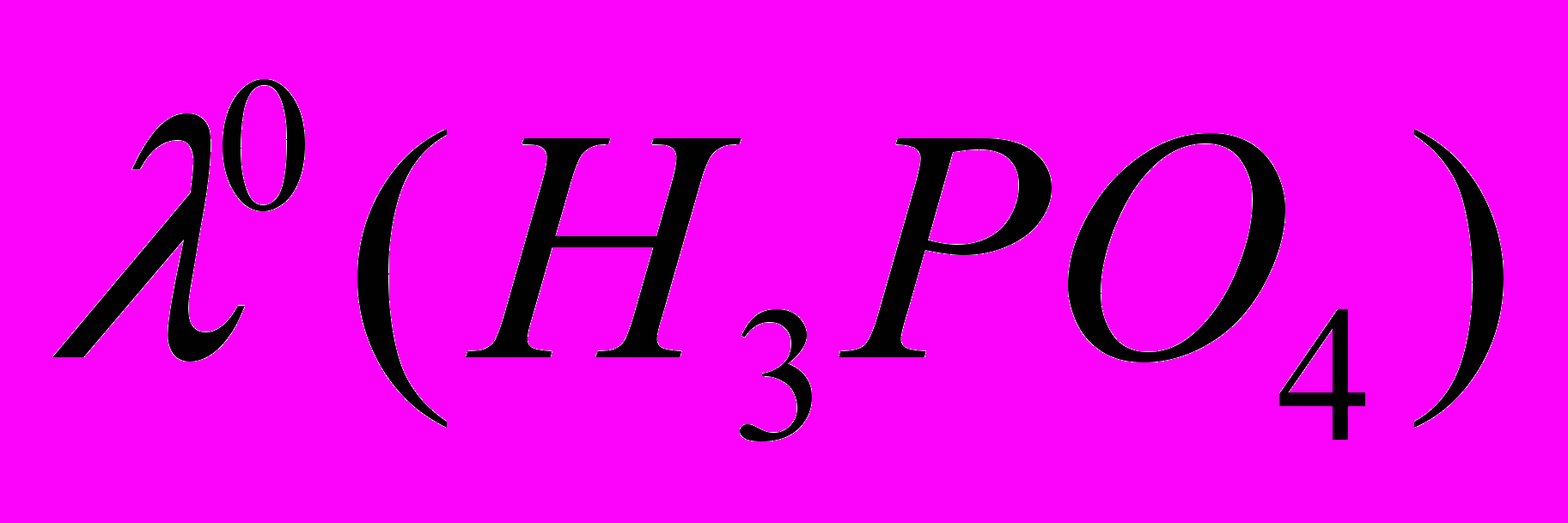 можно приблизительно рассчитать величину константы диссоциации фосфорной кислоты в ДМФА при данной концентрации.
можно приблизительно рассчитать величину константы диссоциации фосфорной кислоты в ДМФА при данной концентрации.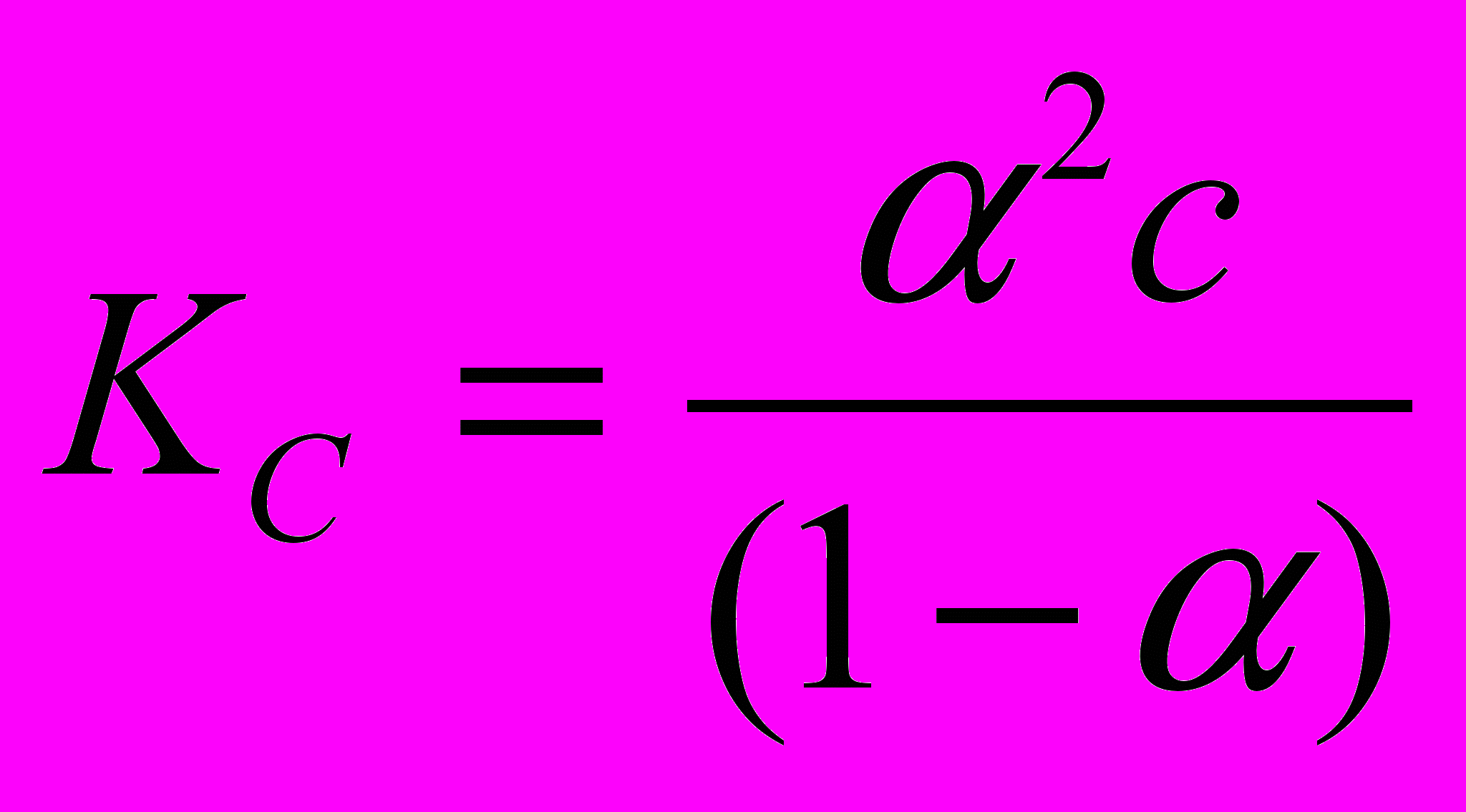 , (1)
, (1)где степень диссоциации кислоты равна
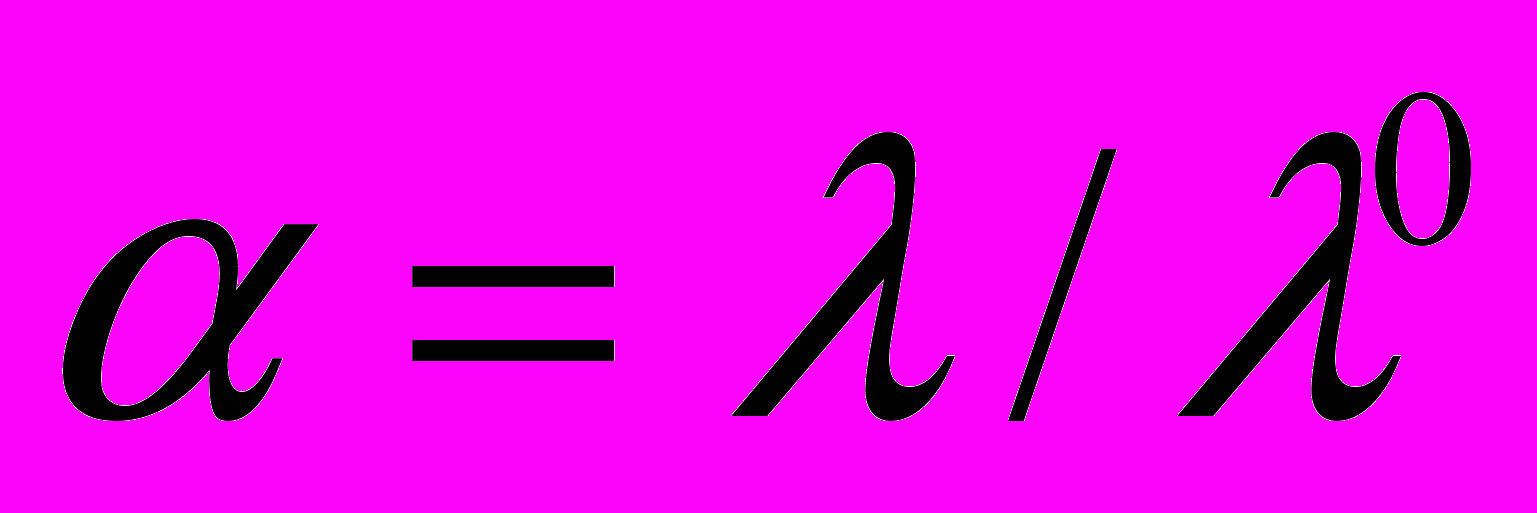 . Расчет константы диссоциации по уравнению (1) в интервале концентраций с=4,3∙10-5÷2,5∙10-4 моль/л показал, что значение KC находится в пределах 2∙10-6÷4∙10-6.
. Расчет константы диссоциации по уравнению (1) в интервале концентраций с=4,3∙10-5÷2,5∙10-4 моль/л показал, что значение KC находится в пределах 2∙10-6÷4∙10-6.По уравнению Нернста-Эйнштейна:
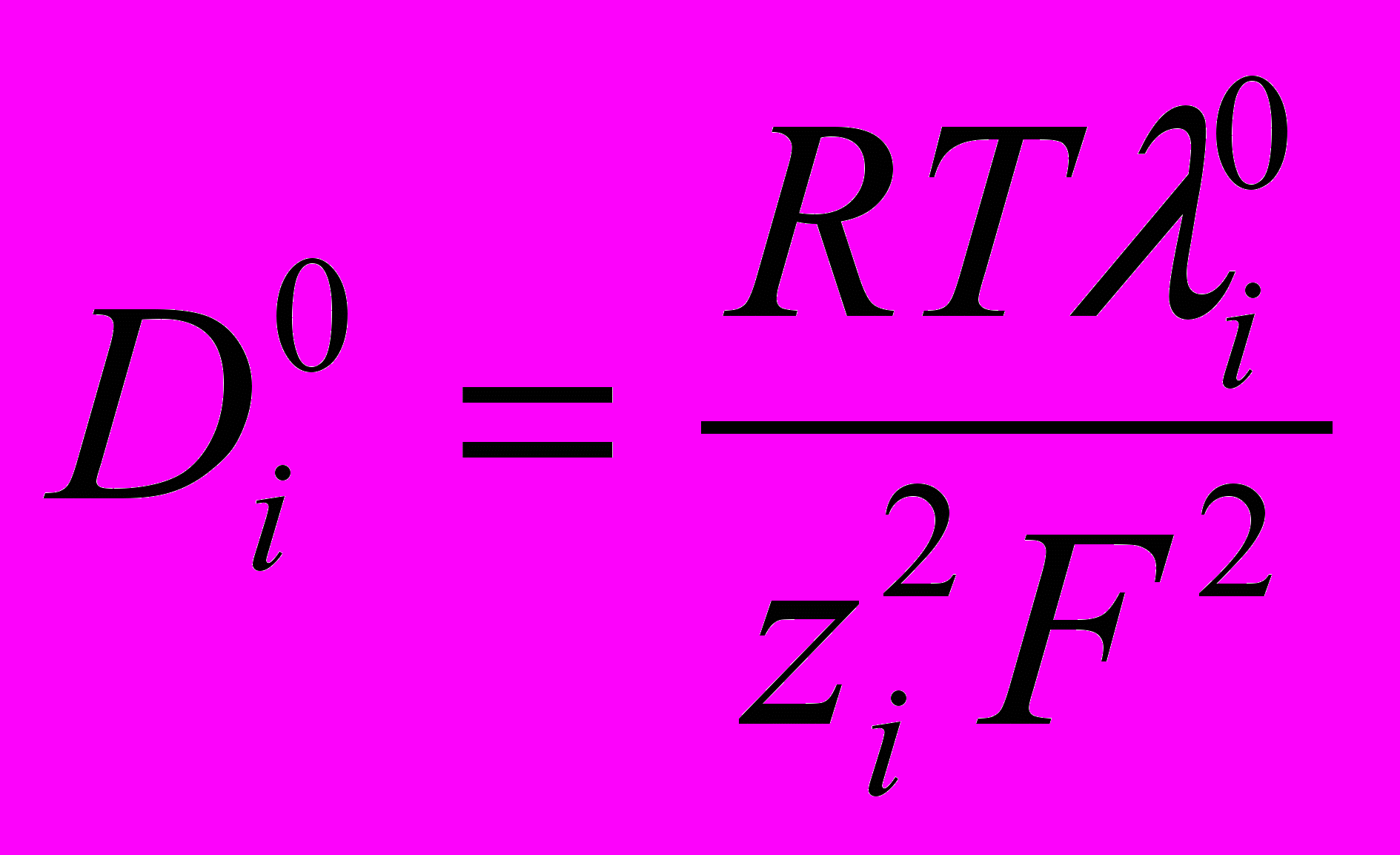 , (2)
, (2)нами был рассчитан коэффициент диффузии протона Н+ в диметилформамиде:
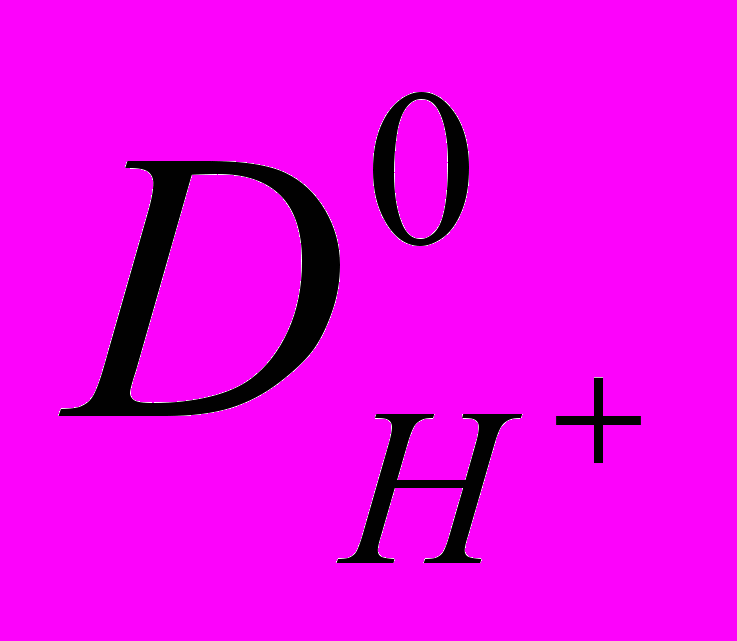 ( ДМФА)=9,31 10-6 см2с-1. Коэффициент самодиффузии ДМФА равен 1,45 10-5см2с-1. В воде, где перенос протона осуществляется по эстафетному механизму, коэффициент диффузии протона больше, а для катионов щелочных металлов меньше, чем коэффициент самодиффузии чистого растворителя. В ДМФА коэффициент диффузии как протона, так и катионов меньше
( ДМФА)=9,31 10-6 см2с-1. Коэффициент самодиффузии ДМФА равен 1,45 10-5см2с-1. В воде, где перенос протона осуществляется по эстафетному механизму, коэффициент диффузии протона больше, а для катионов щелочных металлов меньше, чем коэффициент самодиффузии чистого растворителя. В ДМФА коэффициент диффузии как протона, так и катионов меньше 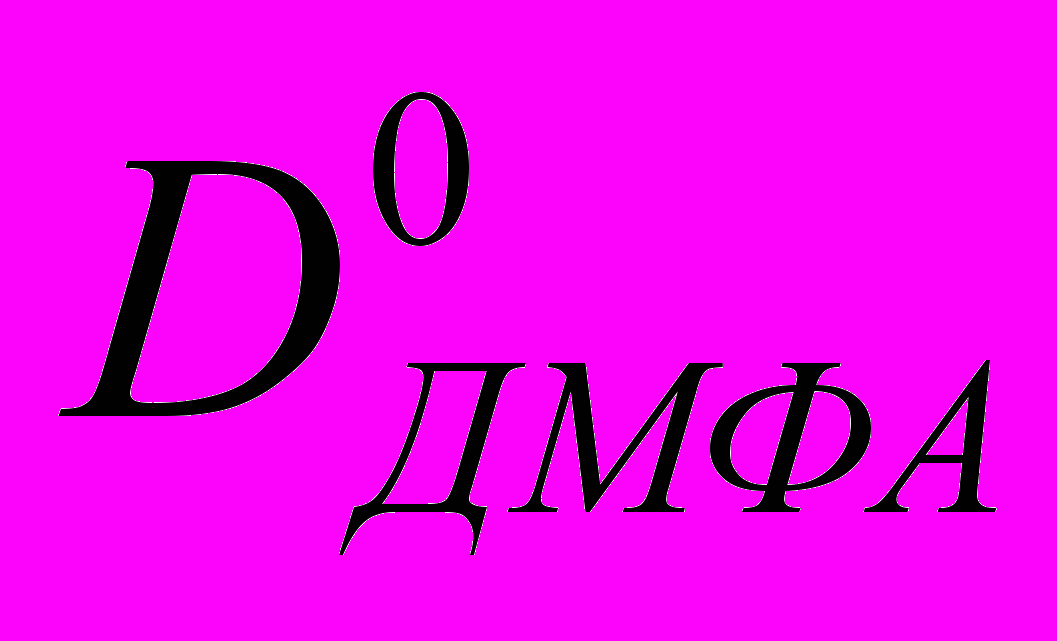 . Таким образом, подвижность иона водорода в ДМФА в большей степени коррелирует с подвижностью ионов щелочных металлов. Анализ величин
. Таким образом, подвижность иона водорода в ДМФА в большей степени коррелирует с подвижностью ионов щелочных металлов. Анализ величин 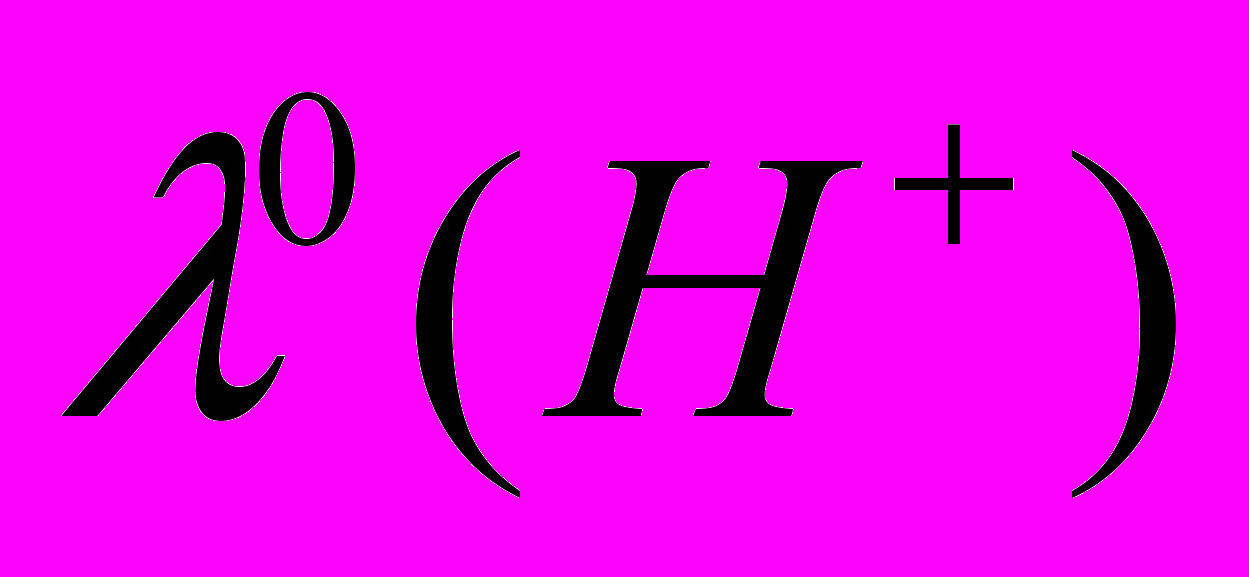 и катионов щелочных металлов в различных растворителях, проведенный в диссертации, приводит к аналогичному выводу.
и катионов щелочных металлов в различных растворителях, проведенный в диссертации, приводит к аналогичному выводу.На рис. 2. представлена молярная электропроводности фосфорной кислоты в ДМФА во всей области составов. Из полученных концентрационных зависимостей видно, что при содержании кислоты в смеси вплоть до ~0,6 м.д. электропроводность слабо зависит от температуры и концентрации раствора (за исключением очень разбавленной области), что еще раз подтверждает вывод об очень низкой степени диссоциации фосфорной кислоты в ДМФА. Дальнейшее увеличение концентрации кислоты приводит к росту электропроводности, что, прежде всего, может быть связано с процессом автопротолиза (как отмечалось ранее, фосфорная кислота имеет достаточно высокое значение константы автопротолиза, рКа=0,8).
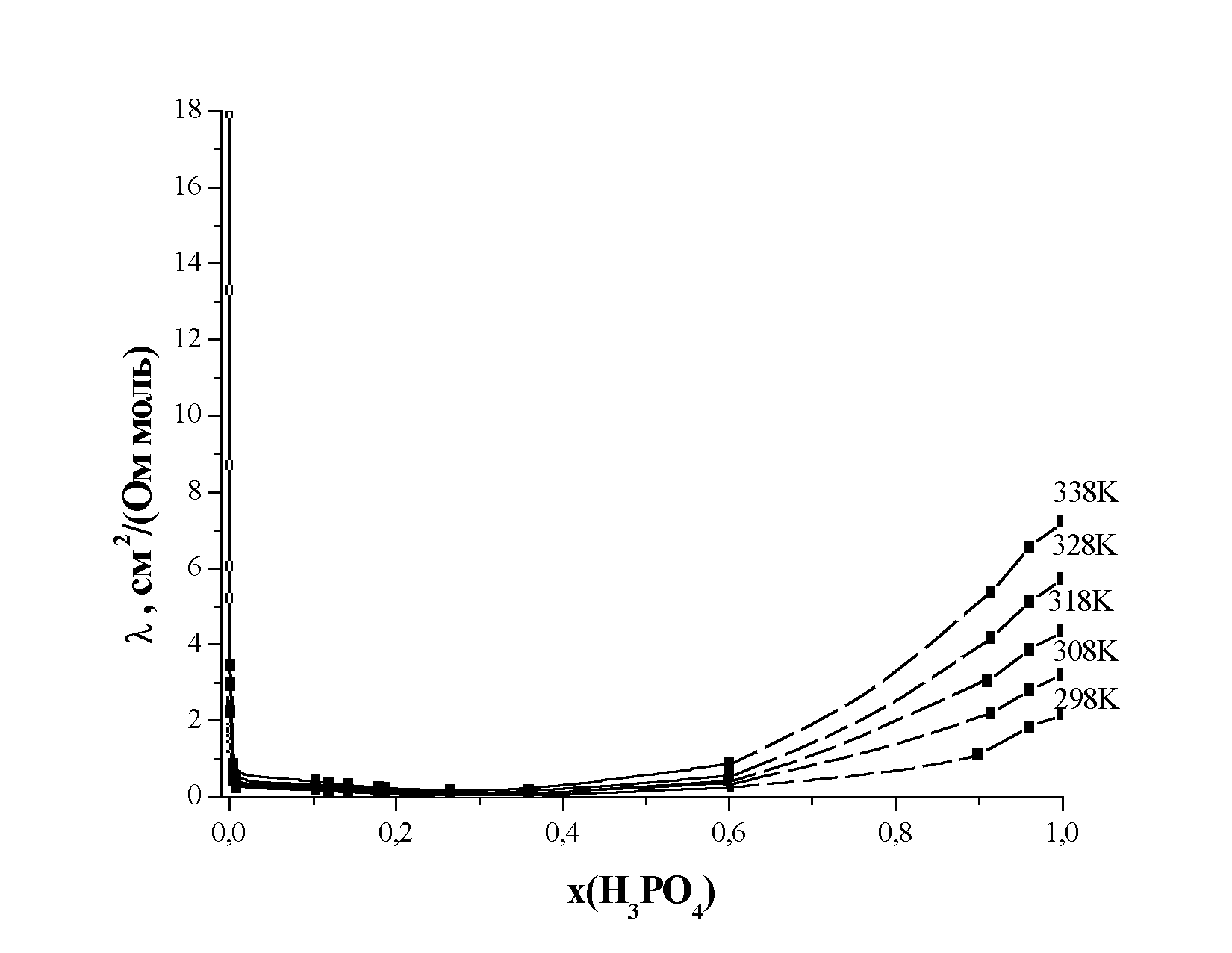 | Рис. 2. Концентрационная зависимость молярной электропроводности фосфорной кислоты в N,N-диметилформамиде при различных температурах |
Коэффициент вязкости и его температурная производная очень чувствительны к ассоциативному состоянию вещества и межмолекулярным взаимодействиям в растворах. Все это заставляет рассматривать вязкость как эффективный параметр физико-химического анализа растворов.
На рис. 3. приведены концентрационные зависимости вязкости системы фосфорная кислота – N,N-диметилформамид при температурах 298 – 338 К.
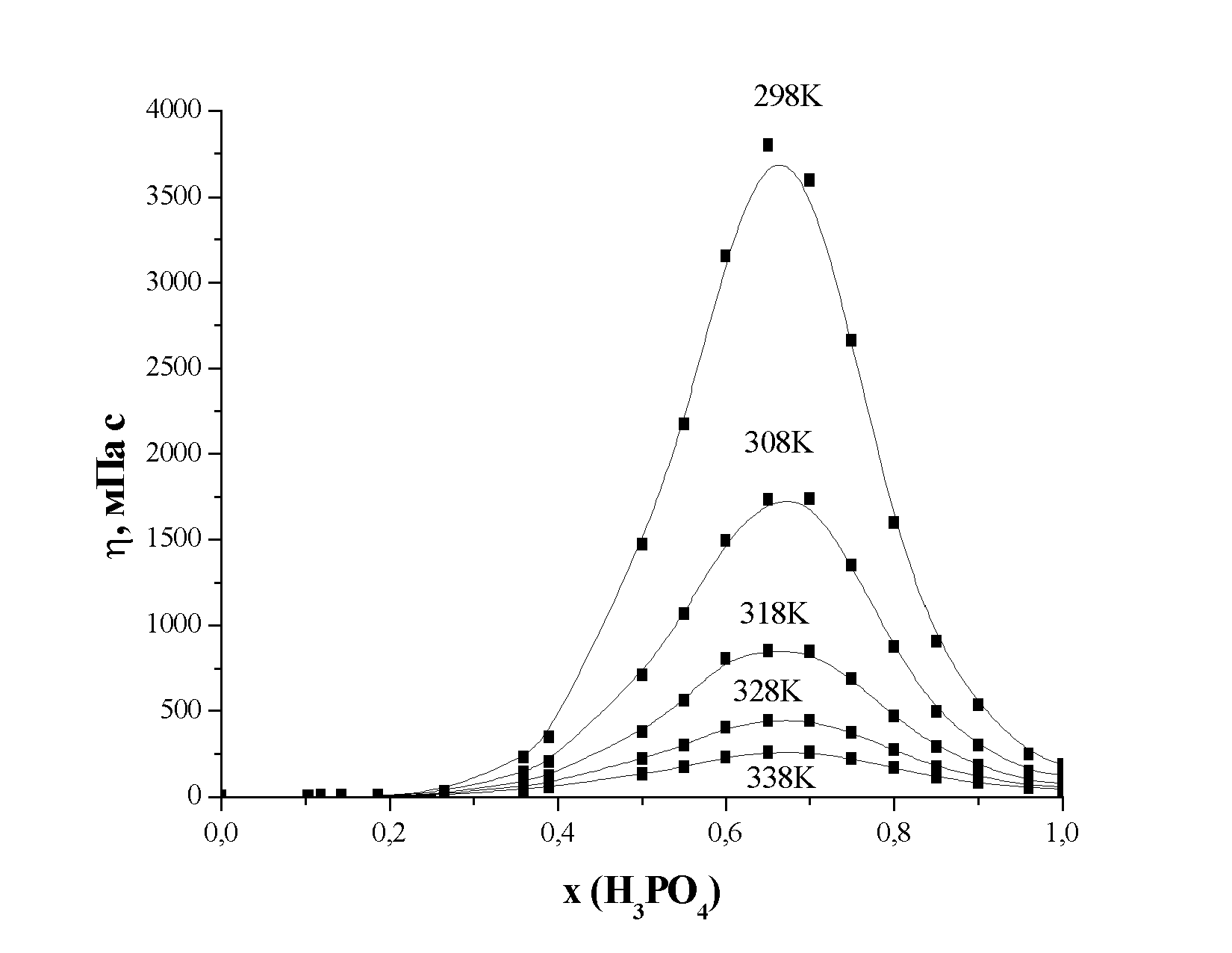 | Рис. 3. Концентрационная зависимость динамической вязкости системы фосфорная кислота – N,N-диметилформамид |
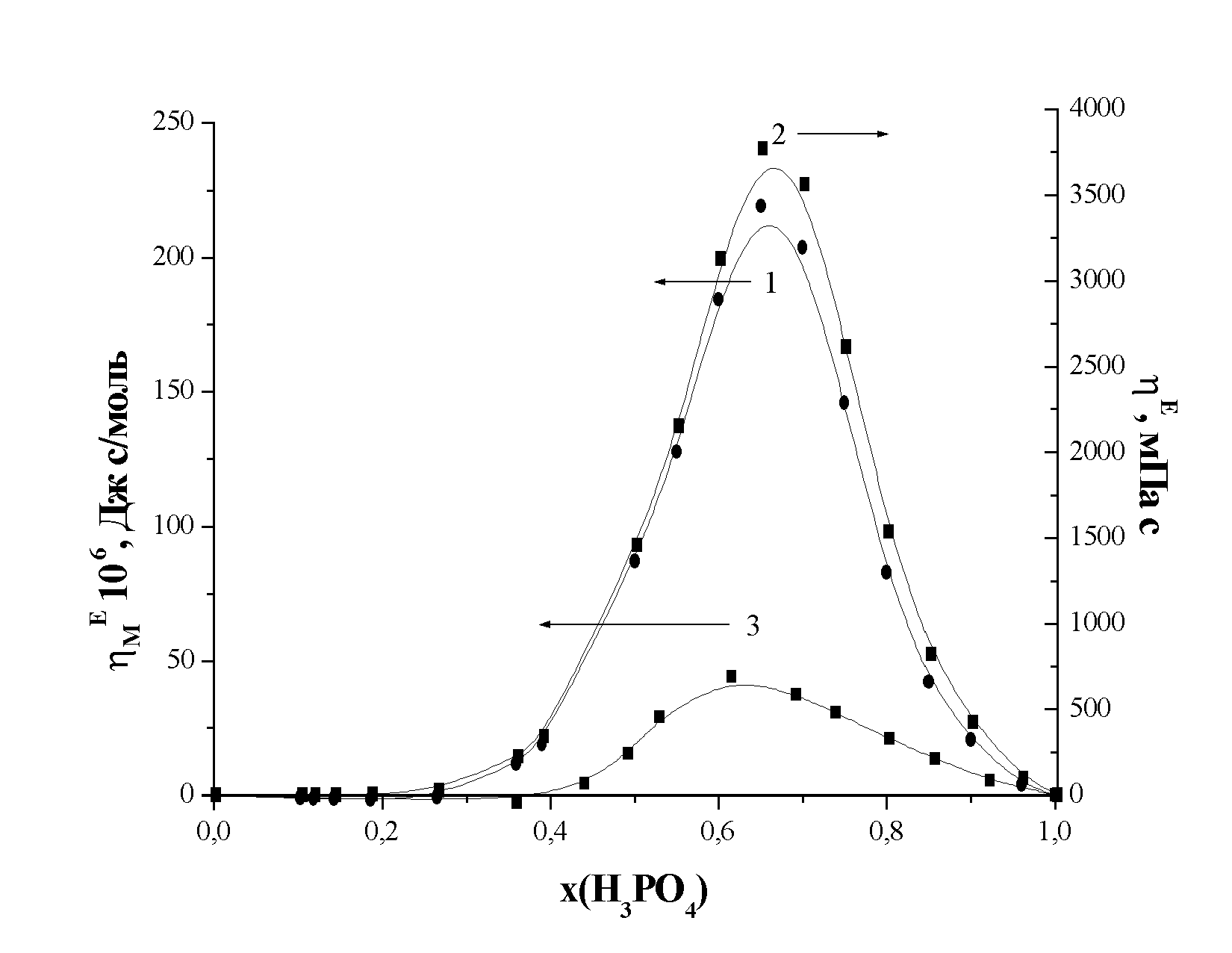 | Рис. 4. Отклонение молярной вязкости системы фосфорная кислота – N,N-диметилформамид от аддитивности (1 – уравнение 3, 2 – уравнение 4.) и для системы фосфорная кислота – диизопропиловый эфир (3) при 298 К |
Как видно из рисунка 3, с увеличением содержания Н3РО4 в смеси значения динамической вязкости возрастают и проходят через максимум, высота которого растет с понижением температуры. Хотя полученная нами зависимость сама достаточно хорошо отражает характер межмолекулярных взаимодействий в системе, анализ диаграмм "состав - свойство" проводился с использованием величины отклонения вязкости от аддитивности (“избыточной” вязкости).
На рис. 4. приведены изотермы отклонения вязкости системы фосфорная кислота - диметилформамид от аддитивной величины, рассчитанной по уравнению аддитивности для молярной вязкости (уравнение 3) и уравнению, основанному на аддитивности свободной энергии активации вязкого течения (уравнение 4):
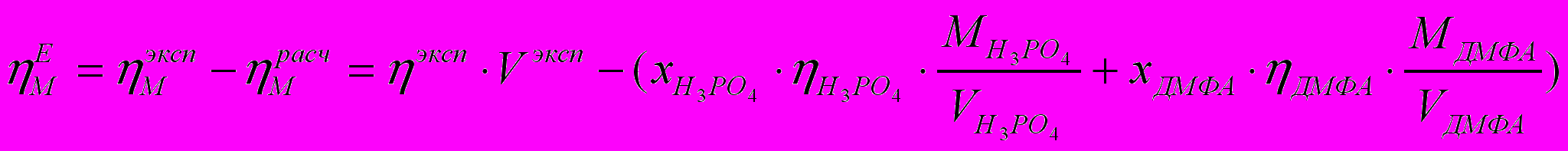 (3)
(3)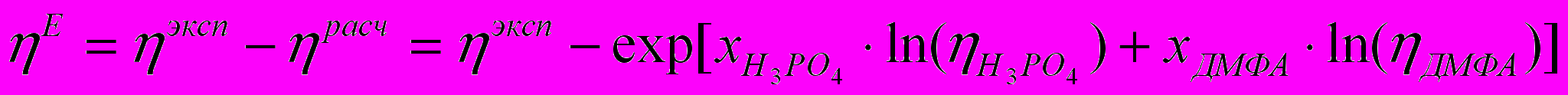 (4)
(4)Проведенные расчеты показали, что положение максимума на изотерме «избыточной» вязкости исследуемой системы не зависит от выбранной схемы аддитивности (Рис. 4.). Поэтому в дальнейшем мы обсуждали величину отклонения от аддитивности молярной вязкости (уравнение 3).
Известно, что если взаимодействие между компонентами смеси сильнее, чем в чистых веществах, то наблюдается положительное отклонение вязкости системы от аддитивности. Причем, если эти взаимодействия приводят к образованию устойчивых комплексов, ассоциатов и т.п., то можно определять и их стехиометрию. Таким образом, наблюдаемый нами экстремум на изотермах «избыточной» вязкости может свидетельствовать об образовании в системе соединений состава 2Н3РО4:ДМФА.
Анализ литературных данных показал, что положение максимума для других систем фосфорная кислота – органический растворитель находится в одной и той же области концентраций, однако, высота его много меньше. Для сравнения, на рисунке 4 приведена избыточная молярная вязкость для раствора фосфорной кислоты в диизопропиловом эфире, имеющего самое большое отклонение от аддитивности из рассмотренных в диссертации растворителей.
Такой характер зависимости, вероятно, определяется не только спецификой взаимодействия фосфорной кислоты с растворителем, но и особенностями самой кислоты. В концентрированных растворах фосфорная кислота находится в виде димеров, которые, по-видимому, и образуют комплексы с молекулами растворителя состава 2Н3РО4:S (где S – растворитель).
Исходя из предположения, что в изучаемой системе образуется комплекс состава 2:1, для описания вязкости мы применили подход Мак-Аллистера, основанный на модифицированной модели Эйринга и предполагающий, что в бинарной смеси имеют место взаимодействия между тремя частицами (1-1-1, 2-2-2, 1-2-1, 2-1-2, 1-1-2, 1-2-2):
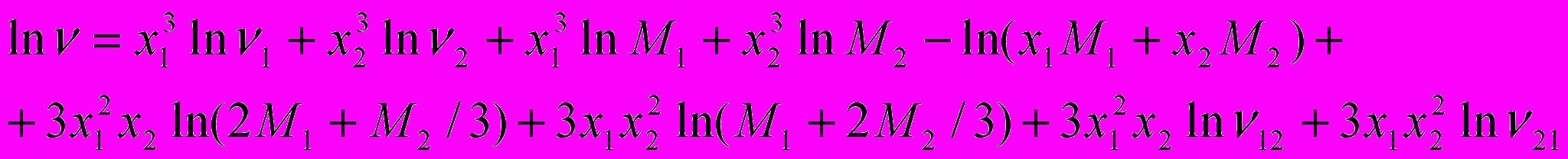 (5)
(5)где
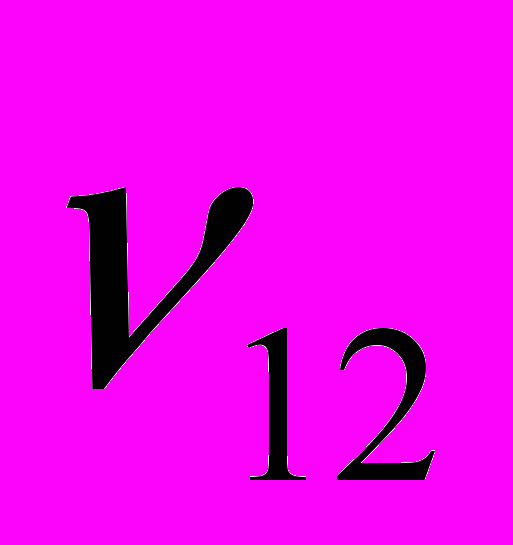 и
и 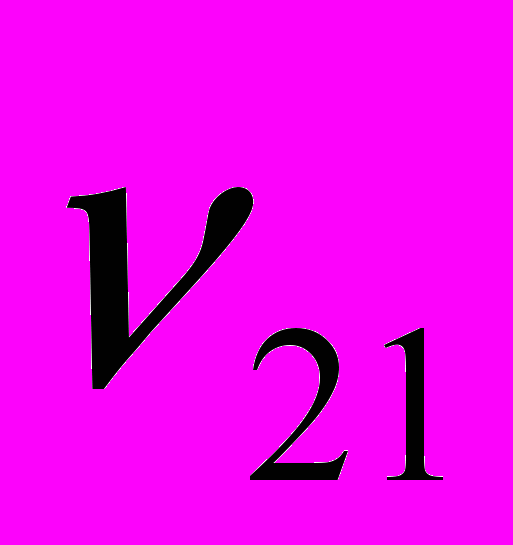 - параметры взаимодействия (здесь индексы 1 и 2 относятся, соответственно, к фосфорной кислоте и ДМФА). Следует подчеркнуть, что авторы уравнения принимают, что параметры взаимодействия зависят только от стехиометрии взаимодействия, т.е.
- параметры взаимодействия (здесь индексы 1 и 2 относятся, соответственно, к фосфорной кислоте и ДМФА). Следует подчеркнуть, что авторы уравнения принимают, что параметры взаимодействия зависят только от стехиометрии взаимодействия, т.е. 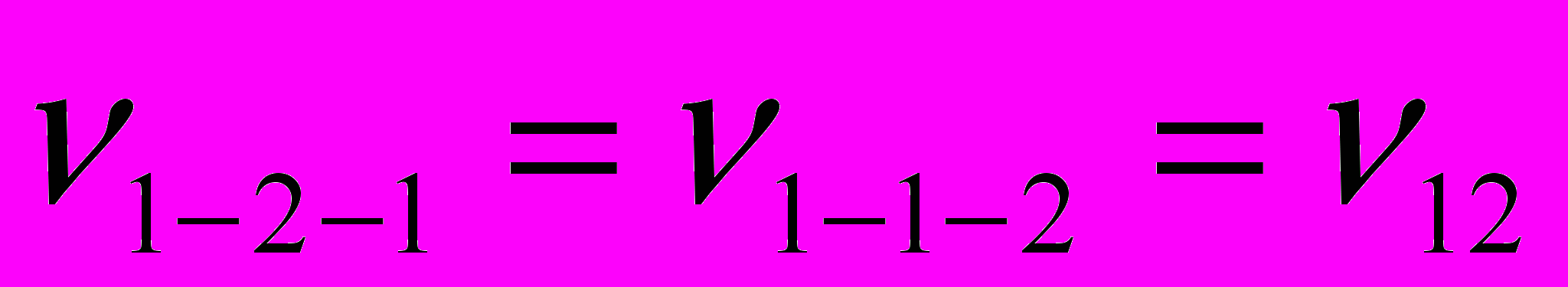 ,
, 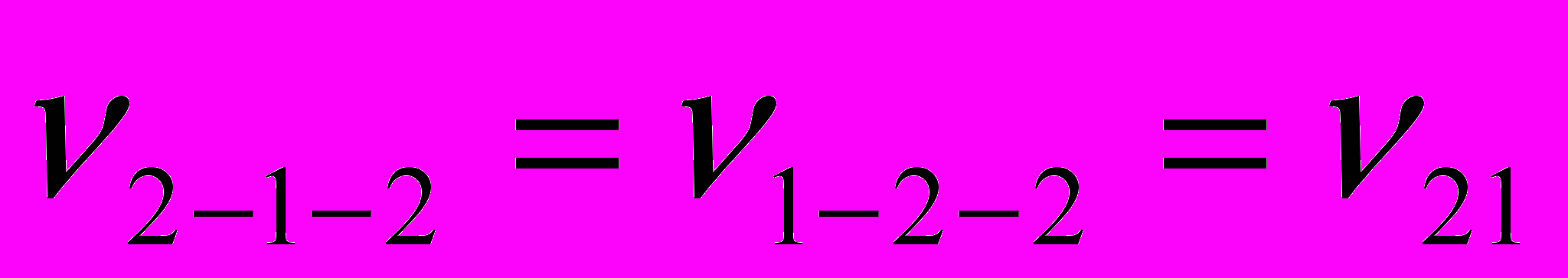 . Формально величины
. Формально величины 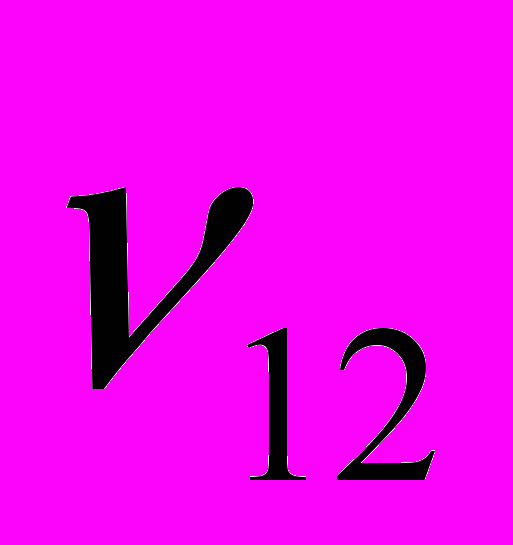 и
и 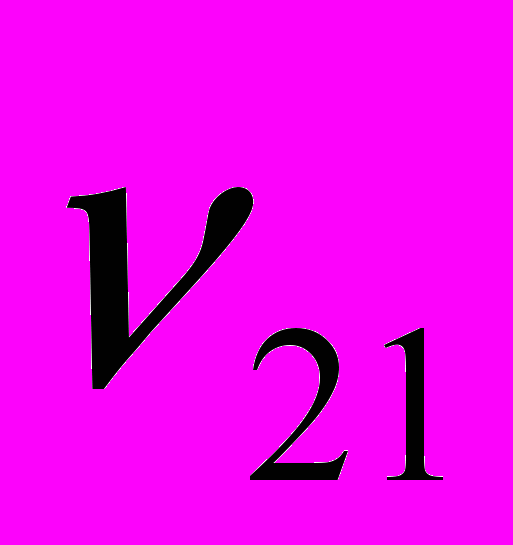 можно рассматривать как кинематическую вязкость системы, состоящей только из комплексов состава 2Н3РО4:ДМФА (
можно рассматривать как кинематическую вязкость системы, состоящей только из комплексов состава 2Н3РО4:ДМФА (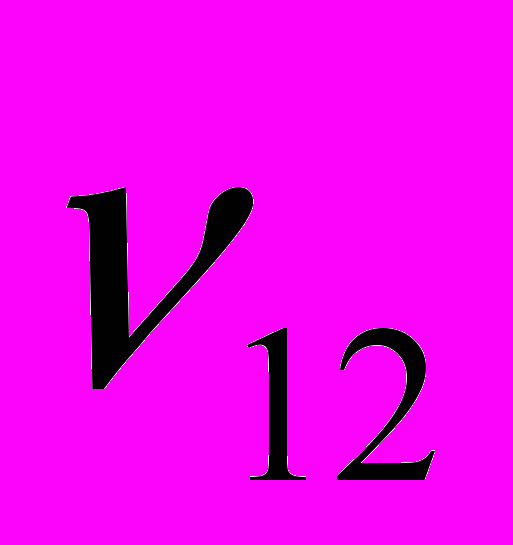 ) или Н3РО4:2ДМФА (
) или Н3РО4:2ДМФА (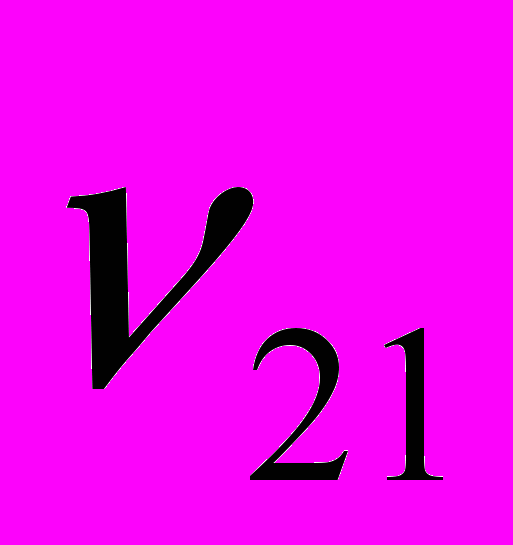 ).
).В результате расчетов по уравнению Мак-Аллистера были получены значения:
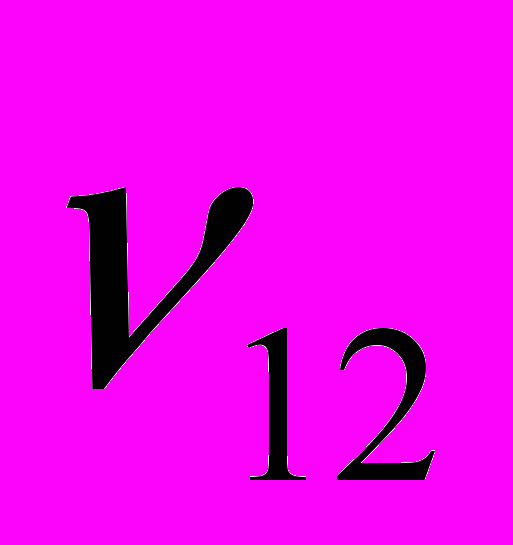 =794
=794 1,6;
1,6; 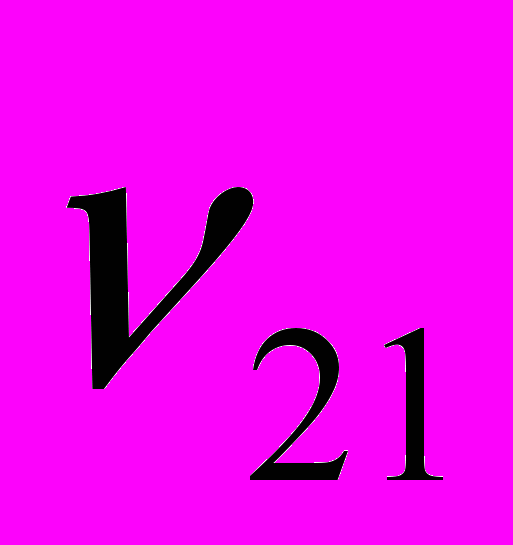 =0,23
=0,23 1,8. Из этих данных видно, что параметром взаимодействия
1,8. Из этих данных видно, что параметром взаимодействия 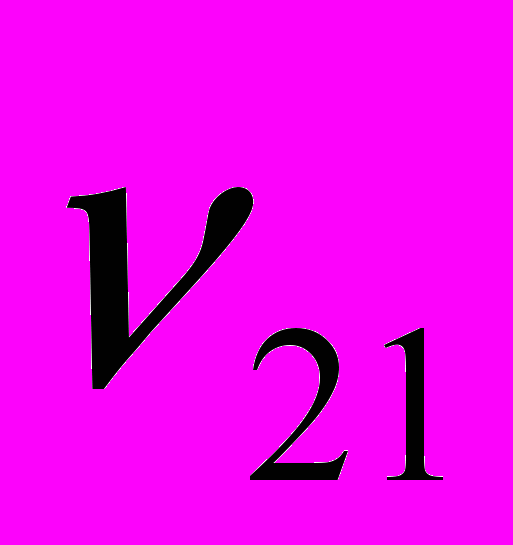 можно пренебречь, т.е. взаимодействия типа Н3РО4:2ДМФА в системе отсутствуют, а основной вклад в величину вязкости вносят комплексы 2Н3РО4:ДМФА.
можно пренебречь, т.е. взаимодействия типа Н3РО4:2ДМФА в системе отсутствуют, а основной вклад в величину вязкости вносят комплексы 2Н3РО4:ДМФА.Проведенные исследования транспортных свойств системы фосфорная кислота – N,N-диметилформамид показали, что диссоциация кислоты в ДМФА протекает настолько слабо, что кондуктометрический метод не позволяет получить количественные характеристики ассоциативно-диссоциативных процессов с участием ионных частиц. В то же время в системе имеют место очень сильные межмолекулярные взаимодействия, которые приводят к образованию прочных комплексов состава 2Н3РО4:ДМФА.
Термодинамические характеристики системы
фосфорная кислота – N,N-диметилформамид
На рис. 5. представлены полученные нами при 298 К энтальпии смешения H3PO4 с ДМФА.
Значения энтальпии смешения отрицательны и в несколько раз больше по абсолютной величине, чем для смесей ДМФА с другими неэлектролитами. В то же время энтальпии смешения эквимолярных количеств неорганических кислот с органическими соединениями, также имеют большие отрицательные значения, что связывается с образованием комплексов. Как и для других систем, содержащих Н-связи, величина избыточной мольной энтальпии для исследованной системы определяется химическим вкладом от образования водородных связей и физическим вкладом, обусловленным ван-дер-ваальсовыми взаимодействиями между молекулами в растворе, причем химическая часть обычно доминирует.
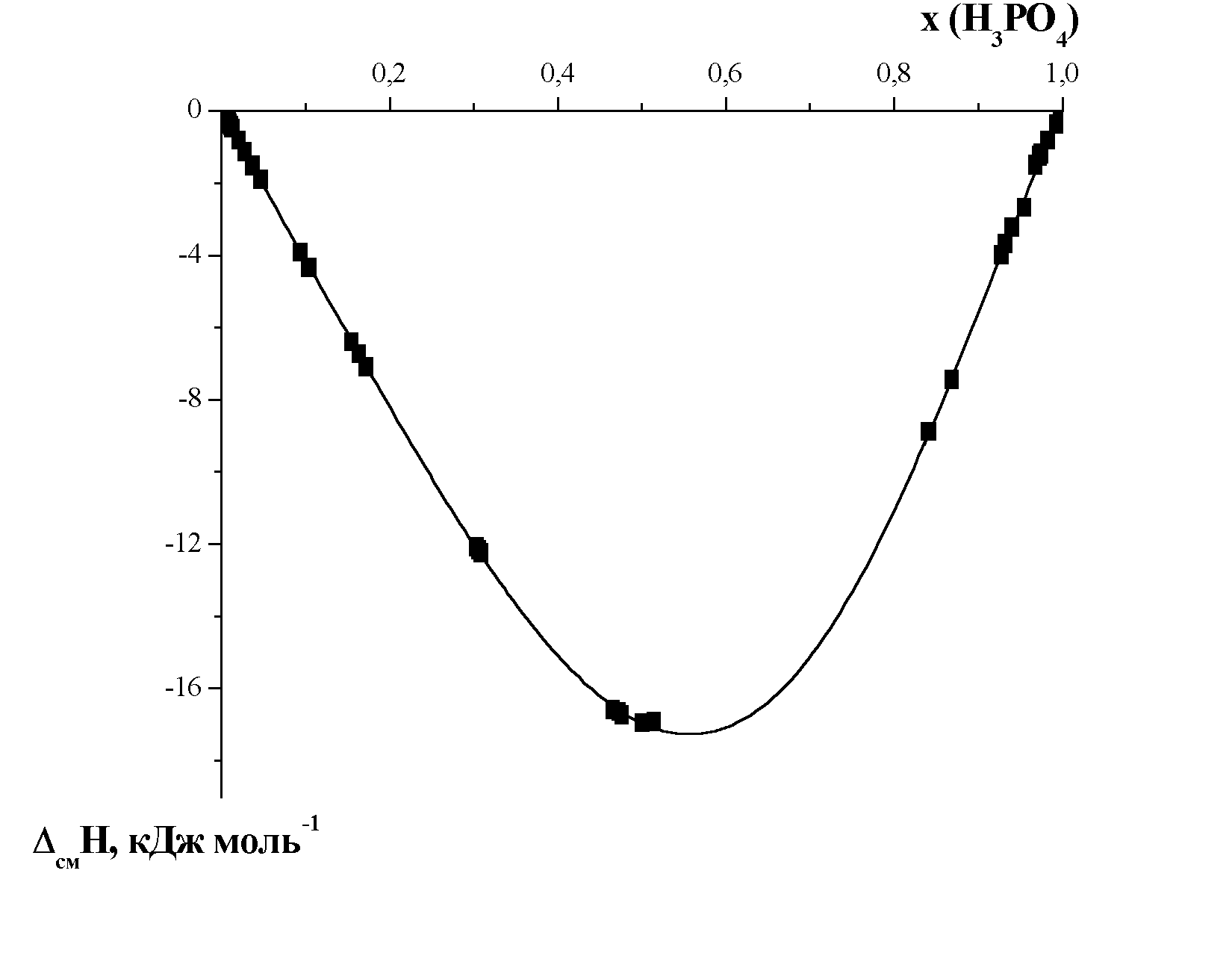 | Рис. 5. Концентрационная зависимость энтальпии смешения фосфорной кислоты и ДМФА при 298 К |
Таким образом, значительный экзо-эффект смешения фосфорной кислоты с диметилформамидом (Рис. 5.) также свидетельствует о наличии в системе сильных межмолекулярных взаимодействий. Как было показано ранее, в системе образуются комплексы состава 2H3PO4:ДМФА, что и объясняет смещение экстремума на концентрационной зависимости энтальпии смешения в область более высоких концентраций кислоты.
Для того чтобы лучше изучить состояние одного компонента смеси в другом, нами был проведен эксперимент по определению энтальпий растворения фосфорной кислоты в ДМФА и ДМФА в кислоте в области больших разбавлений.
Концентрационная зависимость энтальпий растворения H3PO4 в диметилформамиде (рис. 6.) позволяют проводить экстраполяцию на бесконечное разбавление с целью получения стандартных термодинамических величин (в несимметричной системе стандартов). Однако надо признать, что выбор теоретической модели для описания полученной зависимости изученной системы достаточно затруднен.
 | Рис. 6. Энтальпия растворения фосфорной кислоты в ДМФА при 298 К |
Из рисунка видно, что вид зависимости энтальпии растворения фосфорной кислоты в ДМФА на начальном участке аналогичен зависимостям для слабых электролитов. В связи с этим, мы еще раз попытались описать разбавленные растворы фосфорной кислоты с позиций растворов электролитов и для расчета стандартной энтальпии растворения рсH0(H3PO4) использовали экстраполяционное уравнение, учитывающее процесс ионной ассоциации (уравнение 6), при этом было сделано предположение о том, что фосфорная кислота диссоциирует только по первой ступени.
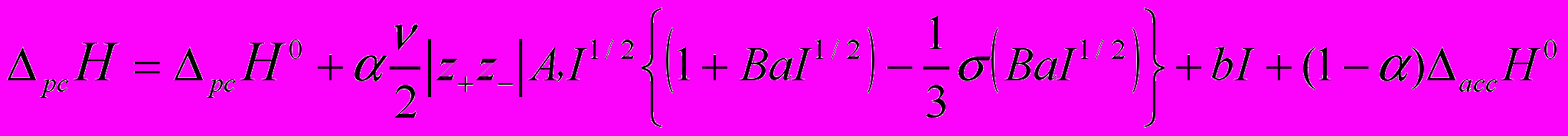 (6)
(6)Уравнение (6) включает четыре подгоночных параметра: стандартная энтальпия растворения (
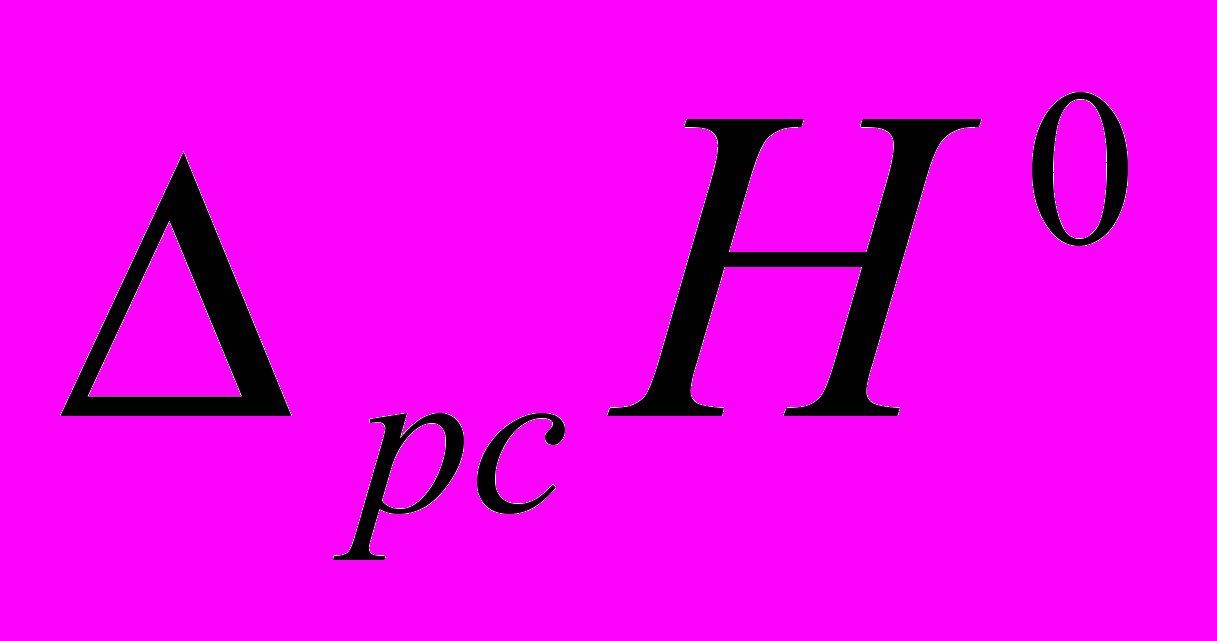 ), стандартная энтальпия ионной ассоциации (
), стандартная энтальпия ионной ассоциации (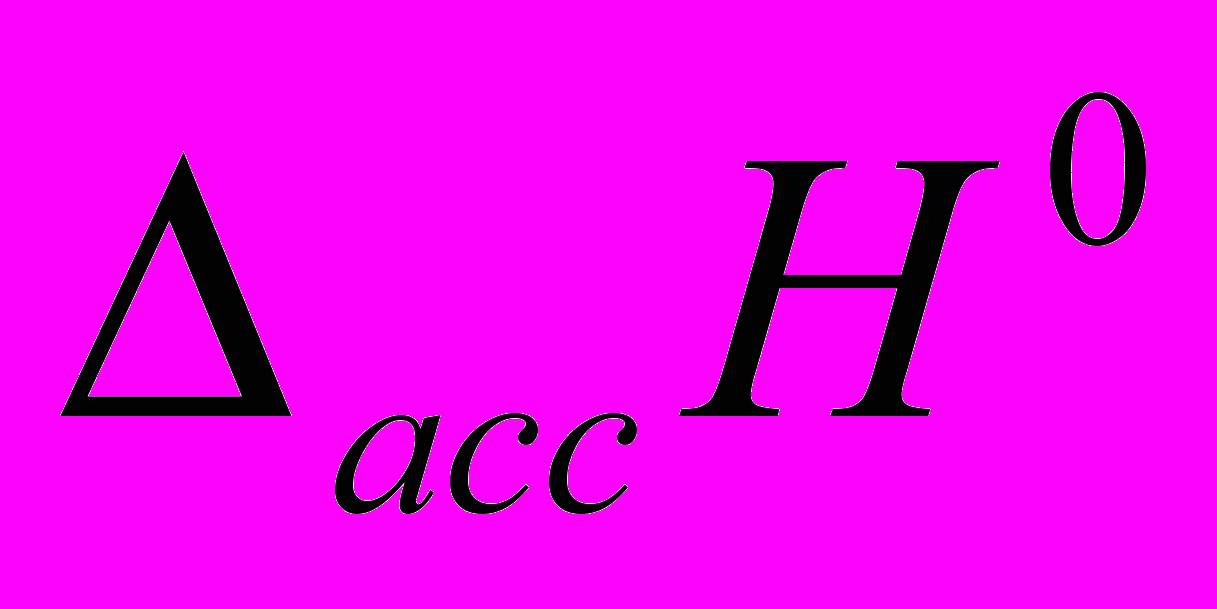 ), константа ионной ассоциации (
), константа ионной ассоциации (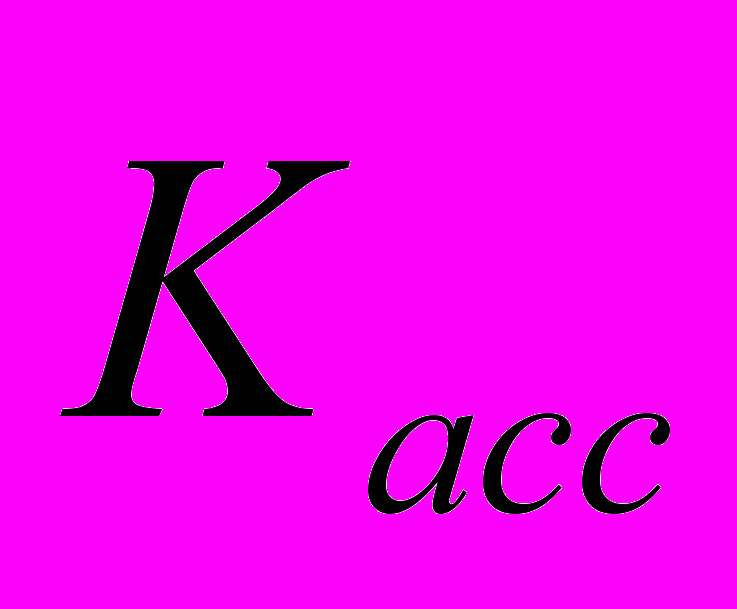 ) и b (эмпирический коэффициент). При таком большом количестве подгоночных параметров возникает неоднозначность в их определении, особенно, если имеется взаимная компенсация одних вкладов другими.
) и b (эмпирический коэффициент). При таком большом количестве подгоночных параметров возникает неоднозначность в их определении, особенно, если имеется взаимная компенсация одних вкладов другими.Путем минимизации функции, которая равна среднеквадратичному отклонению расчетных и экспериментальных величин:
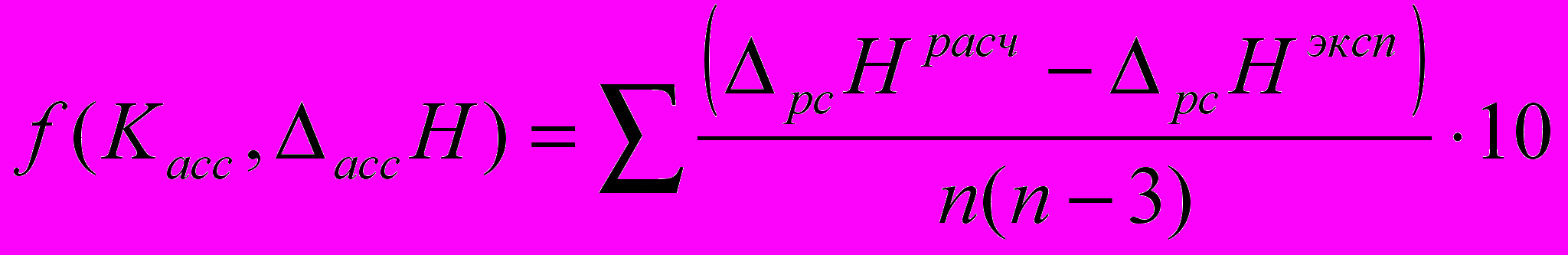 (7)
(7)было рассчитано значение стандартной энтальпии растворения фосфорной кислоты в ДМФА, которое составило -13,9 кДж/моль. Необходимо отметить, что эта величина характеризует энтальпию растворения фосфорной кислоты в ДМФА с образованием бесконечно разбавленного раствора, в котором кислота находится в виде ионов водорода и
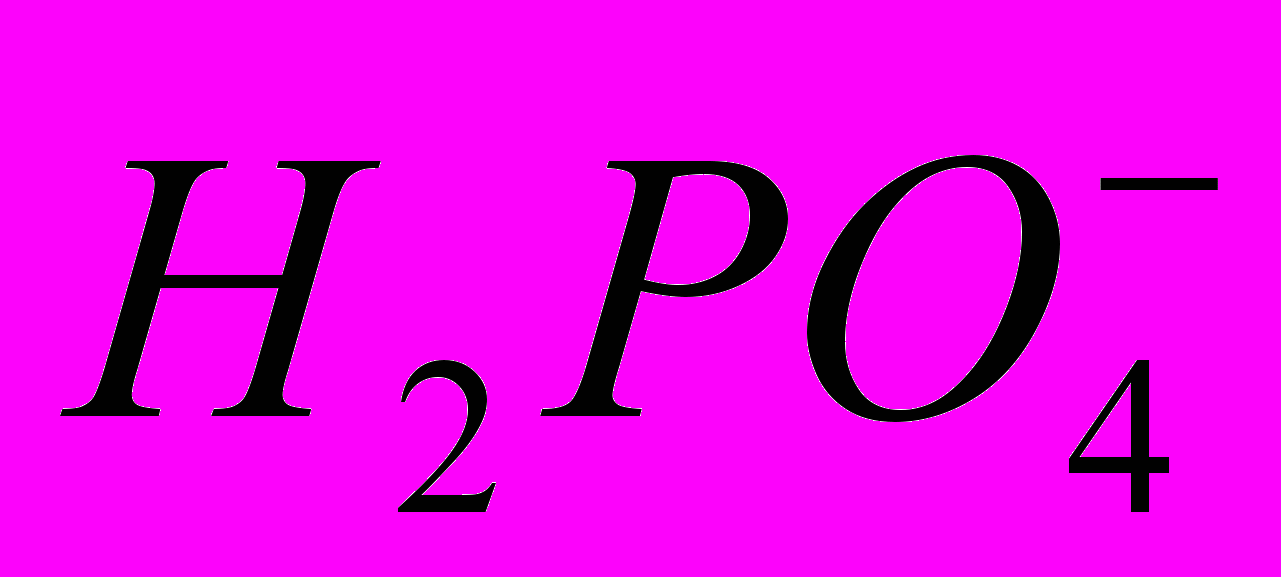 .
.В то же время данные по электропроводности показывают, что в той области концентраций, из которой проводится экстраполяция энтальпий растворения количество ионных частиц пренебрежимо мало. Поэтому для описания концентрационной зависимости энтальпии растворения фосфорной кислоты в ДМФА мы также использовали модель, в которой учитывается процесс образования молекулярных димеров кислоты (возможность нахождения фосфорной кислоты в растворах ДМФА в виде димеров отмечалось нами ранее). Для расчетов использовалось уравнение:
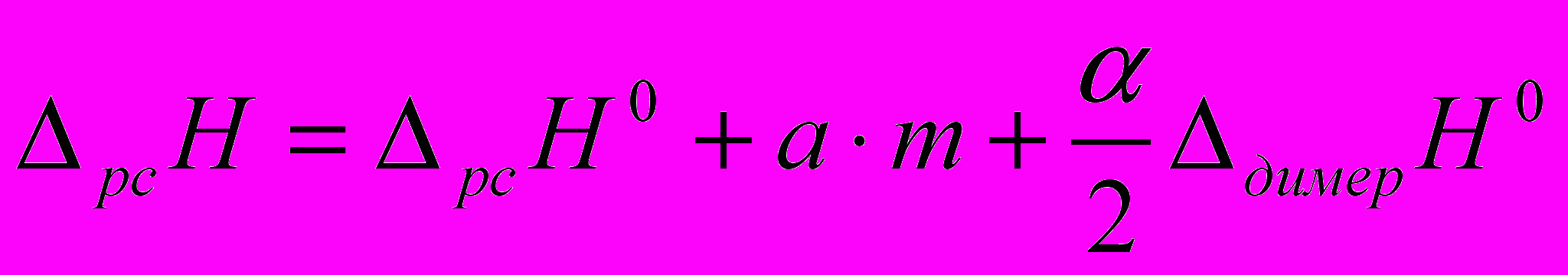 (8)
(8) - степень ассоциации фосфорной кислоты с образованием димеров, которая связана с константой димеризации соотношением (предполагается, что коэффициента активности Н3РО4 и (Н3РО4)2 равны 1):
- степень ассоциации фосфорной кислоты с образованием димеров, которая связана с константой димеризации соотношением (предполагается, что коэффициента активности Н3РО4 и (Н3РО4)2 равны 1):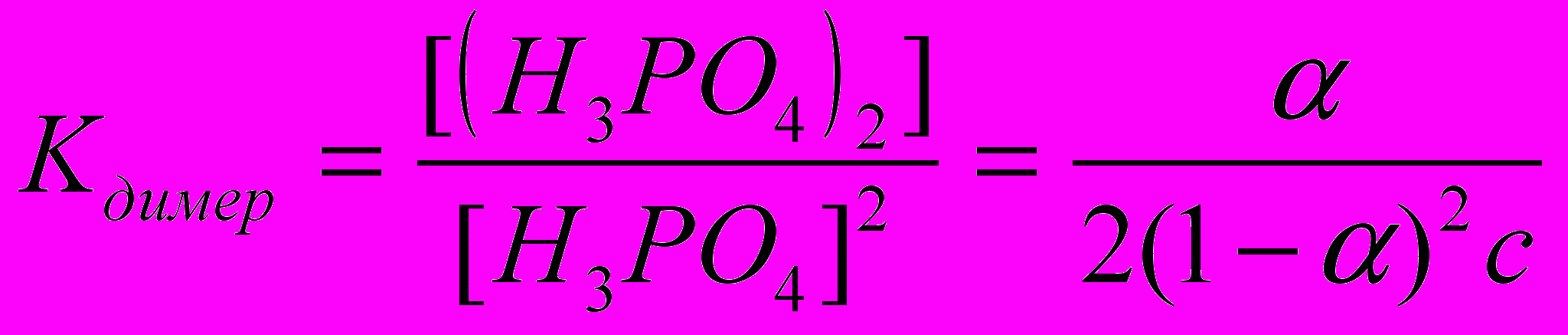 (9)
(9)Значение стандартной энтальпии растворения Н3РО4 в ДМФА, полученное таким образом, составляет:
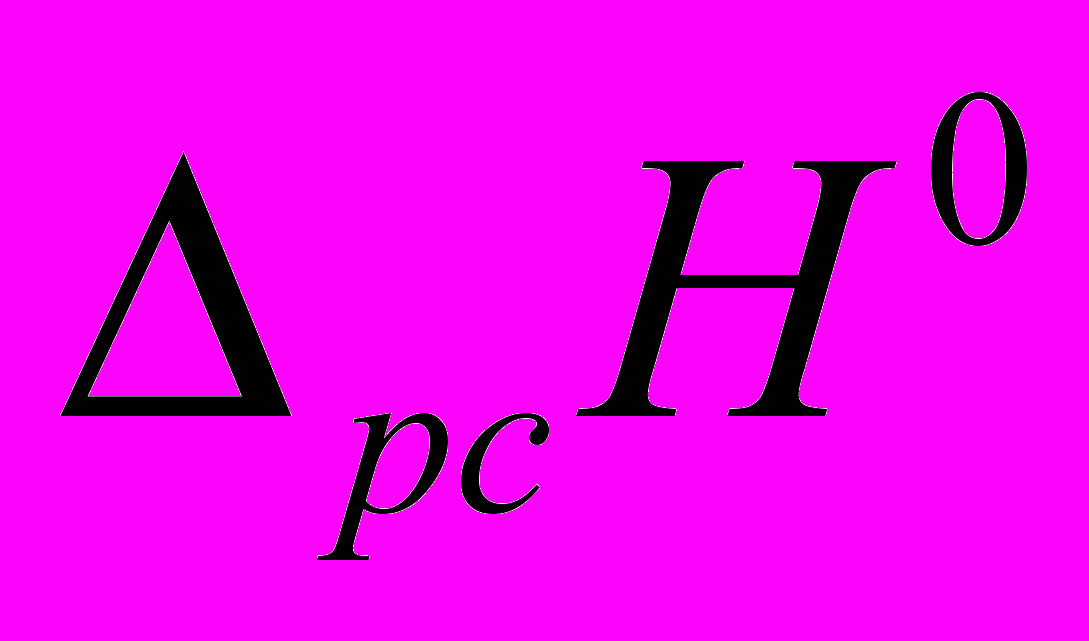 = - 16,6 кДж/моль. Необходимо отметить, что это величина характеризует энтальпию растворения фосфорной кислоты в ДМФА с образованием бесконечно разбавленного раствора, в котором кислота находится в виде молекул. Также мы оценили значения параметров молекулярной ассоциации (димеризации) фосфорной кислоты, которые равны
= - 16,6 кДж/моль. Необходимо отметить, что это величина характеризует энтальпию растворения фосфорной кислоты в ДМФА с образованием бесконечно разбавленного раствора, в котором кислота находится в виде молекул. Также мы оценили значения параметров молекулярной ассоциации (димеризации) фосфорной кислоты, которые равны 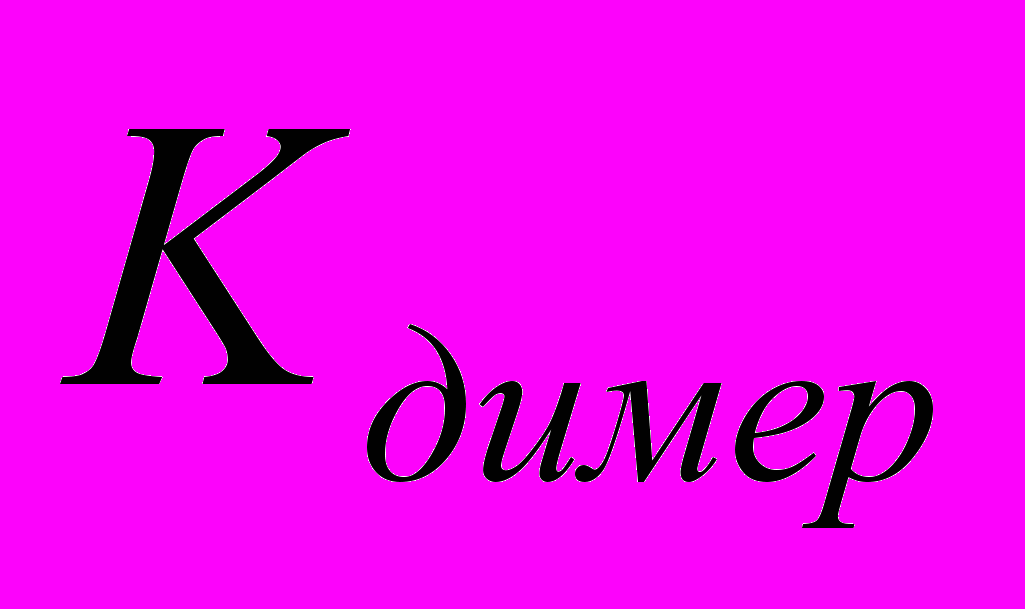 =31;
=31; 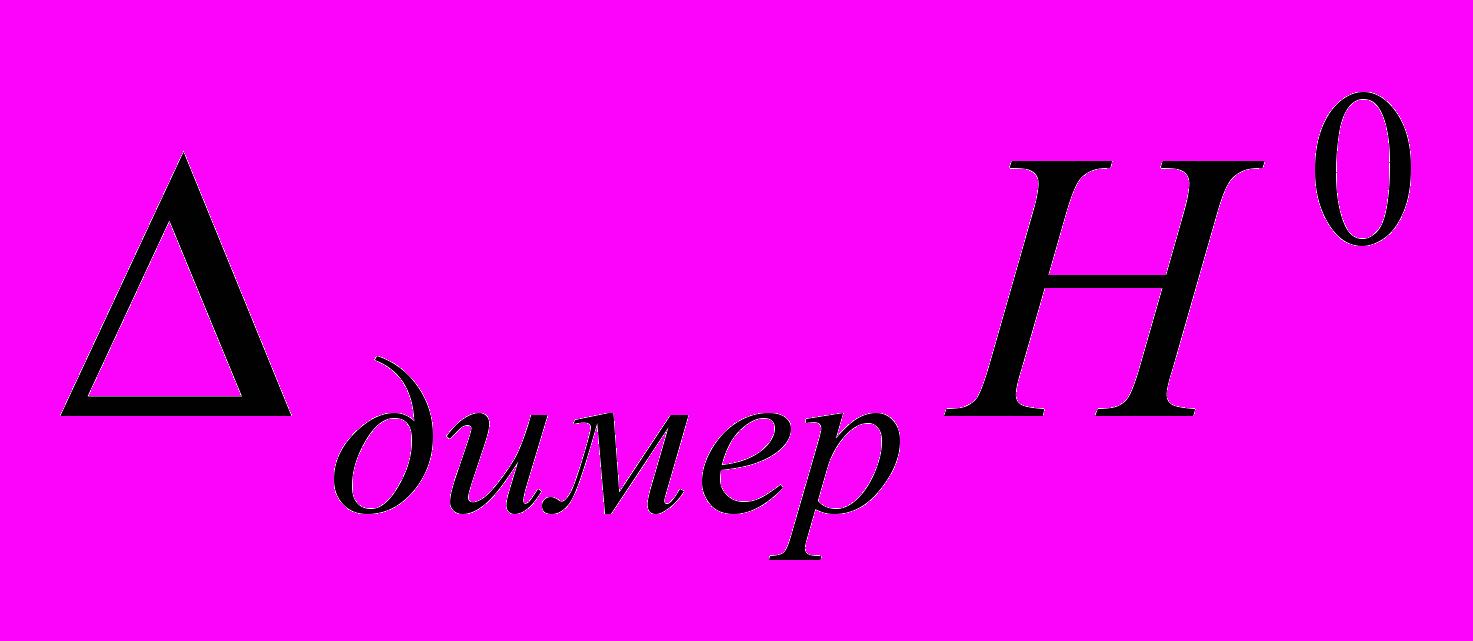 =-60 кДж/моль.
=-60 кДж/моль.Таким образом, величины
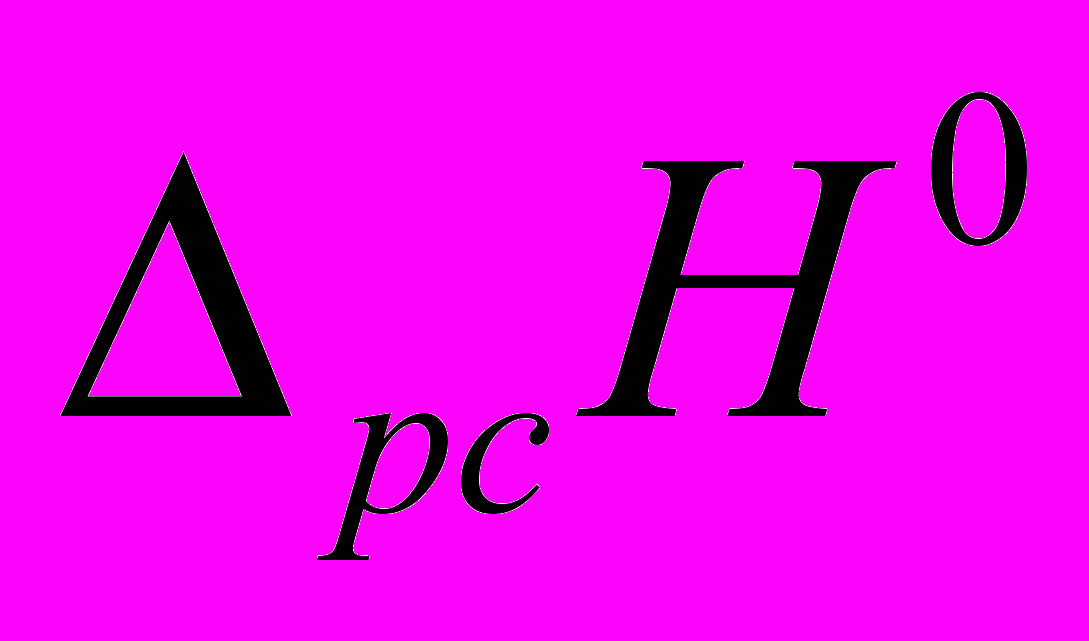 полученными двумя описанными выше методами характеризуют разные процессы и поэтому имеют различное значение. В то же время они позволяют оценить значение энтальпии диссоциации кислоты из термодинамического цикла:
полученными двумя описанными выше методами характеризуют разные процессы и поэтому имеют различное значение. В то же время они позволяют оценить значение энтальпии диссоциации кислоты из термодинамического цикла: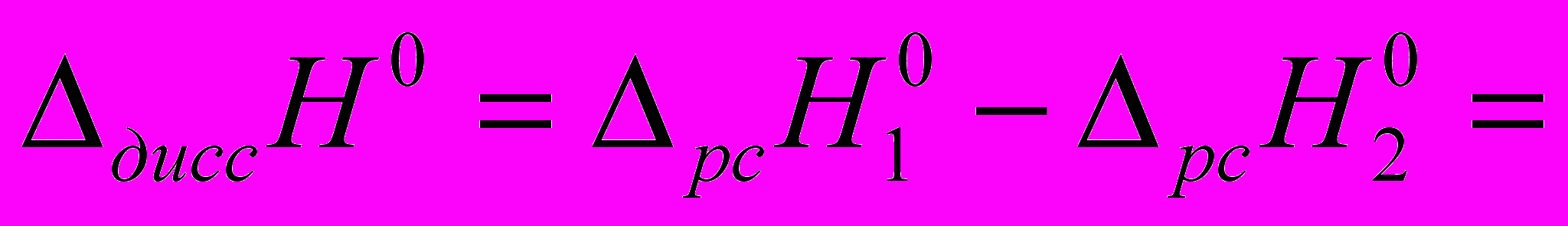 - 13,9+16,6=2,7 кДж/моль.
- 13,9+16,6=2,7 кДж/моль.Сравнивая полученную величину с энтальпией диссоциации фосфорной кислоты в воде (
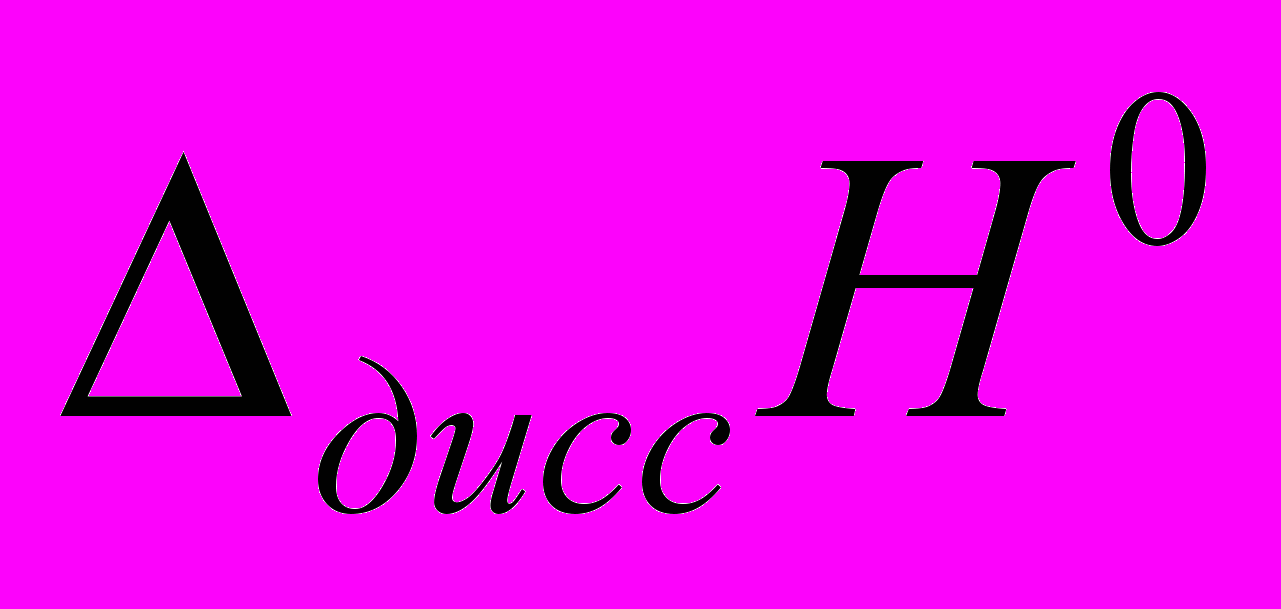 = - 7,9 кДж/моль) видно, что в отличие от водных растворов, в ДМФА экзо-вклад от ионной сольватации не перекрывает энергию разрыва связи в молекуле фосфорной кислоты при диссоциации.
= - 7,9 кДж/моль) видно, что в отличие от водных растворов, в ДМФА экзо-вклад от ионной сольватации не перекрывает энергию разрыва связи в молекуле фосфорной кислоты при диссоциации.Так как нам не удалось точно определить величину константы диссоциации фосфорной кислоты в ДМФА из кондуктометрического эксперимента, мы попытались оценить ее методом сравнительного расчета, используя линейную корреляцию между константой диссоциации кислоты в воде pKW и в органическом растворителе pKS:
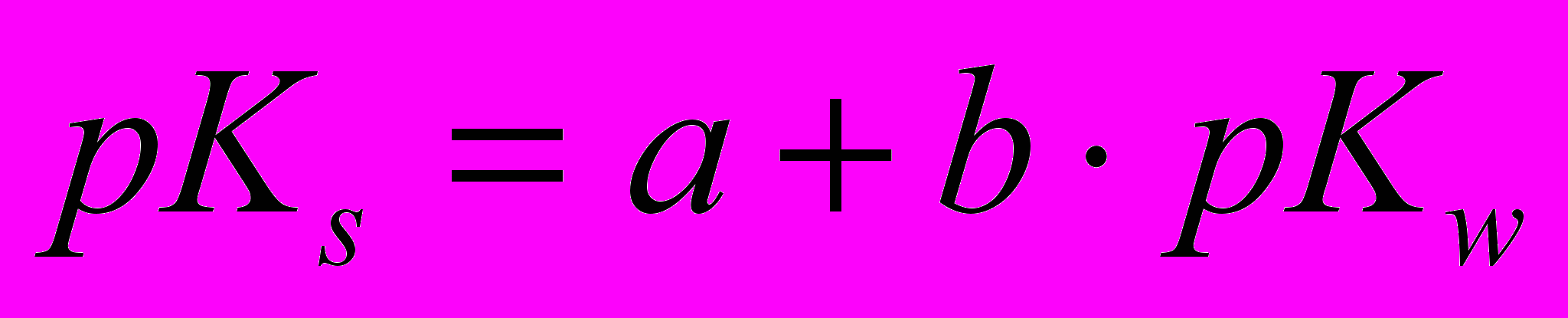 (10)
(10)Константы диссоциации слабых кислот в воде и ДМФА
| Кислота | рКДМФА | рКw | а | b |
| уксусная | 13,3 | 4,73 | 2,39 | 2,36 |
| хлоруксусная | 10,1 | 2,81 | ||
| бензойная | 12,3 | 4,21 | ||
| 3,4-диметил-бензойная | 13,0 | 4,4 | ||
| 3-бром-бензойная | 11,3 | 3,81 | ||
| 3,4-дихлор-бензойная | 11,0 | 3,6 | ||
| 4-нитробензойная | 10,6 | 3,45 | ||
| 3,5-динитро-бензойная | 8,9 | 2,82 |
Используя литературные данные по константам диссоциации ряда кислот в ДМФА и воде (Таблица 2), были определены коэффициенты а и b в уравнении (10), на основании которых и значения
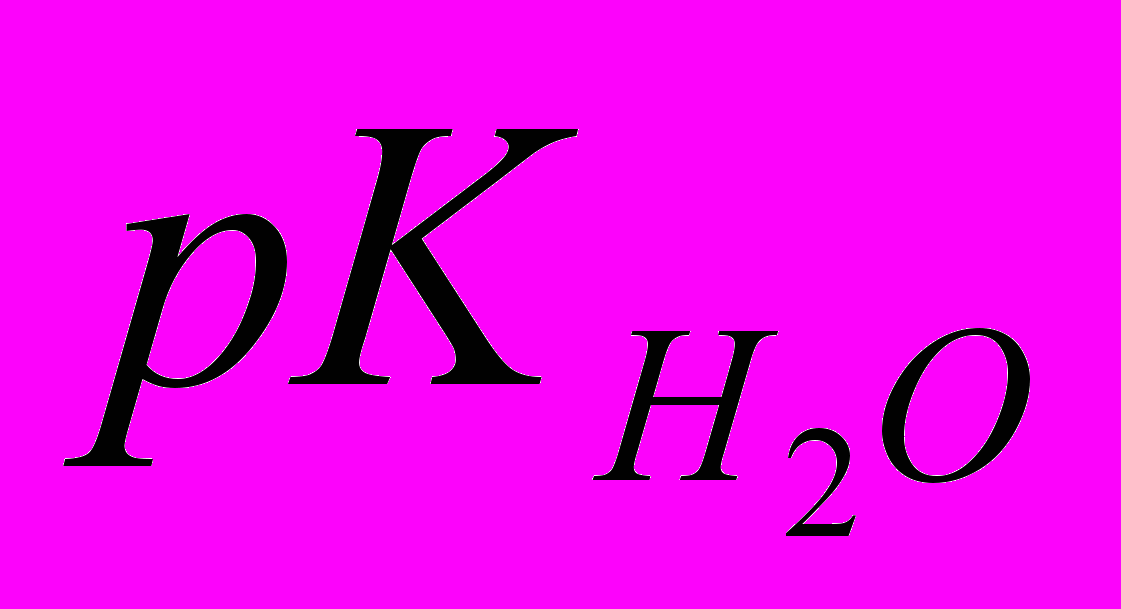 (Н3РО4)=2,12 была рассчитана константа диссоциации фосфорной кислоты в диметилформамиде:
(Н3РО4)=2,12 была рассчитана константа диссоциации фосфорной кислоты в диметилформамиде: 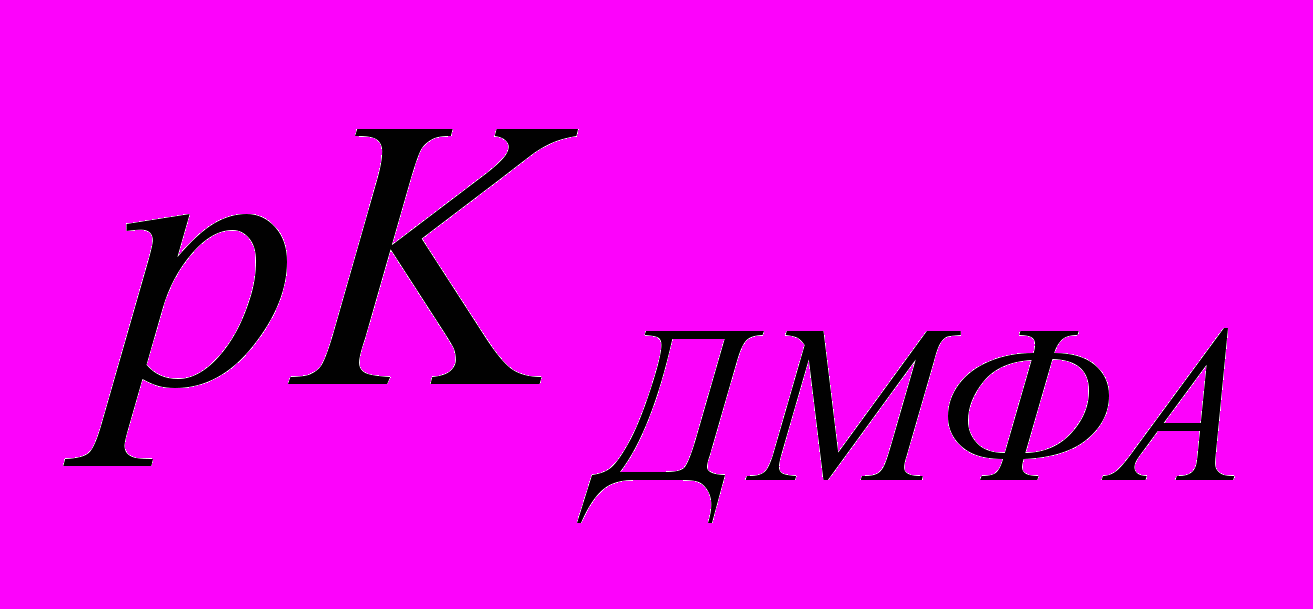 =7,39 (Кдиcc=4·10-8).
=7,39 (Кдиcc=4·10-8).Мы понимаем, что такая корреляционная зависимость лучше соблюдается в одном гомологическом ряду кислот. Но так как рК фосфорной кислоты в воде находится в той же области значений, что и для приведенных в таблице кислот, то, на наш взгляд, такая корреляция может быть использована для оценки величины константы диссоциации фосфорной кислоты в ДМФА в первом приближении.
Таким образом, проведенное термодинамическое исследование подтвердило выводы о сильном межмолекулярном взаимодействии в системе, приводящем к образованию комплекса. Установлено, что константа ионной диссоциации мала и лежит в пределах Кдисс≈10-6÷10-8. Механизм образования комплексов был изучен нами на основе спектральных методов.
Взаимодействия в системе фосфорная кислота – N,N-диметилформамид по данным ИК и КР-спектроскопии
Инфракрасные спектры растворов были записаны во всей области составов, в то время как спектры комбинационного рассеяния получены для растворов с концентрацией фосфорной кислоты до 0,7 м.д.
Используя литературные данные, нами было проведено следующее соотнесение полос в спектрах ДМФА и Н3РО4:
Таблица 2
Соотнесение основных полос в спектрах 100%--ной фосфорной кислоты и ДМФА
| ДМФА | ν, см-1 | Н3РО4 | ν, см-1 |
| | δ(О-Р-О) | 483 | |
| δ(О=С-N) | 658 | | |
| νs(N-CH3) | 865 | ||
| δ(NCH) | 1092 | ν(P-O-P) | 889 |
| ν(P-O(H)) | 1004 | ||
| ν(P=O) | 1145 | ||
| νas(N-CH3) | 1257 | | |
| νs(C-N) | 1387 | ||
| δas(N-CH3) | 1438 | ||
| νas(C-N) | 1506 | ||
| | δ(ОН) | 1653 | |
| ν(C=O) | 1674 | | |
| | νs(О-Н) | 2340 | |
| ν(C-H) и ν(СН3) | 2800 – 3000 | νas(О-Н) | 2887 |
Полученные нами ИК- и КР-спектры растворов фосфорной кислоты в ДМФА в различных частотных областях представлены на рисунках 7 и 8.
При добавлении фосфорной кислоты к ДМФА в ИК-спектре изменяется соотношение интенсивностей основных полос обоих компонентов системы и появляется интенсивное фоновое поглощение. Аналогичная картина наблюдается и в других систем кислота – органическое основание, что связывается с образованием в таких системах комплексов между молекулами кислоты и основания за счет образования сильной водородной связи. Колебания центрального протона сильно влияют на все другие колебания, что приводит к значительным возмущениям колебаний исходных молекул, образующих комплекс и, как следствие, появлению сильного фонового поглощения. В изученной нами системе также возможно существование комплексов с сильными водородными связями между молекулами фосфорной кислоты и ДМФА.
Об образовании таких комплексов можно судить на основе анализа положения полос колебаний различных групп, как в молекулах ДМФА, так и фосфорной кислоты.
Следует отметить, что при анализе колебательных спектров исследованной системы изменение положения основных полос фосфорной кислоты и ДМФА рассматривали относительно полос поглощения чистых компонентов.
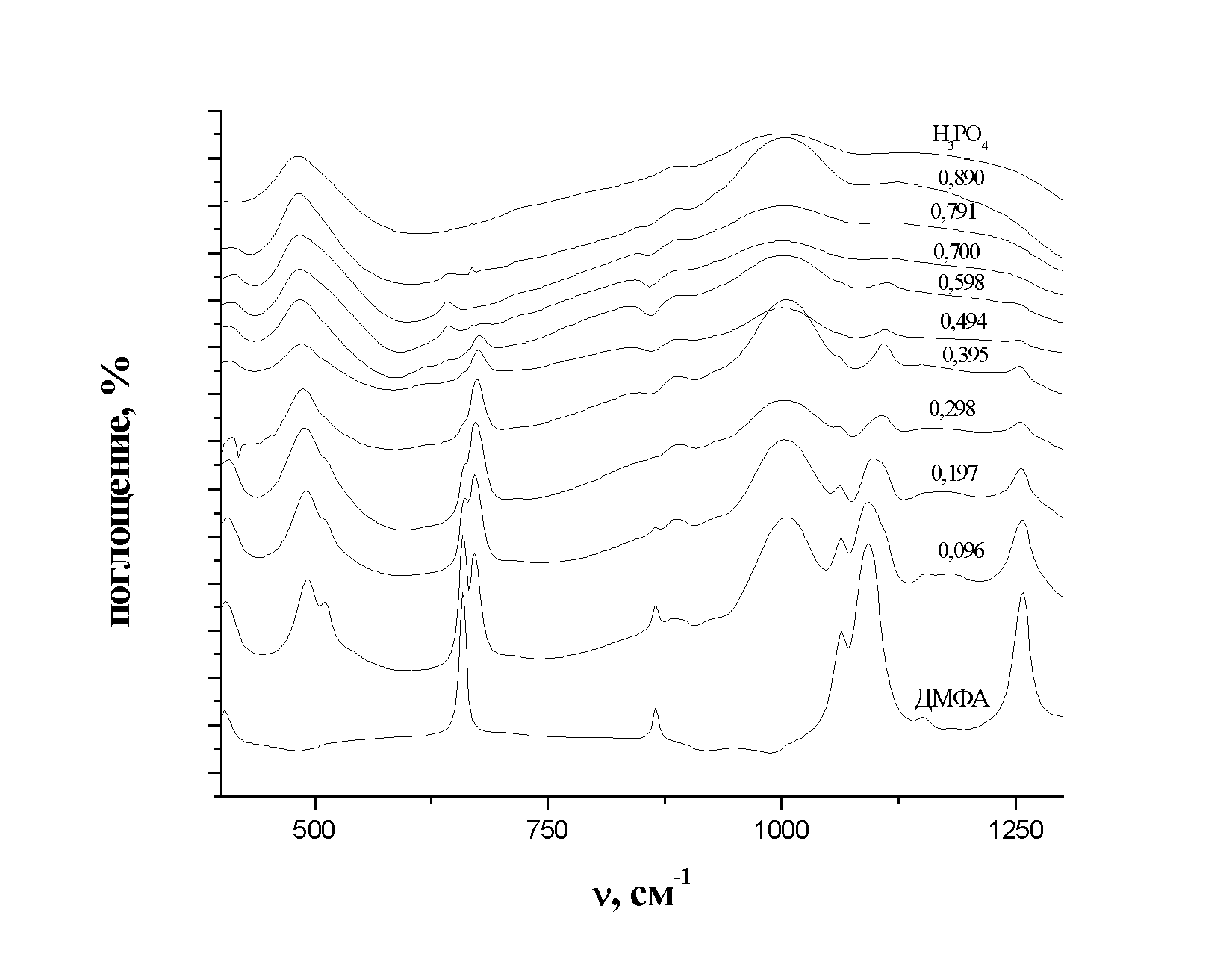 | Рис. 8. ИК-спектры системы Н3РО4 - ДМФА различной концентрации в области частот от 400 до 1300 см- |
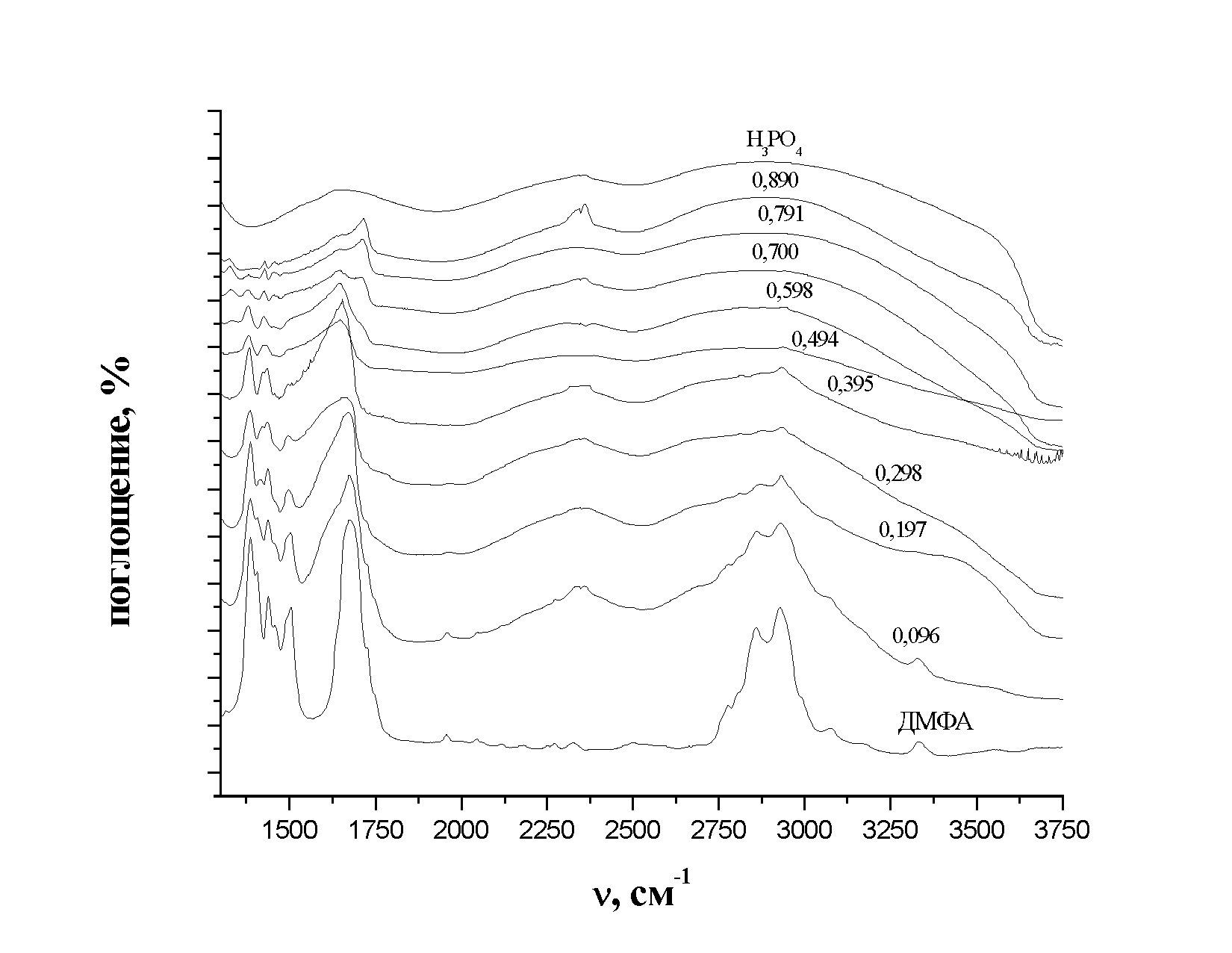 | Рис. 9. ИК-спектры системы Н3РО4 – ДМФА различной концентрации в области частот от 1300 до 2000 см-1 |
Сначала проанализируем изменение положения основных полос в спектре ДМФА.
В инфракрасном спектре раствора вплоть до концентрации 0,7 м.д. кислоты присутствует полоса валентных колебаний группы C-N (1387 см-1) молекулы ДМФА, при этом происходит уменьшение ее относительной интенсивности и незначительный сдвиг (7см-1) в низкочастотную область. Мы связываем это с образованием в системе комплексов с водородной связью
При концентрациях кислоты выше 0,7 м.д. эта полоса не регистрируется (Рис. 9.). В спектрах КР, по-видимому, это колебание не активно, и потому полоса не регистрируется.
При добавлении кислоты происходит уширение низкочастотного крыла полосы валентных колебаний карбоксильной группы молекулы ДМФА (С=О) (1674 см-1) и сдвиг ее в низкочастотную область (рис. 9.). Это понижение частоты является следствием понижения силовой постоянной карбонильной группы из-за оттягивания π-электронной плотности от этой группы, что свидетельствует о взаимодействии молекул ДМФА с фосфорной кислотой через атом кислорода. При концентрациях выше 0,7 м.д. кислоты эта полоса преобразуется в плечо. Одновременно при содержании кислоты 0,7 м.д. появляется полоса 1709 см-1, которая соответствует валентным колебаниям C=N и является полосой протонированного ДМФА (аналогичная полоса появляется и в спектре комбинационного рассеяния).
Для обсуждения механизма взаимодействия фосфорной кислоты с ДМФА при различном содержании кислоты, определенный интерес представляет изменение частоты и интенсивности деформационных колебаний группы O=C-N (658 см-1) молекулы ДМФА, причем описываемые далее изменения наблюдаются как в ИК-, так и в КР-спектрах. Начиная с концентрации кислоты 0,2 м.д. относительная интенсивность этой полосы резко уменьшается. При дальнейшем увеличении содержания кислоты полоса деформационных колебаний группы O=C-N исчезает. В то же время, при добавлении кислоты в спектре ДМФА появляется интенсивная полоса с частотой 672 см-1, которую можно рассматривать, как частоту деформационных колебаний O=C-N в комплексе, образующемся в результате взаимодействия ДМФА и фосфорной кислоты. Более высокая частота колебаний группы O=C-N в комплексе по сравнению с колебаниями этой же группы в свободном ДМФА вполне объяснима. С одной стороны при образовании комплексов происходит ослабление связи, по которой присоединяется «партнер», что приводит к уменьшению частоты колебания. С другой стороны, существенно увеличивается эффективная масса колеблющегося фрагмента. Таким образом, одновременное действие этих двух противоположно направленных факторов, приводит к увеличению частоты колебаний рассматриваемого фрагмента. При концентрации выше 0,7 м.д. фосфорной кислоты полоса (672 см-1) не регистрируется, что еще раз подтверждает, что молекулы ДМФА находятся в протонированной форме.
Спектральные полосы в инфракрасном спектре растворов при концентрации фосфорной кислоты свыше 0,7 м.д. практически идентичны полосам в спектре 100%-ной кислоты. Это, вероятно, связано с тем, что концентрация фосфорной кислоты достаточно велика и перекрывает большинство полос поглощения ДМФА, и, кроме того, происходит разрушение комплексов с водородной связью, и образуются комплексы с переносом заряда, в которых, из-за отсутствия сильной водородной связи, не происходит сильного возмущения колебаний молекул компонентов системы.
Теперь проанализируем смещение полос в спектре фосфорной кислоты.
В общем случае образование водородной связи с молекулой X—Н приводит к понижению частоты и расширению полосы валентного колебания X—Н (Н—О(Р) в молекуле кислоты). Однако, как видно из рис. 9. частота νs(О-Н) (2340см-1) практически не меняется с уменьшением концентрации кислоты. Это может быть связано с тем, что 100%-ная фосфорная кислота, как отмечалось ранее, существует в виде димеров, которые не разрушаются при добавлении ДМФА.
Образование комплекса должно приводить к увеличению частоты деформационных колебаний группы О-Р-О в молекуле фосфорной кислоты, что мы и наблюдаем (Рис. 8). Полоса деформационных колебаний группы О-Р-О смещается на 10см-1 в высокочастотную область по сравнению с ее положением в спектре 100%-ной кислоты (483 см-1). Аналогичное смещение наблюдается и в спектрах комбинационного рассеяния.
Известно, что в 100%-ной фосфорной кислоте протекает процесс автопротолиза. Можно предположить, что в присутствие ДМФА этот процесс будет затруднен. При этом частота валентных колебаний Р=О должна увеличиваться. Однако, в нашей системе происходит перекрывания полос валентных колебаний группы (P=O) (1145 см-1) молекулы фосфорной кислоты и деформационных колебаний группы (N-C-H) (1092 см-1) молекулы ДМФА, вследствие чего проследить изменение положения полосы ν (P=O) по ИК-спектрам невозможно (Рис. 8). В КР-спектрах при концентрации кислоты 0,22 м.д. наблюдается две полосы: 1094 и 1109 см-1, первая из которых отвечает δ(N-C-H), а вторая - ν(P=O) При более высокой концентрации кислоты в этой области частот появляется большое число новых полос, провести корректное соотнесение которых на данном этапе не удалось.
В ИК-спектре фосфорной кислоты присутствует полоса валентных колебаний группы (P-O-P) (889 см-1) (рис. 8.). Ее положение остается практически неизменным при уменьшении содержания кислоты. Наличие этой полосы свидетельствует о том, что даже в разбавленных растворах Н3РО4 в ДМФА присутствует Н4Р2О7 - дегидратированная форма фосфорной кислоты.
На основе данных ИК-Фурье спектроскопического исследования и анализа спектров комбинационного рассеяния предложен следующий механизм взаимодействия фосфорной кислоты и N,N-диметилформамида при различном соотношении компонентов:
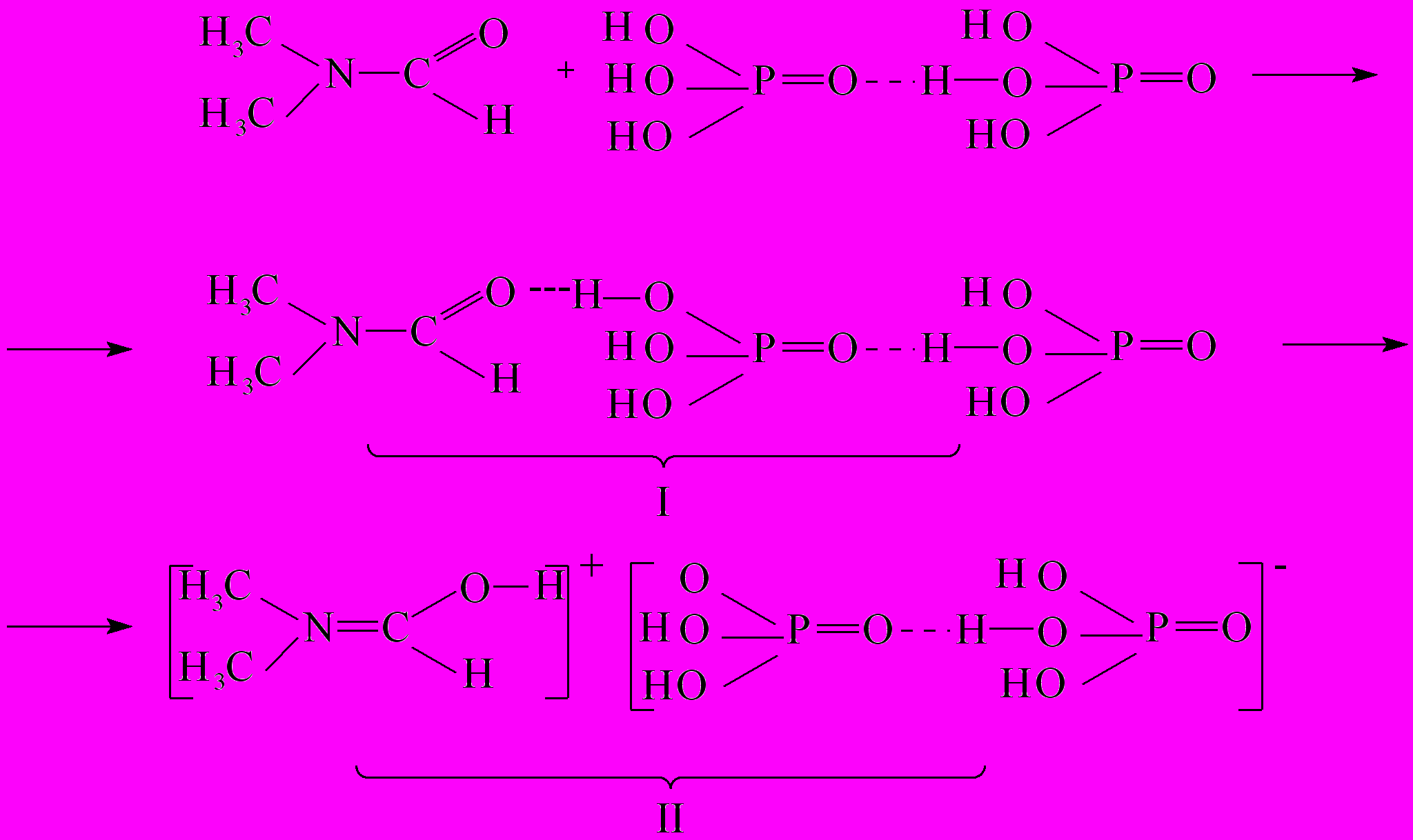

у
 величение концентрации кислоты
величение концентрации кислотыРис. 10. Схема взаимодействия ДМФА и фосфорной кислоты в зависимости от концентрации кислоты
Таким образом, в зависимости от соотношения компонентов в системе фосфорная кислота – ДМФА могут образовываться либо водородно-связанные комплексы (I), либо комплексы с переносом заряда (II).
Выводы
- Впервые проведено комплексное физико-химическое (кондуктометрия, вискозиметрия, термохимия, денсиметрия) и спектроскопическое (ИК-и КР-спектроскопия) исследование системы ортофосфорная кислота - N,N-диметилформамид во всей области составов в интервале температур 298 – 338 К. На основании полученных данных с использованием различных модельных представлений проведен анализ избыточных свойств системы в зависимости от состава и температуры, рассчитана стандартная энтальпия растворения Н3РО4 в диметилформамиде при 298 К.
- Установлено, что Н3РО4 в диметилформамиде является очень слабой кислотой. На основании кондуктометрического эксперимента и с привлечением метода сравнительного расчета оценена константа диссоциации фосфорной кислоты в диметилформамиде (Кдисс≈10-6÷10-8).
- Показано, что в системе существуют сильные межмолекулярные взаимодействия, приводящие к образованию комплекса 2Н3РО4:ДМФА.
- Показано, что в зависимости от состава смеси механизм образования комплекса различен. При концентрации кислоты в смеси до 0,7 м.д. комплексы образуются за счет сильной водородной связи, а при более высоких концентрациях образуются комплексы с переносом заряда.
- Проведенное исследование позволяет предположить, что димеры Н3РО4, которые присутствуют в чистой кислоте, сохраняются и в смеси с диметилформамидом во всей области составов.
Основное содержание диссертации опубликовано в следующих работах:
- Фадеева Ю.А., Шмуклер Л.Э., Сафонова Л. П., Колкер А. М. Система ортофосфорная кислота-N,N-диметилформамид как растворитель целлюлозы // Межвуз. научно-технич. конф. аспирантов, магистров и студентов «Молодые ученые – развитию текстильной и легкой промышленности» (Поиск 2000). Тезисы докладов, Иваново, 2000. С. 144.
- Фадеева Ю.А., Шмуклер Л.Э., Сафонова Л.П. Изучение физико-химических свойств растворов фосфорной кислоты // Международная научная конференция студентов, аспирантов и молодых ученых “Молодая наука – XXI веку”. Тезисы докладов, Иваново, 2001. С. 100-101
- Fadeeva J.A., Shmukler L.E., Safonova L.P. Investigation of system of phosphoric acid-N,N-dimethylformamide as potential solvent for cellulose // 27th International Conference on Solution Chemistry (27ICSC). Book of Abstracts, Vaals, Netherlands, 2001. Р.111.
- Ю.А. Фадеева, Л.Э. Шмуклер, Л.П.Сафонова, А.М.Колкер Сольватация и комплексообразование в системе фосфорная кислота-N,N-диметилформамид // VIII Международная конференции «Проблемы сольватации и комплексообразования в растворах». Тезисы докладов, Иваново, 2001. С.284
- Шмуклер Л.Э., Фадеева Ю.А., Сафонова Л.П., Кинчин А.Н. Термодинамические свойства системы фосфорная кислота - N,N-диметилформамид // XIV Международная конференция по химической термодинамике. Тезисы докладов, С.-Петербург, 2002. С.224
- Safonova L.P., Fadeeva J.A., Shmukler L.E. The Calorimetric Investigation of Phosphoric Acid-N,N-Dimethylformamide System // 17th IUPAC Conference on Chemical Thermodynamics. Book of Abstract, Rostock, Germany, 2002. P.217
- Fadeeva J., Shmukler L., Safonova L. Investigation of Phosphoric Acid –N,N-Dimethylformamide System as Potential Solvent for Cellulose // J. Mol. Liquids. 2003. V.103-104. P. 339-347
