Харьковская Медицинская Академия последиплом
| Вид материала | Диплом |
СодержаниеФизиологические и патологические эффекты докозагексаеновой кислоты и -3 эйкозаноидов Цель исследования Материалы и методы исследования Результаты и их обсуждение Практические рекомендации |
- Харьковская Медицинская Академия Последиплом, 737.36kb.
- Харьковская Медицинская Академия Последиплом, 596.06kb.
- Харьковская Медицинская Академия Последиплом, 531.61kb.
- Н. Г. Барановская Беларусская медицинская академия последиплом, 139.9kb.
- Кувакин Владимир Иванович Заслуженный деятель науки РФ доктор медицинских наук профессор, 361.78kb.
- Симерзин Василий Васильевич доктор медицинских наук, профессор Никитин Олег Львович, 452.7kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- В. И. Александров Учебное пособие. Российская медицинская академия последиплом, 207.44kb.
- Поляков Игорь Васильевич Эрман Михаил Владимирович Ведущее учреждение: гоудпо санкт-Петербургская, 348.31kb.
- Кулага Ольга Константиновна, профессор кафедры государственного учреждения образования, 424.04kb.
Физиологические и патологические эффекты
докозагексаеновой кислоты и -3 эйкозаноидов
| Физиологические | Патологические | |
| недостаток | избыток | |
| Содержание ДГК в клеточных мембранах и фосфолипидах крови | Снижение | Повышение (степень повышения и продолжительность влияния не изучены) |
| Реакция сетчатки глаза на свет | Снижение | Аномальная |
| Острота зрения | Снижение | Повышение |
| Мышление | Замедление | Улучшение |
| Память | Ухудшение | Улучшение |
| Другие виды познавательной деятельности | | Улучшение |
| Ощущение жажды | Полидипсия | Не исследовано |
| Диурез | Полиурия | Не исследован |
кардиомиоцитов, клеток эндотелия сосудов, эритроцитов, тромбоцитов, лейкоцитов и моноцитов.
Цель исследования
Изучить липидный статус и ПМР новорожденных и детей раннего возраста в зависимости от условий внутриутробного и постнатального развития, вскармливания. Определить влияние ЭПНЖК и ЭФ на ПМР детей раннего возраста с перинатальными поражениями ЦНС.
Материалы и методы исследования
Под продольным выборочным наблюдением находилось 120 пар "мать – дитя", начиная с последнего триместра беременности и до 3 лет жизни ребенка.
Основная (І гр.) включала 80 детей – инфицированных герпесом 1,2 и цитомегалией, которым в комплексе иммунореабилитационных мероприятий проводили модификацию фосфолипидного статуса введением ЭПНЖК и ЭФ. В контрольную (II гр.) вошли 40 детей, нутритивное обеспечение которых не корригировалось. Им проводили только стандартную терапию.
Пациенты І гр. вскармливались грудью матери и получали -3 ЭПНЖК Новая Жизнь* компании ВИТАМАКС в дозе 0,5–1г/сут и ЭФ Лецитин Премиум в дозе 2г/сут. Дети на искусственном вскармливании адаптированными смесями, получали 2г/сут ЭПНЖК и 4г/сут ЭФ. Коррекцию пищевого статуса с помощью эссенциальных жирных кислот и фосфолипидов проводили до второго месяца жизни, а затем еще трижды в год курсами по 2 мес. с перерывами 1-2 мес.
Беременным и кормящим матерям детей І гр. во 2-3 триместре в рацион добавляли 3г/сут ЭПНЖК и 6г/сут ЭФ, завершая плановую нутритивную подготовку за 1-2 недели до родов.
По другим факторам (возраст родителей, гестационный и календарный возраст ребенка, физическое развитие, наследственность) сравниваемые группы формировали по принципу "копия – пара".
Липидный статус в плазме крови и мембранах эритроцитов изучали по следующей методике. Исследовали беременных перед родами, новорожденных – на 5-7 день жизни и детей в возрасте 3 и 18 мес.
ПМР оценивали по балльной шкале Л.Т.Журбы и Е.М.Мастюковой. Методика адаптирована и стандартизована нами для периода новорожденности в виде возрастных центильных графиков каждого из 10 подуровней нервно-психического развития, что облегчило индивидуальную оценку и коррекцию развития ребенка.
Полученные результаты исследований обработаны методами вариационной статистики с использованием ПК.
Результаты и их обсуждение
Роль липидов во вскармливании больных новорожденных и недоношенных детей остается серьезной проблемой и является предметом научных поисков и дискуссии ученых и клиницистов.
Жиры обеспечивают 50% энергии, которую ребенок получает с питанием. Это основной компонент клеточных мембран, особенно в нейронах, нейроглии, сетчатке глаза. У новорожденных детей абсорбция жиров из грудного молока происходит только на 70-75% из-за недостаточного синтеза желчных кислот, низкой активности панкреатической липазы в течение первых месяцев жизни. Практически здоровые недоношенные и маловесные дети при высокой потребности в жирах имеют еще меньшую способность к их всасыванию в тонком кишечнике.
Именно желчные кислоты участвуют в абсорбции длинноцепочечных жирных кислот. У больных новорожденных при нарушении кишечного всасывания жиров (гепатобилиарная патология, энтеропатия, дискинезии желчевыводящих путей и диспанкреатопатии, холестазе и других органических и функциональных расстройствах) в первую очередь нарушается абсорбция длинноцепочечных -6 ПНЖК – линолевой и арахидоновой, что приводит к дефициту -3 - α-линоленовой, докозагексаеновой и дисбалансу ЭПНЖК в сторону увеличения соотношения -6 / -3.
Основные представители -3 ПНЖК – эйкозапентаеновая (ЭПК) и докозагексаеновая (ДГА) кислоты – конкурентные антагонисты арахидоновой кислоты класса -6. Они конкурируют за циклооксигеназу, что приводит к синтезу -3 простагландинов, и за липооксигеназу с последующим синтезом -3 тромбоксана и лейкотриенов с противоположными -6 эйкозаноидам свойствами (антикоагуляционные, противовоспалительные, спазмолитические).
Арахидоновая кислота (АК) – первичный субстрат для выработки большого семейства эйкозаноидов (простагландины, простациклин, тромбоксан, лейкотриены и др. производные). Изученные нами по литературным источникам и в клиническом наблюдении физиологические и патологические эффекты -6 эйкозаноидов представлены в табл. 1. АК в большом количестве присутствует в мембранах нервных стволов и окончаний, способствует их миелинизации, обеспечивает скорость проведения нервных импульсов, участвует в формировании ПМР.
Докозагексаеновая кислота вырабатывается из α-линоленовой и модулирует функции эйкозаноидов, включаясь в их состав при наличии адекватного соотношения -6 и -3 ЭПНЖК, а также отвечает за функции нейронов, сетчатки глаз и другие (табл. 2). ДГК составляет 50% фосфолипидов сетчатки глаз, 60% всех фосфолипидов коры головного мозга, влияет на проницаемость мембран, трансмембранный перенос ионов и аминокислот.
Полученные результаты исследования состава липидов плазмы крови и эритроцитов у матерей и детей представлены в таблицах 3-8. Достоверность различий показателей в основной и контрольной группах (p<0,05).
Уровень липидов в эритроцитах и плазме крови беременных и кормящих матерей после лечения значительно отличался по содержанию α-линоленовой, арахидоновой и эйкозапентантаеновой + докозагексаеновой ПНЖК (p<0,05). При этом соотношение -6 и -3 в плазме крови и эритроцитах женщин основной группы составляло 7,9 и 4,4 соответственно, тогда как у беременных и кормящих без нутритивной коррекции оно значительно выше – 19,5 и 8,9 соответственно (p<0,05).
Состав липидов плазмы и эритроцитов крови беременных и кормящих матерей, в диету которых не вводили дополнительно ЭФ и ЭПНЖК, отличался высоким содержанием пальмитиновой и олеиновой жирных кислот, что объясняется характером питания. Количество линолевой, α-линоленовой, АК, ЭПК+ДГК у женщин контрольной группы в плазме в 3-4 раза, а в эритроцитах – в 2,5-3 раза ниже необходимых параметров, что указывает на их глубокий дефицит и невозможность трансплацентарной передачи плоду, создания у него необходимого запаса для обеспечения острофазовой и пролонгированной адаптации после рождения. При норме соотношения насыщенные к ненасыщенным ЖК 50:50, у беременных и кормящих женщин контрольной группы оно составило 62,1:37,9 при общей сумме ПНЖК 25,5%. У женщин, получивших нутритивную коррекцию ЭФ и модификацию жирных кислот пищевой добавкой Новая Жизнь*, указанное соотношение приобрело параметры, приближенные к физиологическим – 52:47,9 при сумме ПНЖК 31,9%.
Недостаточное поступление -3 ПНЖК и ЭФ у беременной во 2 и 3 триместрах и кормящей матери, а при патологии кишечного всасывания у матери – еще и дефицит -6 ПНЖК и ЭФ приводит к снижению трансплацентарной передачи и недостаточному накоплению перечисленных веществ у плода, что способствуют развитию патологии ЦНС и грубой задержке ПМР. Даже небольшое поступление ДГК в рацион матери при кормлении грудью приводили к быстрой нормализации состояния ребенка и ликвидации отставание в ПМР, тогда как отсутствие грудного вскармливания (нет поступления ДГК) приводило к задержке ПМР при достаточном физическом развитии. Поэтому беременным и кормящим женщинам целесообразно обогащать рацион ЭПНЖК, учитывая повышенные потребности и наличие связи между статусом ДГК матери и плода.
Результаты показали, что несмотря на недостаточную абсорбцию длинноцепочечных жирных кислот в первую неделю жизни, их количество в эритроцитах (p<0,05) и плазме крови детей І гр. (матери которых получали ЭФ и ЭПНЖК) были выше, чем у младенцев II гр., что указывает на их трансплацентарное поступление и накопление до рождения и поступление в готовом виде с молоком матери.
У новорожденных ІІ гр. в плазме крови и эритроцитах, как и у их матерей, преобладали стеариновая, олеиновая и пальмитиновая ЖК при умеренном недостатке линолевой и α-линоленовой кислот и резко выраженном дефиците АК и ЭПК+ДГК. У детей І гр. запасы α-линоленовой кислоты в плазме крови увеличились в 2 раза, а в эритроцитах – в 8 раз, что отражает лучшее усвоение из материнского молока и большую трансплацентарную передачу с накоплением у плода при предварительной нутритивной коррекции липидного статуса матери. Соотношения насыщенные/ненасыщенные ЖК в плазме крови и эритроцитах обеих групп существенно не отличались, что свидетельствует о достаточном усвоении ненасыщенных ЖК из пищи, однако сумма ПНЖК у детей I гр. была значительно выше при физиологичном коэффициенте -6 / -3. В обеих группах детей уровень -6 ЖК в плазме крови и эритроцитов превышал физиологические нормативы, что можно объяснить наличием патологии (СЗВУР плода, гипоксические и метаболические нарушения, TORCH-инфекции и др.). Уровень α-линоленовой и ЭПК+ДГК в эритроцитах детей II гр. был значительно ниже физиологических параметров, тогда как у детей I гр. он едва достигал нормальных значений, что при адекватном обеспечении ПНЖК детей I гр. указывает на дисбаланс ЭПНЖК из-за патологических состояний и присутствия -6 эйкозаноидов.
У новорожденных II гр. содержание α-линоленовой кислоты в плазме крови практически достигало нормальных значений, однако уровень ЭПК+ДГК не повышался, что характеризует нарушенную ассимиляцию ЖК из пищи и наличие патологических состояний с деградацией клеточных мембран преобладанием -6 ЖК и образованием -6 эйкозаноидов, составляющих основу нарушения ПМР.
Таким образом, у новорожденных от матерей с TORCH-инфекцией, ФПН, СЗВУР, гипоксией плода, а также нарушенным пищеварением и/или неправильным питанием во время беременности наблюдается глубокий дефицит ЭПНЖК, нарушение соотношения -6 и -3 и обмена эйкозаноидов (преобладание -6 эйкозаноидов), тяжелая эндотелиальная дисфункция и повреждение различных органов, задержкой ПМР.
У детей на искусственном вскармливании, в том числе и при временном вынужденном вскармливании смесями или парентеральном питании, в первые 2-3 недели жизни из-за тяжести состояния ребенка, фосфолипидный обмен самостоятельно не регулируется, что требует адекватного лечения. ДГК и АК в усвояемой форме необходимо добавлять к питанию матери и ребенка или по возможности вводить парентерально как можно раньше, что сегодня является наиболее актуальным предметом научных изысканий.
При некоторых патологических состояниях (грибковые инфекции, поражение ЖКТ грамотрицательной флорой с выделением токсинов) наблюдается усиленное потребление -3 эйкозаноидов и избыточная выработка -6 эйкозаноидов, что приводит к усугублению патологии, развитию сепсиса, потере IgA, аутоиммунным поражениям. Длительная эндотелиальная дисфункция на фоне избытка -6 эйкозаноидов может провоцировать глиоз, бронхолегочную дисплазию, ретинопатию, НЭК.
Состав липидов плазмы и мембран эритроцитов крови у детей 3-месячного возраста во II гр. характеризовался преобладанием пальмитиновой кислоты и глубоким дефицитом α-линоленовой, АК, ЭПК+ДГК. В динамике наблюдения уровни -3 ЖК и сумма ПНЖК снижались, что свидетельствует об усугублении дефицита -3 ПНЖК без их дополнительной модификации в первые 2 месяца жизни. Коэффициент -6/-3 в этой группе составил 14,63 по сравнению с его нормальным значением 3,17 у младенцев І гр. Нормализация достигнута за счет увеличения ЭПК+ДГК в 3,5 раза путем грудного вскармливания и введения в диету матери и в комплекс лечебных мероприятий -3 ПНЖК. Соответственно, дети ІІ гр. показали значительной отставание в ПМР.
В возрасте 18 мес. у детей ІІ гр., не получавших грудного молока и дополнительной коррекции ЭФ и ЭПНЖК, уровень пальмитиновой кислоты значительно преобладал при недостатке α-линоленовой, АК, ЭПК+ДГК в плазме и эритроцитах крови. Этот факт подтверждает невозможность самостоятельной регуляции липидного обмена у детей на искусственном вскармливании даже после расширения питания и их перехода на «общий стол», а также необходимость проведения модификации -3 ПНЖК путем введения готового вещества. У детей І гр., получавших нутритивную коррекцию, сумма ПНЖК практически достигала норматива при оптимальном соотношении насыщенные/ ненасыщенные ЖК. Этого не произошло у детей ІІ гр., которые отставали в ПМР, хотя коэффициент -6/-3 в этом возрасте у них приближался к норме. Соотношение -6/-3 в эритроцитах у детей І гр. в возрасте 18 мес. составило 2,46, что соответствует норме здоровых детей. У них отмечена нормализация ПМР к этому возрасту (рис.1).
В настоящее время нет четких представлений о потребности плода, доношенного и недоношенного ребенка в ЭПНЖК в различные периоды развития (2 и 3 триместры внутриутробного и первые месяцы постнатального развития; интенсивного роста до 2-3 лет и в более поздний возраст до 18 лет в зависимости от физических и умственных нагрузок, условий внешней и внутренней среды. Имеющиеся данные исследований касаются преимущественно новорожденных. Роль ЭПНЖК в психомоторном и интеллектуальном развитии детей более старшего возраста и подростков освещена недостаточно (единичные работы). Потребность в ЭПНЖК определена только для недоношенных новорожденных (не менее 0,2-0,3% от всех фосфолипидов при соотношении -6 / -3 – 6:1 [EPAGAN 1987], а при патологических состояниях – 3:1).
Не установлены сроки проведения лечения и последующей реабилитации и не определено сочетание -6 и -3 ЭПНЖК при внутриутробных инфекциях, хронической гипоксии и ишемии мозга, печени, почек, сердца, особенно в сочетании с преждевременным рождением, неправильным питанием кормящей матери, вынужденным «голоданием» ребенка с истощением запасов ДГК. Знание этих закономерностей может помочь в проведении коррекции фосфолипидного статуса ребенка в зависимости от различных факторов, для предупреждения хронизации патологического процесса, задержки развития мозга, улучшения дифференциации его тканей и функций в различные периоды роста и развития ЦНС, особенно до 2-3 лет, когда происходит максимальное развитие функций коры и анализаторов, реализуются морфологические потенции интеллектуального развития человека.
Развитие ЦНС ребенка сопровождается следующими процессами: клеточная репликация (внутриутробный период и первые 2 года жизни); синаптогенез; клеточная миграция, прогрессия и регрессия (с разной интенсивностью в отдельных структурах в разные периоды развития); пластичность (способность центров мозга выполнять функции в зависимости от условий и связей между разными отделами мозга).
Вредные воздействия на мать в ранние сроки беременности могут провоцировать врожденные пороки и аномалии развития. Неблагоприятные факторы, влияющие на развитие мозга во 2 и 3 триместре беременности, включая нерациональное питание, сопряжены с риском задержки интеллектуального и ПМР, вплоть до врожденного слабоумия и аутизма.
Исследованиями последних лет выявлено значительное влияние ЭПНЖК и ЭФ на все процессы развития ЦНС ребенка. По данным проведенных долговременных наблюдений (до 17-летнего возраста) детей, родившихся с внутриутробной гипотрофией, установлено, что дети с малым весом при рождении характеризовались слабыми познавательными способностями и более низкими результатами школьного обучения. Показано, что недостаточное питание матери во время беременности и лактации, отсутствие грудного вскармливания также отрицательно влияет на ПМР детей.
Грудное молоко содержит -6 (линолевую и арахидоновую) и -3 (α-линоленовую и докозагексаеновую) НЖК. Стандартные смеси для вскармливания недоношенных новорожденных содержат только линолевую и α-линоленовую кислоты. В последнем триместре внутриутробного развития в головном мозге плода количество арахидоновой и докозагексаеновой кислот увеличивается в 3-5 раз. Эндогенный синтез арахидоновой и докозагексаеновой кислот не обеспечивает потребности плода и ребенка, особенно недоношенных детей в первые 2-3 года жизни. Недоношенные дети при искусственном вскармливании подвергаются дополнительному риску задержки ПМР и нарушению зрительной функции, так как не получили необходимое количество длинноцепочечных ПНЖК ни трансплацентарно, ни с материнским молоком.
Мозг плода особенно быстро развивается в 3 триместре внутриутробного развития. За первый год жизни мозг ребенка увеличивается в размере в 3 раза (с 350 до 1000г) и продолжает развиваться быстрыми темпами в первые 3 года жизни, достигая 80% массы органа взрослого. Наиболее интенсивное развитие мозга наблюдается в момент становления интеллекта, зрения и речевых функций до 2-3 лет.
Установлены нарушения структуры питания женщин во время беременности и лактации, в частности, недостаточное употребление рыбы, растительных жиров, свежих овощей и фруктов, а также излишек рафинированных углеводов, животных жиров, что приводит к дисбалансу ПНЖК, дефициту -3 ЖК, нарушению ПМР.
Р
Зона нормального развития здоровых (>25)
 езультаты исследования показателей ПМР новорожденных и детей раннего возраста, которые получали ЭФ и ЭПНЖК приведены на рис.1.
езультаты исследования показателей ПМР новорожденных и детей раннего возраста, которые получали ЭФ и ЭПНЖК приведены на рис.1.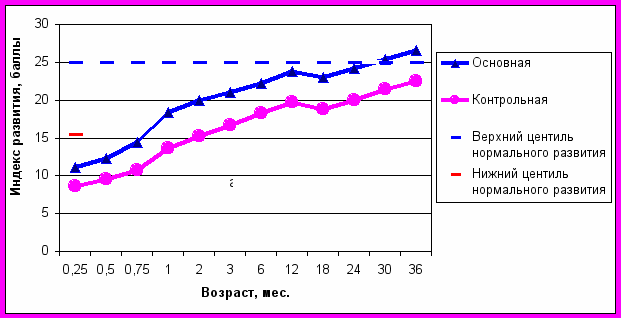
Рисунок 1. Суммарные возрастные показатели психомоторного развития детей основной и контрольной групп в сравнении со стандартами развития здоровых.
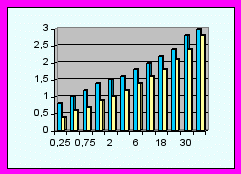
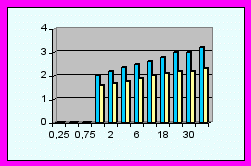
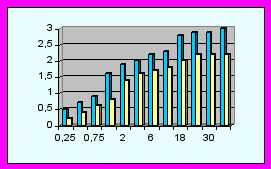
В неонатальном периоде дети основной группы показали лучший суммарный индекс развития в баллах (15,54±,34 против 11,79±0,39, р<0,05) за счет повышения коммуникабельности (разница 0,413 баллов - см. диаграммы), улучшение мышечного тонуса (0,45), уменьшение грубых моторных реакций (0,7), ускорение развития тонкой моторной деятельности (0,4) и сенсорно-моторного поведения (0,43), уменьшение симптоматики поражения черепно-мозговых нервов (0,4), патологических движений (0,42).
В возрасте 1-12 месяцев суммарный индекс развития в основной группе составил 21,73±0,27 против 17,44±0,28 баллов, р<0,05. За данный период наблюдения в основной группе улучшилось предречевое и речевое развитие (разность голосовых реакций составила 0,53 балла), исчезли затянувшиеся врожденные безусловные рефлексы (0,52), улучшился мышечный тонус (0,43), уменьшилась грубая моторная (0,45) и значительно повысилась тонкая моторная деятельность (0,58), улучшилось сенсорно-моторное поведение (0,46), значительно уменьшились патологические движения (0,48) и симптомы поражений черепно-мозговых нервов (0,49).
От 1 до 3 лет разница суммарных показателей психомоторного развития составила 4,12 баллов (24,76±0,56 в основной и 20,64±0,51 в контрольной, р<0,05). Наибольшая разность в показателях развития сравниваемых групп наблюдалась за счет речевой составляющей (0,4), тонкой моторной деятельности (0,8), сенсорно-моторного поведения (0,66), уменьшения симптомов поражения черепно-мозговых нервов (0,56) и патологических движений (0,75).
В сравнении с центилями коридоров нормального развития здоровых детей отмечены опережение ПМР детей основной группы по коммуникабельности (0,33 баллов), уменьшению грубой (0,48) и развитию тонкой моторной деятельности (0,4), исчезновению патологических движений (0,3). Остальные показатели ПМР детей основной группы вошли в пределы коридора нормального развития после 3 недели жизни, а в контрольной - после 2,5 месяца (см. рис.1). У 3 детей контрольной группы развился ДЦП, у 2 – ретинопатия. Аналогичные результаты при изучении интеллекта и зрительной функции у детей с малой массой тела получены и другими авторами.
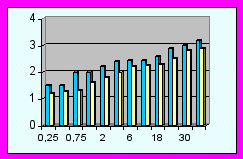 | 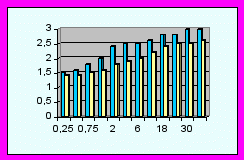 | 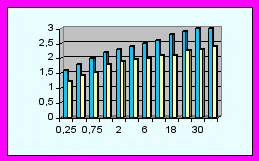 |
| Коммуникабельность | Голосовые реакции | Сенсорно-моторное поведение |
 |  |  |
| Грубая моторная деятельность | Тонкая моторная деятельность | Патологические движения |
Диаграммы сравнения ПМР детей исследуемых групп (р<0,05).
| | - основная группа | | | - контрольная группа |
Таким образом, модификация липидного статуса беременных и кормящих матерей, новорожденных и детей раннего возраста на искусственном вскармливании за счет введения -3 ПНЖК оказала положительное влияние на психомоторное развитие детей с перинатальными поражениями ЦНС на фоне персистенции инфекции TORCH-группы.
Выводы
- У беременных и кормящих матерей с TORCH-инфекцией, а также у их детей недостаточность в питании эссенциальных полиненасыщенных жирных кислот и фосфолипидов – наиболее распространенный фактор, приводящий к задержке внутриутробного роста и развития.
- При модификации липидного статуса беременных и кормящих матерей, а также грудном вскармливании их детей с задержкой ПМР путем введения в рацион -3 ПНЖК и ЭФ большинство нарушений функций нервной системы нивелируется к году, а нейросенсорное поведение и тонкая моторная деятельность ребенка выравниваются к 3 годам жизни.
- Отсутствие коррекции пищевого статуса беременных и кормящих матерей, а также у детей, находящихся на искусственном вскармливании введением необходимого количества ЭПНЖК и ЭФ, способствовало развитию задержки ПМР к 3 годам жизни.
- Недостаточность ЭПНЖК и ЭФ в рационе рекомендуется компенсировать употреблением БАД Новая Жизнь* и Лецитин Премиум компании ВИТАМАКС.
Практические рекомендации
- Беременным группы высокого риска по перинатальной патологии ЦНС плода рекомендуется создать необходимый запас ЭПНЖК и ЭФ во 2-3 триместре путем введения в диету 3г/сут ЭПНЖК (Новая Жизнь) и 6 г/сут ЭФ (Лецитин Премиум) компании ВИТАМАКС.
- Кормящим матерям, которым проводилась во время беременности модификация липидного статуса Омега-3 ПНЖК и ЭФ, добавлять в рацион питания 2 г. БАД Новая жизнь и 5 г. Лецитин Премиум до 2 месяца жизни ребенка, а при наличии патологии ЦНС у ребенка – до 2-х лет, курсами по 2 мес. с перерывами в 1 мес.
- Новорожденным на грудном вскармливании, родившимся с низкой массой тела, с различной патологией, приводящей к нарушению кишечного всасывания жиров, вводить с лечебной целью Новая Жизнь (Омега-3 ПНЖК 1 г/сутки) и Лецитин Премиум 3 г/сутки курсами по 2 мес. с перерывами в 1 мес. до 2-х летнего возраста.
- Новорожденным и детям раннего возраста на искусственном вскармливании с заместительной целью вводить Новая Жизнь (Омега-3 ПНЖК 2 г/сутки) и Лецитин Премиум 5 г/сутки курсами по 2 мес. с перерывами в 1 мес. до 3-х летнего возраста, при угрозе задержки ПМР – коррекцию липидного статуса обязательно проводить в первые 2 мес. жизни.
Новая Жизнь хорошо усваивается при введении в полость рта каплями во время каждого кормления. Лецитин Премиум вводится с молоком матери или питательной смесью.
Таблица 3
