Вісник львів. Ун-ту visnyk LVIV univ. Серія хім. 2004. Вип. 44. С. 107-114 Ser. Khim. 2004. No 44. P. 107-114 Аналітична хімія
| Вид материала | Документы |
СодержаниеКлючові слова Властивості пероксимоносульфатної кислоти ... Властивості пероксимоносульфатної кислоти ... Властивості пероксимоносульфатної кислоти ... |
- Вісник львів. Ун-ту visnyk LVIV univ. Серія хім. 2003. Вип. 43. С. 205-208 Ser. Khim., 73.67kb.
- Вісник львів. Ун-ту visnyk LVIV univ серія географічна. 2004. Вип. 31. С. 96-100 Ser., 93.97kb.
- К львів. Ун-ту серія філол. 2004. Вип. 33. Ч. С. 74-81 visnyk LVIV univ. Ser. Philol., 1992.1kb.
- Вісник львів. Ун-ту серія філол. 2004. Вип. 35. С. 123-129 visnyk LVIV univ. Ser. Philol., 1761.46kb.
- Львів. Ун-ту серія філол. 2004. Вип. 35. С. 3-6 Visnyk LVIV univ. Ser. Philol. 2004., 2427.38kb.
- Вісник львів. Ун-ту серія філол. 2004. Вип. 35. С. 373-382 visnyk LVIV univ. Ser. Philol., 1208.15kb.
- Львів. Ун-ту visnyk LVIV univ. Серія хімічна. 200 Вип. 4 С. 197 201 Ser. Khim. 2004., 102.82kb.
- Серія філол. 2004. Вип. 33. Ч. С. 3-12 visnyk LVIV univ. Ser. Philol. 2004. №33. Part, 2604.78kb.
- Вісник львів. Ун-ту серія філол. 2003. Вип. 31. С. 75-92 visnyk LVIV univ. Ser. Philologi., 1743.21kb.
- Вісник львів. Ун-ту серія філол. 2003. Вип. 31. С. 192-201 visnyk LVIV univ. Ser. Philologi., 877.55kb.
| ВІСНИК ЛЬВІВ. УН-ТУ | VISNYK LVIV UNIV. |
| Серія хім. 2004. Вип.44. С.107-114 | Ser. Khim. 2004. No 44. P.107-114 |
Аналітична хімія
УДК 535.379.547
ВЛАСТИВОСТІ ПЕРОКСИМОНОСУЛЬФАТНОЇ КИСЛОТИ ТА ВИКОРИСТАННЯ ЇЇ В АНАЛІЗІ
В. Зінчук, О. Мицук, О. Стаднічук 1
Львівський національний університет імені Івана Франка,
вул. Кирила і Мефодія, 6, 79005 Львів, Україна
Узагальнено результати вивчення властивостей і можливостей використання в аналізі розведених водних розчинів пероксимоносульфатної кислоти. На основі реакцій окиснення метилсульфату 9,10-диметилакридинію та гідразиду 3-амінофталевої кислоти (люмінолу, H2L) пероксимоносульфатною кислотою розроблено нові високочутливі методи хемілюмінесцентного визначення Cu(II), Ni(II), Cr(VI), Mn(II), аскорбінової кислоти, пероксимоносульфату і пероксидисульфату, непрямого фотометричного визначення третинних амінів, кінетичний метод визначення Mn(II). Методи апробовані в аналізі природних вод, фармпрепаратів, хімреактивів.
Ключові слова: хемілюмінесценція, метилсульфат 9,10-диметилакридинію, люмінол, пероксимоносульфат калію.
Метилсульфат 9,10-диметилакридинію (МСДМА) і пероксимоносульфат калію синтезували за методиками, описаними в [1]. Одержаний препарат МСДМА ідентифікували спектрофотометрично: УФ-спектр (розчин МСДМА в 10% CH3COOH), як і ІЧ-спектр цього реагенту (таблетки з KBr) добре узгоджуються з відомими в літературі [1]. Інтенсивність хемілюмінесценції (ХЛ) вимірювали як описано в [2]. Спектри (ХЛ) та флуоресценції (ФЛ) реєстрували пристроєм з монохроматором МДР-2, фотопомножувачем ФЭУ-39А, підсилювачем постійного струму В2-11 і самописцем Н306.
Останнім часом все більше цікавляться пероксидними сполуками як окиснювачами в різних методах аналізу. Це, зокрема, належить до аліфатичних пероксикислот, можливості використання яких в аналізі наведено в [3]. Що до застосування в аналізі неорганічних пероксикислот, наприклад, перокси-оносульфатної (H2SO5, ПМСК, кислота Каро), то в літературі є повідомлення, що стосуються лише аналізу сумішей, які містять ПМСК, гідроген пероксид і пероксидисульфат [4,5].
Використанню ПМСК в аналізі сприяє те, що вона порівняно з пероксиди-сульфатом та аліфатичними пероксикислотами у водних розчинах характеризується
| 108 | В. Зінчук, О. Мицук, О. Стаднічук |
досить високою стабільністю і вищою окиснювальною здатністю [4,6].
У цій статті узагальнено результати застосування ПМСК в аналізі. Можливість такого застосування вимагало попереднього дослідження властивостей розведених (10-4-10-6 М) водних розчинів ПМСК, зокрема кінетики її розкладання.
Для вимірювання швидкості реакції розкладання використовували йодометричний метод у титриметричному та фотометричному (за поглинанням розчинів
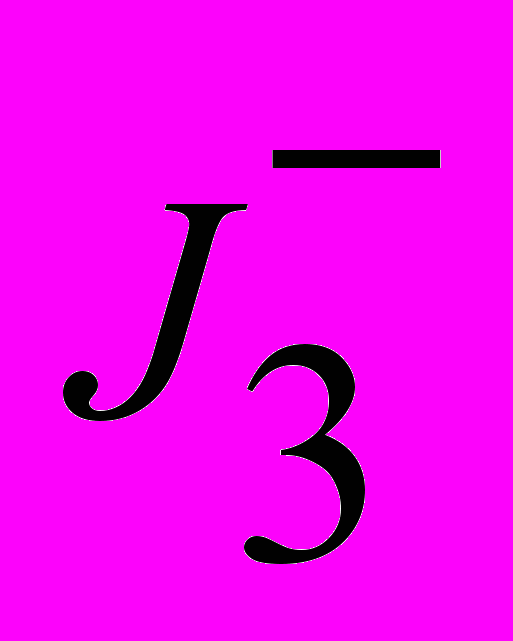
 при =360 нм) варіантах.
при =360 нм) варіантах.Відомо [7], що в нейтральному та слабколужному середовищі ПМСК повільно розкладається за іонним механізмом, згідно з яким активний проміжний комплекс утворюється внаслідок нуклеофільної атаки аніона SO52- на атом Оксигену пероксигрупи аніону HSO5- . Інтермедіат при взаємодії з іонами ОН- розкладається на SO42- і О2:
| ОН– | (1) |
| SO52- + HSO52- [HSO62-] + SO42- 2SO42- + O2 + H2O |
Іонний механізм розкладання ПМСК узгоджується з залежністю швидкості від рН: вона максимальна при рН 9.2-9.3, що відповідає значенню рКа аніонної кислоти HSO5- . До підтвердження такого механізму розкладання ПМСК автори дійшли в пізніших працях, застосовуючи мічені атоми [8].
У лужному середовищі реакція розкладання описується кінетичним рівнянням [7]

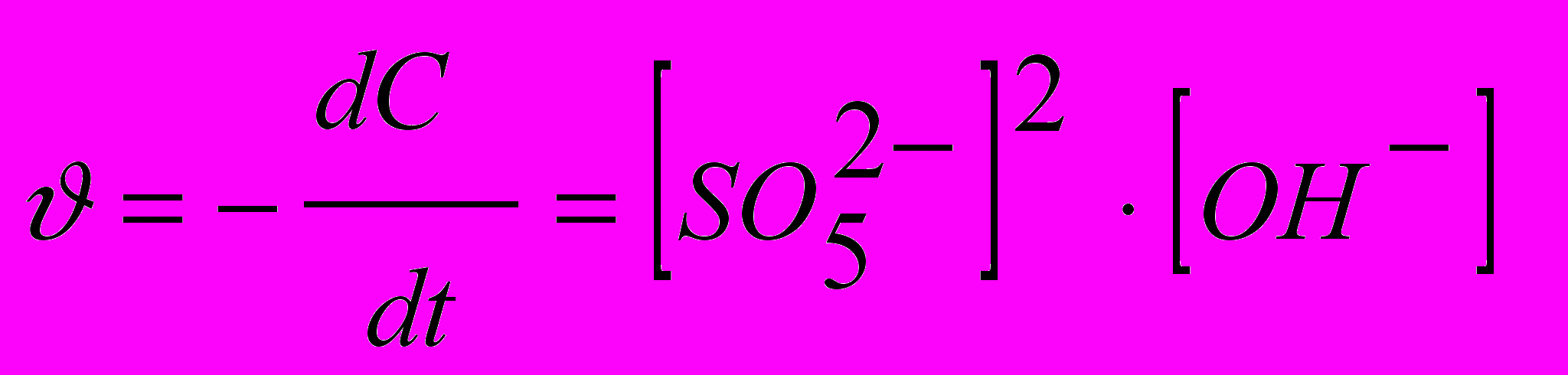 .
.Крім реакції розкладання ПМСК з виділенням оксигену (реакція 1), в кислому середовищі відбувається її протоліз (реакція 2)
| H2SO5 + H2O = H2O2 + H2SO4 | (2) |
З’ясовано [10], що при кімнатній температурі в середовищі 8М H2SO4 протоліз відбувається в незначній мірі, а частина ПМСК, що зазнала протолізу, відповідає концентрації H2O2, який утворився. Помітний протоліз ПМСК відбувається при вищих концентраціях H2SO4 і посилюється з підвищенням температури.
У працях [8, 10, 11, 12, 13] вивчали вплив іонів Co(II), V(IV,V), Mn(II), Ce(III, IV) на швидкість розкладання ПМСК у кислому середовищі і механізм реакцій. Проте в цих працях не розглядали можливості використання цих реакцій в практиці аналізу. Розчини ПМСК з рН 2-4 при кімнатній температурі, на відміну від пероксидисульфату й аліфатичних пероксикислот, стабільні практично упродовж декількох місяців [14], що важливо для використання їх в аналізі.
На відміну від аліфатичних пероксикислот, ПМСК у лужному середовищі практично не протолізує, тобто в такому розчині немає Н2О2 як продукту реакції. Це сприяє використанню ПМСК у нейтральному, слабколужному чи лужному середовищі, де вона є єдиним окиснювачем. Відсутність Н2О2 в лужному розчині ПМСК, а також вища, ніж у Н2О2 окиснювальна здатність стосовно хемілюмінесцентних реагентів – метилсульфату 9,10-диметилакридинію (МСДМА) і гідразиду 3-аміно-
| ВЛАСТИВОСТІ ПЕРОКСИМОНОСУЛЬФАТНОЇ КИСЛОТИ ... | 109 |
фталевої кислоти (люмінолу, H2L) використані для розроблення високочутливих методів хемілюмінесцентного визначення ПМСК [16, 17] з нижньою межею визначуваних вмістів (Сн) 14 и 6 нг/мл відповідно. Визначенню ПМСК з МСДМА не заважають шістдесятикратні надлишки Н2О2 і п’ятсоткратні S2O82-, а з H2L - 10 та стократні відповідно.
У лужному середовищі розкладання ПМСК помітно каталізують Cu(II), Ni(II), змінюючи ступінь окиснення Cu(II)Cu(III), Ni(II) Ni(III,IV). Значення вищих ступенів окиснення Купруму та Ніколу ми оцінили титриметричним і фотометричним методами на основі перетворень у системах Ni(II), (Cu(II)) - ПМСК - NaOH [10]. В умовах надлишку ПМСК (стократний стосовно Cu(II), Ni(II) в середовищі 0.2 М NaOH) досягається практично повне перетворення Cu(II) в Cu(OH)4- з чіткою смугою поглинання при max= 360 нм та Ni(II) в Ni(III,IV) - широкою смугою в межах 350-400 нм, яка є характерною для гідролізованих форм Ніколу вищих ступенів окиснення. Ці форми Cu і Ni малоактивні в реакції розкладання ПМСК і є кінцевими продуктами практично повного окиснення Ni(II), Cu(II). На основі їхніх хімічних і спектрофотометричних характеристик показана можливість кількісного визначення Cu(III) в присутності Cu(II) і Ni(III,IV) в присутності Ni(II) [16].
Зазначимо невисоку каталітичну активність Cu(II) і Ni(II) в реакції разкладання ПМСК, про що свідчить розраховане значення кількості циклів каталізатора, яке не перевищує 1.0 хв-1 і зменшується зі збільшенням концентрацій металу і ОН--іонів. Це зумовлено тим, що стадія відновлення каталізатора у вищому ступені окиснення конкурує з протолізом, внаслідок чого каталізатор дезактивується і виводиться зі сфери каталізу. Незважаючи на це, Cu(II) и Ni(II) суттєво збільшують світіння в реакції ПМСК з МСДМА і H2L. На підставі літературних і одержаних даних можна припустити, що в момент змішування розчинів Cu(II) чи Ni(II) в лужному середовищі з розчином ПМСК утворюються проміжні активні пероксидні сполуки сильніші окиснювачі за ПМСК. Утворенню такої сполуки Купруму, яка, ймовірно, містить пероксимоносульфатну групу (чи групи) сприяє ефективне перенесення заряду з d-орбіталі катіону Cu(II) на розпушуючу р*-орбіталь пероксидної групи ПМСК. Порівняно з Н2О2 та пероксидисульфатом, які в умовах досліду з Cu(II) не утворюють подібних сполук, ПМСК завдяки поляризації -О-О- зв’язку та нижчої енергії вакантної молекулярної орбіталі здатна до утворення пероксидів. Перенесення заряду від Cu(II) дестабілізує пероксимоносульфат-іон, який входить до складу лабільного комплексу та забезпечує не тільки високу окиснювальну здатність, а й підвищену швидкість розкладання. Якщо в розчині є хемілюмінесцентний реагент МСДМА чи H2L, то збільшується не тільки швидкість їх окиснення, а й проміжна пероксидна група внаслідок розкладання генерує проміжні активні форми Оксигену, наприклад, радикали О2.-, які збільшують квантовий вихід ХЛ [18]. Непрямим доказом участі таких радикалів в реакції з H2L є гасіння світіння під впливом OsO4, іонолу та аскорбінової кислоти.
Каталітичний вплив Cu(II) і Ni(II) на ХЛ в реакції ПМСК з H2L використано для розроблення високочутливих методів визначення Cu(II) і Ni(II) в природних водах без попереднього їх відокремлення та концентрування; Сн. для Cu(II) становить 0.6 нг/мл,
| 110 | В. Зінчук, О. Мицук, О. Стаднічук |
Ni(II) - 2.3 нг/мл. Органічні компоненти природних вод руйнують концентрованою HNO3, якою обробляють сухий залишок після випаровування проби води [19].
У реакції з МСДМА (I) проміжні пероксидні сполуки Купруму чи Ніколу окиснюють карбінол (II), який утворюється в лужному середовищі за схемою
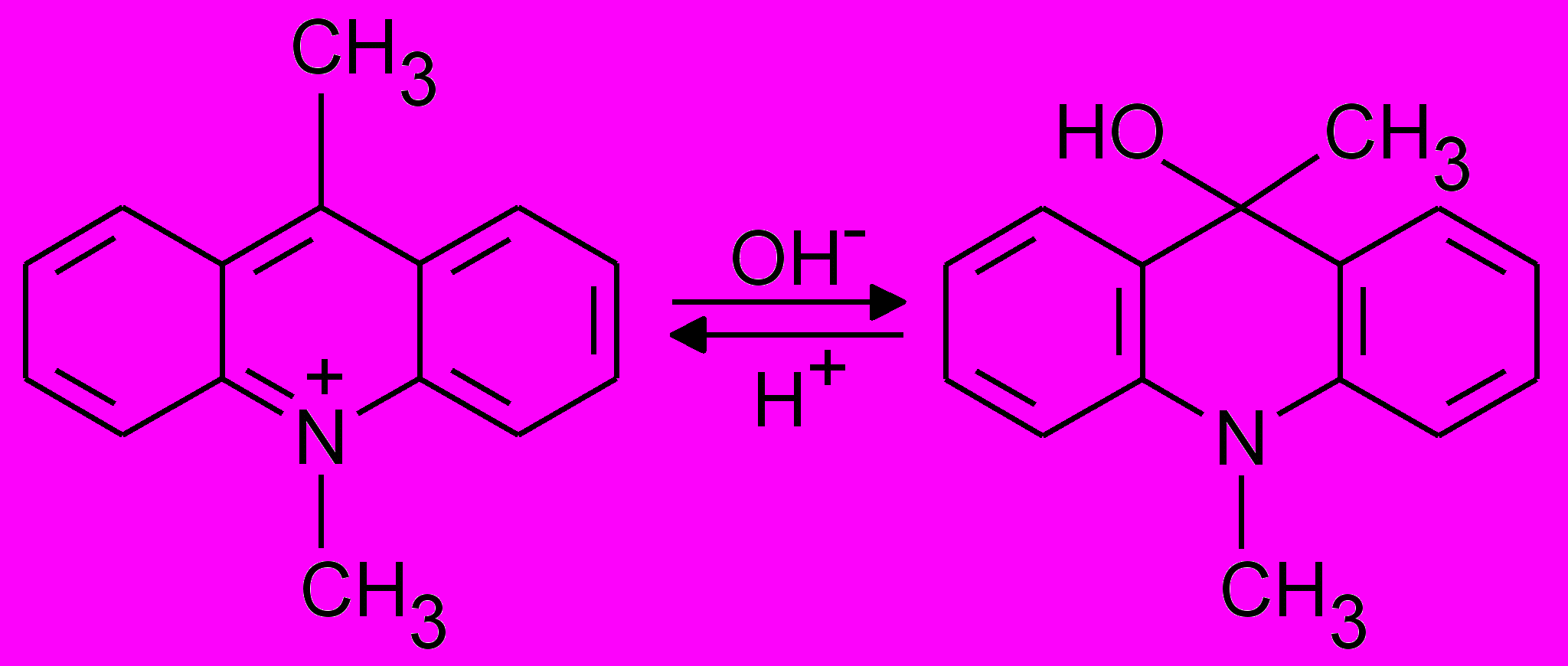 | |
| (I) | (II) |
Окиснення супроводжується інтенсивною хемілюмінесценцією. Реакція застосована для визначення домішок Cu(II) в Na2WO4·2H2O і Na2MoO4·2H2O без попереднього концентрування Купруму з Сн. 3.0·10-6 % і 1.0·10-5 % відповідно [21].
Каталітичний вплив Ni(II) на хемілюмінесценцію збільшується в присутності диметилгліоксиму (H2Dm), причому найбільшого ефекту можна досягнути в момент утворення червоної розчинної сполуки Ніколу з H2Dm. Хоча швидкість розкладання ПМСК у цьому випадку не змінюється, а швидкість окиснення карбінолу (II) навіть дещо зменшується, можна припустити, що H2Dm сприяє утворенню та стабілізації проміжної пероксидної сполуки [21]. Запропонований також хемілюмінесцентний метод визначення Ni(II) з Сн.=3.0 нг/мл. Визначенню Ni(II) заважають Co(II), Cu(II), Mn(II), Fe(III), Pb(II), Cd(II) у сумірних з Ni(II) концентраціях. Не заважають іони лужних металів, Cl-, SO42-, NO3-, F- , великі кількості Al3+ , MоО42-, PO43-, B4O72-, C2O42- [22].
Перетворення в системі Ni(II)-H2Dm-H2SO5 в слабколужному середовищі аналогічні до тих, де окиснювачем є аліфатична пероксикислота [22], внаслідок чого утворюється розчинна у воді червона сполука, природа якої до кінця не з’ясована. Швидкість утворення і вихід цієї сполуки в реакції з ПМСК максимальні при рН 9.0-9.5, тобто в оптимальних для розкладання ПМСК умовах. На відміну від аліфатичних дипероксикислот, червона сполука в цих умовах утворюється швидше, а 470=1,4104 л моль см-1, який дещо більший, ніж у випадку використання інших окиснювачів (аліфатичні пероксикислоти, пероксидисульфат, йод). Зміна 470 залежно від природи окиснювача свідчить про складність процесу утворення червоної сполуки. Ми припускаємо, що вона містить Нікол у змішаних ступенях окиснення. Сполука, яку одержують за допомогою ПМСК, стабільна в часі, особливо в лужному середовищі, де вона не розкладається навіть у присутності комплексону III. Для використання цієї сполуки в аналізі важливим є те, що вихід її не залежить від послідовності змішування компонентів реакції. Реакцію покладено в основу методики фотометричного визначення Ni(II) з Сн.=0.04 мкг/мл, яку використано для визначення Ni(II) в природних водах після концентрування його співосадженням на Mg(OH)2 [23].
| ВЛАСТИВОСТІ ПЕРОКСИМОНОСУЛЬФАТНОЇ КИСЛОТИ ... | 111 |
У кислому середовищі світіння в системі МСДМА-ПМСК підсилює Cr(VI), активність якого пояснюється утворенням пероксихромату – проміжного продукту Cr(VI) з H2O2, який накопичується в реакції протолізу ПМСК. Проміжний пероксихромат активніше окиснює катіон МСДМА до 10-метил-9-карбокси-кридинію, який надалі окиснюється пероксимоносульфатною кислотою до кінцевого продукту 10-метилакридону – випромінювача в хемілюмінесцентній реакції. Запро-понована методика визначення Cr(VI) в присутності Cr(III) і надлишку сторонніх іонів - Fe3+, Co2+, Cu2+, Mn2, Zn2+, Al3+, NH4+, NO3-, PO43- [24]. Методика застосована для визначення загального вмісту хрому в природних водах з Сн.=0.025 мкг/мл після попередньої мінералізації проби, відгонки хлоридів і окиснення Cr(III) до Cr(VI).
На відміну від Cu(II) і Ni(II) прості солі Mn(II) неефективні в хемілюмінесцентній реакції ПМСК з H2L. Активність Mn(II) збільшується внаслідок його активування комплексоутворенням з амінами, зокрема триетаноламіном (ТЕА) або сумішами амінів з оксикарбоновими кислотами (так зване подвійне активування) [25]. У лужному середовищі в присутності ТЕА і розчиненого Оксигену Mn(II) перетворюється в зелений комплекс Mn(III)ТЭА, склад якого невизначений. Зауважимо, що сам комплекс у відсутності ПМСК в хемілюмінесцентній реакції неактивний. З іншого боку, комплекс не каталізує розкладання ПМСК [26]. Можна припустити, що активною в хемілюмінесцентній реакції є проміжна форма Mn(IV), яка утворюється при взаємодії Mn(III)ТЕА з ПМСК в лужному середовищі (рН 10.2). Ймовірно, вона внаслідок розкладання здатна генерувати радикали О2.-, які потрібні для перетворення H2L "світловим шляхом" [18]. Світіння інгібують OsO4, аскорбінова кислота. Реакцію активування Mn(II) покладено в основу методики хемілюмінесцентного визначення Mn(II) з Сн.=3 нг/мл, а в присутності оксалату 0.05 нг/мл. Її перевагою є висока селективність (маскування сторонніх іонів надлишком ТЕА) і задовільна точність (5% відносних). Методика перевірена на визначенні Mn у природних водах без попереднього його відокремлення та концентрування, Сн.=0.5 мкг/л [26].
Як зазначалось, аскорбінова кислота гасить світіння в реакції ПМСК з H2L у присутності Mn(III)ТЭА. На кінетичних кривих хемілюмінесценції з’являється індукційний період (затримка світіння), величина якого пропорційна концентрації аскорбінової кислоти. Оскільки в умовах хемілюмінесценції (рН 10.2) аскорбінова кислота повільно та стехіометрично окиснюється ПМСК, а за час реєстрації світіння (0.5-30 с) вона практично не витрачається, то, мабуть, гасіння хемілюмінесценції зумовлено захопленням радикала О2-, що утворюється в реакції розкладання проміжного продукту Mn(III)ТЭА з ПМСК. Вплив аскорбінової кислоти як інгібітора хемілюмінесцентної реакції використано для розроблення методики її визначення у фармацевтичних препаратах з Сн.=18 нг/мл [27]. Методика є однією з найчутливіших, відзначається простою виконання та задовільною точністю (sr 0.10).
Третинні аміни, серед них і ТЕА, окиснюються пероксикислотами, зокрема ПМСК до відповідних N-оксидів
(НOCH2-CH2)3N + H2SO5 = (НOCH2CH2)3NO + H2SO4.
| 112 | В. Зінчук, О. Мицук, О. Стаднічук |
Стехіометрію в реакції ми підтвердили вольтамперометричним методом (за нагромадженням N-оксиду, Е1/2=-1.1В стосовно насиченого каломельного електрода на фоні 0.06 М Na4P2O7) і фотометричним (за залишком ПМСК) методами. З’ясовано, що зміна концентрації ПМСК упродовж певного часу перебігу реакції з ТЕА є еквівалентною концентрації N-оксиду. Взаємодія компонентів описується кінетичним рівнянням другого порядку. В оптимальних умовах (рН 9.2 і 3-кратний надлишок ПМСК стосовно ТЕА, час взаємодії компонентів 30 хв) можливе кількісне визначення ТЕА за залишком ПМСК. Розроблена методика непрямого фотометричного визначення третинних амінів з Сн=110-7 М. Визначенню не заважають первинні та вторинні аміни, великі кількості етанолу, борної кислоти і NaCl. Методику застосовано для визначення ТЕА, димедролу, новокаїну, прозерину. Вона чутливіша за існуючі, відзначається простотою виконання та задовільною точністю: відносна похибка визначення 5-15 мкг ТЕА не перевщує 10%, 5-20 мкг димедролу - 7%, 5-15 мкг прозерину - 5% в 25,0 мл кінцевого об’єму [28].
З наведених даних видно, що ПМСК як окиснювач можна використовувати в титриметричних, фотометричних і хемілюмінесцентних методах визначення малих концентрацій металів, амінів, аскорбінової кислоти, а в перспективі й інших речовин у різних об’єктах.
__________________________
- Захс Є.Р., Лешенюк Н.Г., Эфрос Л.С. Строение продуктов взаимодействия 9.10-диметилакридиния с ароматическими о-оксиальдегидами // Химия гетероцикл. соед. 1973. №4.С.539-544.
- Пацай І., Гута О., Дудчак Л. Хемілюмінесцентна реакція нітрату 9-ціано-10-метилакридинію з цистеїном // Вісн. Львів. ун-ту. Сер. хім. 2000. Вип. 39. С.209-212.
- Зінчук В., Скоробагатий Я. Застосування пероксикарбонових кислот в аналітичній хімії // Праці НТШ. 1997. Т.1. С.241.
- Перекись водорода и перекисные соединения // Под ред. Позина М.Е. М., 1951. 475 с.
- Бусев А.И., Симонова Л.Н. Аналитическая химия серы. М., 1975. 190 с.
- Edwards O., Gallopo A Kinetics and Mechanism of the oxydation of Pyrydine by Caro’s acid catalyzed by ketones // J. Org. Chem. 1981. Vol.46. P.1684.
- Goodman J.F, Robson P. The kinetic and mechanism of the decomposition of Caro’s acid// J. Chem.Soc. 1963. Vol.5. P.2871.
- Zhang Z., Edwards O. The cerium (IV) induced decomposition of peroxymonosulfate
// Inorg. Chem. 1992. Vol.31. P.3514.
- Ball D., Edwards J.O. Decomposition of inorganic peroxyacids in aqueous alkali // J. Phys. Chem.1958. Vol.62. P. 343.
- Мицук О.А. Хемілюмінесцентні реакції метилсульфату 9,10-диметилакридинію з пероксимоносульфатом калію та дипероксіадипіновою кислотою в присутності Cu(II), Ni(II), V(IV,V), Cr(VI): Дис….канд. хім.наук. К., 1999. 183 с.
| ВЛАСТИВОСТІ ПЕРОКСИМОНОСУЛЬФАТНОЇ КИСЛОТИ ... | 113 |
- Kim J., Edwards J. A study of cobalt catalysis and copper modification in the coupled decomposition of hydrogen peroxide and peroxomonosulfate ion // Inorg. Chim. Acta. 1995. Vol.235. P.9.
- Луненок-Бурмакина В.А., Грищенко Л.И., Емельянов В.Б. Изучение механизма ракции пероксимоносульфатной кислоты с ионами марганца(II) // Журн. физ.химии. 1977. Т.51. С.840
- March C., Zhang Z., Edwards J.O. Chain-lehgs in the decomposition of peroxomonosulfate catalyzed by cobalt and vanadium // Aust. J. Chem. 1990. Vol.43. P.321.
- Пилипчук О.А., Зінчук В.К., СушинцеваН.М., Василечко В.О. Дослідження стабільності розведених розчинів кислоти Каро // Укр. хим. журн. 1996. Т. 62. N 2. С.122.
- Пилипчук Е.А., Зинчук В.К., Василечко В.О. Хемилюминесцентное определение пероксимоносульфата и пероксидисульфата при их совместном присутствии
// Заводская лаборатория. 1996. Т. 62. N 11. С. 31-32.
- Стаднічук О.М. Пероксимоносульфатна кислота-окиснювач люмінолу: Дис….канд. хім.наук. К., 2000.
- Мирошниченко А.С., Луненок-Бурмакина В.А. Квантово-механический расчет перекиси водорода и пероксосерных кислот // Неорганические перекисные соединения. 1985. С. 72.
- Калиниченко И.Е., Ткачук Т.М., Пилипенко А.Т. Применение в хемилюминесцентном анализе реакции люминола с гексацианоферратом (III) и неорганическими ингибиторами // Журн. аналит. химии. 1985.Т. 40. N 9. С. 1581.
- Стадничук Е.Н., Зинчук В.К., Тарас О.Б., Веселовская О.О. Хемилюминесцентное определение меди и никеля в природных водах // Химия и технология воды. 1998. Т. 20. N 5. С. 472.
- Пилипчук Е.А., Зинчук В.К., Василечко В.О. Хемилюминесцентный метод определения примесей меди в солях Mo(VI) и W(VI) // Заводская лаборатория. 1996. Т. 62. N 2. С. 26.
- Мицук О.А., Зінчук В.К., Василечко В.О. Хемілюмінесцентна реакція метилсульфату 9,10-диметилакридинію з кислотою Каро в присутності іонів Ni(II) // Вісн. Львів. Ун-ту. Сер. Хім. 1996. Вип. 36. С. 82.
- Зинчук В.К., Медведык Л.П., Крутень Н.К. Взаимодействие ионов никеля с диметилглиоксимом в присутствии алифатических дипероксикислот
// Укр. хим. журн. 1993. Т. 63. N 10. С. 1019.
- Зинчук В.К., Федько Л.И. Фотометрическое определение никеля (II) в природных водах // Заводская лаборатория. 1997. Т. 63. N 10. С. 12
- Мыцук Е.А., Зинчук В.К., Гута А.М., Василечко В.О. Хемилюминесцентное определение меди и хрома в природных водах // Химия и технология воды. 1999. Т. 21. N 2. С. 169.
- Калиниченко И.Е. Активирование солей марганца в хемилюминесцентной реакции люминола с перекисью водорода // Укр. хим. журн. 1968. Т. 34. N 3. С. 307.
| 114 | В. Зінчук, О. Мицук, О. Стаднічук |
- Зинчук В.К., Ковальчук Е.Н. Хемилюминесцентное определение марганца в природных водах // Химия и технология воды. 1997. Т.19. N 3. С.265.
- Стадничук Е.Н., Зинчук В.К. Хемилюминесцентное определение аскорбиновой кислоты в фармпрепаратах // Заводская лаборатория. 2001. Т.67. N1. С.18.
- Стадничук Е.Н., Зинчук В.К. Фотометрическая методика определения индивидуальных третичных аминов в лекарственных преператах // Заводская лабораторя. 1998. Т.64. N9. С.16.
THE PROPERTIES AND USING OF PEROXOMONOSULFATE
ACID IN ANALYSIS
V. Zinchouk, O. Mytsuk, O. Stadnichouk,
Ivan Franko National University of Lviv,
Kyryla & Mefodiya Str. 6, UA-79005, L'viv, Ukraine
The possibility of using of potassium peroxomonosulfate in analysis have been shown. On base of these reactions a new chemiluminescence techniques of Cu(II), Ni(II), Cr(VI), Mn(II), potassium peroxomonosulfate and potassium peroxodisulfate have been elaboreted.
Key words: chemiluminescence, methosulfate 9,10-dimethylacridinium, potassium peroxomonosulfate, luminol.
Стаття надійшла до редколегії 27.10.2003
Прийнята до друку 15.01.2004
1© Зінчук В., Мицук О., Стаднічук О., 2004
