Методическое руководство к выполнению практических заданий всероссийских олимпиал школьников по биологии Физиология растений
| Вид материала | Руководство |
- Рабочая программа дисциплины «физиология» (физиология растений) Код дисциплины по учебному, 269.31kb.
- Регенерационная активность разных генотипов пшеницы и эгилопса в культуре in vitro, 499.46kb.
- «Физиология растений», 308.24kb.
- Положение о конкурсе на разработку эмблемы Всероссийских спортивных соревнований школьников, 94.89kb.
- Методические указания по выполнению практических заданий и организации самостоятельной, 1154.96kb.
- Культура столонов и регуляция роста растений и клубнеобразования у картофеля in vitro, 342.87kb.
- Методическое руководство по выполнению дипломного проекта для студентов специальности, 278.61kb.
- Методические указания домашняя контрольная работа №1 по дисциплине «Налогообложение, 681.22kb.
- Методические рекомендации о проведении в 2011-2012 годах школьного и муниципального, 220.71kb.
- Указа Президента Российской Федерации от 30 июля 2010 г. N 948 "О проведении всероссийских, 117.55kb.
Ганчарова О.С., Куравский М.Л.
М
 етодическое руководство к выполнению практических заданий всероссийских олимпиал школьников по биологии
етодическое руководство к выполнению практических заданий всероссийских олимпиал школьников по биологииФизиология растений
Задания по физиологии растений, как правило, попадаются на практическом туре 10-11-м классам. Обычно предлагают работы, связанные с осмотическими явлениями в растительных клетках (плазмолиз и деплазмолиз), работой устьиц или разделением фотосинтетических пигментов методом хроматографии.
Осмотические явления в растительной клетке. Плазмолиз
Осмос и осмотические явления. Осмотическое давление
Все биологические мембраны представляют собой полупроницаемые мембраны, так как в силу своей структуры они пропускают одни вещества (воду, газы), а другие (крупные заряженные молекулы, к примеру, глюкозу) – нет. На самом деле, конечно, в мембране клетки есть переносчики для глюкозы, но они строго регулируются и не позволяют веществу проходить в клетку бесконтрольно; то же самое можно сказать про каналы для ионов. Избирательность транспорта веществ через мембрану считается одним из признаков жизни на клеточном уровне. Мертвая клетка не контролирует поступление и веществ внутрь себя и выведение веществ наружу. Тем не менее, из-за липидной природы даже мембрана мертвой клетки остается полупроницаемой, хотя и менее «избирательной», чем мембрана живой.
Избирательность транспорта через проницаемую мембрану ведет к возникновению в клетке осмотических явлений. Осмотическими называют явления, происходящие в системе, состоящей из двух растворов, разделенных полупроницаемой мембраной. В растительной клетке роль полупроницаемых пленок выполняют: плазмалемма – мембрана, разделяющая цитоплазму и внеклеточную среду, и тонопласт – мембрана, разделяющая цитоплазму и клеточный сок, представляющий собой содержимое вакуоли растительной клетки.
Осмосом называют диффузию воды через полупроницаемую мембрану из раствора с низкой концентрацией растворенного вещества в раствор с высокой концентрацией растворенного вещества. Явление осмоса может быть продемонстрировано на классическом примере. Представим сосуд, разделенный на две части полупроницаемой мембраной, в одной половине сосуда находится более концентрированный раствор соли (к примеру, 1M NaCl), в другой – менее концентрированный (0,01 M NaCl). В начале опыта (рис. 12A) объем раствора в каждой из половин одинаков, а концентрация соли различается.
Р
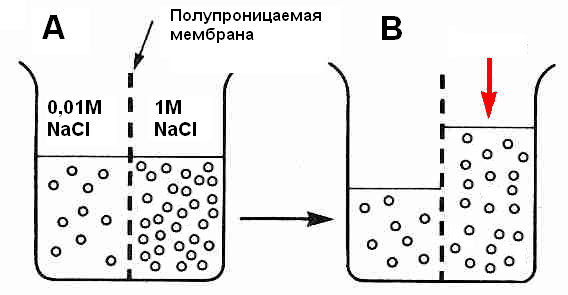
ис. 12. Схема, демонстрирующая явление осмоса
Ионы Na+ и Cl-, на которые соль, будучи сильным электролитом, распадается сразу после попадания в раствор, не могут пройти через мембрану, в отличие от молекул воды. Неверно думать, что вода из отсека с большей концентрацией соли не переходит в отсек с меньшей концентрацией. Вода идет через мембрану в обе стороны, но интенсивность перехода разная. Известно, что ионы в воде гидратированы – покрыты гидратной «шубой». Вода распадается на ионы H+ и OH- которые электростатически связываются с ионами хлора и натрия, соответственно. Так как в «правой» половине сосуда (см. рис. 12) концентрация Na+ и Cl- больше, соответственно больше воды требуется для гидратирования этих ионов. В связи с этим вода интенсивнее переходит из отсека с малой концентрацией соли в отсек с большой концентрацией. Поскольку вода будет перетекать из разбавленного раствора в концентрированный быстрее, чем в обратном направлении, в целом движение воды между двумя растворами будет идти в одну сторону. В результате уровень раствора в первом понижается, а в последнем повышается; концентрация соли в отсеках выравнивается (рис 12B). Заметим, что изменение объема жидкости и концентрации соли связано с перераспределением только молекул воды, но не соли, так как мембрана непроницаема для ионов натрия и хлора.
Если приложить к столбу жидкости в отсеке с большей начальной концентрацией соли давление (красная стрелка на рисунке 12B), диффузия воды замедлится. Давление, при котором диффузия жидкости прекращается, называется осмотическим давлением. Описанным образом осмотическое давление измеряется для раствора, к которому прикладывается давление (то есть в описанном примере измерено осмотическое давление раствора с большей начальной концентрацией соли). Осмотическое давление – очень важная величина, характеризующая осмос. В физической химии осмотическое давление обозначается буквой π и вычисляется по простой формуле:
π = CRT,
где C – концентрация раствора, R – универсальная газовая постоянная (8,314
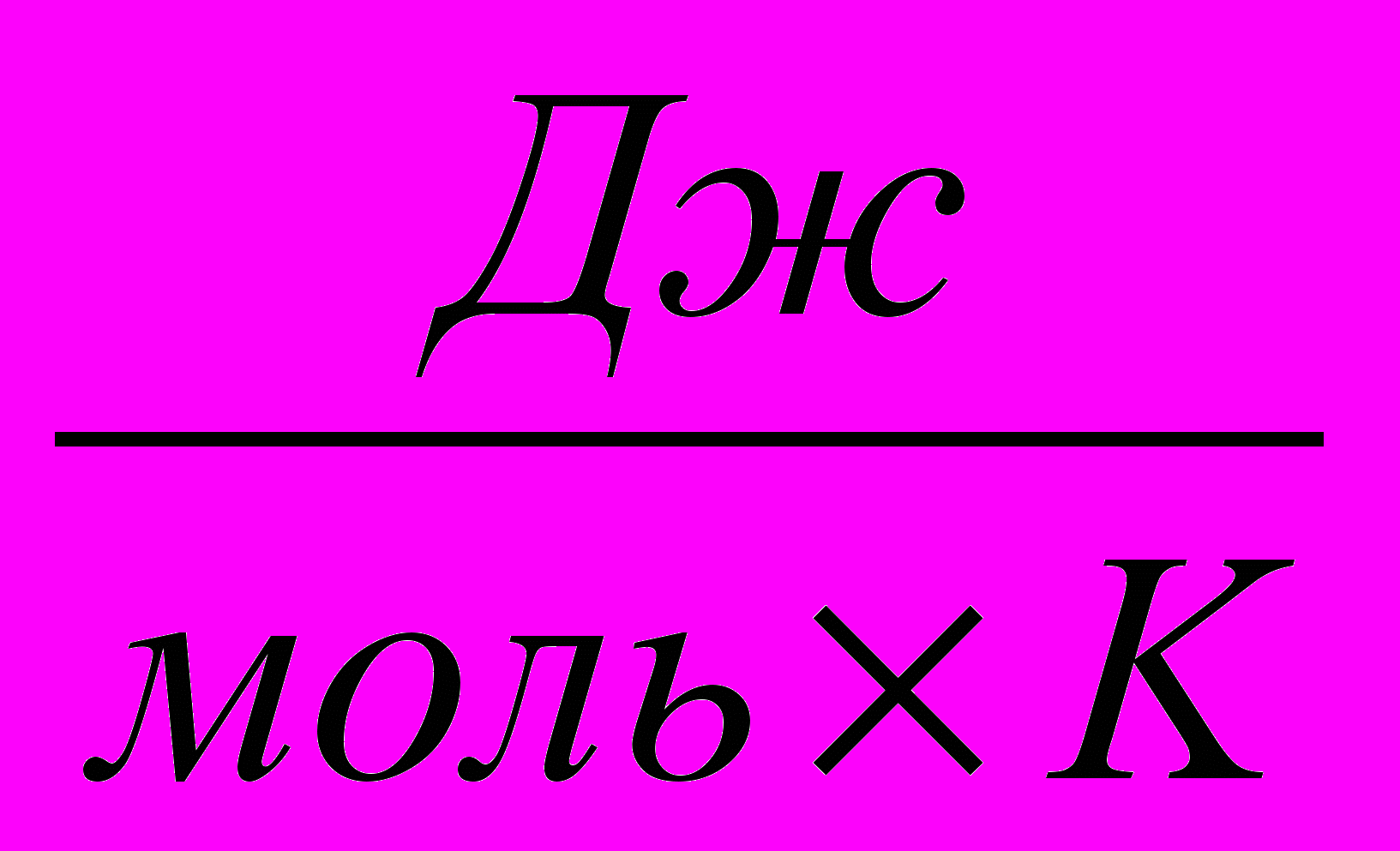 ), T – абсолютная температура (K). Попробуем проанализировать это выражение. R – просто постоянная величина, константа, которая никак не влияет на осмотическое давление. Температуру тоже можно принять за постоянную величину, поскольку мы рассматриваем живые системы, которые существуют в узком температурном диапазоне (мы не будем принимать во внимание бактерий-экстремальных термофилов). Следовательно, по большому счету, осмотическое давление раствора зависит только от его концентрации, причем зависимость линейная: чем больше концентрация соли (или сахара, или другого вещества, не проходящего через полупроницаемую мембрану – осмотически активного вещества) в растворе, тем больше его осмотическое давление. В нашем случае осмотическое давление раствора поваренной соли с концентрацией 0,01M гораздо меньше, чем осмотическое давление раствора с концентрацией 1M.
), T – абсолютная температура (K). Попробуем проанализировать это выражение. R – просто постоянная величина, константа, которая никак не влияет на осмотическое давление. Температуру тоже можно принять за постоянную величину, поскольку мы рассматриваем живые системы, которые существуют в узком температурном диапазоне (мы не будем принимать во внимание бактерий-экстремальных термофилов). Следовательно, по большому счету, осмотическое давление раствора зависит только от его концентрации, причем зависимость линейная: чем больше концентрация соли (или сахара, или другого вещества, не проходящего через полупроницаемую мембрану – осмотически активного вещества) в растворе, тем больше его осмотическое давление. В нашем случае осмотическое давление раствора поваренной соли с концентрацией 0,01M гораздо меньше, чем осмотическое давление раствора с концентрацией 1M. Обычно при описании живых систем, биологических жидкостей и других растворов не указывают значение осмотического давления, пользуясь относительной характеристикой. Принято описывать осмотическое давление растворов относительно интересующей нас жидкости (к примеру, крови, цитоплазмы, клеточного сока). Если осмотическое давление раствора больше, чем давление «нашей» жидкости, раствор называют гипертоническим; если меньше – гипотоническим, если такое же – изотоническим. В этом определении слова «осмотическое давление» смело можно заменить на «концентрация осмотически активного вещества», так как мы уже выяснили, что осмотическое давление раствора зависит от концентрации линейно. В приведенном выше примере раствор с концентрацией 0,01M NaCl является гипотоническим по отношению к раствору с концентрацией 1M NaCl. Широко используемый в медицинской практике физиологический раствор, является изотоническим по отношению к плазме крови. Концентрация солей в физиологическом растворе и плазме крови одинакова, а значит, одинаково и осмотическое давление. Заметим, что существует несколько типов физиологических растворов с одинаковым осмотическим давлением и немного отличающимся составом солей – растворы Рингера – Локка, Рингера – Тироде и Кребса – Рингера.
Осмотическое давление жидкостей живых организмов может быть очень значительным. К примеру, осмотическое давление жидкостей человеческого тела в среднем равно семи (!) атмосферам. Именно за счет осмотического давления вода из корней деревьев доходит до листьев.
Если приложить к столбу жидкости в указанном отсеке сосуда давление, большее осмотического, процесс осмоса «пойдет вспять» - начнется переход растворителя из отсека с большей концентрацией соли в отсек с меньшей концентрацией соли. Это явление носит название обратного осмоса. Обратный осмос находит широкое применение в производстве фильтров для очистки питьевой воды.
Тургор растительной клетки
Если взять клетки животных, например, эритроциты, и поместить их в физиологический раствор, морфология клеток не изменится, так как физиологический раствор изотоничен плазме крови (содержит физиологическое количество солей). Если же поместить эритроциты в гипертонический раствор, например, в раствор с концентрацией соли 10%, вода по закону осмоса будет выходить из цитоплазмы (как из жидкости с меньшей концентрацией соли) в окружающий раствор, в результате чего эритроциты сморщатся. При помещении эритроцитов в гипотоническую среду (дистиллированную воду), вода будет проникать внутрь клеток, «стараясь» уравновесить концентрации солей внутри и вне клетки. В конце концов, эритроциты лопнут, их содержимое высвободится в воду, превратив содержимое пробирки в так называемую «лаковую кровь» - прозрачную красную жидкость. Этот известный эксперимент показывает, что клетки животных не окружены плотной оболочкой и вынуждены существовать в очень ограниченном диапазоне концентраций солей. Клетки пресноводных простейших, не обладающих достаточно плотной оболочкой (амебы, инфузории) справляются с проблемой переизбытка воды с помощью сократительных вакуолей, постоянно «вычерпывающих» лишнюю воду за пределы клетки.
Если поместить взрослые клетки растений (в составе ткани, к примеру, эпидермиса) в гипотонические условия, они не лопнут, поскольку каждая клетка растения окружена более или менее толстой клеточной стенкой. Последняя служит ригидной структурой, не позволяющей притекающей воде разорвать клетку. Если бы клеточная стенка и плазматическая мембрана клетки могли растягиваться, вода входила бы в клетку до тех пор, пока концентрация осмотически активных веществ снаружи и внутри клетки не выровнялась бы. В реальности клеточная стенка – прочная нерастяжимая структура, и в гипотонических условиях входящая в клетку вода давит на клеточную стенку, плотно прижимая к ней плазмалемму. Давление протопласта изнутри на клеточную стенку называется тургорным давлением. Говорят, что клетки растений обладают тургесцентностью. Тургорное давление препятствует дальнейшему поступлению воды в клетку. Состояние внутреннего напряжения клетки, обусловленное высоким содержанием воды и развивающимся давлением содержимого клетки на ее оболочку носит название тургора.
Заметим, что клетки растений обычно находятся в гипотонических условиях, поскольку содержимое растительной клетки богато осмотически активными веществами, большая часть которых (органические кислоты, сахара, солей, низкомолекулярных пигментов) входят в состав клеточного сока, расположенного внутри вакуоли. Вакуоли – органеллы, присущие растительным клеткам. Мембрана, ограничивающая вакуоль, называется тонопластом, и по своим свойствам сходна с плазмалеммой. Это мембрана, обладающая избирательной проницаемостью и способностью к активному транспорту. Осмотически активные вещества с целью запасения или утилизации переносятся в вакуоль с помощью белков-каналов и переносчиков, обратно эти вещества в большинстве своем не выходят. Таким образом, с помощью избирательного активного транспорта в клетке создается градиент осмолярности – клеточный сок гипертоничен по отношению к цитоплазме, а цитоплазма гипертонична по отношению к окружающей среде. Вода извне поступает в клетку, «стремясь» уравнять концентрации осмотически активных веществ, давит на клеточную стенку изнутри, обеспечивая тургор.
Тургор – показатель оводненности и состояния водного режима растений. Снижением тургора сопровождаются процессы, увядания и старения клеток. Именно за счет тургора органы растений находятся в выпрямлено, упругом состоянии. Увядание растения – не что иное, как понижение тургорного давления его клеток.
Неверно думать, что тургесцентность свойственна только клеткам растений или бактерий, обладающих клеточной стенкой. Тургор есть и у животных клеток, но он невелик из-за гораздо меньшей прочности плазмалеммы по сравнению с клеточной стенкой (именно из-за наличия тургора, а также из-за эластичности цитоплазматической мембраны, эритроциты в гипотонических условиях разрушаются не сразу, а после некоторого набухания). При разрушении клеточных стенок растительных клеток тургесцентность последних резко падает, и в гипотонических условиях обнаженные протопласты клеток растений ведут себя так же, как клетки млекопитающих.
Плазмолиз. Виды плазмолиза
Под плазмолизом понимается отделение протопласта клетки от оболочки под действием на клетку гипертонического раствора. Плазмолиз характерен главным образом для клеток растений, обладающих жесткой клеточной стенкой. Животные клетки при помещении в гипертонический раствор, как было указано выше, теряя воду, сморщиваются и уменьшаются в размерах. Плазмолиз растительной клетки аналогичен этому процессу, но сморщивание протопласта происходит внутри клеточной стенки. В нормальных условиях плазмалемма растительной клетки плотно прижата к клеточной стенке изнутри под действием тургорного давления. При помещении клетки в раствор, концентрация осмотически активных веществ в котором больше концентрации клеточного сока, то скорость диффузии воды из клеточного сока будет превышать скорость диффузии воды в клетку из окружающего раствора. Вследствие выхода воды из клетки объем клеточного сока сокращается, тургор уменьшается. Уменьшение объема клеточной вакуоли сопровождается отделением цитоплазмы от оболочки. В процессе плазмолиза протопласт теряет воду, уменьшается в размерах и отделяется от клеточной стенки.
Известно, что живые ткани растения в какой-то мере могут быть рассмотрены как симпласты (синцитии), поскольку протопласты соседних клеток сообщаются между собой через плазмодесмы – цитоплазматические нити, располагающиеся в канальцах, пронизывающих клеточную стенку. Плазмодесмы располагаются в клетке группами на месте так называемых первичных поровых полей. Роль плазмодесм заключается в обеспечении передачи раздражений и передвижения веществ от клетки к клетке. Протопласт как бы закреплен на клеточной стенке в местах расположения плазмодесм, поэтому при уменьшении объема клетки в процессе плазмолиза протопласт дольше всего остается прикрепленным к клеточной стенке именно в местах плазмодесм.
Исследование плазмолиза позволяет сделать выводы о проницаемости мембран растительных клеток для различных веществ, о величине нормального тургорного давления. Плазмолиз чаще всего исследуют на препаратах, в которых клетки расположены в один или несколько слоев и удобны для изучения. К таким препаратам можно отнести кожицу лука, листья элодеи, эпидермис листьев высших растений.
В зависимости от вязкости цитоплазмы, от разницы между осмотическим давлением клетки и внешнего раствора, а, следовательно, от скорости и степени потери воды цитоплазмой, различают плазмолиз выпуклый, вогнутый, судорожный и колпачковый.
Изучение форм плазмолиза на препарате листа элодеи
В ходе плазмолиза форма плазмолизированного протопласта меняется. Рассмотрим плазмолиз клетки листа элодеи, помещенного в гипертонический раствор. Для наблюдения плазмолиза нужно сделать временный препарат листа элодеи, для начала поместив лист в воду и накрыв покровным стеклом. Клетки листа следует рассматривать на большом увеличении. Вода – гипотоничная относительно содержимого клетки среда, и пока лист элодеи находится в воде, клетки находятся в состоянии тургора, их протопласт плотно прижат тургорным давлением к клеточной стенке (рис. 8A). При этом на микропрепарате не видно мест, где находятся плазмодесмы (плазмодесмы – объект электронномикроскопического исследования, их средний диаметр составляет 0,3-0,4 нм). Для того чтобы вызвать плазмолиз в клетках, нужно сменить внеклеточную среду на гипертоничную. С этой целью препарат снимают со столика микроскопа, с одного бока покровного стекла, прикрывающего лист элодеи, помещают каплю гипертонического раствора так, чтобы она касалась покровного стекла. С другой стороны стекла аналогично помещают кусочек фильтровальной бумаги. Из-за возникающих капиллярных сил вода, находящаяся под стеклом, впитывается бумагой, втягивая гипертонический раствор под стекло. После замены раствора нужно немного подождать (5 минут), затем наблюдать формы плазмолиза, переходящие одна в другую.
В начале протопласт отстает от клеточной стенки лишь в отдельных местах, чаще всего в уголках. Плазмолиз такой формы называют уголковым (рис. 13Б). Затем протопласт продолжает отставать от клеточных стенок, сохраняя связь с ними в отдельных местах, поверхность протопласта между этими точками имеет вогнутую форму. На этом этапе плазмолиз называют вогнутым (рис. 13В). Места, в которых сохраняется связь протопласта с клеточной стенкой, отражают расположение групп плазмодесм в клетке. Постепенно протопласт отрывается от клеточных стенок по всей поверхности и принимает округлую форму. Такой плазмолиз носит название выпуклого (рис. 13Г). Если у протопласта связь с клеточной стенкой в отдельных местах сохраняется, то при дальнейшем уменьшении объема в ходе плазмолиза протопласт приобретает неправильную форму. Протопласт остается связанным с оболочкой многочисленными нитями Гехта, прикрепляющимися к клеточной стенке в местах расположения групп плазмодесм. Такой плазмолиз носит название судорожного (рис. 13Д).
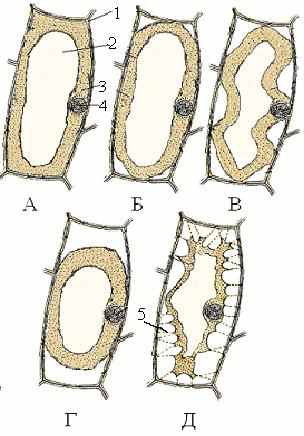
Рис. 13. Плазмолиз растительной клетки: А – клетка в состоянии тургора; Б – уголковый; В – вогнутый; Г – выпуклый; Д – судорожный. 1 - оболочка, 2 - вакуоль, 3 - цитоплазма, 4 - ядро, 5 - нити Гехта.
Приготовить временный препарат кожицы лука, листа элодеи либо эпидермиса листа высшего растения. Вплотную к покровному стеклу нанести на предметное стекло каплю раствора соли - более концентрированного, чем раствор веществ, содержащихся в вакуолях. С другой стороны на предметное стекло вплотную к покровному стеклу положить полоску фильтровальной бумаги, которую нужно держать до тех пор, пока раствор соли не войдет под покровное стекло, заменив воду. Через 5-10 минут обратить внимание на отрыв цитоплазмы от оболочки клеток, т.е. плазмолиз.
Влияние разных агентов, вызывающих плазмолиз, на форму плазмолиза
Форма плазмолиза зависит не только и не столько от стадии процесса (очень редко удается проследить возникновение всех форм плазмолиза на одном и том же препарате), как от свойств цитоплазмы клетки: ее вязкости, гидрофильности, коллоидного состояния (гель или золь). Те или иные свойства цитоплазмы могут быть модулированы агентами, вызывающими плазмолиз.
Задание:
Исследовать влияние ионов натрия и кальция на форму плазмолиза.
Ход работы:
Взять два чистых предметных стекла, капнуть на одно из них 1M KNO3? на другое – 1M Ca(NO3)2, в каждую каплю поместить лист элодеи (или кожицу лука, или препарат эпидермиса листа растения), накрыть покровным стеклом. Через пять-десять минут рассмотреть препараты под микроскопом, сначала на малом, потом на большом увеличении. Найти участки с плазмолизированными клетками, зарисовать клетки в состоянии плазмолиза.
Результат:
В растворе нитрата калия возникает главным образом выпуклый плазмолиз (см. рисунок 13Г), в растворе нитрата кальция – судорожный плазмолиз (см. рисунок 13Д).
Ион калия (очень медленно по сравнению с водой проходящий через мембрану за счет наличия калиевых каналов) уменьшает вязкость цитоплазмы, способствуя ее отделению от клеточной стенки, вследствие чего возникает выпуклый плазмолиз. Ион кальция, напротив, повышает вязкость цитоплазмы, увеличивая силы ее сцепления с клеточной стенкой, что вызывает преимущественно судорожный плазмолиз.
Оба описанных вида плазмолиза обычно предваряются вогнутым плазмолизом.
Исследование колпачкового плазмолиза в раствора роданида калия.
Задание:
Вызвать возникновение колпачкового плазмолиза в клетках растений. Объяснить, в связи с чем возникает указанный тип плазмолиза.
Ход работы:
На чистое предметное стекло капается 1M раствор роданида калия KSCN (или нитрата калия KNO3), в каплю кладется кожица лука или лист элодеи, препарат накрывается покровным стеклом и рассматривается под микроскопом на большом увеличении.
Результат: При длительном нахождении клеток в растворе роданида или нитрата калия (15 мин. и более) цитоплазма набухает, там, где протопласт не касается клеточных стенок, вокруг вакуолей образуются так называемые колпачки цитоплазмы (рис. 14).
Р
 ис. 14. Колпачковый плазмолиз в клетке листа элодеи, длительно находящейся в растворе KNO3. Белым показана вакуоль, ограниченная коричневатыми колпачками цитоплазмы.
ис. 14. Колпачковый плазмолиз в клетке листа элодеи, длительно находящейся в растворе KNO3. Белым показана вакуоль, ограниченная коричневатыми колпачками цитоплазмы.Вывод:
Колпачковый плазмолиз возникает при разной проницаемости плазмалеммы и тонопласта: ионы калия, медленно проникают в цитоплазму через калиевые каналы, вызывая ее набухание. В тонопласте таких каналов не имеется, и поэтому объем вакуоли не увеличивается.
Деплазмолиз
Плазмолизированные клетки обычно остаются живыми, особенно если клетка провела в состоянии плазмолиза короткое время. При помещении живой плазмолизированной клетки в воду или гипотонический раствор происходит деплазмолиз – клетка вернется в состояние тургора и приобретет нормальный вид.
В условиях гипотонического раствора, концентрация осмотических веществ в котором меньше, чем в клеточном соке, вода из внеклеточной среды будет поступать внутрь клетки (а там – внутрь вакуоли, «стараясь» уменьшить концентрацию клеточного сока). В результате увеличения объема вакуоли повысится давление клеточного сока на цитоплазму, которая, в свою очередь, которая начнет приближаться к стенкам клетки, пока не примет первоначальное положение. Деплазмолиз обычно происходит медленнее, чем плазмолиз.
Сравнение проницаемости клеточных мембран для различных веществ
По интенсивности плазмолиза и по времени наступления деплазмолиза можно оценить проницаемость мембраны для тех или иных веществ.
Задание:
исследовать проницаемость мембран растительной клетки для сахарозы и мочевины (карбамида).
Ход работы:
Взять два чистых предметных стекла, на одно капнуть 1M раствор сахарозы, на другое – 1M мочевину, в каждую каплю поместить лист элодеи (или кожицу лука, или препарат эпидермиса листа растения), накрыть покровным стеклом. Через пять минут рассмотреть препараты под микроскопом, сначала на малом, потом на большом увеличении. Найти участки с плазмолизированными клетками, зарисовать клетки в состоянии плазмолиза. Отметить время начала плазмолиза. Оставить препараты на полчаса, затем снова рассмотреть их под микроскопом. Отметить, в каком препарате произошел деплазмолиз, зарисовать клетки из обоих препаратов.
Вывод:
В условиях гипертонического раствора как сахарозы, так и мочевины в клетках возникает плазмолиз, поскольку оба указанных вещества растворимы в воде и осмотически активны. В растворе сахарозы деплазмолиз не возникает, так как плазмалемма непроницаема для крупных молекул сахаров и раствор сахарозы остается гипертоничным относительно содержимого клетки с течением времени. В растворе мочевины по прошествии некого промежутка времени происходит деплазмолиз, так как плазмалемма обладает проницаемостью для мочевины (хотя меньшей, чем для воды, поэтому плазмолиз изначально возникает), и постепенно мочевина проходит в клетку. За ней внутрь клетки следует вода, обеспечивающая тургорное давление – возникает деплазмолиз.
Для сравнительной оценки плазмолиза в тканях существует 2 метода: пограничного плазмолиза и плазмометрический. Первый метод, разработанный Гуго Де Фризом (1884), заключается в погружении тканей в растворы с различной концентрацией осмотичнески активного вещества и установлении той концентрации, при которой плазмолизируется 50% клеток. При плазмометрическом методе после плазмолиза измеряют относительный объем клетки и протопласта и по концентрации раствора вычисляют осмотическое давление клетки (по соответствующим формулам).
Разделение фотосинтетических пигментов методом тонкослойной хроматографии
Задание:
Разделить фотосинтетические пигменты, входящие в состав предложенной вытяжки, методом тонкослойной хроматографии (на бумаге), определить пигменты на полученной хроматограмме.
Что делать:
Провести разделение, следуя предложенной методике. На полученной хроматограмме обвести карандашом и подписать пятна пигментов, отметить линию фронта и вычислить значения Rf. Объяснить полученный результат.
Методика проведения тонкослойной хроматографии (на бумаге)
Полоску хроматографической бумаги шириной 2-3 см и длиной, соответствующей высоте хроматографической камеры, положить на чистую поверхность стола и нанести карандашом линию старта на расстоянии 2 см от края. Аккуратно перенести небольшую порцию вытяжки с помощью шприца или капилляра на линию старта (диаметр пятна на должен превышать 1 см). После полного высыхания повторить процедуру 3-4 раза с целью повышения концентрации пигментов. Поместить полоску хроматографической бумаги в хроматографическую камеру, на дне которой налит неполярный растворитель (бензин, гексан). При этом пятно пигментов должно находится выше уровня растворителя. Плотно закрыть хроматографическую камеру (для предотвращения высыхания растворителя с хроматографической бумаги, которое приводит к увеличеснию размытости пятен), подождать, пока расстояние между фронтом растворителя и верхним краем полоски бумаги не достигнет 2-3 см. Вынуть полученную хроматограмму из хроматографической камеры и сразу же отметить на ней карандашом положение фронта растворителя и пятнен пигментов.
Механизм разделения пигментов
Разделение пигментов основано на различие их растворимостей в подвижной и неподвижной фазах. В качестве подвижной фазы обычно используют неполярные растворители (бензин, гексан), в качестве подвижной фазы выступает полярный растворитель – вода, адсорбированная на волокнах целлюлозы, из которой состоит бумага. При проведении хроматографии подвижная фаза движется по бумаге под действием капиллярных сил. Чем выше отношение растворимостей пигмента в подвижной и неподвижной фазах, тем большее расстояние он проходит.
Таким образом, наибольший пробег соответствует неполярным пигментам, наименьший – полярным. Фотосинтетические пигменты распределяются в следующем порядке (начиная от фронта растворителя): каротины (светло-желтые), ксантофиллы (желтые), феофитин (серый), хлорофилл a (сине-зеленый), хлорофилл b (желто-зеленый), лютеин (один из ксантофиллов, ярко-желтый) – рис. 15-17. Феофитин является ассоциированным со II фотосистемой переносчиком электронов, но в значительно большем количестве образуется при разрушении хлорофиллов. Большое количество феофитина на хроматограмме говорит о том, что предложенная вытяжка пигментов была несвежей.
Р
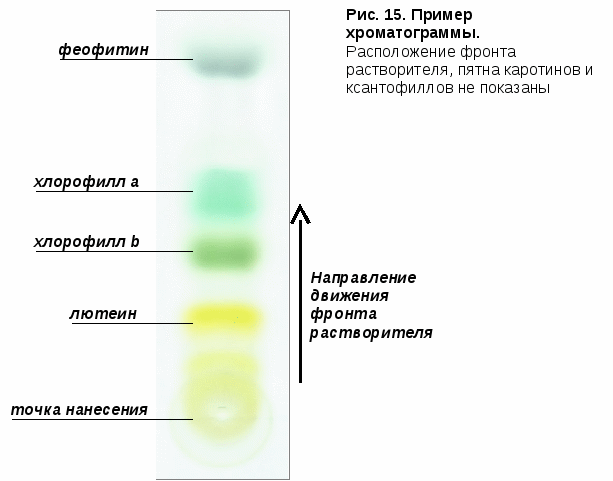
асстояние, пройденной пигментом, характеризуется величиной Rf, которая представляет собой отношение расстояния, пройденного пигментом, к расстоянию, пройденному фронтом растворителя подвижной фазы. В стандартных условиях эта величина является постоянной для каждого пигмента и приводится в справочниках.
 А.
А.  Б.
Б. 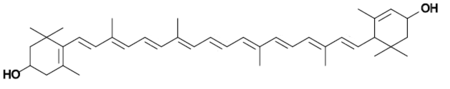 В.
В. 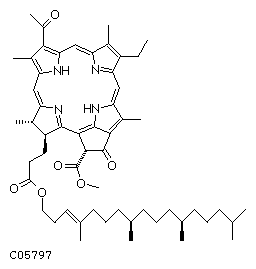
 Г.
Г. Рис. 16. Некоторые дополнительные фотосинтетические пигменты Высших растений.
А. β-каротин. Б, В. Ксантофиллы (криптоксантин и лютеин соответственно). Г. Феофитин.
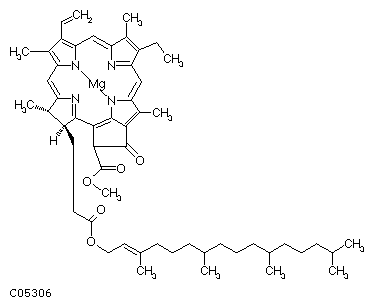
А.
Б.

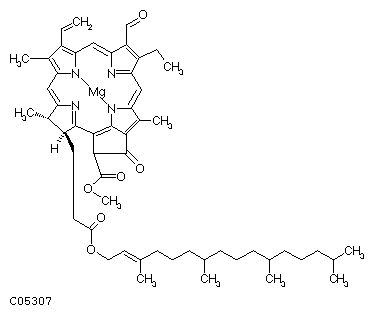

Рис. 17 (А, Б). Хлорофилл a (А) и хлорофилл b (Б).
Наблюдение за движением устьиц
Задание:
1. Приготовить препарат эпидермиса листа растения (в воде), рассмотреть его и зарисовать состояние устьиц.
2. Заменить воду на раствор осмотически активного вещества низкой концентрации (5% глицерин или 0.1М сахароза). Наблюдать за происходящими изменениями, зарисовать состояние устьиц.
3. Заменить раствор осмотически активного вещества на воду, наблюдать за происходящими измененииями.
4. Заменить воду на раствор осмотически активного вещества в высокой концентрации (20% глицерин или 1М сахароза), наблюдать за происходящими изменениями.
5. Объяснить происходившие изменения.
Что делать:
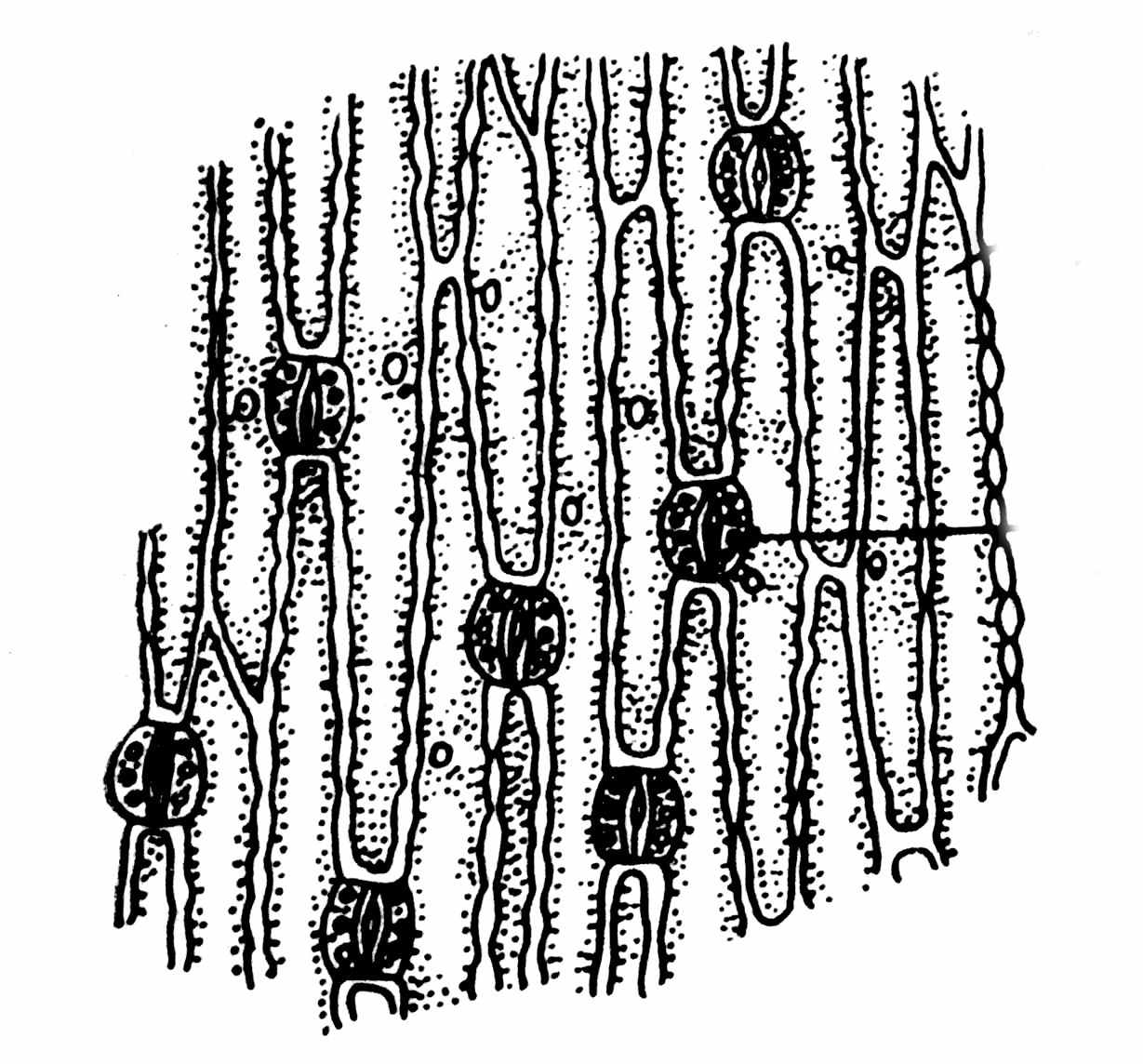
Для приготовления препарата необходимо надломить лист и подцепить лоскут эпидермиса препаровальной иглой. Если лист достаточно тонкий (например, лист злака), достаточно резко разорвать его в направлении, параллельном жилкованию. По краю разрыва под микроскопом будут видны участки эпидермиса (рис. 18).
Полученный препарат поместить в каплю воды под покровное стекло. Для того, чтобы сменить воду на раствор осмотически активного вещества, необходимо нанести каплю раствора на край покровного стекла и убрать воду, прикоснувшись фильтровальной бумагой к противоположному краю покровного стекла. При этом раствор осмотически активного вещества будет затянут под покровное стекло.
При помещении препарата эпидермиса в раствор осмотически активного вещества вода начинает покидать вакуоли замыкающих клеток устьиц, что приводит к уменьшению в них внутриклеточного давления и закрывание устьичной щели (см. главу, посвященную плазмолизу). При помещении в воду происходят обратные процессы.
Для осуществления повторного закрывания устьичной щели необходимо поместить препарат в раствор более высокой концентрации. Это связано с тем, что некоторое количество осмотически активного вещества ранее проникло внутрь вакуолей замыкающих клеток, повысив осмотическое давление внутри них.

устьице
устьице
побочная клетка

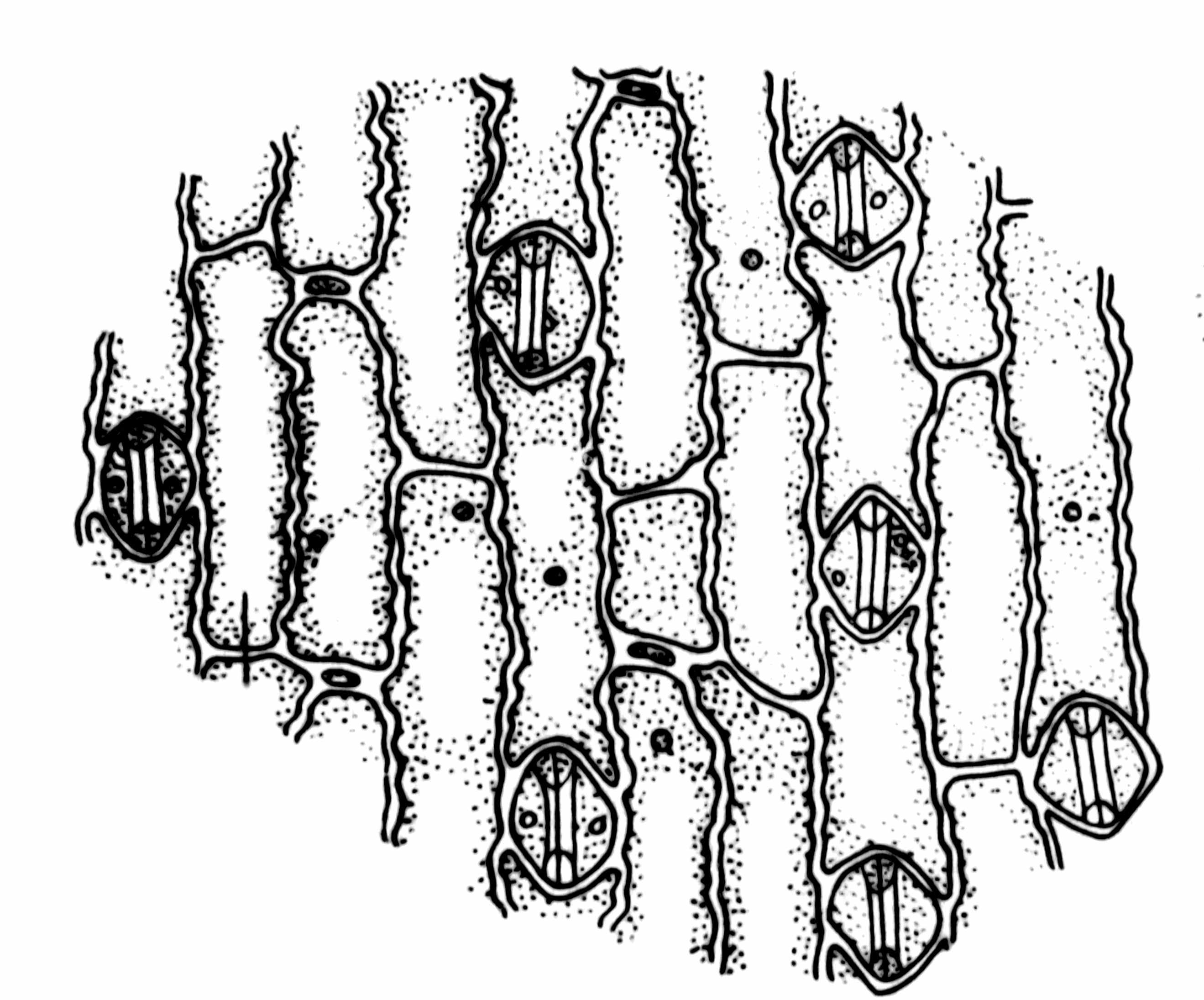
Рис. 18 (А, Б). Эпидермис листа ириса (А) и листа кукурузы (Б).
Строение и механизм работы устьиц
Устьице состоит из двух замыкающих клеток, ограничивающих устьичную щель. Внутренные стенки замыкающих клеток утолщены значительно сильнее, чем наружние. Неодинаковая толщина стенок устьиц приводит к тому, что при изменении внутриклеточного давления они способны менять свою форму, вызывая открывание или закрывание устьичной щели. При увеличении внутриклеточного давления тонкие наружние стенки растягиваются, что приводит к деформации и расхождению более жестких внутренних стенок (устьичная щель открывается). При уменьшении внутриклеточного давления растяжение наружних стенок ослабевает, и внутренние стенки возвращаются в недеформированное состояние (устьичная щель закрывается).
Различают три типа движения устьиц: гидропассивные, гидроактивные и фотоактивные.
Гидропассивные движения. Насыщение водой клеток, прилежащих к устьицам, вызывает увеличение их объема. Это приводит к механическому сдавливанию замыкающих клеток устьица и закрыванию устьичной щели.
Гидроактивные движения. При повышении водного дефицита в замыкающих клетках синтезируется абсцизовая кислота, подавляющая работу H+-насосов. Это приводит к снижению осмотического давления внутри клеток и закрыванию устьичной щели.
Фотоактивные движения. Понижение интенсивности освещения вызывает закрывание устьичной щели. Механизм фотоактивных движений окончательно не установлен. Существует гипотеза, утверждающая, что при уменьшении освещенности падает интенсивность фотосинтеза. Это вызывает понижение концентрации сахаров в цитоплазме и, как следствие, снижение осмотического давления и закрывание устьичной щели.
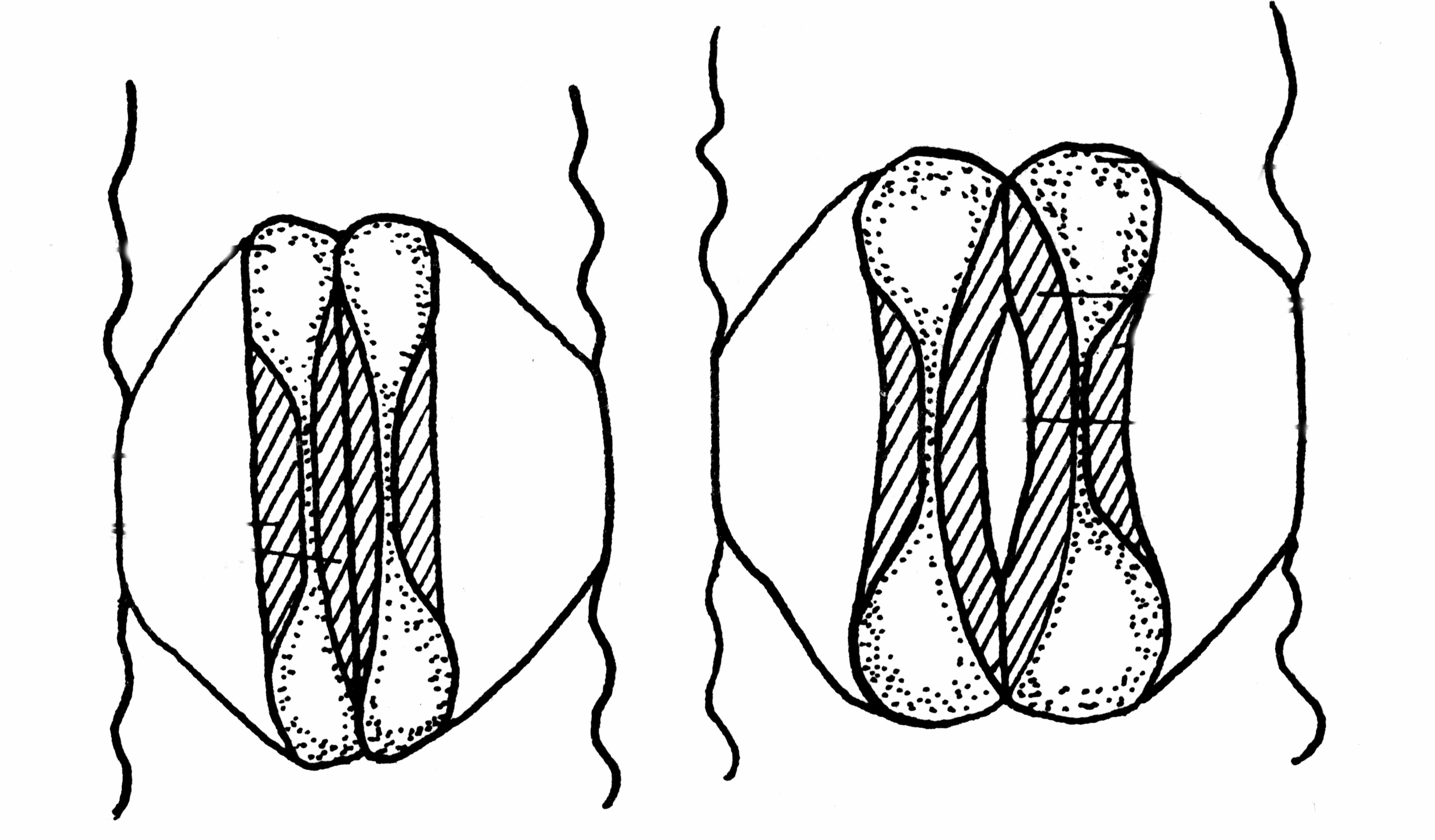
Особое строение устьиц злаков
У
А
Б
стьица злаков имеют гантелевидую форму, причем утолщены не только стенки замыкающих клеток, обращенные в сторону устьичной щели, но и стенки, примыкающие к соседним клеткам эпидермиса. Замыкающие клетки окружены ромбовидной побочной клеткой. Механизм открывания и закрывания устьиц при изменении внутриклеточного давления связан с изменением объема концевых утолщений замыкающих клеток (рис. 19).
замыкающие клетки
побочная клетка
устьичная щель
Рис. 19 (А, Б). Строение устьичного аппарата злаков.
А. Устьичная щель закрыта. Б. Устьичная щель открыта.
- -
