И. Я. Яковлева Кафедра анатомии, физиологии и гигиены детей Д. А. Димитриев «Нейрон, его строение и функция» «Общие свойства сенсорных систем» Учебное пособие
| Вид материала | Учебное пособие |
- Физиология сенсорных систем Цель дисциплины, 13.63kb.
- План: Предмет и задачи возрастной анатомии, физиологии и гигиены. Значение возрастной, 69.36kb.
- Время и место проведения Конференция проводится в апреле 2012 года в Нижегородском, 41.09kb.
- Правила гигиены органов зрения, 62.45kb.
- Экзаменационная программа по физиологии высшей нервной деятельности и сенсорных систем., 48.31kb.
- Перечень вопросов для подготовки к итоговой государственной аттестации по специальности, 451.95kb.
- Особенности морфологического и гормонально-метаболического статуса спортсменок-борцов, 533.99kb.
- Учебное пособие раскрывает происхождение и значение более 1000 учебных терминов, 1634.01kb.
- Планирование темы Урок Биосоциальная природа человека и науки, изучающие его, 1716.33kb.
- Л. Н. Шиян Свойства и химия воды. Водоподготовка Учебное пособие, 1119.56kb.
Чувашский государственный педагогический университет им.И.Я.Яковлева
Кафедра анатомии, физиологии и гигиены детей
Д.А.Димитриев
«Нейрон, его строение и функция»
«Общие свойства сенсорных систем»
Учебное пособие по физиологии человека и животных
Чебоксары 2002
УДК 612.82
ББК 28.991
Ф50
Д.А.Димитриев Учебное пособие по физиологии. Тема: «Нейрон, его строение и функция»«Общие свойства сенсорных систем»– Чебоксары, 2002. – 26с.
Печатается по решению ученого совета Чувашского педагогического университета им.И.Я.Яковлева
Учебное пособие включает материалы по функционированию нейронов, проведению импульсов по нервному волокну и передаче импульсов посредством синапсов, а также большое внимание уделяется объективной и субъективной физиологии восприятия. Руководство предназначено для студентов, обучающихся по специальностям «Биология» и «Психология».
Научный редактор- доктор биологических наук, профессор А.Д.Димитриев
Рецензенты:
Ю.Г.Максимов, докт. мед. наук., профессор кафедры профилактической медицины ЧГУ им.И.Н.Ульянова;
В.С.Куприянов, докт. мед. наук., профессор, заведующий кафедрой нормальной физиологии ЧГУ им.И.Н.Ульянова;
Ж.В.Бухаринова, канд.биол. наук., старший преподаватель кафедры анатомии, физиологии и гигиены детей ЧГПУ им.И.Я.Яковлева.
© Димитриев Д.А., 2002
© Чувашский государственный педагогический
университет им.И.Я.Яковлева, 2002
Введение
Настоящее руководство посвящено двум разделам физиологии человека: физиологии возбудимой ткани и физиологии сенсорных систем. Вполне естественно, что у читателя может возникнуть вопрос о причинах выбора именно этих разделов. Ответ на этот вопрос состоит в следующем. Как показал опыт преподавания дисциплин медико-биологического блока, физиологии человека, физиологии высшей нервной деятельности, изучение закономерностей возникновения и изменения мембранного потенциала всегда вызывают у студентов значительные затруднения. Причина этого кроется как в сложности материала, так и в отсутствии простого современного учебного пособия, доступного для большого числа студентов. Вторая причина, побудившая автора к написанию этой работы и выбору тем для нее, является стремление сделать процесс преподавания дисциплин, описывающих человека, наиболее целостным. Если первая часть данного пособия посвящена электрофизиологии и проблематике синапса, то второй раздел написан таким образом, чтобы связать физиологию человека с психологией. Последнее, на наш взгляд, особенно важно для студентов психологических и педагогических специальностей.
Нейрон, его строение и функции
Электрофизиологические явления в центральной нервной системе.
Нервные клетки, подобно другим клеткам организма, ограничены липопротеиновой мембраной, которая является хорошим электрическим изолятором. По обе стороны мембраны между содержимым клетки (цитоплазмой) и внеклеточной жидкостью существует электрическая разность потенциалов – мембранный потенциал. В нервных клетках изменения мембранного потенциала составляет основу деятельности клетки – переработки информации. На рис.1 представлено распределение ионов по обе стороны мембраны.

Внутриклеточная среда
Внеклеточная среда
Мембрана
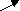
155 К+
4 К+
12 Na+
145 Na+
4 Cl¯
120 Cl¯
155 A¯
Рис.1 Внутри- и внеклеточные концентрации ионов для клетки теплокровного животного, ммоль/л.
В нервных и мышечных клетках мембранный потенциал долго сохраняется постоянным, если клетка не активизируется какими-либо внешними факторами. Мембранный потенциал такой покоящейся клетки называется мембранным потенциалом покоя (МПП). Потенциал покоя нервной и мышечной клетки всегда отрицателен, его величина постоянна для каждого типа клеток и колеблется в диапазоне от –50 до –100мВ.
Неравномерное распределение различных ионов между вне- и внутриклеточным пространством необходимо для существования потенциала покоя. Этот потенциал между внутриклеточной средой и межклеточной жидкостью возникает потому, что мембрана не является совершенным изолятором, а до некоторой степени проницаема для определенных ионов. Наиболее проницаема мембрана для ионов калия, несколько меньше для ионов хлора и еще менее проницаема для ионов натрия. В качестве примера, объясняющего механизмы трансмембранного движения ионов рассмотрим ток ионов калия. Можно представить, что мембрану пронизывают поры – каналы, через которые способны проходить ионы калия. Всякий раз, когда эти ионы наталкиваются на отверстие поры, они диффундируют через мембрану. Поскольку с внутренней стороны мембраны ионов калия намного больше, то такие столкновения будет происходить здесь гораздо чаще, чем снаружи, так что больше ионов будет проходить изнутри наружу, чем в обратном направлении. Наблюдается чистый выход ионов калия из клетки. При этом имеется сила, противодействующая этому процессу. Эта сила обусловлена электрическим зарядом ионов калия. По мере выхода калия из клетки уменьшается число положительно заряженных ионов на внутренней стороне мембраны. Одновременно увеличивается положительный заряд с внешней стороны мембраны. Возникающий при этом мембранный потенциал препятствует выходу катионов из клетки. Таким образом, выход положительных зарядов создаёт электрический потенциал, который мешает выходу других положительных ионов. Мембранный потенциал продолжает нарастать до тех пор, пока сила, препятствующая выходу калия, не станет равна осмотическому давлению калия. При таком уровне потенциала вход и выход калия находятся в равновесии, потому он называется калиевым равновесным потенциалом (
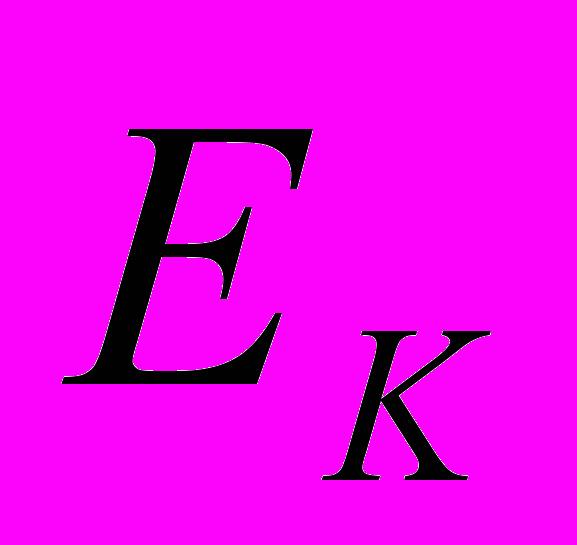 ). Величина калиевого равновесного потенциала может быть вычислена с помощью уравнения Нернста (ф.1).
). Величина калиевого равновесного потенциала может быть вычислена с помощью уравнения Нернста (ф.1).
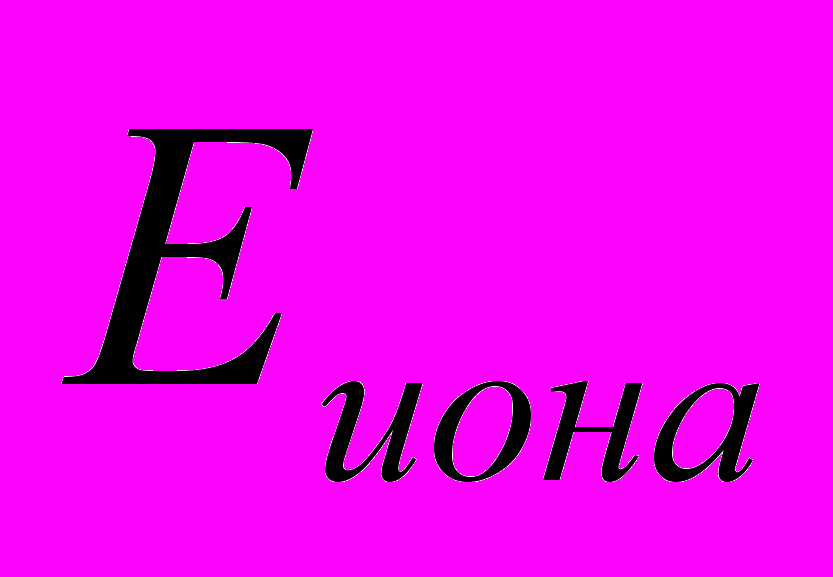 =
= 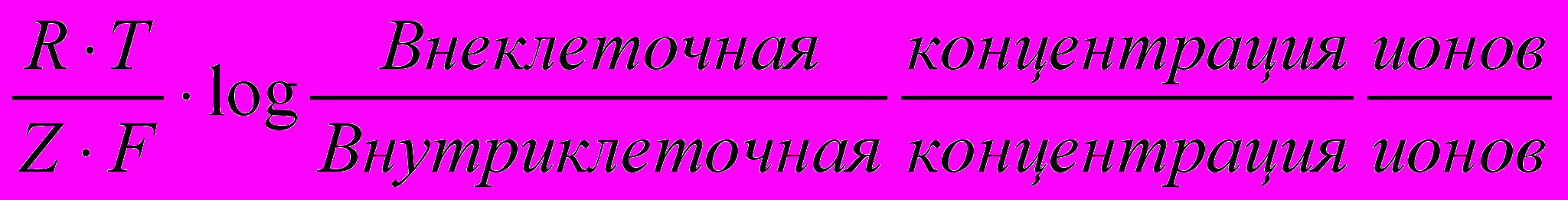 (ф.1),
(ф.1),где R –газовая постоянаая, T – абсолютная температура, Z – валентность иона и F – постоянная Фарадея. Для калия эта величина составляет –97мВ.
Мембранный потенциал действия. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то МПП нерва или мышцы быстро уменьшается и на короткий промежуток времени (миллисекунда) произойдет перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной. Это кратковременное изменение МПП, происходящее при возбуждении клетки, которое на экране осциллографа имеет форму одиночного пика, называется мембранным потенциалом действия (МПД) (рис.2).
МПД в нервной и мышечной тканях возникает при снижении абсолютной величины МПП (деполяризации мембраны) до некоторого критического значения, называемого порогом генерации МПД. В гигантских нервных волокнах кальмара МПД равен –60 мВ. При деполяризации мембраны до –45 мВ (порог генерации МПД) возникает МПД.
Во время возникновения МПД в аксоне кальмара сопротивление мембраны уменьшается в 25 раз, с 1000 до 40 Ом/см2, тогда как электрическая емкость не изменяется. Указанное снижение сопротивление мембраны обусловлено увеличением ионной проницаемости мембраны при возбуждении.
По своей амплитуде (100-120 мВ) МПД на 20-50 мВ превышает величину МПП. Другими словами, внутренняя сторона мембраны на короткое время становится заряженной положительно по отношению к наружной, - «овершут» или реверсия заряда.
Причиной таких изменений мембранного потенциала является увеличение проницаемости мембраны для ионов натрия. Это происходит благодаря открытию натриевого канала. Натриевый канал представляет собой гликопротеид. Этот белок обладает способностью изменять свою конформацию при изменении величины мембранного потенциала.
Механизм, который обеспечивает открывание и закрывание ионных каналов, получил название ворот канала. Принято различать активационные (m) и инактивационные (h) ворота. Ионный канал может находиться в трех основных состояниях: закрытом (m – ворота закрыты; h – открыты), открытом (m – и h – ворота открыты) и инактивированном (m – ворота открыты; h – закрыты).
Деполяризация мембраны, вызываемая раздражающим стимулом, например, электрическим током, открывает m – ворота натриевых каналов и обеспечивает появления направленного внутрь потока положительных зарядов – ионов натрия. Это ведет к дальнейшей деполяризации мембраны, что в свою очередь, увеличивает число открытых натриевых каналов и следовательно, повышает натриевую проницаемость мембраны. Возникает «регенеративная» деполяризация мембраны, в результате которой потенциал внутренней стороны мембраны стремится достичь величины натриевого равновесного потенциала.
Причиной прекращения роста МПД и реполяризации мембраны клетки является: а) увеличение деполяризации мембраны, т.е. когда мембранный потенциал (Ем ) → ЕNа, в результате чего снижается электрохимический градиент для ионов натрия, равный Ем - ЕNа. (уменьшается сила, «толкающая» натрий внутрь клетки); б) деполяризация мембраны порождает процесс инактивации натриевых каналов (закрывание h- ворот), который тормозит рост натриевой проницаемости мембраны и ведет к ее снижению; в) деполяризация мембраны увеличивает ее проницаемость для ионов калия. Процессы инактивации натриевых каналов может быть блокирован токсинами и фармакологическими препаратами (местными анестетиками). Выходящий калиевый ток стремится сместить мембранный потенциал в сторону калиевого равновесного потенциала.
Снижение электрохимического потенциала для ионов натрия и инактивации натриевых каналов уменьшает величину входящего натриевого тока. В определенный момент времени величина входящего тока натрия сравнивается с возросшим выходящим током – рост МПД прекращается. Когда суммарный выходящий ток превышает входящий, начинается реполяризация мембраны, которая также имеет регенеративный характер. Начавшаяся реполяризация ведет к закрыванию активационных ворот (m), что уменьшает натриевую проницаемость мембраны, ускоряет реполяризацию, а последняя увеличивает число закрытых каналов и т.д.
С инактивацией натриевых каналов связано важное свойство нервного волокна, называемое рефрактерностью. Во время абсолютного рефрактерного периода нервное волокно полностью утрачивает способность возбуждаться при действии раздражителя любой силы. Относительная рефрактерность, следующая за абсолютной, характеризуется более высоким порогом возникновения МПД.
Распространение потенциала действия. При распространении потенциала действия отмечается полное возбуждение каждой точки нервного волокна, так что амплитуда потенциала действия везде одна и та же. Протекающие по принципу «всё или нечего» процессы возбуждения в разных участках мембраны связаны посредством электротонического распространения раздражающих токов вдоль волокна. Ионы натрия, которые входят в волокно в возбужденном участке мембраны, служат источником тока для возникновения деполяризующего электротонического потенциала в соседнем, еще не возбужденном участке. Когда эта деполяризация достигает порога, она вызывает в этом участке возбуждение. Таким образом, состояние возбуждения распространяется посредством электротонической связи от возбуждаемых участков мембраны к еще не возбужденным. Однако такое распространение возбуждение довольно медленное. Гораздо быстрее потенциал действия распространяется в миелинизированных нервных волокнах. Это обусловлено особенностям строения миелинизированных волокон: только очень короткие участки этих волокон (перехваты Ранвье) покрыты обычной клеточной мембраной. Поэтому при проведении ток, по существу, не идет через мембрану межперехватных участков, и потенциал действия от одного перехвата Ранвье к другому распространяется через межперхватные участки. Время проведения через межперехватные участки практически равно нулю – возбуждение перескакивает от одного перехвата к следующему (сальтаторное проведение).
Межклеточная передача возбуждения. Как мы уже отмечали выше, по нервной клетке информация передается в виде потенциалов действия. Передача информации к соседней клетке происходит через специальные межклеточные контакты – синапсы. Синапсы подразделяются на химические и электрические. В химических синапсах проведение осуществляется благодаря особым веществам – медиаторам, а в электрических синапсах решающее значение для проведения имеет специфическое распределение токов. Нами будут рассмотрены синапсы первого типа, поскольку именно они обеспечивают сложное взаимодействие клеток в организме человека.
На рисунке 3 показаны важнейшие компоненты химического синапса. Распространяющийся по аксону потенциал действия вызывает деполяризацию пресинаптической мембраны, что приводит к высвобождению медиатора и поступлению его в синаптическую щель. Медиатор диффундирует к плазматической мембране постсинаптической клетки (постсинаптической мембране), где происходит его взаимодействие с рецепторами. Рассмотрим эти процессы на молекулярном уровне несколько подробнее. Для этого нам потребуется, прежде всего информация о химическом строении медиаторов и их функции. Одним из наиболее распротсраненных медиаторов является ацетилхолин, который относится к числу возбуждающих медиаторов. К той же группе медиаторов относят и моноамины дофамин, серотонин, норадреналин, адреналин. Последние два объединены в группу катехоламинов. Среди медиаторов имеются и аминокислоты: γ-аминомасляная кислота и глицин. Оба этих медиатора оказывают тормозящее воздействие на постсинаптические клетки. Аминокислоты, моноамины и ацетилхолин представляют собой группу так называемых «классических» медиаторов. Все они – низкомолекулярные соединения, образующиеся в качестве промежуточных продуктов метаболизма. Каждый из них связывается со специфическим рецепторов постсинаптической мембраны, в результате чего повышается ее проводимость – либо для натрия (и калия) в случае передачи возбуждения, либо для калия и хлора с развитием торможения. Кроме «классических» медиаторов в межклеточном взаимодействии участвуют более сложные по химическому строению и обладающие большей молекулярной массой вещества – пептиды. К важнейшим пептидным медиаторам относят мет-энкефалин, лей-энкефалин, вещество Р, ангиотензин II, вазоактивный кишечный (интерстинальный) пептид, соматостатин, рилизинг-гормон лютеотропного гормона (люлиберин или ЛГРГ). Медиаторы накапливаются в синаптических пузырьках, ассоциированных с участками пресинаптической мембраны. Эту ассоциацию можно рассматривать как аппарат, специализированный для экзоцитоза, т.е. для выброса медиаторов в синаптическую щель. При этом медиатор поступает в синаптическую щель в виде квантов, соответствующих объему одного пузырька. Небольшое количество медиатора выделяется и в состоянии покоя, но пик поступления медиатора в синаптическую щель связан с деполяризацией пресинаптической мембраны – потенциал действия пресинаптического окончания ведет к почти синхронному высвобождению квантов медиатора, которое приводит к генерированию потенциала в постсинаптической мембране. Ключевую роль в квантовом высвобождении медиатора играет входящий ток ионов кальция.
Поступивший в синаптическую щель медиатор взаимодействует с рецептором постсинаптической мембраны, вызывая изменение ее проводимости. Механизм этого взаимодействия описан в рамках теории молекулярной рецепции – раздела биокинетики. Несколько слов об истории вопроса. В начале XX-го века П.Эрлих и И.И.Мечников сформулировали теорию боковых цепей (Нобелевская премия, 1908). Согласно этой теории на клеточной поверхности имеются особые химические соединения, которые образуют «боковые цепи». Химические соединения способны взаимодействовать с этими боковыми цепями. В результате взаимодействия происходит клеточное распознавание веществ и формирование клеточного ответа. П.Эрлих назвал эти боковые цепи рецепторами (от латинского recipere – получать, узнавать). Он сформулировал основной постулат рецепторного механизма действия химических соединений: “вещество не действует, если не фиксировано” (“corpora non agun nisi fixata”). Первое количественное описание величины ответа клетки в зависимости от концентрации добавленного химического соединения было предпринято А. Кларком в 1926г. Аналогично тому, как это сделано в ферментативной кинетике, Кларк предположил, что химические вещества находятся в избытке по отношению к рецепторам. Кроме того, он предположил, что взаимодействие химических веществ с рецепторами обратимо. В настоящее время химические вещества, способные взаимодействовать с рецепторами, принято называть лигандами ( от латинского ligo – связываю). Такое взаимодействие лигандов с рецепторами, согласно Кларку записывается так:
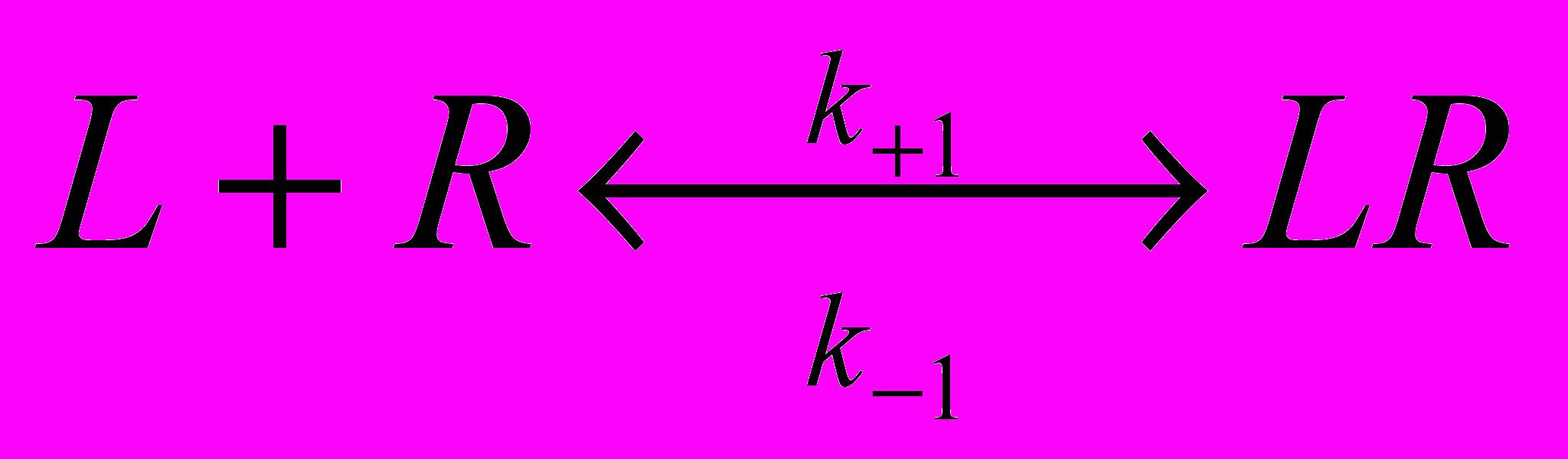 (ф.2),
(ф.2),где L –лиганд; R – рецептор; LR – комплекс лиганда с рецептором или лиганд-рецепторный комплекс;
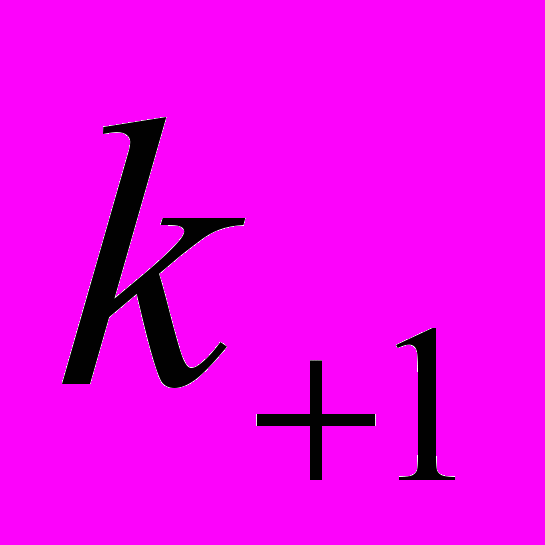 и
и 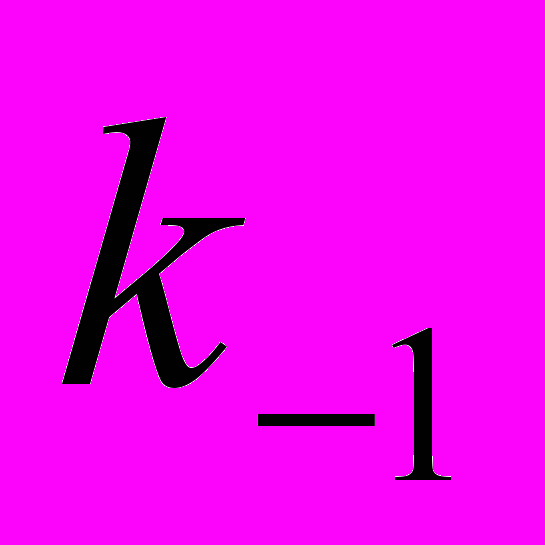 - константы скоростей образования и распада лиганд-рецепторных комплексов.
- константы скоростей образования и распада лиганд-рецепторных комплексов.Согласно современным представлениям, большинство биологически активных веществ и лекарств оказывает воздействие на организм, регулируя функции клеток. При этом многие вещества не проникают в клетку, а оказывают свое действие опосредованно, взаимодействуя на клеточной мембране со специфическими молекулами, называемыми рецепторами. Рецепторы способны специфически распознать биологически активное вещество, обратимо или необратимо взаимодействовать с ним и передавать специфический сигнал об этом взаимодействии в клетку. Под рецепторами понимают макромолекулы, расположенные на цитоплазматической мембране клеток или внутриклеточно, способные специфически взаимодействовать с ограниченным набором биологически активных веществ (лигандов) и трансформировать сигнал об этом взаимодействии в специфический клеточный ответ. Все лиганды делятся на агонисты и антогонисты. Агонистами называют лиганды, которые, связываясь с рецепторами данного типа, активно вызывают клеточный ответ. В синапсе в качестве агонистов могут выступать как медиаторы, так и другие вещества. Это обусловлено тем, что специфичность мембранных рецепторов не абсолютна. Так, в холинергическом синапсе в качестве агонистов могут выступать карбамилхолин и суберилдихолин. Другие вещества, также связывающиеся с рецепторами медиаторов, но не столь эффективно изменяющие мембранную проницаемость, называются частичными агонистами. Антагонистами называются лиганды, которые связываются с рецепторами и не вызывают активного клеточного ответа. Антагонисты препятствуют связыванию агонистов с рецепторами, угнетая клеточные функции. Связывание их может быть обратимым: спустя некоторое время антагонист отделяется от рецептора. Такие вещества называют конкурентными антагонистами, так как они конкурируют с медиаторами и их антагонистами за участки связывания. Хорошо известный конкурентный антагонист ацетилхолина в нервно-мышечном синапсе – яд кураре (d-тубокурарин). По мере повышения концентрации он блокирует все больше рецепторов, и эффект ацетилхолина ослабляется из-за уменьшения доступных мест связывания. Это приводит к уменьшению потенциала концевой пластинки и параличу мышцы.
С учетом всего вышесказанного формула Кларка будет выглядеть следующим образом:
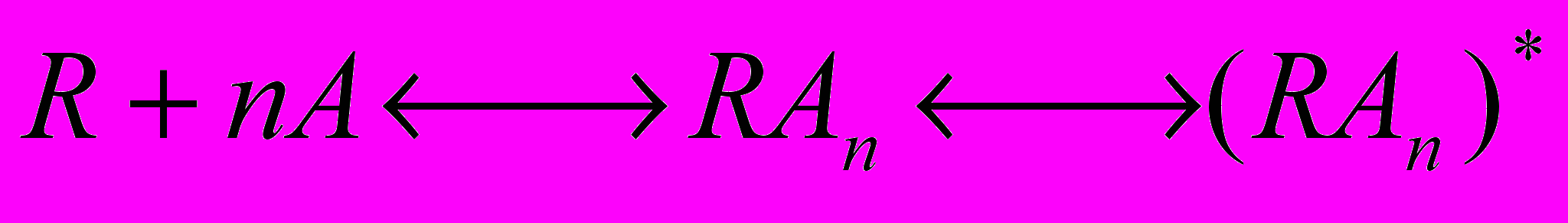 (ф.3),
(ф.3),где n – число молекул агониста, связывающихся с одним рецептором, а переход от состояния
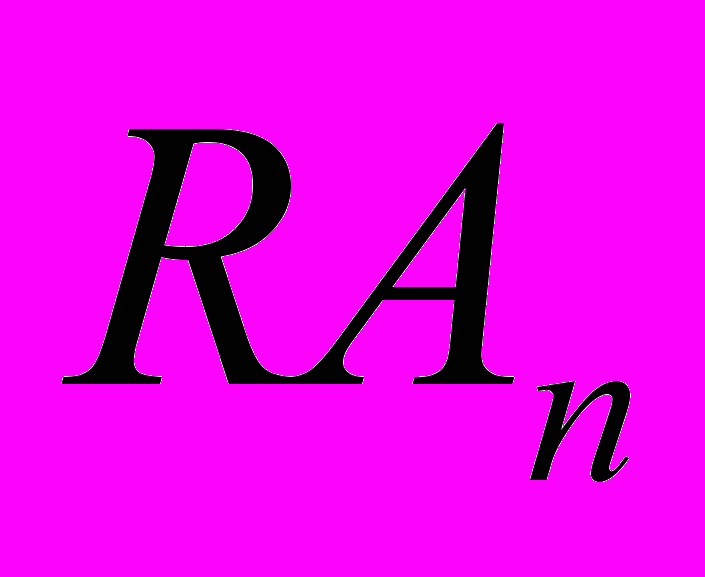 к состоянию
к состоянию 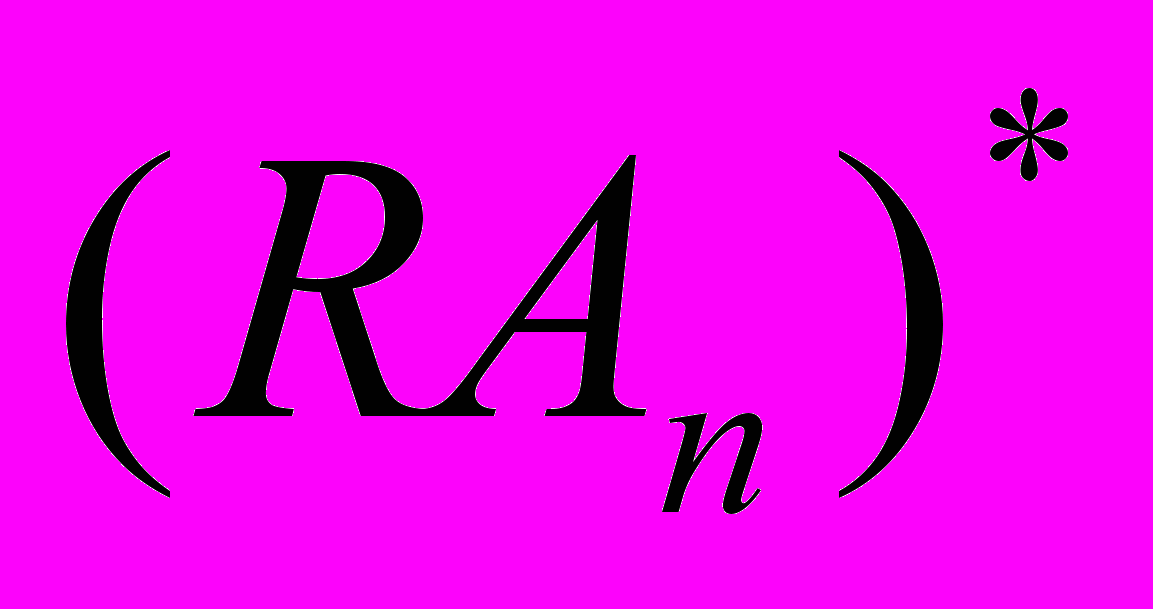 отражает сдвиг проводимости, т.е. открытие постсинаптического ионного канала. Рецепторы делятся на несколько групп. К первой из них относятся рецепторы – ионные каналы. Наиболее часто эти рецепторы представляют собой несколько белков, образующих ионный канал. В неактивном состоянии эти белки расположены так, что ионный канал закрыт. Связывание одной или нескольких белковых молекул с лигандом приводит к открытию канала и прохождению ионов в клетку или выход из клетки. В этом случае ионы могут выступать в качестве вторичных мессенджеров. Вторичными мессенджерами (от английского message – сообщение) называются внутриклеточные молекулы, осуществляющие сопряжение рецепторов с внутриклеточными эфферентными системами (ферментами, ионными каналами, геномом и т.д.). В результате лиганд-рецепторного взаимодействия концентрация вторичных мессенджеров в клетке меняется (возрастает или убывает). Известны четыре системы вторичных посредников:
отражает сдвиг проводимости, т.е. открытие постсинаптического ионного канала. Рецепторы делятся на несколько групп. К первой из них относятся рецепторы – ионные каналы. Наиболее часто эти рецепторы представляют собой несколько белков, образующих ионный канал. В неактивном состоянии эти белки расположены так, что ионный канал закрыт. Связывание одной или нескольких белковых молекул с лигандом приводит к открытию канала и прохождению ионов в клетку или выход из клетки. В этом случае ионы могут выступать в качестве вторичных мессенджеров. Вторичными мессенджерами (от английского message – сообщение) называются внутриклеточные молекулы, осуществляющие сопряжение рецепторов с внутриклеточными эфферентными системами (ферментами, ионными каналами, геномом и т.д.). В результате лиганд-рецепторного взаимодействия концентрация вторичных мессенджеров в клетке меняется (возрастает или убывает). Известны четыре системы вторичных посредников: - аденилатциклаза – циклический аденозин – моно – фосфат (цАМФ);
- гуанилатциклаза – циклический гуанозин – монофосфат (цГМФ);
- фосфолипаза С - инозитол – три – фосфат (Ифз);
- ионизированный кальций.
Система аденилатциклаза – цАМФ. Мембранный фермент аденилатциклаза может находиться в двух формах – активированной и неактивированной. Переход этого фермента из неактивной в активную форму происходит под влиянием лиганд-рецепторного комплекса, образование которого приводит к связыванию гуанилового нуклеотида (ГТФ) с особым регуляторным стимулирующим белком (GS – белок) после этого GS – белок вызывает присоединение Mg к аденилатциклазе и ее активацию. Лиганд–рецепторные комплексы взаимодействуют в мембране клетки с другим регуляторным ингибирующим белком (GI-белок), который вызывает гидролиз ГТФ и ГДФ и, сответственно, подавление активности аденилатциклазы. Адреналин через бета – адренорецепторы активируют аденилатциклазу, а через альфа- 1 – адренорецепторы ее подавляет.
Под влиянием аденилатциклазы из АТФ синтезируется цАМФ, вызывающий активацию двух типов протеинкиназ в цитоплазме клетки, ведущих к фосфорилированию многочисленных внутриклеточных белков. Это меняет проницаемость мембран, активность и количество ферментов (табл.1).
Таблица 1. Основные эффекты фосфорилирования белков клетки цАМФ – зависимой протеинкиназой
Виды белков | Эффекты фосфорилирования |
| Компоненты мембраны | Изменения проницаемости |
| Ферменты, лимитирующие скорость метаболического процесса | Активация или подавление |
| Белки рибосом | Активирование или подавление трансляции |
| Ядерные белки | Активирование или подавление транскрипции |
| Белки микротрубочек | Секреторный, двигательный эффекты или изменение конфигурации клетки |
