Г. С. Русских Общая характеристика работы
| Вид материала | Автореферат |
- Контрольные вопросы к экзамену по пропедевтике внутренних болезней общая часть, 89.68kb.
- Содержание лекций Модели местного самоуправления в России Местное самоуправление:, 786.51kb.
- Общая характеристика работы актуальность работы, 336.09kb.
- Общая характеристика работы актуальность работы, 236.99kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Общая характеристика работы актуальность работы, 227.87kb.
- Задачи физического воспитания детей дошкольного возраста. Общая характеристика средств, 34.6kb.
- Реферат по курсу: экология на тему: Общая характеристика экосистем, как, 726.64kb.
- Научная работа студентов, 2153.55kb.
- Научная работа студентов, 2114.42kb.
На правах рукописи
Величко
Елена Юрьевна
РОЛЬ САЙТОВ ВЗАИМОДЕЙСТВИЯ ДНК С КОМПЛЕКСОМ СТЕРОИДНЫЙ ГОРМОН – АПОЛИПОПРОТЕИН А-I В РЕГУЛЯЦИИ ТРАНСКРИПЦИИ
03.00.04 – биохимия
03.00.03 – молекулярная биология
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск – 2008
Работа выполнена в Государственном учреждении Научно-исследовательском институте биохимии СО РАМН, г. Новосибирск
Научные руководители:
академик РАМН,
доктор медицинских наук, профессор
Панин Лев Евгеньевич
доктор биологических наук
Гимаутдинова Ольга Ивановна
Официальные оппоненты:
доктор биологических наук
Гришанова Алевтина Юрьевна
доктор биологических наук
Усынин Иван Федорович
Ведущая организация: Институт химической биологии и фундаментальной медицины СО РАН, г. Новосибирск
Защита диссертации состоится «____»_______________2008 г.
в _____часов на заседании диссертационного совета Д 001.034.01 в Государственном учреждении Научно-исследовательском институте биохимии СО РАМН по адресу: 630117, г. Новосибирск, ул. Академика Тимакова, 2
С диссертацией можно ознакомиться в библиотеке Государственного учреждения Научно-исследовательского института биохимии СО РАМН
Автореферат разослан «______» ____________________2008 г.
Ученый секретарь
диссертационного совета,
кандидат биологических наук Г.С. Русских
Общая характеристика работы
Актуальность темы. Данная работа посвящена изучению молекулярных механизмов гормональной регуляции транскрипции. Известно, что адаптивные свойства гормонов, как правило, реализуются через взаимодействие с геномом клетки, приводя к усилению экспрессии или, напротив, к супрессии отдельных генов. Несмотря на пристальное внимание ученых к данной проблеме многие этапы этого взаимодействия до сих пор неясны. Достаточно полно изучены молекулярные механизмы индукции ключевых ферментов глюконеогенеза при участии гормонов пучковой зоны коры надпочечников и цитозольного рецептора этих гормонов (Mangelsford D. J. et al., 1995; Libri V. et al., 2004). Однако механизмы взаимодействия гормон-рецепторных комплексов с ДНК изучены недостаточно.
В Институте биохимии СО РАМН ранее было открыто явление стимуляции резидентными макрофагами биосинтеза белка в паренхимных клетках органов и тканей в процессе регенерации, в котором принципиальную роль играли стероидные гормоны и липопротеины высокой плотности 3 подкласса (ЛПВП3) (Панин Л.Е., Усынин И.Ф., Харьковский А.В., 1994; 1999). Показано, что функцию переносчика стероидных гормонов в ядра клеток в данном механизме выполняет аполипопротеин A-I (апоA-I) (Панин Л.Е. и др., 1992). Образование биологически активного комплекса стероидный гормон-аполипопротеин A-I протекает в резидентных макрофагах. Затем осуществляется перенос данного комплекса в ядра соматических клеток, где он взаимодействует с депротеинизированными участками ДНК с последующим усилением экспрессии генов. Молекулярные механизмы данного явления во многом еще не раскрыты. К ним следует отнести определение сайтов взаимодействия комплексов стероидный гормон-аполипопротеин A-I с ДНК и их роль в активации транскрипции. Так, ранее было показано, что комплекс стероидный гормон (тетрагидрокортизол, дегидроэпиандростерон-сульфат)-аполипопротеин A-I взаимодействует преимущественно с GCC/CGG-последовательностями в изолированной ДНК (Панин Л.Е. и др., 2002; Panin L.E. et. al., 2003). Однако ряд деталей этого взаимодействия можно выяснить только на синтетических олигонуклеотидах, а не на нативной ДНК. Сегодня это важное и недостающее звено в изучении не только механизмов усиления экспрессии генов, но и копирования ДНК. Решение этих вопросов чрезвычайно актуально для понимания молекулярных механизмов гормональной индукции синтеза белков, их роли в процессах регенерации и пролиферации клеток.
Цель и задачи исследования
Целью данного исследования являлось изучение молекулярных механизмов действия комплексов стероидный гормон (тетрагидрокортизол, кортизол)-аполипопротеин A-I на вторичную структуру синтетических олигонуклеотидов вида (gCC)n и их комплементарных дуплексов, а также на транскрипцию ДНК крысы.
Для достижения поставленной цели необходимо было решить следующие задачи:
1. Установить возможные нуклеотидные последовательности сайтов связывания комплексов стероидный гормон-апоA-I (где стероидный гормон – ТГК или кортизол) с ДНК. Определить устойчивость их к действию ДНКазы I и нуклеазы S1 после взаимодействия с комплексом тетрагидрокортизол-апоА-I;
2. Изучить воздействие комплексов стероидный гормон-апоA-I (где стероидный гормон – ТГК или кортизол) на вторичную структуру синтетических олигонуклеотидов и их комплементарных дуплексов;
3. Оценить влияние метилирования олигонуклеотидов вида (gCC/ggC)n на их взаимодействие с комплексом стероидный гормон-апоА-I;
4. Исследовать влияние комплексов стероидный гормон-апоA-I на транскрипцию ДНК in vitro.
Научная новизна работы
Впервые определены минимально достаточные нуклеотидные последовательности, специфично взаимодействующие с комплексом тетрагидрокортизол-аполипопротеин A-I. Найдены концевые нуклеотиды последовательностей, усиливающие связывание с указанным комплексом. Показано, что последовательность, связывающая комплекс тетрагидрокортизол-аполипопротеин A-I и недоступная действию нуклеаз, представляет собой 5`-gg(Cgg)3T3.
Впервые показано, что метилирование оснований в нуклеотидах CpG не препятствует связыванию олигонуклеотидного дуплекса вида gCC/ggC с комплексом ТГК-апоА-I. На модельных олигонуклеотидных дуплексах AnCC(gCC)3●gg(Cgg)3Tn (n=0, 3 и 6) доказано «расплетающее» действие комплекса ТГК-апоА-I.
Впервые показано, что комплекс тетрагидрокортизол-аполипопротеин А-I дозозависимо активирует транскрипцию ДНК крысы in vitro, выполняя роль, подобную роли транскрипционного фактора, изменяющего структуру ДНК в сайтах связывания, в процессе транскрипции.
Теоретическая и практическая значимость работы
Полученные данные вносят существенный вклад в понимание молекулярных механизмов гормональной регуляции синтеза белков в соматических клетках. Показано, что важную роль в этих механизмах играет такой адресный переносчик стероидных гормонов в ядра клеток как аполипопротеин А-I. Определение минимально достаточного сайта связывания ДНК с комплексом стероидный гормон-аполипопротеин А-I и особенности их взаимодействия существенно дополняют современные представления о структурно-функциональной организации генома эукариот. Полученные данные раскрывают новые механизмы гормональной регуляции экспрессии генов, их роли в регенерации и пролиферации клеток, в том числе, и при опухолевых процессах. Полученные результаты могут быть использованы при обосновании новых методов коррекции и лечения как пролиферативных, так и дегенеративно-деструктивных процессов в органах и тканях.
Основные положения, выносимые на защиту
- Аполипопротеин A-I в составе комплекса со стероидными гормонами (где стероидный гормон – ТГК или кортизол) имеет высокое сродство как к природной ДНК, так и к GC-богатым синтетическим олигодезоксирибонуклеотидам разного состава.
- Связывание комплекса ТГК-апоA-I с олигонуклеотидными дуплексами вида (gCC/Cgg)n приводит к образованию одноцепочечных (S1-нуклеазочувствительных) участков. Метилирование оснований в нуклеотидах не препятствует связыванию комплекса ТГК-апоA-I с комплементарным дуплексом.
- Минимально достаточная для связывания комплекса ТГК-апоA-I нуклеотидная последовательность, недоступная действию S1 нуклеазы и ДНКазы I, представляет собой олигонуклеотид gg(Cgg)3T3.
- Транскрипция in vitro ДНК крысы, катализируемая РНК-полимеразами белкового экстракта ядер из клеток печени, дозозависимо активируется комплексом ТГК-апоА-I; но при 200-кратном мольном избытке комплекса транскрипция ингибируется полностью.
Апробация работы и публикации
Материалы диссертации изложены в 4 публикациях и были представлены на международной школе молодых ученых (BGRS, Новосибирск, 2005 г.), доложены на ученом совете Института Биохимии СО РАМН.
Структура и объем работы: диссертация изложена на 137 страницах машинописного текста, включая 2 таблицы и 22 рисунка. Работа состоит из введения, обзора литературы, описания материалов и методов исследований, результатов собственных исследований, обсуждения результатов, заключения, выводов и списка цитируемой литературы. Список литературных источников содержит 195 ссылок, включая 57 отечественных.
ОСНОВНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
- Выделение ЛПВП методом изоплотностного ультрацентрифугирования (Hatch F. T., Less R. S., 1968).
- Выделение апоА-I из апоЛПВП методом электрофореза по Лэммли (Laemmli U. K., 1970) в препаративном варианте.
- Выделение нативной ДНК из печени крысы линии Вистар (Karlinsey J. et al., 1989).
- Выделение белкового экстракта из ядер клеток печени крысы по (Dignam J. D. et al., 1983) с собственными модификациями.
- Аффинная хроматография олигонуклеотидов.
- Введение 32Р-метки в олигонуклеотиды (Маниатис Т. и др. 1984).
- Титрование растворов олигонуклеотидов, комплементарных дуплексов и ДНК комплексами стероидный гормон-апоА-I (Гимаутдинова О. И. и др., 1998).
- Ферментативный анализ структуры олигонуклеотидов, ДНК и их продуктов с применением нуклеазы S1 (Vogt V.M., 1973), ДНКазы I (Sambrook J., et al., 1989), метилазы M.Fsp4HI и рестриктазы Fsp4HI (Zingg J. M., Jones P. A., 1997; Власова Т. И. и др., 1996).
- Реакция транскрипции на матрицах ДНК крысы и хроматина in vitro.
- Электрофорез олигонуклеотидов, ДНК и РНК в полиакриламидном геле.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ РАБОТЫ И ИХ ОБСУЖДЕНИЕ
Полное описание результатов приведено в диссертации, в автореферат вынесены результаты, определяющие теоретическую и практическую значимость, а также новизну исследования.
Ранее было показано влияние комплексов стероидный гормон–апоА-I (где стероидный гормон – ТГК или кортизол) на вторичную структуру ДНК, в состав которой входят исследуемые нами последовательности нуклеотидов (рис. 1) (Панин Л. Е., Гимаутдинова О. И. и др., 1998), поэтому можно было ожидать аналогичное воздействие на олигонуклеотиды и их комплементарные дуплексы.
Взаимодействие олигонуклеотидов и их комплементарных дуплексов с комплексами ТГК–апоА-I или кортизол–апоА-I
В эксперименте были использованы два вида GC-олигонуклеотидов: содержащие An или Tn-последовательности на 5`- и 3`-концах, соответственно (рис. 1).
| Г1 – 5`-CC(gCC)3 | Г2 – 5`-gg(Cgg)3 |
| Г1А6 – 5`-А6CC(gCC)3 | Г2Т6 – 5`-gg(Cgg)3T6 |
| Г1А3 – 5`-A3CC(gCC)3 | Г2Т3 – 5`-gg(Cgg)3T3 |
| ON1 – 5`-СС(gCC)5 | |
| ON2 – 5`-pATCTTTAACTGATGAACTTCT | |
| ON3 – 5`-pTGCCTGGAGCTGCTTGATGC | |
Рис. 1. Нуклеотидные последовательности использованных в работе олигонуклеотидов, моделей сайтов связывания ДНК с комплексом ТГК-апоА-I.
Последовательность (gCC)3 является регуляторной (т.е. той последовательностью, с которой связываются транскрипционные факторы или другие регуляторные белки) для гена белка апоА-I человека (Перевозчиков А., 1997), а также встречается в промоторах других генов (Кузнецов П. А., 2004).
В нашей работе показано, что апоА-I способен связываться с олигонуклеотидами в составе комплекса с ТГК и кортизолом. Максимальным эффектом на структуру ДНК обладает комплекс состава 1 молекула белка – 2 молекулы гормона (Кузнецов П. А., 2004). Такой комплекс, по-видимому, обладает оптимальной конформацией для максимального воздействия на структуру ДНК.
На рис. 2 представлены данные по сродству олигонуклеотидов к комплексу ТГК-апоА-I (А и Б) и к комплексу кортизол-апоА-I (В) (стероидный гормон : белок – 2:1, моль/моль), полученных аффинной хроматографией на колонке с Сефарозой 4В с пришитыми поликлональными антителами к апоА-I (синтезирована О. И. Гимаутдиновой).
Комплексы стероидный гормон-апоАI (где стероидный гормон – ТГК или кортизол) связываются со всеми синтетическими олигодезоксирибонуклеотидами разного состава и длины (рис. 1), используемыми в эксперименте, кроме Т19 (рис. 2 А, Б, дор. 1, 6). Для данного олигонуклеотида заметного связывания с комплексом ТГК-апоА-I обнаружено не было.

Рис. 2. Радиоавтографы 15% ПААГ после разделения электрофорезом Р32-олигонуклеотидов, элюированных с сорбента Сефароза-антиапоАI:апоАI-стероидный гормон (где стероидный гормон – ТГК или кортизол); ( # ) - метка введена до аффинной хроматографии. В каждом опыте на колонку с аффинным сорбентом наносили одинаковое количество молей олигонуклеотидов.
А – сродство олигонуклеотидов к комплексу ТГК-апоА-I.
- Т19;
- #ON1 (5`-СС(gCC)5);
- ON2 (5`-pTGCCTGGAGCTGCTTGATGC);
- ON3 (5`-pATCTTTAACTGATGAACTTCT);
- ON1 (5`-СС(gCC)5).
Б – сродство олигонуклеотидов к комплексу ТГК-апоА-I.
- #Т19;
- Г2 (5`-gg(Cgg)3);
- Г2Т3 (5`-gg(Cgg)3Т3);
- Г2Т6 (5`-gg(Cgg)3Т6).
В – сродство олигонуклеотидов к комплексу кортизол-апоА-I.
- Г2Т3;
- Г2Т6.
Наибольшим сродством к комплексу ТГК–апoA-I обладают олигонуклеотиды, содержащие Tn на 3`-конце (Г2Т3 и Г2Т6), т.к. на радиоавтографе обнаруживалось наиболее заметное их присутствие (рис. 2 Б, дор. 8, 9). Также обнаружено связывание Tn-содержащих олигонуклеотидов (Г2Т3 и Г2Т6) с апоА-I в комплексе с другим стероидным гормоном – кортизолом, но в меньшей степени (рис. 2 В, дор. 8-10 и 9-11).
Из рис. 2 можно заключить, что электрофоретические подвижности в 15% ПААГ исследуемых олигонуклеотидов, соотнесенные с маркерными красителями ХС и BP, соответствуют литературным (Мазин А. В., Кузнеделов К. Д., 1986).
Изменение чувствительности к S1 нуклеазе и ДНКазе I олигонуклеотидов и их комплементарных дуплексов под влиянием комплексов ТГК-апоА-I или кортизол-апоА-I
Предварительная обработка ДНК комплексом апоА-I – стероидный гормон (кортизол и ТГК, АС, ДЭА, ДЭАС) приводит к появлению дополнительных S1-нуклеазочувствительных участков (Кузнецов П. А., 2004) и защищает от действия ДНКазы I.
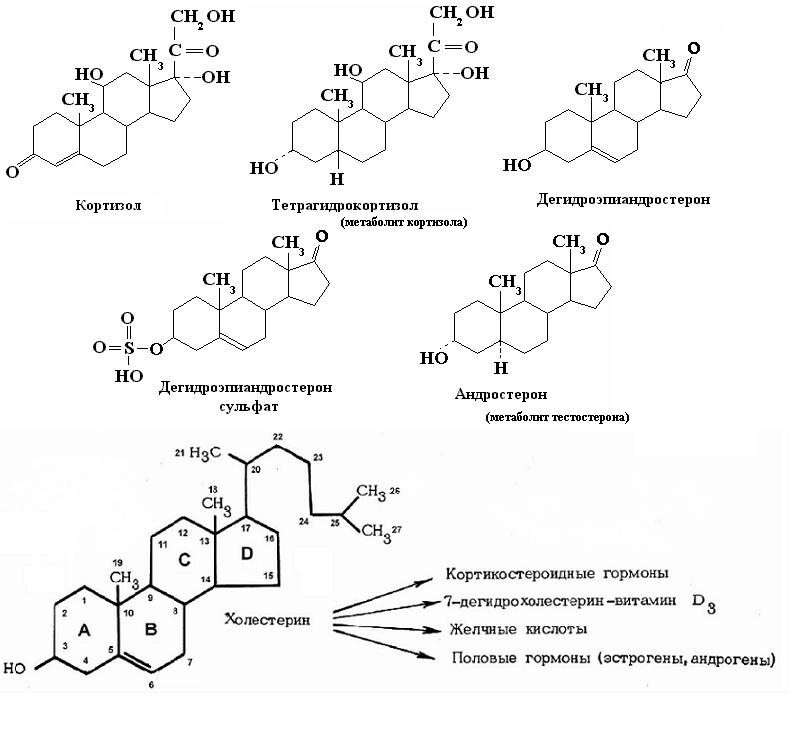
(метаболит кортизола)
Рис. 3. Структура стероидных гормонов, которые использовались в данной работе.
Проведенные нами эксперименты показали, что инкубация с комплексом ТГК-апоА-I дуплексов комплементарных олигонуклеотидов приводит к появлению S1-нуклеазочувствительных участков, чего не наблюдается для необработанных комплексом ТГК-апоА-I комплементарных дуплексов. Олигонуклеотиды, имеющие Аn-последовательности на 5`-конце, оказались более подвержены гидролизу нуклеазой S1 и ДНКазой I, чем олигонуклеотиды, имеющие Тn-последовательности на 3`-конце или олигонуклеотиды, не имеющие Тn- и Аn-последовательностей на 3`- и 5`-концах, соответственно.
При предварительной обработке комплементарных дуплексов комплексом кортизол-апоА-I не наблюдалось появления S1-нуклеазочувствительных участков. По-видимому, различие в действии комплексов апоА-I с ТГК и кортизолом связано с отсутствием ОН-группы в А-кольце у кортизола (рис. 3), что приводит к другой конформации комплекса стероидный гормон-апоА-I.
Ниже представлены результаты гидролиза олигонуклеотидов (рис. 1) и их дуплексов, инкубированных с комплексами ТГК-апоА-I (рис. 4 и 6) и кортизол-апоА-I (рис. 5 и 7), нуклеазой S1 и ДНКазой I.
Дуплекс Г1•Г2, образованный комплементарными олигонуклеотидами Г1 и Г2 (рис. 4, дор. 1), инкубировали с комплексом ТГК-апоА-I при молярных соотношениях дуплекс : комплекс 1:0,5 (дор. 3) и 1:2 (дор. 4), затем обрабатывали нуклеазой S1 (дор. 2, 3 и 4). Олигонуклеотиды Г1 и Г2 (рис. 4, дор. 5 и 9, соответственно) также предварительно инкубировали с комплексом ТГК-апоА-I при молярных соотношениях дуплекс : комплекс 1:0,5 (дор. 7 и 11) и 1:2 (дор. 8 и 12), затем обрабатывали нуклеазой S1 (дор. 6-8 и 10-12). Дорожки 1, 5 и 9 – контрольные.
Как следует из рис. 4, нуклеаза S1 практически полностью расщепляет однонитевые олигонуклеотиды Г1 (дор. 6) и Г2 (дор. 10), в то время как дуплекс Г1•Г2 остается негидролизованным (дор. 2), что соответствует литературным данным (Vogt V. M., 1973).

—XC
—BP
Продукты
гидролиза
нуклеазой S1



1 2 3 4 5 6 7 8 9 10 11 12


Рис. 4. Радиоавтограф 20% ПААГ после разделения электрофорезом продуктов гидролиза олигонуклеотидов Г1 и Г2 и их дуплекса Г1•Г2 нуклеазой S1 в присутствии и в отсутствие комплекса ТГК-апоА-I.
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3);
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3) + нуклеаза S1;
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 при молярном соотношении дуплекс : комплекс – 1:0,5;
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:2);
- Г1 (5`-CC(gCC)3);
- Г1 (5`-CC(gCC)3) + нуклеаза S1;
- Г1 (5`-CC(gCC)3) + [ТГК-апоА-I] + нуклеаза S1, при молярном соотношении олигонуклеотид : комплекс – 1:0,5;
- Г1 (5`-CC(gCC)3) + [ТГК-апоА-I] + нуклеаза S1 (1:2);
- Г2 (5`-gg(Cgg)3);
- Г2 (5`-gg(Cgg)3) + нуклеаза S1;
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:0,5);
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:2).
Предварительная инкубация олигонуклеотидов Г1 и Г2 с комплексом ТГК-апоА-I защищает их от действия нуклеазы S1 (рис. 4, дор. 7-8, 11-12), причем, чем выше концентрация комплекса, тем лучше защита. Данный вывод был сделан при сравнении интенсивности окрашивания пятен на радиавтографе в дорожках 7-8 и 11-12, в которых молярное соотношение олигонуклеотид : комплекс (где олигонуклеотид Г1 или Г2) увеличивается от 1:0,5 (дор. 7 и 11) до 1:2 (дор. 8 и 12), соответственно. При предварительной обработке дуплекса Г1•Г2 комплексом ТГК-апоА-I наблюдается образование S1-нуклеазочувствительных участков, что видно по накоплению продуктов гидролиза в дор. 3 (рис. 4).
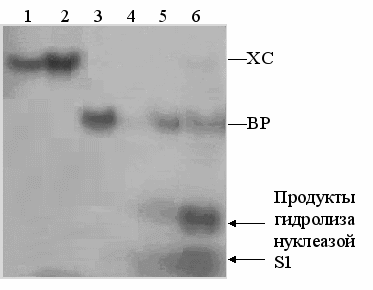
Рис. 5. Радиоавтограф 20% ПААГ после разделения электрофорезом продуктов гидролиза олигонуклеотида Г2 и дуплекса Г1•Г2 нуклеазой S1 в присутствии и в отсутствие комплекса кортизол-апоА-I.
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3) + [кортизол-апоА-I] при молярном соотношении дуплекс : комплекс, равном 1:2;
- Г1•Г2 (5`-CC(gCC)35`-gg(Cgg)3) + [кортизол-апоА-I] + нуклеаза S1 (1:2);
- Г2 (5`-gg(Cgg)3);
- Г2 (5`-gg(Cgg)3) + нуклеаза S1;
- Г2 (5`-gg(Cgg)3) + [кортизол-апоА-I] + нуклеаза S1 (1:2);
- Г2 (5`-gg(Cgg)3) + [кортизол-апоА-I] + нуклеаза S1 (1:0,5).
Дуплекс Г1•Г2, инкубированный с комплексом кортизол-апоА-I при молярном соотношении дуплекс : комплекс, равном 1:2 (рис. 5, дор. 1 и 2), обрабатывали нуклеазой S1 (дор. 2). Олигонуклеотид Г2 (рис. 5, дор. 3) инкубировали с комплексом кортизол-апоА-I при молярных соотношениях олигонуклетид : комплекс 1:0,5 (дор. 6) и 1:2 (дор. 5), затем обрабатывали нуклеазой S1 (дор. 4). Дорожки 1 и 3 – контрольные.
Как следует из рис. 5, нуклеаза S1 полностью расщепляет однонитевой олигонуклеотид Г2 (дор. 4), в то время как дуплекс Г1•Г2 остается негидролизованным (дор. 2). Для того, чтобы обнаружить возможные продукты гидролиза дуплекса Г1•Г2 нуклеазй S1, на 2-ую дорожку (рис. 5) наносили 2- кратную пробу. Предварительная обработка олигонуклеотида Г2 комплексом кортизол-апоА-I защищает его от действия нуклеазы S1 (дор. 5 и 6), причем при увеличении концентрации комплекса кортизол-апоА-I увеличивается защита от действия S1 нуклеазы, как это наблюдалось при инкубации Г2 с комплексом ТГК-апоА-I (рис. 4, дор. 7-8, 11-12), т.к. увеличивается количество исходного негидролизованного Г2 при увеличении концентрации комплекса (рис. 5, сравн. дор. 5 и 6). При предварительной обработке дуплекса Г1•Г2 комплексом кортизол-апоА-I не наблюдается образования S1-нуклеазочувствительных участков (рис. 5, дор. 2) в отличие от взаимодействия этого же дуплекса с комплексом ТГК-апоА-I (рис. 4, дор. 3-4).

Рис. 6. Радиоавтограф 15% ПААГ после разделения электрофорезом в 6 М мочевине продуктов гидролиза олигонуклеотидов Г2Т6 и Г2 нуклеазой S1 в присутствии и в отсутствие комплекса ТГК-апоА-I.
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] + нуклеаза S1, при молярном соотношении олигонуклеотид : комплекс – 1:4, соответственно;
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] + нуклеаза S1 (1:2);
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] + нуклеаза S1 (1:0,5);
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:0,5);
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:2);
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] + нуклеаза S1 (1:4);
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] (1:2);
- Г2 (5`-gg(Cgg)3) + [ТГК-апоА-I] (1:2);
- Г2Т6 (5`-gg(Cgg)3T6) + нуклеаза S1;
- Г2 (5`-gg(Cgg)3) + нуклеаза S1;
- Г2Т6 (5`-gg(Cgg)3T6);
- Г2 (5`-gg(Cgg)3).
Аналогичные результаты были получены нами и для остальных олигонуклеотидов (рис. 1), использовавшихся в работе.
Олигонуклеотид Г2Т6 (рис. 6, дор. 11) предварительно инкубировали с комплексом ТГК-апоА-I при молярных соотношениях олигонуклеотид : комплекс 1:0,5 (дор. 3), 1:2 (дор. 2) и 1:4 (дор. 1) и обрабатывали нуклеазой S1. В контрольном эксперименте олигонуклеотид Г2Т6 инкубировали с комплексом ТГК-апоА-I при молярном соотношении олигонуклеотид : комплекс, равном 1:2 (дор. 7), не подвергая гидролизу нуклеазой S1.
Олигонуклеотид Г2 (рис. 6, дор. 12) обрабатывали нуклеазой S1 (дор. 10), предварительно инкубируя с комплексом ТГК-апоА-I при молярных соотношениях олигонуклеотид : комплекс 1:0,5 (дор. 4), 1:2 (дор. 5) и 1:4 (дор. 6). В контрольном опыте олигонуклеотид Г2 инкубировали с комплексом ТГК-апоА-I при молярном соотношении олигонуклеотид : комплекс, равном 1:2 (рис. 6, дор 8), не подвергая гидролизу нуклеазой S1. Дорожки 11 и 12 содержат контрольные образцы олигонуклеотидов.
Как следует из рис. 6, обработка олигонуклеотидов комплексом ТГК-апоА-I защищает их от действия нуклеазы S1 (дор. 1-6). При увеличении концентрации комплекса усиливается защита Г2 (дор. 4-6), в то время как для Г2Т6 (дор. 3-1) наблюдается необычная закономерность. При увеличении концентрации комплекса олигонуклеотид более подвержен гидролизу нуклеазой S1. Это можно увидеть при сравнении дорожек 3-1 и 4-6, в которых молярное соотношение олигонуклеотид : комплекс увеличивается от 1:0,5 до 1:4, соответственно.
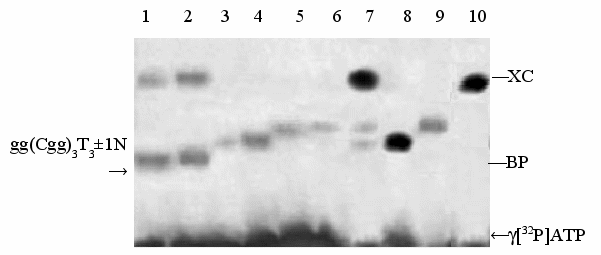
Рис. 7. Радиоавтограф 15% ПААГ после разделения электрофорезом олигонуклеотидов Г1А6, Г2Т6 и их дуплекса Г1А6•Г2Т6, инкубированных с комплексом стероидный гормон-апоА-I (где стероидный гормон ТГК или кортизол) и нуклеазами S1 (Vogt V.M., 1973) и ДНКазой I (время инкубации 2 часа).
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + [ТГК-апоА-I] + ДНКаза I, при молярном соотношении дуплекс : комплекс – 1:0,5, соответственно;
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + [ТГК-апоА-I] + ДНКаза I, (1:2);
- Г1А6 (5`-А6CC(gCC)3) + [ТГК-апоА-I] + нуклеаза S1, при молярном соотношении олигонуклеотид : комплекс – (1:0,5);
- Г1А6 (5`-А6CC(gCC)3) + [ТГК-апоА-I] + S1, (1:2);
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] + S1, (1:0,5);
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоА-I] + S1, (1:2);
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + [ТГК-апоА-I] (1:0,5);
- Г1А6 (5`-А6CC(gCC)3);
- Г2Т6 (5`-gg(Cgg)3T6);
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + [кортизол-апоА-I] (1:0,5).
Кроме этого наблюдается образование фрагмента Г2Т6, связывающего комплекс ТГК-апоА-I, и недоступного действию нуклеазы S1 (рис. 6, дор. 3).
Дуплекс Г1А6•Г2Т6 инкубировали с комплексом ТГК-апоА-I при молярных соотношениях дуплекс : комплекс 1:0,5 (рис. 7, дор. 1) и 1:2 (дор. 2), затем обрабатывали ДНКазой I. Дуплекс Г1А6•Г2Т6 инкубировали с комплексами ТГК-апоА-I или кортизол-апоА-I при молярном соотношении дуплекс : комплекс, равном 1:0,5 (рис. 7, дор. 7 и 10, соответственно) не подвергая их гидролизу нуклеазами. Олигонуклеотиды Г1А6 и Г2Т6 (рис. 7, дор. 8 и 9, соответственно) инкубировали с комплексом ТГК-апоА-I при молярных соотношениях олигонуклеотид : комплекс 1:0,5 (дор. 3 и 5) и 1:2 (дор. 4 и 6), затем обрабатывали нуклеазой S1.
Как следует из рис. 7, обработка дуплекса Г1А6•Г2Т6 комплексом ТГК-апоА-I (дор. 7) приводит к «расплетанию» дуплекса Г1А6•Г2Т6. Это подтверждается образованием олигонуклеотидов, имеющих одинаковую с исходными олигонуклеотидами Г1А6 (дор. 8) и Г2Т6 (дор. 9) электрофоретическую подвижность. В то же время обработка данного дуплекса комплексом кортизол-апоА-I (дор. 10) не приводит к такому результату.

Рис. 8. Радиоавтограф 15% ПААГ после разделения электрофорезом в 6 М мочевине олигонуклеотидов Г1А6 и Г2Т6 и дуплекса Г1А6•Г2Т6, инкубкированных с комплексом ТГК-апоA-I и ДНКазой I (время инкубации 30 мин.).
- Г1А6 (5`-А6CC(gCC)3);
- Г1А6 (5`-А6CC(gCC)3) + ДНКаза I (0,75 нг/мл реакционной смеси);
- Г1А6 (5`-А6CC(gCC)3) + ДНКаза I (0,5 нг/мл реакционной смеси);
- Г1А6 (5`-А6CC(gCC)3) + [ТГК-апоA-I] + ДНКаза I(0,5 нг/мл реакционной смеси), при молярном соотношении олигонуклеотид : комплекс – 1:0,5;
- Г2Т6 (5`-gg(Cgg)3T6) + ДНКаза I (0,75 нг/мл реакционной смеси);
- Г2Т6 (5`-gg(Cgg)3T6) + ДНКаза I (0,5 нг/мл реакционной смеси);
- Г2Т6 (5`-gg(Cgg)3T6) + [ТГК-апоA-I] + ДНКаза I(0,5 нг/мл реакционной смеси), (1:0,5);
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + ДНКаза I (0,75 нг/мл реакционной смеси);
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + ДНКаза I (0,5 нг/мл реакционной смеси);
- Г1А6•Г2Т6 (5`-А6CC(gCC)35`-gg(Cgg)3T6) + [апоA-I – ТГК] + ДНКаза I (0,5 нг/мл реакционной смеси), (1:0,5).
Из рис. 7 также следует, что олигонуклеотид Г1А6 гидролизуется легче, чем Г2Т6 (сравн. дор. 3 и 5). Вероятно, это связано со стабилизацией самокомплементарных gC-структур Tn-последовательностью, находящейся на 3`-конце.
Олигонуклеотиды Г1А6 (рис. 8, дор. 1) и Г2Т6 инкубировали с комплексом ТГК-апоА-I при молярном соотношении олигонуклеотид : комплекс, равном 1:0,5 (дор. 4 и 7, соответственно) и обрабатывали ДНКазой I при концентрации ДНКазы I 0,5 нг/мл реакционной смеси (рис. 8, дор. 4 и 7). Известно, что 0,5 мкг свежего фермента ДНКазы I полностью разрушают 5 мг ДНК тимуса теленка за 10 мин. при комнатной температуре (Sambrook J., et al., 1989), т.е. реакционные смеси содержали фермент в количестве, достаточном для полного гидролиза олигонуклеотида (менее 50 нг). Аналогичный эксперимент проводили с дуплексом Г1А6•Г2Т6 (рис. 8, дор. 8-10).
Как следует из рис. 8, Г1А6 в отсутствие комплекса гидролизуется полностью в выбранных условиях (дор. 1-3) и несколько защищается комплексом ТГК-апоА-I (дор. 4), тогда как Г2Т6 мало подвержен разрушению ДНКазой I (дор. 5-7).
Известно, что ДНКаза I гидролизует связи пурин-пиримидин (Sambrook J., et al., 1989). При поиске сведений о строгой нуклеотидной специфичности данного фермента в литературных источниках нами ничего не было найдено. Таким образом, можно сказать, что gC-структуры, содержащие Аn-последовательности (где n=3 или 6) на 5`-конце, гидролизуются ДНКазой I в выбранных условиях эффективно (рис. 7, дор. 1-4), тогда как gC-структуры, содержащие Тn-последовательности (где n=3 или 6) на 3`-конце, меньше подвержены разрушению ДНКазой I (рис. 8, дор. 5-7). Вероятно, это связано со стабилизацией самокомплементарных gC-структур Tn-последовательностью.
Нами было обнаружено, что при метилировании комплементарных олигонуклеотидных дуплексов, выявленных в составе ДНК и используемых в данной работе, способность комплекса ТГК-апоА-I защищать их от действия ДНКазы I усиливается, т.е. метилирование оснований в комплементарных дуплексах не препятствует связыванию с комплексом ТГК-апоА-I.
Из литературных данных известно, что в эукариотических клетках степень метилирования ДНК часто коррелирует со степенью экспрессии гена (Гвоздев В. А., 1996). Показано, что метилируется, в основном, цитозин, находящийся после гуанозина, образуя 5-метилцитозин (Jeltsch A., 2002). Для метилирования олигонуклеотидов использовали M.Fsp4HI – фермент, катализирующий метилирование азотистых оснований в gC-содержащих последовательностях. Для подтверждения факта метилирования ДНК или олигонуклеотидных дуплексов использовали рестиктазу Fsp4HI – фермент, расщепляющий ДНК по неметилированным gC-содержащим последовательностям.
На рис. 9 представлены результаты гидролиза ДНКазой I и рестриктазой Fsp4HI неметилированного и метилированного дуплекса Г1А3•Г2Т3 в присутствии или в отсутствие комплекса ТГК-апоА-I.
Дуплекс Г1А3•Г2Т3 инкубировали с ДНКазой I (рис. 9, дор. 4) или рестриктазой Fsp4HI (дор. 5), предварительно обработав комплексом ТГК-апоА-I при молярном соотношении дуплекс : комплекс, равном 1:4 (дор. 7).
Дуплекс Г1А3•Г2Т3, метилированный с помощью MFsp4HI, подвергали действию рестриктазы Fsp4HI (рис. 9, дор. 6) или ДНКазы I в течение 2 часов (дор. 8), предварительно инкубируя с комплексом ТГК-апоА-I при молярном соотношении дуплекс : комплекс, равном 1:4 (дор. 9, 10). Дорожки с 1 по 3 - контрольные.
Как следует из рис. 9, метилирование дуплекса Г1А3•Г2Т3 размером 14 п.о. осуществляется (сравн. дор. 5 и 6) с помощью фермента MFsp4HI, предназначенного для полимерной ДНК. Метилирование оснований в дуплексе Г1А3•Г2Т3 уменьшает действие ДНКазы I (сравн. дор. 4 и 8); видно, что остается больше негидролизованного дуплекса на дор. 8. Комплекс ТГК-апоA-I связывается с дуплексом после метилирования его оснований, т.к. на рис. 9 видно, что он защищает метилированный дуплекс от гидролиза ДНКазой I (сравн. дор. 8 и 9) даже в большей степени, чем неметилированный (сравн. дор. 7 и 9).
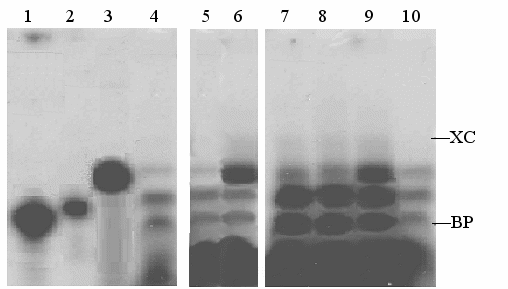
Рис. 9. Радиоавтограф 15% ПААГ после разделения электрофорезом в 6 М мочевине олигонуклеотидов Г1А3, Г2Т3 и дуплекса Г1А3•Г2Т3, инкубированных с MFsp4HI, комплексом ТГК-апоA-I, ДНКазой I и Fsp4HI.
- Г1А3 (5`-A3CC(gCC)3);
- Г2Т3 (5`-gg(Cgg)3T3);
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3);
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + ДНКаза I;
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + Fsp4HI;
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + MFsp4HI+ Fsp4HI;
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + [ТГК-апоА-I] + ДНКаза I, при молярном соотношении дуплекс : комплекс – 1:4, соответственно;
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + MFsp4HI + ДНКаза I;
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + MFsp4HI + [ТГК-апоА-I] + ДНКаза I (дуплекс : комплекс – 1:4);
- Г1А3•Г2Т3 (5`-A3CC(gCC)35`-gg(Cgg)3T3) + MFsp4HI + [ТГК-АпоА-I] + ДНКаза I + Fsp4HI (дуплекс : комплекс – 1:4).
Известно, что метилирование ДНК способствует связыванию в районе промотора белков, подавляющих транскрипцию (Schäfer C. et al., 2007).
Наши данные по связыванию метилированных дуплексов Г1А3Г2Т3 с комплексом ТГК-апоА-I указывают на способность этого комплекса влиять на регуляцию транскрипции и в районах метилированных участков генома.
Нуклеотидная специфичность и минимально достаточная нуклеотидная последовательность, взаимодействующая с комплексом ТГК-апоА-I
Нуклеотидная последовательность, связывающая комплекс ТГК-апоА-I, становится недоступной действию нуклеазы S1 и ДНКазы I и представляет собой последовательность gg(Cgg)3T3±1N. Этот вывод сделан на основании появления при обработке дуплекса Г1А6•Г2Т6 ДНКазой I олигонуклеотида, защищенного от действия фермента, с большей электрофоретической подвижностью, чем у исходных олигонуклеотидов Г1А6 и Г2Т6 (рис. 7, дор. 1 и 2). Данный результат дублируется при обработке олигонуклеотидов нуклеазой S1, что было показано на рис. 6 (дор. 3). Кроме этого, по электрофоретической подвижности данный олигонуклеотид примерно соответствует 13-15 N (Мазин А. В., Кузнеделов К. Д., 1986).
Это подтверждает ранее полученные результаты об образовании одноцепочечных участков в gC-богатых районах ДНК под влиянием комплекса ТГК-апоА-I (Кузнецов П. А. и др. 2000, Панин Л. Е. и др., 2002).
Наличие открытых последовательностей ДНК в хроматине и возможность их аффинной модификации производными олигонуклеотидов были показаны в работе (Chernolovskaya E. L. et al., 1992).
В литературе описаны S1-нуклеазочувствительные участки в промоторных районах некоторых генов (Santra M. et al., 1994, Wang Z. Y. et al., 1993, McKeon C. et al., 1984). Известно также, что промоторы многих генов общего метаболизма являются gC-богатыми (Holmquist G., 1988). Поиск по компьютерным базам данных последовательностей вида (gCC/Cgg)n показал, что данные последовательности встречаются во всех структурах генома: экзонах, интронах, 5`- и 3`-нетранслируемых районах и довольно часто – в промоторных районах. Это важно для понимания функции исследуемого нами комплекса и роли сайтов их связывания, учитывая, что промоторные районы многих конститутивно экспрессирующихся генов свободны от нуклеосомной укладки.
Влияние комплексов стероидный гормон-апоА-I на транскрипцию ДНК и хроматина
Паниным Л.Е. и соавторами (2002) было показано, что комплексы стероидный гормон-апоА-I (где стероидный гормон - ТГК, АС, ДЭА, ДЭАС) вызывают увеличение биосинтеза белка в культивируемых гепатоцитах. Скорее всего, эффективность взаимодействия неодинакова для разных гормонов и для изучения данного аспекта необходимы эксперименты на модельных ДНК. Также следует учитывать, что в живой клетке эффект стимуляции биосинтеза белка комплексом стероидный гормон-апоА-I развивается на фоне активации хроматина и лизосомального аппарата клетки. Показано, что апоА-I увеличивает проницаемость лизосомальных мембран, облегчает проникновение лизосомальных протеиназ в ядро клетки. Показано также, что гепатоцит способен захватывать протеиназы макрофагального происхождения из межклеточного пространства (Панин Л. Е., 1998).
На основании проведенных нами экспериментов можно заключить, что комплекс ТГК-апоА-I in vitro активирует синтез РНК на ДНК-матрице выполняя роль, подобную роли фактора, изменяющего структуру ДНК, что приводит к дозозависимой активации транскрипции ДНК крысы, катализируемой гомологичными РНК-полимеразами белкового экстракта из ядер клеток печени, однако, при 200-кратном молярном избытке комплекса транскрипция полностью ингибируется.
В таблице представлены результаты по синтезу 32Р-транскриптов в присутствии ТГК как в составе комплекса с апоА-I, так и без него в условиях реакции транскрипции, катализируемой РНК-полимеразами белкового экстракта из ядер клеток печени крысы. В качестве матрицы использовалась ДНК крысы Вистар или ДНК в составе хроматина из ядер клеток печени крысы той же линии.
Таблица
Синтез 32Р-транскриптов в присутствии комплекса ТГК-апоA-I, катализируемый РНК-полимеразами белкового экстракта из ядер клеток печени крысы. Матрица - ДНК крысы.
| № | ДНК/ комплекс ТГК-апоА-I | Р32-транскрипты, относительное кол-во, % | |||||
| Опыт 1 (контроль) | Опыт 2 | Опыт 3 | Опыт 4 | Опыт 5 | Опыт 6 | ||
| 1 | Без комплекса | 100 | 100 | 100 | 100 | 100 | 100 |
| 2 | 1:5, моль/моль | 110 | 109 | 108 | 107 | - | 108 |
| 3 | 1:10 | 118 | 116 | 112 | 111 | - | 117 |
| 4 | 1:50 | 89 | 86 | 89 | 86 | 91 | 87 |
| 5 | 1:100 | 42 | 45 | 47 | 48 | 41 | 46 |
| 6 | 1:200 | 0 | 0 | 0 | 0 | 0 | 0 |
| 7 | ДНК/ТГК, 1:200 | 16 | 27 | 21 | 24 | 23 | - |
Примечание: № – номер дорожки, опыт 6 – матрица – ДНК в составе хроматина.
n=5, Р0,05; где n – количество выборки, Р – достоверность различий по сравнению с контролем.
Как следует из таблицы, при увеличении молярного избытка комплекса ТГК-апоА-I над ДНК до 5- и 10-кратного транскрипция активируется, а начиная с 50-кратного, происходит ингибирование транскрипции ДНК. ТГК вне комплекса с апоА-I также способен ингибировать транскрипцию ДНК.
На рис. 10 представлены результаты влияния комплексов стероидный гормон–апоА-I (где стероидный гормон – ТГК или кортизол) на транскрипцию ДНК. В условиях реакции транскрипции ДНК (рис. 10, дор. 2) предварительно инкубировали с комплексами ТГК-апоА-I (дор. 1) или кортизол-апоА-I (дор. 3) при молярном соотношении ДНК : комплекс, равном 1:10.
Связывание ДНК с комплексами ТГК-апоА-I или кортизол-апоА-I подтверждается изменением результатов реакции транскрипции после инкубации с комплексами ТГК-апоА-I (рис. 10, дор. 1) или кортизол-апоА-I (дор. 3) и без инкубации с комплексами (дор. 2).
Как следует из рис. 10 и табл. 1, комплекс ТГК-апоА-I активирует транскрипцию ДНК, т.к. увеличивается относительное содержание синтезированных 32Р-транскриптов с увеличением концентрации комплекса ТГК-апоA-I до молярного соотношения ДНК : комплекс, равного 1:10 (табл. 1, № дор. 1-3). Кроме того наблюдается образование транскриптов определенной длины (~70-53 N для верхнего пятна и ~12-15 N для нижнего пятна) (рис. 10, дор. 1), в то время как в контроле в отсутствие комплекса ТГК-апоA-I образуются транскрипты различной длины (дор. 2), т.е. совершенно меняется картина транскрипции. Комплекс кортизол-апоА-I не оказывает подобного влияния на транскрипцию ДНК (рис. 10, дор. 3).

Рис. 10. Транскрипция ДНК крысы, катализируемая РНК-полимеразами белкового экстракта из ядер клеток печени крысы. Радиоавтограф 15% ПААГ после разделения электрофорезом 32Р-транскриптов суммарной РНК, образовавшейся в процессе реакции транскрипции в присутствии и в отсутствие комплекса стероидный гормон-апоА-I (где стероидный гормон – ТГК или кортизол).
- ДНК в условиях реакции транскрипции + [ТГК-апоA-I], при молярном соотношении ДНК : комплекс – 1:10;
- ДНК в условиях реакции транскрипции;
- ДНК в условиях реакции транскрипции + [кортизол-апоA-I], при молярном соотношении ДНК : комплекс – 1:10.
При проведении данного опыта на хроматине, выделенном в нашей лаборатории с участием Базалук В. В. по методу (Dignam J.D., 1983), были получены аналогичные результаты (табл. 1, опыт 6, № дор. 1-3).
На рис. 11 представлена схема дозозависимого влияния комплекса ТГК-апоА-I на транскрипцию ДНК.
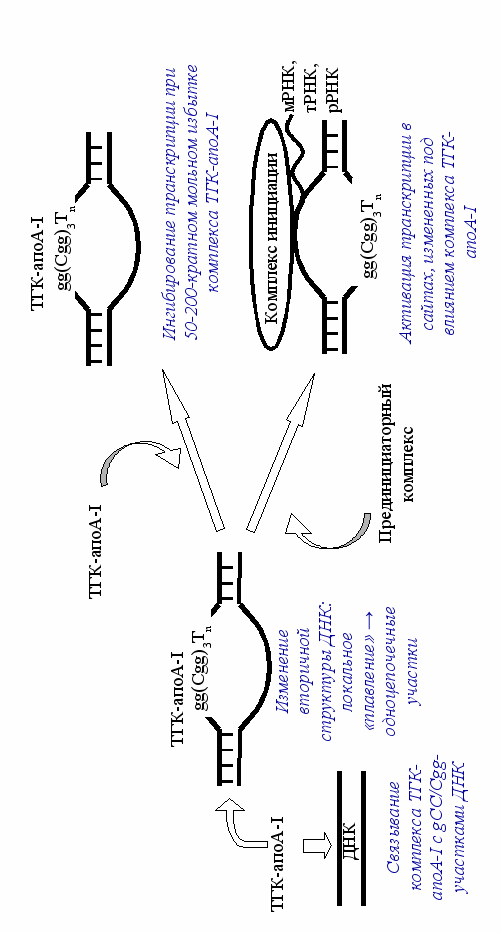
Рис. 11. Схема дозозависимого влияния комплекса ТГК-апоА-I на транскрипцию ДНК
ВЫВОДЫ
- Аполипопротеин A-I связывается с дезоксирибоолигонуклеотидами (11N-21N) как в составе комплексов с кортизолом и тетрагидрокортизолом, так и в свободном состоянии.
- Комплементарные дуплексы CCgCCgCCgCCggCggCggCgg и AnCCgCCgCCgCCggCggCggCggTn (n = 3 и 6) становятся чувствительными к нуклеазе S1 при взаимодействии с комплексом тетрагидрокортизол-аполипопротеин A-I; комплекс кортизол-апоА-I такого действия не оказывает. Олигонуклеотиды AnCC(gCC)3 в присутствии комплекса тетрагидрокортизол-апоA-I более подвержены гидролизу нуклеазой S1, чем gg(Cgg)3Tn (n = 3 и 6). Комплекс тетрагидрокортизол-апоA-I связывается с комплементарными дуплексами после метилирования его азотистых оснований.
- Олигонуклеотиды gg(Cgg)3Tn (n = 3 и 6) избирательно связываются с комплексом тетрагидрокортизол-аполипопротеин A-I как в свободном состоянии, так и в составе комплементарного дуплекса, становясь недоступными действию нуклеазы S1 и ДНКазы I.
- Минимально достаточная для связывания комплекса тетрагидрокортизол-апоA-I нуклеотидная последовательность, недоступная действию нуклеаз, представляет собой 5`-gg(Cgg)3T3±1N.
- Комплекс тетрагидрокортизол-аполипопротеин А-I дозозависимо активирует транскрипцию in vitro ДНК крысы (при молярных соотношениях ДНК : комплекс от 1:5 до 1:10), катализируемую гомологичными РНК-полимеразами; однако, при 200-кратном молярном избытке комплекса транскрипция ингибируется полностью. Комплекс тетрагидрокортизол-апоА-I способен in vitro играть роль, подобную роли фактора, изменяющего структуру ДНК в процессе транскрипции.
СПИСОК ОСНОВНЫХ ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Velichko E. Ju., Gimautdinova O. I. Interaction sites of eukaryotic DNA with the steroid hormone - apolipoprotein A-I complexes // The BGRS Intern. School of Young Scientists.-Russia, Novosibirsk, 2005.
- Gimautdinova O. I., Velichko E. Ju., Panin L. E. The role of DNA GCC elements binding the steroid-apoAI complex in stress conditions // Second Intern. Interdisciplinary Congress “Neuroscience for Medicine and Psychology”. -Ukraina, Sudak, 2006. – P. 78-80.
- Панин Л. Е., Гимаутдинова О. И., Кузнецов П. А., Величко Е. Ю., Базалук В. В. Структура сайтов взаимодействия ДНК эукариот с комплексами стероидный гормон-аполипопротеин A-I // Молек. биол. – 2007. – Т. 41, № 4. – С. 647-653.
- Гимаутдинова О. И., Величко Е. Ю., Базалук В. В. Функциональная роль GCC/GGC последовательностей при воздействии на ДНК метаболитов стероидных гормонов в комплексе с апоАI // Бюллетень СО РАМН. – 2007. – № 6. – С. 38-40.
Список сокращений и обозначений
BP – бромфеноловый синий;
Fsp4HI – эндонуклеаза рестрикции с сайтом узнавания GCNGC или CGNCG;
M.Fsp4HI - ДНК-метилтрансфераза из Flavobacterium species 4HI;
N – любой рибонуклеотид;
NTP – любой рибонуклеозидтрифосфат;
SAM – S-аденозил-L-метионин;
XC – ксиленцианол;
апоА-I – аполипопротеин А-I;
апоЛП – аполипопротеины;
апоЛПВП – аполипопротеины из липопротеинов высокой плотности;
АС, ДЭА, ДЭАС – андростерон, дегидроэпиандростерон дегидроэпиандростерон-сульфат, соответственно;
БЯЭ – белковый экстракт из ядер клеток печени крыс;
ПААГ – полиакриламидный гель;
ТГК – тетрагидрокортизол;
ТФ – транскрипционный фактор.
Соискатель Е. Ю. Величко
