Молекулярно-генетическая характеристика индивидуального района интеркалярного гетерохроматина 75С1-2 политенных хромосом дрозофилы 03. 02. 07 генетика
| Вид материала | Автореферат диссертации |
- Характер изменения функционально активных участков и компактности политенных хромосом, 364.37kb.
- Молекулярно-генетическая природа первичных гемофагоцитарных лимфогистиоцитозов в россии, 381.26kb.
- Проведение опытов по моногибридному скрещиванию дрозофил, 55.8kb.
- Рабочая программа и календарно-тематический план по дисциплине «цитогенетика» специальности, 126.42kb.
- Клинико-генетическая характеристика преэклампсии 03. 00. 15 Генетика 14. 00. 01- акушерство, 260.13kb.
- Лекция 23. Генетика человека. Генетика популяций Методы изучения генетики человека, 101.01kb.
- Государственное санитарно-эпидемиологическое нормирование Российской Федерации, 861.79kb.
- Тема 1,2 «Оплодотворение», 85.94kb.
- 2. Доклад "Молекулярно-генетическая классификация рака молочной железы" (Е. В. Ткаченко), 16.33kb.
- Л. И. Параллелизмы в молекулярной организации генома и проблемы эволюции. В кн.: Молекулярные, 251.18kb.
На правах рукописи
АНДРЕЕНКОВА НАТАЛЬЯ ГРИГОРЬЕВНА
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ХАРАКТЕРИСТИКА ИНДИВИДУАЛЬНОГО РАЙОНА ИНТЕРКАЛЯРНОГО ГЕТЕРОХРОМАТИНА 75С1-2 ПОЛИТЕННЫХ ХРОМОСОМ ДРОЗОФИЛЫ
03.02.07 генетика
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Новосибирск
2010
Работа выполнена в лаборатории молекулярной цитогенетики Учреждения Российской академии наук Институте цитологии и генетики СО РАН и в лаборатории молекулярной цитогенетики Отдела молекулярной и клеточной биологии Учреждения Российской академии наук Институте фундаментальной медицины и химической биологии СО РАН, г. Новосибирск.
Научный руководитель: академик РАН, доктор биологических наук, профессор
Жимулев И. Ф.,
Институт химической биологии и
фундаментальной медицины СО РАН,
г. Новосибирск
Официальные оппоненты: доктор биологических наук, профессор
Высоцкая Л. В.
Новосибирский Государственный
Университет,
г. Новосибирск
кандидат биологических наук,
Елисафенко Е. А.
Института цитологии
и генетики СО РАН, г. Новосибирск
Ведущее учреждение: Институт молекулярной биологии РАН,
г. Москва
Защита диссертации состоится «__» ________ 2010 г. на утреннем заседании диссертационного совета по защите диссертаций на соискание ученой степени доктора наук Д 003.011.01 в Институте цитологии и генетики СО РАН в конференц-зале института по адресу: 630090, г. Новосибирск, проспект Лаврентьева, 10, тел. (383)-333-12-78, e-mail: dissov@bionet.nsc.ru
С диссертацией можно ознакомиться в библиотеке Института цитологии и генетики СО РАН.
Автореферат разослан «__» __________2010 г.
Ученый секретарь
диссертационного совета,
доктор биологических наук Т.М. Хлебодарова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Одним из важнейших направлений современной клеточной биологии является изучение регуляции активности генов в контексте структуры хроматина. К этому направлению относится исследование молчащих хромосомных доменов. Кроме прицентромерных районов хромосом, которые состоят, в основном, из повторенной ДНК и почти не содержат генов (прицентромерный гетерохроматин, ПГХ), к молчащим районам относят также районы интеркалярного гетерохроматина (ИГХ). В политенных хромосомах слюнных желез D. melanogaster эти сравнительно небольшие районы разбросаны по плечам хромосом (обзор: Zhimulev I.F. et al., 2003a) и часто содержат кластеры уникальных тканеспецифичных генов со сходными профилями транскрипции (Belyakin S.N. et al., 2005; 2010).
Общими свойствами молчащих районов являются репрессия транскрипции, плотная упаковка хроматина и поздняя репликация ДНК в S-фазе клеточного цикла. В политенных хромосомах эти районы также демонстрируют недорепликацию ДНК, которая приводит к разломам и эктопическим контактам между разными районами гетерохроматина (Zhimulev I.F. et al., 2003a). Маркером районов прицентромерного и интеркалярного гетерохроматина в политенных хромосомах слюнных желез дрозофилы является белок SUUR, продукт гена SuUR (Suppressor of Underreplication). Фенотип мутации SuUR - подавление недорепликации в гетерохроматиновых районах политенных хромосом – обусловлен тем, что все районы интеркалярного гетерохроматина и некоторые прицентромерные районы заканчивают репликацию существенно раньше, чем в норме. Механизмы влияния гена SuUR на репликацию ДНК пока неизвестны (Belyaeva E.S. et al., 1998; обзоры: Zhimulev I.F. et al., 2003a; Колесникова Т.Д. и др., 2006).
Несмотря на интенсивное изучение белкового состава и механизмов репликации районов ИГХ дрозофилы, в настоящее время организация этих районов и даже их функции остаются в большинстве случаев неизвестными. Одна из проблем, стоящих перед исследователями, это отсутствие данных о локализации цитологически определяемых районов ИГХ на физической карте генома дрозофилы. В результате до сих пор можно говорить лишь об очень приблизительном соответствии плотных дисков политенных хромосом, которые демонстрируют разломы, и районов поздней репликации и недорепликации, обнаруженных молекулярными методами в различных геномных исследованиях. Изучение дисков политенных хромосом методами молекулярной биологии во многих случаях сильно затруднено. К тому же невозможно точно определить, какие гены находятся в дисках ИГХ политенных хромосом. Сравнение свойств этих районов в диплоидных тканях и в тканях с политенными хромосомами также оказывается невозможным.
Сейчас очень быстро развивается техника исследования распределения белков, времени репликации и профилей экспрессии генов на уровне целых геномов. Однако из-за неудобства работы с ДНК неделящихся полиплоидных клеток, внутренняя организация районов ИГХ в политенных хромосомах остается почти неизученной. Непонятно, являются ли эти районы цельными структурами или состоят из отдельных частей, независимо демонстрирующих свойства гетерохроматина.
Цели и задачи работы. Цель работы – провести детальный цитогенетический анализ индивидуального района интеркалярного гетерохроматина политенных хромосом слюнных желез дрозофилы. В данной работе был исследован район 75С1-2. Для достижения цели нами были поставлены следующие задачи:
- Получить ряд хромосомных перестроек, затрагивающих район 75С1-2.
- Получить систему зондов для молекулярно-биологических работ с разными участками района 75С1-2.
- Определить с максимальной точностью расположение дисков района 75С1-2 на физической карте генома дрозофилы.
- Изучить локализацию белка SUUR и его влияние в разных частях района 75С1-2.
- Получить профиль политенизации района 75С1-2 методом Саузерн-блот гибридизации.
- Изучить влияние хромосомных перестроек на степень политенизации отдельных частей района 75С1-2.
Научная новизна работы. Впервые с высокой точностью определены границы дисков и исследовано распределение различных характеристик хроматина по длине индивидуального района интеркалярного гетерохроматина политенных хромосом дрозофилы.
Впервые показана независимость связывания белка SUUR с разными фрагментами района интеркалярного гетерохроматина.
Впервые показано влияние окружающих последовательностей на степень политенизации района интеркалярного гетерохроматина.
Положения, выносимые на защиту.
- Район интеркалярного гетерохроматина 75С1-2 политенных хромосом D. melanogaster с точностью до 10 т. п. о. соответствует участку физической карты хромосомного плеча 3L с координатами 18173300-18618800 (release 5.22).
- Район интеркалярного гетерохроматина 75С1-2 обладает асимметричным профилем политенизации, который расширяется при введении в геном двух дополнительных копий гена SuUR.
- Степень политенизации отдельных частей района интеркалярного гетерохроматина 75С1-2 зависит от окружающих последовательностей.
Практическая значимость работы. Точное картирование и подробная характеристика внутренней структуры района 75С1-2 позволяет планировать и проводить исследования тонких процессов, связанных с интеркалярным гетерохроматином. Кроме того, полученные в данной работе линии дрозофилы с перестройками в районе 75С1-2, а также клонированные зонды из этого района могут быть использованы в работе по цитогенетике дрозофилы.
Апробация работы. Результаты работы представлены на международных конференциях в докладах и стендовых сообщениях: на 7-ой, 8-ой и 9-ой международных конференциях по гетерохроматину дрозофилы (Губбио, Италия, 2005, 2007, 2009); на международной конференции «Генетика в России и мире» (Москва, 2006); на международной конференции, посвященной 90-летию академика Д. К. Беляева (Новосибирск, 2007); на международной молодежной научно-методической конференции «Проблемы молекулярной и клеточной биологии» (Томск, 2007); на юбилейной конференции, посвященной 50-летию Института цитологии РАН (Санкт-Петербург, 2007); на международной конференции «Хромосома 2009» (Новосибирск, 2009).
По теме диссертации опубликованы четыре статьи.
Вклад автора. Основные результаты получены автором самостоятельно. Часть работ по анализу цитологических препаратов и выявление белка SUUR в разных фрагментах района 75С1-2 выполнялось совместно с Е. Б. Кокоза. Частоты разломов района 75С1-2 определялись совместно с Е. Б. Кокоза и Е. С. Беляевой. Выявление двуцепочечных разрывов ДНК иммуноокрашиванием выполнялось совместно с Е. Н. Андреевой. Картирование на политенных хромосомах проводилось совместно с И. Ф. Жимулевым и Е. С. Беляевой.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, описания материалов и методов, результатов, обсуждения, а также выводов и списка цитируемой литературы (286 ссылок). Работа изложена на 144 страницах машинописного текста, содержит 3 таблицы и 22 рисунка.
МАТЕРИАЛЫ И МЕТОДЫ
Линии дрозофилы. Используемые генетические маркеры и линии описаны в базе данных FlyBase (Drysdale R.A. and Crosby M.A., 2005). Культуры мух вели по стандартной методике при температуре 25С на корме состава: агар – 13 г, дрожжи – 80 г, ржаная мука – 62 г, изюм – 76 г, патока – 65 г на 1 литр воды.
Для введения двух дополнительных копий гена SuUR во вторую хромосому линий дрозофилы, несущих хромосомные перестройки в районе 75С1-2, использовали линию 4xSuUR+, гомозиготную по встройке Р-элемента P{SuUR, w+} во второй хромосоме (Zhimulev I.F. et al., 2003a).
Хромосомные перестройки в районе 75С1-2 были получены методом FLP-FRT-рекомбинации (Ryder E. et al., 2004) с модификациями, с использованием линий, предоставленных ссылка скрыта. Для получения делеции Df(3L)ED4719 использовали линии ссылка скрыта и ссылка скрыта; для получения делеции Df(3L)NA34 и дупликации Dp(3L)NA18 использовали линии ссылка скрыта и ссылка скрыта. Присутствие всех перестроек подтверждали визуальным анализом хромосом и гибридизацией in situ.
Цитологические методы. Препараты политенных хромосом, окрашенные ацетоорсеином, готовили по стандартной методике. Анализ и фотографирование проводили с помощью люминесцентного микроскопа Olympus BX50 и камеры Olympus DP50 (Япония).
Наличие разлома в районе 75С1-2 определяли по цитологическим признакам (Zhimulev I.F. et al., 1982). Достоверность изменения частот разломов при различных перестройках в районе 75С1-2 определяли по критерию Фишера в однофакторном дисперсионном комплексе и методом Б. Л. Ван-дер-Вардена (Васильева Л.А., 2004).
Избыточную экспрессию белка SUUR индуцировали в системе UAS>GAL4 по методике, приведенной в статье (Zhimulev I.F. et al., 2003c).
Флюоресцентную гибридизацию in situ на политенных хромосомах проводили по стандартной методике (Ashburner M. et al., 2005), используя зонды, меченые дезоксигенином.
Иммуноокрашивание проводили по стандартной методике (Andreyeva E.N. et al., 2005), используя следующие первые антитела: кроличьи поликлональные anti-SUUR (E-45), 1:50 (Makunin I.V. et al., 2002) и phosphoH2AvS137), 1:200 (Madigan J.P. et al., 2002.
Идентификацию хромосомных районов проводили по рисованной карте П. Н. Бриджеса (Bridges P.N., 1941).
Количественная Саузерн-блот гибридизация. Клеточные ядра выделяли из 45 слюнных желез или 25 комплексов личиночных ганглиев и имагинальных дисков и заливали в блочки агарозы по методике (Karpen G.H. and Spradling A.C., 1990). Эти блочки обрабатывали определенными ферментами рестрикции и подвергали электрофорезу по стандартной методике. Затем ДНК переносили на фильтр Hybond-N+ (Amersham Biosciences), следуя рекомендациям производителя.
Зонды для гибридизации in situ и Саузерн-блот гибридизации получали с помощью ПЦР и клонировали по стандартной методике в плазмиды pBluescript или pGEM-T Easy. Наработку и выделение плазмиды из клеток E. coli проводили стандартным методом (Маниатис Т. и др., 1984 с. 100).
Саузерн-блот гибридизацию проводили по методике, приведенной (Маниатис Т. и др., 1984 с 344). Интенсивность гибридизации измеряли с помощью программы GelPro3. Степень политенизации рассчитывали, как отношение интенсивностей гибридизации зонда из района 75С1-2 в политенных хромосомах и в диплоидной ткани (после нормировки на интенсивность гибридизации контрольного зонда из эухроматина на той же дорожке).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Картирование района 75С на физической карте хромосомного плеча 3L
Картирование с помощью электронной микроскопии, проведенное В. Ф. Семешиным, показало, что район 75С1-2 включает три отдельных диска: 75C1, 75С2 и тонкий диск 75C1’ между ними.
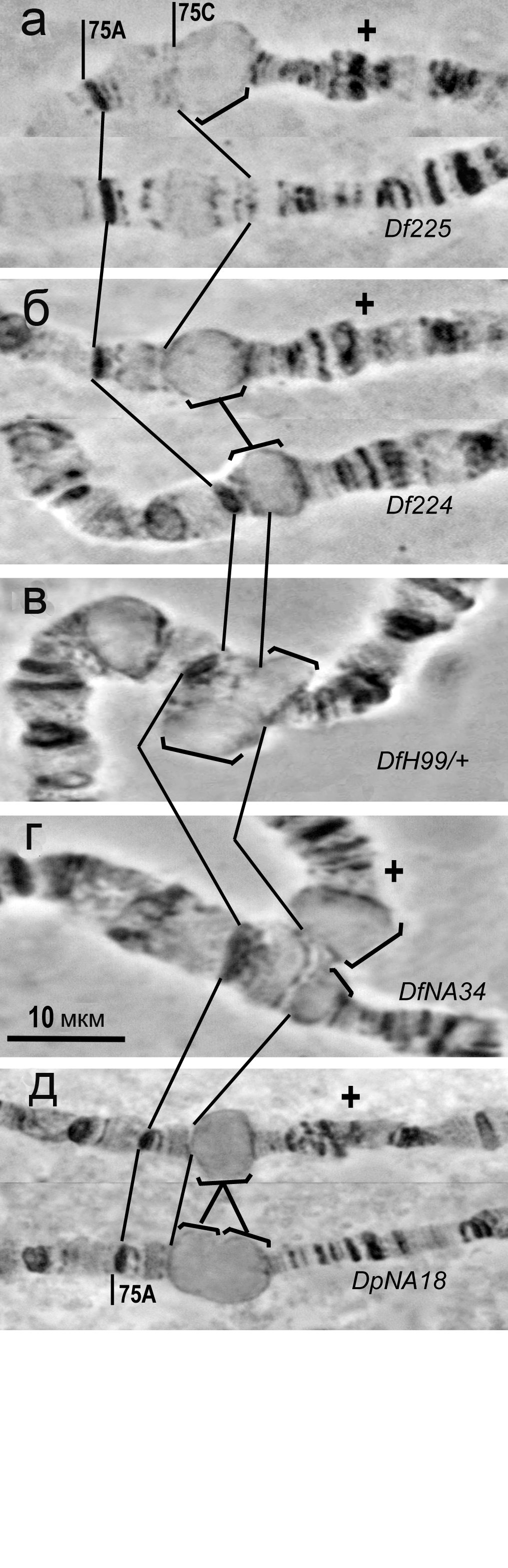
Для работы методами молекулярной биологии возникла необходимость максимально точно соотнести положение дисков 75С1-2 на цитологической и физической картах политенных хромосом, поскольку существующие данные об этом очень неточны. Для картирования был выбран ряд хромосомных перестроек с известным (для всех, кроме Df(3L)H99) положением точек разрыва на молекулярной карте. Часть этих перестроек была получена ранее: Df(3L)H99 (Mackay W.J. and Bewley G.C., 1989; White K. et al., 1994), Df(3L)ED224 и Df(3L)ED225 (Ryder E. et al., 2007; ссылка скрыта). Остальные перестройки (Df(3L)ED4719, Df(3L)NA34 и Dp(3L)NA18) мы получили методом FLP-FRT рекомбинации.
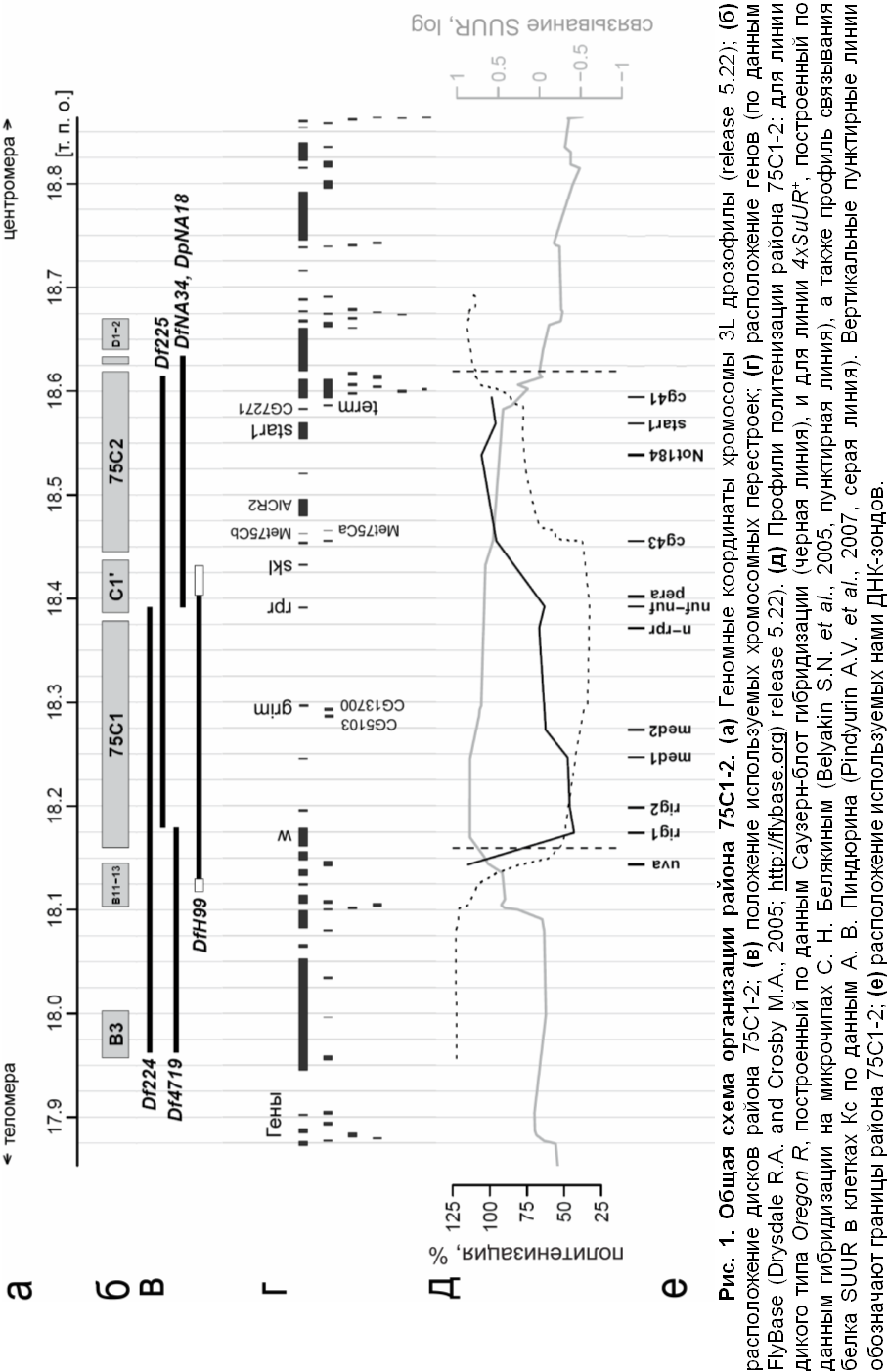
Анализируя давленые препараты политенных хромосом линий дрозофилы с этими перестройками, мы с высокой точностью установили положение дисков района 75С1-2 на физической карте генома дрозофилы. Оказалось, что весь этот район занимает 440-450 т. п. о. (Рис. 1а-в).
2. Генетическое содержание района 75С1-2
По данным С. Н. Белякина с коллегами, 30 из 52 обнаруженных районов недорепликации в политенных хромосомах дрозофилы содержат гены со сходными паттернами экспрессии, то есть являются транскрипционными территориями. Кроме того, недопредставленные районы оказались обогащенными генами, активными в клетках полового пути самца (Spellman P.T. and Rubin G.M., 2002; Belyakin S.N. et al., 2005). В районе 75С1-2 не было обнаружено транскрипционной территории, однако нужно учитывать, что, в связи с особенностями метода, в этом исследовании рассматривались только кластеры, содержащие не менее 10 генов. Таким образом, в выборку не попали небольшие группы генов со сходными паттернами экспрессии.
Установив положение дисков района 75С1-2 на физической карте хромосомы 3L дрозофилы (Рис. 1а), мы получили возможность более точно узнать, какие гены располагаются внутри этих дисков (рисунке 1г). Всего район содержит около 25 генов, но интересно, что в дисках 75С1 и С1’ находится две особые группы генов: четыре гена, участвующих в индукции эмбрионального апоптоза у дрозофилы (Wrinkled (W), grim, reaper (rpr) и sickle (skl)) (Srinivasula S.M. et al., 2002), а также два гена (CG5103 и CG13700), которые специфично экспрессируются в клетках полового пути самца (Boutanaev A.M. et al, 2002). Возможно, расположение этих генов в гетерохроматиновом районе 75С1-2 обеспечивает скоординированную регуляцию их экспрессии.
Мы провели анализ последовательности ДНК района 75С1-2 на наличие внутренних гомологичных участков с помощью программ серии BLAST, представленных на сервере i.nlm.nih.gov/Blast.cgi. В результате мы обнаружили внутри диска 75С2 несколько последовательностей с высокой степенью гомологии. Интересно, что попарно гомологичными оказались, в основном, кодирующие части генов. Гены term и CG7271 отличаются, фактически, только вставкой около 60 п. о. Ген Met75Cb полностью гомологичен гену Met75Ca, но включает вдобавок фрагмент около 65 п. о. Нужно отметить, что гены Met75Ca и Met75Cb входят в состав в несколько раз более длинных последовательностей, гомология которых составляет около 98%. Эти последовательности имеют длину примерно по 1100 п. о., но обе разделены пополам разными по длине негомологичными друг другу фрагментами. Для средней части кодирующих последовательностей генов AlCR2 (Drostar2) и star1 (Drostar1) гомология превышала 70%, хотя в длинных интронах этой пары генов значимой гомологии обнаружено не было. По-видимому, в данном гетерохроматиновом районе произошли внутренние дупликации. Однако непонятно, почему именно полностью политенизированный диск 75С2 оказался насыщен такими дупликациями.
3. Функциональная диссекция района 75С1-2
Р
 асполагая набором делеций, которые удаляют различные части района 75С1-2 и прилегающих областей, и зная цитологические районы, удаляемые каждой из делеций, мы получили возможность изучать влияние каждого из этих фрагментов на проявление в районе таких свойств ИГХ, как недорепликация ДНК, связывание белка SUUR и образование «пузыря» при избыточной экспрессии белка SUUR.
асполагая набором делеций, которые удаляют различные части района 75С1-2 и прилегающих областей, и зная цитологические районы, удаляемые каждой из делеций, мы получили возможность изучать влияние каждого из этих фрагментов на проявление в районе таких свойств ИГХ, как недорепликация ДНК, связывание белка SUUR и образование «пузыря» при избыточной экспрессии белка SUUR. 3.1. Локализация белка SUUR и формирование «пузырей»
Ранее было показано, что белок SUUR связывается с районом 75С1-2 политенных хромосом (Makunin I.V. et al., 2002). Кроме того, оказалось, что в эмбриональной культуре клеток Кс SUUR связывается по всей длине района и с наибольшей интенсивностью – в его дистальной части (Pindyurin A.V. et al., 2007; Рис. 1д). Чтобы проверить, с какой частью района SUUR связывается на политенных хромосомах, мы провели иммуноокрашивание антителами к этому белку хромосом с перестройками Df(3L)ED224, Df(3L)NA34 и Dp(3L)NA18. Во всех случаях мы наблюдали явный сигнал в районе 75С1-2, независимо от того, какая часть района была удалена. В хромосоме с дупликацией Dp(3L)NA18 присутствовал дополнительный сигнал.
И
Рис. 2. Образование «пузырей» в районе 75С1-2 при избыточной экспрессии SuUR. Показаны хромосомы линий дикого типа («+») и несущих перестройки (а) Df(3L)ED225, (б) Df(3L)ED224, (в) Df(3L)Н99, (г) Df(3L)NA34 и (д) Dp(3L)NA18. «Пузыри» обозначены скобками.
звестно, что при избыточной экспрессии гена SuUR в системе трансгенов Sgs3-Gal4; UAS-SuUR в дисках ИГХ на политенных хромосомах личинок дрозофилы конца третьего возраста образуются специфические вздутия, так называемые «пузыри» (Zhimulev I.F. et al., 2003c). В норме район 75С1-2 при введении такой системы образует очень крупный «пузырь». Чтобы выяснить, из какой части района он образуется, мы проанализировали перестройки Df(3L)ED224, Df(3L)ED225, Df(3L)NA34 и Dp(3L)NA18 в условиях избыточной экспрессии SuUR (Рис. 2).
Мы обнаружили, что практически полное удаление района 75С1-2 делецией Df(3L)ED225 приводит к исчезновению «пузыря» (Рис. 2а). При удалении дистальной части района делециями Df(3L)ED224 и Df(3L)Н99 образуется «пузырь» примерно того же размера, что и в норме (Рис. 2б, в), а в хромосоме с делецией Df(3L)NA34 оставшийся диск 75С1 формирует «пузырь» явно меньшего размера (Рис. 2г). В хромосоме Dp(3L)NA18 дуплицированный материал и целый район 75С1-2 образуют примерно одинаковые по размеру «пузыри», которые затем сливаются (Рис. 2д). По-видимому, в формировании этой структуры участвует весь материал района 75С1-2.
Таким образом, мы выяснили, что в норме белок SUUR независимо связывается с проксимальной и дистальной половинами района 75С1-2 и также независимо образует в них «пузыри» при избыточной экспрессии.
Наши данные подтверждают, что размер «пузыря» напрямую зависит от количества хроматина, присутствующего в районе (Zhimulev I.F. et al., 2003c). Делеции дистальной части района (Df(3L)ED224 и Df(3L)Н99), которая сильно недореплицирована и поэтому содержит сравнительно мало ДНК, не влияла заметно не размер «пузыря» (Рис. 2б, в), а делеция сравнительно полно политенизированной проксимальной части района (Df(3L)NA34) сильно уменьшала размер «пузыря» (Рис. 2г). На хромосоме с дупликацией Dр(3L)NA18 «пузыри» из целого района 75С1-2 и его дуплицированной проксимальной части выглядели одинаково (Рис. 2д). Это может свидетельствовать о примерно одинаковом количестве хроматина в сильно недореплицированном целом районе и более полно политенизированной половине 75С1-2 на хромосоме Dр(3L)NA18.
3.2. Недорепликация ДНК
3.2.1. Анализ частоты разломов в разных частях района 75С1-2
Разломы политенных хромосом на давленых препаратах образуются в результате локальной недорепликации ДНК в районах ИГХ. Для каждого района характерна определенная частота разломов, которая отражает степень недорепликации. Мы оценивали частоты разломов в районе 75С1-2 в линиях, гетерозиготных по делециям разных фрагментов района (Табл. 1), чтобы определить, какая часть района необходима для образования разлома. Мы сравнивали на одних и тех же препаратах политенных хромосом слюнных желез частоту разломов района 75С1-2 в гомологе с перестройкой и в балансерном гомологе (TM3 или TM6C).
Из данных, приведенных в таблице, следует, в общем, что удаление дистальной половины района приводит к исчезновению разломов, а удаление проксимальной половины снижает частоту разломов до 9%. Таким образом, дистальный фрагмент района 75С1-2 (удаляемый делециями Df(3L)ED225, Df(3L)ED224 и Df(3L)H99) более всего необходим для образования разлома.
Известно, что при увеличении дозы гена SuUR такие свойства районов ИГХ, как недорепликация и образование эктопических контактов становятся более выраженными (Zhimulev I.F. et al., 2003a). Чтобы проверить, как повлияют на частоту разломов в районе 75С1-2 дополнительные дозы гена SuUR при наличии перестроек, мы провели такой же анализ частот разломов для линий, несущих, помимо перестройки в районе 75С1-2, две дополнительные трансгенные копии гена SuUR. Однако в этом случае мы обнаружили достоверное появление разломов только в линии 4SuUR Df(3L)ED224/TM6B. Это означает, что при удалении дистальной половины района увеличении дозы гена SuUR очень слабо влияет на недорепликацию района.
Табл. 1. Частоты возникновения разломов в районе 75С1-2 в линиях с перестройками в норме (2 копии гена SuUR) и при введении двух дополнительных копий гена SuUR. В качестве контроля используется балансерный гомолог. Чтобы проверить, можно ли считать частоту разломов в балансерном гомологе нормой, были подсчитаны частоты разломов для района 75С1-2 на хромосомах мух +/ТМ3.
-
линии
Частоты разломов (%) (количество проанализированных хромосом)
гомолог с перестройкой
балансер
Df(3L)ED224/TM6C
0%(75)
53%(66)
Df(3L)H99/TM3C
0%(93)
58%(94)
Df(3L)NA34/TM6C
9%(322)
50%(326)
Df(3L)ED4719/TM6C
42%(142)
49%(121)
Df(3L)ED225/TM6C
0%(93)
54%(70)
Dp(3L)NA18/TM6C
75%(75) целый район
64%(44)
0%(75) дупликация
4xSuUR
4xSuUR Df(3L)225/TM6
0%(38)
71%(17)
4xSuUR Df(3L)224/TM6
5%(141)
73%(78)
4xSuUR Df(3L)H99/TM6
0%(121)
65%(85)
4xSuUR Dp(3L)NA18(/TM6)
91%(170) целый район
90%(148)
1%(116) дупликация
нормальный гомолог
балансер
Oregon/TM3
56%(43)
60%(40)
3.2.2. Выявление свободных концов нитей ДНК
Известно, что при недорепликации районов ИГХ в политенных хромосомах D. melanogaster возникают свободные концы ДНК, появление которых сопровождается фосфорилированием С-конца гистона H2Av (Madigan J.P. et al., 2002). Фосфорилированная форма H2Av выявляется в том числе и в районе 75С1-2 (Andreyeva et al., 2008). Мы провели иммуноокрашивание политенных хромосом линий Df(3L)ED224/ТМ6С и Dp(3L)NA18 антителами против фосфорилированной формы гистона H2Av, чтобы выяснить, присутствуют ли двуцепочечные разрывы ДНК в районе 75С1-2. Оказалось, что в обоих случаях присутствует четкий сигнал. То есть свободные концы молекул ДНК есть и в целом районе 75С1-2 и в проксимальной его половине на хромосомах Df(3L)ED224 и Dp(3L)NA18, несмотря на то, что недорепликация в проксимальной части 75С1-2 сильно подавлена, и разломов в ней не происходит (Табл. 1).
3.2.3. Определение профиля политенизации ДНК
Мы получили профиль недорепликации для линии дикого типа (Oregon R) методом количественной Саузерн-блот гибридизации. Для этого мы, зная положение района 75С1-2 на физической карте хромосомы 3L, разработали 11 ДНК-зондов, расположенных в этом районе (Рис. 1е). В каждой точке мы измеряли степень политенизации, используя для нормировки зонды, соответствующие полностью политенизированным фрагментам хромосом. Согласно полученному профилю (Рис. 1д), на хромосомах линии Oregon R заметно недореплицированными оказываются диски 75C1 and 75C1’, тогда как диск 75C2 выглядит практически полностью политенизированным. Минимум политенизации располагается в самой дистальной части диска 75С1, что вполне соответствует цитологическим данным о расположении слабой точки на дистальной границе этого диска.
Ранее С. Н. Белякиным был получен профиль политенизации района 75С1-2 для линии с двумя дополнительными копиями гена SuUR (4xSuUR+) с помощью гибридизации на микрочипах, содержащих фрагменты генов (Belyakin S.N. et al., 2005). Сравнение его результатов с нашими показывает, что при четырех копиях гена SuUR зона недорепликации становится заметно шире, чем в линии дикого типа. Особенно сильно она расширяется в проксимальную сторону (Рис. 1д).
Интересно, что заметную недорепликацию (более 5%) в политенных демонстрируют только дистальные 300 т. п. о. (Рис. 1д), тогда как в культуре клеток Кс белок SUUR связывает весь район 75С1-2 с достаточно высокой интенсивностью (Pindyurin A.V. et al., 2007, Рис. 1д). Можно предположить, что за недорепликацию отвечает не только SUUR, или для возникновения заметного уровня недорепликации нужна определенная концентрация белка. С другой стороны, несмотря на общую корреляцию интенсивности связывания SUUR в клетках Кс и уровня политенизации в хромосомах слюнных желез (Pindyurin A.V. et al., 2007), профиль связывания SUUR в этих типах клеток может все же несколько отличаться.
3.2.4. Зависимость степени политенизации от окружающих последовательностей
На хромосомах с делециями Df(3L)ED224 и Df(3L)Н99 мы обнаружили неожиданный эффект: оказалось, что при удалении дистальной части района оставшаяся проксимальная половина выглядит, как правило, заметно массивней, чем целый район на балансерном гомологе. То же самое наблюдается и в районе с дупликацией Dp(3L)NA18: новый диск, представляющий собой дупликацию проксимальной половины 75С1-2, часто выглядит на давленых препаратах заметно толще, чем целый район на той же хромосоме. Эти факты заставили нас предположить, что проксимальная часть района 75С1-2 после отделения от дистальной стала реплицироваться полнее, чем в составе целого района.
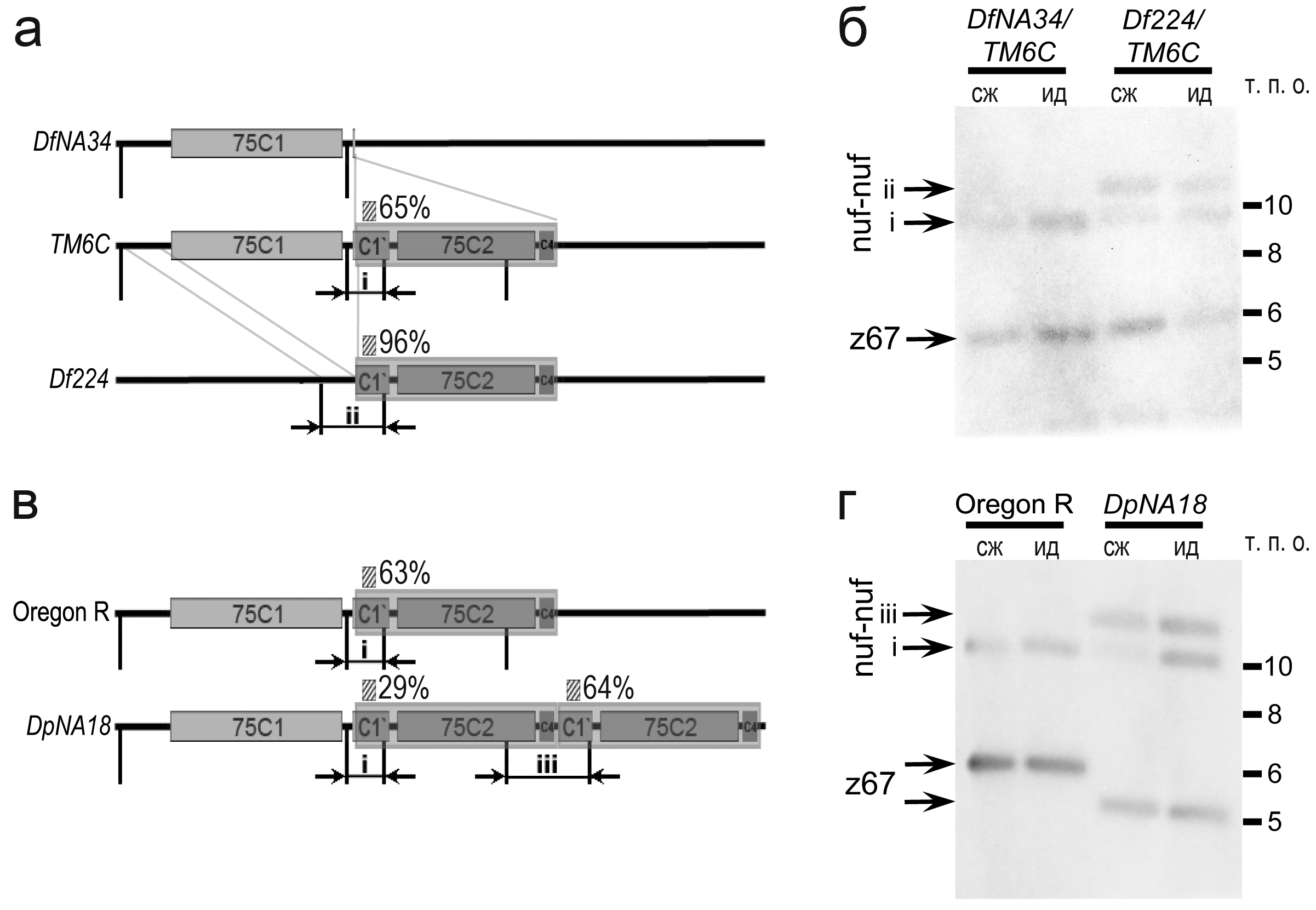
Рис. 3. Измерение уровня политенизации последовательности nuf-nuf в политенных хромосомах с перестройками Df(3L)NA34 и Dp(3L)NA18. (а, в) Схемы дисков района 75С1-2 на хромосомах Df(3L)ED224, Df(3L)NA34 (а) и Dp(3L)NA18, Oregon R (дикий тип) (в). Положение последовательности зонда nuf-nuf обозначено заштрихованным прямоугольником, стрелками показаны рестрикционные фрагменты (“i”–“iii”), включающие зонд. (б, г) Саузерн-блот гибридизация зондов nuf-nuf (район 75С1-2) и z67 (эухроматин) с геномной ДНК слюнных желез («сж») и комплекса головных ганглиев с имагинальными дисками («ид»). Линия Df(3L)NA34/ТМ6С, несущая последовательность nuf-nuf только в балансерной хромосоме, была использована в качестве контроля для линии Df(3L)ED224/ТМ6С, а линия дикого типа Oregon R – в качестве контроля для линии Dp(3L)NA18. Рестрикционный фрагмент PvuII, содержащий контрольную последовательность z67 демонстрирует полиморфизм в хромосомах дикого типа и Dp(3L)NA18.
Чтобы проверить, насколько изменилась степень политенизации проксимальной части района 75С1-2 при делеции Df(3L)ED224 и дупликации Dp(3L)NA18, мы воспользовались методом количественной Саузерн-блот гибридизации. Для этого был сделан специальный зонд nuf-nuf, соответствующий дистальному краю дуплицированного района в Dp(3L)NA18 и оставшейся части района в Df(3L)ED224 (Рис. 1е; Рис. 3а, в). Последовательность зонда была выбрана так, чтобы после гидролиза рестриктазами PvuII или MfeI рестрикционные фрагменты, включающие зонд, оказались разной длины для целого 75С1-2 и его дуплицированной части, а также для целого 75С1-2 и его части в Df(3L)ED224 (Рис. 3а, в). Эксперименты по измерению уровня политенизации проводились независимо по 2-3 раза с разными комбинациями используемых рестриктаз и контрольных эухроматиновых зондов. Эти измерения показали, что степень политенизации последовательности nuf-nuf в хромосоме с делецией Df(3L)ED224 примерно в 1,5 раза выше, чем в контрольном гомологе, а в дуплицированном участке на хромосоме Dp(3L)NA18 – примерно в 2,5 раза выше, чем в целом районе 75С1-2 на той же хромосоме (Рис. 3б, г). Таким образом, степень недорепликации фрагментов района 75С1-2 зависит от окружающих последовательностей.
Результаты наших экспериментов по анализу недорепликации позволяют заключить, что дистальная часть района является наименее политенизированной и необходима для образования разлома. Это подтверждается цитологическими данными о том, что разлом всегда образуется в самой дистальной части района (Zhimulev I.F. et al., 1982; Andreyenkova N.G. et al., 2009).
В работе Т. Лича с соавторами было показано, что существуют предпочтительные длины недореплицированных молекул ДНК. По мнению авторов, существуют определенные последовательности ДНК, в которых вилка репликации с наибольшей вероятностью оказывается в конце S-фазы (Leach T.J. et al., 2000a). Такими «барьерами» могут служить сателлиты, обладающие сложной конформацией, однако в настоящее время неизвестно, каким образом осуществляется остановка репликативных вилок. Наличие таких «барьеров» репликации в районе 75С1-2 подтверждается экспериментами С. А. Демакова (Andreyenkova N.G. et al., 2009). Наши данные предполагают, что эти «барьеры» должны быть сосредоточены, в основном, в дистальной части района.
На рисунке 4 приведена гипотетическая схема организации района 75С1-2 относительно «барьеров» и ориджинов репликации. Схема нарисована, исходя из предположения, что внутри района нет ориджинов, и весь район реплицируется вилками, приходящими из окружающего эухроматина. Слабые ориджины внутри района, вероятно, не будут качественно менять картину. Согласно приведенной схеме, в дистальной части района 75С1-2 дикого типа находится несколько «барьеров», часть из которых достаточно сильные. В проксимальной части района локализуются только слабые барьеры (Рис. 4а). Если убрать дистальную часть района, то политенизация будет проходить практически полностью (Рис. 4б), что и наблюдается в хромосомах с делецией Df(3L)ED224, где уровень политенизации зонда nuf-nuf равен почти 100%, и никогда не возникают разломы. Если убрать проксимальную часть района, то недорепликация останется и будет достаточно сильной, чтобы с небольшой частотой возникали разломы (Рис. 4в). Это и происходит при делеции Df(3L)NA34, где разломы возникают в 9% случаев. В дупликации Dp(3L)NA18 картина становится сложнее, поскольку здесь изменяется и проксимальная граница целого района 75С1-2 (Рис. 4г). Вероятно, ориджин репликации, или часть ориджинов, которые находились возле этой границы в норме, отодвигаются дуплицированной частью и до проксимальной половины целого 75С1-2 вилка репликации доходит теперь еще реже. По нашим данным это приводит к снижению уровня политенизации зонда nuf-nuf до 29% и к увеличению частоты разломов до 75%. Зато дуплицированная проксимальная часть района находится теперь практически в тех же условиях, что и в норме: с проксимальной стороны есть эффективный ориджин репликации, а с дистальной ориджин находится за сильными «барьерами». В результате, степень недорепликации зонда nuf-nuf оказывается такой же, как и в норме – 64%.

Рис. 4. Гипотетическая схема «барьеров» и ориджинов репликации в районе 75С1-2. Показаны хромосомы (а) дикого типа, (б) Df(3L)ED224, (в) Df(3L)NA34, (г) Dp(3L)NA18. Черным прямоугольником обозначен район 75С1-2, широкими стрелками – ориджины репликации; большими крестиками – сильные «барьеры», а маленькими – слабые. Тонкими стрелками показано направление репликации отдельных нитей ДНК. Треугольником и числом показаны местоположение последовательности nuf-nuf и степень ее политенизации; число в рамке обозначает частоту разломов в районе. Подробные объяснения в тексте.
Однако мы знаем, что разломов в дуплицированной части района 75С1-2 не возникает (Табл. 3.1). Возможно, образованию разлома в этом случае мешают эктопические контакты между двумя близко расположенными районами ИГХ – целым районом 75С1-2 и его дуплицированной частью (такая возможность описана в статьях Zhimulev I.F. et al., 1982; Moshkin Y.M. et al., 2001; Semeshin F. et al., 2001). Если это так, то становится понятно, почему даже увеличение количества белка SUUR не вызвало достоверного появления разломов в дуплицированной проксимальной части района (изначально политенизированной только на 64%), но привело к появлению разломов в той же части района на хромосоме Df(3L)ED224, хотя она изначально была политенизирована практически полностью.
Еще интересно, что при повышении дозы гена SuUR разломы появились только в хромосоме с делецией Df(3L)ED224, а в хромосоме с делецией Df(3L)Н99, которая убирает лишь немногим больше материала, разломов обнаружить не удалось (Табл. 1). Возможно, в районе с делецией Df(3L)Н99 недорепликация усиливается при повышении дозы гена SUUR, но не настолько, чтобы появились заметные разломы. Можно даже предположить, что дополнительный SUUR усиливает эффективность «барьеров» для репликационной вилки и, таким образом, увеличивает степень недорепликации районов ИГХ. В этом случае Df(3L)Н99 может просто удалять дополнительный «барьер», помимо тех, что удаляются делецией Df(3L)ED224.
Понятно, что приведенная схема – это очень упрощенная модель, которая не учитывает возможности включения или замолкания дополнительных ориджинов в пределах самого района, а также разнообразия внешнего окружения дисков, с изменением которого могут меняться параметры процесса репликации (например, скорость). К сожалению, изучение механизма репликации ДНК в районах ИГХ находится пока на начальных этапах.
3.3. Типы районов ИГХ
Итак, наши данные и ранее опубликованные результаты свидетельствуют о том, что район ИГХ 75С1-2 организован асимметрично: зона максимальной недорепликации смещена к самому краю района и совпадает с максимальной интенсивностью связывания белка SUUR в клетках Кс (Pindyurin A.V. et al., 2007, Рис. 1д). С другой стороны, материал всего района способен отвечать на избыточное количество SUUR образованием «пузырей». Интересно, что, согласно последним данным о расписании репликации в культурах клеток Kc и C18 (из раннего эмбриона и крылового имагинального диска личинки третьего возраста соответственно) (Schwaiger M. et al., 2009), диски района 75С1-2 очень хорошо совпадают с зоной поздней репликации в клетках Кс. В клетках С18 - совсем другая картина: зона максимальной недорепликации реплицируется раньше, чем проксимальная часть района.
Исходя из всего сказанного выше, можно разделить район 75С1-2 на три зоны (Рис. 5). Зона «1», ограниченная дистальным краем диска 75С1 и зондом nuf-nuf (Рис. 5б, в), демонстрирует наиболее выраженную недорепликацию (более 30%), которая может вызывать появление разлома. Зона «2», расположенная между последовательностями зондов nuf-nuf и cg43 (Рис. 5б, в), имеет средний уровень недорепликации (между 5 и 30%) и может образовывать разлом при избыточной экспрессии SUUR, хотя и с очень малой частотой. Зона «3», расположенная между зондом cg43 и проксимальным краем диска 75С2, не обнаруживает заметной недорепликации и никогда не образует разлома, хотя, как и зоны «1» и «2», реплицируется в клетках Кс в поздней S-фазе (Schwaiger M. et al., 2009), что отличает ее от эухроматиновых районов. Зоны «1», «2» и «3» имеют размеры 219 т. п. о., 63 т. п. о. и 163 т. п. о., то есть примерно соответствуют дискам 75C1, 75C1’ и 75C2 (Рис. 5г).
Анализ наших результатов и ранее опубликованных данных позволил нам думать, что районы ИГХ в политенных хромосомах слюнных желез дрозофилы можно разделить на три разных типа. Первый тип, к которому принадлежит и район 75С1-2, характеризуется асимметричной зоной недорепликации относительно цитологически наблюдаемых плотных дисков. В районах ИГХ второго типа зона недорепликации локализована в середине. Такие районы выглядят, как два близко расположенных плотных диска, которые могут разделяться разломом. К этому типу принадлежит район ИГХ 11А6-9, в котором, согласно карте К. Б. Бриджеса (Bridges C.B., 1938) расположены два поздно реплицируемых дублета 11A6-7 и 11A8-9. Однако если недорепликация подавлена, как это происходит в Х-хромосоме самца (Zhimulev I.F. et al., 1982) или при мутации SuUR, в этом районе наблюдается только один большой, плотный диск. Такая организация характерна для многих районов ИГХ, в том числе для 19E1-4, 33A1-2, 64C1-2, 65B1-2, 70C1-2, 84D, 89E1-4 и других (Semeshin F. et al., 2001; Zhimulev I.F. et al., 2003a). К третьему типу районов ИГХ относятся районы, подобные 7B1-2 и 71C1-2, в которых разлом может локализоваться в любой части плотных дисков (Semeshin F. et al., 2001). По-видимому, в этом случае все диски района политенизированы примерно в одинаковой степени.

Рис. 5. Разделение района 75С1-2 на качественные зоны. (а) Геномные координаты хромосомного плеча 3L дрозофилы; (б) Профиль политенизации района 75С1-2: для линии дикого типа Oregon R (указаны зонды nuf-nuf и cg43), (в) Качественные зоны, на которые можно разделить район (пояснения в тексте); (г) расположение дисков района 75С1-2.
Несмотря на различия в профилях политенизации и белковом составе, существуют общие черты в организации районов ИГХ, хотя и выражаются они в разных районах с неодинаковой интенсивностью. Проведенная нами функциональная диссекция района ИГХ 75С1-2 позволяет уже более направленно искать молекулярные механизмы, которые обеспечивают архитектуру этого района, а также других районов ИГХ со сходной структурой. Дальнейшее изучение организации районов ИГХ позволит лучше понять, как обеспечивается скоординированная регуляция экспрессии генов на уровне гетерохроматиновых доменов хромосом.
ВЫВОДЫ
В данной работе на примере района 75С1-2 политенных хромосом D. melanogaster впервые с высокой точностью были определены границы индивидуального района ИГХ и проведен детальный анализ его внутренней организации. Обобщая полученные результаты, можно сделать следующие выводы:
- Район интеркалярного гетерохроматина 75С1-2 политенных хромосом D. melanogaster с точностью до 10 т. п. о. соответствует участку физической карты хромосомного плеча 3L с координатами 18173300-18618800 (release 5.22). Район занимает примерно 445 т. п. о. и содержит около 25 генов.
- Белок SUUR независимо связывается с дистальной и проксимальной половинами района 75С1-2 и при избыточной экспрессии независимо образует из них «пузыри».
- Район интеркалярного гетерохроматина 75С1-2 обладает асимметричным профилем политенизации, причем максимум недорепликации находится на дистальном краю района.
- Зона недорепликации в районе 75С1-2 расширяется при введении в геном двух дополнительных копий гена SuUR. Проксимальная граница зоны становится при этом более пологой.
- Выявлена сложная зависимость степени политенизации отдельных частей района 75С1-2 от окружающих последовательностей, что позволяет предполагать существование локальных барьеров, препятствующих прохождению вилки репликации. Согласно этой гипотезе самые «сильные» барьеры должны располагаться в дистальной части района.
Список работ, опубликованных по теме диссертации:
- Колесникова Т.Д., Андреева Е.Н., Пиндюрин А.В., Ананько (Андреенкова) Н.Г., Белякин С.Н., Шлома В.В., Юрлова А.А., Макунин И.В., Похолкова Г.В., Волкова Е.И. Заруцкая Е.А., Кокоза Е.Б., Семешин В.Ф., Беляева Е.С., Жимулев И.Ф. Ген SuUR и его участие в организации эпигенетически репрессированных районов хромосом Drosophila melanogaster // Генетика. 2006. Т. 42. №8. С. 1013–1028.
- Жимулев И.Ф., Беляева Е.С., Андреенкова Н.Г., Андреева Е.Н., Белякин С.Н., Болдырева Л.В., Брусенцова И. В., Волкова Е.И., Демаков С.А., Демакова О.В., Заруцкая Е.А., Зыков И. А., Кокоза Е.Б., Колесникова Т.Д., Комор У.А., Коряков Д.Е., Макунин И.В., Пиндюрин А.В., Похолкова Г.В., Семешин В.Ф., Шлома В.В., Юрлова А.А. Ген SuUR - уникальный инструмент для изучения структуры и организации хромосом и генома дрозофилы // Инф. Вестник ВОГиС. 2008. Т. 12. №1/2. С. 127-149.
- Бабенко В.Н., Похолкова Г.В., Кокоза Е.Б., Андреенкова Н.Г., Белякин С.Н., Беляева Е.С., Жимулёв И.Ф. Особенности молекулярно-генетической организации диска интеркалярного гетерохроматина 10А1-2 Х хромосомы Drosophila melanogaster // Доклады Академии наук. 2009. Т. 424. №3. С. 407-410.
- Andreyenkova N.G., Kokoza E.B., Semeshin V.F., Belyaeva E.S., Demakov S.A., Pindyurin A.V., Andreyeva E.N., Volkova E.I., Zhimulev I.F. Localization and characteristics of DNA underreplication zone in the 75C region of intercalary heterochromatin in Drosophila melanogaster polytene chromosomes // Chromosoma. 2009. Vol. 118. №6. P. 747-761.
