Характер изменения функционально активных участков и компактности политенных хромосом chironomus (diptera) под влиянием холинотропных препаратов
| Вид материала | Автореферат диссертации |
- Рабочая программа и календарно-тематический план по дисциплине «цитогенетика» специальности, 126.42kb.
- Тема 1,2 «Оплодотворение», 85.94kb.
- С. М., Комаров А. С. Выявление связи особенностей высшей нервной деятельности и почерка, 89.78kb.
- Характер изменений нарушенных коагуляционных и фибринолитических свойств крови под, 413.35kb.
- В. А. Матвиенко (Елец) Этноконфессиональная ситуации в Липецкой области, 359.26kb.
- Эффективность экстракта пихты сибирской на фоне физической нагрузки и гипоксии, 169.92kb.
- Молекулярно-генетическая характеристика индивидуального района интеркалярного гетерохроматина, 399.53kb.
- Уровень занятости населения содержание, 337.4kb.
- Тема : Смятение умов, 42.95kb.
- Анализ кариограммы человека, 156.5kb.
На правах рукописи
Фёдорова Ирина Александровна
ХАРАКТЕР ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНО АКТИВНЫХ
УЧАСТКОВ И КОМПАКТНОСТИ ПОЛИТЕННЫХ ХРОМОСОМ CHIRONOMUS (DIPTERA) ПОД ВЛИЯНИЕМ ХОЛИНОТРОПНЫХ
ПРЕПАРАТОВ
03.00. 25 – гистология, цитология, клеточная биология
Автореферат диссертации на соискание ученой степени
кандидата биологических наук
Астрахань - 2009 г.
Р
 абота выполнена на кафедре общей биологии, фармакогнозии и ботаники
абота выполнена на кафедре общей биологии, фармакогнозии и ботаникиСаратовского государственного медицинского университета
им. В.И. Разумовского
Научный руководитель:
доктор биологических наук, доцент Полуконова Наталья Владимировна
Официальные оппоненты:
доктор биологических наук, с. н. с. Воронежская Елена Евгеньевна
доктор биологических наук, профессор Фельдман Бронислав Владимирович
Ведущая организация: Институт биологии внутренних вод РАН
им. И. Д. Папанина
Защита состоится «27» ноября 2009 г. в 1200 часов
на заседании объединенного диссертационного совета ДМ 212.009.01 при Астраханском государственном университете по адресу: 414000, г. Астрахань, пл. Шаумяна, 1. ЕИ АГУ.
С диссертацией можно ознакомиться в библиотеке Астраханского государственного университета
Автореферат разослан «27» октября 2009 г.

Ученый секретарь
диссертационного совета,
доктор биологических наук Нестеров Ю.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Холинотропные препараты - пилокарпин и атропин – алкалоиды с противоположным действием на вегетативную нервную систему и секрецию слюнных и других желёз: м-холиномиметик (пилокарпин) стимулирует секреторную деятельность, м-холиноблокатор (атропин) - угнетает (Levin, 1992; Busch, Borda, 2007). Изучение действия нейротропных веществ (лекарственных препаратов, фосфорорганических и карбаматных соединений, используемых в качестве пестицидов и боевых отравляющих веществ антихолинэстеразного действия), воздействующих на мускариновые холинореактивные системы, актуально в связи с их широким применением в медицине, военной промышленности и сельском хозяйстве (Нежинская и др., 2008 а и др.).
Индикатором воздействия на субклеточном уровне служат изменения в интерфазных ядрах клеток человека и животных (Тимошевский, Назаренко, 2005). Уникальный модельный объект для анализа изменений функциональной активности интерфазных хромосом представляют политенные хромосомы (ПХ) клеток слюнных желез личинок двукрылых насекомых, постоянно находящиеся в интерфазном состоянии (Кикнадзе и др., 1996). Наличие м-холинергической нейромедиации у Chironomidae (Beauvais et al., 1999; Turberg et al., 1999) делает ПХ их слюнных желез, высокочувствительных к воздействию холинотропных препаратов, моделью для выявления их цитогенетических эффектов, а личинок - тест-системой для оценки действия этих препаратов на организменном, клеточном и субклеточном уровнях. Сведения о влиянии холинотропных препаратов на функциональную активность ПХ клеток слюнных желёз хирономид разрозненны, хотя цитогенетические эффекты пилокарпина изучались, начиная с 60-70-х годов (Clever, 1969; Beerman, 1973). Установлено, что под действием пилокарпина белковый секрет из слюнной железы полностью выводился (Mähr et al., 1980), введение атропина в организм личинок, наоборот, сопровождалось уменьшением секреции (Grossbach, 1977). Цитогенетические эффекты пилокарпина и атропина на ПХ хирономид не сравнивали.
Существенными недостатками подавляющего большинства проводимых ранее исследований цитогенетических эффектов лекарственных препаратов на ПХ Chironomus были визуальная или с ограниченным использованием морфометрических показателей оценка изменений активности ПХ, часто без статистической обработки результатов, и отсутствие единых стандартных подходов к условиям проведения эксперимента, что препятствовало сопоставлению данных разных авторов. Не была известна индивидуальная реакция особей на основе естественного генетического полиморфизма, не установлено - обратимы или необратимы изменения активности функционально значимых участков ПХ под действием заведомо токсических концентраций. Между тем, сравнительный анализ отклика ПХ под влиянием холинотропных препаратов на основе использования современной обработки данных позволит не только оценить ответную реакцию ядерного аппарата на их воздействие, расширив представления о функционировании интерфазных хромосом в целом, но и усовершенствовать методические подходы к анализу цитогенетических эффектов лекарственных средств.
Цель исследования: установить характер и степень воздействия холинотропных препаратов на функционирование политенных хромосом слюнных желез личинок Chironomus plumosus in vivo в остром эксперименте.
Задачи исследования:
1. Оптимизировать методические подходы к оценке действия лекарственных препаратов на основе анализа их цитогенетических эффектов, выявить особенности функциональной активности ПХ клеток слюнных желёз личинок Ch. plumosus при акклимации к лабораторным условиям и установить границы изменчивости и процент работающих активных участков ПХ в контроле.
2. Установить особенности влияния холинотропных препаратов на личинок с различными генотипическими характеристиками.
3. Изучить динамику работы функциональных участков ПХ и сравнить цитогенетические эффекты холинотропных препаратов в остром периоде.
4. Проанализировать цитогенетические эффекты холинотропных препаратов с противоположным действием на секрецию при их комбинированном влиянии.
5. Оценить обратимость изменения активности функционально значимых участков ПХ под воздействием заведомо токсической концентрации пилокарпина.
Научная новизна. Впервые на уровне функционирования интерфазных хромосом доказано доминирование м-холиноблокатора - атропина по сравнению с агонистом - пилокарпином, известное ранее на уровне функционирования м-холинорецепторов, что, наряду с универсальностью холинергической нейромедиации у эукариотических организмов, позволяет эффективнее использовать возможности холинергических структур разных уровней организации и прогнозировать ответную реакцию ядерного аппарата на воздействие холинотропных веществ. Расширены представления о функционировании интерфазных хромосом: впервые показано, что неоднородность в активности функционально значимых участков ПХ между группами особей с разными генотипическими характеристиками, проявляющаяся в период акклимации личинок, существенно снижена под воздействием токсиканта, на примере действия холинотропных препаратов.
Теоретическая и практическая значимость работы. Установлено, что уровень активности специфических участков ПХ зависит от числа гетерозиготных инверсий в кариотипе (активность BR2G уменьшалась с увеличением числа инверсий в кариотипе от 1.88 при одной инверсии до 1.59 при трех.), что свидетельствует о работе генома как единой сбалансированной системы. При этом под воздействием токсикантов такая зависимость существенно снижена. Впервые показана динамика изменения функциональной активности ПХ Ch. plumosus под действием препаратов противоположного действия на секреторную активность. Установленные закономерности действия холинергических лигандов - антагонистов на секрецию желёз используются на спецкурсе по физиологической экологии животных кафедры физиологии человека и животных СГУ им. Н. Г Чернышевского.
Впервые представлены каталоги известных к настоящему времени пуфов de novo, как по данным ряда авторов, так и собственным для Ch. plumosus, что позволяет проводить мониторинг пуфинговой активности у этого вида.
Оптимизирована методика цитогенетического тестирования лекарственных препаратов на ПХ: впервые разработана десятибалльная шкала оценки морфофункциональных изменений личинок; рекомендовано изменение условий содержания личинок Chironomus в условиях острого эксперимента; доказано, что ведущим показателем служит активность NО. Обосновано отсутствие необходимости учета генотипических комбинаций в связи со снижением разброса значений функциональной активности ПХ в экспериментах на генотоксичность у особей с разными генотипическими характеристиками. Методические подходы по использованию личинок Chironomus как тест-системы в цитогенетических исследованиях внедрены в спецкурсы экологической генетики кафедры генетики и гидробиологии кафедры морфологии и экологии животных СГУ им. Н. Г Чернышевского.
Апробация работы. Результаты исследования апробированы на научно-практической конференции «Экологические проблемы урбанизированных территорий» (Елец, 2007 г.); XXI Любищевских чтениях «Современные проблемы эволюции» (Ульяновск, 2007 г.); Международной научной конференции (Астрахань, 2007 г.); XIII Международной школы-конференции молодых учёных «Биология внутренних вод» (Борок, 2007 г.); 9-ой конференции «Водные экосистемы, организмы, инновации – 9» (Москва, 2007 г.); III Всероссийской конференции по водной токсикологии (Борок, 2008 г.); Международной научно-практической конференции (Ставрополь, 2008 г.); научных конференциях аспирантов и молодых ученых (Саратов, СГМУ, 2007-2008 г.); Международной научной конференции «Хромосома 2009» (Новосибирск, 2009 г.).
Публикации. По теме диссертационного исследования опубликованы 14 работ, из них две – в реферируемых научных журналах списка ВАК; три находятся в печати.
Личный вклад автора включает проведение экспериментов, обработку данных и алгоритмическую реализацию разработанных подходов.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы, материалов и методов, четырех глав собственных исследований, заключения, выводов и списка литературы. Объём работы составляет 155 страниц, содержит 18 таблиц и 39 рисунков. Список литературы включает 194 источника, в том числе 83 на иностранном языке.
Положения, выносимые на защиту.
1. Ведущим показателем для оценки изменений функциональной активности ПХ служит реакция одного из универсальных компонентов ядра эукариотических клеток, ответственного за поддержание клеточного гомеостаза, - ядрышкового организатора (NO), который работает как в контроле, так и при воздействии в 97–100% клеток. На токсичность препарата указывает снижение интенсивности работы NO.
2. Доминирование атропина, известное ранее на уровне функционирования м-холинорецепторов, опосредованно проявляется и на уровне функционирования интерфазных хромосом: атропин и смесь атропина с пилокарпином дают одинаковый цитогенетический эффект подавления за счет препятствия атропином стимулирующего действия пилокарпина.
3. Функциональная активность интерфазных хромосом при акклимации личинок к лабораторным условиям неоднородна при разных генотипических характеристиках и является результатом включения в работу в разных клетках неодинакового числа активных участков ПХ.
4. При токсическом воздействии, на примере влияния холинотропных препаратов, неоднородность активности функционально значимых участков ПХ при разных генотипических характеристиках снижается.
5. Изменения активности функционально значимых участков ПХ, включая образование пуфов de novo, обратимы, что свидетельствует о модификационном характере её изменчивости.
Благодарности. Автор выражает искреннюю признательность своему научному руководителю д. б. н. Н. В. Полуконовой, глубокоуважаемым коллегам, с которыми обсуждались фрагменты настоящего исследования – д.б.н. Н. А. Шобанову, д. б. н. Г. М. Чуйко, д. м. н. С. И. Богословской, д. б. н. С. И. Беляниной, к. м. н. Н. В. Петрову, к. ф.-м. н. К. Н. Дворецкому, С. Е. Дееву. Автор благодарен Е. Ю. Мельникову и М. С. Козлову за помощь в подготовке иллюстраций. Я глубоко благодарна своим родителям, без моральной и финансовой поддержки которых эта работа не могла бы быть осуществлена.
СОДЕРЖАНИЕ РАБОТЫ
Глава 1. ТЕОРЕТИЧЕСКИЕ И ПРИКЛАДНЫЕ АСПЕКТЫ АНАЛИЗА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПОЛИТЕННЫХ ХРОМОСОМ ДВУКРЫЛЫХ НАСЕКОМЫХ (обзор литературы)
Представлен обзор данных о функционировании ПХ двукрылых насекомых в норме и при воздействии различных факторов. Приведены особенности действия холинотропных препаратов на живые системы.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материал
В качестве испытуемого объекта использованы личинки Ch. plumosus из озера Сазанка Саратовской области, собранные в 1 декаде марта 2007 г. и 1 декаде февраля 2008 г. В эксперименте использовали личинок Ch. plumosus IV возраста 7 фазы зрелости (Ильинская, Иордан, 1975). Всего исследовано 1080 личинок, в т. ч. 100 – в опыте на акклимацию (50 - зафиксированных у проруби, 50 - акклимированных в течение суток) и 980 – в экспериментах по воздействию: 210 - в контроле, 250 – под воздействием атропина, 200 – пилокарпина; при комбинированном воздействии препаратов - 270, в опыте на обратимость – 50.
Методы
До начала экспериментов личинок акклимировали в течение суток, во время которых погибали травмированные при транспортировке особи. Эксперименты проводили в кюветах объемом - 250 мл, глубиной – 5 см и площадью поверхности – 102 см2, при комнатной температуре, в непроточных условиях, без субстрата (во избежание адсорбции препарата на поверхности частиц ила)**, в отстоянной водопроводной воде при pH=7 (РД 52.24.635-2002. Методические указания, 2002). Экспозиция препаратов - 12 - 96 ч соответствовала острому периоду воздействия, поэтому кормление животных не осуществляли. Состояние морфофункциональных изменений личинок под действием токсиканта оценивали по разработанной нами десятибалльной шкале (табл. 1).
LC50 для атропина и пилокарпина определяли пробит-анализом (Коросов, Калинкина, 2003) и аналитическим экспресс-методом (Фрумин, 1991). Препаративная форма веществ - атропина сульфат (ФГУП Московский эндокринный завод, Россия) и пилокарпина гидрохлорид (Ферейн, Россия).
Для фиксации личинок использована спирт-уксусная смесь (96% этанол, ледяная уксусная кислота, 3:1). Препараты ПХ готовили по этилоорсеиновой методике (Дёмин, 1989). Временные препараты ПХ анализировали под световым микроскопом «Люмипам» при увеличении 7×60.
Ch. plumosus, 2n=8, цитологический комплекс thummi: I(AB), II(CD), III(EF) и IV(G). Центромеры морфологически выражены. Гомологи ПХ IV не конъюгируют. Вид полиморфен за счет парацентрических инверсий и B-хромосом. В кариотипе пять активных районов. BR локализованы: одно в плече В ПХ I(АВ), по цитофотокарте Максимовой (1976), в 16 районе и два в плече G ПХ IV - в 7 и 8 отделах. NО – локализован в плече G отделе 2, пуф (PВ) – в плече В ПХ I (АВ) в 21 районе.
Изменения функциональной активности ПХ исследовали по индексам: компактности (CR***) - отношение абсолютной длины III хромосомы к ширине ее центромеры (Ильинская, 1989), ядрышкового организатора (NОR***) - отношение максимального диаметра к ширине интактного района 6 ПХ IV (Stockert, 1990), колец Бальбиани - BR1GR и BR2GR*** - отношение максимального диаметра, соответственно, BR1G и BR2G к ширине интактного района 6 ПХ IV (Лычёв, 1968), BRВ*** - отношение максимального диаметра BR плеча В к ширине интактного района 17 (Лычёв, 1968) и пуфа (PВR***) - отношение максимального диаметра пуфа к ширине интактного района 21 (Лычёв, 1968). Учитывали не отмеченные в контроле пуфы de novo. Их описание проводили по классификации Максимовой (1983), выделяющей пять классов пуфовой активности. Учитывали только пуфы IV – V классов, т.к. при работе со световым микроскопом малые пуфы практически неотличимы от междисков. Детальное картирование пуфов, инверсионных последовательностей дисков ПХ и обозначение последовательностей дисков проводили по Шобанову (1994 а, б).
Таблица 1
Шкала сопряженности токсического действия холинотропных препаратов
с морфофункциональными изменениями у личинок Ch. plumosus
| Бал-лы | Динамика локомоторной активности и поведения экспериментальных личинок | ||||
| Дыхательные движения | Ответ на раздражение пинцетом | Окраска и упругость тела | % погибших | Состоя-ние | |
| 1 | Активные, на дне | Попытка свернуться в кольцо | Ярко-красная | 0 | норма |
| 2 | Снижение активности | Различ-ные стадии интоксикации | |||
| 3 | Медленные, на дне, единичные особи неподвижны | Красная | |||
| 4 | Медленные, на дне; 30% неподвижны | ||||
| 5 | Медленные, на дне; 50% неподвижны | Темно-красная. Лизис тканей | |||
| 6 | Редкие движения на дне;большинство неподвижны | Темно-красная. Лизис тканей | 1-3 | ||
| 7 | 5-25 | ||||
| 8 | Судорожные сокращения подталкивателей | 25-50 | |||
| 9 | Неподвижны | Едва заметные судорожные сокращения подталкивателей | Темная. Лизис тканей | 50-90 | |
| 10 | Отсутствует | 100 | гибель | ||
Определение степени компактности ПХ проводили по Ильинской (1989). В норме о функциональной активности ПХ свидетельствует изменение значений индекса компактности в пределах от 5.7±0.1 до 10.3±0.1; о снижении функциональной активности ПХ – как уменьшение значения до 4.6 ± 0.1, так и увеличение до 14.7±0.3 и выше.
При сравнении цитогенетических эффектов для нивелирования погрешностей (связанных со стрессовым воздействием на основе изменения температурных условий, отсутствия субстрата и пищи в период острого эксперимента) данные нормировались на контроль, т.е. значения индексов контроля принимались за единицу. Статистическую обработку проводили в среде специализированных пакетов Excel, Statistiсa 6. Для характеристики группы использовали среднее арифметическое и стандартное отклонение. Для оценки значимости различий использовали однофакторный дисперсионный анализ при Р < 0.05, для анализа различий дисперсий – Ф-тест Фишера.
Схема проведения акклимации. При исследовании влияния акклимации 50 личинок были зафиксированы у проруби сразу после вылова, 50 – через сутки после адаптации к лабораторным условиям.
Схема проведения эксперимента по влиянию атропина и пилокарпина. При анализе цитогенетических эффектов атропина использовали концентрации 0.1 мг/мл, 0.13 мг/мл, 0.2 мг/мл 0,4 мг/мл и 1 мг/мл при экспозицях - 12, 24, 48, 72 и 96 ч, - пилокарпина – 0.5 мг/мл, 0.67 мг/мл, 1 мг/мл, 2 мг/мл и 5 мг/мл при экспозициях - 12, 24, 48, 72 ч, т.к. уже на 3 сут (72 ч) наблюдалась гибель личинок. Подбор концентраций проводили с учетом более сильного воздействия атропина, как блокатора м-холинорецепторов.
Схема проведения эксперимента по комбинированному влиянию холинотропных препаратов. Личинок помещали в четыре ёмкости: с чистой водой (контроль, раствор 1); в раствор атропина в концентрации 0.13 мг/мл (раствор 2) и 0.4 мг/мл (раствор 3); и - пилокарпина - 0.67 мг/мл (раствор 4); добавление к раствору атропина 0.13 мг/мл пилокарпина 0.67 мг/мл (5), перемещение из раствора атропина 0.4 мг/мл в пилокарпин 0.67 мг/мл (6), добавление к раствору атропина 0.4 мг/мл пилокарпина 0.67 мг/мл (7). Через 24 ч часть личинок оставалась в растворах 1–4; часть - из растворов 2 и 3 помещали в новую ёмкость с раствором 4; и часть - находилась в ёмкостях с растворами 2 и 3, к которым был добавлен раствор 4. Личинок фиксировали через 24, 48 и 72 ч, как после их перемещения из атропина в пилокарпин, так и при добавлении пилокарпина к атропину. Параллельно фиксировали контрольных личинок и личинок из растворов атропина и пилокарпина через 12, 24, 48, 72 и 96 ч. В эксперименте использовали концентрации атропина, составляющие 1/15 и 1/5 доли от LC50 и более высокую концентрацию пилокарпина – 1/3 LC50.
Схема проведения эксперимента на обратимость. Личинки были помещены в раствор пилокарпина 2 мг/мл. Через 12 ч после начала воздействия часть личинок оставалась в растворе пилокарпина, другая часть была перемещена в емкость с чистой водой. Личинок зафиксировали: 1) через 12 ч воздействия пилокарпином, 2) через 36 ч воздействия пилокарпином, 3) через 60 ч воздействия пилокарпином, 4) через 24 ч нахождения в воде (после 12 ч воздействия пилокарпином), 5) через 48 ч нахождения в воде (после 12 ч воздействия пилокарпином). Контроль устанавливался через 12, 36 и 60 ч. Во всех экспериментах при каждой экспозиции и концентрации исследовали по 10 личинок (по 10 клеток от каждой личинки).
Глава 3. СОСТОЯНИЕ АКТИВНЫХ РАЙОНОВ И КОМПАКТНОСТИ
ПОЛИТЕННЫХ ХРОМОСОМ CHIRONOMUS PLUMOSUS
Активность функциональных участков ПХ и инверсионный полиморфизм
У личинок обнаружены следующие генотипические комбинации (табл. 2).
Таблица 2
Генотипические комбинации личинок Ch. рlumosus из озера Сазанка
| № № п/п | Генотипические комбинации | Частота встречаемости, % (от 760 особей) |
| 1 | А1.1 В1.1 С1.1 D4.4 Е1.1 F1.1 G1.1 | 6 |
| 2 | А1.2 В1.1 С1.1 D4.4 Е1.1 F1.1 G1.1 | 2 |
| 3 | А1.1 В1.2 С1.1 D4.4 Е1.1 F1.1 G1.1 | 10 |
| 4 | А1.1 В1.1 С1.1 D1.4 Е1.1 F1.1 G1.1 | 10 |
| 5 | А1.1 В2.2 С1.1 D4.4 Е1.1 F1.1 G1.1 | 2 |
| 6 | А1.1 В1.2 С1.1 D4.4 Е1.1 F1.1 G1.1 | 2 |
| 7 | А1.2 В1.2 С1.1 D4.4 Е1.1 F1.1 G1.1 | 10 |
| 8 | А1.2 В1.1 С1.1 D1.4 Е1.1 F1.1 G1.1 | 12 |
| 9 | А1.2 В1.1 С1.1 D4.4 Е1.2 F1.1 G1.1 | 2 |
| 10 | А1.1 В2.2 С1.1 D1.4 Е1.1 F1.1 G1.1 | 2 |
| 11 | А1.1 В1.2 С1.1 D1.4 Е1.1 F1.1 G1.1 | 10 |
| 12 | А1.1 В1.2 С1.1 D4.4 Е1.2 F1.1 G1.1 | 2 |
| 13 | А1.2 В2.2 С1.1 D1.4 Е1.1 F1.1 G1.1 | 2 |
| 14 | А1.2 В1.2 С1.1 D1.4 Е1.1 F1.1 G1.1 | 12 |
| 15 | А1.2 В1.1 С1.1 D1.4 Е1.2 F1.1 G1.1 | 4 |
| 16 | А1.2 В1.2 С1.2 D1.4 Е1.2 F1.1 G1.1 | 2 |
| 17 | А1.5 В1.2 С1.1 D4.4 Е1.1 F1.1 G1.1 | 2 |
| 18 | А1.2 В1.2 С1.1 D4.4 Е1.1 F1.1 G1.1 + В-хромосома | 2 |
| 19 | А1.2 В1.1 С1.1 D1.4 Е1.1 F1.1 G1.1 + В-хромосома | 2 |
| 20 | А1.2 В2.2 С1.1 D1.4 Е1.1 F1.1 G1.1 + В-хромосома | 2 |
| 21 | А1.2 В1.2 С1.1 D1.4 Е1.1 F1.1 G1.1 + В-хромосома | 2 |
Выявлены различия в активности NО на основе естественного полиморфизма между группами личинок с разными генотипическими комбинациями: pluA1.2D1.4 и plu B1.2D1.4; plu A1.2B1.2D1.4 и plu B1.2D1.4; plu A1.2B1.2 и plu B1.2D1.4.
Наибольшая активность NО наблюдалась у личинок с plu B1.2D1.4. У гетерозиготных по последовательности plu В2 личинок по сравнению с гомозиготными (plu В1.1, и plu В2.2) активность BRB увеличена за счет территориального сближения PB и BRB в результате гетерозиготной инверсии. При анализе активности функциональных участков ПХ в зависимости от числа инверсий в кариотипе выявлено увеличение активности BR2G у личинок с наименьшим числом гетерозиготных инверсий, значение BR2GR увеличивалось (от 1.59 при трех инверсиях до 1.63 при двух и 1.88 при одной). Отмечена тенденция к уменьшению разброса значений индексов функциональной активности ПХ в группе подопытных личинок по сравнению с контролем (табл. 3).
Снижение разнородности работы активных участков ПХ личинок в условиях стрессового воздействия токсикантов свидетельствует о мобилизации внутриклеточных ресурсов, подавляющих проявление индивидуальных реакций особей на основе естественного генетического полиморфизма, и позволяет в экспериментах на генотоксичность пренебрегать индивидуальными различиями функциональной активности ПХ особей с разными зиготическими комбинациями.
Таблица 3
Величина дисперсии в период акклимации и при воздействии холинотроных
препаратов
| Индекс активности ПХ | В период акклимации | воздействие | Вероятность сходства дисперсий в контроле и в эксперименте при р≤0.05 |
| CR | 5,96 | 4,57 | <0.01 |
| NОR | 0,49 | 0,44 | 0.02 |
| BRBR | 0,17 | 0,12 | <0.01 |
| BR2GR | 0,2 | 0,04 | <0.01 |
| PBR | 0,05 | 0,04 | <0.01 |
Влияние акклимации
Для ПХ зимних личинок после акклимации характерны: повышение функциональной активности всех BR, увеличение количества работающих BR ПХ IV и PB и измененная картина пуфинга. Стабильно, в 100% из 500 клеток, как у зафиксированных у проруби личинок, так и акклимированных работал NО; число активных BR ПХ IV и PB повышалось (табл. 4). По индексам CR, NОR, PBR достоверных различий не обнаружено.
Таблица 4
Число работающих активных участков ПХ во время акклимации личинок
| Показатель работает, % | BRBR | BR1GR | BR2GR | PBR |
| У личинок, зафиксированных у проруби | 24 | 85 | 48 | 9 |
| У акклимированных личинок | 23 | 91 | 72 | 12 |
Активность политенных хромосом в контроле и под действием препаратов
Определены границы значений индексов функциональной активности и число работающих активных участков ПХ личинок в контроле и эксперименте при действии холинотропных препаратов (табл. 5, 6). Наиболее вариабельным является индекс компактности.
Таблица 5
Значения индексов активности ПХ в контроле и эксперименте
| Индексы активности ПХ | контроль | атропин | пилокарпин |
| CR | 4.60-18.00 | 5.00-16.67 | 4.60-22.00 |
| NOR | 1.00-5.00 | 1.00-5.00 | 1.00-5.00 |
| BRBR | 1.00-3.00 | 1.00-2.67 | 1.00-2.75 |
| BR1GR | 1.00-2.50 | 1.00-2.50 | 1.00-2.00 |
| BR2GR | 1.00-3.00 | 1.00-2.67 | 1.00-2.00 |
| PBR | 1.00-2.67 | 1.00-2.67 | 1.00-2.50 |
Таблица 6
Число работающих активных участков ПХ в контроле и эксперименте
| Индексы активности ПХ | контроль, % | атропин, % | пилокарпин, % |
| NOR | 98 | 97 | 99 |
| BRBR | 41 | 30 | 70 |
| BR1GR | 13 | 9 | 54 |
| BR2GR | 24 | 10 | 19 |
| PBR | 14 | 12 | 13 |
Глава 4. ДИНАМИКА ФУНКЦИОНАЛЬНОЙ АКТИВНОСТИ ПОЛИТЕННЫХ ХРОМОСОМ ПОД ДЕЙСТВИЕМ АТРОПИНА И ПИЛОКАРПИНА
Динамика активности участка ПХ связана с его функциональной ролью: NO - участок, участвующий в поддержании клеточного гомеостаза, и компактность ПХ рассматриваются как показатели «общих» функций (Ильинская, 1990; Зацепина, 2007), а BR, характерные для клеток ряда органов двукрылых насекомых и ответственными за выработку секрета слюнными железами, как показатели «специфических функций» (Кикнадзе, 1972; Жимулёв, 1992).
Активность NO в момент первичного отклика (к 12 ч) при действии атропина снижалась, пилокарпина – возрастала (рис. 1). При увеличении продолжительности влияния и атропина, и пилокарпина происходило восстановление активности NO до состояния в контроле, что в целом характеризует этот участок как устойчивый к стрессовому воздействию.
 I
I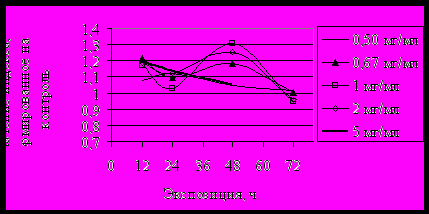 II
IIРис. 1. Изменение индекса NOR под влиянием: I - атропина, II – пилокарпина.
Снижение функциональной активности ПХ по индексу компактности - CR под действием атропина выявлено к 72 ч (рис. 2.I). В момент же первичного отклика активность резко повышалась, что свидетельствовало о включении краткосрочных механизмов клеточной гиперкомпенсации, которого при продолжительном воздействии было недостаточно для сохранения гомеостаза. При действии пилокарпина характер изменений функциональной активности ПХ был прямо противоположным: в момент первичного отклика происходило ее резкое снижение, повышение же отмечалось к 72 ч (рис. 2, II). Результаты свидетельствуют об изменении компактности ПХ, как одного из наиболее чувствительных показателей отклика интерфазного ядра на воздействие.
 I
I II
IIРис. 2. Изменение индекса компактности под влиянием: I - атропина, II – пилокарпина
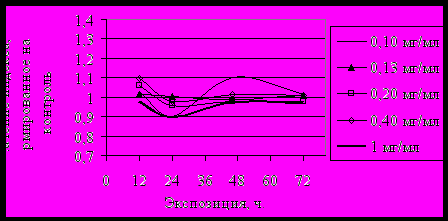
Активность BRB под действием атропина снижалась (рис. 3-5, I), - BRB, BR1G, BR2G под действием пилокарпина - увеличивалась (рис. 3-5, II), что свидетельствовало о подавлении работы участков, ответственных за секрецию желез под действием атропина и активации под действием пилокарпина, соответственно фармакологическим особенностям влияния этих препаратов на секреторную деятельность слюнных желез. При влиянии атропина, подавляющего секреторную активность желёз, отмечалось угнетение работы BR, участвующих в синтезе тканеспецифических гликозилированных белков секрета. При влиянии пилокарпина, стимулирующего секрецию, активность BR, напротив, возрастала. Характер изменения активности BR при действии холинотропных препаратов коррелировал с реакцией NO.
 I
I II
IIРис. 3. Изменение индекса BRBR под влиянием: I - атропина, II–пилокарпина
 I
I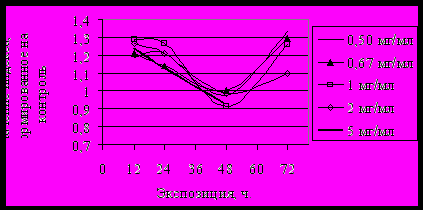 II
IIРис. 4. Изменение индекса BR1GR под влиянием: I–атропина, II–пилокарпина
 I
I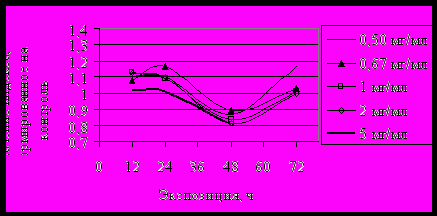 II
IIРис. 5. Изменение индекса BR2GR под влиянием: I - атропина, II–пилокарпина
Активность PB в диапазоне исследованных концентраций атропина, не вызывающих летальный эффект у личинок, незначительно изменялась в момент первичного отклика, в отличие от действия пилокарпина (рис. 6). При увеличении экспозиции пилокарпина в концентрации, вызывающей летальный эффект у личинок, равновесие смещалось в сторону снижения активности ПХ. О токсичности препарата на субклеточном уровне может свидетельствовать неадекватная реакция PB.
Атропин и пилокарпин индуцировали появление пуфов de novo, не отмеченных в контроле. Под действием атропина возникали пуфы IА6с-а+7a-l, IA10c-v, IA11s-w+12a-q, IID14z-a+13w-k, пилокарпина–IIC14-15, IIIF13n-p14a-e. При всех исследованных концентрациях и экспозициях препаратов пуфинговая активность возникала у единичных особей и изменялась произвольно.
 I
I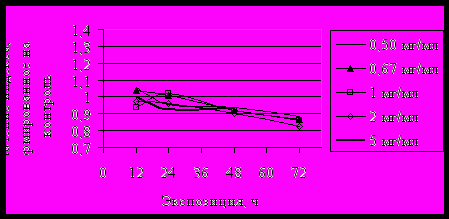 II
IIРис. 6. Изменение индекса PBR под влиянием I - атропина, II – пилокарпина
Сравнительный анализ действия LC50 атропина и пилокарпина
Функциональная активность ПХ по индексу компактности при LC50 атропина в целом повышалась, в то время, как работа всех активных участков ПХ была понижена. При действии LC50 пилокарпина отмечалось повышение активности NO и BRB. Повышение активности NO и функциональной активности ПХ по CR отражает отсутствие резкого угнетения деятельности интерфазного ядра под действием заведомо токсичной концентрации препарата. Снижение активности BR и PB свидетельствует о подавлении работы участков, ответственных за секрецию слюнных желез.
Глава 5. ЦИТОГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ АТРОПИНА И ПИЛОКАРПИНА ПРИ КОМБИНИРОВАННОМ ДЕЙСТВИИ
Проведенный анализ функциональной активности ПХ слюнных желез при одновременном действии пилокарпина и атропина на личинок Ch. plumosus in vivo подтвердил закономерность наступления сначала холиномиметического, а затем типичного холиноблокирующего эффекта, что вполне согласуется с данными, полученными при действии этих препаратов на слюнные железы других биологических объектов (Левин, Высотский, 1949; Levin, 1992). Пилокарпин, как агонист м-холинорецепторов, раньше связывался с ними, а антагонистические свойства атропина проявлялись позже, что, возможно, обусловлено различиями этих препаратов по химической структуре и характеру межмолекулярного взаимодействия с аминокислотами в составе м-холинорецепторов (Samarskii, 1996). Повышение функциональной активности ПХ по по индексу компактности через 24 ч при перемещении личинок в раствор пилокарпина (4) после предварительной обработки атропином (раствор 2) свидетельствовало о включении краткосрочных механизмов клеточной адаптации в ответ на стрессовое воздействие (рис. 7). Снижение функциональной активности ПХ по индексу компактности в последующие 2 сут при предварительной обработке атропином (растворы 2 и 3) объяснялось недостаточностью краткосрочного толчка для сохранения гомеостаза и истощением компенсаторных механизмов. Выявленный нами характер изменений значений CR позволяет говорить о чувствительности этого показателя при стрессовом воздействии.
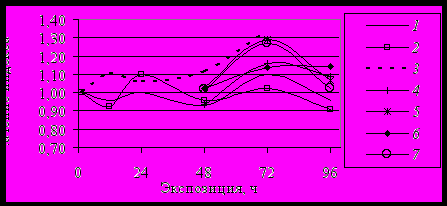
Рис. 7. Изменение индекса компактности при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
На основе динамики работы NO отмечен нами как устойчивый при стрессовом воздействии. Так, после кратковременного снижения активности NO через 24 ч равновесие в работе этого активного участка восстанавливалась при перемещении из раствора 3 в раствор 4 через 48–72 ч (рис 8).

Рис. 8. Изменение индекса NOR при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
Снижение активности NO при добавлении раствора 4 к раствору 3 при всех экспозициях свидетельствовало об угнетении его работы под действием смеси препаратов с более высокой концентрацией атропина.
О снижении компенсаторных реакций свидетельствовало также подавление активности BR1G через 24 ч и 72 ч и - BR2G через 24 ч после перемещения из атропина (растворы 2 и 3) в пилокарпин (4) (рис. 9, 10).
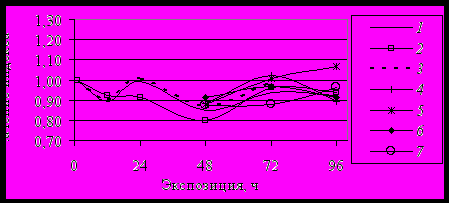
Рис. 9. Изменение индекса BR1GR при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
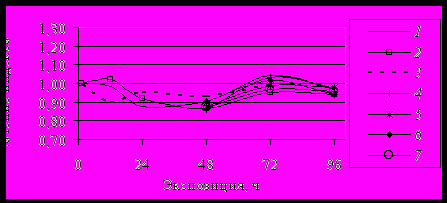
Рис. 10. Изменение индекса BR2GR при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
Отмечено увеличение активности BRB и PB Ch. plumosus, как участков, ответственных за синтез секрета слюнных желез, вслед за его выведением под влиянием пилокарпина, - BR1G через 72 ч и PB с 24 до 48 ч после перемещения из раствора 3 в раствор 4 (рис 9, 11). Наблюдаемый нами цитогенетический эффект согласуется с данными Валеевой (1975) по особенностям действия пилокарпина на ПХ другого вида Chironomus - Ch. thummi (= Ch. riparius).
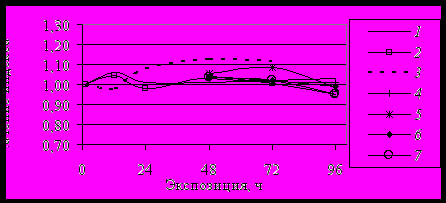
Рис. 11. Изменение индекса PBR при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
О токсическом действии смеси атропина и пилокарпина свидетельствовало снижение: функциональной активности ПХ по по индексу компактности через 48 ч; функциональной активности BRВ при всех экспозициях (рис. 12); активности BR1G и BR2G через 24 ч при добавлении раствора 4 к раствору 2 и функциональной активности ПХ по по индексу компактности через 48 ч; а также снижение активности BRВ и BR2G через 24 ч; - BR1G с 24 ч до 48 ч; PB через 72 ч при добавлении раствора 4 к раствору 3.

Рис. 12. Изменение индекса BRВR при воздействии холинотропных препаратов in vivo. Обозначения в тексте.
Был выявлен значительный подавляющий функциональную активность ПХ эффект смеси препаратов, как при повышении концентрации атропина, так и - добавлении пилокарпина к атропину. Такой цитогенетический эффект, по-видимому, объясняется известными ранее данными (Левин, Высотский, 1949) о том, что с увеличением концентрации атропина в смеси начальная пилокарпиновая стадия укорачивается, а последующая атропиновая – удлиняется. Критерием токсичности на субклеточном уровне послужило угнетение активности NO при увеличении доли холиноблокатора в смеси. Действительно, нарушение функций NO, ответственного за поддержание гомеостаза в клетке и являющегося сенсором многих стрессовых воздействий, приводит к апоптозу и гибели клеток (Зацепина, 2007), в связи с чем, ответная реакция NO специфична и может служить индикатором биологической активности.
Глава 6. ОБРАТИМОСТЬ ИЗМЕНЕНИЙ АКТИВНОСТИ ЯДРЫШКОВОГО ОРГАНИЗАТОРА И КОЛЕЦ БАЛЬБИАНИ ПОД ВЛИЯНИЕМ ПИЛОКАРПИНА
Действие пилокарпина в концентрации 2 мг/мл привело к угнетению NO и BR при 60 ч. Активность NO, сниженная к 12 ч по сравнению с контролем, вновь возрастала к 36 ч, и затем равномерно понизилась к 60 ч (рис. 13).

Рис. 13. Обратимость изменений индекса NОR при влиянии 2 мг/мл пилокарпина (П)
Неоднозначный характер изменений активности NO свидетельствовал о включении краткосрочных механизмов адаптации в ответ на токсическое действие пилокарпина и сбое циклической активности по сравнению с контролем. Угнетение работы BR при продолжительном действии пилокарпина - об избыточном количестве синтезируемого секрета и, вследствие этого, подавлении работы участков ПХ, ответственных за секреторную деятельность желез (рис. 14-16).

Рис. 14. Обратимость изменений индекса BR1GR при влиянии 2 мг/мл пилокарпина (П)

Рис. 15. Обратимость изменений индекса BR2GR при влиянии 2 мг/мл пилокарпина (П)
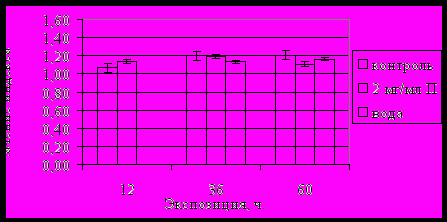
Рис. 16. Обратимость изменений индекса BRВR при влиянии 2 мг/мл пилокарпина (П)
Повышение активности всех BR после 12 ч воздействия пилокарпином у личинок, перемещенных в чистую воду, по-видимому, объяснялось необходимостью восстановления равновесия между выведением секрета и его синтезом.
В целом цитогенетические эффекты пилокарпина свидетельствовали о функциональной разбалансировке активных участков ПХ под действием заведомо токсичной концентрации - 2 мг/мл. Изменения активности участков ПХ, даже при токсичной концентрации пилокарпина – 2 мг/мл, приводящей к образованию максимального количества пуфов de novo, обратимы, что согласуется с мнением Ильинской (1989) о модификационной природе изменчивости активности ПХ.
В заключении подведены основные результаты диссертационного исследования.
ВЫВОДЫ
1. В качестве оптимизации методических подходов к оценке действия лекарственных препаратов рекомендовано: проводить эксперимент по воздействию без субстрата; цитогенетические эффекты оценивать на фоне морфофункциональных изменений у личинок; полученные при влиянии результаты нормировать на контроль; снизить количество изучаемых параметров до NOR, уменьшение значений которого может служить критерием токсического действия на субклеточном уровне.
2. Выявленo, что при акклимации личинок Ch. plumosus к лабораторным условиям происходит: повышение функциональной активности всех BR, увеличение количества работающих BRG и PB и изменение картины пуфинга. Определены границы изменчивости и процент работающих активных участков ПХ в контроле, наиболее вариабелен индекс компактности, наиболее стабильно работает NO.
3. Установлена зависимость активности ряда участков ПХ от генотипических характеристик личинок: увеличение активности BRB у личинок с гомо- и гетерозиготной инверсией plu В2 по сравнению с личинками, гомозиготными по последовательности plu В1; уменьшение активности BR2G при возрастании числа гетерозиготных инверсий в кариотипе; изменчивость NO у личинок с разными генотипическими комбинациями (plu A1.2 D1.4 и plu B1.2D1.4, plu A1.2B1.2D1.4 и plu B1.2D1.4, plu A1.2B1.2 и plu B1.2D1.4), что указывает на индивидуальные особенности реакции особей на основе естественного генетического полиморфизма и свидетельствуют о работе генома как единой сбалансированной системы.
4. Выявлено, что атропин в остром периоде в целом снижает функциональную активность ПХ, а пилокарпин – повышает. Адекватно воздействию холинотропных препаратов меняются значения NOR и BRBR в отличие от BRGR и PВR, характер изменений которых не согласован. Показано, что наиболее чувствительным к воздействию холинотропных препаратов является компактность ПХ, наиболее устойчивым – индекс NOR.
5. Проанализированы цитогенетические эффекты холинотропных препаратов с противоположным действием на секрецию при их комбинированном влиянии. Значительный подавляющий функциональную активность ПХ эффект наблюдался, как при повышении концентрации атропина в смеси, так и добавлении раствора пилокарпина к атропину по сравнению с перемещением из атропина в пилокарпин. Увеличение концентрации холиноблокатора в смеси препаратов приводит к токсическому цитогенетическому эффекту.
6. Показана обратимость всех изменений функциональной активности NO, всех BR и пуфов даже после воздействия токсической концентрации пилокарпина, что подтверждает модификационный характер изменчивости морфологии ПХ, известный ранее для компактности.
СПИСОК РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Полуконова Н.В., Фёдорова И.А. Эколого-кариологическая оценка последствий действия экологических факторов на хирономид (Chironomidae, Diptera) // Поволжский экологический журн. 2006. № 2/3. С. 164-175.
2. Фёдорова И.А., Полуконова Н.В. Оптимизация методов хромосомного мониторинга водных экосистем разного типа // Экологические проблемы урбанизированных территорий: материалы научн.-практ. конференции. Елец: ЕГУ им. И.А. Бунина. 2007. С. 151-155.
3. Полуконова Н.В., Белянина С.И., Фёдорова И.А. Методологические подходы к анализу генотоксичности // XXI Любищевские чтения. Современные проблемы эволюции (сборник докладов). Ульяновск: Ульяновский гос. пед. ун-т. 2007. С. 180-186.
4. Фёдорова И.А., Полуконова Н.В. Особенности цитогенетического анализа ткани слюнных желез личинок хирономид под воздействием холинотропных препаратов // Тезисы всероссийской научной конференции. Астрахань 20-22 сентября, 2007 г. Астрахань. 2007. С. 191.
5. Фёдорова И.А., Полуконова Н.В. Цитогенетические эффекты политенных хромосом хирономид под влиянием холинотропных препаратов // Тезисы XIII Международной школы-конференции молодых учёных «Биология внутренних вод». Борок, 23–26 октября 2007 г. Борок, 2007. С. 54.
6. Полуконова Н.В., Дёмин А.Г., Катаева И.В., Фёдорова И.А. Анализ сообществ, популяций и генома хирономид (Diptera) в биомониторинге гидроэкосистем // Тезисы 9-ой конференции (сессии стендовых сообщений) «Водные экосистемы, организмы, инновации – 9» МГУ. М. 2007 г. С. 102.
7. Фёдорова И.А., Полуконова Н.В. Реакция различных участков генома хирономид (Diptera) под действием атропина // Энтомологические и паразитологические исследования в Поволжье. Вып. 6. Саратов. Изд-во Сарат. ун-та. 2007. С. 65-73.
8. Фёдорова И.А. Цитогенетический анализ действия атропина // Материалы межрегиональной научно-практической конференции «Молодежь и наука: итоги и перспективы» Саратов. Изд-во Сарат. ун-та. 2007. С. 81.
9. Полуконова Н.В., Ермохин М.В., Воронин М.Ю., Дёмин А.Г., Катаева И.В., Фёдорова И.А., Козлов М.С. Биологический мониторинг водных экосистем на основе анализа сообществ, популяций, кариотипа и мтДНК хирономид (Chironomidae, Diptera) // Известия Саратовского гос. ун-та. Серия биологическая. 2007. С. 71-78.
10. Фёдорова И.А., Полуконова Н.В. Изменение транскрипционной активности политенных хромосом Chironomus plumosus (Diptera) под действием полулетальной концентрации атропина // Тр. Ставропольского отделения Русского энтомол. об-ва. Вып. 4: материалы Междунар. Научно-практ. конфер. Ставропольский гос. аграрный ун-т. Ставрополь: АРГУС. 2008. С. 269-273.
11. Фёдорова И. А., Полуконова Н. В. Динамика транскрипционной активности политенных хромосом и морфофункционального состояния личинок Chironomus plumosus (Chironomidae, Diptera) при разных концентрациях атропина // Материалы III Всероссийской конфер. по водной токсикологии, посвященной памяти Б. А. Флерова «Антропогенное влияние на водные организмы и экосистемы» Ч. 2. Борок. 2008. С. 172-175.
12. Фёдорова И. А., Полуконова Н. В. Цитогенетические эффекты холинотропных препаратов антагонистического действия // Материалы межрегиональной научно-практической конференции «Молодежь и наука: итоги и перспективы» Саратов. Изд-во Сарат. ун-та. 2008. С. 169.
13. Фёдорова И.А., Полуконова Н.В., Дворецкий К.Н., Богословская С.И.
Функциональная активность политенных хромосом Chironomus (Diptera) под влиянием холинотропных препаратов атропина и пилокарпина // Экологическая генетика. 2009, Т. 7. № 3. С. 44-52.
14. Фёдорова И. А., Полуконова Н. В., Петров Н. В. Цитогенетические эффекты холинотропных препаратов при комбинированном действии на личинок Chironomus plumosus (Diptera) in vivo // Цитология. 2009, Т. 51. № 10. С. 849-855.
Фёдорова Ирина Александровна
ХАРАКТЕР ИЗМЕНЕНИЯ ФУНКЦИОНАЛЬНО АКТИВНЫХ УЧАСТКОВ И КОМПАКТНОСТИ ПОЛИТЕННЫХ ХРОМОСОМ CHIRONOMUS (DIPTERA) ПОД ВЛИЯНИЕМ ХОЛИНОТРОПНЫХ ПРЕПАРАТОВ
Автореферат
_______________________________________________________________
Подписано к печати 16.10.2009г.
Формат 60х84/16. Бумага офсетная. Печать офсетная.
Гарнитура «Таймс». Усл.печ. л. 1,16 (1,25).
Тираж 100. Заказ № 893.
_________________________________________________________
Отпечатано с оригинал-макета
в ООО «Принт-Клуб»
4
 10026, г.Саратов, ул.Московская 160. Тел.: (845-2) 507-888
10026, г.Саратов, ул.Московская 160. Тел.: (845-2) 507-888 - использование личинок 7 фазы обусловлено повышением титра гормона линьки – экдизона к стадии предкуколки (Кикнадзе, 1978), способного кратковременно увеличивать концентрацию м-холинорецепторов (Wegener et al., 1996) и обеспечивать повышенную чувствительность слюнных желез к воздействию препаратов этой группы
*
* - содержание личинок при экотоксикологических исследованиях в стандартном грунте-смеси песка и ила (1:1), приведенном во Временном методическом руководстве (2002), на наш взгляд, нецелесообразно при тестировании лекарственных препаратов т.к., с одной стороны, большинство из них в открытые водоемы и грунт не попадают, а, с другой, - адсорбция препарата на поверхности частиц ила приводит к снижению его концентрации в воде и, в конечном счёте, искажению результатов
- звездочкой отмечены индексы, обозначения для которых предложены нами
- изменение значения индекса компактности обратно пропорционально изменению функциональной активности ПХ
