Методичні рекомендації щодо проведення уроків та позакласних заходів, розв’язання розрахункових задач з хімії, бере участь у всіх методичних конкурсах
| Вид материала | Методичні рекомендації |
- План заходів щодо розв, 58.53kb.
- Методичні рекомендації Розглянути тему даного семінару-практикуму на засіданнях шкільних, 54.7kb.
- Методичні рекомендації щодо проведення тематичних уроків, лекцій, виховних заходів, 28.16kb.
- Методичні рекомендації про проведення ІІ (районного) етапу Всеукраїнської учнівської, 46.17kb.
- Реферат на тему, 64.88kb.
- Затвердити заходи щодо розв’язання актуальних проблем осіб з обмеженими фізичними можливостями, 57.07kb.
- Методика проведення позакласних занять з математики. Методика розв’язування задач, 28.16kb.
- Про методичні рекомендації щодо проведення ІІ етапу Всеукраїнської учнівської, 17.03kb.
- Про графічний спосіб розв’язання математичних задач, 262.98kb.
- Відділ освіти Овруцької райдержадміністрації Овруцька загальноосвітня школа №3 Позакласна, 579.77kb.
В
 ікулова Ірина Геннадіївна,
ікулова Ірина Геннадіївна,Бердичівський професійний аграрний ліцей
На протязі 10 років викладач-методист проводить науково - дослідну діяльність з учнями, веде активну просвітницьку роботу. Так як грошей на роботу з дітьми немає (ні оплачуваних гуртків, ні факультативів, ні наукових учнівських товариств), вона переробила програму і тематичні плани так, щоб мати можливість за рахунок резервного часу і в позаурочний час проводити з дітьми екологічні дослідження. Обдаровані учні в свій вільний час під її керівництвом беруть участь в реалізації ІННОВАЦІЙНИХ ЕКОЛОГІЧНИХ ПРОЕКТІВ
Роботи Вікулової І. Г. друкувалися у «Віснику профтехосвіти» (Житомир, 2006р.), журналі «Хімія» (видавництво «Основа», Харків, 2007р.), у збірнику «Дослідна та проектна діяльність під час вивчення хімії» (Харків, видавнича група «Основа», 2008р), висвітлювалися у мас-медіа: газетах м. Бердичева, на телебаченні (ТРК «Вік»).
Викладач
- співпрацює з лабораторією хімії Житомирського обласного інституту післядипломної педагогічної освіти (у 2008р. знайомила педагогів області з досвідом впровадження в навчальний процес методу проектів та використання мультимедійних засобів навчання).
- пропонує власні спеціальні зошити для проведення лабораторних та практичних робіт для учнів ПТНЗ (хімія, біологія) та зошит-підручник з хімії для учнів І курсу,
- розробляє методичні рекомендації щодо проведення уроків та позакласних заходів, розв’язання розрахункових задач з хімії,
- бере участь у всіх методичних конкурсах:
- дипломант Всеукраїнського конкурсу методичної літератури 2006р.,
- дипломант Всеукраїнської естафети інноваційних проектів 2007р,
- в грудні 2008 р. брала участь у обласному проекті «Інформаційно-методичне забезпечення впровадження державних стандартів професійно-технічної освіти в навчальний процес ПТНЗ» - розробила :
- робочий зошит-конспект для учнів ПТНЗ (окремі теми) з
предметів «Трактори», «Будова і експлуатація автомобілів», «Хімія»,
- робочий зошит-конспект для учнів ПТНЗ (окремі теми) з предметів «Кулінарія», «Технологія приготування їжі» «Хімія»,
- посібник експрес-контроль «Предмет трактори» (окремі теми без ТО), «Хімія»,
- в грудні 2009 р. взяла участь у обласному проекті Intel- навчання для майбутнього – зробила електронний зошит для лабораторних та практичних робіт з біології, навчальні проекти: «Утилізація сміття», «Забруднення атмосфери м. Бердичева автотранспортом», «Забруднення гідросфери»,
- в лютому 2010 р. представляла учнів та їх дослідницькі роботи на ІІ етапі - національного етапу міжнародного конкурсу науково-технічної творчості школярів Intel ISEF 2010 (International Science and Engineering Fair),
- в грудні 2010 р. взяла участь у обласному проекті на кращій дидактичний матеріал,
- в лютому 2011 р. почала навчальний проект «Вода, яку ми п’ємо».
Фрагмент посібника МАйстер-клас викладача ПТНЗ
РОЗВ’ЯЗАННЯ ЗАДАЧ З ХІМІЇ
(з досвіду роботи)
Хімія – це одна з найважливіших наук, відомих людству. Вона належить до тих природничих дисциплін, які розглядають питання, що мають безпосереднє відношення до повсякденних турбот людини. Існує багато речей навколо, виробництво яких неможливо без знання хімічної науки. Хімічні знання необхідні всім людям незалежно від їх фаху. Це потрібно для усвідомлення ролі хімії у вирішенні сировинних, енергетичних, харчових та медичних проблем людства, для безпеки в повсякденному житті та діяльності в усіх галузях виробництва.
На уроках хімії вивчають найважливіші елементи, їх прості та складні речовини, поширеність у природі, способи добування, застосування речовин, виробництва, проводять хімічні дослідження, розв’язують задачі різних типів. Хімія є досить складною наукою, тому потрібна наполегливість і систематичність при її вивченні.
З огляду на це викладачем БПАЛ, членом методичної комісії природничо-математичних дисциплін розроблені дані рекомендації. Вони створені задля досягнення наступних цілей:
- полегшення розуміння учнями навчального матеріалу;
- відтворення в їх пам’яті певних ключових вмінь та навичок;
- закріплення алгоритму розв’язування стереотипних задач (алгоритмізація процесу мислення);
- підтримання інтересу до навчання;
- розвитку творчих здібностей ;
- стимуляції активності;
- поступового залучення до самостійної пізнавальної діяльності;
- забезпечення співпраці між учнями і викладачами;
- виховання любові до предмету.
Любов до предмету виникає лише тоді, коли є його розуміння. А останнє може прийти в результаті наполегливої праці.
Розв’язування задач у процесі вивчення хімії – найраціональнішій метод засвоєння та закріплення теоретичного матеріалу. На жаль, цей вид діяльності залишається для багатьох учнів складним і не дуже цікавим заняттям.
Аналізуючи контрольні роботи за курс основної школи, які пишуть учні ПТНЗ на початку навчального року (т.з. “нульовий зріз”, приходимо до висновку, що в учнів недостатньо сформовані загальні вміння і навички розв’язування хімічних задач. Це притаманно для усіх видів задач.
У тлумачному словнику Ожегова С. І. “задача” трактується як вправа, яка виконується, розв’язується за допомогою умовиводу, розрахунку і т.д. [13].
Хімічну задачу можна розглядати як систему, стан якої характеризується певними параметрами. Звичайно хімічною задачею називають невелику проблему, яку можна розв’язати за допомогою логічних умовиводів, математичних дій, хімічного експерименту на основі понять, законів і методів хімії [27].
Серед засобів навчання особливе місце займають розрахункові хімічні задачі. Розв’язування їх є одним з найважливіших засобів поєднання теорії з практикою, активізації розумової діяльності учнів у процесі вивчення основ хімії. Задачі – це засіб, який дозволяє не тільки використовувати теоретичні знання, а й може бути використаний для стимулювання вивчення нових тем. Вміння розв’язувати задачі є критерієм творчого засвоєння курсу, сприяє формуванню в учнів хімічного мислення і розвитку самостійності.
Завдання хімічної освіти – це не лише формування в учнів знань про речовини та їх перетворення, а й розвиток експериментальних умінь, вироблення навичок безпечного поводження з речовинами в побуті та на виробництві. Досягти цієї мети можливо лише за умови використання хімічного експерименту на уроці, зокрема експериментальних задач.
Уроки, на яких відбувається формування вмінь розв’язувати задачі, мають істотну відмінність від інших навчальних уроків, оскільки на них інтегруються теоретичні знання й узагальнені розрахункові вміння, послідовно вироблені вправами. Діяльність учня під час виконання задач легко піддається управлінню й добре алгоритмується. Упровадження алгоритмів сприяє чіткої послідовності розв’язку задач, підвищує рівень сформованості цих умінь
Використання комп’ютерних технологій у навчальному процесі дає змогу змінити підходи до добору методів та форм його організації. Метод проектів сприяє виробленню дослідницьких навичок в учнів, розвитку пізнавального інтересу [3]. Ми пропонуємо використовувати його під час роботи з навчальною інформацією, застосовуючи комп’ютерні технології.
Бінарний урок - нестандартна форма навчання з реалізації міжпредметних зв'язків. Це творчість двох педагогів. Вивчення якоїсь проблеми на грані двох наук - це завжди цікаво, такий вид діяльності викликає високу мотивацію. На жаль, бінарні уроки в навчальній системі - це, скоріше, виняток з правила. Їх важко спіставити з навчальною програмою двох, трьох предметів, виникають складнощі з розкладом. Та і часу для підготовки такого уроку потрібно більше, ніж для звичайного. Але в результаті можна побачите, що учні отримали не просто теоретичні знання, а відразу ж знайшли їм практичне застосування.
Зміст посібника:
| Передмова ……………………...………...…………………………..…... | 5 |
| Розділ 1. Розв’язання розрахункових задач за допомогою алгоритмів ……………………………………………………………...... | 8 |
| 1.1. Розв’язування задач на обчислення маси (об’єму) продукту реакції за масою (об’ємом) реагентів, один з яких узято в надлишку …………......……………………………...…………………... | 8 |
| 1.2. Розв’язування задач на вихід продукту реакції .....….……………. | 9 |
| 1.2.1. Приклад 1. Знаходження масової чи об’ємної частки виходу продукту ……………………………..……………................................. | 10 |
| 1.2.2. Приклад 2. Знаходження маси чи об’єму продукту реакції ……………………………………...………………………….... | 11 |
| 1.3. Розв’язування задач на знаходження молекулярної формули сполуки з масовими частками елементів у цій речовині ……………………………………….……………………….... | 14 |
| 1.4. Розв’язування задач на знаходження молекулярної формули газуватої речовини за її відносною густиною за іншім газом і масовими частками елементів у цій речовині ........................................ | 16 |
| 1.5. Розв’язування задач на знаходження молекулярної формули газу за продуктами згоряння ……………………………………………...…. | 18 |
| 1.6. Розв’язування задач на визначення формул органічних речовин за загальними формулами класів органічних сполук ……………….... | 21 |
| 1.7. Розв’язування задач на знаходження молекулярної формули сполуки за рівнянням хімічної реакції …………………………...……. | 24 |
| Розділ 2. Розв’язання експериментальних задач за допомогою алгоритмів ….………………………………………………………...….. | 25 |
| 2.1. Фрагмент робочого зошиту для лабораторних та практичних робіт з хімії. Практична робота № 3 ……….………………………...... | 26 |
| 2.2. Інструктивна картка диференційованих експериментальних задач (за рівнем навчальних досягнень). Практична робота №3 ……………………………………………………………………...... | 33 |
| Розділ 3. Використання методу проектів на уроках хімії при розв’язуванні розрахункових задач …………….……………………. | 36 |
| 3.1. Навчально-дослідницький проект ...……………………..……….. | 36 |
| 3.2. Розробка інтегрованого (бінарного) уроку хімії та інформатики з мультимедійним супроводом “Розв’язання задач на виведення молекулярної формули газу за масою (об’ємом) продуктів згоряння” …………………………………………………………..……. | 39 |
| Термінологічний словничок………………………………….………... | 59 |
| Додаток 1. Безпека праці під час роботи на комп’ютері ………..….. | 61 |
| Додаток 2. Якісні реакції на катіони ……………………………..…… | 63 |
| Додаток 3. Якісні реакції на аніони ……………………………..…….. | 65 |
| Використана література .………………………………………….…… | 67 |
1. Розв’язування задач на знаходження молекулярної формули сполуки з масовими частками елементів у цій речовині за допомогою алгоритмів
Хімічні формули – позначення кількісного і якісного складу речовини за допомогою символів хімічних елементів та індексів.
Наприклад про те, що молекула сульфатної кислоти складається з двох атомів Гідрогену, одного атому Сульфуру і чотирьох атомів Оксигену, свідчить формула Н2SО4.
Масову частку елемента знаходять за формулою:
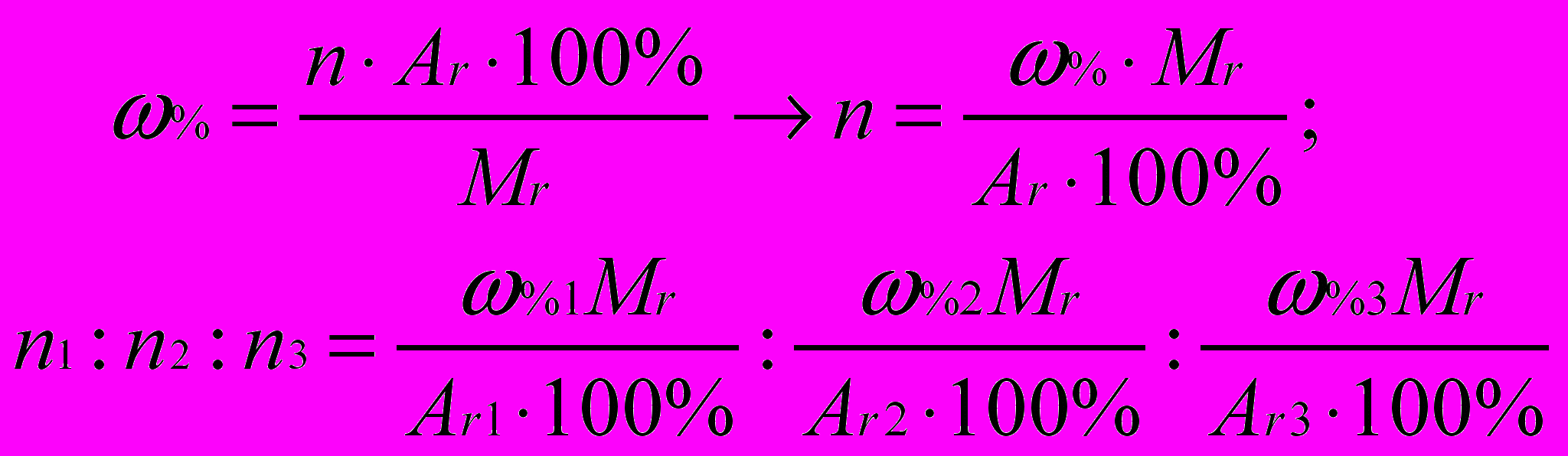
Скорочуємо усі вирази на Мr / 100% та одержуємо формулу визначення
числа атомів у речовині:
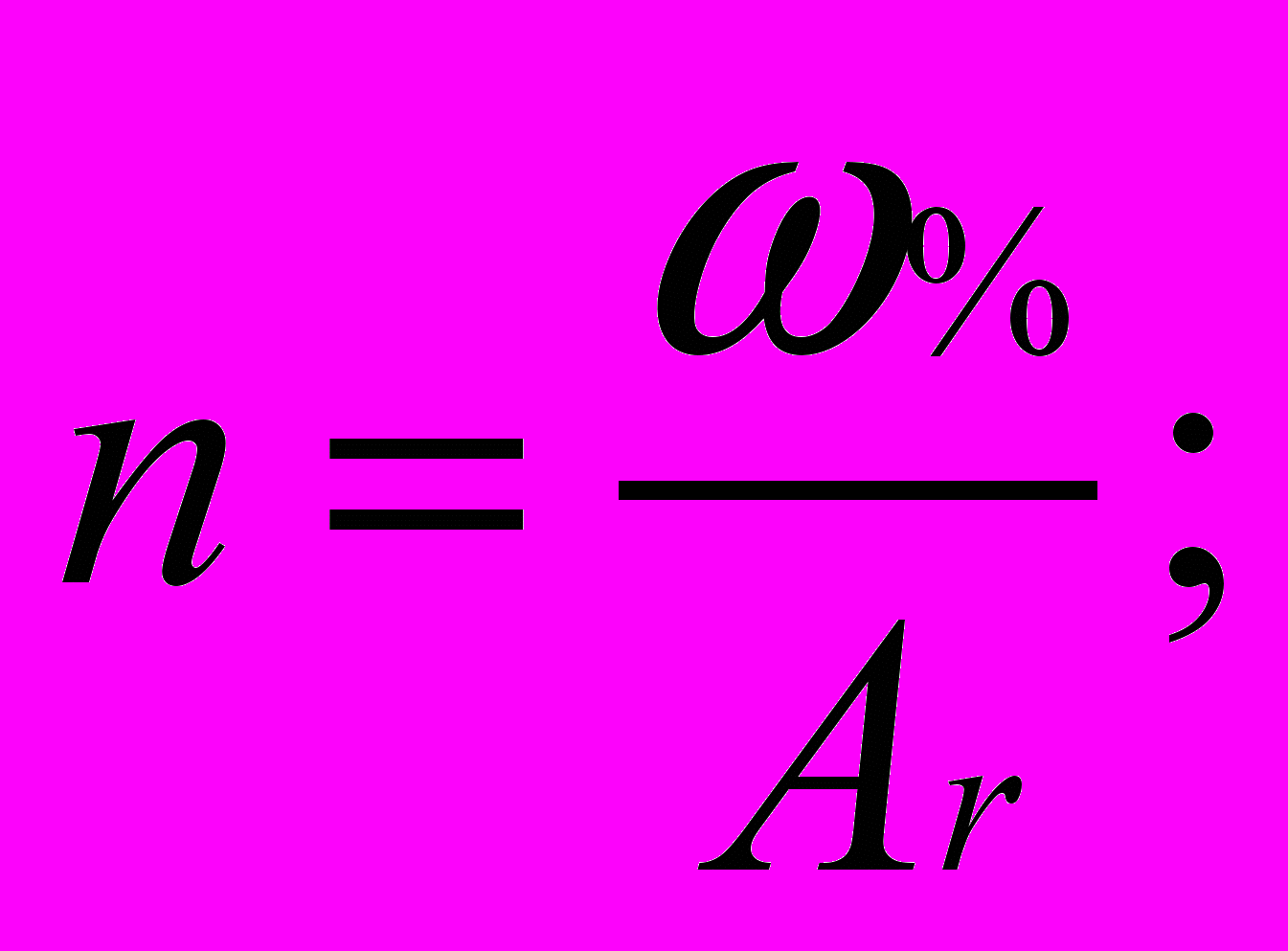
Алгоритм розв’язування задач:
- Запишіть скорочену умову задачі.
- Позначте число атомів кожного елементу, який входить до складу речовини через х, у, z …m, n… і т.д.
- Знайдіть відношення числа атомів елементів за формулою:
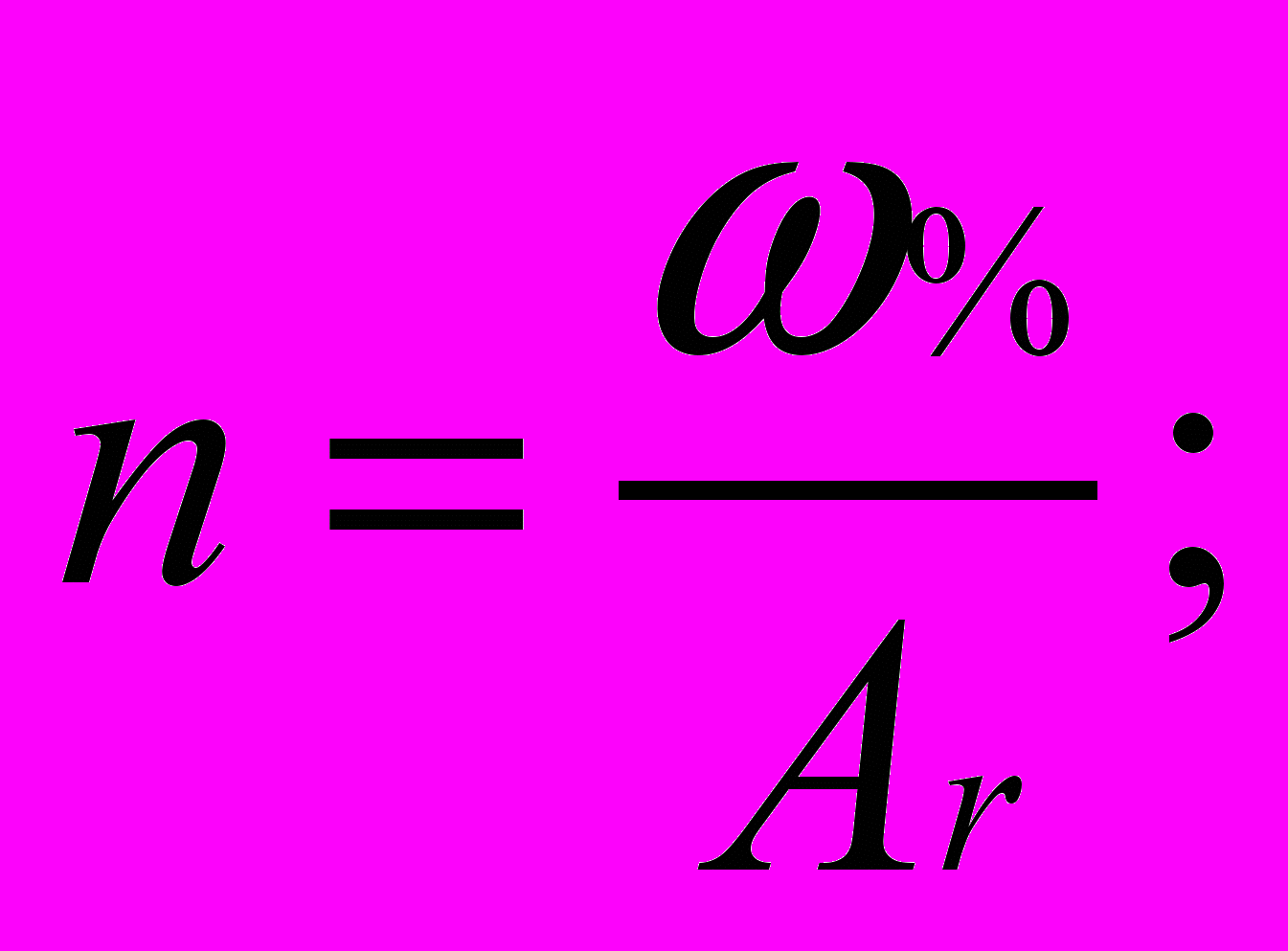 (поділивши масові частки кожного елемента – ω% на його відносну атомну масу – Аr).
(поділивши масові частки кожного елемента – ω% на його відносну атомну масу – Аr).
- Приведіть отримані дані до цілочислених значень, поділивши їх на найменше число.
4* Якщо знову з’являються дробові числа, перемножте їх усі на 2,3… і т.д.
- Знайдіть найпростішу формулу речовини.
Приклад
Задача 1. Знайти найпростішу формулу речовини, якщомасова частка Натрію становить 42,1%, Фосфору – 18,9%, Оксигену – 39%. Дайте назву речовині за систематичною номенклатурою.
Д
 ано: Розв’язування задачі:
ано: Розв’язування задачі:1
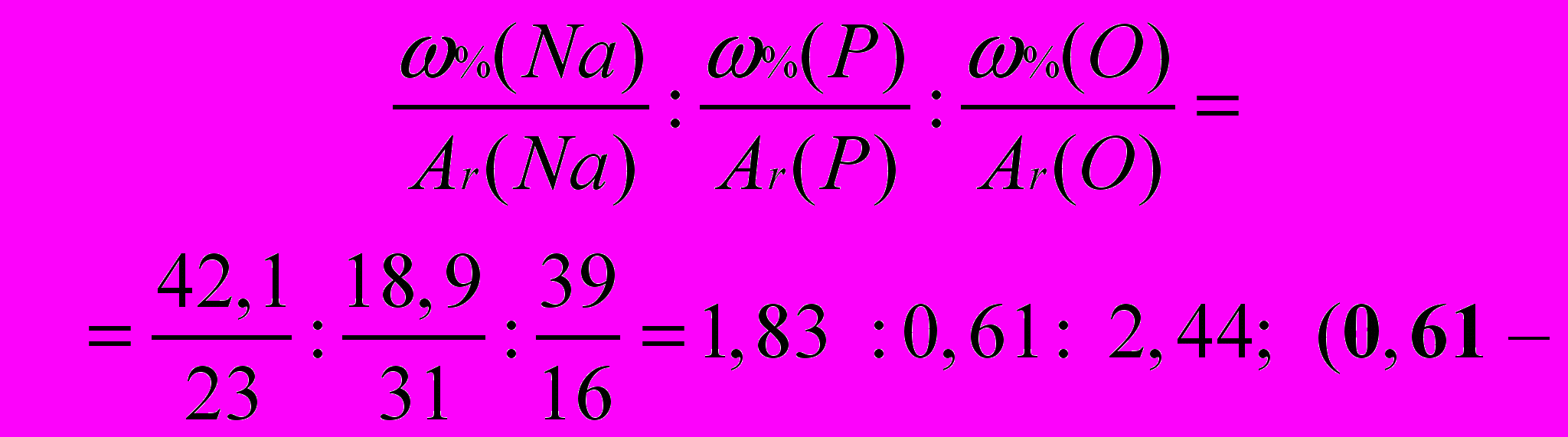 .ω%(Na) = 42,1% 2. Naх Ру Оz;
.ω%(Na) = 42,1% 2. Naх Ру Оz;ω%(P) = 18,9% 3. х : у : z =
ω% (O) = 39% Мол. формула – ?
найменше число);
4. х : у : z = (1,83 / 0,61) : (0,61 / 0,61) : : (2,44 / 0,61) = 3 : 1 : 4;
5. Найпростіша формула речовини – Na 3 РО4.
Відповідь: молекулярна формула речовини – Na3РО4, це натрій ортофосфат.
2. Інструктивна картка диференційованих експериментальних задач (за рівнем навчальних досягнень)
Алгоритм виконання роботи:
- Запишіть номер, тему, мету практичної роботи.
- Ознайомтесь з правилами безпеки праці при роботі з їдкими речовинами та поставте підпис.
- Прочитайте уважно умови задачі.
- Виконайте практично досліди, опишіть хід роботи, запишіть рівняння реакцій, зазначте ознаки реакцій.
 Практична робота № 3
Практична робота № 3_____________ _____________ _______________________________
(число, місяць) (номер групи) (прізвище, ім’я)
Тема: Розв’язування експериментальних задач.
Мета: закріпити та перевірити практичні вміння та навички з розпізнавання і добування в лабораторних умовах сполук металів, а також планування та проведення дослідів згідно з запропонованими схемами.
З правилами безпеки праці ознайомлений __________ (підпис)
Хід роботи:
І рівень
Задача І. До розчину купрум (ІІ) сульфату додайте розчин калій гідроксиду. Запишіть рівняння реакції, визначте ознаки реакції.
Задача 2. У двох пронумерованих пробірках містяться розчини калій карбонату і калій сульфату. Використовуючи хлоридну кислоту,
визначте, в якій з них – розчин калій карбонату.
ІІ рівень
Задача І. Доведіть на досліді, в яких пробірках містяться розчини купрум (ІІ)
сульфату і ферум (ІІІ) сульфату.
Задача 2. Здійснити практично реакцію, що виражається таким йонним рівнянням: Ва3+ + SO42– → ВаSO4 ↓
ІІІ рівень
Задача І. Добудьте розчин ферум (ІІІ) гідроксиду з розчину ферум (ІІІ) хлориду.
Задача 2. В трьох пронумерованих пробірках містяться розчини речовин: натрій хлорид, натрій сульфат, натрій карбонат. Визначте вміст кожної пробірки.
IV рівень
Задача І. Доказати якісний склад ферум (ІІІ) сульфату за допомогою якісних реакцій.
Задача 2. В трьох пронумерованих пробірках містяться розчини речовин: калій хлорид, калій карбонат, калій сульфат. Визначте вміст кожної пробірки.
Задача 3. Здійснити практично реакцію, що виражається таким йонним рівнянням: Са2+ + CO32– → СаСО3 ↓
Завдання для контролю
1. Розпізнати розчини натрій нітрату і натрій карбонату можна дією:
а) калій гідроксиду; б) води; в) хлоридної кислоти; г) калій сульфату.
Напишіть рівняння реакції у молекулярному, повному та скороченому йонному вигляді.
2. З ферум (ІІІ) хлоридом не реагує:
а) натрій гідроксид; б) сульфатна кислота; в) ортофосфатна кислота; г) натрій силікат.
3. У водному розчині не можуть разом існувати йони:
а) Al3+ i Cl – ; б) Ag+ i Cl – ; в) Ag+ i NO–3 ; г) Ba2+ i Cl – Чому?
4. Складіть генетичний ряд з речовин, формули яких приведені нижче:
CaCO3 ; Ca(OH)2 ; CaO ; Ca.
5. Складіть молекулярні рівняння реакцій, за допомогою яких можна здійснити перетворення за такою схемою:
залізо → ферум (ІІ) хлорид → ферум (ІІ) гідроксид → ферум (ІІІ) гідроксид → ферум (ІІІ)оксид → ферум (ІІІ) хлорид.
3. Розробка інтегрованого уроку хімії та інформатики з мультимедійним супроводом
Урок в групі 7Б – професія “оператор комп'ютерного набору, конторський службовець (бухгалтер)”
Дата проведення – 30.11.2010 р.
Тема: “Розв'язання задач на виведення молекулярної формули газуватого вуглеводню за масою (об'ємом) продуктів згоряння ”
Епіграф до уроку: “Пам'ятайте: якщо ви хочете навчитися плавати, то сміло заходьте у воду, а якщо хочете навчитися розв'язувати задачі, то розв'язуйте їх ” Д.Пойа
Мета уроку:
- Навчальна: продовжити формування вміння розв'язання задач на визначення формули газу; закріпити знання учнів про логічні функції та їх використання;
- Розвивальна: розвивати навички дослідницької діяльності учнів шляхом пошуку багатоваріантного підходу до розв‘язання задач, шляхом інтеграції знань з різних предметів, шляхом використання електронних таблиць; розвивати синтетичне і аналітичне мислення учнів;
- Виховна: підвищувати зацікавленість учнів у вивченні хімії, математики і інформатики; виховувати акуратність, вміння і навички раціонального використання свого часу.
Тип уроку: комбінований:
- урок засвоєння нових знань;
- урок застосування знань, умінь і навичок.
Форма уроку: інтегрований урок хімії та інформатики, урок розв’язання задач з мультимедійним супроводом.
Форма організації навчальної діяльності:
- Методи та прийоми навчання: метод проектів, елементи інтерактивних технологій «мікрофон», «мозковий штурм», самооцінка учнями своєї роботи; розповідь, пояснення, взаємодія в парах, міні-презентації учнів, перегляд відеосюжетів, розв’язування задач різними способами, робота з комп’ютером, повторення правил безпеки життєдіяльності при роботі з комп’ютером.
- Дидактичне та технічне забезпечення: роздатковий матеріал (алгоритм розв’язання задач на виведення молекулярної формули газуватого вуглеводню за масою (об'ємом) продуктів згоряння, листи із завданнями, звітний аркуш, аркуш з рефлексією), мультимедійний проектор, екран, біла дошка з плакатним папером, маркер, комп’ютери для учнів, годинник, презентація в програмі Microsoft Power Point, табл. “Періодична система Д.І.Менделєєва”.
Базові поняття та терміни: вуглеводні, продукти повного згоряння вуглеводнів, маса, молярна маса, об’єм, молярний об’єм, кількість речовини, алгоритм, проект, логічні функції, програма Microsoft Exсle.
Міжпредметні зв’язки: математика, інформатика, фізика, безпека життєдіяльності (охорона праці), інформаційні технології.
Очікувані навчальні результати: учні повинні опанувати алгоритм розв’язування задач на знаходження молекулярної формули речовини за продуктами згоряння та вміти розв’язувати задачі цього типу; навчитися проводити дослідження по виведенню формул для розрахунків шляхом інтеграції знань з різних предметів, шляхом використання електронних таблиць.
Випереджувальне завдання для дослідницької бригади: провести дослідження і визначити найважливіші формули для розрахунків у програмі Exсеl.
Перша група проводила визначення маси Карбону у карбон (IV) оксиді – СО2 (за масою) та визначення числа атомів Карбону у молекулі речовини, що згоріла (за масою).
Друга група проводила визначення маси Карбону в карбон (IV) оксиді – СО2 (за об'ємом) і визначення числа атомів Карбону у молекулі речовини, що згоріла (за об'ємом).
Третя група проводила визначення маси Гідрогену в речовині, що згоріла та визначення числа атомів Гідрогену у речовині, що згоріла.
Структура уроку:
І. Організаційний етап (1-2 хв.)
ІІ. Актуалізація опорних знань учнів –“мозковий штурм” (5 хв.)
ІІІ. Мотивація навчальної діяльності учнів, повідомлення теми та мети уроку (1 хв.)
ІV. Вивчення нового матеріалу (38 хв.)
- Перегляд відеосюжету про дослідницьку діяльність учнів БПАЛ.


- Розв’язання задач за алгоритмом.
- Розв’язання задач за рівнянням реакції.
- Навчальний проект викладача.
- Мініпрезентації учнів.
- Повторення правил безпеки праці при роботі з комп’ютером – інструктаж на робочому місці.
- Усвідомлення одержаних знань (39 хв.)
- самостійна робота в парах за комп’ютером в програмі Exсle;
- фізхвилинка (1,5-2 хв.);
- продовження роботи в парах по розв’язанню задач;
- самооцінка.
- самостійна робота в парах за комп’ютером в програмі Exсle;
- Усвідомлення одержаних знань (39 хв.)
VІ. Підсумок уроку – рефлексія (2 хв.)
VІІ. Домашнє завдання (2 хв.)
Алгоритм розв’язування задач:
- Запишіть скорочену умову задачі.
- Складіть рівняння реакції згоряння речовини.
- Підпишіть відомі дані над речовинами. Підпишіть під речовинами дані, виходячи з рівняння реакції (кількість речовини – υ, молярну масу – М або молярний об’єм – Vm та масу – m ).
- Знайдіть кількість атомів Карбону (розрахунки за молекулою СО2).
- Знайдіть кількість атомів Гідрогену(розрахунки за молекулою Н2О).
- Знайдіть відношення кількостей Карбону та Гідрогену.
- Знайдіть найпростішу формулу речовини.
- Розрахуйте молярну масу найпростішої речовини.
- Знайдіть молярну масу речовини, що згоріла за формулою: D =
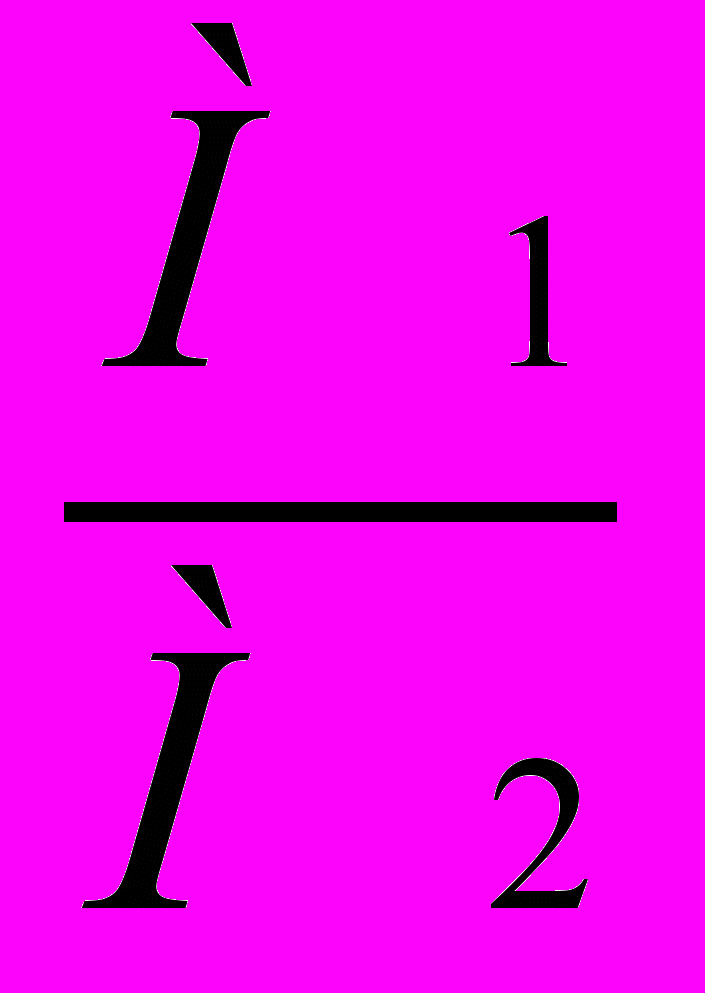 ;
;
- M1 = D∙ M2 ; М (Н2) = 2 г/моль; М(повітря) = 29 г/моль
- 10. Знайдіть число n, яке показує у скільки разів потрібно збільшити індекси найпростішої формули:
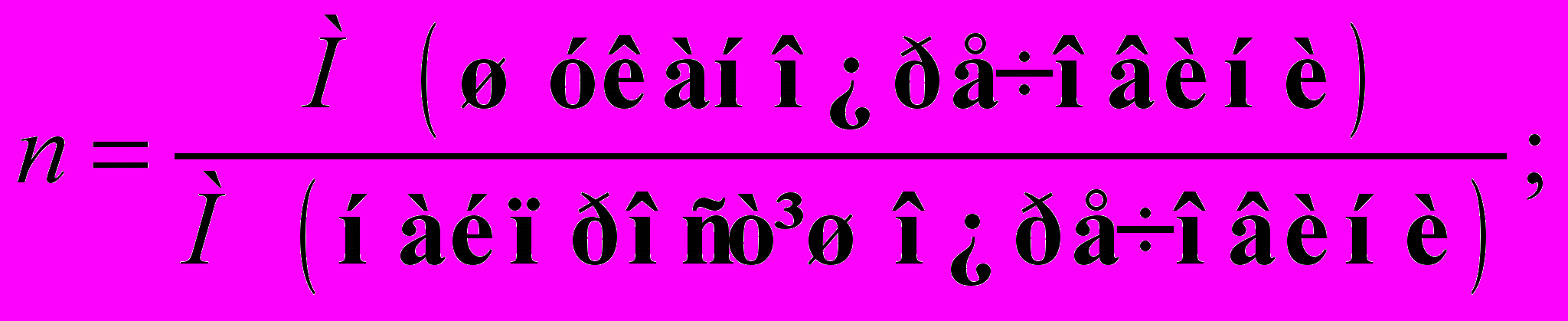
- Напишіть справжню формулу речовини.
Використана література:
- Величко Л.П., Ярошенко О.Г. Програма з хімії для ЗНЗ, – К., 2010, –16 с.
- Винник О.Ф., Федченко В.М.,Світська Т.М. Використання комп’ютерних технологій візуалізації на уроках хімії // Хімія, 2005. – с.23.
- Вікулова І.Г. Упровадження інноваційних проектів. Дослідна та проектна діяльність під час вивчення хімії (збірник). – Х.: Основа, 2008. с. 21-63.
- Гольдфарб Я.Л., Ходаков Ю.В. Збірник задач і вправ з хімії –К.:Радянська школа. 1981. – 182 с.
- Грабовий А. Експериментальні задачі з хімії // Хімія та біологія в школі, 2008. – с.14
- Клейман, Т.М. Школи майбутнього: Комп'ютери в процесі навчання. – М.: Просвещение, 1997. –с.48.
- Лабий Ю.М. так ін. Хімія. Задачі та вправи. –К.: Вища школа. 1981. – 104 с.
- Мархель І.І. Комп'ютерна технологія навчання // Педагогіка, 1990 № 5 –с. 84
- Мастер-класс учителя химии (сборник) – М.: Глобус, 2010. –269 с.
- Назарова Т.С., Лаврова В.Н. Использование учебного оборудования на практических занятиях по химии. – М.: Владос, 2008. –72 с.
Назарова Т.С., Лаврова В.Н. Карты-инструкции для практических занятий по химии.– М.: Владос, 2000. –56с.
- Николаенко В.К. Решение задач повышенной сложности по общей и неорганической химии. К.: Радянська школа, 1990. –159 с.
- Новошинский И.И., Новошинская Н.С. Тетрадь для практических работ к учебнику Новошинского И.И., Новошинской Н.С. – Краснодар:, Советская Кубань, 2008. – 42 с.
- Обаленцова Л.М. Розв’язування задач на виведення молекулярних формул вуглеводнів// Хімія, 2010. – с.6-8.
- Ожегов С.И. Словарь русского языка – М.: Русский язык. 1978. – 846 с.
- Пак М. Мікрокалькулятори на уроках хімії. – М.: Просвещение,1988. – 68 с.
- Полєскова Л. Урок з теми «Естери» // Хімія та біологія в школі, 2010. – с. 26-28.
- Пометун О., Пироженко Л. Сучасний урок. Інтерактивні технології навчання. К.: А.С.К., 2005. – 108с.
- Попель П.П., Крикля Л.С. Хімія-10 (зошит для практичних робіт), – К.:Академія, 2010. – с.44.
- Попель П.П., Крикля Л.С. Хімія-10, – К.:Академія, 2010. – 206 с.
- Сергєєва Т.А. Про використання персональних ЕРМ в навчанні хімії //Хімія в школі, 1985 № 5. – 86 с.
- Сорока Л. Хімія. Екологічні задачі. – Тернопіль: Мандрівець, 2003. – 77с.
- Сухан В.В., Табенська Т.В., Капустян А.Й., Горлач В.Ф. Хімія-посібник для вступників до ВУЗів. – К.: Либідь, 1993. – с.
- Сучасний урок у 11 класі/Упоряід. К.М.Задорожний – Х.: Основа. 2005. – 207 с.
- Тимченко О.В. Використання алгоритмів під час розв’язування розрахункових задач з хімії //Хімія, 2011 №2 – с.2-8.
- Усе для атестації учителя хімії / – Х.: Ранок. 2009. – 240 с.
- Цветков Л.О. Органічна хімія-10 –К.: Радянська школа, 1988. – 223 с.
- Шаповалов А.І. Методика розв’язування задач з хімії – К.: Радянська школа. 1989. – 87с.
- Я готуюсь до уроку хімії. 10-й клас. Випуск 2 / Упоряд. Г. Мальченко, О. Каретникова. – К.: Редакція загально педагогічних газет, 2004. – 128 с.
- Ярошенко О.Г. Компакт-підручник Неорганічна хімія – К.: Станіца-Київ. 1997. – 6с.
- Ярошенко О.Г. Компакт-підручник Органічна хімія – К.: Станіца-Київ. 1997. – 6с.
- Ярошенко О.Г. Хімія -10 –К.: Грамота, 2010. – 223 с.
- Ярошенко О.Г., Новицька В.І. Завдання і вправи х хімії –К.: Станіца-Київ. 2007. – 291с.

