Опыт Резерфорда. Планетарная модель атома. Постулаты Бора
| Вид материала | Урок |
- Торсионная модель строения атома резюме по анализу планетарной модели атома, 664.76kb.
- Этапы Время Приемы и методы Актуализация 10 мин. Сообщения учащихся изложение, 55.81kb.
- Атомная энергетика Ядерная модель строения атома. Постулаты Бора, 71.8kb.
- Основы атомной физики. Развитие представлений о строении атома. Модели Томсона и Резерфорда., 63.54kb.
- Інститут управління природними ресурсами Кафедра фундаментальних наук Реферат з концепції, 134.65kb.
- Модель атома Резерфорда І Бора, 162.23kb.
- Элементы квантовой механики Атом Резерфорда – Бора и гипотеза де Бройля Ядерная модель, 38.71kb.
- Володимирівна Номінація «Фізика», 210.34kb.
- Задачи: дать представление о форме различных орбиталей; обобщив полученные знания,, 82.88kb.
- Темы рефератов по истории и философии науки (история физики), 40.39kb.
Тема: Опыт Резерфорда. Планетарная модель атома. Постулаты Бора.
Цель урока:
- познакомить учащихся с фундаментальным опытом Резерфорда, с планетарной моделью атома
- Познакомить учащихся с постулатами Бора, раскрывающие основные свойства атома.
План урока
| Этапы урока | Время, мин | Приемы и методы |
| 1. Повторение материала предыдущего урока | 10-12 | Фронтальный и письменный опрос. Решение задач. |
| 2. Изложение нового материала. Выступление ученика с докладом о Резерфорде. | 18-20 | Рассказ учителя с элементами беседы. Демонстрация модельного эксперимента. Записи учащихся в тетради |
| 3. Отработка изученного материала. | 15 | Решение задач |
| 4. Подведение итогов. Домашнее задание. | 2 | Сообщение учителя. Запись на доске |
- Фронтальная беседа с использованием иллюстраций.
а) Каково значение опытов по дифракции электронов?
б) В чем состоит гипотеза де Бройля?
в) В чем заключаются волновые свойства, корпускулярные свойства микрочастиц?
г) Образуется ли дифракционная картина одним электроном?
д) Объясните образование дифракционной картины от множества электронов, движущихся по одиночке?
е) Какие корпускулярные характеристики частицы можно определить, зная длину волны де Бройля?
- Изучение нового материала
- Модель атома Дж. Дж. Томсона.
- Экспериментальное исследование распределения положительного заряда, а значит и массы внутри атома. Опыт Резерфорда. Схема опытов Резерфорда (рис. 245 учебника). Интерпретация полученных результатов.
- Определение размеров атомного ядра. Ядро имеет диаметр порядка 10-12-10-15 см. При условии, что заряд электрона принят за единицу, заряд в точности равен номеру данного химического элемента в периодической таблице Д.И.Менделеева.
- Планетарная модель строения атома
- В центре расположено положительно заряженное атомное ядро, в котором сосредоточена вся масса.
- Отрицательный заряд всех электронов распределен по всему объему атома.
- Модель атома водорода (рис. 247 учебника).
- Противоречия между планетарной модели атома и законами классической электродинамики.
Квантовые постулаты Бора
- Атомная система может находиться только в некоторых состояниях, в которых не происходит излучение, хотя при этом заряженные частицы в атоме движутся с ускорением. Такие состояния называются стационарными состояниями атома.
- Любое испускание или поглощение энергии атомов происходит при переходе атома из одного стационарного состояния в другое. При переходе атома из стационарного состояния с энергией En в состояние с энергией Em излучается квант (рис. 2.1), частота которого определяется уравнением
hν= Em – En
Атом, поглощая свет, переходит из низших энергетических состояний в высшие. При этом он поглощает излучение той же самой частоты, которую излучает, переходя из высших энергетических состояний в низшие (рис. 248 учебника).
- Отработка изученного материала
- Решение задач.
Задача № 1
При переходе атома водорода из одного энергетического состояния в другое разница в энергиях этих состояний 1,89 эВ. Определите длину волны излучения

Задача № 2
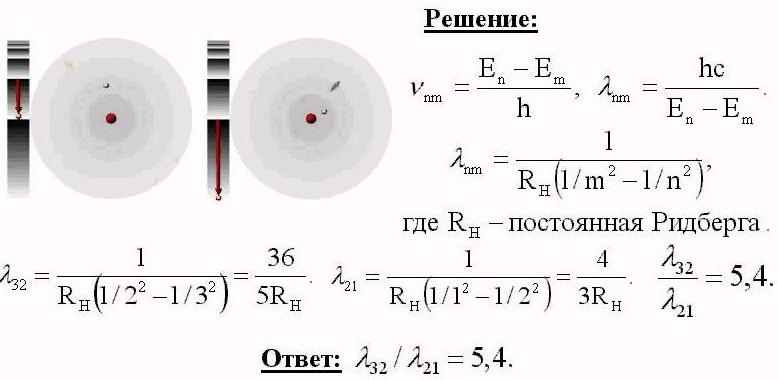
Во сколько раз длина волны излучения атома водорода при переходе из 3его энергетического состояния во 2ое больше длины волны излучения, обусловленного переходом из 2ого состояния в 1ое.
- Тестирование
- Как объяснить, что в опытах Резерфорда некоторые альфа-частицы отклоняются на большие углы?
- Как вращается электрон в атоме?
- Каким зарядом заряжена альфа-частица?
- На примере опыта Резерфорда объясните строение атома.
- Объясните происхождение линейчатого спектра испускания водорода?
- Почему планетарная модель атома не согласуется с классическими законами физики?
- Какое излучения наблюдается при переходах электрона в атоме водорода на низший энергетический уровень?
- Домашнее задание.
- Параграф 94-96
- Упражнение 13 № 2.
- Хрестоматия по физике (стр. 187-191)
- Учебник «Физика 11кл.», Мякишев Г.Я., Бухавцов Б.Б.
