Элементы квантовой механики Атом Резерфорда – Бора и гипотеза де Бройля Ядерная модель атома
| Вид материала | Документы |
СодержаниеОпыты Резерфорда. Ядерная модель атома. Недостатки модели атома по Резерфорду. |
- Атомная энергетика Ядерная модель строения атома. Постулаты Бора, 71.8kb.
- Опыт Резерфорда. Планетарная модель атома. Постулаты Бора, 33.72kb.
- Темы рефератов по истории и философии науки (история физики), 40.39kb.
- Урок 1-2 Строение атома. Опыты Резерфорда., 26.63kb.
- Інститут управління природними ресурсами Кафедра фундаментальних наук Реферат з концепції, 134.65kb.
- Волновые свойства вещества. Эксперименты Дэвиссона и Джермера и др. Гипотеза де Бройля., 58.28kb.
- Модель атома Резерфорда І Бора, 162.23kb.
- Будем пытаться строить модель сознания в духе математики квантовой механики, 181.49kb.
- Программа по курсу «Атомная и ядерная физика», 28.5kb.
- 14. Элементы квантовой статистики и зонной теории твердого тела, 460.81kb.
Элементы квантовой механики
Атом Резерфорда – Бора и гипотеза де Бройля
Ядерная модель атома Резерфорда
Введение. В 19 веке впервые были открыты явления, обнаруживающие сложность строения и свойств атомов, которые до этого рассматривались как мельчайшие частицы вещества. Так в 1833 году М. Фарадей установил, что ток в растворе электролита – это упорядоченное движение заряженных частиц (ионов), минимальный заряд которых примерно равный е = 1,60∙10-19 Кл был назван элементарным электрическим зарядом. Поскольку в обычных условиях атомы являются электронейтральными, то естественно было предположить, что в их состав входят и какие-то положительно заряженные частицы. В 1896 году французский ученый Беккерель обнаружил явление естественной радиоактивности солей урана. Это явление исследовали Пьер и Мария Кюри, доказав, что из атомов вылетают и электроны, и положительно заряженные частицы (впоследствии названные α-частицами). На сложную структуру атомов указывали спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра, и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.). В 1897 году Дж. Томсон открыл электрон и измерил отношение e/m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
В первой модели атома Дж. Томсона (1903 г.) атом рассматривался как заполненный положительным электричеством шар, внутри которого находились электроны. Атом в целом был электронейтрален. Однако в дальнейшем выяснилась несостоятельность этой модели.
Опыты Резерфорда. Эксперименты по исследованию внутренней структуры атомов впервые были выполнены Э. Резерфордом c сотрудниками в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки α-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость порядка 107 м/с). Резерфорд, исследуя прохождение α-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые α–частицы, как показано на рис. 11.1 (примерно одна из 20 000), резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как α-частицы, то Резерфордом был сделан вывод, что значительное отклонение α-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако, значительное отклонение испытывают лишь немногие α-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. Эту часть атома Резерфорд назвал атомным ядром.
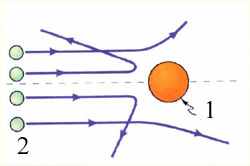
Рис. 11.1. Рассеяние α–частицы в опыте Резерфорда. 1 – атом золота, 2 - α–частицы.
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Ядерная модель атома. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил ядерную (планетарную) модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны (рис. 11.2). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
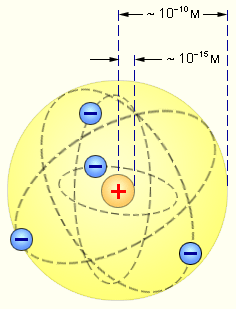
Рис. 11.2 Планетарная модель атома Резерфорда. Показаны круговые орбиты четырёх электронов.
Недостатки модели атома по Резерфорду. Планетарная модель атома, предложенная Резерфордом, явилась крупным шагом в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц. Однако применение представлений классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами. Согласно классической теории, должна иметь место: 1) непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивость атома, поскольку движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию; 2) существование только непрерывного спектра. Дискретные спектральные линии не должны наблюдаться. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
