Рабочая программа и задание на контрольную работу c методическими указаниями для студентов II курса специальности 330200. Инженерная защита
| Вид материала | Рабочая программа |
| С – концентрация, кг/м; к |
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 116.18kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 526.56kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 1259.29kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 201.3kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 162.08kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 188.99kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 1598.02kb.
- Рабочая программа и задание на контрольную работу с методическими указаниями для студентов, 120.13kb.
- Рабочая программа и задание на курсовую работу с методическими указаниями для студентов, 452.76kb.
- Рабочая программа и задания на контрольную работу с методическими указаниями для студентов, 91.67kb.
69. Найдите ζ-потенциал для суспензии кварца в воде. При электрофорезе частицы перемещаются к аноду; смещение границы составило 5·10-2м за 180 с; Н=10·10-2 В/м; ε=81; ε0=8,85·10-12ф/м; η=1·10-3 Н·с/м2.
70. Вычислить скорость электрофореза коллоидных частиц берлинской лазури в воде, если ζ-потенциал составляет 0,058В, Н=5·10-2В/м; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
71. Вычислите ζ-потенциал коллоидных частиц трехсернистого мышьяка в воде, если при электрофорезе за 180 сек граница сместилась на 5,4·10-2м. Н=8·10-2В/м; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
72. Найдите величину ζ-потенциала на границе кварцевое стекло-водный раствор KCl. Процесс электроосмоса характеризовался следующими показателями: J=4·10-4А; время переноса 0,01·10-6м3 раствора τ=12,4с; χ=1,8·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
73. Вычислите величину ζ-потенциала на границе кварц-водный раствор KCl. Процесс электроосмоса получены следующие данные:
J=2·10-3А; время переноса 0,01·10-6м3 раствора τ=11с; χ=6,2·10-2Ом-1·м-1;
η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
74. При какой силе тока в процессе электроосмоса водного раствора KCl через мембрану из полистирола его объемная скорость будет равна 5,5·10-10м3/сек? χ=9·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
Величина ζ-потенциала равна 10·10-3В.
75. Вычислите величину ζ-потенциала на границе водный раствор KCl-мембрана из полистирола. В процессе электроосмоса объемная скорость равнялась 15·10-10м3/сек; J=7·10-3А; χ=9·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
76. Найдите объемную скорость электроосмоса, наблюдаемого в системе: водный раствор KCl – мембрана из полистирола, окрашенная жировым коричневым красителем. ζ-потенциал = 6·10-3В, J=7·10-3А;
χ=9·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
77. Вычислите величину потенциала Е, если через пленку коллодия продавливается водный раствор KCl при p=20·103 H/м2; χ=1,3·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м; ζ-потенциал=6·10-3В.
78. Вычислите величину ζ-потенциала на границе коллодиевая мембрана-водный раствор KCl, если при продавливании раствора через мембрану под давлением 26,6·103Н/м2 потенциал течения Е оказался равным 8,8·10-3В; χ=1,3·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
79. Найдите величину ζ-потенциала на границе керамический фильтр-водный раствор KCl, если при продавливании раствора при p=13,3·103Н/м2 потенциал течения Е равнялся 2·10-3В; χ=1,3·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
80. Под каким давлением должен продавливаться раствор NaCl через керамическую мембрану, чтобы потенциал течения Е был равен 4·10-3В? ζ- потенциал = 3·10-3В; χ=1,3·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
81. Вычислите величину ζ-потенциала на границе керамической мембраны с водным раствором KCl. Е=6·10-3В, p=39.9·10-3Н/м2, χ=1,3·10-2Ом-1·м-1; η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
82. Найдите величину ζ-потенциала на границе: мембрана из углеуислого бария-96%-ный раствор этилового спирта. Е=0,7В,
χ=1,1·10-4Ом-1·м-1; η=1,2·10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м; p=7,9·10-3Н/м2.
83. Какое давление нужно приложить, продавливая через мембрану из углекислого бария 96% этиловый спирт, чтобы при этом потенциал течения Е оказался равным 1,98В? ζ- потенциал = 54·10-3В; χ=1,1·10-2Ом-1·м-1;
η=1,2·10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м.
84. Вычислите величину потенциала Е на границе: кварцевая диафрагма-водный раствор NaCl, если давление, при котором жидкость продавливается через диафрагму p=200Н/м2; χ=8.0·10-2Ом-1·м-1;
η=10-3Н·с/м2, ε=81; ε0=8,85·10-12ф/м; ζ-потенциал=120·10-3В.
5. Оптические свойства дисперсных систем
Изучение оптических свойств коллоидных систем связано с определением дисперсности или концентрации дисперсной фазы.
Как и молекулярные растворы, коллоидные системы поглощают и преломляют свет. Вместе с этим у них ярко проявляется способность к светорассеянию (опалесценции). Объясняется это соизмеримостью коллоидных частиц с длиной световых волн видимой части спектра:
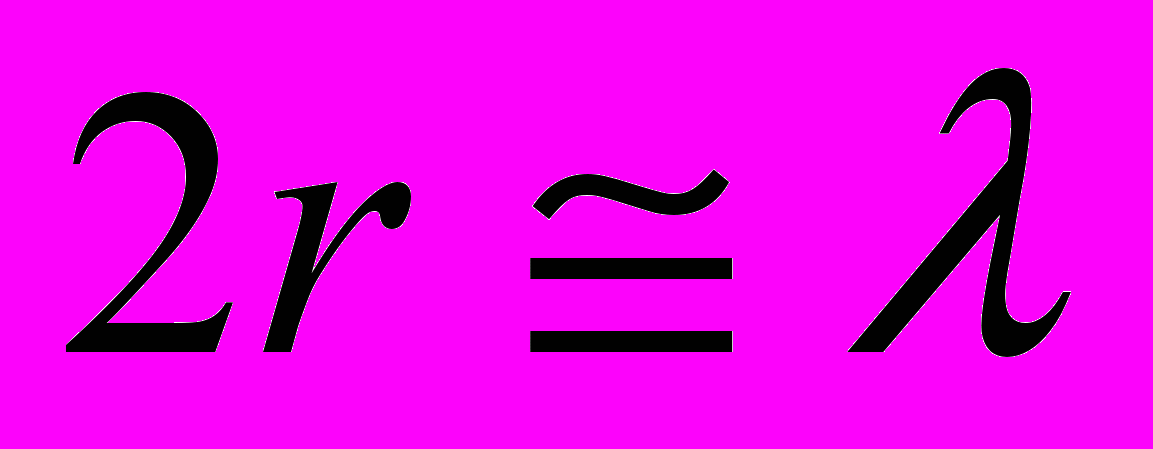 .
.Закон Рэлея устанавливает зависимость интенсивности опалесценции от размера частиц, концентрации:
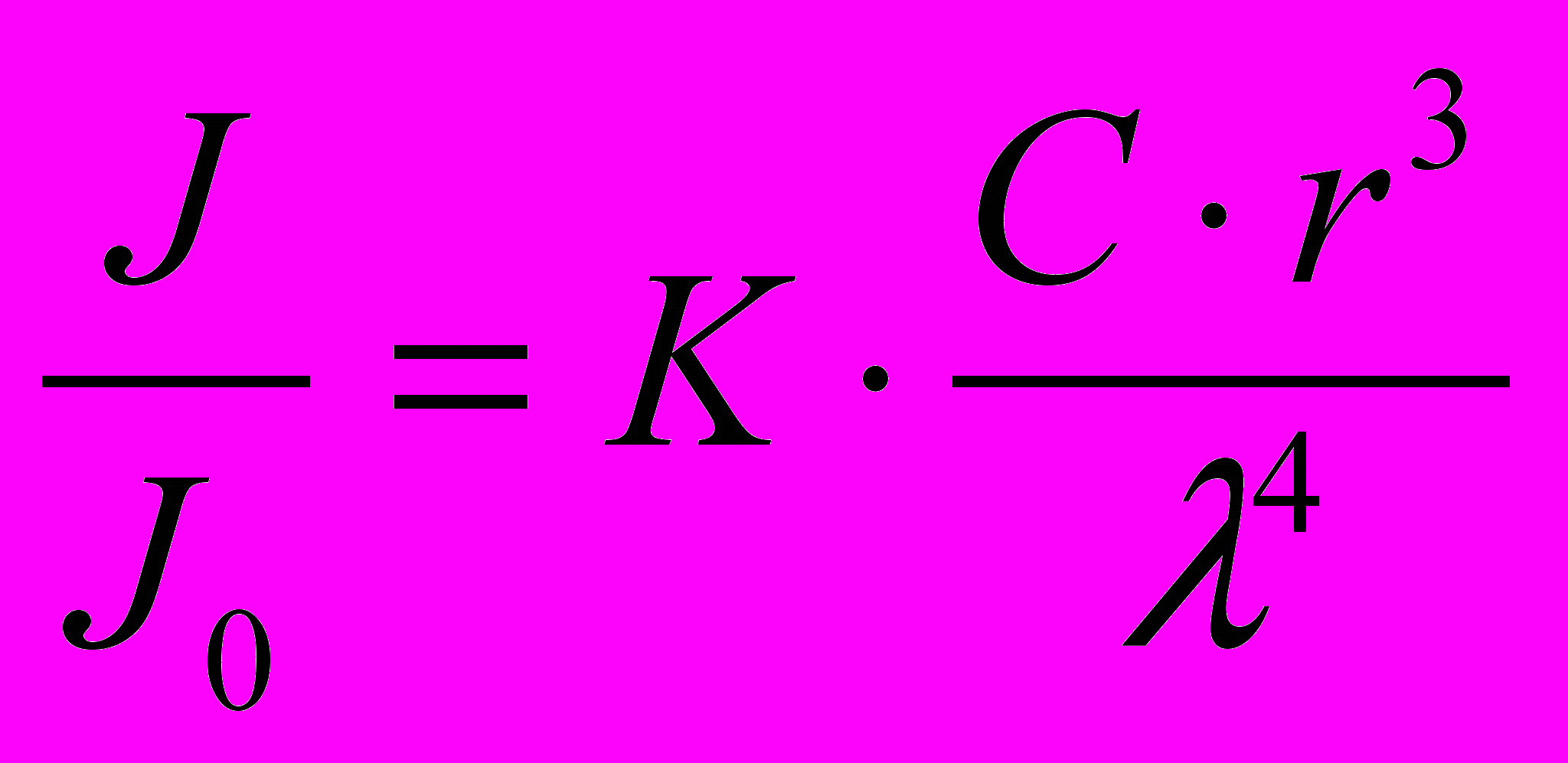 ,
, где J0 – интенсивность падающего света;
С – концентрация, кг/м3;
к – радиус частицы, м;
λ – длина волны падающего света, м;
К – константа.
Отсюда следует, что отношение интенсивности рассеянного света, получившее название мутности и обозначающееся τ, пропорционально концентрации диспергированного вещества и радиусу его части. В определенной области концентраций зависимость τ = (С) является линейной.
Светорассеяние коллоидных растворов измеряется с помощью нефелометров различных систем. Нефелометрия позволяет определить концентрацию или размеры частиц дисперсной фазы.
Сущность метода заключается в сравнении мутностей τ1 и τ2 двух систем, концентрация (или дисперсность) одной из которых известна.
Освещая куветы с золями равномерно падающим светом и меняя высоту освещенной части золей h1 и h2 добиваются равенства интенсивности света, рассеянного обоими золями. Тогда справедливо равенство:
τ 1· h1 = τ2 · h2 ,
а т.к. мутность τ пропорциональна концентрации С, то С1 · h1 = С2 · h2 .
Дебай предложил формулу, связывающую мутность раствора с размером частиц:
τ =Н · С · М,
где С – концентрация, кг/м3;
Н – обобщенная константа;
М – молекулярная или мицеллярная масса вещества.
Уравнение Дебая справедливо для сильно разбавленных растворов.
Опалесценцию можно наблюдать не только в боковом освещении, но также измеряя интенсивность прошедшего света. При прохождении через систему интенсивность падающего света ослабляется вследствие поглощения или рассеяния, причем, согласно закона Ламберта-Бора:
J=J0 е εСd ,
где J – интенсивность прошедшего света;
d – толщина поглощающего слоя, м;
ε – индивидуальная константа, зависящая от природы вещества, длины световой волны и не зависящая от концентрации раствора.
Логарифм отношения интенсивности падающего света к интенсивности прошедшего света называется оптической плотностью системы Dλ:
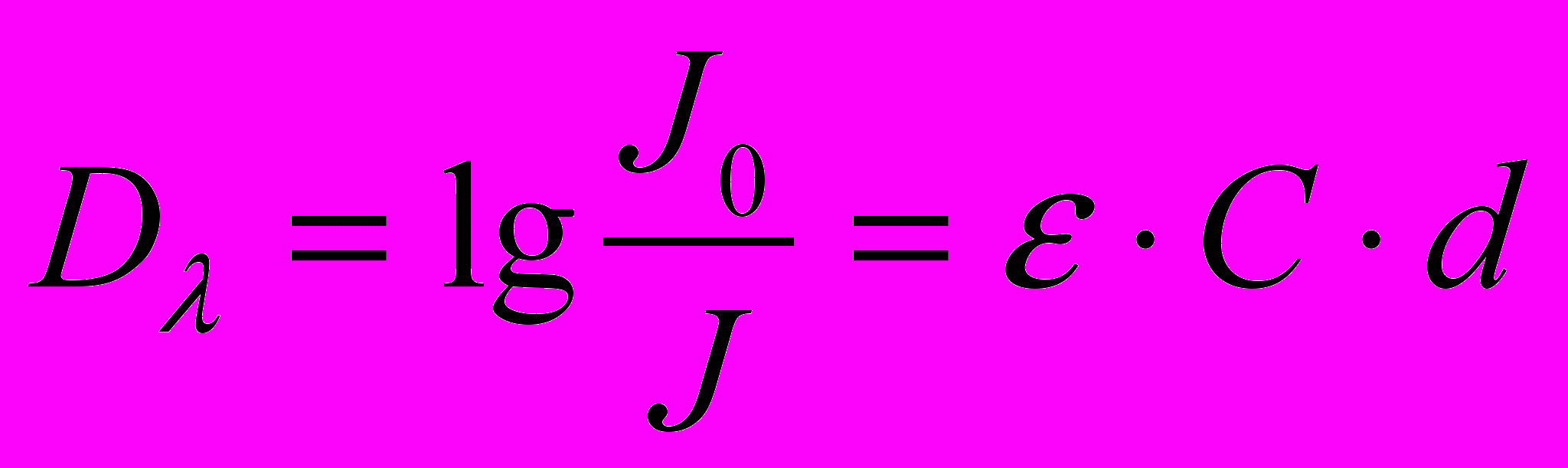 .
.Применимость закона Лимберта-Бора проверяется графически: зависимость Dλ от концентрации С должна быть линейной.
В определенной области концентраций уравнение Ламберта-Бора применимо к золям. Для этого одно из оптических явлений (опалесценция или поглощение света) должно доминировать. Например, золи кубовых и зернистых красителей ярко окрашены, но слабо мутны. Наоборот белые золи TiO2, SiO2, Al(OH)3, латексы бесцветны, но мутны. В этом случае Dλ будет расти с концентрацией линейно, что позволяет применить оптический метод для концентрации золей. Для определения Dλ служат разоичные калориметры, фотометры. Для белых золей Геллер установил зависимость общего вида между Dλ и длиной волны:
Dλ = K·λ·α,
где: λ – длина волны падающего света, м;
α – коэффициент, величина которого меняется от 1 до 4 в соответствии с диаметром частиц.
Эта зависимость имеет большое практическое значение для определения размеров частиц золя. Для этого нужно построить прямую в координатах lgDλ=f(lgλ), тангенс угла наклона прямой равен коэффициенту α. Далее по калибровочной кривой Геллера для латексов, построенной в координатах α = f(d), находят средний диаметр частиц.
Показатель α можно определить также по методу Теорелла: пользуясь всего двумя светофильтрами, получают два значения Dλ для двух длин волн (различие в величинах λ должно быть возможно большим), затем по соотношению:
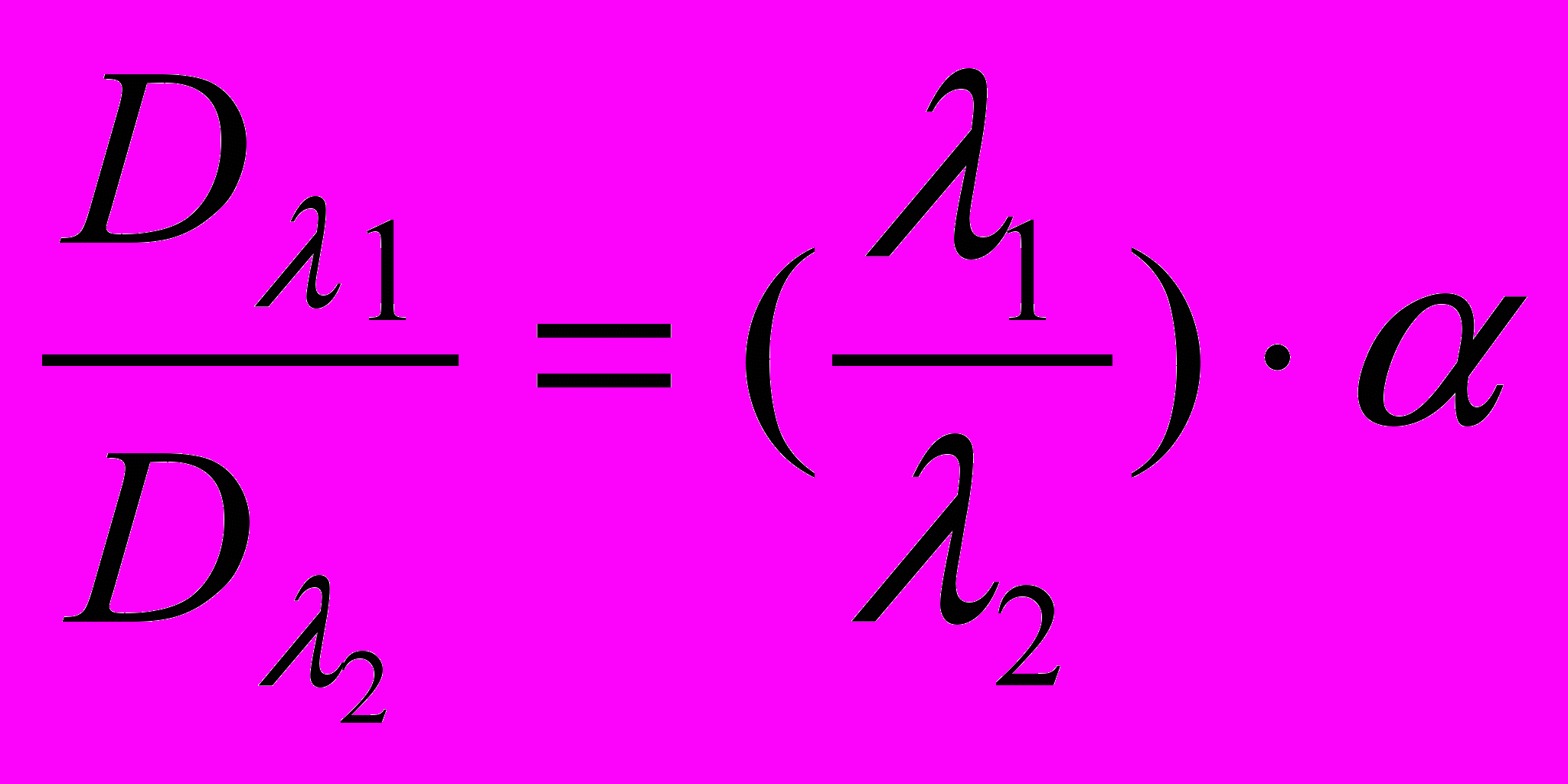
находят α. По α определяют размеры частиц.
Задачи
85. Сравните интенсивности светорассеяния высокодисперсного полистирола, освещенного монохроматическим светом с длиной волны λ1=680·10-9м, а затем с длиной волны λ2=420·10-9м (α=4).
86. В каком случае и во сколько раз интенсивность светорассеяния латекса полистирола больше: при освещении светом λ1=530·10-9м или λ2=680·10-9м?
87. С помощью нефелометра сравнивались мутности двух гидрозолей мастики равных концентраций. Мутности определяемого и стандартного золей стали одинаковыми при высоте освещенности части первовго золя h1=5·10-3м и высоте второго золя h2=19,0·10-3м. Средний радиус частиц второго золя r1=120·10-9м. Определите радиус частиц r2 второго золя.
88. Рассчитайте среднмй радиус частиц гидрозоля латекса полистирола, пользуясь данными нефелометра: высота освещенной части стандартного золя h1=8·10-3м, средний радиус частиц r1=88·10-9м, высота освещенной части неизвестного золя h2=18,0·10-3м. Концентрации стандартного и неизвестного золя равны.
89. Используя экспериментальные значения оптической плотности Dλ для разных длин волн λ, определите средний радиус частиц полистирольного латекса. Указания:
1. При построении логарифмической прямой целесообразно брать логарифмы 100Dλ;
2. Предварительно постройте калибровочную прямую Геллера по следующим данным:
| Диаметр частиц латекса d · 109, м | 77,0 | 88,0 | 95,0 | 106,7 | 111,0 | 119,0 |
| Характеристика дисперсности α | 3,82 | 3,64 | 3,545 | 3,30 | 3,235 | 3,04 |
| Диаметр частиц латекса d · 109, м | 132,0 | 139,0 | 143,0 | 158,0 | 167,0 | 189,0 |
| Характеристика дисперсности α | 2,82 | 2,72 | 2,66 | 2,45 | 2,365 | 2,14 |
Экспериментальные данные:
| Диаметр волны λ · 109, м | 415 | 485 | 527 | 685 |
| Оптическая плотность латекса Dλ | 0,195 | 0,127 | 0,099 | 0,048 |
90. То же, что в задаче №89, при экспериментальных данных:
| Диаметр волны λ · 109, м | 415 | 485 | 527 | 685 |
| Оптическая плотность латекса Dλ | 0,474 | 0,329 | 0,259 | 0,133 |
91. Условие, смотри задачу №89, при экспериментальных данных:
| Диаметр волны λ · 109, м | 415 | 485 | 527 | 685 |
| Оптическая плотность латекса Dλ | 0,324 | 0,215 | 0,160 | 0,084 |
92. Условие, смотри задачу №89, при экспериментальных данных:
| Диаметр волны λ · 109, м | 415 | 485 | 527 | 685 |
| Оптическая плотность латекса Dλ | 0,189 | 0,129 | 0,104 | 0,050 |
93. Исходя из значений оптической плотности Dλ1=0,023 и Dλ2=0,135, полученных с помощью ФЭК для длин волн: λ1=680·10-9м и λ2=420·10-9м, и используя калибровочную кривую Геллера (см. задачу №89), найдите средний радиус частиц гидрозоля латекса.
94. Проверьте графически применимость закона Ламберта-Бора к гидрозолю кубового синего красителя, используя данные спектрофотометрического метода:
| Концентрация золя С·103, кг/м3 | 20,0 | 40,0 | 60,0 | 70,0 |
| Оптическая плотность Dλ | 0,2 | 0,38 | 0,55 | 0,67 |
95. Пользуясь экспериментальными данными подтвердите графически применимость закона Ламберта-Бора к гидрозолю сернистого черного красителя и определите конуентрацию золя при Dλ=0,55.
| Концентрация золя С·103, кг/м3 | 20 | 40 | 60 | 80 | 100 | 120 |
| Оптическая плотность Dλ | 0,15 | 0,30 | 0,43 | 0,60 | 0,78 | 0,92 |
6. Вязкость. Реологические свойства дисперсных систем
Структуры бывают коагуляционные и конденсационные (кристализационные). Первые образуются за счет слабых водородных связей и сил Ван-дер-Ваальса, легко разрушаются при механических воздействиях и через некоторое время могут самопроизвольно восстановиться. Это явление получило название тиксотропии. Примером тиксотропных систем могут служить золи Fe(OH)3 и V2O5, суспензии бентонитовых глин, минеральные краски, растворы некоторых полуколлоидных и высокосолекулярных соединений и др.
Тиксотропные системы обычно проявляют пластичные свойства.
Конденсационные структуры образуются за счет химических связей между частицами, за счет возникающих срастающихся кристаллов. Такие системы не могут обладать тиксотропными свойствами, они не пластичны, а хрупки (цементы, гели кремниевой кислоты).
Закон Пуазейля характеризует ламинарное течение бесструктурной жидкости по капилляру под действием приложенного давления:
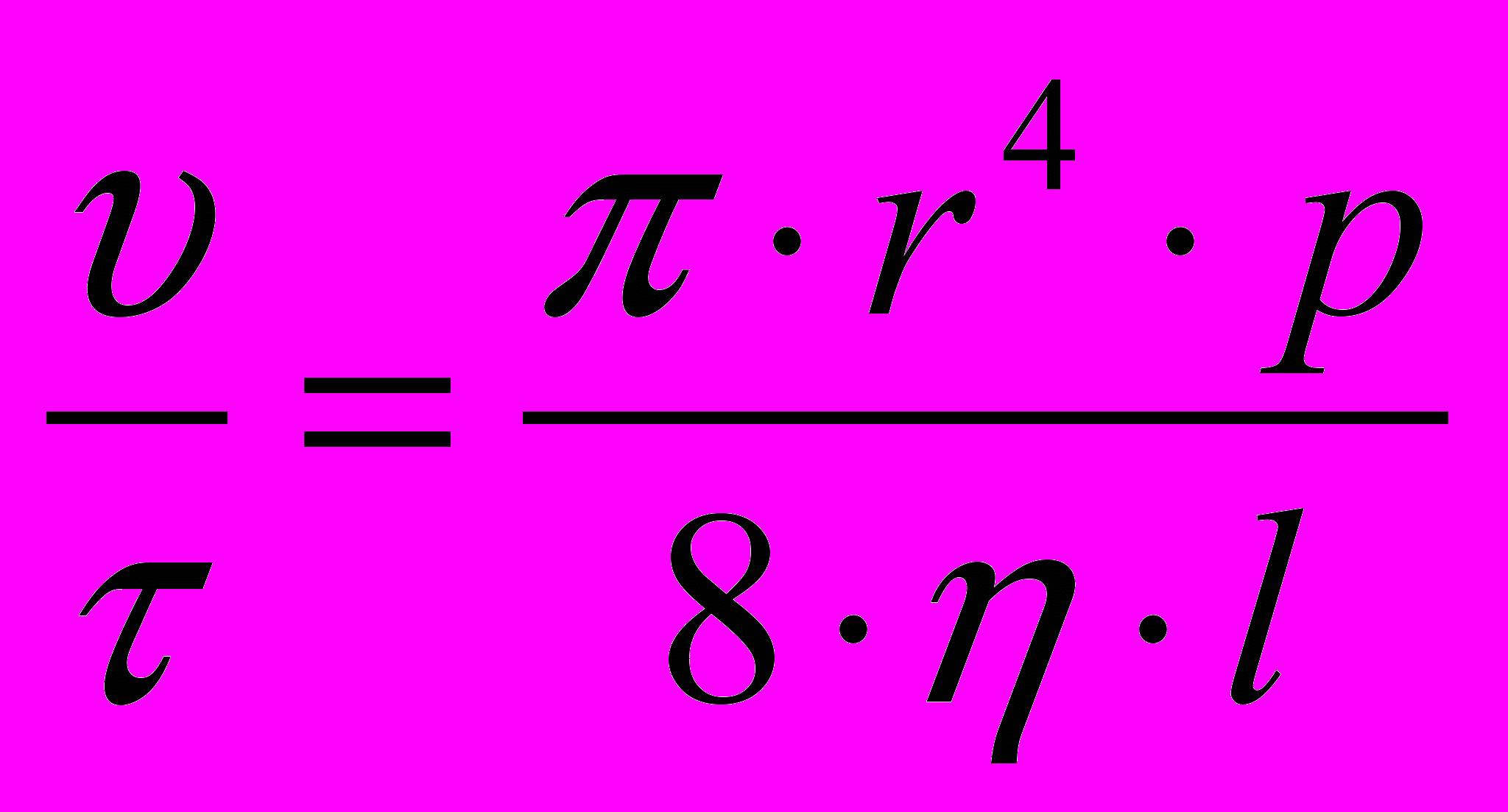 ,
,где υ/τ – объемная скорость течения, м3/с;
p – приложенное давление (или напряжение на сдвиг), Н/м2;
r – радиус капиляра, м;
l – длина капиляра, м;
η – вязкость жидкости, (H·c)/м2.
Для структурных систем, обладающих структурными свойствами, предполагающее ньютоновское течение системы после разрушения непрочной структуры:
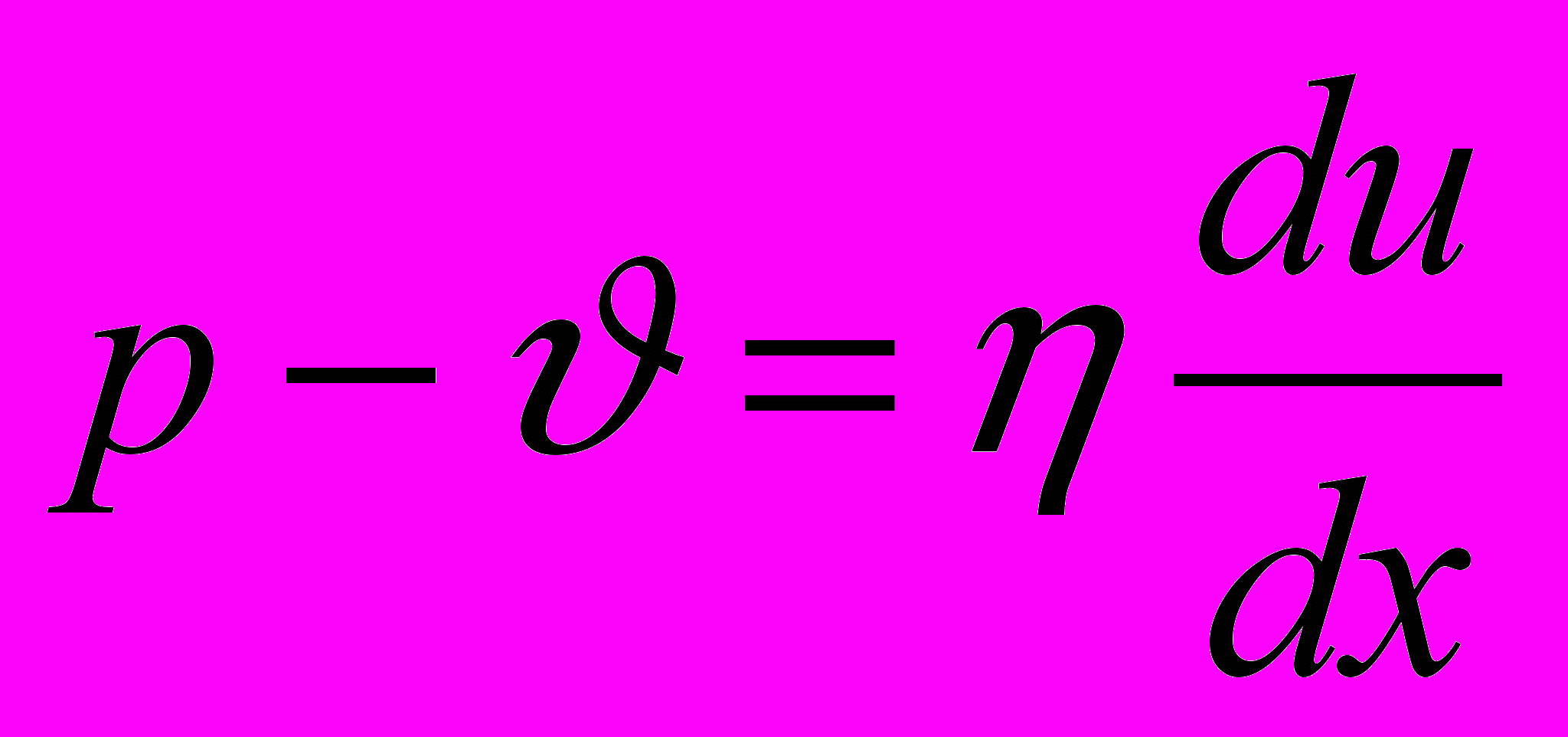 ,
,где du/dx – градиент скорости;
θ – напряжение на сдвиг, необходимое для начала течения, кг/м2.
Для концентрированных систем используют ротационные вискозиметры типа прибора Волоровича, состоящие из двух коаксиальных цилиндров. Исследуемая система помещается между цилиндрами. Под действием приложенного внешнего напряжения р внутренний цилиндр начинает вращаться, причем число оборотов N (об/с) определяется структурно-механическими свойствами системы. При достижении p=pm (предельное напряжение сдвига) структура полностью разрушена и вязкость системы становится постоянной величиной, близкой к вязкости дисперсной среды.
Для исследования структурированных систем типа паст наиболее прпименимы два метода: конического пластометра и тангенциального смещения пластинки.
Для первого
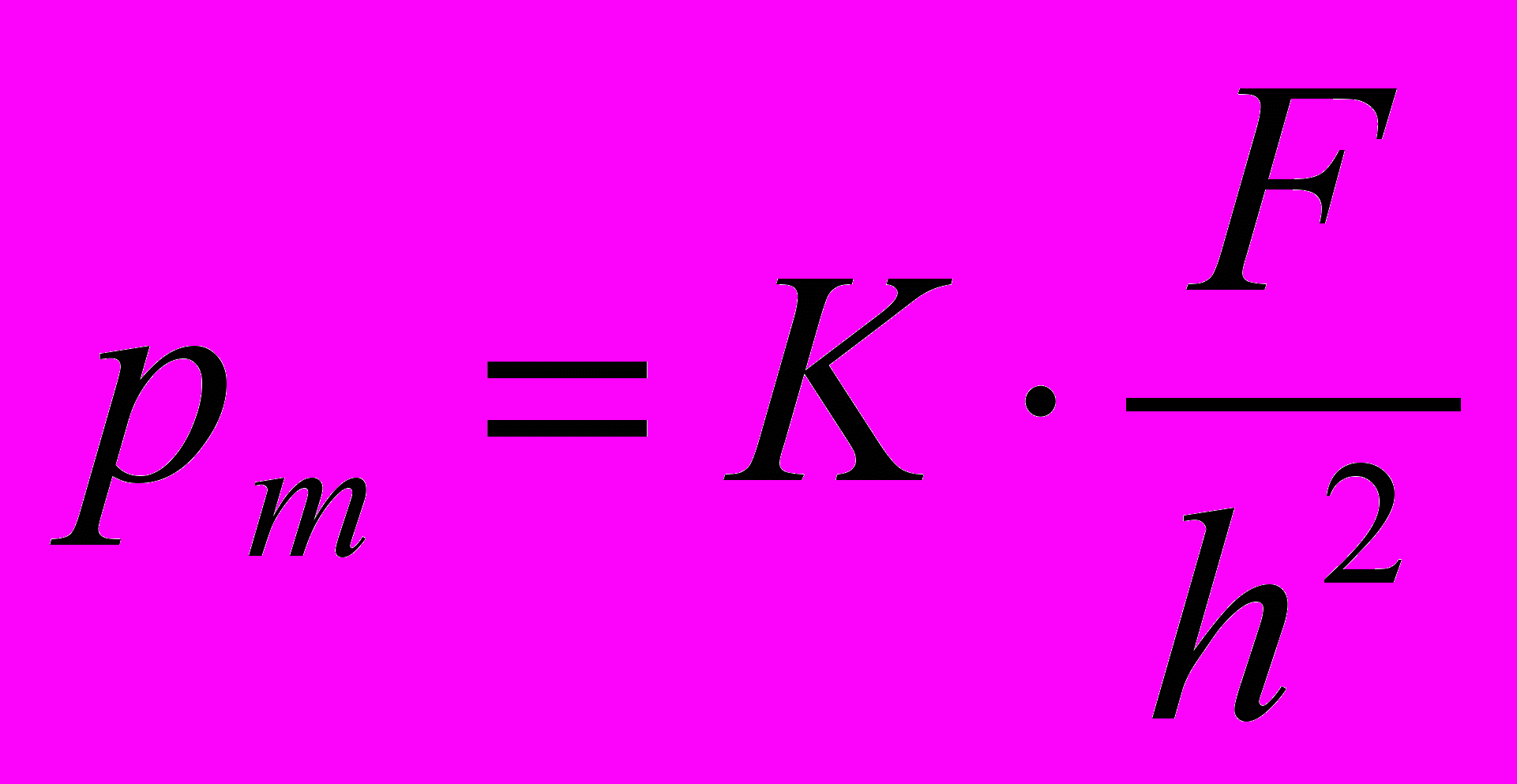 ,
,где: pm – предельное напряжение сдвига, кг/м2;
К – константа прибора;
F – величина усилия, кг;
h – глубина погружения корпуса, м.
Для второго
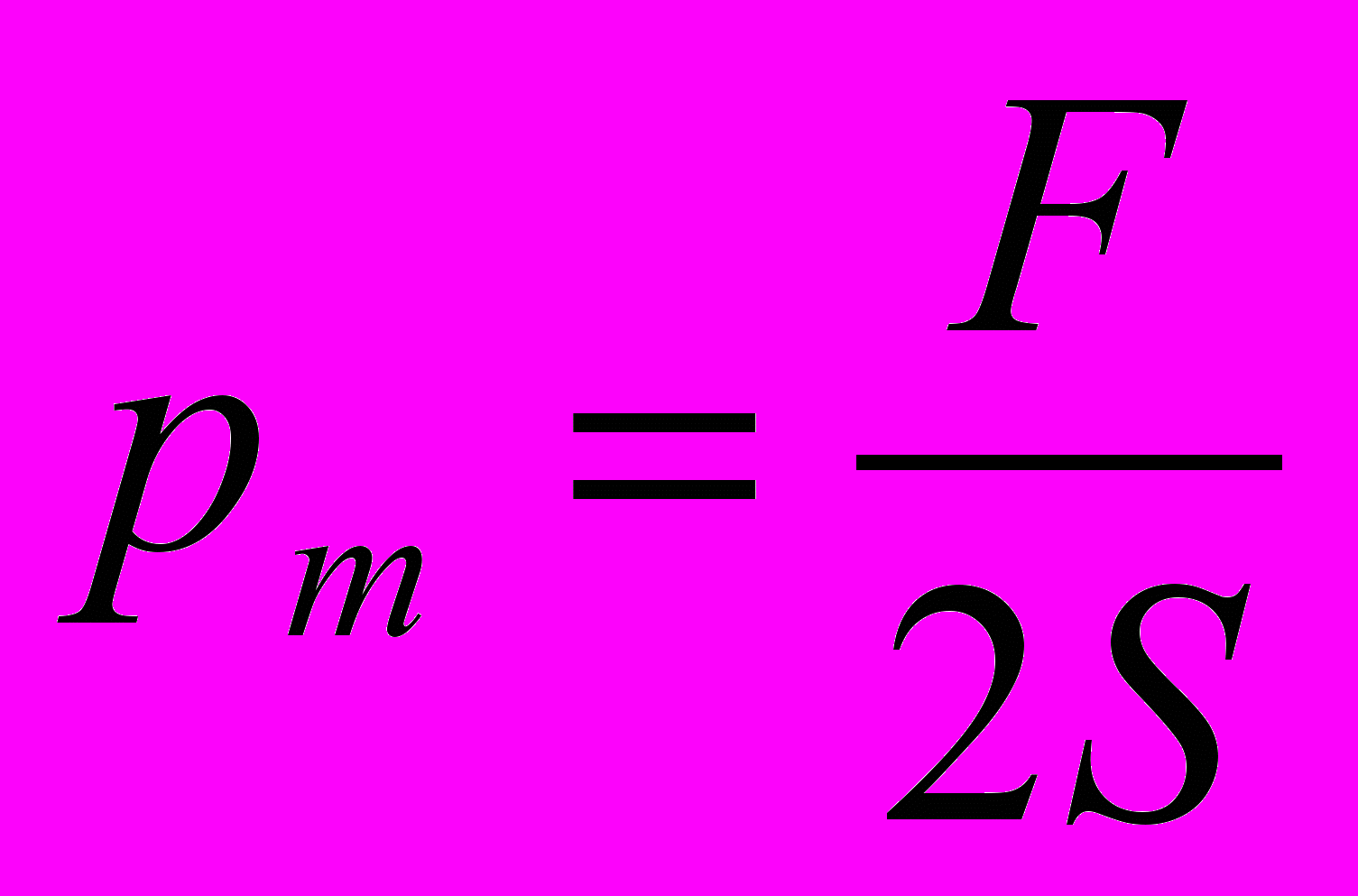 ,
,Где S – боковая поверхность пластинки, погруженной в исследуемую систему, м2.
Задачи
96. Вычислите скорость истечения жидкости из капилляра длиной l=5·10-2м с радиусом сечения r = 25·10-5м под давлением p=980 Н/м2. Вязкость жидкости η = 2·10-3 Н·с/м2.
97. Какова вязкость глицерина, если из капилляра длиной l=6·10-2м с радиусом сечения r = 1·10-5м он вытекает со скоростью υ/τ=14·10-10м3/с под давлением p=200Н/м2?
98. Определите давление, которое необходимо применить к бесструктурной жидкости при истечении ее из капиляра. Вязкость жидкости η = 1,8·10-3 Н·с/м2. Капилляр имеет длину l=10·10-2м с радиусом сечения r = 2·10-4м.
99. Какова вязкость салициловой кислоты, если из капилляра длиной l=5·10-2м жидкость вытекает со скоростью υ/τ=2·108м3/с под давлением p=150Н/м2?
100. С помощью вискозиметра Волоровича исследована 95%-ная суспензия окиси цинка в органической среде. Постройте реологическую кривую в координатах N=f(p) и определите величину предельного напряжения на сдвиг pm.
| Масса груза p·103, кг | 40 | 44 | 48 | 52 | 56 | 60 |
| Число оборотов N, об/с | 0,455 | 0,566 | 0,675 | 0,782 | 0,89 | 1,0 |
101. Определите величину предельного напряжения на сдвиг pm для суспензии TiO2 в органической среде, по данным, полученным с помощью вмскозиметра Волоровича (график строить в координатах N=f(p)).
| Масса груза p·103, кг | 42 | 46 | 50 | 54 | 58 | 62 |
| Число оборотов N, об/с | 0,502 | 0,605 | 0,708 | 0,810 | 0,982 | 1,036 |
102. При исследовании реологических свойств олеосуспензий методом тангенциального смещения пластинки напряжения на сдвиг pm=354Н/м2 для 25%-ной суспензии железного сурина. Как будет меняться величина pm в зависимости от концентраций ПА-добавок олеиновой кислоты. Покажите графически.
| Концентрация олеиновой кислоты С,% | 0,5 | 2,0 | 6,0 | 20,0 |
| Наибольшее усилие Fm·102, Н | 2,0 | 1,2 | 0,5 | 0,2 |
103. Рассчитайте и постройте график изменения величины предельного напряжения сдвига в зависимости от концентрации суспензии железного сурина в параксилоле. При использовании метода тангенциального смещения пластин получены следующие данные:
| Концентрация дисперсной фазы С,% | 15 | 20 | 22 | 24 | 27 |
| Наибольшее усилие Fm·102, Н | 0,28 | 1,26 | 2,10 | 2,38 | 2,94 |
Длина пластинки а=0,7·10-2м, ширина в=0,5·10-2м.
104. Рассчитайте и постройте график зависимости pm агарового студня от концентрации поверхностно-активной добавки – изопропилового спирта. Исследования проводились методом конического пластомера.
| Концентрация изопропилового спирта, с·102, кмоль/м3 | 0,0 | 3,0 | 6,0 | 12,0 | 30,0 |
| Глубина погружения конуса h·102, м | 1,08 | 1,34 | 1,54 | 1,81 | 2,03 |
Величина нагрузки F=1·10-2кг, константа конуса K=0,413.
105. При исследовании влияния поверхностно-активных добавок на структурообразование суспензии окиси кальция получены данные (метод конического пластомера):
| Концентрация CCБ С,% | 0,0 | 0,14 | 0,40 | 0,72 | 1,44 | 7,2 |
| Глубина погружения конуса h·103, м | 2,0 | 1,64 | 0,95 | 0,75 | 0,63 | 0,59 |
Величина нагрузки F=1кг, константа конуса К=0,4. Постройте кривую зависимости pm от концентрации добавки.
106. Покажите графически влияние добавки глюкозы на pm концентрированной суспензии CaO (конический пластометр):
| Концентрация глюкозы С,% | 0,0 | 0,4 | 0,8 | 1,6 | 4,0 | 8,0 |
| Глубина погружения конуса h·103, м | 2,14 | 1,25 | 1,19 | 0,95 | 0,85 | 0,77 |
Величина нагрузки F=1,2кг, константа конуса К=0,4.
107. С помощью конического пластометра исследовалось влияние дисперсности пасты красителя кубового зеленого на ее структурообразование. Получены данные:
| Время τ, час | Глубина погружения конуса h·103м при радиусе частиц | ||
| r1=(0,5+5)·10-6м | r2=(5+10)·10-6м | r3>10·10-6м | |
| 1 | 2,44 | 3,84 | 4,21 |
| 2 | 2,09 | 3,14 | 4,21 |
| 3 | 1,98 | 3,05 | 4,10 |
| 4 | 1,92 | 2,93 | 4,10 |
| 5 | 1,88 | 2,88 | 4,10 |
| 6 | 1,85 | 2,88 | 4,10 |
Величина нагрузки F=5·10-2кг, константа конуса К=0,5.
Постройте кривые в координатах pm=(τ) и сравните величины pm соответствующие 6 часам.
108. При исследовании реологических свойств нефти получены данные:
| Напряжение p·10-2, Н/м2 | 5,0 | 10,0 | 15,0 | 20,0 | 25,0 | 30,0 | 40,0 |
| Скорость течения (1/τ)·102, 1/с | 0,2 | 1,0 | 2,2 | 3,7 | 5,3 | 7,0 | 8,7 |
Постройте кривую в координатах pτ=(p) и определиие при каком напряжении полностью разрушится структура.
109. Постройте реологическую кривую в координатах dυ/dτ=f(p) для концентрированной суспензии сажи в вазелиновом масле и определите pm.
| Напряжение p·10-2, Н/м2 | 2,5 | 3,0 | 3,5 | 4,5 | 6,0 | 7,0 | 8,0 | 9,0 | 10,0 |
| Градиент скорости dυ/dτ, с-1 | 10 | 20 | 49 | 120 | 235 | 310 | 360 | 400 | 500 |
110. Рассчитайте и постройте кривую изменениия pm на сдвиг в зависимости от влажности хвалынской глины.
| Напряжение p·10-2, Н/м2 | 1,0 | 2,0 | 8,0 | 12,8 | 16,0 | 24,0 | 30,0 | 40,0 |
| Время истечения раствора τ, с | 340,0 | 159,0 | 39,0 | 23,4 | 17,8 | 10,8 | 8,7 | 6,5 |
Величина нагрузки F=1 кг, константа конуса К=0,66.
111. Постройте реологическую кривую раствора нитроцеллюлозы в ацетоне в координатах pτ=(p).
| Влажность глины, % | 32 | 35 | 40 | 45 | 52 | 60 |
| Глубина погружения конуса h·103, м | 2,45 | 3,15 | 3,66 | 5,12 | 8,10 | 11,5 |
Определите pm.
112. Постройте реологические кривые в координатах pτ=(p) для растворов этилцеллюлозы различной молекулярной массы в толуоле. Сравните величину предельного напряжения сдвига pm.
| Напряжение p·10-2, Н/м2 | Время истечения растворов τ (c) при молекулярной массе | ||
| 30,080 | 46,780 | 72,160 | |
| 10,0 | 735 | 755 | 795 |
| 20,0 | 350 | 360 | 375 |
| 30,0 | 232 | 236 | 246 |
| 50,0 | 138 | 140 | 144 |
| 70,0 | 98 | 99,3 | 102 |
| 80,0 | 85,7 | 87,0 | 89,5 |
| 90,0 | 76,2 | 77,2 | 79,3 |
7. Молекулярно-кинетические свойства коллоидных систем
Молекулярно-кинетические свойства неструктурированных коллоидных систем и обычных истинных растворов принципиального различия не имеют, разница носит лишь количественные характеристики. Как молекулы, так и коллоидные частицы находятся в беспрерывном тепловом движении, которое применительно к коллоидным системам получило название броуновского движения.
Путь частицы не является прямолинейным, т.к. при движении она испытывает толчки со стороны молекул среды, так же находящихся в тепловом движении. Поэтому, не меняя своего направления, частица сдвигается то в одну, то в другую сторону, а ее сложный путь характеризуется так называемым средним сдвигом.
Для вычисления среднего сдвига x, необходимо на произвольно выбранную ось спроектировать все наблюдаемые отклонения частицы, возвести каждую проекцию в квадрат, и взять среднюю величину:
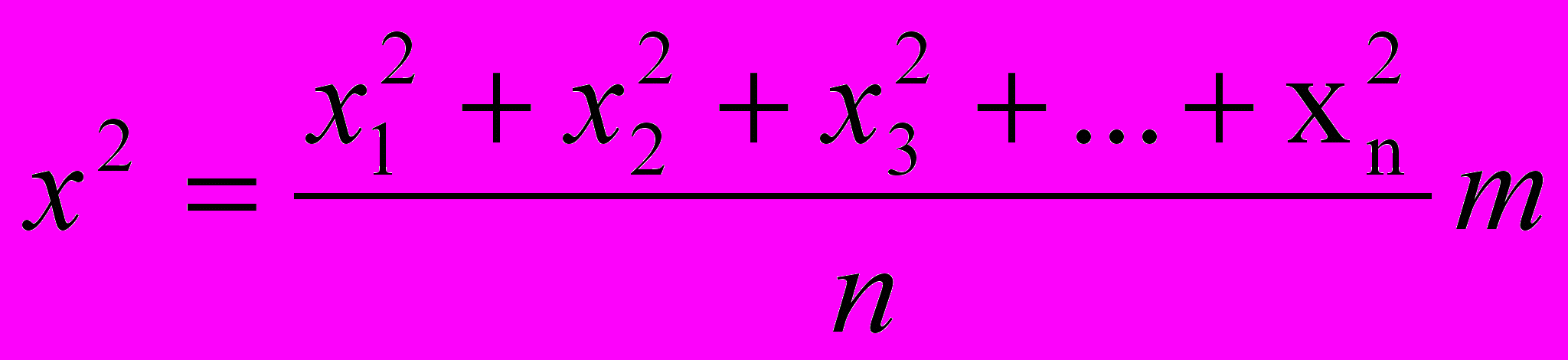 ,
,где n – число сдвигов.
Согласно уравнению Эйншейна, величина среднего сдвига:
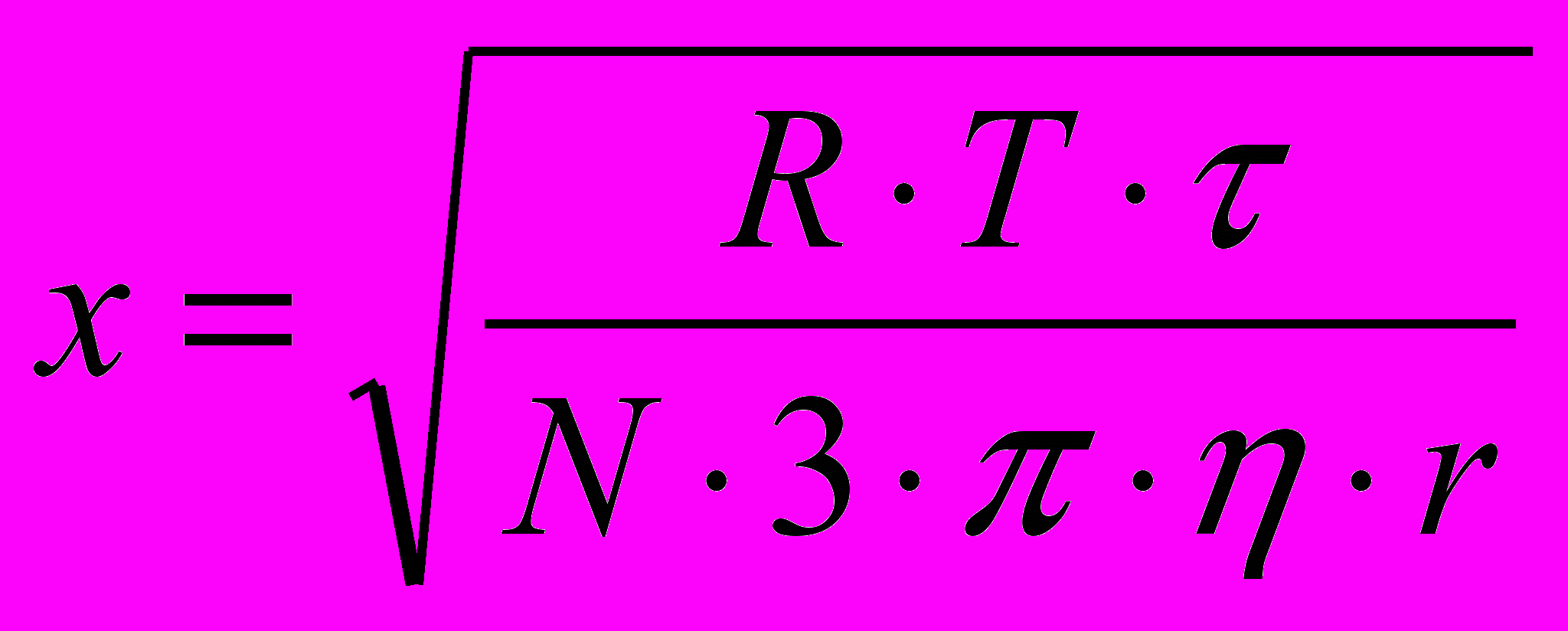 ,м.
,м.Диффузией называется процесс выравнивания концентраций по всему объему раствора, происходящий под влиянием броуновского движения. Скорость его характеризуется коэффициентом диффузии D, величина которого по Эйнштейну равна:
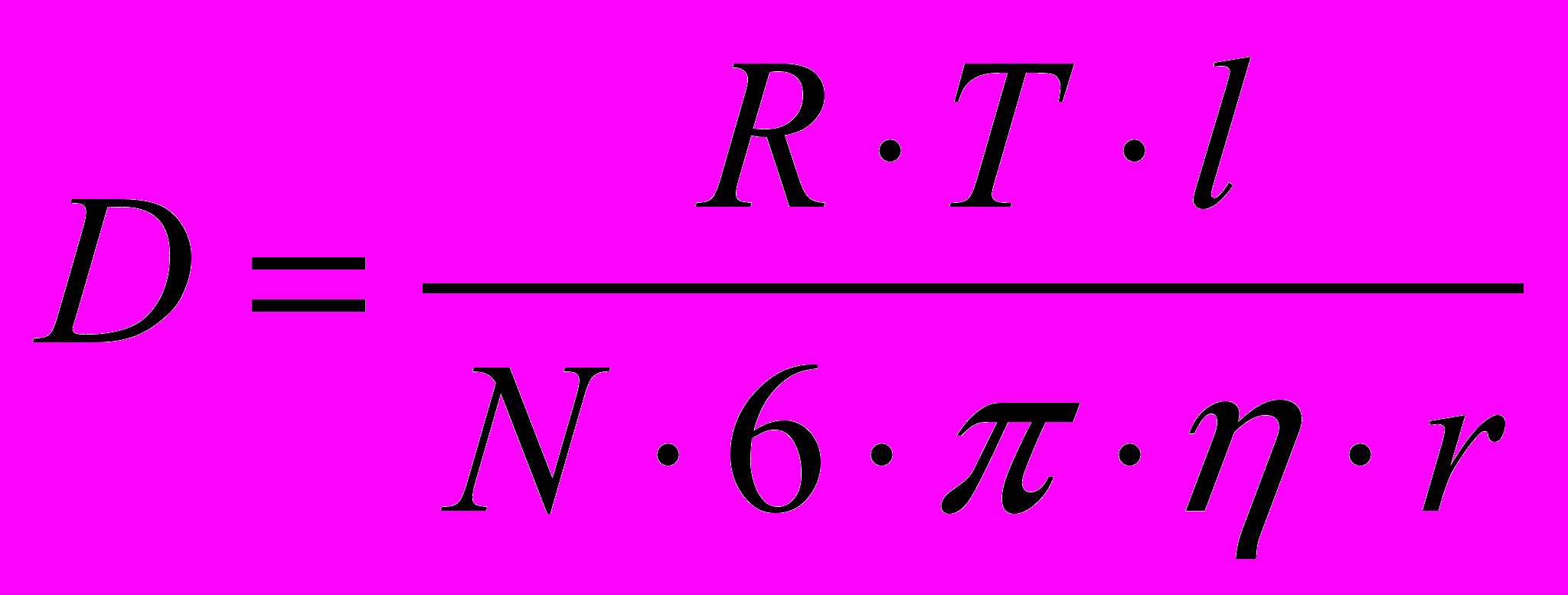 (м2/с или м2/сутки),
(м2/с или м2/сутки),где R – газовая постоянная;
T – температура, К;
N – число Авогадро;
r – вязкость среды, (Н·с)/м2.
По экспериментальным данным В легко рассчитать средний радиус сферических частиц, отсюда – молекулярная или мицеллярная масса вещества:
М = 4/3 πr3γN, где γ – плотность вещества.
Осмотическое давление p, Н/м2, разбавленных коллоидных растворов можно найти, пользуясь уравнением Вант-Гоффа:
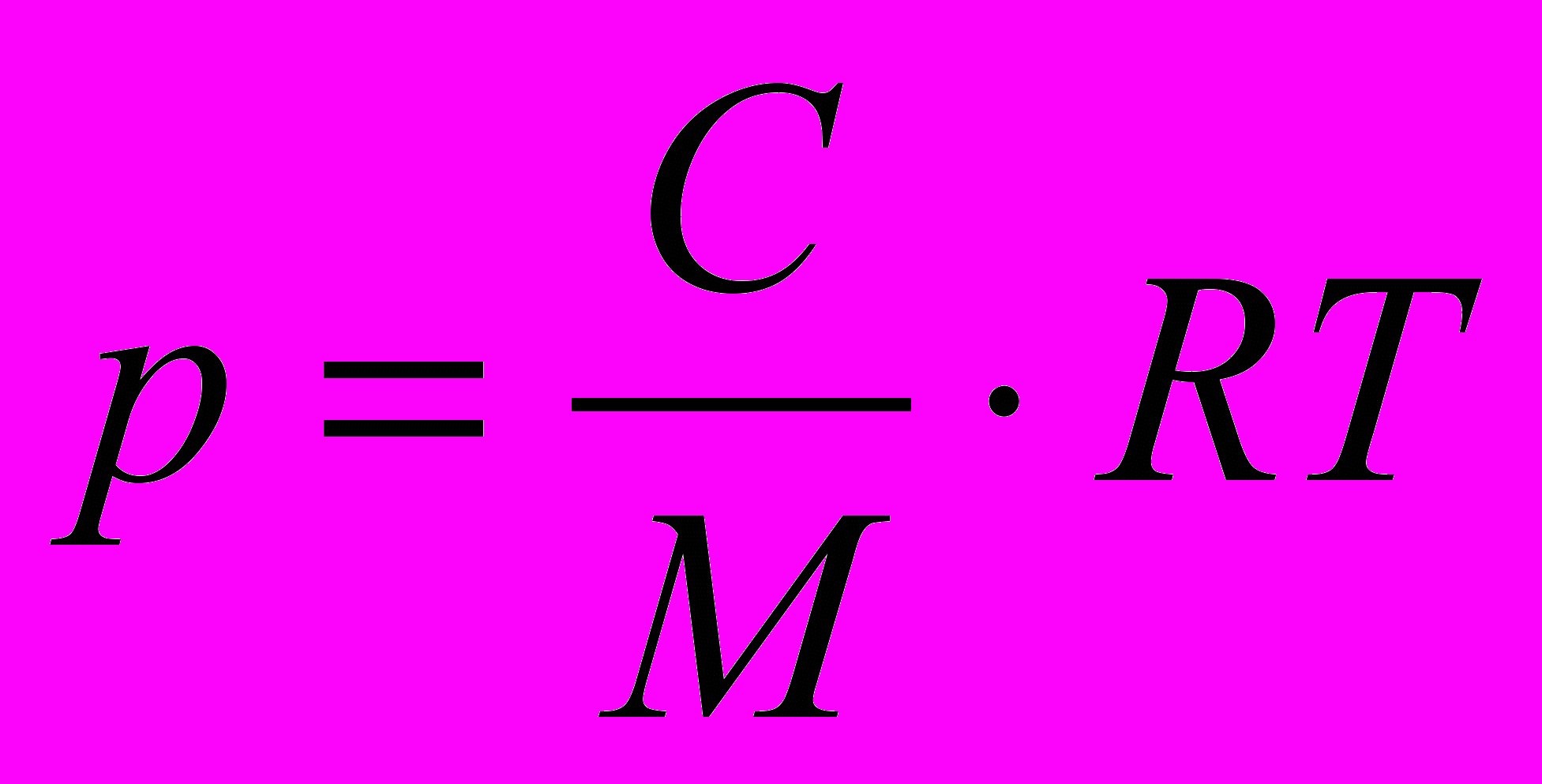 или p = nRT Н/м2, т.к. n =С/M,
или p = nRT Н/м2, т.к. n =С/M, где С – концентрация раствора, кг/м3;
M – молекулярная масса вещества, кг/моль;
n – частичная концентрация системы;
R – газовая постоянная, Дж/моль;
T – температура, К.
Величина осмотического давления золей значительно меньше осмотического давления истинных растворов. Причиной этого является большая масса коллоидных частиц: при одинаковой массовой концентрации частичная концентрация коллоидной системы всегда меньше, чем у истинного раствора.
Для двух систем одинаковой концентрации и равной плотности, но разных радиусов частиц:
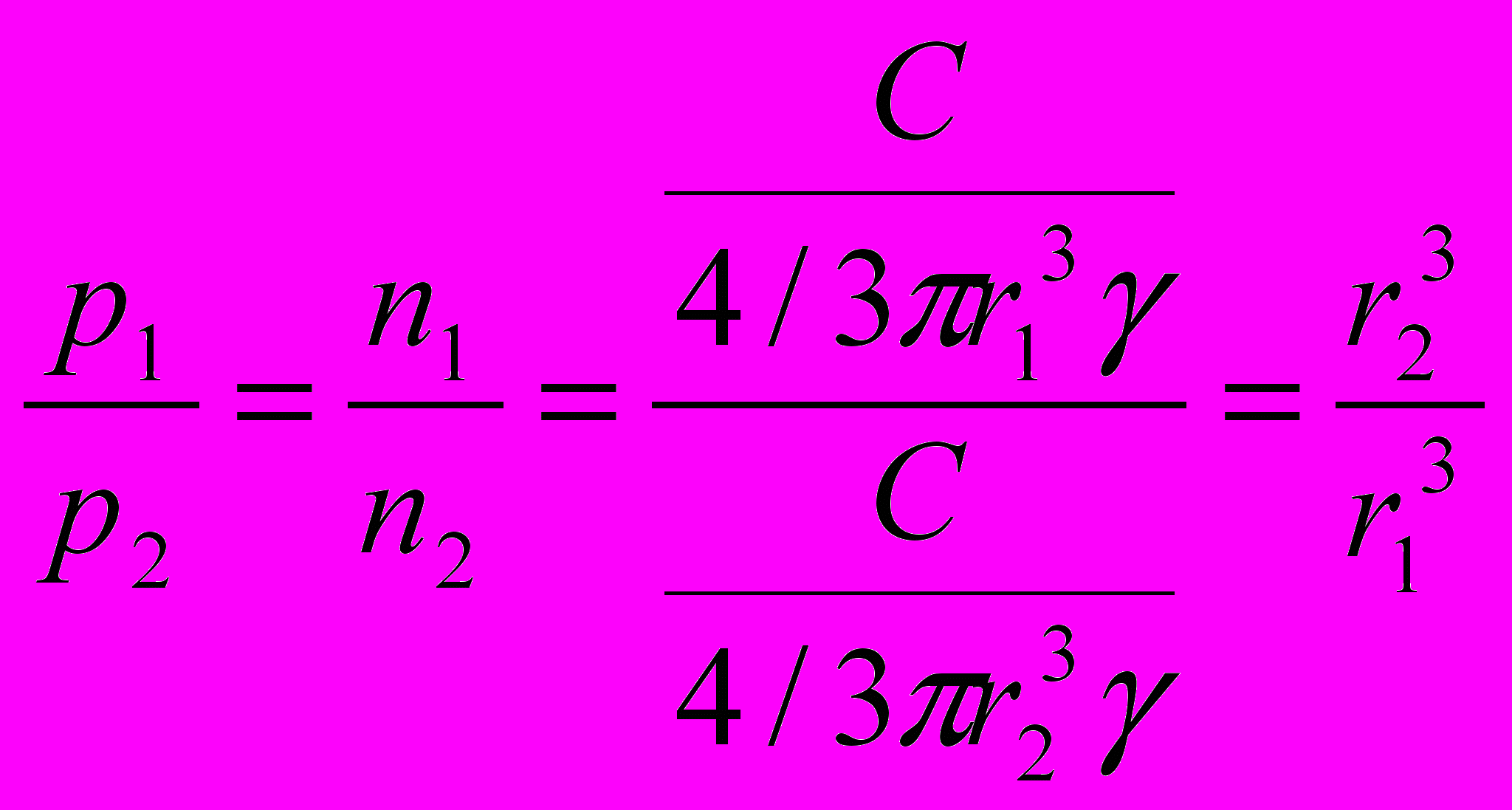 ,
,где r1 и r2 – радиусы частиц первой и второй системы, м;
p1 и p2 – соответственно величина их осмотического давления;
γ – gплотность вещества, кг/м3;
с – концентрация, кг/м3.
Другой особенностью осмотического давления коллоидных растворов является непостоянство его величины, что объясняется агрегацией, имеющей место в золях. Поэтому метод осмометрии не применяется для определения размера или мицеллярной массы коллоидных частиц.
Если в коллоидной систеие сила тяжести будет превалировать над броуновским движением, то частицы начнут оседать. Скорость оседания (седиментации) по закону Стокса:
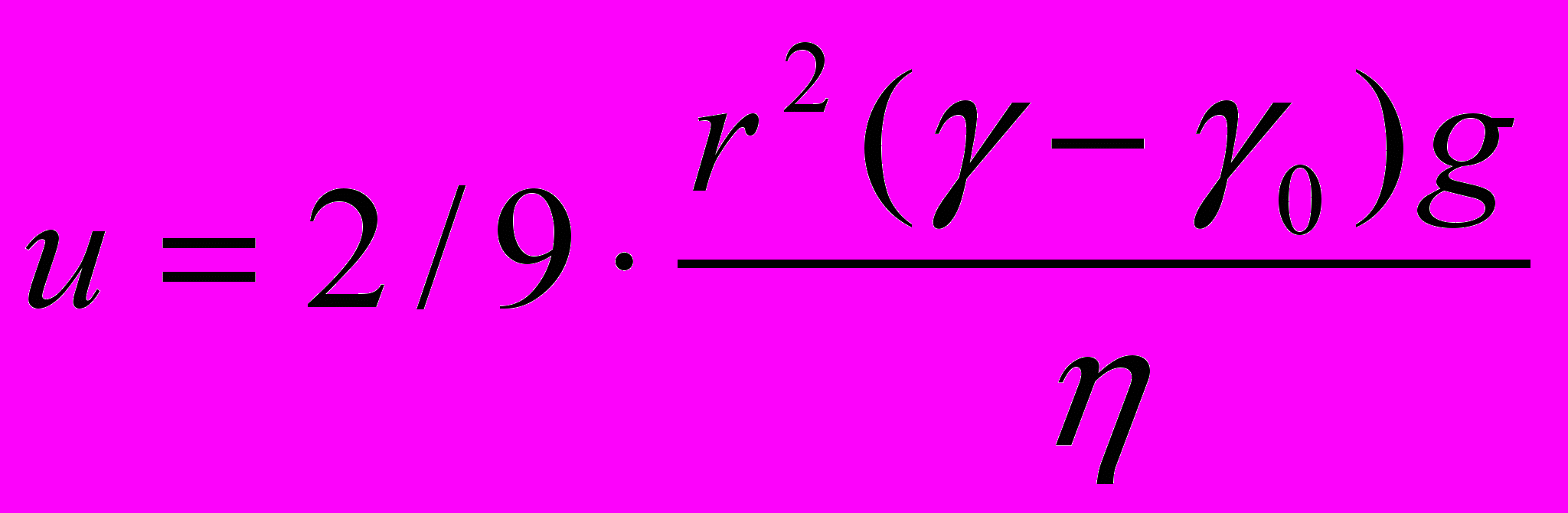 м/с,
м/с,где r – радиус частицы, м;
γ и γ0 – соответственно плотность дисперсной фазы и дисперсной среды, кг/м3;
g – ускорение силы тяжести, м/с2;
η – вязкость среды, (Н·с)/м2.
Такая зависимость скорости седиментации от размеров частиц положена в основу седиментационного анализа. Заменив скорость оседания u
отношение пути h, пройденного частицей, ко времени τ:
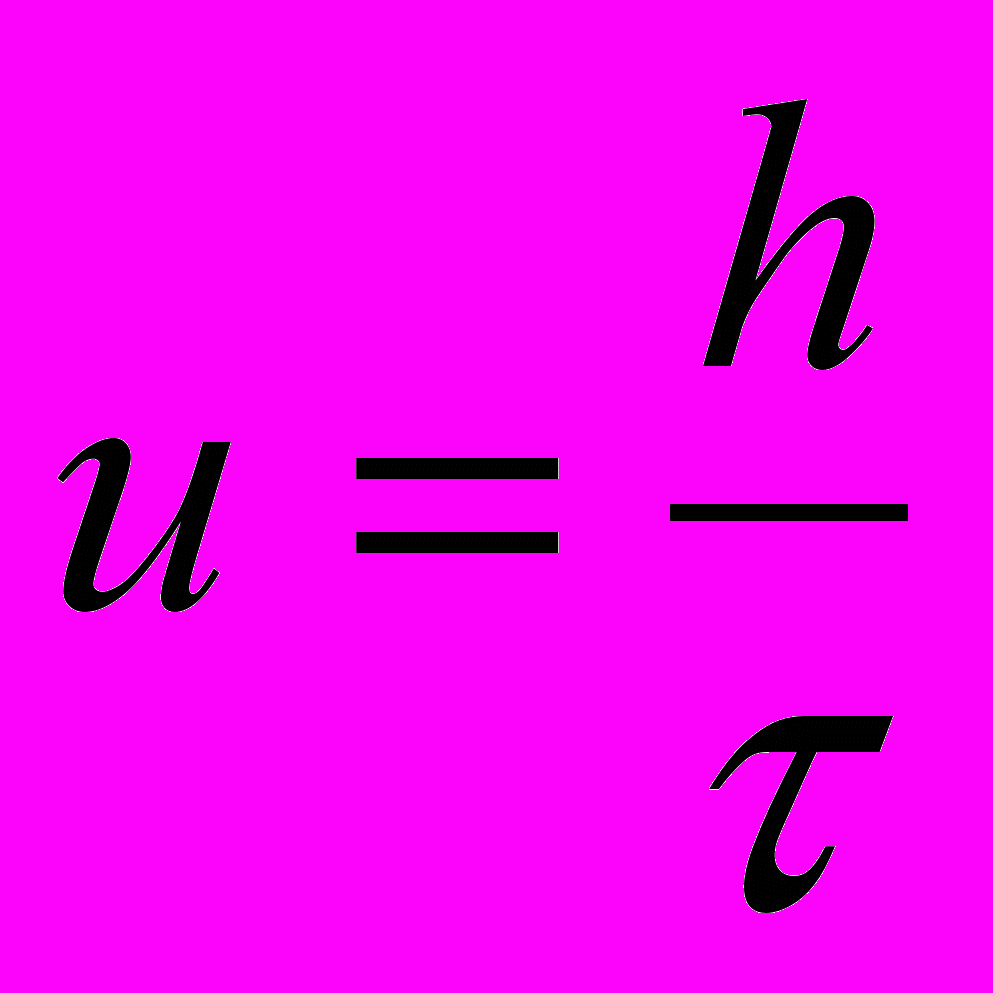 (м/с) и объединив постоянные величины в константу К, запишем закон Cтокса в таком виде:
(м/с) и объединив постоянные величины в константу К, запишем закон Cтокса в таком виде: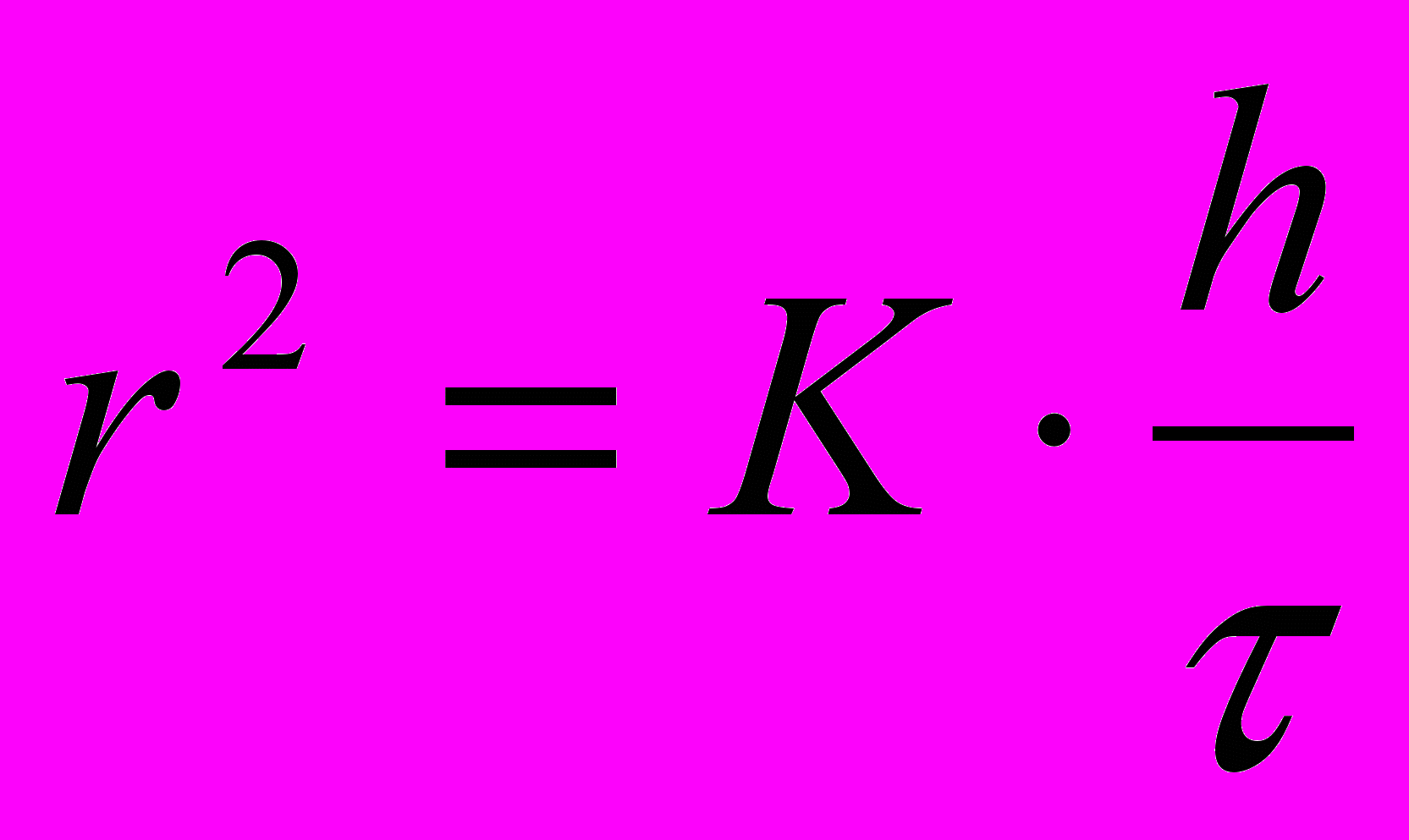 .
.Для наблюдения за оседанием суспензии обычно применяют седиментационные или торзиционные весы. На основе экспериментальных данных строят кривую седиментации в координатах Q=f(τ), где Q – количество суспензии (выраженное в процентах к общему количеству порошка), осевшей на время τ. Разбив кривую касательными на несколько участков можно соответственно каждому отрезку времени τ рассчитать радиус частиц:
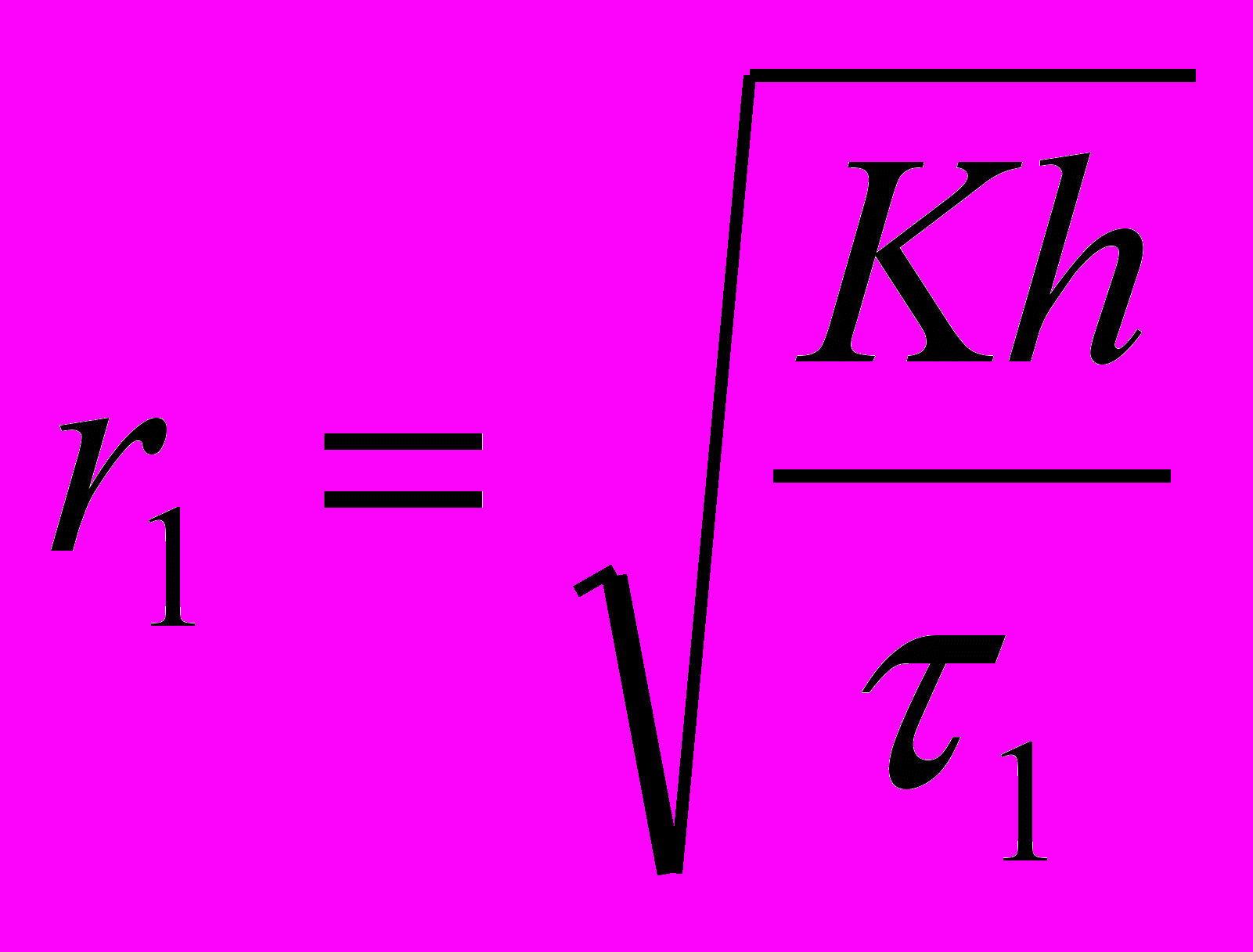
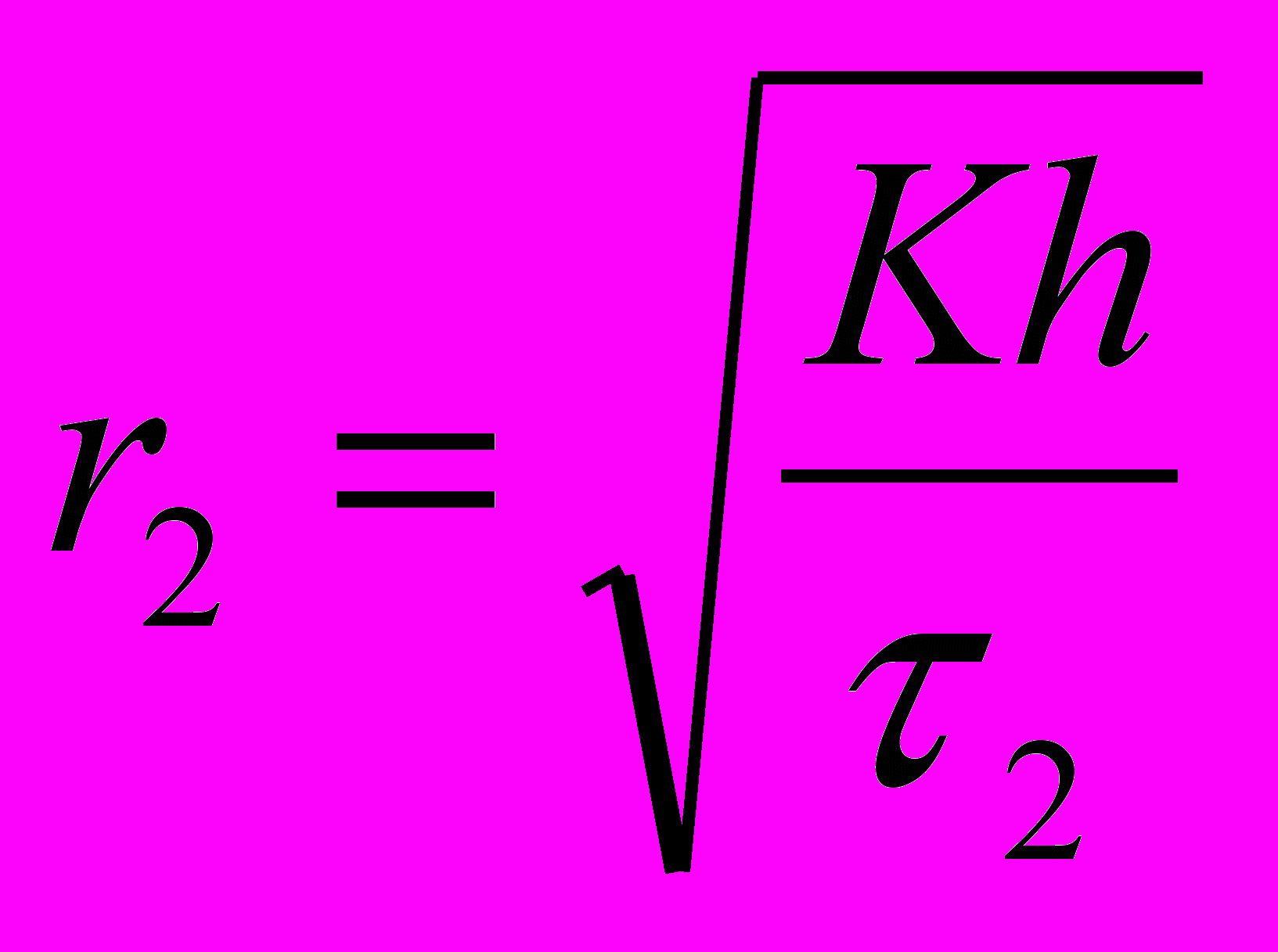 и т.д.
и т.д.
Отрезок между касательными 1-2, очевидно, соответствует количеству вещества, осевшему за промежуток времени τ2- τ1 и содержащему радиусы от r1 до r2. Остальные отрезки рассматриваются аналогично. Приняв величину отрезка 0-4 за 100%, находят величину каждого отрезка в процентах: Q1, Q2, Q3 и т.д.
Чтобы построить кривую распределения, нужно на оси ординат отложить отношение
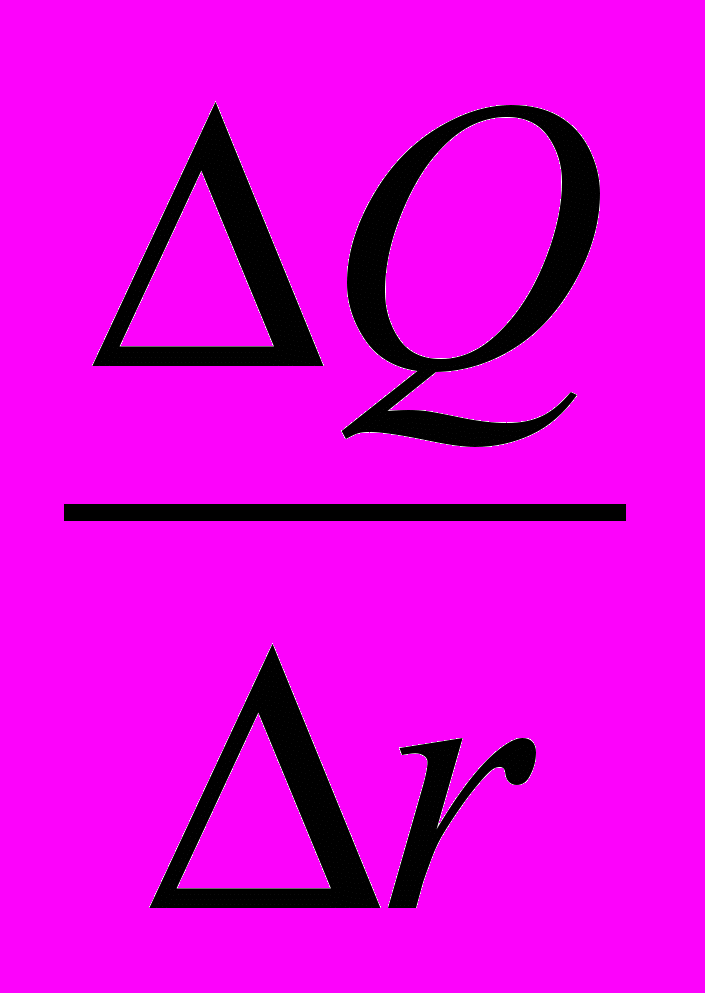 (Δr – разность между r2 и r1; r3 и r2 и т.д. )обы построить кривую распределения, нужно на оси ординат отложить отношение 0% находят величину каждого отрезка в процентахей,), а на оси абсцисс средние значения радиусов:
(Δr – разность между r2 и r1; r3 и r2 и т.д. )обы построить кривую распределения, нужно на оси ординат отложить отношение 0% находят величину каждого отрезка в процентахей,), а на оси абсцисс средние значения радиусов: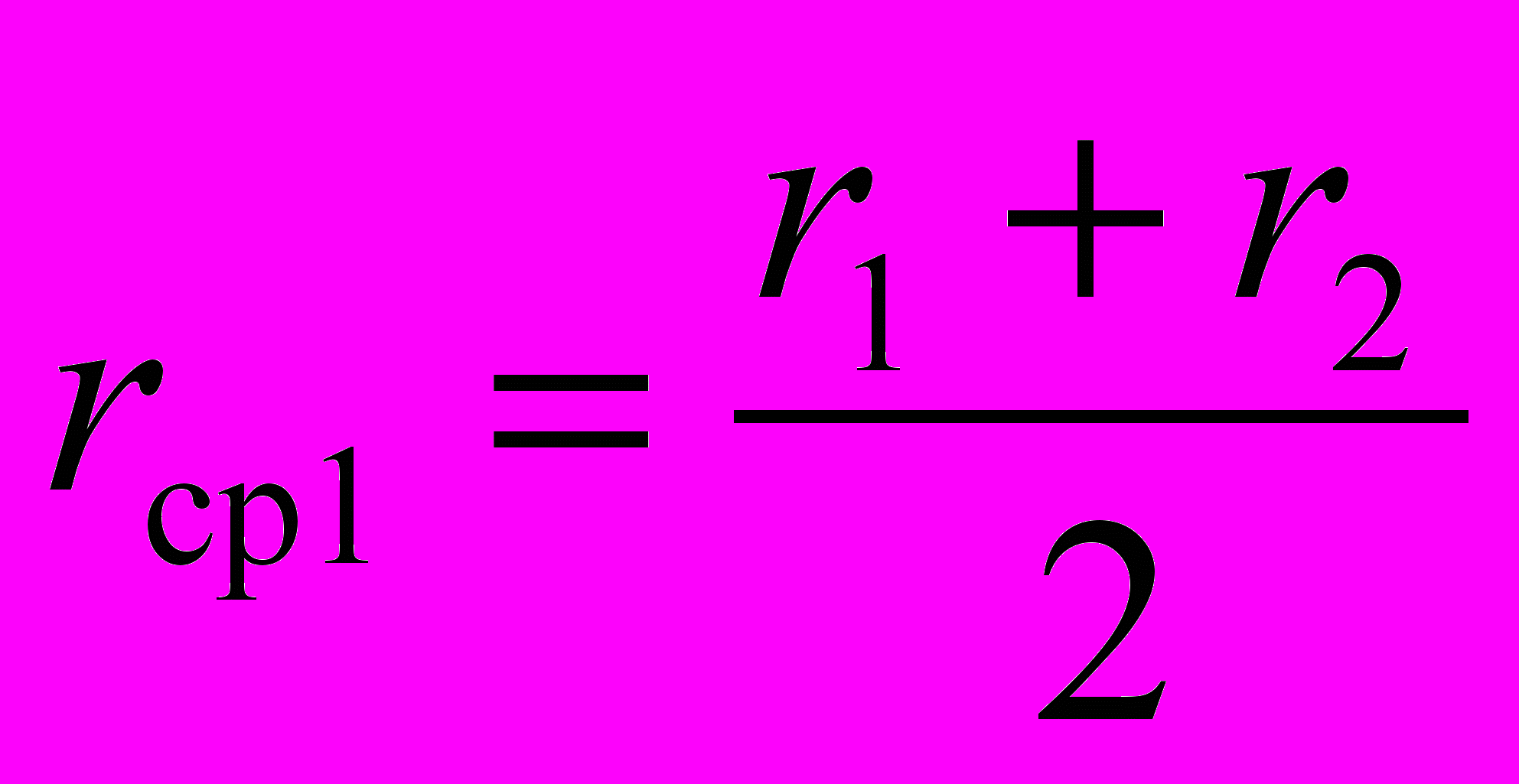 ;
; 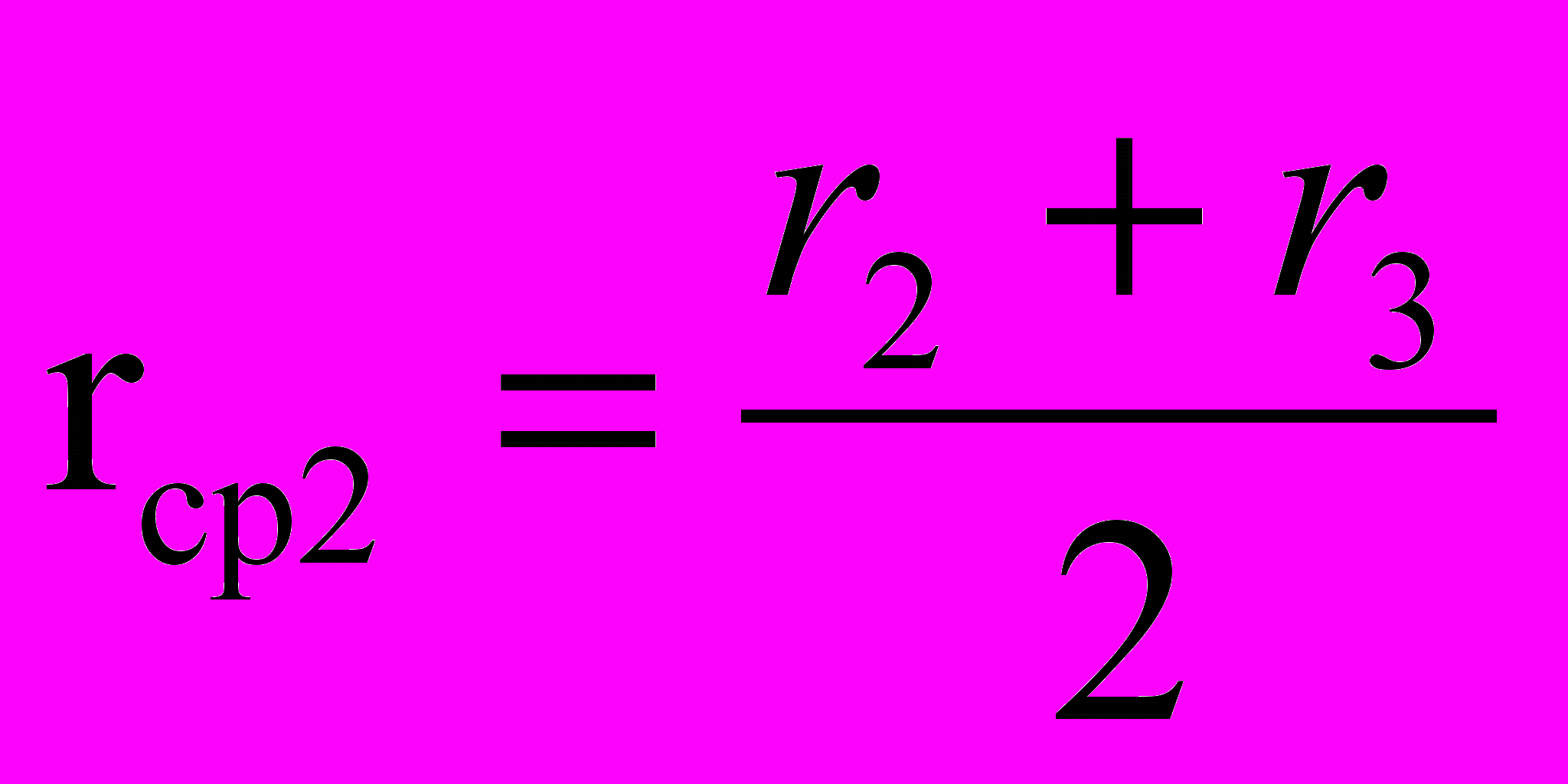 и т.д.
и т.д.Описанный метод расчета кривых распределения несложен, однако он не всегда может быть применен из-за трудности графического написания касательных.
Более надежным и точным является аналитический метод расчета. В этом методе процесс седиментации описывается уравнением:
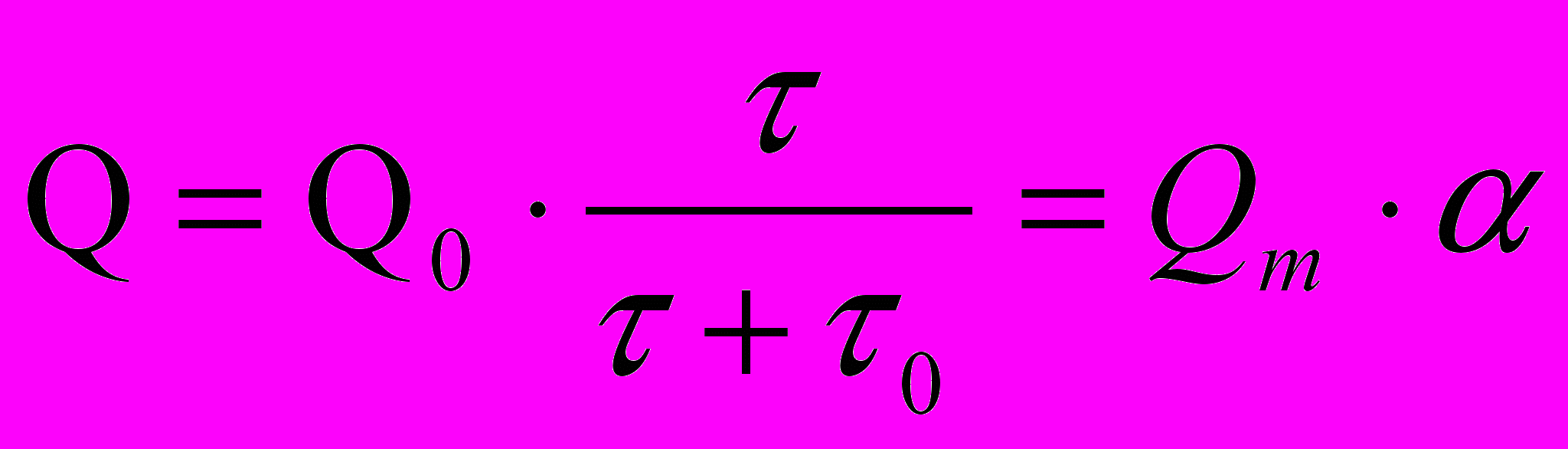 ,
, где Qm и τ0 – константы (первая выражена в %, вторая – в размерности веремени).
По экспериментальным данным строят кривую оседания Q = f(τ), а затем прямую в координатах [τ/Q]=f(τ), по которой находят τ0 и Qm (где Qm – котангенс угла наклона прямой, а [τ0/Qm]-отрезок, отсекаемый прямой на оси ординат). Затем константу τ0 заменяют, используя закон Стокса, эквивалентной ей константой r0:
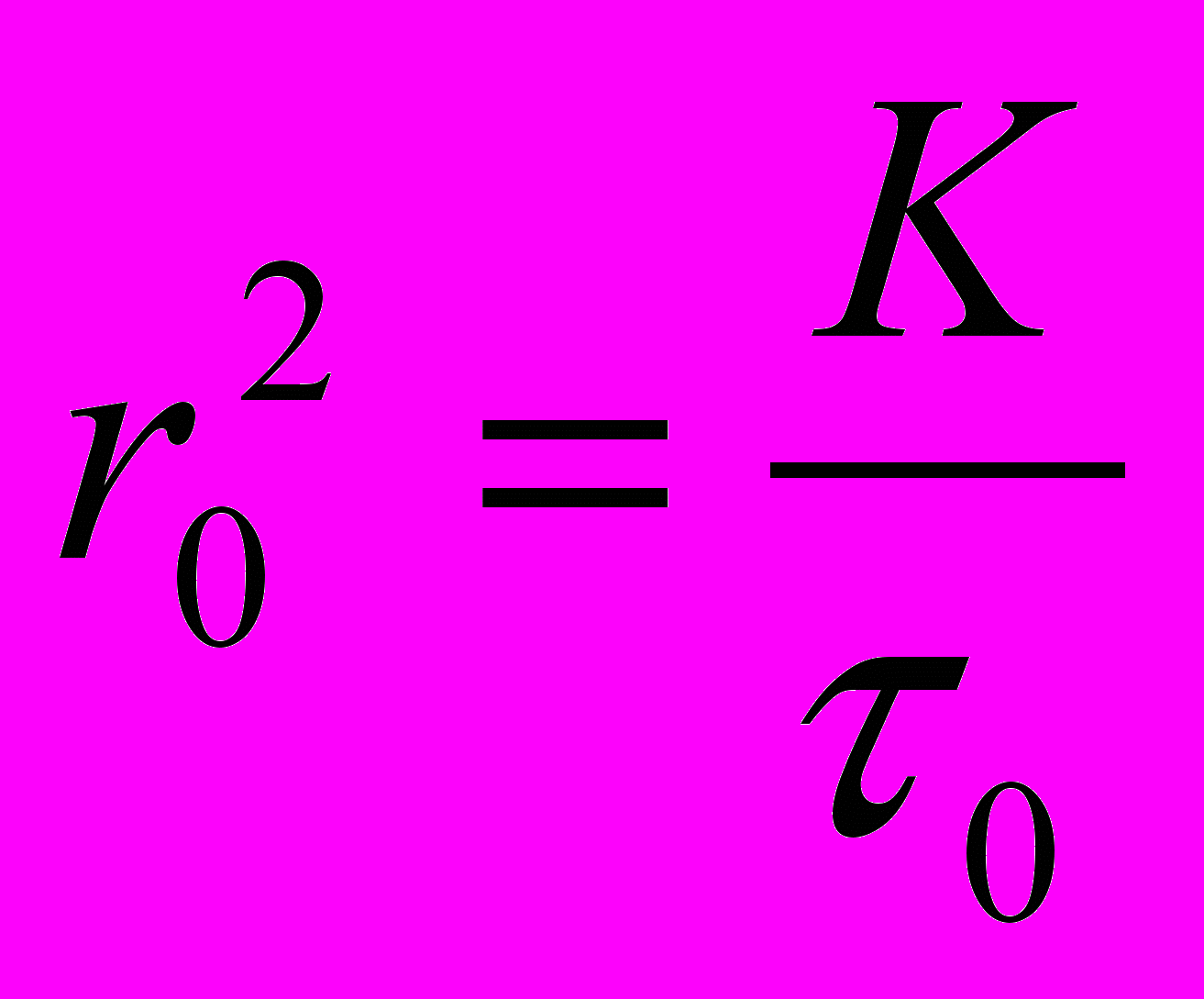 , тогда
, тогда 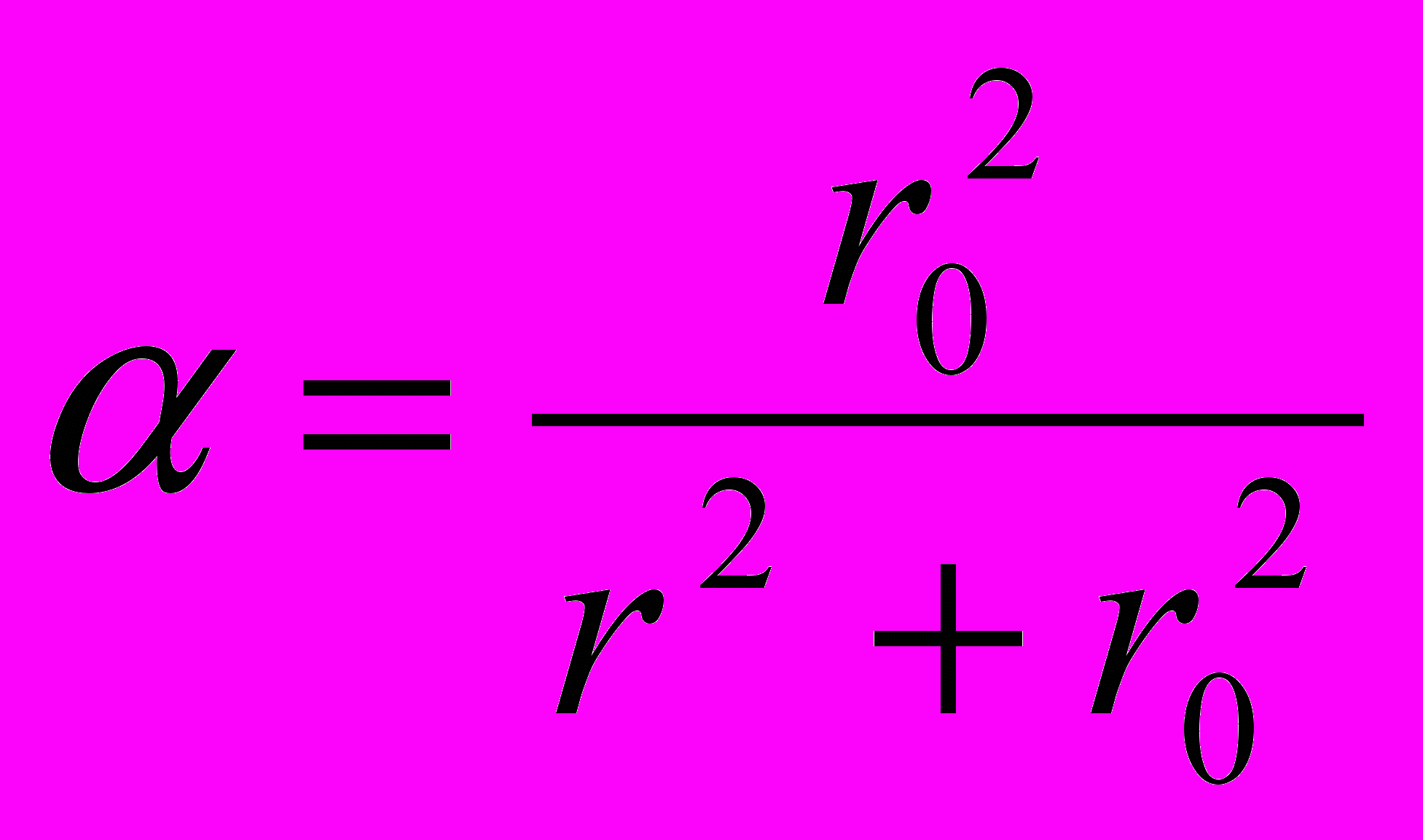 .
.Определяют три основных радиуса, характеризующих кривую распределения: rпр – предельный (наименьший); rн – наивероятнейший, отвечающий максимальному значению ΔQ/Δr, и rм – максимальный радиус:
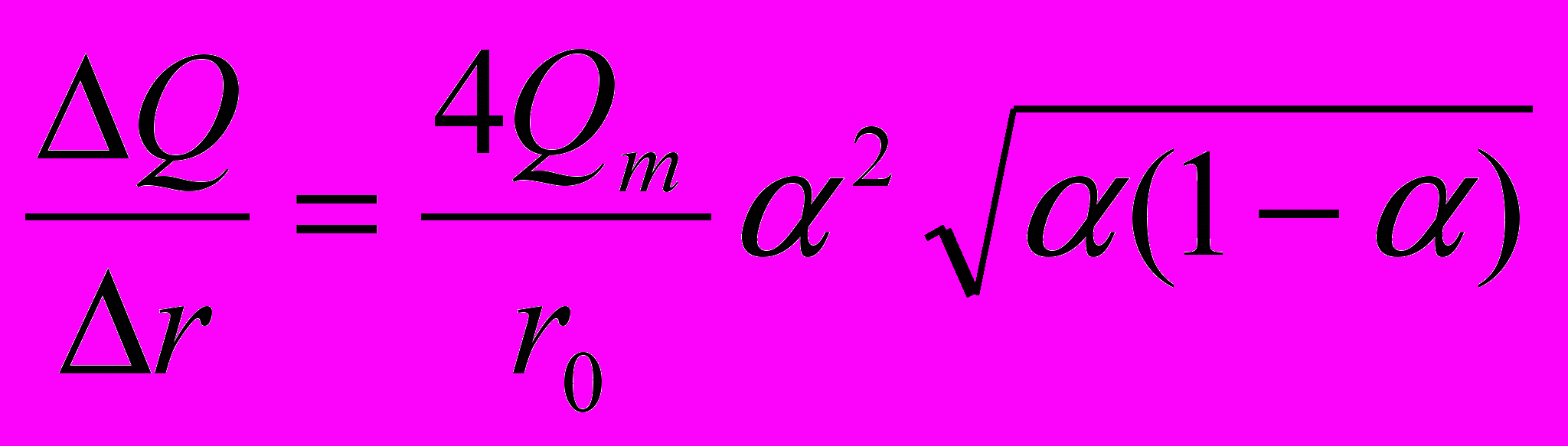
или, заменяя
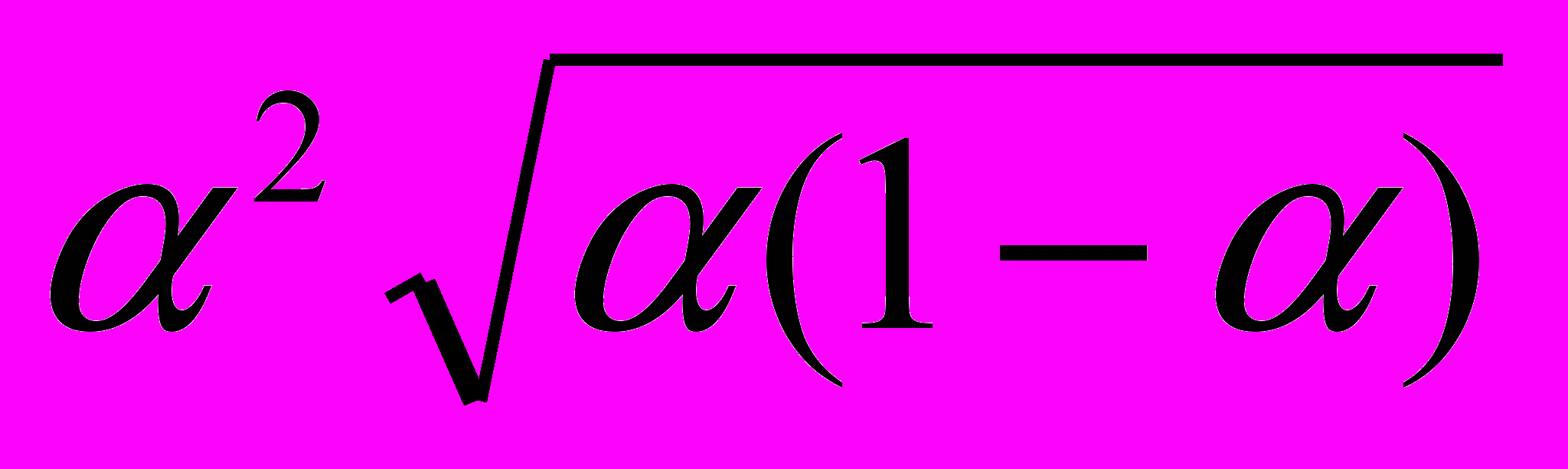 через ε:
через ε: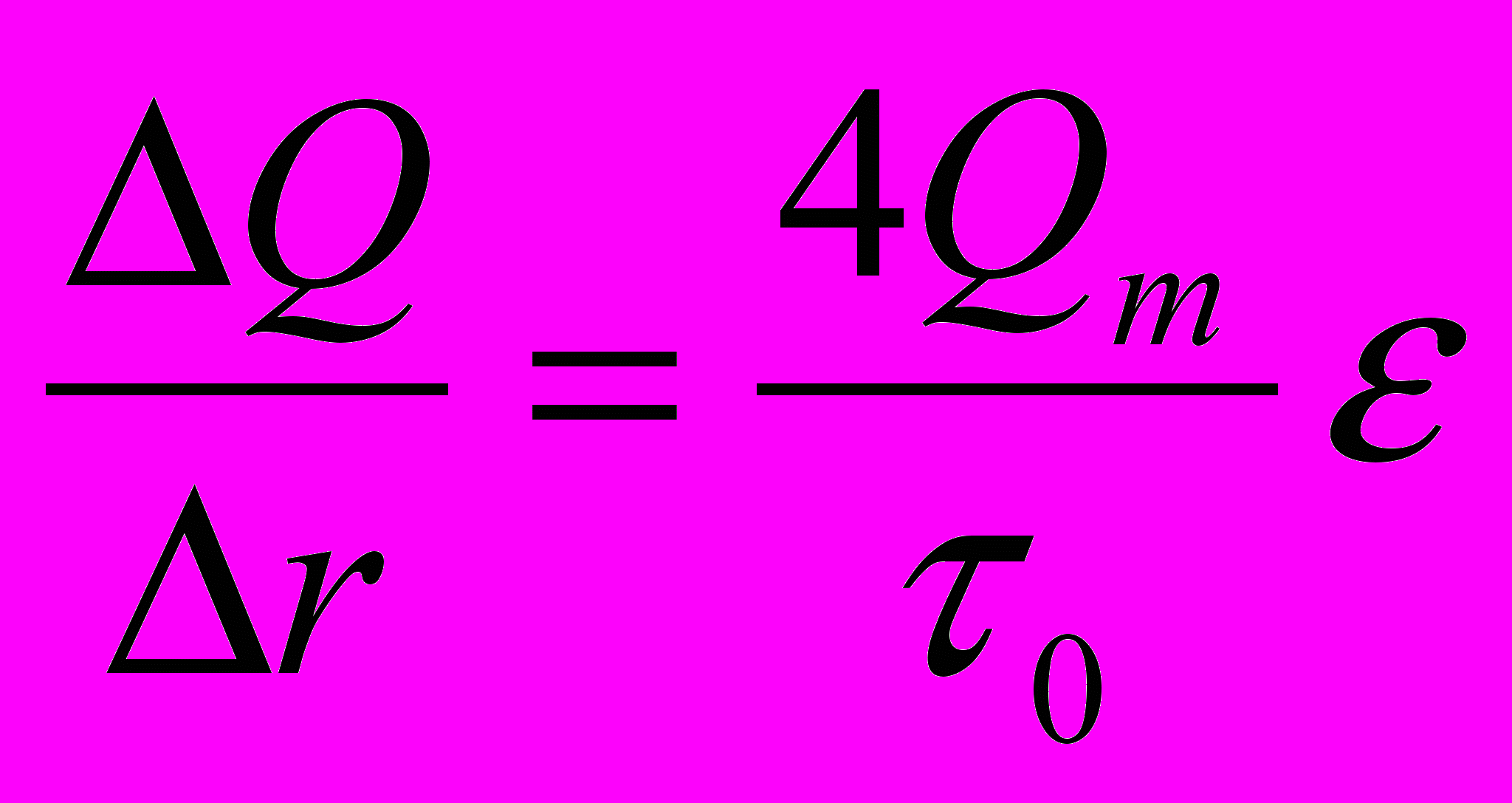 ,
,т.к. ε зависит только от α, то ее можно найти в табл. 1(см. приложение).
Дифференциальная кривая строится в координатах ΔQ/Δr = f(r).
