Генетические и иммунологические параллели у больных раком легкого и бронхиальной астмой 14. 00. 14 онкология 14. 00. 36 аллергология и иммунология
| Вид материала | Автореферат |
| Методы исследования Результаты и обсуждение GSTT1 и сочетаний GSTT1 GSTT1 и сочетания генотипов GSTT1 |
- Результаты использования иммуномодулятора галавит в лечении больных II iii стадией, 442.33kb.
- Клинико иммунологические особенности аллергодерматозов на фоне урогенитальной инфекции, 335.48kb.
- Аллергия, состояние противоинфекционной защиты и оптимизация лечения у больных бронхиальной, 327.27kb.
- Программа Национальной конференции «клиническая иммунология и аллергология практическому, 72.87kb.
- Иммунологические аспекты перинатальной патологии у недоношенных детей 14. 00. 36 аллергология, 874.04kb.
- И. В. Юрков общая характеристика работы, 364.22kb.
- Название Ф. И. О, 1200.6kb.
- Глюкокортикоидные гормоны в лечении больных бронхиальной астмой, 35.3kb.
- Особенности патологии пищеварительной системы у больных бронхиальной астмой и хронической, 1170.78kb.
- Global Initiative for Asthma Глобальной инициативы по бронхиальной астме, 154.96kb.
РЛ – группа больных раком легкого
БА – группа больных бронхиальной астмой
Больные РЛ находились на стационарном лечении в торако-абдоминальном отделении ГУ НИИ онкологии ТНЦ СО РАМН (зав. отделением – д.м.н. С.А. Тузиков). Подавляющее число больных РЛ было мужского пола: обследовано 165 мужчин (92%) и 15 женщин (8%), возрастной интервал составил от 32 до 78 лет (средний возраст манифестации заболевания 59,1±0,9 лет). Анамнез курения был известен у 86 обследованных, среди них доля курящих составила 87,2%. Клинический диагноз РЛ устанавливался на основании клинического, морфологического, эндоскопического и рентгенологического обследования. Стадия онкологического процесса определялась в соответствии с четвертым пересмотром Международной классификации опухолей по системе TNM (Женева, 1987), а также вторым пересмотром (UICC, 1992) и дополнением к классификации TNM (UICC, 1993), одобренным Американским комитетом по раку (AJCC). Образцы опухолей легкого и прилежащих к опухоли тканей легкого были получены в результате диагностических биопсий и/или после оперативных вмешательств по поводу РЛ, гистологическое исследование проводилось в отделении патологической морфологии ГУ НИИ онкологии ТНЦ СО РАМН (руководитель отделения – д.м.н., профессор В.М. Перельмутер).
Больные БА находились на стационарном лечении в аллергологическом отделении Межвузовской больницы (при кафедре иммунологии и аллергологии СибГМУ, зав. кафедрой д.м.н., профессор Климов В.В.) и в пульмонологическом отделении Городской больницы № 3 (при кафедре терапии педиатрического факультета СибГМУ, зав. кафедрой – д.м.н., профессор Волкова Л.И.). Диагноз устанавливался в соответствии с Глобальной стратегией лечения и профилактики БА (GINA, 2003) на основании жалоб на приступы затрудненного дыхания или приступообразный кашель, купирующиеся ингаляцией 2-агонистов, наличия обратимой бронхиальной обструкции, подтвержденной объективными методами обследования (суточный разброс ПСВ > 20%, прирост ОФВ1 > 15%), положительных результатов кожного тестирования с наиболее часто встречаемыми аллергенами для Западно-Сибирского региона (домашняя пыль, библиотечная пыль, шерсть кошки, береза, полынь, одуванчик, лебеда, овсяница, ольха, костра, одуванчик, производитель – ОАО «Биомед», г. Москва).
Больные ХОБЛ находились на стационарном лечении в пульмонологическом отделении Городской больницы № 3 (при кафедре терапии педиатрического факультета СибГМУ, зав. кафедрой – д.м.н., профессор Волкова Л.И.) и в торако-абдоминальном отделении ГУ НИИ онкологии ТНЦ СО РАМН (зав. отделением – д.м.н. С.А. Тузиков). Всего обследовано 83 человека, из них 70 мужчин (84,3%) и 13 женщин (15,6%), в возрасте от 33 до 87 лет, средний возраст составил 58,3±1,1 лет. Доля курящих составила 80,7%. Диагноз устанавливался по рекомендациям, представленным программой «GOLD» (2003) на основании жалоб на хронический кашель с мокротой и одышку, наличия факторов риска в анамнезе и результатов исследования функции внешнего дыхания (ОФВ1/ФЖЕЛ<70% и постбронходилатационное значение ОФВ1<80% от должного). Подавляющее большинство составили больные с тяжелой и крайне тяжелой стадией заболевания: стадия I диагностирована у 12 пациентов (14,4%), стадия II диагностирована у 20 пациентов (24,0%), стадия III у 27 (32,5%), стадия IV – у 24 (28,9%).
При оценке полиморфизма генов GSTT1 и GSTM1 у больных РЛ, БА и ХОБЛ в качестве популяционного контроля использовали выборки здоровых лиц европеоидного происхождения, проживающих в г. Томске и г. Новосибирске, которые не отличались по распределению генотипов (Ляхович В.В., 1997; Севостьянова Н.В., 2003). Контрольные выборки были сформированы из здоровых мужчин и женщин отдельно для больных ХОБЛ и РЛ, и для больных БА, с учетом соответствия возрастного и полового состава, данные любезно предоставлены В.А. Белявской (Новосибирск).
Методы исследования
Материалом для исследования служили периферическая кровь и индуцированная мокрота (ИМ).
Для выявления делеции гена хемокинового рецептора (CCR5del32-полиморфизм) использовали аллель-специфичную полимеразную цепную реакцию (ПЦР). Амплифицировали фрагмент гена размером 276 п.н., несущий потенциальную делецию в 32 п.н., с использованием фланкирующих праймеров (Юдин Н.С. и соавт., 1998). Применяли праймеры CCR5F: 5’ – GAA-GGT-CTT-CAT-TAC-ACC-TG и CCR5R: 5’ – AGA-ATT-CCT-GGA-AGG-TGT-TC из генетического банка, каталожный номер U54994. Наличие продукта амплификации размером только 276 п.н. интерпретировалось как гомозиготное состояние по нормальному аллелю (генотип CCR5/CCR5), наличие продукта размером только 244 п.н. – как гомозиготное состояние по делеционному аллелю CCR5del32 (генотип CCR5del32/CCR5del32), наличие фрагментов 276 и 244 п.н. – как гетерозиготное (генотип CCR5/CCR5del32).
Генотипирование гена р53 осуществляли методом анализа полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ) с помощью праймеров: Pr1: 5’ – TTG CCG TCC CAA GCA ATG GAT GA – 3’ и Pr2: 5’ – TCT GGG AAG GGA CAG AAG ATG AC – 3’. Для рестрикции фрагмента гена р53 использовали эндонуклеазу BstFN1. Визуализацию рестрикционных фрагментов гена р53 (199, 113 и 86 п.н.) проводили с помощью электрофореза в 7% полиакриламидном геле.
Типирование образцов по генам GSTT1 и GSTM1 проводили путем мультиплексной ПЦР (Spurdle et al., 2001). Использовали три пары олигонуклеотидных праймеров, специфичных к участку гена рецептора эстрогенов, ER (F: 5’ – CAA-GTC-TCC-CCT-CAC-TCC-CC; R: 5’ –GTG-CGA-GTG-GCT-CAG-TGT-GT) и генов GSTT1 (F: 5’ –GGT-CAT-TCT-GAA-GGC-CAA-GG; R: 5’ –TTT-GTG-GAC-TGC-TGA-GGA-CG), и GSTM1 (F: 5’ –TGC-TTC-ACG-TGT-TAT-GGA-GGT-TC; R: 5’-GTT-GGG-CTC-AAA-TAT-ACG-GTG-G). Гомозиготность по нулевым аллелям (0/0) генов GSTT1 и GSTM1 определяли по отсутствию на электрофореграммах продуктов амплификации фрагментов размером 131 п.н. и 114 п.н., соответственно. Наличие этих фрагментов свидетельствовало о присутствии, по крайней мере, одной нормальной (без делеции) копии генов (гомо- и гетерозиготы, генотипы +/+ и +/0). Участок гена ER размером 183 п.н. использовали в качестве внутреннего контроля амплификации.
Для тестирования субпопуляций лимфоцитов применяли метод иммуноцитохимии с использованием моноклональных антител для дифференцировочных и активационных антигенов СD3, CD4, CD8, CD16, CD22, CD25, CD95, HLA-DR («DAKO», «Novocastra»). Концентрацию сывороточных иммуноглобулинов: IgG, IgM, IgA определяли методом радиальной иммунодиффузии в геле по Манчини (Mancini et al., 1965). Функциональную активность нейтрофилов определяли по их способности генерировать активные формы кислорода в реакции восстановления нитросинего тетразолия (Нестерова И.В. с соавт., 1999). ИМ получали и обрабатывали согласно рекомендациям Института пульмонологии (1998). При помощи иммерсионной микроскопии на 400 клеток мазка подсчитывали процентное соотношение плазматических клеток, лимфоцитов, нейтрофилов, макрофагов, и эозинофилов, не учитывая клетки плоского и бронхиального эпителия. Содержание фактора некроза опухоли- (ФНО-), интерферона- (ИНФ-), интерлейкинов 4, 2, 8 и 10 (ИЛ-4, ИЛ-2, ИЛ-8 и ИЛ-10) в ИМ определяли иммуноферментным методом с использованием наборов реагентов «ИФА-TNF-alpha» и «ИФА-IL-10» (ГНЦ НИИ особо чистых биопрепаратов, Санкт-Петербург), «гамма-Интерферон-ИФА-БЕСТ» и «ИЛ8-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Новосибирск), «Human IL2 ELISA BMS221INST» («Bender MedSystems», Австрия), «ИЛ-4-ИФА-БЕСТ» (ЗАО «Вектор-Бест», Новосибирск).
Статистическая обработка материала проводилась с использованием пакета прикладных программ «Statistica for Windows 6.0». Выборки данных проверяли на нормальность распределения (критерий Колмогорова-Смирнова). При соответствии нормальному закону распределения признака в исследуемых выборках проверку гипотезы о равенстве средних выборочных величин проводили с использованием t-критерия Стьюдента. Для оценки статистической значимости различий показателей выборок, не подчиняющихся закону нормального распределения, использовали непараметрический критерий Манна-Уитни (U-тест). С целью обнаружения связи между исследуемыми показателями проводили корреляционный анализ путем вычисления коэффициента ранговой корреляции Спирмена (r). Коэффициент корреляции считали значимым, если вероятность ошибки не превышала 0,05. При сравнении частот генотипов использовался стандартный критерий 2 Пирсона, при условии, когда объем выборки не превышал 5 случаев, использовали критерий 2 с поправкой Йетса и критерий Фишера. Подсчитывали отношение шансов (OR - odd ratio) для оценки ассоциации между определенными генотипами и риском развития заболевания по стандартной формуле OR=a/b x d/c, где a и b – количество больных, имеющих и не имеющих мутантный генотип, соответственно, и d и с – количество человек в контрольной группе, имеющих и не имеющих мутантный генотип. OR указан с 95%-ным доверительным интервалом (Confidence interval CI) (Лакин Г.Ф., 1989; Дж. Флейс, 1989). Для всех изученных полиморфных вариантов генов в выборках популяционного контроля и пациентов распределение генотипов соответствовало ожидаемому при равновесии Харди-Вайнберга.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Мультифакториальный характер аллергических заболеваний и злокачественных новообразований предполагает определенную генетическую детерминированность функционирования патогенетически важных звеньев, связанных с обеспечением взаимодействия с ксенобиотиками, поддержания целостности генома и функционирования иммунной системы. Возникновение изменений в структуре ДНК, приводящих при определенных условиях к злокачественной трансформации эпителия, напрямую зависит от интенсивности воздействия мутагенов внешней среды и генотоксических агентов эндогенного происхождения, что, в свою очередь, определяется эффективностью работы систем контроля стабильности генома и ферментативной детоксикации, в соответствии генетическими особенностями индивидуума (Palli et al., 2004; Yokota & Kohno, 2004).
*
*
*
*
*
*
*
*
*
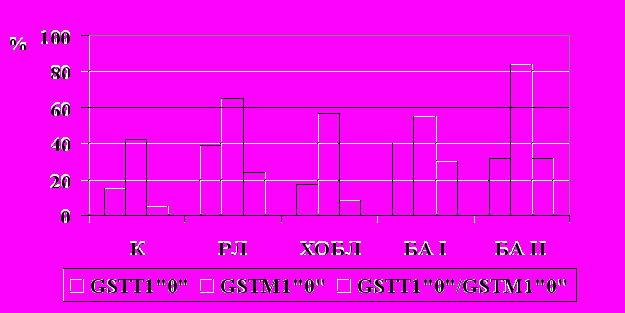
Рис.1. Частота встречаемости «нулевых» генотипов генов ферментов биотрансформации ксенобиотиков GSTT1 и GSTM1 у больных раком легкого, ХОБЛ и бронхиальной астмой. Примечание: * - значимые различия с группой контроля, p<0,05. Здесь и далее: БАI - больные атопической астмой; БАII – больные астмой смешанного генеза.
Результаты осуществленного нами генотипирования генов ФБК 2 фазы, которые обеспечивают инактивацию генотоксических агентов, у больных, ХОБЛ и БА, а также РЛ (данные П.А.Гервас, 2006) представлены на диаграмме (рис.1).
У больных ХОБЛ мы не выявили значимых отличий в распределении генотипов генов GSTT1 и сочетаний GSTT1 и GSTM1 от контрольной выборки, при этом частота нулевого генотипа гена GSTT1 была существенно ниже, чем у больных РЛ. Частота нефункционального генотипа GSTM1”0/0” как в общей группе, так и среди курящих пациентов с ХОБЛ была значимо повышена по сравнению с контролем и не отличалась от таковой в группе больных РЛ. Литературные сведения свидетельствуют об отсутствии ассоциации нулевого генотипа гена GSTT1с ХОБЛ в большинстве популяций (Д.Г.Янбаева и соавт., 2005, Yim et al., 2000). Наши результаты об ассоциации «нулевого» генотипа GSTM1 с риском заболевания ХОБЛ согласуются с данными для европеоидов Великобритании и Франции (H. Baranova et al., 1997; D.J. Harrison et al., 1997), а также для Тайваньской популяции (S.L. Cheng et al., 2004), однако находятся в противоречии с данными Д.Г.Янбаевой и соавт., (2005), полученными на более представительной (240 человек) выборке жителей России.
Ассоциация генотипа GSTM1”0/0” с ХОБЛ и РЛ свидетельствует об общих патогенетических механизмах формирования этих заболеваний и о наличии определенной генетической предрасположенности пациентов с ХОБЛ к формированию РЛ.
В общей группе БА показано существенное повышение частоты встречаемости нулевых генотипов гена GSTT1 и сочетания генотипов GSTT1 и GSTM1 по сравнению с популяционным контролем (рис.1). Известно, что для истинно атопической астмы характерно раннее начало заболевания (до 40 лет), а в группе больных БА с дебютом после 40 лет преобладают пациенты со смешанным механизмом формирования заболевания. Также есть литературные данные о различиях распределения вариантных аллелей генов ФБК и хемокинового рецептора CCR5 у больных бронхиальной астмой разных возрастных групп (С.И. Макарова и соавт., 2002; Srivastava et al, 2003). Поэтому мы сочли целесообразным оценить полиморфизм генов GSTT1 и GSTM1 раздельно в вышеозначенных группах больных БА. Оказалось, что в группе с превалированием пациентов с астмой смешанного генеза частота генотипа GSTM1”0/0” сравнима с таковой в группе больных РЛ и значительно выше, чем у больных БА с манифестацией заболевания в молодом возрасте (атопическая БА), у которых этот показатель не отличается от контрольного уровня.
Поскольку курение является ведущим этиологическим фактором развития РЛ, мы провели анализ частот генотипов генов GSTT1 и GSTM1 у курящих больных БА и ХОБЛ, соответствующих по половому и возрастному составу, в сравнении с группой больных РЛ. Оказалось, что ассоциация генотипа GSTM1”0/0” с повышенным риском заболевания ХОБЛ наблюдается только для курящих лиц. Это свидетельствует о модифицирующем влиянии курения у носителей генотипов GSTM1”0/0” на предрасположенность к ХОБЛ, а также указывает на более высокий риск заболевания РЛ курящих пациентов с ХОБЛ. Такой зависимости от курения у больных БА не выявлено.
Наши данные о повышении частоты нулевых генотипов генов глутатион-S-трансфераз GSTT1, GSTM1 у больных БА не противоречат литературным сведениям (Ляхович В.В. и соавт., 2000; Иващенко Т.Э. и соавт., 2001). В этиологии БА значимая роль придается загрязнению окружающей среды ксенобиотиками, в том числе и токсическими веществами, которые снижают барьерную функцию кожи и слизистых; при этом многие ксенобиотики сами являются аллергенами или гаптенами либо приобретают свойства аллергенов после ферментативной биотрансформации in vivo (Казначеева Л.Ф. и соавт., 2002). Оказалось, что курение матери во время беременности и пассивное курение является фактором риска формирования БА у детей (Gilliland et al., 2002; Kabesch et al., 2004). Хотя показано, что активное курение не влияет на риск развития заболевания у взрослых, однако оно способствует более тяжелому течению астмы (Siroux et al., 2000).
Согласно нашим данным, рисковая значимость GSTM1”0/0” для формирования БА повышается с возрастом, что согласуется с результатами других авторов (С.И. Макарова и соавт., 2002). Вероятно, здесь играют роль временной фактор экспозиции ксенобиотиков у носителей GSTM1”0/0”, а также изменение метаболизма эндогенных биологически активных веществ вследствие нарушения функции GSTM1, в том числе продуктов перекисного окисления и метаболитов арахидоновой кислоты, которые участвуют в патогенезе хронического инфекционного воспаления у лиц со смешанным генезом БА.
Для формирования РЛ важное значение имеют нарушения функции одного из ключевых генов, осуществляющих охрану целостности генома - онкосупрессора р53. Чувствительность р53 к генотоксическим повреждениям существенно зависит от функциональной активности генов детоксикации, в число которых входят глутатион-S-транферазы. Важное значение в плане подверженности р53 к повреждению генотоксическими агентами может иметь Arg/Pro полиморфизм 72 кодона 4 экзона, оказывающий модифицирующий эффект на чувствительность гена р53 к инактивации путем мутаций ( Bonafe et al, 2003, Tada et al, 2001).
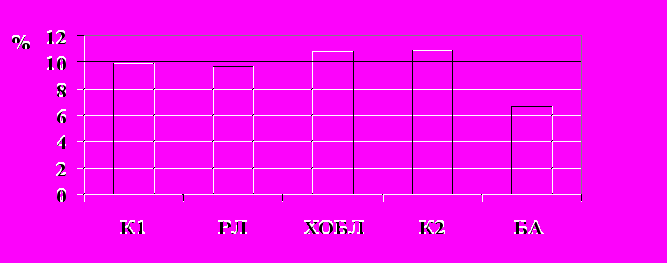
У больных ХОБЛ нами выявлено повышение частоты Arg аллеля (76,7%) гена р53 при снижении частоты Pro аллеля (23,2%) и Pro/Pro генотипа (1,75%) по сравнению с популяционным контролем (65,9%, 34%, 12,7% соответственно). Различий в распределении генотипов и частоте аллелей р53 в группе ХОБЛ с больными РЛ не выявлено. Больные РЛ демонстрируют повышение частоты Arg аллеля по сравнению с популяционным контролем и тенденцию к снижению частоты Pro/Pro генотипа (П.А.Гервас, 2006). Полиморфизм гена р53 у больных ХОБЛ практически не изучен. Лишь в одной известной нам работе получены данные, свидетельствующие об ассоциации аллеля Pro с риском заболевания ХОБЛ у курящих лиц в популяции монголоидной расы (Wang et al., 2005).
Таким образом, нами обнаружено сходство распределения генотипов гена р53 (BstU1-полиморфизм 72 кодона 4 экзона) у больных РЛ и ХОБЛ: при обоих заболеваниях выявлено повышение частоты Arg аллеля и снижение частоты Pro/Pro генотипа по сравнению с популяционным контролем. Наши результаты находятся в согласии с представленными ранее В.В.Ляховичем с соавторами данными для Западно-Сибирской популяции о повышении частоты Arg аллеля в группах больных раком желудка и РЛ (1997), а также данными ряда зарубежных авторов (Papadakis et al, 2002, Wang et al, 1999). Следует отметить, что литературные сведения об ассоциации Arg/Pro полиморфизма 72 кодона 4 экзона гена р53 с РЛ достаточно противоречивы, и это не является только следствием популяционных различий. Показано, что в опухолях происходит селекция полиморфных аллелей р53 с более высокой способностью к мутациям, в частности, для опухолей легкого, молочной железы, головы и шеи и ряда других было установлено селективное преимущество опухолевых клеток, несущих р53 Arg (Furihata et al., 2002; Papadakis et al., 2002; Langerod et al., 2002; Bonafe et al., 2003).
Полученные нами данные свидетельствуют об отсутствии ассоциации полиморфизма р53 с риском заболевания БА, однако у больных БА смешанного генеза выявлена ассоциация Pro аллеля с тяжестью течения заболевания (рис. 2). Поскольку известно, что степень тяжести БА зависит от степени дефекта апоптоза лимфоцитов и эозинофилов, а Pro аллель менее эффективен в индукции апоптоза, можно полагать, что гомозиготное состояние по аллелю Pro у больных БА ассоциировано с нарушением индукции запрограммированной гибели иммунокомпетентных. Степень дефекта апоптоза при БА прямо пропорциональна активности процесса и степени тяжести заболевания (Невзорова В.А. и соавт., 2001; Мамонтова Т.В., Кайдашев И.П., 2004; Woolley et al., 1996; Kankaanranta et al., 2001).
*
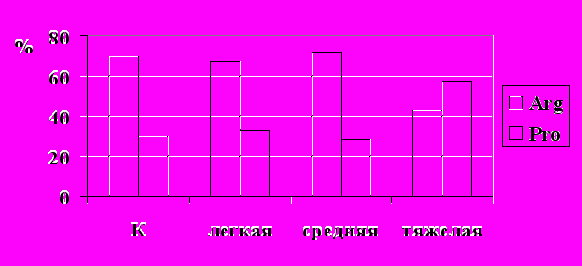
*
Рис. 2. Частота аллелей гена р53 (BstU1-полиморфизм 72 кодона 4 экзона) у больных бронхиальной астмой смешанного генеза с различной степенью тяжести заболевания.
Примечание: * - значимость различий по сравнению с контролем, p<0,05
Так, при исследовании биоптатов бронхиального эпителия показано, что уровень экспрессии гена р53 у больных БА меньше показателей здоровых лиц и наиболее низкий у больных с тяжелой степенью астмы (Vignola et al., 2001; Ivanchuk et al., 2005; Sazonov et al., 2005). Кроме того, в ряде исследований выявлен повышенный уровень хромосомных аберраций в лимфоцитах, микроядрах в эритроцитах и буккальных клетках у больных БА, что косвенно свидетельствует о нарушении систем контроля стабильности генома при этом заболевании (Буторина О.К. и соавт., 1992; Семенов А.В. и соавт, 2003).
С другой стороны, ген р53 участвует в регуляции экспрессии рецептора глюкокортикостероидов (Ganguli et al., 2002; Maiyar et al., 2006). Базисная противовоспалительная терапия тяжелой БА предполагает использование глюкокортикостероидных препаратов в высоких дозах, а тяжелое течение астмы в ряде случаев ассоциировано с устойчивостью к стероидной терапии. Возможно, вариантные генотипы р53 обладают различной функциональной активностью в отношении регуляции экспрессии рецептора глюкокортикостероидов. Полученные данные свидетельствуют о необходимости дальнейшего исследования роли функционального полиморфизма гена р53 в патогенезе тяжелой БА и в резистентности к стероидной терапии.
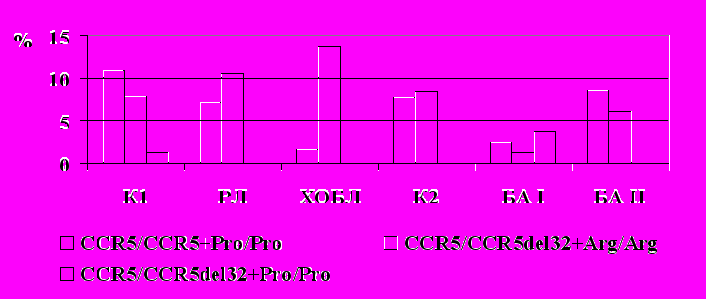
Хемокины продуцируются практически всеми видами клеток, в том числе и опухолевыми, которые экспрессируют хемокиновые рецепторы. Показано, что хемокины непосредственно вовлечены в процесс неоангиогенеза и принимают участие в формировании лимфогенных и органо-специфических метастазов (Strieter et al., 2004; Kakinuma et al., 2006; Zlotnik, 2006). Лигандами для CCR5 являются хемокины RANTES, MIP1-α и β, MCP-2 и MCP-4. CCR5-опосредованный сигнал ведет к активации иммунокомпетентных клеток и их миграции в очаг воспаления, то есть CCR5 функционально вовлечен в процессы естественного и специфического противоопухолевого иммунитета (Lavergne et al., 2004). Имеются свидетельства о роли CCR5 в метастазировании опухолей (Deventer et al., 2005). Важными представляются и уже упоминавшиеся выше данные о вовлечении CCR5 в регуляцию транскрипционной активности р53 модифицированных клеток и связи CCR5del32 полиморфизма с прогрессией рака молочной железы (Manes et al., 2003), а также о накоплении CCR5/CCR5del32 генотипов у больных РЛ с метастазами в регионарные лимфоузлы (Севостьянова Н.В и соавт., 2004). Все вышесказанное послужило весомым основанием для исследования полиморфизма гена хемокинового рецептора CCR5 у больных ХОБЛ и БА (рис. 3).
*
Рис. 3. Частота делеционного аллеля гена CCR5 (CCR5del32) у больных раком легкого,
ХОБЛ и бронхиальной астмой.
Примечание: * - значимость различий по сравнению с контролем, p<0,05
К1 – популяционный контроль для больных РЛ и ХОБЛ
К2 – популяционный контроль для больных БА
У больных ХОБЛ не выявлено изменений в распределении генотипов гена CCR5 по сравнению с популяционным контролем и больными РЛ. Однако отмечена более низкая, чем в контроле, частота сочетаний генотипов CCR5/CCR5-Pro/Pro, при этом значимых различий с группой РЛ не выявлено (рис.4). С одной стороны, это указывает на протективное значение данного сочетания генотипов в отношении формирования ХОБЛ и подтверждает данные, представленные выше, в отношении Pro/Pro генотипа и Pro аллеля. С другой стороны, это дает основания заключить об отсутствии различий в распределении генотипов гена CCR5 (полиморфизм CCR5del32) у больных ХОБЛ и РЛ.
У больных БА частота делеционного аллеля CCR5del32 существенно ниже, чем в популяционном контроле, и минимальна при БА атопического генеза с легкой степенью тяжести (2,5% против 11% в популяционном контроле, р<0,05). Интересно, что частота делеционного аллеля у больных БА с вовлечением нескольких органов-мишеней в аллергический процесс и у больных ХОБЛ с латентной сенсибилизацией была значительно снижена, а у больных БА без других сопутствующих аллергических заболеваний и у больных ХОБЛ без латентной сенсибилизации не отличалась от показателя популяционного контроля и больных РЛ. Инверсная направленность изменений частоты CCR5del32 у больных РЛ и атопической БА указывает на защитное значение атопической конституции в плане предрасположенности к развитию РЛ.
В группе с атопической БА частота сочетания генотипов CCR5/CCR5del32-Arg/Arg ниже, а комбинации генотипов CCR5/CCR5del32-Pro/Pro выше, чем в контрольной группе, то есть можно говорить об ассоциации последней комбинации с повышенным риском формирования БА атопического генеза. Среди больных РЛ и ХОБЛ вообще не найдено лиц с сочетанием CCR5/CCR5del32-Pro/Pro, при этом интересно, что для БА и ХОБЛ выявлены ассоциации с разными сочетаниями генотипов (рис. 4). Это служит дополнительным указанием на различия механизмов вовлечения генов CCR5 и р53 в патогенез этих заболеваний и указывает на разный характер накопления генетических изменений в группах больных атопической БА и РЛ.