Тема: Почечная ангиография
| Вид материала | Доклад |
- Особенности вирусных гепатитов в условиях лечения программным гемодиализом, 58.29kb.
- 1 11 Тема 2 12 тема 3 13 Тема 4 14 Тема 5 15 Тема 6 17 Тема 7 20 Тема 8 22 Тема, 284.17kb.
- Бражник Елена Анатольевна л-314, 424.02kb.
- Вопросы теории, практики и методики изучения, 1714.38kb.
- Программа курса Тема I. Предмет, метод и задачи статистики Тема, 1602.61kb.
- О. В. Белова Новосибирск: Научно-учебный центр психологии нгу, 1996 Введение Тема Тема, 1005.33kb.
- О. В. Белова Новосибирск: Научно-учебный центр психологии нгу, 1996 Введение Тема Тема, 1006.61kb.
- Тема Великой Отечественной войны. $B тема Гражданской войны. $C тема коллективизации;, 241.02kb.
- Лекции по уголовному процессу. Тема № Понятие уголовного процесса, его сущность и задачи, 1734.34kb.
- Тема Философия как высший вид мировоззрения Тема История философии, 6054.43kb.
| Российский государственный медицинский университет | ||||
| | | Кафедра детской хирургии | ||
| ДОКЛАД | ||||
| | ДИСЦИПЛИНА: урология ПРЕПОДАВАТЕЛЬ: Врублевский С. Г. ТЕМА: Почечная ангиография ВЫПОЛНИЛ: Гришин Д. В. | |||
| | | |||
| | ||||
| г. Москва. СНК детской хирургии 2005г. | ||||
С О Д Е Р Ж А Н И Е
Введение 4
Глава 1. Виды ангиографий 4
Глава 2. Значение ангиографии 5
2.1. Показания 5
2.2. Противопоказания 6
Глава 3. Техника выполнения 6
3.1. Транслюмбальная аортография 6
3.2. Трансфеморальная аортография 8
Глава 4. Осложнения 8
4.1. Транслюмбальная аортография 8
4.2. Трансфеморальная аортография по Сельдингеру 10
Глава 5. Фазы почечной ангиографии 15
Глава 6. Ангиографические признаки нормальной почки 17
Глава 7. Диагностика патологии 18
На сайт автора 20
Список использованных источников: 20
Введение
П

 очечная ангиография, широко известная под названием транслюмбальной или трансфе- моральной аортографии, была предложена Dos Santos в 1929 г. С 1942 г. этот метод исследования стал постепенно внедряться в урологическую практику. Особенно широко почечная ангиография стала применяться за последние 15 лет. Этому благоприятствуют высокое развитие техники, усовершенствование рентгеновской аппаратуры и специальных приспособлений, облегчающих исследование, а также наличие малотоксичных контрастных веществ, пригодных для ангиографии. Наряду с этим большая диагностическая ценность данного метода расширяет показания к его применению и увеличивает количество сторонников почечной ангиографии.
очечная ангиография, широко известная под названием транслюмбальной или трансфе- моральной аортографии, была предложена Dos Santos в 1929 г. С 1942 г. этот метод исследования стал постепенно внедряться в урологическую практику. Особенно широко почечная ангиография стала применяться за последние 15 лет. Этому благоприятствуют высокое развитие техники, усовершенствование рентгеновской аппаратуры и специальных приспособлений, облегчающих исследование, а также наличие малотоксичных контрастных веществ, пригодных для ангиографии. Наряду с этим большая диагностическая ценность данного метода расширяет показания к его применению и увеличивает количество сторонников почечной ангиографии.В нашей стране почечная ангиография была внедрена в практику урологической клиникой II Московского медицинского института с февраля 1955 г. (А. Я. Пытель и Н. А. Лопаткин, 1956). Благодаря применению портативной приставки-кассеты для серийной почечной ангиографии, предложенной Н. А. Лопаткиным и А. П. Жирновым, этот метод сделался легко доступным и находит все большее и большее применение в практике урологических учреждений Советского Союза.
Глава 1. Виды ангиографий
В зависимости от способа введения в аорт контрастного вещества различают транслюмбальную аортографию (Dos Santos, 1929), когда заполнение рентгеноконтрастным веществом аорты и ее ветвей осуществляется путем пункции аорты со стороны поясницы, и ретроградную (трансфеморальную) аортографию (Ichikawa, 1938; Seldinger, 1953), при которой контрастное вещество вводят в аорту путем пункции бедренной артерии с проведением по ней катетера до уровня отхождения от аорты почечных артерий (середина тела I поясничного позвонка). Эти два метода почечной ангиографии в настоящее время применяются чаще всего.

Глава 2. Значение ангиографии
Почечная ангиография является ценным функциональным и морфологическим методом диагностики. Помимо выявления особенностей ангиоархитекто- ники, она позволяет определить функциональную способность почек в тех случаях, когда другими методами исследования сделать это не удается. Ее следует применять тогда, когда другие методы рентгенодиагностики не в состоянии установить характер заболевания. Почечная ангиография не исключает диагностических возможностей ретроградной пиелографии или экскреторной урографии; она дополняет их либо приходит им на смену там, где они оказываются несостоятельными.
2.1. Показания
П
 очечная ангиография показана:
очечная ангиография показана: - когда невозможно произвести ретроградную пиелографию, а экскреторная урография не устанавливает вида и степени заболевания;
- в случаях почечной гематурии, этиологию которой нельзя установить другими методами;
- при подозрении на опухоль почки, преимущественно в корковом веществе ее;
- при необходимости дифференцировать опухоль почки от кисты ее;
- при гидронефрозе с целью определения этиологии его, степени сохранности почечной паренхимы и допустимости резекции добавочного сосуда, исходя из масштабов кровоснабжения почки основной и добавочной артерией;
- при туберкулезе почки, когда решается вопрос о возможности и уровне резекции в зависимости от ангиоархитектоники ее;
- при сложных аномалиях почек;
- при гипертонии неясной этиологии;
- при нефрогенной гипертонии для установления ее вида, характера поражения почечной артерии (стеноз, атеросклеротические изменения, аневризма и др.);
- при опухолях надпочечников и других забрюшинных новообразованиях.
2.2. Противопоказания

Т
 ранслюмбальная пункция аорты противопоказана при резко выраженном атеросклерозе ее. Повышенная чувствительность организма к йоду и резко выраженный тиреотоксикоз, прогрессирующая тяжелая почечная недостаточность, тяжелая степень недостаточности печени, активный туберкулез легких и тяжелая степень сердечно-сосудистой недостаточности являются противопоказанием к почечной ангиографии.
ранслюмбальная пункция аорты противопоказана при резко выраженном атеросклерозе ее. Повышенная чувствительность организма к йоду и резко выраженный тиреотоксикоз, прогрессирующая тяжелая почечная недостаточность, тяжелая степень недостаточности печени, активный туберкулез легких и тяжелая степень сердечно-сосудистой недостаточности являются противопоказанием к почечной ангиографии.С целью выявления возможной идиосинкразии к йоду обязательно предварительное проведение пробы на скрытую повышенную чувствительность каждого больного к йоду.
Глава 3. Техника выполнения
После транслюмбальной аортографии, в зависимости от самочувствия больного, ему разрешают ходить на 2-е сутки, а после трансфеморальной аортографии — на 4-е сутки. На протяжении ближайших 3—5 дней следует производить больным обычные анализы мочи и крови.
3.1. Транслюмбальная аортография
За 30 минут до исследования больному делают инъекцию 1 мл 1 % раствора морфина и непосредственно перед исследованием 1 мл 1% раствора омнопона. Больного укладывают вниз животом на горизонтально расположенный рентгеновский стол с вытянутой вдоль туловища левой рукой и отведенной в сторону правой рукой, на которой регистрируют артериальное давление и пульс. Исследование производят под местной анестезией.
Для почечной ангиографии не требуется какого-либо сложного технического оснащения. Она с успехом может быть выполнена при наличии рентгеновского аппарата типа УРДД-110 отечественного производства и простым кассетным приспособлением Н. А. Лопаткина и А. П. Жирнова, позволяющим произвести серийные снимки с очень короткими интервалами времени (3 снимка в 2 секунды). Первые две рентгенограммы производят в течение первых 2 секунд, т. е. во время введения в аорту контрастной жидкости, третью рентгенограмму — тут же после введения всего количества контрастной жидкости, четвертую — спустя 3—5 минут после первой.
В качестве контрастного вещества применяют наши отечественные препараты — трийотраст (70%), кардиотраст (70%) и зарубежные — диодон (70%), гипак (70%), урокон (70%), диатризоат натрия (70%), дийодраст (70%) и др. Для получения четкого изображения сосудов почек вполне достаточно ввести в аорту 20—25 мл контрастной жидкости со скоростью 10 мл в секунду.
П
 ункцию аорты производят иглой, имеющей длину 15 см и диаметр 1,8 мм. Пунктируют аорту со стороны поясницы, отступая влево на 8—9 см от остистых отростков позвонков и на 2—4 см от нижнего края XII ребра. Острие иглы должно направляться к телу I поясничного позвонка. На пути следования игла может встретить два костных препятствия. Первое препятствие на глубине 4—5 см обусловлено поперечным отростком позвонка; в этом случае иглу направляют более отвесно на 1 см, а затем придают ей прежнее направление к телу позвонка. Второе костное препятствие, обусловленное телом позвонка, может встретиться на глубине 8—9 см. В таком случае иглу оттягивают на 1—2 см назад и придают ей более отвесное направление, чтобы острие ее отошло в латеральную сторону и скользнуло по телу позвонка. При дальнейшем продвижении иглы на глубине 11 —15 см часто удается ощутить пульсацию аорты. После дополнительной анестезии раствором новокаина парааортальной клетчатки пунктируют аорту. Доказательством пункции аорты является ощущение провала, подобно проколу твердой мозговой оболочки при спинномозговой пункции. Тут же из иглы выбрасывается кровь пульсирующей струей.
ункцию аорты производят иглой, имеющей длину 15 см и диаметр 1,8 мм. Пунктируют аорту со стороны поясницы, отступая влево на 8—9 см от остистых отростков позвонков и на 2—4 см от нижнего края XII ребра. Острие иглы должно направляться к телу I поясничного позвонка. На пути следования игла может встретить два костных препятствия. Первое препятствие на глубине 4—5 см обусловлено поперечным отростком позвонка; в этом случае иглу направляют более отвесно на 1 см, а затем придают ей прежнее направление к телу позвонка. Второе костное препятствие, обусловленное телом позвонка, может встретиться на глубине 8—9 см. В таком случае иглу оттягивают на 1—2 см назад и придают ей более отвесное направление, чтобы острие ее отошло в латеральную сторону и скользнуло по телу позвонка. При дальнейшем продвижении иглы на глубине 11 —15 см часто удается ощутить пульсацию аорты. После дополнительной анестезии раствором новокаина парааортальной клетчатки пунктируют аорту. Доказательством пункции аорты является ощущение провала, подобно проколу твердой мозговой оболочки при спинномозговой пункции. Тут же из иглы выбрасывается кровь пульсирующей струей.Во избежание тромбирования иглы и тромборбразования в сосудах вводят в аорту раствор гепарина (в разведении 10 000 единиц на 2 л физиологического раствора) в течение всего периода исследования. Этот раствор поступает в аорту по каплям из банки, подвешенной на высоте 1,5 м.
П
 еред введением в аорту контрастной жидкости уровень стояния иглы контролируют тут же произведенной рентгенограммой. Затем, в аорту вводят 5 мл 0,5% раствора новокаина. Это предупреждает спазм аорты и ее ветвей, который может возникнуть в ответ как на пункцию аорты, так и на введение в нее контрастной жидкости. Только убедившись в соответствии избранной экспозиции данному больному и в правильном положении иглы по контрольной рентгенограмме можно вводить контрастную жидкость в аорту.
еред введением в аорту контрастной жидкости уровень стояния иглы контролируют тут же произведенной рентгенограммой. Затем, в аорту вводят 5 мл 0,5% раствора новокаина. Это предупреждает спазм аорты и ее ветвей, который может возникнуть в ответ как на пункцию аорты, так и на введение в нее контрастной жидкости. Только убедившись в соответствии избранной экспозиции данному больному и в правильном положении иглы по контрольной рентгенограмме можно вводить контрастную жидкость в аорту.Перед самым введением контрастной жидкости больному приказывают не дышать. Рентгенография начинается после того, как в аорту введено 10 мл контрастной жидкости. Вторую рентгенограмму производят немедленно в конце введения всего количества контрастной жидкости, третью — тут же вслед за второй. Последующие рентгенограммы производят через 1—5 минут, в зависимости от показаний. Иглу удаляют в два приема и только тогда, когда рентгенограммы проявлены и качество их отвечает нужным требованиям. В случае необходимости можно повторить введение контрастной жидкости в аорту, однако общее количество препарата не должно превышать 1 мл на 1 кг веса больного.
3.2. Трансфеморальная аортография
Э
 тот вид почечной ангиографии может быть осуществлен либо путем обнажения и пункции бедренной артерии, либо путем чрескожной пункции ее (метод Seldinger).
тот вид почечной ангиографии может быть осуществлен либо путем обнажения и пункции бедренной артерии, либо путем чрескожной пункции ее (метод Seldinger). Линейным разрезом в скарповском треугольнике рассекают кожу, подкожную клетчатку и фасцию бедра. Мышцы тупо раздвигают, благодаря чему обнажают бедренную артерию и вену. Бедренную артерию не следует мобилизовать циркулярно, а достаточно выделить переднюю ее стенку на протяжении 1,5—2 см. Артерию пунктируют сосудистым троакаром конструкции НИИЭХАИ. По троакару вводят в артерию полый зонд соответствующего диаметра, после чего троакар удаляют, а зонд постепенно продвигают вверх в аорту до уровня отхождения почечных артерий. Производят контрольную рентгенографию с целью определения уровня стояния верхнего конца сосудистого зонда в аорте. Затем по зонду вводят 5 мл раствора новокаина и вслед за ним рентгеноконтрастное вещество. Рентгенография должна начинаться с момента введения 7 мл контрастной жидкости. Последнюю вводят с максимальной быстротой. Периоды производства рентгенограмм те же, что и при транслюмбальной аортографии: в момент введения жидкости — 2 рентгенограммы, а третья в конце введения. Пункционная рана артерии обычно имеет маленький диаметр и требует наложения только одного шва на адвентицию с целью остановки кровотечения.
Описанная методика значительно упрощает технику зондирования аорты, и делает ее легко доступной для врача и безопасной для больного. Метод Сельдингера (Seldinger, 1953), заключается в чрескожной пункции бедренной артерии специальной иглой и введении по ней проводника для продвижения по нему полого зонда в брюшную аорту. У больных артериальной гипертонией после удаления из сосуда катетера, несмотря на длительное прижатие места пункции, иногда наблюдаются межфасциальные и подкожные гематомы.
Глава 4. Осложнения
4.1. Транслюмбальная аортография
Наибольшее число осложнений при транслюмбальной аортографии описано в литературе до 60-х годов, когда этот метод широко применялся в клинической практике. В настоящее время методом выбора является чрескожная катетсризационная аортография по Ссльдингеру. Однако она все же используется по определенным показаниям (в частности, при синдроме Лериша и др.). Необходимо кратко упомянуть о осложнениях и опасностях, с которыми можно встретиться при проведении аортографии по данной методике.
J. С. McAfee (1957) при анализе 13200 брюшных аортографии в 206 американских лечебных учреждениях выявил 135 серьезных осложнений, из которых 37 со смертельным исходом. В последующие 10 лет, по мере улучшения качества контрастного вещества, совершенствования техники исследования и установления строгих показаний, риск при транслюмбальной аортографии заметно уменьшился. Так, в клинике сосудистой хирургии De Bakey с 1964 по 1967 г. на 2000 транслюмбальных аортографии не отмечено тяжелых осложнений. Однако в менее специализированных учреждениях осложнения возникали нередко. Н. Diemel и Н. G. Schmitz-Drager (1967) при выполнении 300 транслюмбальных аортографии в 10% случаев наблюдали легкие ив 1 % тяжелые осложнения.
Различают следующие локальные осложнения транслюмбальной аортографии:
- паравазальное введение контрастного вещества;
- интрамуральное введение контрастного вещества;
- расслоение стенки аорты с образованием аневризмы;
- ошибочную пункцию ветвей аорты;
- подкожную постпункционную гематому;
- неврологические осложнения при перидуральной инъекции контрастного вещества;
- травму люмбального мешка;
- гнойный спондилит;
- повреждение легочного синуса с последующим гемо- и пневмотораксом;
- повреждение грудного лимфатического протока.
И. В. Колядюк (1955) и Г. А. Нацвлишвили (1959) показали, что при пункции аорты иглой диаметром более 1,2 мм возникает значительное кровотечение, для остановки которого в ряде случаев приходится накладывать шов на сосуд. В связи с этим Н. А. Лопаткин (1961) рекомендует двухэтапное извлечение иглы после пункции. Вначале иглу извлекают из стенки аорты и через ту же иглу вводят в парааортальную клетчатку 30—40 мл 0,25% раствора новокаина. Это позволяет уменьшить парааортальную гематому после люмбальной цункции, а в случае парааортального введения контрастного вещества новокаин уменьшает боли и способствует разведению контрастной жидкости.
Наблюдались пациенты через 24 ч после транслюмбальной аортографии, во время операции значительные парааортальные и параренальные гематомы с имбибицией нодвздошно-поясничной мышцы. К каким-либо отрицательным последствиям это не приводит, но обширные гематомы могут затруднить оперативное вмешательство. Б. В. Петровский и соавт. (1961) рекомендуют оперировать больных спустя 12—14 дней после аортографии.
Некоторые не считают осложнением кровотечение из места прокола аорты, полагая, что это неизбежно. Однако A. Bouchet и С. Duguesnel (1973) пришлось произвести лапаротомию по поводу угрожающего внутрибрюшного кровотечения.
Наиболее частым осложнением является экстрааортальное введение контрастного вещества. Это наблюдали J. M. Stokes и Н. R. Butcher (1957) в 15%, Н. А. Лопаткин (1961)—в 3,1% случаев. При парааортальном введении даже небольшого количества контрастного вещества больные испытывают резкую боль в поясничной области и в животе. Н. А. Лопаткин (1961) рекомендует до серийной аортографии вводить лишь небольшое количество контрастного вещества и в зависимости от реакции больного решать вопрос о продолжении исследования.
Интрамуральное введение контрастного вещества является более тяжелым осложнением. Образующаяся ложная анавризма в области устья почечной артерии может вызвать расстройство почечного кровообращения. Транслюмбальная аортография может привести к серьезным осложнениям при изолированной пункции и введении контрастного вещества в почечные и брыжеечные артерии. В этих случаях могут наступить расстройства кровообращения, приводящие к инфаркту почки или участка кишечника. Повреждения грудного лимфатического протока описали G. Sectrest (1957), Е. Schwartz (1960), Ch. J. Fagan и Ch. Н. Robinson (1971).
Поскольку основные осложнения при транслюмбальной аортографии связаны не с пункцией аорты, а с техническими погрешностями, профилактика их заключается в соблюдении правил пункции аорты и введения контрастного вещества.
4.2. Трансфеморальная аортография по Сельдингеру
Внедрение в практику чрескожной катетеризационной вазографии привело к значительному упрощению техники ангиографии и более широкому использованию данного метода. В последние годы все чаще появляются сообщения о различных осложнениях при вазографии. Это понятно, так как неизмеримо возросло число исследований и многие наблюдают осложнения при освоении этого метода.
Помимо общих реакций, обусловленных введением контрастного вещества в кровяное русло, возникают осложнения местного характера, среди которых наиболее часто встречаются:
- подкожная гематома и вторичное кровотечение из места пункции сосуда;
- забрюшинная гематома;
- тромбоз артерии;
- перфорация сосуда;
- образование аневризмы в месте пункции;
- экстравазаты контрастного вещества;
- отламывание кончика проводника, катетера.
Р. М. Langsjoen и Е. В. Best (1969), ссылаясь на статистические данные, указывают, что летальность при ангиографии достигла 16,1%, а несмертельные осложнения отмечаются в 27,2% случаев. Учитывая нефротоксическое действие рентгеноконтрастных препаратов, нельзя согласиться с мнением С. Schwarzbach и соавт. (1983) о целесообразности селективной почечной артериографии при диагностике заболеваний единственной почки. Следует отдать предпочтение абдоминальной аортографии.
Осложнения, связанные с пункцией артерии и проведением катетера в сосудистое русло (местные гематомы, повторное кровотечение из места пункции, паравазальное введение катетера), И. А. Биличенко и соавт. (1964) наблюдали в 5% случаев. По их мнению, причина осложнений заключается в грубых манипуляциях при пункции артерии и неправильной компрессии места пункции после удаления катетера.
Одним из наиболее опасных осложнений при исследовании брюшной аорты и ее магистральных сосудов является нарушение целости стенок аорты и сосудов с последующим тромбообразованием. Е. К. Lang (1963), изучив исходы 11402 ангиографии пришел к выводу, что даже местная гематома может привести к венозному спазму, а последний — к тромбофлебиту и затем к эмболии легочной артерии. Такое осложнение он зарегистрировал у одного из 7 умерших больных. М. Hettler (1960) при выполнении 1090 катетеризационных аортографии наблюдал в 1,46% случаев местную гематому, в 0,65% —тромбоэмболию, в 0,18% —образование ложной аневризмы.
По данным Р. Heinrich и R. Oschatz (1969), у 14 из 1000 больных возникли осложнения, потребовавшие оперативного вмешательства: у 8—обширная гематома, у 5—тромбоз артерии, у одного — сосудистый спазм. У 2 больных пришлось прибегнуть к ампутации конечности. У 4 больных спустя 25 мес после исследования оставалась перемежающаяся хромота.
Г. Г. Арабидзе (1969) наблюдал осложнения в 17,3%, А. А. Спиридонов (1972)—в 4% случаев, А. П. Савченко (1973) сообщает, что спазм бедренной артерии возник у 3,8%, подкожные гематомы—у 3%, тромбоз бедренной артерии— у 0,2% больных. Г. С. Кротовский (1974) указывает на 2,6% осложнений. М. Е. Фишер и И. И. Канус (1974) наблюдали 3,8% осложнений. В. С. Савельев и соавт. (1975) отметили осложнения у 6 из 241 больного. По данным М. Д. Джавад-Заде и соавт. (1977), на 310 вазографий осложнения возникли в 45 случаев (13,5%). И. Н. Гришин и Н. С. Филиппович (1977) наблюдали осложнения в 37 случаях (1,7%) с летальным исходом в 2 случаях на 2140 ангиографии, Л. С. Розенштраух и соавт. (1977) — в 54 из 2578 (2,13%) исследований. Г. Л. Аккерман и В. П. Романкин (1978) указывают, что пульсирующие гематомы образовались в 3 случаях на 720 ангиографии.
На 2686 вазографий наблюдали образование местной гематомы в 166 (6,2%) случаях. Большинство больных страдали артериальной гипертензией. Спустя 1—2 нед. гематомы рассасывались. У 4 больных после исследования появились признаки тромбоза бедренной артерии (резкие боли, побледнение конечности, исчезновение пульса на подколенной артерии и тыльной артерии стопы). Не было возможности с уверенностью дифференцировать тромбоз от спазма бедренной артерии и произвели обнажение сосуда. У 3 больных выявлен спазм бедренной артерии. Произведена десимпатэктомия с введением 2 г но-шпы под адвентицию артерии, после чего восстановилась нормальная проходимость артерии. В течение 5 лет никаких последствий осложнения у этих больных не наблюдалось. У одного больного в результате отрыва атероматозной бляшки произошел тромбоз бедренной артерии, потребовавший тромбэктомии, после чего восстановилось нормальное кровообращение.
При тромбозе артерии требуется срочная тромбэктомия. Если тромбоз артерии трудно дифференцировать от спазма, то также показано обнажение сосуда. При обнажении артерии спустя сутки наступают значительные изменения интимы и может потребоваться пластическая операция — наложение заплаты на сосуд [Петровский Б. В., Крылов В. С., 1968].
Серьезным осложнением является образование больших забрюшинных гематом. Это связано с неправильной (косой) пункцией бедренной артерии. Пункционное отверстие на передней стенке артерии располагалось ниже паховой связки, а отверстие на задней—выше связки. При компрессии места пункции кровотечение останавливается лишь из отверстия на передней стенке артерии, а из пункционного отверстия на задней — оно продолжается, что приводит к образованию обширной забрюшинной гематомы. У 6 больных предпринятые консервативные мероприятия оказались оправданными и у них не наблюдалось какие-либо последствий, а у одной больной это привело к неблагоприятному исходу.
Больная Г., 33 лет, поступила в клинику с диагнозом правостороннего нефроптоза, хронического пиелонефрита.
С целью выяснения состояния магистральных почечных сосудов перед нефропексией проведена обзорная аортография по Сельдингеру. На уровне паховой складки пунктирована левая бедренная артерия. Игла введена не перпендикулярно, а под острым углом. После удаления катетера кровотечение из пункционного отверстия остановлено прижатием сосуда в течение 10 мин. Однако больная предъявляла жалобы на чувство распираний в левой подвздошной области. Спустя 6 ч состояние ухудшилось: появились боли в левой половине живота, артериальное давление снизилось до 90/70 мм рт. ст. После гемотрансфузии и применения средств, повышающих артериальное давление, состояние улучшилось. Было принято ошибочное решение воздержаться от оперативного вмешательства. При пальпации в левой половине живота определялась больших размеров забрюшинная гематома. В течение 20 дней отмечались повышение температуры тела и отек левой нижней конечности, связанный со сдавлением и тромбозом левой подвздошной вены.
Длительное время проводилось лечении токами Бернара и лидазой, после чего отек нижней конечности уменьшился, но оставались акроцианоз и боли при ходьбе. Спустя 2 года сохранялись небольшая отечность левой нижней конечности и быстрая ее утомляемость при ходьбе.
Это наблюдение показывает, что в случае возникновения обширной забрюшинной гематомы не следует ограничиваться консервативными мерами, а целесообразно предпринять оперативное лечение, направленное на эвакуацию кровяных сгустков, что является профилактикой нарушения венозного оттока из конечности.
В литературе имеются сообщения об отломе металлических проводников. В. В. Виноградов и Г. Г. Шаповальянц (1966) отметили такое осложнение в 3 случаях на 54 исследования. Однажды в аорте обмотка металлического проводника отсоединилась от основного стержня. В начале был извлечен основной стержень, а затем удалена размотавшаяся обмотка с эластичным концом проводника.
Подинтимальное введение металлического проводника и катетера чаще происходят в подвздошных артериях и в области бифуркации аорты. Большинство исследователей считают, что подобные повреждения стенок сосуда связаны со склеротическими изменениями. Г. А. Кучинский (1970) в одном случае на 800 артериальных катетеризации наблюдал подинтимальное введение контрастного вещества. В. Е. Жилин и О. Н. Пелевкина (1971) при выполнении 180 ангиографии в 11 случаях отметили внесосудистое и в 3 — интрамуралыюе введение контрастного вещества. Было паравазальное введение металлического проводника и катетера у 9 (0,34%) больных, из них у 7 — до бифуркации аорты и у 2 — до абдоминального отдела аорты. При данном осложнении появляются боли и кровь не выделяется по катетеру.
Нет в литературе сообщений об образовании внутрипочечных гематом при выполнении селективной артериографии. Такое осложнение может иметь место при введении в артерию контрастного вещества под большим давлением. Вероятность этого особенно возрастает при наличии опухоли, когда патологические сосуды лишены эластических волокон и легко подвергаются разрыву.
Больной К., 70 лет, поступил в клинику с подозрением на опухоль левой почки. Диагноз опухоли почки подтвержден на основании ангиографии. При изучении артериограммы высказано подозрение на экстравазат, образовавшийся во время исследования (рис. 1, а). Произведены экстраплевральная тораколапаротомия в десятом межреберье слева и нсфрэктомия. Опухоль занимала всю нижнюю часть удвоенной почки. На разрезе в области почечного синуса и частично внутрипочечно определялась организовавшаяся гематома (рис. 1, б). По всей мероятности, это экстравазат после аргериографии.
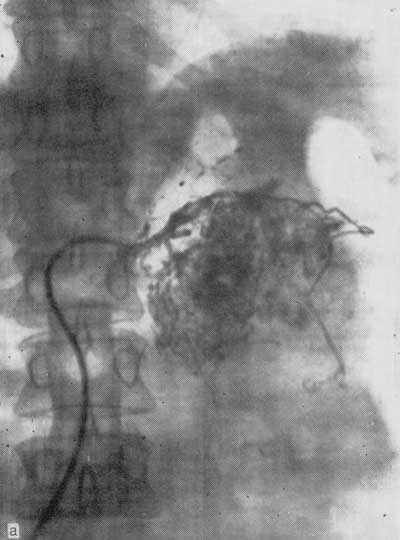
Рис. 1. Опухоль левой почки.
а — селективная артериограмма. Подозрение на экстравазат в результате ангиографического исследования;
б
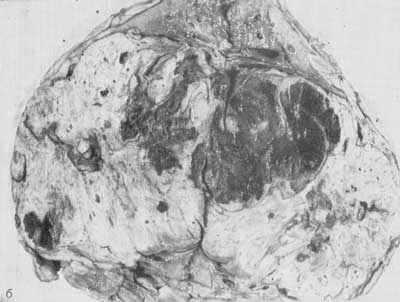 — макропрепарат. В области почечного синуса и частично внутрипочечно видна организовавшаяся гематома в опухоли почки.
— макропрепарат. В области почечного синуса и частично внутрипочечно видна организовавшаяся гематома в опухоли почки.Нередко тяжелые осложнения возникают при ошибочной пункции вены. Г. Г. Арабидзе (1964) описал пункцию вены вместо бедренной артерии с последующей катетеризацией нижней полой вены, перфорацией ее, внутренним кровотечением и летальным исходом. С. Ш. Хундадзе (1971) сообщает об ошибочной пункции бедренной вены во время трансфеморальной аортографии.
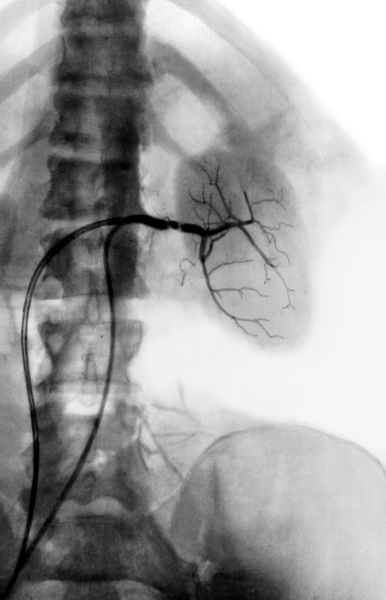
Больной П., 43 лет. Для выяснения причины тотальной гематурии сделана попытка выполнить обзорную аортографию. За 7 мес до исследования перенес резекцию легкого по поводу бронхоэктатической болезни. После чрескожной пункции бедренного сосуда из иглы появилась сильная струя крови (высотой около 30 см, которая по цвету напоминала артериальную. Однако вместо аортограммы была получена кавограмма (рис. 2), на которой отмечалось резкое сужение нижней полой вены в диафрагмальном отделе со значительным расширением ее ниже этого участка. Давление в нижней полой вене оказалось равным 200 мм вод. ст. Исследование больной перенес хорошо. Через 2 нед произведены аортография и селективная венография, выявившие венную почечную гипертензию как причину гематурйи. Техническая ошибка обусловлена резким повышением давления в нижней полой вене, что было вызвано ее сужением в диафрагмальном отделе вследствие перенесенного оперативного вмешательства.

Рис. 2. Нижняя кавограмма. полученная вместо ожидаемой аортограммы. Резкое сужение полой вены в диафрагмальном отделе (ошибочная пункция вены).
Спинальные осложнения при трансфеморальной аортографии встречаются редко. У одного больного развился спинальный инсульт в бассейне большой корешковой артерии [Иванов А. В. и др., 1970]. Очевидно, осложнение возникло вследствие введения контрастного вещества в просвет артерии. Аналогичное осложнение наблюдали Е. Schindler и соавт. (1974).
Глава 5. Фазы почечной ангиографии

В результате серийной почечной ангиографии представляется возможность судить о четырех фазах циркуляции контрастной жидкости в почке и мочевых путях. Вначале получаем изображение почечных артерий и их ветвей — артериограмму (рис. 3), затем — изображение почечной паренхимы в виде плотной тени — нефрограмму (рис. 4), далее удается зафикси- ровать момент оттока по венам контрастной жидкости — венограмму и, наконец, экскреторную урограмму. Изучение всех стадий циркуляции контрастной жидкости в почке имеет большое диагностическое значение (рис. 5, 6 а, б).
Р
 ис. 3. Почечная ангиография (транслюмбальный метод). Мужчина 39 лет. Артериографическая фаза. Нормальные почечные артерии и их ветви.
ис. 3. Почечная ангиография (транслюмбальный метод). Мужчина 39 лет. Артериографическая фаза. Нормальные почечные артерии и их ветви.Рис. 4. Почечная ангиография (транслюмбальный метод). Мужчина 39 лет. Нефрографическая фаза. Нормальная функция почек.

Р
 ис. 5. Транслюмбальная почечная ангиография. Женщина 36 лет. Артериографическая фаза.
ис. 5. Транслюмбальная почечная ангиография. Женщина 36 лет. Артериографическая фаза.
Рис. 6. Транслюмбальная почечная ангиография. Мужчина 34 лет. а — артериографическая фаза, нормальная; б — нефрографическая фаза, нормальная.
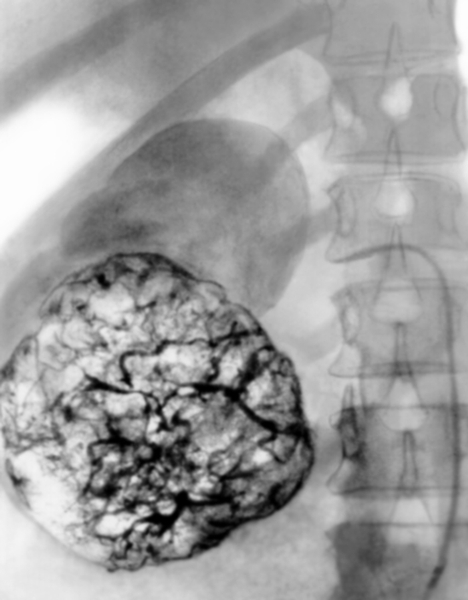
Помимо приведенных двух видов почечной ангиографии, иногда прибегают к операционной почечной вазографии [ангиография на обнаженной во время операции почке по Alken и Sommer (1950)], но значительно чаще к селективной почечной ангиографии. При последней путем трансфеморального или трансбрахиального зондирования аорты и одной какой-либо п
 очечной артерии с последующим введением в нее контрастного вещества удается получить избирательную ангиограмму одной почки (рис. 7). Этот метод ангиографии часто применяется в итальянских клиниках (Chiaudano, 1955; Malchiodi et al., 1957; Morino, 1960; Meinardi и Bubbio, 1962).
очечной артерии с последующим введением в нее контрастного вещества удается получить избирательную ангиограмму одной почки (рис. 7). Этот метод ангиографии часто применяется в итальянских клиниках (Chiaudano, 1955; Malchiodi et al., 1957; Morino, 1960; Meinardi и Bubbio, 1962).Рис. 7. Селективная почечная ангиография (брахиально-аортальный метод). Нормальная ангиограмма (Meinardi, Bubbio, 1962).
Удовлетворительными ангиограммами, на основании которых могут быть сделаны правильные диагностические заключения, являются такие, на которых видно равномерное заполнение контрастной жидкостью аорты и почечных артерий. При изолированном заполнении артерии той почки, в которой предполагается патологический процесс, исследование может считаться полноценным, если известно функционально-морфологическое состояние другой, противоположной почки на основании данных хромоцистоскопии, ретроградной пиелографии, экскреторной урографии. Заполнение контрастной жидкостью артерии только здоровой почки при незаполнении или неравномерном заполнении соответствующего отрезка аорты является показанием к повторному исследованию.
Глава 6. Ангиографические признаки нормальной почки
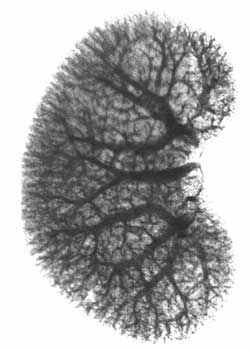
Артериальное кровоснабжение почечной паренхимы состоит как бы из двух зон: передней, более обширной, и задней, менее обширной. Диаметр артериальных сосудов постепенно равномерно суживается от центра к периферии, при этом калибр сосудов в одноименных зонах почки одинаков. Наибольшая изменчивость сосудистой архитектоники отмечается на полюсах почки, с чем следует считаться при интерпретации ангиограмм, равно как и при резекции почки. Так, например, одна из основных ветвей почечной артерии может у ворот почки делиться на 2—3 сосуда, из которых каждый направляется к соответствующему отделу почки. Распределение артерий не всегда строго соответствует дольчатости, выраженной иногда у некоторых больных. Артерии в почке могут распределяться по магистральному и рассыпному типу. У одного индивидуума может наблюдаться тот и другой вид распределения артерий в почках.
Глава 7. Диагностика патологии
Почечная ангиография — метод весьма ценный в тех случаях, когда другими общепринятыми способами рентгенодиагностики нельзя определить характер заболевания.
При помощи аортографии удается весьма точно определить наличие добавочных почечных сосудов, их локализацию и распределение в почечной паренхиме. На ангиограммах возможно установить зону кровоснабжения отдельными сосудами, что важно при решении вопроса о геминефрэктомии или резекции почки при туберкулезе и камнях, а также при резекции добавочного сосуда по поводу гидронефроза. Так как аортография позволяет судить не только о почечной ангиоархитектонике, но одновременно и о функциональной способности почек, этот метод представляет гораздо больше возможностей, чем пневморетроперитонеум и
др., чтобы установить точный диагноз многих почечных заболеваний. Опыт урологической клиники II Московского медицинского института показывает, что этот метод позволяет поставить диагноз, когда на основании других способов сделать это невозможно.
У
 30,3% обследованных больных диагноз был установлен только благодаря ангиографии, а у 13,2% на основании данных почечной ангиографии предварительный диагноз был отвергнут.
30,3% обследованных больных диагноз был установлен только благодаря ангиографии, а у 13,2% на основании данных почечной ангиографии предварительный диагноз был отвергнут.Согласно данным Maluf и Cornelia (1955), диагностические ошибки при заболеваниях почек до применения аортографии составляли 17%, а при применении аортографии количество их снизилось до 6,4%. Согласно новейшим данным, этот процент снизился до 2,1—3 (Vogler к Herbst, 1958; Olsson, 1962; Beall et al., 1961). По нашим данным, общий процент диагностических ошибок при аортографии равен 2,8.
М
 ногие заболевания почек ангиографически характеризуются весьма специфическими признаками. Так, например, для гидронефроза характерно резкое сужение артерий и уменьшение их количества; изменения эти тем сильнее выражены, чем значительнее гидронефротическая трансформация. Опухоль (гипернефроидный рак) характеризуется грубым нарушением правильного распределения артерии в паренхиме почки, обрывом одной или нескольких ветвей магистральной почечной артерии, увеличением ее диаметра и беспорядочным скоплением контрастной жидкости в области опухоли в виде так называемых пятен-озер. Для более “молодых” новообразований почек характерна повышенная плотность тени на артериограммах соответственно локализации опухоли. При кисте почки имеет место как бы раздвигание ветвей почечной артерии с образованием бессосудистого участка. Аналогичная картина наблюдается и при поликистозных почках. Однако при них бессосудистых участков в почечной паренхиме имеется больше в зависимости от стадии патологического процесса. Соответствующие изменения ангиоархитектоники имеют место при почечных аномалиях, опухолях надпочечника и новообразованиях забрюшинного пространства. Аортография является методом, дающим самый низкий процент ошибок в диагностике опухолей почек и кист.
ногие заболевания почек ангиографически характеризуются весьма специфическими признаками. Так, например, для гидронефроза характерно резкое сужение артерий и уменьшение их количества; изменения эти тем сильнее выражены, чем значительнее гидронефротическая трансформация. Опухоль (гипернефроидный рак) характеризуется грубым нарушением правильного распределения артерии в паренхиме почки, обрывом одной или нескольких ветвей магистральной почечной артерии, увеличением ее диаметра и беспорядочным скоплением контрастной жидкости в области опухоли в виде так называемых пятен-озер. Для более “молодых” новообразований почек характерна повышенная плотность тени на артериограммах соответственно локализации опухоли. При кисте почки имеет место как бы раздвигание ветвей почечной артерии с образованием бессосудистого участка. Аналогичная картина наблюдается и при поликистозных почках. Однако при них бессосудистых участков в почечной паренхиме имеется больше в зависимости от стадии патологического процесса. Соответствующие изменения ангиоархитектоники имеют место при почечных аномалиях, опухолях надпочечника и новообразованиях забрюшинного пространства. Аортография является методом, дающим самый низкий процент ошибок в диагностике опухолей почек и кист.И
 зучение почечной ангиоархитектоники чрезвычайно важно не только для диагностики почечных заболеваний, но и для правильного выбора оперативного пособия органосохраняющего характера. Так, на основании данных ангиографии получают представление о положении и направлении почечной артерии, о степени отклонения или сдавления аорты, о состоянии почечной вены и т. д., что позволяет выбрать лучший доступ к почечной ножке, например, при операции по поводу опухоли почки. Исключительно велика ценность ангиографии в установлении вида и локализации стеноза почечной артерии, ее облитерации, аневризматического расширения сосудов и т. д., что предрешает выбор соответствующего оперативного пособия при нефрогенной гипертонии. Аортография фактически предопределила развитие пластических операций на почечных сосудах и аорте, и мы являемся свидетелями блестящих успехов в лечении больных гипертонией, обусловленной стенозом почечной артерии. Аортография в сочетании с пневморетроперитонеумом позволяет диагностировать забрюшинные опухоли, особенно при применении стереоскопических снимков в комбинации с томографией.
зучение почечной ангиоархитектоники чрезвычайно важно не только для диагностики почечных заболеваний, но и для правильного выбора оперативного пособия органосохраняющего характера. Так, на основании данных ангиографии получают представление о положении и направлении почечной артерии, о степени отклонения или сдавления аорты, о состоянии почечной вены и т. д., что позволяет выбрать лучший доступ к почечной ножке, например, при операции по поводу опухоли почки. Исключительно велика ценность ангиографии в установлении вида и локализации стеноза почечной артерии, ее облитерации, аневризматического расширения сосудов и т. д., что предрешает выбор соответствующего оперативного пособия при нефрогенной гипертонии. Аортография фактически предопределила развитие пластических операций на почечных сосудах и аорте, и мы являемся свидетелями блестящих успехов в лечении больных гипертонией, обусловленной стенозом почечной артерии. Аортография в сочетании с пневморетроперитонеумом позволяет диагностировать забрюшинные опухоли, особенно при применении стереоскопических снимков в комбинации с томографией.Аортография все чаще находит применение и у детей, в том числе у новорожденных. Чаще всего аортография детям производится при подозрении на аномалии почек и верхних мочевых путей, опухоли надпочечников. Техника исследования у них мало отличается от техники, применяемой у взрослых. Аортографию у детей предпочтительнее производить под наркозом. Walter и Goodwin (1953) рекомендуют комбинировать аортографию с пневморетроперитонеумом.
Абдоминальная аортография — весьма ценный метод диагностики и заслуживает того, чтобы он значительно шире применялся в практике урологических учреждений.
Внутривенная аортография. Этот вид аортографии заключается во введении полиэтиленового катетера в срединную локтевую вену и продвижении его на 8—10 см в направлении плеча. По катетеру быстро вводят 50 мл диатризоата натрия, меченного J131 (ренографин), затем 2 мл 76% стойкого раствора диатризоата натрия и 75 мл физиологического раствора. Время циркуляции контрастного вещества, содержащего меченый йод, от плечевой вены до брюшной аорты определяют при помощи сцинтилляционного скоростного счетчика. После этого с максимальной скоростью вводят по катетеру в вену контрастное вещество в количестве от 65 до 100 мл. Снимки брюшной полости производят через интервал, равный ранее определенному времени циркуляции контрастного вещества от плечевой вены до брюшной аорты (Bernstein, 1958; Steinberg, 1961). При помощи такой техники Greenspan et. al. (1959) произвели 158 абдоминальных аортографии. Более чем у 90% больных были получены достаточные для диагностики данные (при различных заболеваниях почек, аневризмах аорты, стенозе и облитерации аорты). Осложнения были отмечены у 2 больных в виде кратковременной тошноты, у 2 — головной боли и у 3 — флебита (в области плеча, где катетер находился длительное время).
Сложность техники внутривенной аортографии и необходимость введения больному весьма больших количеств контрастного вещества при ней не сделали этот вид исследования распространенным в урологии.
На сайт автора
В начало работы
Список использованных источников:
- Айвазян А. В., Войно-Ясенецкий А. М. Острые заболевания почек и мочевых путей.—М.: Наука, 1985.
- Аккерман Г. Л., Спирин В. А. Осложнения и ошибки при аортоартериографии.—В кн.: Вопросы ангиографии. М., 1977, с. 117—119.
- Джавад-Заде М. Д., Фигаров И. Г., Мамедов Т. Р. Осложнения при ангиографии в условиях урологической клиники. — В кн.: Вопросы ангиографии. М.,1977,147—149.
- Екимски Б. О состоянии почек, не выявляющихся при внутривенной урографии.—Вести. рентгенол., 1976, № 4, с. 28—35.
- Некрасов А. М„ Митряев Ю. И., Спирин В. А. Селективная ангиография почек при первичной опухоли почечной лоханки.—Вестн. рентгенол., 1974, № 5, с. 94—95.
- Лазорт Г., Гаузе А. и Джинджиан Ф. Васкуляризация и гемодинамика спинного мозга, пер. с франц., с. 222, М., 1977;
- Рабкин И.X., Матевосов А,Л. и Гетман Л.Н. Рентгено-эндоваскулярная хирургия, М., 1987;
- Руководство по ангиографии, под ред. И.X. Рабкина, М., 1977.
- Клиническая нефрология, под ред. Е.М. Тареева, т. 1, М., 1983;
- Клиническая онкоурология, под ред. Е.Б. Мариибаха, с. 5, М., 1975;
- Лопаткин Н.А. и Пугачев А.Г. Детская урология, М., 1986;
- Люлько А.В., Мурванидзе Д.Д. и Возианов А.Ф. Основы практической урологии детского возраста, Киев, 1984;
- Мухин Н.Д. и Тареева И.Е. Диагностика и лечение болезней почек, М, 1985, библиогр.;
- Пытель Ю.А. и Золотарев И.И. Неотложная урология, М., 1985:
- Пытель Ю.А. и Золотарев И.И.. Ошибки и осложнения при рентгенологическом исследовании почек и мочевых путей, М., 1987;
- Терещенко А.В. и Люлько А.В. Рентгеноурологическая диагностика в педиатрии, Киев, 1985;
- Трапезникова М.Ф. Опухоли почек, М., 1978, библиогр.;
- Устименко Е.М. Травма почек, М., 1981, библиогр.
Что ещё можно почитать…
