«Гликозидазы. Амилолитические, целлюлолитические, пектинолитические ферменты»
| Вид материала | Реферат |
- Ферменты и витамины, 14.69kb.
- Железы Железы внешней и внутренней секреции, 62.09kb.
- Вопросы к экзамену по курсу лекций «Ферменты», 26.87kb.
- Мимср методичка №48 Фармация. Бапд. Диетология Биоэлементы. Ферменты. Лекарственные, 21944.65kb.
- Тема: Ферменты, 182.4kb.
- Тема обмен белков. Вопросы лекции, 90.92kb.
- Особенности использования иммобилизованных ферментов в пищевой промышленности, 89.87kb.
- Факультет биотехнологии и биотехники кафедра промышленной биотехнологии Реферат, 1153.97kb.
- 1. Особенности состава молока и их влияние на технологические свойства, 7842.87kb.
- «Основы биохимии белков и аминокислот в организме человека», 123.74kb.
Федеральное агентство по образованию
Государственное учреждение высшего профессионального образования
Пермский государственный технический университет
Кафедра химии и биотехнологии
Пермское НПО «Биомед»
Реферат на тему:
«Гликозидазы. Амилолитические,
целлюлолитические, пектинолитические ферменты»
Выполнила:
студентка гр. ХТБ-05мЭ
Кошелева Д.А.
Проверил:
преподаватель Грязнова Д.В.
Пермь, 2010
Содержание
Введение…………………………………………………………………………...3
Гликозидазы……………………………………………………………………….4
Локализация и функции гликозидаз………………………………………….4
Классификация гликозидаз…………………………………………………....5
Номенклатура...………………………………………………………………...6
Применение гликозидаз……………………………………………………….7
Амилолитические ферменты (амилазы)…………………………………………7
Альфа-амилаза…………………………………………………………………8
Бета-амилаза…………………………………………………………………...8
Гамма-амилаза…………………………………………………………………9
Получение технических препаратов амилаз…………………………………9
Применение амилолитических ферментов…………………………………10
Целлюлолитические ферменты (целлюлазы)………………………………….11
Механизм действия целлюлаз…………………………………………….…12
Получение целлюлолитических ферментных препаратов………………..14
Области применения целлюлолитических ферментов…………………….14
Пектолитические ферменты (пектиназы)……………………………………...16
Деэтерифицирующие пектиназы……………………………………………16
Деполимеризующие пектиназы……………………………………………..17
Области применения пектолитических ферментов...……………………..17
Заключение……………………………………………………………………….19
Список литературы………………………………………………………………20
Введение
Конец ХХ и начало ХХI века называют эпохой биотехнологий, которые находят широкое применение в различных отраслях науки и техники. В настоящее время биотехнологии используют в медицине, пищевой промышленности, сельском хозяйстве, энергетике, фармацевтической, комбикормовой, текстильной промышленности и многих других.
Как известно, биотехнологии базируются на применении ферментов, которые представляют собой катализаторы белковой природы (биокатализаторы), обладающие способностью многократно ускорять химические реакции и отличающиеся избирательностью воздействия.
История применения ферментов уходит корнями в далекое прошлое. Некоторые ферменты, содержащиеся в природных растительных материалах, издавна использовались человеком для получения пива, спиртных напитков, хлеба и кисломолочных продуктов. Практика, основанная на коллективном опыте людей, намного опередила получение знаний и разработку научных основ для создания данных технологических процессов. Промышленная отрасль получения ферментных препаратов из природного растительного сырья стала зарождаться только в конце XIX столетия, а эра современной инженерной энзимологии насчитывает около 30 лет. Тем не менее, ферменты настолько прочно вошли в нашу жизнь и настолько широко применяются в различных промышленных отраслях, что представить без них наше существование сегодня не представляется возможным. Промышленное получение и применение ферментов в различных технологических процессах составляет сегодня один из важнейших разделов новейшей биотехнологии.
Успехи прикладной энзимологии позволили во второй половине XX века получить более 2000 ферментов в более или менее очищенном состоянии [1]. Среди них наибольшее практическое значение имеют около 50. Негидролитические ферменты, такие как оксидоредуктазы, лиазы, изомеразы и лигазы применяются сравнительно редко. Основную же часть ферментов, получаемых промышленным способом, составляют гидролазы. К ним относятся, в первую очередь, гликозидазы, протеиназы и липазы.
В настоящей работе представлена обзорная информация о гликозидазах и отдельных группах ферментов данного класса – амилазах, целлюлазах и пектиназах. Рассмотрены механизмы действия этих ферментов, микроорганизмы-продуценты этих ферментов, способы получения ферментных препаратов и возможные области их применения.
Гликозидазы
Локализация и функции гликозидаз
Гликозидазами (называемыми также гликозил-гидролазами) называются ферменты, относящиеся к классу гидролаз и катализирующие гидролиз гликозидных связей в молекулах углеводов, что приводит к появлению двух более мелких молекул углеводов. Кроме того, некоторые типы гликозид-гидролаз катализируют перенос остатка углевода от молекулы гликозида - олиго- или полисахарида на соединение, содержащее гидроксильную ОН-группу (реакции типа трансгликозилирования) [2-3]. На рис. 1 представлена компьютерная модель молекулы гликозидазы [2].
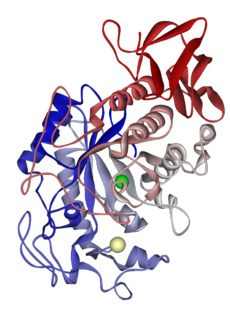
Рис. 1. Модель молекулы гликозидазы с пространственной структурой в виде (β/α)8-бочонка. Желтым цветом отмечен ион кальция, зеленым цветом – ион хлора.
Указанные ферменты встречаются практически повсеместно. Так, гликозидазы обнаружены в вирусах и фагах, различных микроорганизмах, грибах, растениях, в клетках и тканях животных. У бактерий и прокариот они присутствуют в виде внутриклеточных и внеклеточных ферментов, которые участвуют в потреблении питательных веществ. У бактерий одним из важных представителей гликозид-гидролаз является фермент β-галактозидаза (LacZ), который участвует в регуляции экспрессии лаг-оперона в клетках E.coli [2]. У высших организмов гликозидазы находятся внутри эндоплазматического ретикулума и аппарата Гольджи, где они участвуют в модификации N-связанных гликопротеинов, а также функционируют как лизосомы, выполняя деградацию углеводных структур. Гликозидазы встречаются также в желудочно-кишечном тракте, слюне, где они расщепляют различные углеводы - крахмал, лактозу, сахарозу, трегалозу и др. [2, 4].
Среди множества разнообразных функций, выполняемых гликозидазами, можно выделить ряд особенно важных, необходимых для жизнедеятельности клеток и всего организма в целом. В частности, гликозид-гидролазы:
- осуществляют расщепление (или деградацию) биомассы, например, комплексы специальных сахаролитических ферментов разрушают целлюлозу и гемицеллюлозы, входящие в состав растительных материалов;
- обеспечивают антибактериальную защиту организма, например, лизоцим, содержащийся в слизи, слюне, способен легко разрушать структуру пептидогликана – основного компонента клеточных стенок бактерий;
- участвуют в развитие патогенеза, например, вирусные нейраминидазы;
- играют важную роль в клеточном биосинтезе, например, маннозидазы вовлечены в созревание N-гликозилированных гликопротеинов;
- вместе с другими ферментами - гликозилтрансферазами образуют основу биологического аппарата синтеза и разрушения гликозидных связей.
Классификация гликозидаз
Гликозил-гидролазы объединены в «Каталоге ферментов» в группу (К.Ф.3.2.1) ферментов, катализирующих гидролиз О- или S-гликозидов. Все представители гликозидаз имеют свои определенные классификационные номера К.Ф.3.2.1.Х, где Х варьирует от 1 до 100 и более, что зависит от субстратной специфичности фермента [2].
На основе молекулярного механизма реакции, катализируемой гликозидазами, указанные ферменты могут быть разбиты на две группы. Представители одной из них путём двойного обращения обеспечивают одинаковую оптическую конфигурацию как субстрата, так и продукта реакции гидролиза, т.е. сохраняют конфигурацию аномерного атома углерода (например, лизоцим). Представители другой группы, напротив, обращают (или инвертируют) конфигурацию субстрата. Например, к данной группе относится β-глюкозидаза [4-5].
Гликозил-гидролазы также могут быть классифицированы как экзо- и эндогликозидазы в зависимости от того, действуют ли они на концевой или внутренний моносахаридный участок углеводной цепи, соответственно [4].
Современные классификации гликозил-гидролаз основаны на сравнении последовательностей аминокислот, входящих в состав ферментов. Важно подчеркнуть, что такие классификации обладают большой предсказательной силой, т.е. позволяют предвидеть, какую биохимическую активность будет проявлять еще не до конца изученный фермент, но у которого уже определёны аминокислотные последовательности. Впервые такая классификация была предложена более 15 лет назад и включала все гликозидазы с известными на тот момент аминокислотными последовательностями [6]. Близкородственные ферменты было предложено группировать в семейства. Впоследствии родственные семейства стали объединять на более высоком иерархическом уровне в роды. Недавние исследования показали возможность создания многоуровневой (иерархической) классификации на основе существующей двухуровневой [7].
Номенклатура гликозидаз
Большинство гликозидаз получили свои названия по рациональной номенклатуре, согласно которой название фермента составляется из названия основного субстрата и окончания –аза, такие как целлюлаза, хитиназа. Наряду с этим довольно часто используются и названия, которые даны ферменту по отщепляемому углеводному остатку, например, мальтаза, которая расщепляет крахмал с образованием мальтозы. Для ряда гликозил-гидролаз применяются также тривиальные названия, например, сахараза (согласно Официальной номенклатуре ферментов, это сахарозо-α-глюкозидаза) [8]. Ниже в качестве примера приведены названия некоторых гликозидаз с соответствующими им номерами в «Каталоге ферментов» [2]:
- α-амилаза (К.Ф.3.2.1.1);
- β-амилаза (К.Ф.3.2.1.2);
- глюкоамилаза (К.Ф.3.2.1.3);
- целлюлаза (К.Ф.3.2.1.4);
- лизоцим, или мурамидаза (К.Ф.3.2.1.17);
- кислая α-глюкозидаза, или мальтаза (К.Ф.3.2.1.20);
- β-галактозидаза, или лактаза (К.Ф.3.2.1.23);
- амило-α-1,6-глюкозидаза (К.Ф.3.2.1.33);
- глюкоцереброзидаза (К.Ф.3.2.1.45);
- гексоминидаза (К.Ф.3.2.1.52);
- ссылка скрыта (К.Ф.3.2.1.63);
- α-L-идуронидаза (К.Ф.3.2.1.76);
- 6-фосфо- β-глюкозидаза (К.Ф.3.2.1.86);
- Эндо-α-N-ацетилгалактозаминидаза (К.Ф.3.2.1.97);
- 2-дезоксиглюкозидаза (К.Ф.3.2.1.112).
Применение гликозидаз
Гликозидазы, или гликозид-гидролазы, широко используют в промышленном производстве при получении этилового спирта из сахаро- и крахмалосодержащего сырья (сахарного тростника, кукурузы и др). Так, сырье заливают водным раствором α-амилазы и нагревают, в результате чего получается сжиженный крахмал. Фермент глюкоамилаза превращает этот крахмал в сахар, служащий субстратом для ферментации, затем к нему добавляют дрожжи. После этого полученную смесь перегоняют, обезвоживают и получают чистый спирт. Если спирт предназначен для топливных целей (биоэтанол), то его денатурируют, делая непригодным для употребления в пищу [9]. При этом сегодня наибольший практический интерес вызывает возможность использования для этих целей отходов промышленности (древесных отходов), сельского хозяйства (кукурузной кочерыжки), содержащих целлюлозу и гемицеллюлозы. Эти компоненты могут быть переработаны в глюкозу и целый набор других сахаров –галактозу, маннозу, ксилозу, арабинозу с помощью ферментов целлюлазного комплекса и гемицеллюлаз, выделенных из исходных штаммов микроорганизмов или полученных с помощью методов генной инженерии.
Важную роль гликозидазы играют и в пищевой промышленности. Эти ферменты применяют при облагораживании продуктов питания. Например, пектиназы обязательно используют в производстве фруктовых соков, вин (например, сидра) – при этом происходит осветление этих напитков за счет ферментативного растворения мути, состоящей в основном из пектинов [10]. При растворении образуются сахароподобные вещества.
Кроме того, путем обработки молока ферментом β-галактозидазой получают «безлактозное» молоко (лактоза распадается на глюкозу и галактозу), предназначенное для людей, которые не переносят содержащуюся в молоке лактозу. Это свойство организма получило название лактазной недостаточности [10-11].
На молочных заводах в качестве отхода часто выступает молочная сыворотка, содержащая до 5% лактозы, которая сама по себе не имеет широкой сферы применения [10]. Обработка ее β-галактозидазой позволяет получить раствор глюкозы, на котором можно выращивать дрожжи, получать спирты и многие другие продукты.
Ввиду того, что гликозидазы способны оказывать антибактериальное действие на клетки, их зачастую используют в качестве бактерицидного средства при консервировании продуктов питания. Например, к таким ферментам относится лизоцим, который «убивает» грамположительную микрофлору, но не действует при этом на грамотрицательные бактерии [2].
Таким образом, сферы применения различных гликозидаз весьма обширны. Поэтому рассмотрим отдельные группы ферментов, относящихся к классу гликозидаз – амилолитические, целлюлолитические и пектолитические ферменты.
Амилолитические ферменты (амилазы)
Амилазы (от лат. amylum, что в переводе означает «крахмал») — ферменты класса гликозил-гидролаз, катализирующие гидролиз крахмала, гликогена и других родственных полисахаридов главным образом по α-(1→4)-гликозидной связи с образованием олиго- и моносахаридов [12]. Амилазы также называют ферментами пищеварения.
В истории амилаза стала первым открытым ферментом, когда французский химик Ансельм Пайя описал в 1833 году диастазу – фермент, расщепляющий крахмал с образованием мальтозы. Согласно другим данным, амилазу открыл в 1814 году российский химик, академик Петербургской Академии наук Константин Сигизмундович Кирхгоф [13].
Именно амилаза приводит к появлению сладковатого вкуса при длительном пережёвывании крахмалосодержащих продуктов (например, риса или картофеля), но без добавления сахара. Амилаза присутствует в слюне (птиалин), где начинает процесс пищеварения [13].
Существует три типа амилаз, которые в зависимости от субстратной специфичности классифицируют на  альфа-, бета- и гамма-амилазу. Рассмотрим каждый из упомянутых ферментов более подробно.
альфа-, бета- и гамма-амилазу. Рассмотрим каждый из упомянутых ферментов более подробно.
Альфа-амилаза
Фермент α-амилаза способен беспорядочно гидролизовать полисахаридную цепь крахмала и других длинноцепочечных углеводов по α-(1→4)-связям с образованием преимущественно α-мальтозы, т.е остатки мономеров при таком расщеплении имеют α–конфигурацию. Продуктами расщепления оказываются, помимо мальтозы, также олигомеры, содержащие от 3 до 7 остатков глюкозы. Так, амилоза крахмала под действием α-амилазы превращается в глюкозу и мальтозу. Амилопектин, содержащий в молекуле α-(1→6)-связи, полностью не гидролизуется, поэтому остается разветвленный полисахарид (с более низкой степенью разветвленности по сравнению с крахмалом), так называемый «остаточный декстрин» [11,12].
Все α-амилазы являются кальцийзависимыми ферментами. Полное удаление кальция приводит к инактивации фермента. Повторное введение кальция в среду может частично восстановить его активность.
α-Амилазы богаты тирозином и триптофаном, а также глутаминовой и аспарагиновой кислотами (25% от массы белка). Наличие этих кислот связывают с осахаривающей способностью, которую проявляют эти энзимы [11]. Серосодержащие аминокислоты входят в состав α-амилаз в сравнительно малых количествах, либо вообще отсутствуют. Кроме того, некоторые α-амилазы, выделенные из грибов, имеют углеводный фрагмент, в состав которого могут входить манноза, ксилоза.
α-Амилаза обладает слабокислыми свойствами, при этом оптимальный диапазон pH для проявления ее максимальной активности составляет 6,7-7,0, т.е для действия фермента наиболее благоприятна нейтральная среда [12-13].
Фермент α-амилаза присутствует во всех тканях животных и растений (например, в овсе), обнаружена также в грибах (в аскомицетах, базидиомицетах) и бактериях (Bacillus) [13]. Причем ферменты, выделенные из разных источников, значительно отличаются друг от друга по каталитической активности. α-Амилазы животных являются основными пищеварительными ферментами. Так, α-амилаза слюны, поджелудочной железы и слизистой кишечника участвуют в переваривании пищи, α-амилаза печени расщепляет гликоген [3].
Бета-амилаза
β-Амилаза в отличие от α-амилазы не воздействует на внутренние участки молекулы, а последовательно гидролизует полисахариды, начиная с невосстанавливающего конца цепи, по α-(1→4)-гликозидным связям, отщепляя остатки мальтозы в β-форме, но не расщепляет α-(1→6)-связи. Таким образом, под действием β-амилазы из амилозы крахмала образуется β-мальтоза, а из амилопектина также «остаточный декстрин», точнее, «β-концевой декстрин» [12-13].
β-Амилаза проявляет большую стабильность в отсутствие ионов Са2+. Фермент содержит сульфгидрильные SH-группы и чувствителен к действию тяжелых металлов [11].
Данный фермент встречается только у высших растений (ячменя, пшеницы и др.). При созревании фруктов β-амилаза расщепляет плодовый крахмал на сахара, что приводит к сладкому вкусу зрелых плодов. В семенах β-амилаза активна на стадии, предшествующей прорастанию, тогда как α-амилаза важна при непосредственном прорастании семени. β-Амилаза пшеницы является ключевым компонентом при образовании солода [13].
Гамма-амилаза
γ-Амилаза (глюкоамилаза) отщепляет остатки α-D-глюкозы от невосстанавливающего конца молекулы по α-(1→4)-гликозидным связям. Кроме того, фермент способен также расщеплять α-(1→6)-связи, если следующие за ней остатки моносахаридов соединены α-(1→4)-гликозидными связями [12-13]. γ-Амилаза неспецифична, гидролизует гликоген, крахмал и другие полисахариды.
Почти все γ-амилазы являются гликопротеидами, содержащими от 5 до 35% углеводов, которые состоят из олиго-, ди- и моносахаридов. Углеводный компонент может быть целостным фрагментом или разбитым на индивидуальные соединения, которые прикрепляются к белку через треонин и серин [11].
Для действия большинства известных γ-амилаз оптимальным диапазоном рН является 4,5-5,2, реже диапазон 5,7-6,0 (в основном для дрожжевых глюкоамилаз). Термостабильность γ-амилаз лежит в интервале 30-450С и редко повышается до 55-600С [11,13].
γ-Амилазы широко распространены в природе. Эти ферменты синтезируется многими микроорганизмами, в частности, плесневелыми грибами, и образуются в животных тканях, особенно в печени и почках [13].
Получение технических препаратов амилаз
Для получения промышленных препаратов амилазы используют грибы – Aspergillus oryzae, A. niger и A. wentii. Например, така-амилаза, или така-диастаза - коммерческий препарат, получаемый из культуры A. oryzae, который расщепляет крахмал до глюкозы [14].
Среди бактерий к активным продуцентам амилаз относятся некоторые бациллы (Bacillus macerans, В. polymyxa, В. subtilis), псевдомонады и различные виды стрептомицетов. Фермент, выделяемый из культуры В. stearothermophilus, не утрачивает своей активности даже при кратковременном нагревании до 1000С [15].
Комплексный амилолитический ферментный препарат получают путем выращивания плесневых грибов на твердой питательной среде с последующей сушкой и измельчением полученной массы. Более активный препарат фермента получают путем экстракции такого «грибного солода» с последующим выпариванием и сушкой. Еще более активные ферментные препараты можно выделить из культуральной жидкости путем осаждения амилазы ацетоном (иногда сульфатом аммония) и дальнейшим высушиванием коагулятом при температуре 270С. При этом культуральную жидкость предварительно выпаривают при температуре 400С до 40%-ного содержания сухих веществ. Коагулят сушат вместе с наполнителем [16].
Применение амилолитических ферментов
Амилазы нашли широкое применение в хлебопечении. Во время приготовления теста дрожжевые клетки, содержащие амилазы, разлагают крахмал до ди- и трисахаридов, которые потом используются в жизнедеятельности микроорганизмов. В результате образуются этиловый спирт, углекислый газ и другие метаболиты, которые придают хлебу специфический вкус и «поднимают» тесто. Однако это весьма длительный процесс, поэтому в современных производствах амилаза используется в качестве одного из важных составляющих специальной добавки, ускоряющей процесс брожения. Так, в пищевой промышленности зарегистрирована пищевая добавка E1100, способствующая улучшению качества муки и хлеба [13].
Помимо этого, амилолитические ферменты используются и в других отраслях хозяйственной деятельности человека (см. Таблицу) [11]:
Таблица
Области применения амилолитических препаратов
Производство | Применение |
Производство глюкозы и патоки | Крупномасштабное производство сахара путем полного или частичного гидролиза крахмала α-амилазой |
Пивоварение | Превращение размолотых зерен крахмала в мальтозу – субстрат, пригодный для дальнейшего брожения |
Производство фруктовых соков | Осветление путем гидролиза нерастворимых фракций крахмала |
Бумажная промышленность | Снижение вязкости раствора крахмала под действием α-амилазы, предшествующее нанесению раствора на целлюлозную основу |
Кондитерская промышленность | Производство кондитерских изделий необходимой консистенции |
Производство стиральных порошков, моющих средств | Удаление крахмала, присутствующего в белье и на поверхности загрязненной посуды, под действием бактериальных амилаз |
Целлюлолитические ферменты (целлюлазы)
Ни для кого не секрет, что целлюлоза является главной составной частью любого растительного материала, и синтез целлюлозы по своим масштабам превосходит синтез всех других природных соединений. Сохраняющиеся в почве и возвращающиеся в нее растительные остатки на 40-70% состоят из целлюлозы.
Целлюлоза состоит из цепочек D-глюкозы, соединенных β-(1→4)-гликозидными связями и собранных в плотную упаковку с кристаллической структурой. Цепи поперечно сшиты водородными связями, что обусловливает высокую механическая прочность и стабильность целлюлозных фибрилл. По данным рентгеноструктурного анализа, участки, имеющие кристаллическое строение, чередуются в целлюлозе с аморфными (некристаллическими) участками. Целлюлозные волокна представляют собой пучки фибрилл, одетые общей оболочкой, которая содержит воск и пектин.
В природе имеются так называемые целлюлолитические микроорганизмы, содержащие набор специфических ферментов – целлюлаз, способных расщеплять не только аморфную, но и кристаллическую целлюлозу до глюкозы. Попадая на поверхность целлюлозосодержащего материала и прикрепляясь к ней, микроорганизм выделает целлюлазы, под действием которых субстрат - целлюлоза в непосредственной близости от грибка-паразита расщепляется до конечного продукта – глюкозы. Микроорганизм поглощает глюкозу в качестве основного источника питания, растет, размножается, захватывая при этом все большие участки поверхности, «выбрасывает» новые и новые порции ферментов до тех пор, пока не иссякнет запас целлюлозы.
Однако подобные процессы протекают в природе довольно медленно. Например, чтобы пень в лесу полностью сгнил, понадобятся годы. Если из таких микроорганизмов выделить ферменты целлюлазы, сконцентрировать их и добавить к целлюлозе, процесс расщепления значительно ускорится. При этом образующаяся глюкоза не будет потребляться грибками, а станет накапливаться в реакционной смеси. Полученная глюкоза в зависимости от ее чистоты и экономической эффективности процесса применяется в медицине, пищевой промышленности, тонкой химической технологии, микробиологии. Кроме того, глюкозу можно сбраживать в этанол и затем его использовать как моторное топливо - альтернативу бензину, получаемому из традиционного нефтяного топлива.
Необходимо отметить, что при использовании в качестве субстрата не чистой целлюлозы, а целлюлозосодержащих отходов сельского хозяйства и промышленности позволит решить проблему утилизации отходов, образующихся в избыточном количестве.
Механизм действия целлюлаз
Ферментативная деструкция целлюлозы происходит обычно под действием не одного, а нескольких ферментов, собранных в настоящие полиферментные системы (комплексы), состоящие из экзо- и эндоферментов. Их совместное функционирование позволяет с максимальной эффективностью превращать целлюлозу в мономерные единицы, которые затем служат строительными блоками для создания новых химических веществ, необходимых для жизнедеятельности микроорганизмов.
Целлюлолитические ферменты, или целлюлазы относятся к классу О-гликозид-гидролаз, катализирующих гидролиз О-гликозидной связи, и являются одними из самых распространенных ферментов в природе – они встречаются в организмах животных, высших и низших растениях, бактериях, грибах. У некоторых микроорганизмов целлюлазы входят в состав целлюлосомы – белкового комплекса, находящегося на поверхности клеточной стенки [11, 17-18].
По месту атаки и способу воздействия целлюлолитические ферменты делятся на четыре группы. В первую группу входят эндоферменты, в частности, эндоглюканаза, которая одновременно гидролизует различные β-1,4-связи между соседними остатками глюкозы в неплотно упакованных областях целлюлозы, образуя разрывы в середине цепи. Это приводит к образованию больших фрагментов со свободными концами.
Вторую и третью группы составляют экзоферменты, такие как:
– экзоглюканаза, отщепляющая разорванные целлюлозные цепи с нередуцирующих концов с образованием глюкозы, целлобиозы (содержит два остатка глюкозы) и целлотриозы (содержит три остатка глюкозы);
– целлобиогидролаза, которая частично присутствует в целлюлолитических грибах и является разновидностью экзоглюканазы, отщепляющей фрагменты из 10 и более остатков глюкозы с нередуцирующих концов молекул целлюлозы.
И, наконец, четвертую группу образуют ферменты, расщепляющие небольшие фрагменты целлюлозы до глюкозы, например, β-глюкозидаза, или целлобиаза, которая катализирует превращение целлобиозы и целлотриозы в глюкозу [11, 17].
Первыми в процесс деградации целлюлозы вовлекаются эндоглюканазы, поскольку молекула природной целлюлозы состоит из нескольких тысяч мономерных глюкозных единиц и количество концевых глюкозных остатков для действия экзоферментов в исходном полимере мало. При этом каждая удавшаяся атака эндоглюканазы приводит к разрыву полимерной цепи и образованию двух новых концов в укороченной молекуле целлюлозы, которые в свою очередь могут атаковываться экзоферментами. Иначе говоря, роль экзоферментов и скорость их действия прогрессивно возрастают по мере деградации целлюлозы эндоферментами. Наконец, целлобиоза и целлотриоза расщепляются под действием последнего фермента комплекса - β-глюкозидазы с образованием двух и трех молекул глюкозы, соответственно.
Итак, для того, чтобы в реакционной смеси появился конечный продукт – глюкоза, реакция должна пройти через несколько этапов или стадий, включающих частичную деградацию исходного субстрата - целлюлозы. В целом, ферментативное расщепление целлюлозы до глюкозы может быть представлено в следующем виде (см. Рис. 2) [17]:
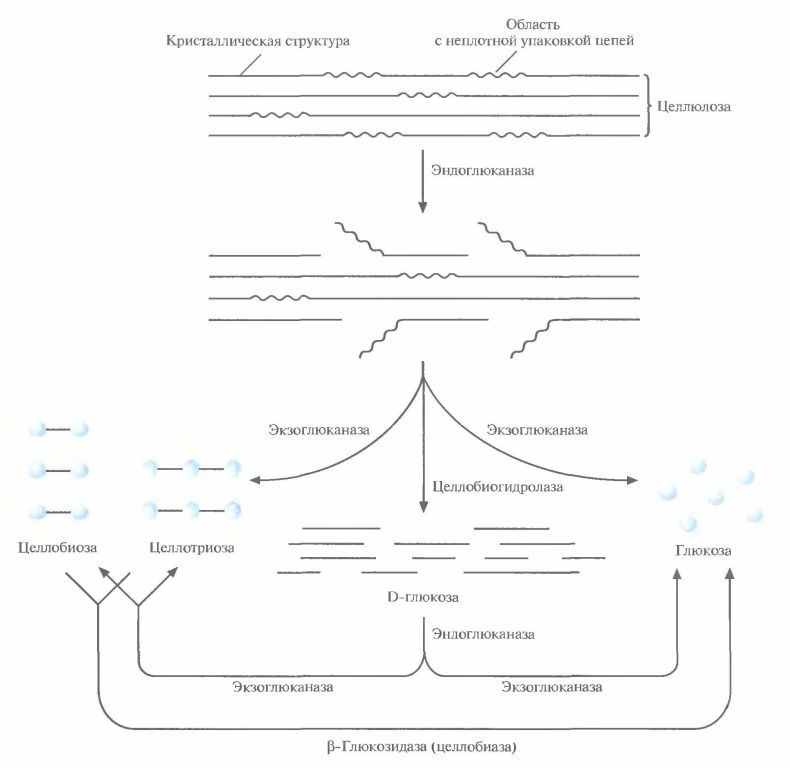
Рис.2. Схема ферментативного гидролиза целлюлозы
В условиях лабораторной культуры микроорганизмы обычно синтезируют эти ферменты лишь в том случае, если целлюлоза - единственный имеющийся субстрат. Их синтез подавляют как другие субстраты, так и продукт расщепления целлюлозы – целлобиоза [17, 19]. Это связано с существованием двух регуляторных механизмов, действующих по принципу обратной связи: накапливающаяся целлобиоза ингибирует гидролиз целлюлозы, а глюкоза препятствует гидролизу целлобиозы. Так, было показано, что 0,01 %-ный раствор целлюбиозы ингибирует активность целлюлазы на 75% [19].
Указанную проблему уже сегодня можно решить благодаря достижениям генной инженерии. В одной из серии экспериментов ученые выделили ген β-глюкозидазы из грибов Trichoderma reesei, клонировали в мультикопийной плазмиде и вновь ввели в T. reesei. В итоге, трансформированный штамм продуцировал β-глюкозидазу в 5,5-кратном избытке и расщеплял производное целлюлозы - авицел (Avicel) на 33 % быстрее, чем нетраснформированный штамм [17]. Таким образом, с помощью модификации активности соответствующих ферментов, их регуляции и синтеза благодаря мутагенезу, разнообразным методам селекции и манипуляциям с рекомбинантными ДНК становится возможным получать более стабильные и высокоэффективные ферментные препараты, с успехом применяющиеся в различных отраслях промышленности.
Получение целлюлолитических ферментных препаратов
Целлюлазы в России и за рубежом производят в промышленных и опытно-промышленных масштабах, используя в качестве продуцентов микроскопические грибы – Trichoderma viride, T. reesei, T. lignorum, T. koningii, Aspergillus niger, A. foetidus и другие [18].
Существующие в настоящее время способы получения целлюлаз методом глубинного культивирования предполагают выращивание микроорганизмов-продуцентов целлюлаз на питательной среде, содержащей в качестве источников углерода, как правило, очищенную целлюлозу или ее природные субстраты. Однако получение целлюлазы с использованием в качестве основного компонента среды природной целлюлозы (например, древесных опилок) сопряжено с рядом технологических трудностей. В связи с этим более рациональным является использование питательной среды, содержащей растворимый «индуктор». Такой питательной средой может быть молочная сыворотка, основным компонентом которой является лактоза (при этом от молочной сыворотки предварительно отделяют белок). В качестве продуцента может быть использован гриб Trichoderma lignorum, позволяющий получить весь комплекс целлюлолитических ферментов, необходимый для расщепления природных целлюлозосодержащих субстратов [16, 18].
Области применения целлюлолитических ферментов
Использование целлюлолитических ферментных препаратов (как и любых других) позволяет интенсифицировать ряд технологических процессов, повысить выход готовой продукции, повысить ее качество, рационально использовать отходы производства.
В России в течение ряда лет используют мультиферментные композиции для пивоваренной промышленности (на основе амилолитических, целлюлолитических, протеолитических препаратов бактериального и грибного происхождения). Наличие в таком комплексе эндоглюканазы способствует гидролизу некрахмальных полисахаридов ячменя, солода. Бактериальные препараты являются более термостабильными и содержат больше эндоглюканазы, однако обладают меньшей целлюлазной активностью, чем грибные препараты [18]. Преимущество технологии получения пива с применением подобных ферментных препаратов на стадии получения пивного сусла заключается в том, что она дает возможность производства высококачественного пива.
Ферменты (β-глюканаза, β-глюкозидаза и другие целлюлазы), гидролизующие некрахмальные полисахариды, играют значительную роль в получении спирта из крахмалистого сырья. Эти ферменты способны мацерировать растительные ткани, разрушая межклеточный материал, и, таким образом, значительно интенсифицировать процесс расщепления крахмала [18].
Не менее важной проблемой является стабилизация соков, получаемых из различного плодово-ягодного сырья. Для уменьшения склонности соков к образованию коллоидных помутнений используют ферментные композиции, содержащие пектиназы, целлюлазы и гемицеллюлазы, которые разрушают клеточные стенки и повышают выход сока. Кроме того, последние ферменты способствуют получению однородной консистенции соков с мякотью, чего нельзя добиться в случае использования пектолитических ферментов [18, 20].
Целлюлолитические ферменты совместно с пектиназами применяются и в виноделии, что значительно облегчает процесс переработки винограда, позволяет увеличить скорость образования сусла и повысить его выход из единицы сырья.
Внесение добавок в смесь амилолитических ферментов препаратов, обладающих целлюлазной активностью, позволяет повысить выход этанола из различных видов сырья (ячменя, овса, проса, зерна и других) [9, 18].
Применение кормовых дрожжей в животноводстве позволяет значительно увеличивать привесы сельскохозяйственных животных и снижать таким образом себестоимость мяса [18]. Обычно кормовые дрожжи выращиваются на грубом фильтрате зернокартофельной барды, а также других видах целлюлозосодержащего сырья (например, на гидролизатах древесины) [10].
Целлюлолитические ферментные препараты, осуществляющие расщепление некрахмальных полисахаридов, позволяют повысить выход кормового продукта более чем в два раза с сохранением концентрации кормового белка в дрожжах по сравнению с традиционной технологией и улучшить качество кормового продукта за счет содержания в нем продуктов частичного гидролиза целлюлозы [10, 18].
Для кормления сельскохозяйственных животных также используется силос, поскольку при силосовании кормов создаются оптимальные условия для некоторых микроорганизмов, например, молочнокислых бактерий, которые сбраживают сахара до молочной кислоты, повышая кислотность корма до рН = 4-4,2 и прекращая деятельность растительных ферментов, проявляющих активность при рН = 6-7 [18]. С помощью ферментных препаратов, содержащих целлюлолитические и пектинолитические комплексы, можно при силосовании бобовых культур частично гидролизовать клетчатку до сбраживаемых сахаров и тем самым обеспечить необходимое количество молочной кислоты в силосе. Это позволяет получать из клевера, люцерны, люпина и других культур силос хорошего качества.
Силосование соломы является единственным способом ее сохранения в северных районах России. При этом целлюлолитические ферментные препараты (например, Целловиридин ГЗх) расщепляют целлюлозу и другие сложные полисахариды соломы до простых сахаров. При этом уровень молочной кислоты в силосе из ячменной соломы увеличивается в 2 раза, из ржаной – в 4 раза [17-18].
В последнее десятилетие целлюлазы стали широко использоваться в текстильной промышленности для удаления ворсинок и микродефектов при биополировке хлопчатобумажных тканей, а также для частичного удаления индиго из джинсовой ткани (процесс ферментативной депигментации) с целью придания ей внешнего вида «вареных джинсов», где ферменты заменили использовавшиеся ранее пемзу и химические реагенты [21].
Пектолитические ферменты (пектиназы)
Пектиновые вещества, или пектины представляют собой полигалактурониды - неразветвленные цепи, состоящие из остатков D-галактуроновых кислот, соединенных α-(1→4)-гликозидными связями. Карбоксильные группы этих кислот полностью или частично этерифицированы метанолом. В нерастворимых пектинах цепи большей частью связаны между собой и образуют сплошную сеть [15]. Микроорганизмы расщепляют пектины с помощью специфических пектолитических ферментов, которые можно разделить на две группы: деэтерифицирующие и деполимеризующие пектиназы [22].
Деэтерифицирующие пектиназы
Это ферменты (называемые также пектинэстеразами), которые катализируют разрыв эфирных связей в пектинах, в результате чего высвобождаются метанол и полигалактоуроновые кислоты. Последние в свою очередь расщепляются специальными гидролазами до олигомеров и мономеров D-галактоуроновой кислоты [15, 22]. Необходимо отметить, что пектинэстеразы очень специфичны по отношению к сложным метиловым эфирам и обычно высвобождают метиловые группы одна за другой в определенной последовательности, начиная чаще всего с конца цепи [22].
Деполимеризующие пектиназы
Эти энзимы принадлежат к двум классам - гидролазам и трансэлиминазам. Гидролазы включают полиметилгалактуроназу, для которой основным субстратом является пектин, и полигалактуроназу, для которой субстратом является пектиновая кислота [22]. Деполимеризующие пектиназы вызывают разрыв α-(1→4)-гликозидных связей. Эти ферменты можно также классифицировать как эндо- и экзопектиназы, которые действуют беспорядочно внутри цепей и последовательно отщепляют остатки с конца цепей, соответственно. Ферменты первой группы оказывают более эффективное деполимеризующее действие, чем ферменты второй группы. Так, в случае применения эндопектиназ вязкость уменьшается вдвое, при этом разрывается только от 2 до 3% гликозидных связей. Использование экзопектиназ вызывает такое же снижение вязкости только после разрыва 40% (и более) гликозидных связей [22].
Трансэлиминазы включают пектинтрансэлиминазы, субстратом для которых является преимущественно пектин, и трансэлиминазпектиновую кислоту, субстратом для которой является пектиновая кислота. Они ускоряют негидролитическое расщепление пектиновых веществ с образованием двойных связей, т. е. разрыв между полуацетальным атомом кислорода и атомом углерода в четвертом положении сопровождается удалением атома водорода, связанного с атомом углерода в пятом положении. В результате этого образуется двойная связь между этими атомами углерода [22-23]. Эти ферменты, часто встречающиеся в микроорганизмах, очень редко обнаруживают в растениях.
Области применения пектолитических ферментов
Пектиназы продуцируют микромицеты Aspergillus niger, бактерии Erwinia carotovora, Clostridium sp. и др. [15]. Пектолитические ферменты, используемые для различных технических целей, получают в основном из грибов, выращиваемых на средах с пектинами.
Пектолитические ферменты наиболее широко применяются в пищевой (в производстве фруктовых соков, виноделии) и текстильной промышленности.
После первичной переработки фруктов и овощей получаются очень вязкие соки, что вполне приемлемо для соков из томатов или цитрусов, но часто нежелательно для яблочного и других соков. Так, в 1 литре виноградного сока содержится 0,2 - 4,0 г пектина, в яблочном и томатном соках содержание пектина еще больше [25]. Путем контролируемого гидролиза пектинов удается получить продукт с необходимой текучестью, но в то же время достаточно вязкий для того, чтобы не происходило осаждение нерастворимых веществ. После такой обработки соков концентрация пектина снижается до 50 мг/л [24-25]. В производстве яблочного сока применяют более глубокий гидролиз пектинов, благодаря чему облегчается последующее фильтрование, обеспечивающее необходимую прозрачность сока.
При изготовлении сиропов обязательным условием является освобождение сока от пектина, что достигается путем упаривания раствора. Применение пектиназ позволяет высвободить сок, содержащийся в клеточных структурах, и избежать желеобразования из-за высокого содержания пектина [20].
Напротив, если соки используются в производстве желеобразных продуктов, то их обрабатывают только пектинэстеразой. Образующиеся при этом полигалактоуроновые кислоты затем «желатинизируют» ионами кальция [20, 24].
Другой важной областью применения пектолитических ферментов является виноделие. Добавление смеси пектиназ к раздавленному винограду приводит к повышению выхода сока, более эффективному экстрагированию красящих веществ из кожуры, а также ускоряет процессы фильтрования и отжимки [24]. Обработка уже перебродившего виноградного сока тоже имеет положительный эффект, связанный с ускорением процесса отделения вина от дрожжей и осадка, повышением его прозрачности и стабильности.
Кроме того, пектиназы применяются в текстильной промышленности для вымачивания льна и конопли перед переработкой. Цель этого процесса заключается в отделении пучков целлюлозных волокон от остальных волокон растительных тканей. В аэробной росяной мочке участвуют грибы, а в анаэробной - главным образом бактерии, среди которых наибольшее практическое значение имеют Clostridium pectinovorum и Clostridium felsineum [15]. В Японии для расщепления стеблей растений (рами) на волокна используют пектиназы, выделенные из Aspergillus niger [14].
Заключение
Как известно, ферменты занимают ключевое место в развитии современной биомолекулярной химии и технологии. Большое разнообразие реакций, катализируемых энзимами, доступность их как химических объектов, и, что очень важно, возможность изменения свойств ферментов позволяют использовать ферменты в различных сферах человеческой деятельности. В результате проведенного анализа литературы показаны и охарактеризованы ферменты класса гликозидаз, имеющие наибольший практический интерес.
В частности, описаны особенности амилолитических, целлюлолитических, пектолитических ферментов, их свойства, принципы действия, тип катализируемой реакции, местонахождение в природе. Эти ферменты позволяют эффективно перерабатывать сахаро- и крахмалосодержащее сырье и получать широкий спектр продукции.
Показано, что амилолитические, целлюлолитические и пектолитические ферменты широко применяются в различных отраслях промышленности – пищевой (получение глюкозы, кондитерских изделий, пива и спирта), текстильной, целлюлозно-бумажной промышленности, сельском хозяйстве и др. Так, осветление фруктовых соков, виноделие не обходится без использования целлюлаз в комплексе с пектиназами. Амилолитические и целлюлолитические ферментные препараты применяются в пивоварении и позволяют получать высококачественное пиво. Кроме того, эти же ферменты сегодня используют при переработке растительных материалов (культур и отходов) для получения моторного топлива (биоэтанола). Помимо этого, целлюлолитические ферменты применяются в сельском хозяйстве для получения высококачественных кормовых добавок и при силосовании соломы. Амилолитические препараты являются необходимым компонентом пищевых добавок, применяемых в хлебопечении. Кроме того, области действия ферментов расширяются с каждым годом (биополировка тканей с помощью целлюлаз, производство стиральных порошков и моющих средств, содержащих бактериальные амилазы).
Наряду с этим освещены вопросы получения высокоэффективных и стабильных ферментных препаратов из различных микроорганизмов-продуцентов (грибов и бактерий).
Таким образом, в работе показаны наиболее практически значимые ферменты – гликозидазы и отдельные их группы, дана характеристика этих ферментов, описаны механизмы их действия и области промышленного применения.
Список литературы
1. Комов В.П. Биохимия/ Комов В.П., Шведова В.Н. – М.: Дрофа. – 2004. – 638 с.;
2. Гликозил-гидролазы. [Электронный ресурс]. – URL: dia.org/wiki/Гликозил-гидролазы (дата обращения: 10.04.10);
3. Гликоген. [Электронный ресурс]. – URL: .ru/encyklopedia/1083.php (дата обращения: 10.04.10);
4. Glycoside hydrolase [Электронный ресурс]. – URL: dia.org/wiki/Glycoside_hydrolase (дата обращения: 17.04.10);
5. Sinnott M. L. Catalytic mechanism of enzymic glycosyl transfer//Chem. Rev. – 1990. – Vol. 90 (7). – P. 1171–1202;
6. Henrissat B. Bairoch A. Updating the sequence-based classification of glycosyl hydrolases// Biochem. J. – 1996. Vol. 316. – P. 695-696;
7. Naumoff D.G. Proceedings of the Fifth International Conference on Bioinformatics of Genome Regulation and Structure. Novosibirsk. – 2006. Vol. 1. – P. 294-298;
8. Кольман Я., Рем К.-Г. Наглядная биохимия. Пер. с нем. – М.: Мир. – 2000. – 469 с.;
9. Биоэтанол. [Электронный ресурс]. – URL: dia.org/wiki/Биоэтанол (дата обращения: 10.04.10);
10. Бирюков В.В. Основы промышленной биотехнологии. – М.: КолосС. – 2004. – 296 с.;
11. Биотехнология. В 8 кн./Под рек. Н.С. Егорова, В.Д. Самуилова. Кн. 8: Инженерная энзимология. Березин А.В., Клесов А.А. [и др.]. М.: Высшая школа. – 1987. – 143 с.;
12. Амилазы. [Электронный ресурс]. – URL: .ru/encyklopedia/199.html (дата обращения: 10.04.10);
13. Амилаза. [Электронный ресурс]. – URL: dia.org/wiki/Амилаза (дата обращения: 10.04.10);
14. Род Аспергилл (Aspergillus). [Электронный ресурс]. – URL: mic.ru/dic.nsf/enc_biology/1845/Род (дата обращения: 10.04.10);
15. Шлегель Г. Общая микробиология. Пер. с нем. – М.: Мир. – 1987. – 567 с.;
16. Технические препараты ферментов. [Электронный ресурс]. – URL: ferats.ru/referats/10/231/1.php (дата обращения: 17.04.10);
17. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применения. Пер. с англ. – М.: Мир. – 2002. – 589с.;
18. Синицын А.П., Гусаков А.В., Черноглазов В.М. Биоконверсия лигноцеллюлозных материалов. – М.: Изд-во МГУ. – 1995. – 224с.;
19. Биотехнология. Принципы и применение. Пер. с англ./Под ред. И. Хиггинса, Д. Беста, Дж. Джонса. – М.: Мир. – 1988. – 480 с.;
20. Просеков А.Ю. Научные основы производства продуктов питания. Кемерово: Кемеровский технологический институт пищевой промышленности. – 2005. – 234 с.;
21. Гусаков А.В., Синицын А.П. О механизме действия ферментов-целлюлаз на текстильные материалы: взгляд энзимологов// Текстильная химия [Электронный ресурс]. – URL: leclub.ru/index.php?option=articles&task=viewarticle&artid=35&Itemid=3 (дата обращения: 24.04.10);
22. Классификация пектолитических ферментов - Превращения в винограде. [Электронный ресурс]. – URL: info/knigi/teoriya-i-praktika-vinodeliya/prevrascheniya-v-vinograde-12.php (дата обращения: 24.04.10);
23. Технология ферментных препаратов. [Электронный ресурс]. – URL: chnolog.ru/prombt/prombt8_1.htm (дата обращения: 10.04.10 );
24. Бейли Дж., Оллис Д. Основы биохимической инженерии. Пер. с англ. в 2-х частях. Ч. 1. – М.: Мир. – 1989. – 692 с.;
25. Мосин О.В. Использование биотехнологии в пищевой и перерабатывающей промышленности. [Электронный ресурс]. – URL: ib.ru/o/oleg_w_m/ (дата обращения: 10.04.10).
