Четыре типа взаимодействий в природе. Сравнение их свойств и количественные соотношения между ними
| Вид материала | Документы |
| Спектры излучения. Сплошной и линейчатый спектр. Особенности спектров. Непрерывные (или сплошные) спектры Эволюция представлений о строении атома. Опыт Резерфорда. Планетарная модель. Ее недостатки. |
- Электромагнитные взаимодействия в природе, 147.06kb.
- Многообразие структур урока развивающего типа обучения, 595.49kb.
- Идеализм Готфрида Лейбница Бенедикт Спиноза монизм Томас Гоббс Психофизическая проблема, 489.7kb.
- Тема Общая характеристика сравнительного правоведения, 176.6kb.
- Учреждение осуществляет в соответствии с заданиями Учредителя деятельность, связанную, 128.43kb.
- Тонкие миры Альберта-Виктора Вейника, 682.64kb.
- Лекция 12. Индивидуальный и рыночный спрос, 48.69kb.
- 1. Понятие конфликт в социологической теории, 180.02kb.
- Объединение локальных вычислительных сетей. Внешние средства передачи данных, 90.7kb.
- 32. Эволюция понятия элементарная частица. Неизменность свойств ядер, атомов, молекул, 827.07kb.
1 2
Гюйгенса. Большая заслуга в развитии волновой теорий принадлежит английскому физику Т. Юнгу и французскому физику О. Френелю, исследовавшим явления интерференции и дифракции. Исчерпывающее объяснение этих явлений могло быть дано только на основе волновой теории. Важное экспериментальное подтверждение справедливости волновой теории было получено в 1851 году, когда Ж. Фуко (и независимо от него А. Физо) измерил скорость распространения света в воде и получил значение υ < c.Хотя к середине XIX века волновая теория была общепризнана, вопрос о природе световых волн оставался нерешенным.
В 60-е годы XIX века Максвеллом были установлены общие законы электромагнитного поля, которые привели его к заключению, что свет – это электромагнитные волны. Важным подтверждением такой точки зрения послужило совпадение скорости света в вакууме с электродинамической постоянной:
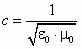 .
.Электромагнитная природа света получила признание после опытов Г. Герца (1887–1888 гг.) по исследованию электромагнитных волн. В начале XX века после опытов П. Н. Лебедева по измерению светового давления (1901 г.) электромагнитная теория света превратилась в твердо установленный факт.
В конце XIX столетия казалось, что ответ на вопрос о природе света найден и доказан экспериментально ― свет есть распространяющиеся в пространстве электромагнитные волны. Волновая теория света, исходя из такого представления о природе света, на основе общих свойств волновых процессов объяснила такие оптические явления как интерференция света, дифракция света, поляризация света и др.
Однако, уже в начале XX века при исследовании взаимодействия света с веществом были обнаружены такие оптические явления как фотоэффект, эффект Комптона, фотохимические реакции и др. При объяснении этих явлений представления о том, что свет есть распространяющиеся в пространстве электромагнитные волны, оказались несостоятельными. Предсказания волновой теории света пришли в противоречие с наблюдаемыми в экспериментах закономерностями явлений квантовой оптики. Объясняя эти явления, в 1905 г. Эйнштейн выдвинул корпускулярную теорию света, которая, развивая идеи Ньютона о световых корпускулах, рассматривала свет как поток большого числа частиц, названных фотонами. Фотонная теория света легко объяснила все качественные и количественные закономерности явлений квантовой оптики.
Итак, на первый взгляд, казалось, что теперь, объединив электромагнитные волны и фотоны в одном объекте, мы и ответим на вопрос о природе света. Свет есть волны и частицы. Однако, критическое изучение такого ответа показало несостоятельность простого механического объединения волн и частиц. Оказалось, что представления об электромагнитной волне и представления о потоке частиц исключают друг друга.
Световая волна представляет собой нелокализованное электромагнитное поле, распределенное по пространству. Объемная плотность энергии электромагнитного поля волны, пропорциональная квадрату ее амплитуды, может изменяться на сколь угодно малую величину, то есть непрерывно.
В отличие от волны, фотон, как световая частица, в данный момент времени локализован вблизи некоторой точки пространства и со временем перемещается в пространстве. Световая энергия в такой модели изменяется не непрерывно, а только дискретно, оставаясь всегда кратной минимальной порции (кванту) энергии, которую несет одиночный фотон.
Как же непротиворечивым образом в одном материальном объекте объединить противоположности, казалось бы, исключающие друг друга? Ответ на этот вопрос содержался еще в работах крупнейших философов, которые пришли к выводу о том, что материальные объекты природы могут обладать внутренними противоречиями, объединяя в себе противоположные качества. Так, например, идея о единстве и борьбе противоположностей составляет основу диалектики Гегеля.
Именно так, диалектически, современная физика отвечает на вопрос о природе света. Свет есть материальный объект, обладающий как волновыми, так и корпускулярными свойствами. В различных физических процессах эти свойства могут проявляться в различной степени. При определенных условиях, то есть в ряде оптических явлений свет проявляет своиволновые свойства. В этих случаях мы должны рассматривать свет как электромагнитные волны. В других оптических явлениях свет проявляет свои корпускулярные свойства, и тогда его следует представлять как поток фотонов.
Спектры излучения. Сплошной и линейчатый спектр. Особенности спектров.
Спектром излучения называется распределение значений мощности излучения по возможным значениям частоты или длины волны. Графическое представление такого распределения называется спектральной диаграммой. Обычно под спектром подразумевается электромагнитный спектр — спектр частот (или, что то же самое, энергий квантов) электромагнитного излучения.
В научный обиход термин «спектр» ввел Ньютон в 1671—1672 годах для обозначения многоцветной полосы, похожей на радугу, которая получается при прохождении солнечного луча через треугольную стеклянную призму.
Спектральный состав излучения веществ весьма разнообразен. Но, несмотря на это, все спектры, как показывает опыт, можно разделить на три типа.
С
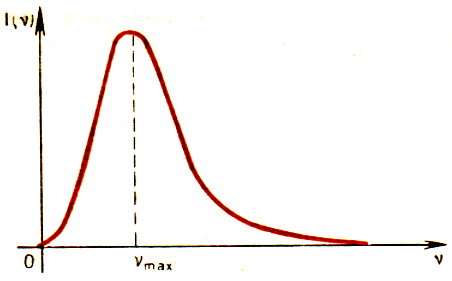 олнечный спектр или спектр дугового фонаря является непрерывным. Это означает, что в спектре представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу.
олнечный спектр или спектр дугового фонаря является непрерывным. Это означает, что в спектре представлены волны всех длин. В спектре нет разрывов, и на экране спектрографа можно видеть сплошную разноцветную полосу. Распределение энергии по частотам, т. е. спектральная плотность интенсивности излучения, для различных тел различно. Например, тело с очень черной поверхностью излучает электромагнитные волны всех частот, но кривая зависимости спектральной плотности интенсивности излучения от частоты имеет максимум при определенной частоте max (так называемый закон смещения Вина). Энергия излучения, приходящаяся на очень малые (0) и очень большие () частоты, ничтожно мала. При повышении температуры максимум спектральной плотности излучения смещается в сторону коротких волн.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
С
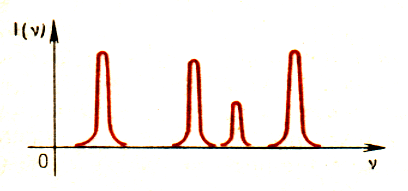 ветящиеся атомарные газы и пары излучают свет, при разложении которого получается спектр, состоящий из отдельных линий. Такие спектры называются линейчатыми. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров. Изолированные атомы излучают строго определенные длины волн.
ветящиеся атомарные газы и пары излучают свет, при разложении которого получается спектр, состоящий из отдельных линий. Такие спектры называются линейчатыми. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров. Изолированные атомы излучают строго определенные длины волн.Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются, и, наконец, при очень большом сжатии газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Полосатый спектр состоит из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом.
Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда.
Эволюция представлений о строении атома. Опыт Резерфорда. Планетарная модель. Ее недостатки.
Открытие сложного строения атома ― важнейший этап становления современной физики. В процессе создания количественной теории строения атома, позволившей объяснить атомные системы, были сформированы новые представления о свойствах микрочастиц, которые описываются квантовой механикой.
Представление об атомах как неделимых мельчайших частицах веществ возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743-1794), великого русского ученого М. В. Ломоносова и английского химика и физика Д. Дальтона (1766-1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. было экспериментально доказано, что электрон является одной из основных частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.
Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе Менделеева, наталкивает на мысль о том, что в основе строения всех атомов лежит общее свойство ― все они находятся в близком родстве друг с другом.
Однако до конца XIX в. в химии господствовало метафизическое убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Различные предположения о строении атома долгое время не подтверждались какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при определенных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома. Первые косвенные подтверждения о сложной структуре атомов были получены при изучении катодных лучей, возникающих при электрическом разряде в сильно разреженных газах.
Изучение свойств этих лучей привело к заключению, что они представляют собой ноток мельчайших частиц, несущих отрицательный электрический заряд и летящих со скоростью, близкой к скорости света. Особыми приемами удалось определить массу катодных частиц и величину их заряда, выяснить, что они не зависят ни от природы газа, остающегося в трубке, ни от вещества, из которого сделаны электроды, ни от прочих условий опыта. Кроме того, катодные частицы известны только в заряженном состоянии и не могут быть лишены своих зарядов, не могут быть превращены в электронейтральные частицы: электрический заряд составляет сущность их природы. Эти частицы, получившие название электронов, были открыты в 1897 г. английским физиком Дж. Томсоном.
Изучение строения атома практически началось в 1897-1898 гг., после того как была окончательно установлена природа катодных лучей как потока электронов и были определены величина заряда и масса электрона. Томсон предложил первую модель атома, по который атом ― сгусток материи, обладающий положительным электрическим зарядом, в который вкраплено столько электронов, что в целом атом ― электрически нейтральное образование. В этой модели предполагалось, что под влиянием внешних воздействий электроны могли совершать колебания, т. е. двигаться ускоренно. Казалось бы, это позволяло ответить на вопросы об излучении света атомами вещества и гамма-лучей атомами радиоактивных веществ.
Положительно заряженных частиц внутри атома модель атома Томсона не предполагала. Но как же тогда объяснить испускание положительно заряженных альфа-частиц радиоактивными веществами? Модель атома Томсона не давала ответа и на некоторые другие вопросы.
Положительно заряженная часть атома была открыта в 1911 г. английским физиком Э. Резерфордом при исследовании движения альфа-частиц в газах и других веществах.
Исходя из этих соображений, Резерфорд предложил следующую схему строения атома.
В центре атома находится положительно заряженное ядро вокруг которого по разным орбитам вращаются электроны. Возникающая при их вращении центробежная сила уравновешивается притяжением между ядром и электронами, вследствие чего они остаются на определенных расстояниях от ядра. Так как масса электрона ничтожна мала, то почти вся масса атома сосредоточена в его ядре. На долю ядра и электронов, число которых сравнительно невелико, приходится, лишь ничтожная часть всего пространства, занятого атомной системой.
Предложенная Резерфордом схема строения атома или, как обыкновенно говорят, планетарная модель атома, легко объясняет явления отклонения альфа-частиц. Действительно, размеры ядра и электронов чрезвычайно малы по сравнению с размерами всего атома, которые определяются орбитами наиболее удаленных от ядра электронов; поэтому большинство альфа-частиц пролетает через атомы без заметного отклонения. Только в тех случаях, когда альфа-частица очень близко подходит к ядру, электрическое отталкивание вызывает резкое отклонение ее от первоначального пути. Таким образом, изучение рассеяния альфа-частиц положило начало ядерной теории атома.
Термин «ядро» введен в 1912 г. Сделав это открытие, Резерфорд сразу же выдвинулся в число основоположников атомной и ядерной физики. За исследования в области радиоактивности и установление ее основных закономерностей Э. Резерфорду совместно с Ф. Содди в 1908 г. была присуждена Нобелевская премия по химии.
Однако модель атома Резерфорда страдала серьезным недостатком. В ней не решался вопрос, как размещаются электроны в околоядерном пространстве. Вращающиеся по плоским орбитам вокруг ядра электроны должны излучать энергию, постепенно падая на ядро. Атом Резерфорда неустойчив, что в действительности не так. Причина этого противоречия заключалась в том, что модель атома Резерфорда основывалась на представлениях классической физики (механики Ньютона), которая справедлива в макромире, но не может быть автоматически перенесена на микромир, так как не учитывает его особенностей.
