Тема: Хлороводород. Соляная кислота
| Вид материала | Урок |
- Тема урока: «соли аммония», 22.5kb.
- Реферат на тему: Азот, азотна кислота, 51.18kb.
- Витамины (от лат vita жизнь), низкомолекулярные органические соединения различной химической, 518.58kb.
- Реферат на тему: Азотная кислота Содержание, 87.78kb.
- Исполнительная дирекция программы «Соликамск соляная столица России». Управление культуры, 82.27kb.
- Курсовая работа " Азотная кислота", 38.26kb.
- Курсовая работа " Азотная кислота", 44.11kb.
- Чиста нитратна кислота hno -безбарвна рідина густиною 1,51 р/см при 42 °С застигаюча, 68.44kb.
- Ћсновные источники в природе, 3148.94kb.
- Трансфер Фактор и Диабет, 47.88kb.
Брянский городской лицей №1 имени А.С.Пушкина
Открытый урок по химии в 9 химико-биологическом классе
Тема: Хлороводород. Соляная кислота.
Учитель - Рулинская Марина Григорьевна
Цель: Изучить получение и свойства хлороводорода и соляной кислоты.
Задачи:
Образовательные:
- Обеспечить усвоение знаний о физических и химических свойствах хлороводорода.
- Обобщить и систематизировать знания о химических свойствах кислот на примере соляной кислоты.
- Продолжить формирование умений работать с таблицами, схемами.
- Продолжить формирование умений решать познавательные задачи.
Развивающая:
- Развивать умение применять знания на практике
- Развивать умение анализировать, сравнивать, обобщать, выделять главное
- Развивать приемов наблюдения
Воспитательная:
- Воспитание мотивов учения, положительного отношения к знаниям
Реактивы и оборудование:
(На демонстрационном столе учителя) - кристаллический хлорид алюминия, растворы лакмуса или метилоранжа, нитрата серебра; демонстрационный прибор для получения хлороводорода, демонстрационные пробирки, горелка или спиртовка, круглодонная колба на 200 мл со вставленной в нее с помощью резиновой пробки длинной стеклянной трубкой (для демонстрации хлороводородного фонтана), химический стакан.
На столах для индивидуальной работы учащихся – карточки-задания «Экспериментальные задачи»
Стол 1
раствор соляной кислоты, металлический цинк, медная проволока, пробирка с газоотводной трубкой, чистая пробирка, кристаллизатор, спички.
Стол 2
раствор соляной кислоты, оксид меди (2),спиртовка. держатель, спички
Стол 3
Пронумерованные пробирки с растворами бромида натрия. иодида натрия, хлорида натрия и соляной кислоты, раствор нитрата серебра, раствор лакмуса.
Стол 4
раствор соляной кислоты, раствор гидроксида натрия, раствор сульфата меди (2), лакмус, фенолфталеин, пробирки, держатель.
| Методы, приемы, средства. | Структура и содержание урока |
| Вводное слово учителя Индивидуальный опрос у доски: а) теоретический вопрос б) задача в) уравнения окислительно-восстановительных реакций г) фронтально Итог 1 этапа урока –опрошены 4 ученика, повторены разделы, помогающие восприятию нового материала. Разъяснительный рассказ с элементами беседы Химическая формула и строение молекулы Получение. работа с учебником (стр.143, рис.35 из учебника В.В.Еремин и др. «Химия 9») Проблемная беседа Разъяснительный рассказ с элементами беседы Физические свойства Создание проблемной ситуации Проблемный эксперимент по получению хлороводорода при нагревании кристаллического хлорида алюминия Проблемно-поисковый метод Учащиеся высказывают предположения, описывают свои наблюдения, делают выводы, записывают уравнение гидролиза кристаллогидрата хлорида алюминия при нагревании, описывают физические свойства полученного хлороводорода и приводят уравнения реакций, доказывающие качественный состав полученного вещества Урок 2 «Соляная кислота» Вводное слово учителя Групповая практическая работа по решению экспериментальных задач работа Лабораторные опыты для групп учащихся по карточкам-заданиям (см. приложение 2) Беседа с учащимися по анализу результатов опыта. Отчет о решении экспериментальной задачи выполняют представители группы по выбору учащихся на доске (формируются навыки работы в группе, формируется умение работать в должном темпе). Представители других групп задают вопросы, дополняют и уточняют детали. Работа с учебником (стр. 146, рис. 37) Фронтальная беседа по схеме « Применение хлороводорода и соляной кислоты» Сообщение учащегося «Каменная соль» Рефлексия Фронтальный опрос-закрепление «Что мы узнали нового о хлороводороде и соляной кислоте на сегодняшнем уроке?» Тест по теме «Соляная кислота. Хлороводород» Комментарий домашнего задания | Сегодня на уроке мы продолжаем изучение галогенов и их соединений. Тема урока – «Хлороводород и соляная кислота». Многие считают эти слова синонимами, однако это совсем разные понятия, с ними мы познакомимся поближе на уроке, но начнем с проверки домашнего задания 1 этап Актуализация знаний I. Проверка ЗУН по домашнему заданию а) Химические свойства хлора б) 300 л хлороводорода растворили в 1л воды при 25 оС и давлении 98 кПа. Какова массовая доля вещества в полученном растворе в) Записать уравнения реакций между веществами, расставить коэффициенты: перманганат калия и соляная кислота; хлор и холодный раствор щелочи; бертолетова соль и соляная кислота. - общая характеристика подгруппы галогенов - общее в строении атомов галогенов - как получают хлор в лаборатории - применение хлора - физические свойства хлора 2 этап. Изучение нового материала Из всех галогеноводородов особенно большое значение имеют хлороводород и его раствор в воде — соляная кислота. Химическая формула хлороводорода НС1, электронная формула Н :С1:. Химическая связь в молекуле ковалентная, сильнополярная. В промышленности хлороводород получают сжиганием водорода в хлоре. H2+Cl2->2HCl В лаборатории хлороводород получают нагреванием хлорида калия с концентрированной серной кислотой H2SO4. Смесь этих веществ реагирует уже при комнатном температуре, но при этом образуется гидросульфат калия: КCl + H2SO4-> КHSO4 + НС1 При сильном нагревании получается сульфат калия 2КCl + H2SO4—>К2SО4 + 2НС1 -Почему для получения хлороводорода нельзя брать раствор серной кислоты? (Предполагаемый ответ - выделяющийся хлороводород поглотится водой и реакция пойдет в обратную сторону) - Почему нельзя брать раствор хлорида калия, а только кристаллическое вещество? (То же) - Почему именно таким способом собирают хлороводород? (Хлороводород тяжелее воздуха, его собирают методом вытеснения воздуха, держа пробирку вниз дном) Хлороводород — бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит. (tплав =-1140С, tкип=-850С). Наиболее характерным свойством хлороводорода является его большая растворимость в воде. При О °С в одном объеме воды растворяется около 500 объемов газа. Так, если заполненный хлороводородом цилиндр закрыть стеклянной пластинкой, опрокинуть вверх дном, внести в воду и пластинку убрать, то вода заполнит цилиндр. В отличие от соляной кислоты хлороводород при обычных условиях не реагирует ни с металлами, ни с их оксидами. Учитель демонстрирует необычный эксперимент - получение хлороводорода из кристаллогидрата хлорида алюминия путем нагревания. (См. приложение) Проведенный эксперимент доказывает, что из кристаллического хлорида алюминия путем нагревания можно получать газообразный хлороводород. Учитель обращает их внимание на то, что в ходе реакции в пробирке образуется вода, и тогда учащиеся выдвигают гипотезу: вероятно, соль вначале подвергается дегидратации, затем гидролизуется и при гидролизе происходит образование хлороводорода. Это предположение необходимо согласовать с результатами опыта, обосновать и составить уравнения реакций. Действительно, при обсуждении учащиеся вспоминают, что при нагревании кристаллогидратов происходит их дегидратация и выделяется кристаллизационная вода. Данный процесс выражает следующее уравнение: А1С13 * 6Н2О = AlCl3 + 6Н2О. Образующаяся вода частично растворяет соль и, поскольку реакция протекает при нагревании, соль подвергается сильному гидролизу. При гидролизе получается хлороводород и образуются основные соли алюминия: А1С13 + 2Н2О = А1(ОН)2С1 + 2НС1. Кроме того, в ходе этой реакции, вероятно, могут образовываться также гидроксид и оксид алюминия. То, что при реакции получается газообразный хлороводород, подтверждает опыт по выяснению его растворимости в воде. Только хлороводород имеет растворимость 500 л в 1 л воды. В этом опыте получается разбавленная соляная кислота. Более концентрированная кислота образуется при насыщении воды газообразным хлороводородом. При внимательном наблюдении учащиеся могут заметить, как тонкие струйки тяжелого раствора опускаются на дно химического стакана. Анализ раствора с помощью индикаторов и нитрата серебра, с химической точки зрения, доказывает, что получена именно соляная кислота. Наконец, когда учащимся демонстрируют занимательный опыт «Хлороводородный фонтан», они уже сами могут догадаться, что этот опыт основан одновременно на двух явлениях: растворении всего собранного в колбу хлороводорода в нескольких капельках воды (при этом в колбе создается сильное разрежение и жидкость из кристаллизатора под давлением атмосферного воздуха по газоотводной трубке устремляется внутрь колбы) и изменение окраски индикатора в полученном растворе. 3 этап. Закрепление полученных знаний Познакомившись с хлороводородом, можно приступать и к изучению его раствора - соляной кислоты. Эту кислоту вы хорошо знаете еще с восьмого класса. Соляная кислота проявляет классические свойства кислот, именно эти свойства вам сейчас предстоит продемонстрировать на лабораторных столах, решив экспериментальные задачи. На выполнение их дается 5 минут, и еще по 3 минуты - каждой группе - для демонстрации и анализа результатов, записи уравнений реакций. (Итого 20 минут) Карточки-задания для решения экспериментальных задач. Карточка 1 Получите водород, используя раствор хлороводорода в воде. Соберите водород методом вытеснения воды, докажите наличие его и степень чистоты Реактивы и оборудование: раствор соляной кислоты, металлический цинк, медная проволока, пробирка с газоотводной трубкой, чистая пробирка, кристаллизатор, спички Карточка 2 Проведите опыт между раствором соляной кислоты и основным оксидом. Докажите образование нового вещества. Реактивы и оборудование: раствор соляной кислоты, оксид меди (2),спиртовка. держатель, спички Карточка 3 Проведите качественные реакции на галогенид-ионы и ион водорода, определите, в какой из четырех пронумерованных пробирок находится хлорид натрия, раствор соляной кислоты, иодид натрия и бромид натрия. Реактивы и оборудование: Пронумерованные пробирки с растворами бромида натрия. иодида натрия, хлорида натрия и соляной кислоты, раствор нитрата серебра, раствор лакмуса. Карточка 4 Проведите опыт между раствором соляной кислоты и основаниями (растворимым и нерастворимым). Докажите образование нового вещества. Реактивы и оборудование: раствор соляной кислоты, раствор гидроксида натрия, раствор сульфата меди (2), лакмус, фенолфталеин, пробирки, держатель. Рефлексия Учащиеся повторяют и закрепляют знания о свойствах кислот и о качественном определении галогенид-ионов. а) Получение водорода с помощью соляной кислоты, собирание водорода методом вытеснения воды и доказательство его наличия б) взаимодействие соляной кислоты с оксидом меди при нагревании в) взаимодействие соляной кислоты с гидроксидами г) качественные реакции на галогенид-ионы 4 этап. Применение знаний, обобщение Производство и применение соляной кислоты Сообщение о наиболее широко применяемых веществах - солях соляной кислоты - поваренной соли, о солевых бунтах в средневековье и о значении хлорида натрия в жизнедеятельности организма. - опишите физические свойства хлороводорода - получение хлороводорода в лаборатории - производство соляной кислоты - химические свойства соляной кислоты - химические свойства хлороводорода - качественные реакции на галогенид - ионы - применение соляной кислоты и ее солей Тест по теме «Соляная кислота. Хлороводород»
А – цинк, гидроксид кальция, медь Б – цинк, оксид меди, оксид кальция В – оксид цинка, хлорид натрия, оксид калия Г – кальций, углекислый газ, вода
А – нитрата серебра Б – силиката калия В – карбоната натрия Г – нитрата свинца(2)
А – 2,44 и 1,258, хлор Б – 3,44 и 2,258, хлор В – 1,258 и 2,44, хлороводород Г – 4 и 2, хлороводород
А – 2М Б – 1,864 М В – 18,64 М Г - 186,4 М
А – нитрат серебра Б – нитрата цинка В – нитрата натрия Г – нитрата меди (2) Ключ к тесту - на обороте доски. Самопроверка. Выставление оценок за урок. 5 этап. Подведение итогов урока. Комментарий домашнего задания Домашнее задание: п.29, 30, упр. 6,7 (стр.148) |
Опыт по получению хлороводорода и соляной кислоты.
Реактивы и оборудование: кристаллический хлорид алюминия, растворы лакмуса или метилоранжа, нитрата серебра; демонстрационный прибор для получения хлороводорода, демонстрационные пробирки, горелка или спиртовка, круглодонная колба на 200 мл со вставленной в нее с помощью резиновой пробки длинной стеклянной трубкой (для демонстрации хлороводородного фонтана), химический стакан.
Выполнение: собирают в вытяжном шкафу прибор для получения хлороводорода лабораторным способом, заменив лабораторные принадлежности этого прибора на демонстрационные (рис. 1).
В пробирку помещают (около 1/4 объема) кристаллический хлорид алюминия. Учитывая образование воды в ходе реакции, дно пробирки слегка приподнимают, чтобы кристаллизационная вода при обезвоживании соли не попадала на горячую часть пробирки. Нагревают соль, и собирают в пустую пробирку выделяющийся хлороводород. Пробирку с собранным газом опускают вверх дном в кристаллизатор с водой. Вода очень быстро заполняет пробирку доверху (рис. 2).
Заменяют пробирку на небольшой химический стакан, заполненный на 1/3 водой. Газоотводную трубку прибора размещают внутри стакана на расстоянии 0,5 см над поверхностью волы и насыщают воду в течение 5 мин выделяющимся хлороводородом. С помощью индикаторов и раствора нитрата серебра доказывают, что получена соляная кислота.
Заменяют пробирку с кристаллической солью на другую со свежей порцией хлорида алюминия, нагревают ее и собирают в круглодонную колбу газообразный хлороводород. Проверяют полноту заполнения колбы с помощью стеклянной палочки, смоченной концентрированным раствором аммиака (появляется белый «дым»).
Демонстрируют хлороводородный «фонтан» (рис.3).

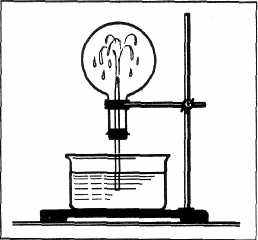

Примечание. При нагревании кристалического хлорида алюминия необходимо контролировать процесс обезвоживания, не допуская попадания в газоотводную трубку воды. Чтобы увеличить наглядность «фонтана», в кристаллизатор добавляют метилоранж.
Рис1 Рис2 рис3
Приложение 2
Тест по теме «Соляная кислота. Хлороводород»
- Укажите группу веществ, в которой все вещества реагируют с соляной кислотой:
А – цинк, гидроксид кальция, медь
Б – цинк, оксид меди, оксид кальция
В – оксид цинка, хлорид натрия, оксид калия
Г – кальций, углекислый газ, вода
- Осадок не образуется при взаимодействии соляной кислоты с раствором:
А – нитрата серебра
Б – силиката калия
В – карбоната натрия
Г – нитрата свинца(2)
- Рассчитайте относительную плотность хлора и хлороводорода по воздуху. Какой газ тяжелее?
А – 2,44 и 1,258, хлор
Б – 3,44 и 2,258, хлор
В – 1,258 и 2,44, хлороводород
Г – 4 и 2, хлороводород
- Определите молярную концентрацию раствора соляной кислоты, полученного растворением 22,4 л (н.у.) хлороводорода в воде объемом 500 мл.(Считать плотность раствора примерно равной единице)
А – 2М
Б – 1,864 М
В – 18,64 М
Г - 186,4 М
- Осадок образуется при взаимодействии соляной кислоты с раствором:
А – нитрат серебра
Б – нитрата цинка
В – нитрата натрия
Г – нитрата меди (2)
