Создание и изучение свойств рекомбинантных белков человека с потенциальным противоопухолевым эффектом
| Вид материала | Автореферат |
- Автореферат диссертации на соискание ученой степени, 357.26kb.
- Получение и применение моноклональных антител и рекомбинантных белков для иммунодиагностики, 1903.98kb.
- Изучение свойств нервной системы учащихся, 286.83kb.
- Практическая работа Тема Создание, 58.94kb.
- Высокомолекулярные азотосодержащие органические вещества, молекулы которых построены, 51.51kb.
- Тема обмен белков. Вопросы лекции, 90.92kb.
- Биосинтез белков Интегрированный урок в 10-м классе(химия и биология). Цель урока, 27.63kb.
- Седьмой Международный Симпозиум «Технеций и рений: изучение свойств и применение» Циркуляр, 30.73kb.
- Анатомия человека наука, изучающая форму и строение тела человека в связи с его функциями, 5847.54kb.
- Анатомия человека наука, изучающая форму и строение тела человека в связи с его функциями, 3564.66kb.
На правах рукописи
Савватеева Людмила Владимировна
СОЗДАНИЕ И ИЗУЧЕНИЕ СВОЙСТВ
РЕКОМБИНАНТНЫХ БЕЛКОВ ЧЕЛОВЕКА
С ПОТЕНЦИАЛЬНЫМ ПРОТИВООПУХОЛЕВЫМ ЭФФЕКТОМ
Специальность 03.00.23. – биотехнология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва – 2007
Работа выполнена в Московском научно-исследовательском институте медицинской экологии Департамента здравоохранения г. Москвы
и на кафедре биотехнологии Московской государственной академии тонкой химической технологии им. М.В. Ломоносова
Научный руководитель: член-корреспондент РАМН,
доктор химических наук, профессор
Северин Сергей Евгеньевич
Официальные оппоненты: член-корреспондент РАН,
доктор химических наук, профессор
Кочетков Сергей Николаевич,
доктор биологических наук,профессор
Глухов Александр Иванович
Ведущая организация: Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН
Защита состоится «…….» декабря 2007 года в 15 часов на заседании Диссертационного Совета Д 212.120.01 при Московской государственной академии тонкой химической технологии имени М.В. Ломоносова по адресу: 119571, Москва, пр. Вернадского, 86.
С диссертацией можно ознакомиться в библиотеке МИТХТ им. М.В. Ломоносова. С авторефератом диссертации можно ознакомиться на сайте www.mitht.ru.
Автореферат разослан «…….» ноября 2007 года. ……………………………
Ученый секретарь Диссертационного Совета
кандидат химических наук,
старший научный сотрудник Лютик А.И.
Общая характеристика работы
Актуальность проблемы. В настоящее время злокачественным новообразованиям принадлежит второе место среди заболеваний, приводящих к летальному исходу. Недостаточная эффективность и избирательность существующих методов лечения рака делают крайне актуальной проблему поиска новых, более действенных и высокоспецифичных методов диагностики и противоопухолевой терапии. Разработка и исследование комбинаций лекарственных средств, принадлежащих к различным классам и действующих на разные клеточные мишени, представляются перспективными в успешном лечении онкологических заболеваний.
В предупреждении и элиминации развившихся опухолей большие надежды связывают с развитием иммунотерапии [Romero P. et al., 2002], которая подразумевает разработку стратегий для разрушения опухолей путем проявления противоопухолевого иммунитета. Так, успешно развивается цитокиновая терапия, специфическая иммунотерапия (вакцинация), адаптивная иммунотерапия (использование опухолеспецифических Т-клеток или моноклональных антител), используется ряд антигенных систем, широко исследуются методы стимуляции гуморального и/или клеточного иммунных ответов, тестируются различные адъюванты. Показано, что белки теплового шока (HSPs) играют важную роль в иммунном ответе, что дало основание использовать некоторые HSPs в качестве вакцин в иммунотерапии рака [Srivastava P.K., 1998]. Иммунологическое функционирование HSPs, которое получило наиболее пристальное внимание, основано на их способности перемещать антигены (в том числе опухолеспецифические) к антиген-презентирующим клеткам (АПК). Также обнаружено, что взаимодействие HSP-АПК независимо от переносимых антигенов приводит к увеличению количества костимуляторных молекул на антиген-презентирующих клетках и секреции воспалительных цитокинов, а взаимодействие HSPs с некоторыми рецепторами вызывает активацию дендритных клеток (ДК) и трансдукционных сигналов [Wallin R. et al., 2002]. Эти уникальные иммуностимулирующие свойства HSPs позволяют использовать их в качестве адъювантов для разработки иммунотерапевтических средств.
Альтернативным подходом в решении указанной проблемы является поиск и изучение новых универсальных опухолевых маркеров, которые могли бы стать основой для создания чувствительных диагностических исследований и мишенью для разработки новых способов направленной противоопухолевой терапии. Предпочтением для выбора можно считать опухолеспецифические антигены, которые должны быть белками-рецепторами, избирательно или преимущественно представленными на опухолевых клетках. Известно, что эукариотические клетки путем эндоцитоза могут захватывать вместе с белковым вектором действующие агенты высокой эффективности и специфичности, в других условиях лишенные возможности проникать в клетку. Мишенью для направленного транспорта могут быть рецепторы онкофетальных белков (в частности, рецепторы альфа-фетопротеина [Moro R. et al., 1993]), а в качестве вектора могут выступать сами онкофетальные белки (например, альфа-фетопротеин или его фрагменты). Этот путь направленной доставки предполагает включение механизма рецептор-опосредованного эндоцитоза (receptor-mediated endocytosis, RME). Создание конъюгатов цитотоксических агентов и различных векторных молекул имеет большие перспективы. С помощью различных кросс-сшивающих агентов образуются ковалентные связи между молекулами белкового вектора и терапевтически активными агентами, например, цитотоксическими препаратами, применяемыми в химиотерапии. Использование механизма RME для доставки в опухолевую клетку конъюгированного цитотоксического препарата позволяет помимо задачи повышения эффективности цитотоксического действия решить проблему селективности и преодоления множественной лекарственной устойчивости опухолевых клеток.
Цели и задачи работы. Целью работы явилось создание и изучение потенциала в противоопухолевой терапии рекомбинантного белка теплового шока HSP70A1B человека и рекомбинантного третьего домена альфа-фетопротеина человека (AFP3D). В соответствии с поставленной целью были сформулированы следующие задачи:
- клонирование и экспрессия в E.coli генных конструкций, осуществляющих биосинтез белка теплового шока HSP70A1B человека и третьего домена альфа-фетопротеина человека (AFP3D);
- разработка технологического метода получения рекомбинантных белков HSP70A1B и AFP3D;
- исследование биологической активности рекомбинантного HSP70A1B по способности взаимодействия с антигенпрезентирующими клетками;
- сравнение биологической активности рекомбинантного третьего домена альфа-фетопротеина человека AFP3D с активностью природного альфа-фетопротеина человека;
- синтез цитотоксического конъюгата AFP3D с химиопрепаратом, обеспечивающего направленное воздействие на опухолевые клетки, и исследование его эффективности in vitro.
Научная новизна и практическая значимость работы.
Сконструированы рекомбинантные плазмидные ДНК E.coli, позволяющие эффективно осуществлять индуцированный биосинтез белка теплового шока человека HSP70A1B и третьего домена альфа-фетопротеина человека AFP3D в клетках соответствующих штаммов-продуцентов.
Разработаны высокоэффективные методы выделения исследуемых рекомбинантных белков в препаративном количестве.
Исследована биологическая активность рекомбинантного HSP70A1B, а также показана его способность к связыванию и активному эндоцитозу дендритными клетками.
Продемонстрирована возможность использования рекомбинантного третьего домена альфа-фетопротеина человека в качестве векторной молекулы для создания противоопухолевых препаратов направленного действия за счет сохранения в AFP3D функциональной активности полноразмерной молекулы природного альфа-фетопротеина человека.
Синтезирован ковалентный конъюгат рекомбинантного третьего домена альфа-фетопротеина человека с таксолом, и показана высокоспецифическая цитотоксическая активность конъюгата in vitro по отношению к клеткам злокачественной опухоли.
Полученные штаммы-продуценты HSP70A1B и AFP3D человека и разработанные методы их выделения могут быть использованы в области промышленной биотехнологии, а соответствующие рекомбинантные белки – в научно-исследовательских работах с последующим потенциальным применением в области практической медицины.
В целом, данная работа демонстрирует роль, которую рекомбинантные белки человека HSP70A1B и AFP3D могут сыграть в противоопухолевой терапии в качестве иммуномодулятора и вектора для направленной доставки лекарственных средств соответственно, а также подчеркивает необходимость дальнейшего совершенствования систем различного механизма действия с использованием рекомбинантных белков.
Апробация работы и публикации. Результаты работы были представлены на следующих симпозиумах и конференциях: XXXIII Meeting of the International Society for Oncodevelopmental Biology and Medicine (Greece, Rhodes, 2005); 19th Meeting of the European Association for Cancer Research (Budapest, Hungary, 2006); Российский Медицинский Форум «Фундаментальная наука и практика» (Москва, 2006); International Scientific-Practical Interdisciplinary Workshop “New Technologies in Medicine and Experimental Biology” (Bangkok-Pattaya, Thailand, 2007).
По материалам диссертации опубликовано 5 работ, оформлена 1 заявка на выдачу патента РФ на изобретение.
С
 труктура и объем работы. Диссертация изложена на 130 страницах; содержит 30 рисунков и 3 таблицы; состоит из введения, обзора литературы, результатов и обсуждения, экспериментальной части, выводов и списка цитируемой литературы, включающей 245 наименований.
труктура и объем работы. Диссертация изложена на 130 страницах; содержит 30 рисунков и 3 таблицы; состоит из введения, обзора литературы, результатов и обсуждения, экспериментальной части, выводов и списка цитируемой литературы, включающей 245 наименований. Содержание работы
1. Получение белка теплового шока HSP70A1B человека и третьего домена альфа-фетопротеина AFP3D в E.coli.
Конструирование рекомбинантных плазмидных ДНК.
Клонирование гена белка теплового шока человека HSP70A1B в pET-28a(+).
На основе известной последовательности мРНК HSP70 (GenBank NM_005346) человека с помощью компьютерной программы DNA-SUN была получена рестрикционная карта ДНК-последовательности HSP70 для определения отсутствующих и уникальных сайтов рестрикции. По результатам анализа этих данных были подобраны и синтезированы праймеры для амплификации ДНК HSP70, соответствующей подсемейству белков теплового шока HSP70A1. Тотальную РНК выделяли из лимфоцитов человека после теплового шока. Комплементарную ДНК (кДНК) гена HSPA1B человека синтезировали на мРНК с помощью обратной транскриптазы мышиного вируса лейкемии Молони (RT М-MuLV). Амплификацию кДНК проводили с помощью полимеразной цепной реакции (ПЦР), используя две пары праймеров, в результате чего получили два перекрывающихся фрагмента ДНК HSP70A1B: N-концевой фрагмент (1068 п.о.) и C-концевой фрагмент (895 п.о.), примерно соответствующие АТP- и пептид-связывающим доменам белка [Tsai M. et al., 1994]. Фрагменты клонировали по SmaI-сайту в плазмиде pUC19 с последующим секвенированием. Полноразмерную последовательность транслируемой области гена HSPA1B получали лигированием фрагментов по сайту PstI, находящегося в области перекрывания этих фрагментов. Плазмиду pUC-HSP70А1B с нуклеотидной последовательностью, соответствующей гену HSPA1B, рестриктировали ферментами NdeI и HindIII. ДНК, соответствующую полноразмерной последовательности транслируемой области гена HSPA1B, встраивали в полилинкер коммерческого экспрессионного вектора pET-28a(+) по указанным сайтам рестрикции (рис. 1).

Данная генная конструкция позволяет при трансляции получить белок HSP70, который по аминокислотной последовательности соответствует HSP70A1В с несколькими дополнительными аминокислотами на N-конце: Met-Gly-Ser-Ser-(His)6-Ser-Ser-Gly-Leu-Val-Pro-Arg-Gly-Ser-His-Met-Gly-Ser (далее обозначаемый His-tag). Размер белка составляет 663 аминокислотных остатков или 72.33 кДa. Сайты узнавания и расщепления тромбином (выделены курсивом и подчеркиванием, соответственно) позволяют при необходимости удалить лишние аминокислоты. Введение C- и N- концевых сайтов рестрикции SalI и BamHI на уровне генной конструкции pET-hHSP70A1B (рис. 1) дает возможность создания гибридных (fusion) белков, имитирующих комплексы HSP70-антиген.
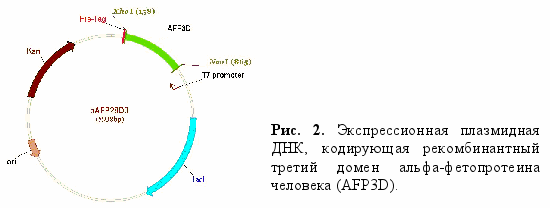
- Клонирование фрагмента гена альфа-фетопротеина человека, соответствующего третьему домену белка (AFP3D), в pET-28a(+).
Для определения отсутствующих и уникальных сайтов рестрикции с помощью компьютерной программы DNA-SUN была получена рестрикционная карта ДНК-последовательности альфа-фетопротеина человека (AFP) на основе известной последовательности мРНК AFP человека (GenBank NM_001134). Тотальную РНК выделяли из клеток продуцирующей альфа-фетопротеин гепатоцеллюлярной карциномы человека линии HepG2. Комплементарную ДНК (кДНК) гена AFP человека синтезировали на мРНК с помощью обратной транскриптазы вируса миелобластоза птиц (RT AMV). Для получения рекомбинантного третьего домена AFP (AFP3D) соответствующий фрагмент гена клонировали в плазмидном векторе pET-28а(+) под контролем промотора бактериофага T7. Фрагмент ДНК, кодирующий AFP3D, получали методом ПЦР, используя в качестве матрицы кДНК альфа-фетопротеина человека. Для амплификации были использованы два олигонуклеотидных праймера: смысловой праймер 5’tttt CCA TGG GAT ACC AGG AGT TAT TG 3’, содержащий сайт узнавания рестриктазой NcoI (подчеркнут), и антисмысловой праймер 5’tttt CTC GAG AAC TCC CAA AGC AGC AC 3’, содержащий сайт XhoI (подчеркнут). Полученный в результате ПЦР фрагмент ДНК клонировали в вектор pET-28а(+) по рестрикционным сайтам NcoI-XhoI (рис. 2). Данная генная конструкция позволяет при трансляции получить белок AFP3D, который по аминокислотной последовательности соответствует третьему домену молекулы AFP с метионином на N-конце и Leu-Glu-(His)6 на С-конце.
1.2. Экспрессия рекомбинантных генов. Очистка белков.
1.2.1. Получение рекомбинантного HSP70A1B.
П
 лазмидную ДНК pET-hHSP70А1B трансфицировали в клетки E.coli BL21(DE3). Выбранный по результатам секвенирования штамм-продуцент BL21(DE3)/pET-hHSP70А1B выращивали на канамицин-содержащей среде, синтез белка индуцировали добавлением изопропил-β-D-тиогалактопиранозида (ИПТГ). Уровень экспрессии целевого белка (~72 кДа) составлял от 40 до 50% от общего клеточного белка, что показал электрофорез в 12% полиакриламидном геле в присутствии додецилсульфата натрия (рис. 3). В отличие от описанных ранее систем экспрессии HSP70A1L [Jindal S. et al., 1995], где основная масса рекомбинантного белка нарабатывалась в Е.соli в виде нерастворимых телец включения, нами получен штамм, продуцирующий рекомбинантный HSP70A1B как в растворимой форме, так и в виде телец включения, причем примерно в равном соотношении (рис. 3).
лазмидную ДНК pET-hHSP70А1B трансфицировали в клетки E.coli BL21(DE3). Выбранный по результатам секвенирования штамм-продуцент BL21(DE3)/pET-hHSP70А1B выращивали на канамицин-содержащей среде, синтез белка индуцировали добавлением изопропил-β-D-тиогалактопиранозида (ИПТГ). Уровень экспрессии целевого белка (~72 кДа) составлял от 40 до 50% от общего клеточного белка, что показал электрофорез в 12% полиакриламидном геле в присутствии додецилсульфата натрия (рис. 3). В отличие от описанных ранее систем экспрессии HSP70A1L [Jindal S. et al., 1995], где основная масса рекомбинантного белка нарабатывалась в Е.соli в виде нерастворимых телец включения, нами получен штамм, продуцирующий рекомбинантный HSP70A1B как в растворимой форме, так и в виде телец включения, причем примерно в равном соотношении (рис. 3). Клеточные осадки подвергали ультразвуковой дезинтеграции, осаждали центрифугированием и собирали супернатант (растворимая фракция белка), а из осадков получали тельца включения. Выделение белка HSP70A1B, проводимое из обеих фракций независимо, было основано на аффинной хроматографии с использованием иминодиацетат-сефарозы, активированной ионами никеля, что стало возможным благодаря введению в состав белка последовательности из шести остатков гистидина. Это значительно упрощает выделение рекомбинантного белка и предотвращает контаминацию DnaK – бактериальным аналогом эукариотического HSP70, что особенно важно при исследовании иммунологических свойств рекомбинантных HSPs человека.
Белок HSP70A1B, находящийся в растворимой фракции, не требует рефолдинга, что дает возможность нарабатывать его без значительных затрат времени и в больших количествах - не менее 30 мг с литра бактериальной культуры. Выделенный белок из солюбилизированных гуанидинхлоридом телец включения восстанавливали β-меркаптоэтанолом и ренатурировали последовательным диализом против буферов E (0.1М Трис-HCl, 0.5М NaCl, 2мМ ЭДТА, рН 8.0) и F (0.05М Трис-HCl, 0.15М NaCl, рН 8.0) для удаления детергента. Выход белка составлял 10-12 мг с литра бактериальной культуры.
Ч
 истота выделенного белка в обоих случаях составляла не менее 90% (рис. 4).
истота выделенного белка в обоих случаях составляла не менее 90% (рис. 4). Соответствие очищенного белка семейству HSP70 подтверждено данными электрофореза в градиентном полиакриламидном геле (5-20%) и иммуноблота с использованием моноклональных антител к HSP70 человека (рис. 5).
Рекомбинантный HSP70A1B подвергали ферментативному протеолизу тромбином для удаления His-tag (см. п. 1.1.1.) с получением белка HSP70A1В* молекулярной массы 70.45 кДа.

Подавляющая часть сведений, касающихся свойств белков теплового шока в качестве противоопухолевых вакцин, получена в экспериментах с использованием природных HSPs [Srivastava P.K. et al., 1997]. Такие методики включают в себя накопление и гомогенизацию ткани, экстракцию целевого белка, а также фракционирование препарата с помощью нескольких хроматографических стадий. Основными недостатками получения HSPs из природных источников являются необходимость накопления опухолевых тканей, трудоемкость процесса выделения, малый конечный выход и не всегда достаточная степень чистоты и гомогенности полученных препаратов. Функции индивидуальных белков различных семейств HSPs до сих пор мало изучены, а исследование и их практическое использование требует препаративного количества высокоочищенных белков (или отдельных доменов). В связи с этим, представляется перспективным использование созданного нами высокоэффективного штамма E.coli BL21(DE3)/pET-hHSP70A1B для получения по упрощенной технологии и с высоким выходом рекомбинантного HSP70A1B человека.
1.2.2. Получение рекомбинантного AFP3D.
Для создания штамма-продуцента третьего домена альфа-фетопротеина человека рекомбинантной плазмидой pAFP28D3 были трансформированы компетентные клетки E.coli BL21(DE3), имеющие хромосомную копию гена Т7 РНК-полимеразы под контролем промотора lac UV5, индуцируемого изопропил-β-D-тиогалактопиранозидом (ИПТГ).
Синтез рекомбинантного белка тестировали методом электрофореза в присутствии SDS. Целевой белок (~27 кДа) накапливался в клетках в виде телец включения с высоким выходом (рис. 6).

Выделенные тельца включения растворяли в буфере, содержащем 6М гуанидинхлорид, и подвергали очистке методом аффинной хроматографии на иминодиацетат-сефарозе, активированной ионами никеля. Связавшийся белок элюировали буфером, содержащем 0.3М имидазол и рефолдировали последовательным диализом относительно буферов E (0.1М Трис-HCl, 0.5М NaCl, 2мМ ЭДТА, рН 8.0) и F (0.01М Трис-HCl, 0.15М NaCl, рН 8.0). Диализованный белок концентрировали на ячейке Amicon, фракционировали на колонке SuperdexTM 200, элюируя буфером F. Было выделено две фракции: фракция I соответствует димеру, фракция II – мономеру AFP3D (рис. 7). Как видно из хроматограммы, эффективность получения мономера II достигает 40% от суммарного белка.

Д
 ля оценки гомогенности очищенных фракций белка проводили электрофорез в 13% полиакриламидном геле в восстанавливающих и невосстанавливающих условиях; чистота мономера составляла не менее 98% (рис. 8).
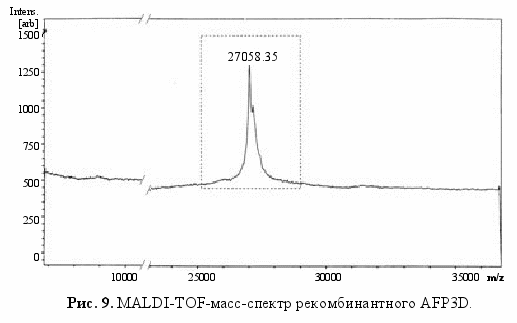
ля оценки гомогенности очищенных фракций белка проводили электрофорез в 13% полиакриламидном геле в восстанавливающих и невосстанавливающих условиях; чистота мономера составляла не менее 98% (рис. 8). Следует отметить, что определяемая на электрофорезе полоса целевого мономера соответствует ~24 кДа, что не отвечает расчетной молекулярной массе - 27 кДа. Реальная масса AFP3D была определена масс-спектрометрически (MALDI-TOF). Оказалось, что около 70% белка имеет массу 27.058 кДа, а остальная часть - 27.200 кДа (рис. 9). Разница, составляющая около 150 Да, соответствует молекулярной массе N-концевого метионина, отщепляющегося в процессе клеточного биосинтеза. Конечный выход высокоочищенной мономерной формы AFP3D составил 5 мг с литра бактериальной культуры.

Выделение и очистка природного альфа-фетопротеина – весьма трудоемкий и дорогостоящий процесс, который требует использования моноклональных антител и значительное количество исходного материала. Получение рекомбинантного альфа-фетопротеина связано со значительными трудностями ввиду его высокой молекулярной массы и наличия углеводных компонентов и внутримолекулярных дисульфидных связей. В значительной мере избежать этих затруднений позволяет использование генно-инженерных конструкций, обеспечивающих продукцию не целого белка, а его биологически активных фрагментов. В данной работе нами разработан технологический метод получения рекомбинантного третьего домена альфа-фетопротеина человека, способного заменить использование как природного, так и рекомбинантного полноразмерного альфа-фетопротеина в качестве вектора для направленной доставки цитотоксических препаратов.
2. Определение активности рекомбинантных белков.
2.1. Исследование функциональной активности HSP70A1B.
Известно, что белки теплового шока в качестве шаперонов обеспечивают стабилизацию нативной конформации различных клеточных белков, их внутриклеточную транслокацию в различные компартменты клетки, используя активный ATP-зависимый конформационный процесс [Hartl F.U. et al., 1996]. Колориметрическим методом определили, что 1 мг рекомбинантного HSP70A1B человека (как выделенного из растворимой фракции, так и рефолдированного) гидролизует 2-4 нмоль ATP/мин при 30ºС, что указывает на биологическую активность целевого продукта. Также показано, что более 60% HSP70A1B (равно как и HSP70A1B*, не содержащий His-tag) связывается с ADP-агарозой, т.е. имеет нативную конформацию ATP-связывающего домена.
Помимо шаперонных функций HSP70 может принимать участие в развитии противоопухолевого иммунитета, обусловленного взаимодействием антигенпредставляющих клеток (АПК) с HSP70 путем рецептор-опосредованного эндоцитоза через рецепторы CD91, CD40, LOX и некоторые другие [Arnold-Schild D. et al, 1999]. После интернализации связанные с HSP70 экзогенные белки и пептиды (в том числе опухолеспецифические) высвобождаются из эндосом в цитоплазму, подвергаются процессингу и образуют комплексы с молекулами МНС I, обеспечивая тем самым возможность индукции специфического клеточного иммунного ответа.
Для исследования способности рекомбинантного HSP70A1B к связыванию и эндоцитозу в качестве АПК были выбраны незрелые дендритные клетки, а в качестве метода детекции - проточная цитофлуориметрия. Препараты рекомбинантных HSP70A1B и HSP70A1B*, предварительно меченные флуресцеинизотиоцианатом (FITC), инкубировали с дендритными клетками при двух температурных режимах: +4ºС в присутствии азида натрия и +37ºС. Известно, что при +4ºС мембранные рецепторы взаимодействуют со своими лигандами, однако интернализация образующихся комплексов наблюдается только при +37ºС.
К
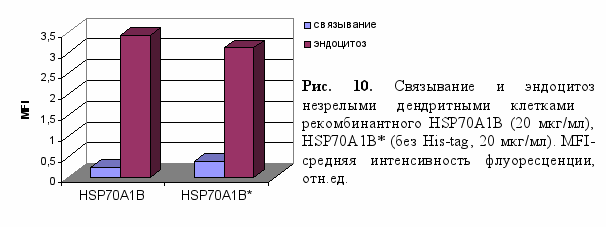 ак видно по уровню флуоресценции клеток (рис. 10), происходит не только связывание HSP70A1B и HSP70A1B* со специфическими рецепторами, представленными на используемых дендритных клетках, но и очень активный процесс интернализации (эндоцитоз) белковых препаратов. При этом, судя по сопоставимым средним значениям интенсивности флуоресценции (MFI), не были выявлены существенные различия между HSP70A1B и HSP70A1B*, что подтверждает предположение об отсутствии влияния His-tag не только на конформацию ATP-связывающего домена полученного нами рекомбинантного белка, но и на его способность к связыванию и эндоцитозу АПК.
ак видно по уровню флуоресценции клеток (рис. 10), происходит не только связывание HSP70A1B и HSP70A1B* со специфическими рецепторами, представленными на используемых дендритных клетках, но и очень активный процесс интернализации (эндоцитоз) белковых препаратов. При этом, судя по сопоставимым средним значениям интенсивности флуоресценции (MFI), не были выявлены существенные различия между HSP70A1B и HSP70A1B*, что подтверждает предположение об отсутствии влияния His-tag не только на конформацию ATP-связывающего домена полученного нами рекомбинантного белка, но и на его способность к связыванию и эндоцитозу АПК. Таким образом, представленные результаты о способности полученного нами рекомбинантного HSP70A1B человека гидролизовать ATP, связываться с рецепторами и проникать в антигенпрезентирующие клетки путем эффективного эндоцитоза, являются качественной характеристикой белка для потенциального проявления противоопухолевого иммунитета.
2.2. Исследование функциональной активности AFP3D.
2.2.1. Связывание и захват FITC-меченного AFP3D опухолевыми клетками и лимфоцитами.
Н
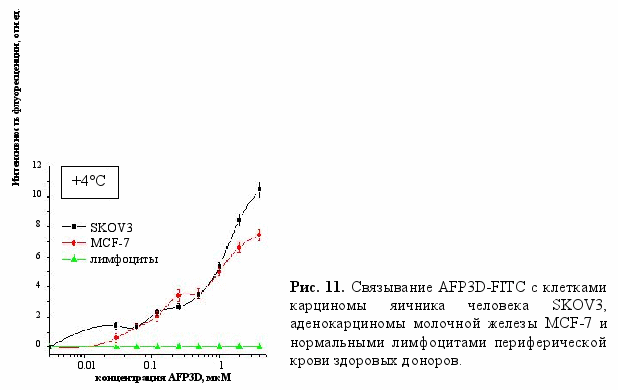 а данном этапе мы исследовали способность полученного нами рекомбинантного третьего домена альфа-фетопротеина к связыванию со специфическим рецептором AFP на поверхности опухолевых клеток человека и последующему рецептор-опосредуемому эндоцитозу. Для исследования связывания клетки инкубировали с флуоресцентно-меченным AFP3D (AFP3D-FITC) при +4°С в течение часа, отмывали, фиксировали и измеряли флуоресценцию клеток на проточном цитофлуориметре. Было показано, что AFP3D-FITC связывается с опухолевыми клетками (карциномами яичника линии SKOV3 и молочной железы линии MCF-7) и практически не связывается с нестимулированными лимфоцитами периферической крови (рис. 11).
а данном этапе мы исследовали способность полученного нами рекомбинантного третьего домена альфа-фетопротеина к связыванию со специфическим рецептором AFP на поверхности опухолевых клеток человека и последующему рецептор-опосредуемому эндоцитозу. Для исследования связывания клетки инкубировали с флуоресцентно-меченным AFP3D (AFP3D-FITC) при +4°С в течение часа, отмывали, фиксировали и измеряли флуоресценцию клеток на проточном цитофлуориметре. Было показано, что AFP3D-FITC связывается с опухолевыми клетками (карциномами яичника линии SKOV3 и молочной железы линии MCF-7) и практически не связывается с нестимулированными лимфоцитами периферической крови (рис. 11). Эксперименты по связыванию FITC-меченого AFP3D с клетками в присутствии природного альфа-фетопротеина человека подтвердили специфичность связывания AFP3D с рецептором AFP. Интенсивность флуоресценции клеток, обработанных AFP3D-FITC (до концентрации 1 мкM) была близка к флуоресценции клеток, обработанных AFP-FITC (рис. 12а). Для исследования специфичности связывания, клетки SKOV3 инкубировали с AFP3D-FITC в присутствии 30-кратного избытка AFP человека в течение часа при +4°C. Инкубация SKOV3 в этих условиях приводила к значительному снижению связывания AFP3D-FITC с опухолевыми клетками (рис. 12б). Из рисунка видно, что природный AFP в значительной степени ингибировал связывание AFP3D-FITC с клетками. Эти данные подтверждают, что AFP3D действительно связывается с рецептором AFP на опухолевых клетках и к
 онкурирует с AFP за сайт связывания.
онкурирует с AFP за сайт связывания. И
 сследование захвата AFP3D-FITC опухолевыми клетками и лимфоцитами периферичекой крови человека показало, что опухолевые линии MCF-7 и SKOV3 активно эндоцитируют AFP3D-FITC (рис. 13), причем особенно высоким захват был в клетках аденокарциномы яичника SKOV3. В лимфоцитах эндоцитоз AFP3D-FITC практически отсутствовал. Эти данные хорошо коррелируют с полученными ранее результами по связыванию и эндоцитозу природного полноразмерного альфа-фетопротеина человека опухолевыми клетками линий MCF-7, SKOV3 и лимфоцитами [Ницветов М.Б. и др., 2001].
сследование захвата AFP3D-FITC опухолевыми клетками и лимфоцитами периферичекой крови человека показало, что опухолевые линии MCF-7 и SKOV3 активно эндоцитируют AFP3D-FITC (рис. 13), причем особенно высоким захват был в клетках аденокарциномы яичника SKOV3. В лимфоцитах эндоцитоз AFP3D-FITC практически отсутствовал. Эти данные хорошо коррелируют с полученными ранее результами по связыванию и эндоцитозу природного полноразмерного альфа-фетопротеина человека опухолевыми клетками линий MCF-7, SKOV3 и лимфоцитами [Ницветов М.Б. и др., 2001].И
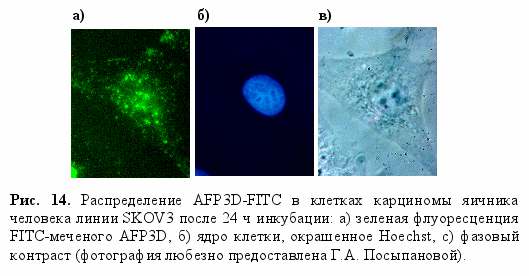 сследование препаратов клеток SKOV3 через 24 часа после инкубации с AFP3D-FITC с помощью флуоресцентной микроскопии подтвердило, что клетки активно захватывают AFP3D-FITC (рис. 14).
сследование препаратов клеток SKOV3 через 24 часа после инкубации с AFP3D-FITC с помощью флуоресцентной микроскопии подтвердило, что клетки активно захватывают AFP3D-FITC (рис. 14).Интересно, что в отличие от AFP-FITC, флуоресценция наблюдалась не только в цитоплазматических компартментах (эндосомах, мульти-везикулярных тельцах, комплексе Гольджи), окружающих ядро [Alava M.A. et al., 1999], но и в клеточных ядрах. По-видимому, это связано с тем, что в рекомбинатном третьем домене экспонируется на поверхность один (или более) из так называемых сигналов ядерной локализации, который маскируется в молекуле AFP вторым и первым доменами.
Способность AFP3D селективно связываться, эффективно эндоцитировать в опухолевые клетки и конкурировать с молекулами природного альфа-фетопротеина за рецептор указывает на то, что структура рецептор-связывающего участка полученного нами рекомбинантного домена белка не претерпела существенных изменений.
2.2.2. Ингибирование эстрадиол-зависимой пролиферации клеток аденокарциномы молочной железы человека MCF-7 in vitro.
О
 дним из параметров биологической активности альфа-фетопротеина является его способность ингибировать эстрадиол-индуцированный рост гормон-зависимых опухолевых клеток как in vivo, так и in vitro [Bennett J.A. et al.,1997]. Мы исследовали влияние AFP3D на Е2-активированную пролиферацию клеток аденокарциномы молочной железы MCF-7 in vitro. Для этого клетки MCF-7 инкубировали до достижения монослоя в среде DMEM без фенолового красного, содержащей 5% бычью сыворотку новорожденных (NBS, CE2<3 пг/мл). Для стимуляции пролиферации к клеткам добавляли E2 в концентрации 10-9 M. В этих условиях через 72 часа стимуляция пролиферации клеток, оцениваемая по включению [3H]-тимидина в ДНК, составляла в среднем 165% от контроля. При одновременном с E2 добавлении к клеткам AFP или AFP3D в диапазоне концентраций 10-11-10-6 M включение [3H]-тимидина значительно снижалось (117±5.85% для AFP и 120±4.8% для AFP3D) (рис. 15). Ингибирование проявлялось при низких концентрациях белков; при повышении концентрации до 10-8 M эффект исчезал.
дним из параметров биологической активности альфа-фетопротеина является его способность ингибировать эстрадиол-индуцированный рост гормон-зависимых опухолевых клеток как in vivo, так и in vitro [Bennett J.A. et al.,1997]. Мы исследовали влияние AFP3D на Е2-активированную пролиферацию клеток аденокарциномы молочной железы MCF-7 in vitro. Для этого клетки MCF-7 инкубировали до достижения монослоя в среде DMEM без фенолового красного, содержащей 5% бычью сыворотку новорожденных (NBS, CE2<3 пг/мл). Для стимуляции пролиферации к клеткам добавляли E2 в концентрации 10-9 M. В этих условиях через 72 часа стимуляция пролиферации клеток, оцениваемая по включению [3H]-тимидина в ДНК, составляла в среднем 165% от контроля. При одновременном с E2 добавлении к клеткам AFP или AFP3D в диапазоне концентраций 10-11-10-6 M включение [3H]-тимидина значительно снижалось (117±5.85% для AFP и 120±4.8% для AFP3D) (рис. 15). Ингибирование проявлялось при низких концентрациях белков; при повышении концентрации до 10-8 M эффект исчезал. 2.2.3. Исследование цитотоксической активности конъюгата AFP3D-Таксол.
Исследование биологической активности полученного нами рекомбинантного третьего домена AFP подтвердило, что AFP3D обладает такими важными свойствами полноразмерного AFP, как способность связываться со специфическим рецептором AFP и ингибировать пролиферацию эстроген-зависимых клеток in vitro.
Ранее было показано, что конъюгаты AFP человека c доксорубицином [Severin S.E. et al., 1996], и некоторыми другими противоопухолевыми лекарствами [Severin S.E. et al., 1997] эффективно подавляют рост опухолевых клеток как in vitro, так и in vivo. Однако широкое применение AFP в качестве универсального белка-транспортера лекарственных соединений в раковые клетки ограничено тем, что выделение в достаточных для производства лекарственных препаратов количествах AFP сопряжено с технологическими трудностями.
С целью изучения возможности использования рекомбинантного биологически активного AFP3D в качестве вектора для направленного транспорта химиопрепаратов нами был синтезирован конъюгат AFP3D с таксолом - цитотоксическим агентом, широко применяющимся в медицинской практике при лечении больных раком молочной железы, яичников, немелкоклеточным раком легкого.
Таксол (международное название – паклитаксел; химическая формула показана на рис. 16) – самый изученный представитель таксанов, фармакологическое действие которых заключается в стимуляции полимеризации клеточного белка тубулина и в образовании чрезмерного количества дефектных микротрубочек. Следствием нарушения функции микротрубочкового аппарата опухолевой клетки является блокирование процесса ее деления, а также повреждение цитоскелета, приводящее к нарушению подвижности, внутриклеточного транспорта и передачи трансмембранных сигналов.
В связи с этим, представляется перспективным использование рекомбинантного третьего домена альфа-фетопротеина в качестве вектора, конъюгированного с таксолом, для направленной доставки цитотоксического препарата непосредственно в клетки опухоли.

Конъюгат AFP3D с таксолом был получен с использованием ангидрида глутаровой кислоты для модификации таксола. Схема получения конъюгата приведена на рис. 16. Из литературных данных известно, что реакция таксола с ангидридами янтарной или глутаровой кислот при комнатной температуре в растворе пиридина дает С2'-монопроизводное таксола, т.к. именно гидроксильная группа при С2'-положении является наиболее реакционноспособной по сравнению с другими группами молекулы таксола [Deutsch H.M. et al., 1989]. Показано также, что модификация С2'-положения молекулы не влияет на цитотоксичность таксола [Lataste H. et al., 1984]. Таким образом, для осуществления синтеза не требуется предварительного введения защитных групп и специфических условий проведения реакции, что значительно упрощает и удешевляет технологию получения исследуемого конъюгата.
Соотношение компонентов в конечном продукте оценивали на основе результатов фотометрического определения белка с использованием медного комплекса бицинхониновой кислоты [Wiechelman K.J. et al., 1988] и определения количества таксола с помощью ВЭЖХ. Молярное соотношение AFP3D:Таксол составило 1:1.5, т.е. конъюгат содержал 1-2 молекулы таксола, ковалентно связанных с одной молекулой рекомбинантного белка.
Полученный конъюгат исследовали на наличие специфической цитотоксической активности (ЦТА) in vitro на культуре клеток карциномы молочной железы линии MCF-7. Конъюгат AFP3D-Таксол проявлял дозозависимую ЦТА в отношении указанной линии опухолевых клеток, при этом ЦТА исследуемого конъюгата была сравнима с активностью конъюгата AFP-Таксол (рис. 17).
Конъюгаты AFP3D-Таксол и AFP-Таксол оказались не токсичнее свободного таксола (рис. 17), что, по-видимому, связано с тем, что эффективность реализации их цитотоксического действия in vitro в значительной мере определяется количеством рецепторов векторного белка на поверхности опухолевых клеток, различиями в сродстве вектора к его рецептору, а также скоростью рецептор-опосредованного эндоцитоза.

Следует учитывать, что in vivo противоопухолевые лекарственные соединения (в частности, таксол) легко проникают не только в опухолевые, но и во все типы нормальных клеток, что является причиной возникновения широкого спектра побочных эффектов. В противоположность этому, конъюгаты AFP-Таксол и AFP3D-Таксол будут проникать, главным образом, в опухолевые клетки, гиперэкспрессирующие рецептор альфа-фетопротеина, поэтому их цитотоксическое действие на нормальные клетки будет минимальным. Поэтому, несмотря на большие значения ЦТА конъюгатов по сравнению с ЦТА свободного таксола in vitro, преимущество конъюгатов при их терапевтическом применении in vivo представляется очевидным.
Таким образом, представленные результаты свидетельствуют о том, что полученный нами рекомбинантный третий домен альфа-фетопротеина AFP3D обладает высоким векторным потенциалом (очень близким к потенциалу полноразмерной молекулы природного AFP) для доставки цитотоксических химиопрепаратов в клетки злокачественных опухолей. При этом нормальные клетки поражаются подобными препаратами в значительно меньшей степени, что дает возможность практического использования уникальных свойств AFP3D для создания новых эффективных препаратов для лечения злокачественных новообразований.
ВЫВОДЫ
- Сконструирована рекомбинантная плазмидная ДНК pET-hHSP70A1B, а также создан высокоэффективный штамм-продуцент E.coli BL21(DE3)/pET-hHSP70A1B, который позволяет осуществлять получение по упрощенной технологии белка теплового шока человека HSP70A1B, относящегося к шаперонному семейству HSP70.
- Продемонстрировано, что рекомбинантный HSP70A1B обладает биологической (ATP-гидролизующей) активностью, способен связываться и активно интернализоваться дендритными клетками, подтверждая свои потенциальные иммуномодулирующие свойства.
- В экспрессионной системе E.coli получен рекомбинантный фрагмент альфа-фетопротеина человека, соответствующий третьему домену белка (AFP3D) и разработан технологический метод его получения.
- Исследована биологическая активность рекомбинантного третьего домена альфа-фетопротеина человека. Показано, что AFP3D обладает такими важными свойствами полноразмерного AFP, как способность связываться со специфическим рецептором AFP на опухолевых клетках и ингибировать пролиферацию эстроген-зависимых клеток in vitro.
- Синтезирован конъюгат рекомбинантного третьего домена альфа-фетопротеина человека AFP3D c противоопухолевым препаратом (таксол), который обладает цитотоксической активностью в отношении опухолевых клеток линии MCF-7. Это дает возможность практического использования AFP3D в качестве вектора для создания новых эффективных средств направленной доставки для лечения злокачественных новообразований.
Список публикаций
- Савватеева Л.В., Гороховец Н.В., Черников В.А. Данилевский М.И., Северин С.Е. Получение рекомбинантного HSP70А1В человека. Вопросы биологической, медицинской и фармацевтической химии, 2007, №3, с. 38-42.
- Гороховец Н.В., Савватеева Л.В., Северин Е.С., Северин С.Е. Рекомбинантная плазмидная ДНК pET-hHSP70, кодирующая белок теплового шока человека HSP70, и штамм E.coli BL21(DE3)/pET-hHSP70-продуцент белка теплового шока человека HSP70. Заявка на выдачу патента РФ № 2006140913 от 21.11.2006.
- Savvateeva L, Gorokhovets N, Makarov V, Posypanova G, Severin S. Recombinant third domain of human alpha-fetoprotein: selectivity and antitumor activity of conjugate with Taxol. Abstracts of the XXXIII Meeting of the International Society for Oncodevelopmental Biology and Medicine (ISOBM), Rhodes, Greece, September 24-28, 2005, p. 84.
- Savvateeva L, Gorokhovets N, Posypanova G, Makarov V. Recombinant domain III of human alpha-fetoprotein–new vector for antitumor drug delivery. Abstracts of the 19th Meeting of the European Association for Cancer Research (EACR), Budapest, Hungary, July 1-4, 2006, p. 86.
- Савватеева Л.В., Гороховец Н.В., Черников В.А. Данилевский М.И., Северин С.Е. Получение рекомбинантного HSP70 человека. Тезисы докладов Российского Медицинского Форума-2006 «Фундаментальная наука и практика», Москва, 18-20 октября, 2006, с. 119.
- Savvateeva LV, Gorokhovets NV, Chernikov VA, Danilevskiy MI, Severin SE. Recombinant human HSP70 and its potential application in cancer immunotherapy. Abstracts of the International Scientific-Practical Interdisciplinary Workshop “New Technologies in Medicine and Experimental Biology”, Bangkok-Pattaya, Thailand, February 28-March 8, 2007, p. 62.
В руководстве работой и подготовке ее к защите принимал участие зав. кафедрой биотехнологии МИТХТ им. М.В. Ломоносова, академик РАМН, д.х.н., профессор Швец В.И.
Активное участие в работе и руководстве диссертацией осуществляла к.б.н. Гороховец Н.В.
Данная часть работы проводилась при участии в.н.с. Московского НИИ медицинской экологии, к.б.н. Г.А. Посыпановой.
