Програма II науково-практичний семінар студентів, аспірантів І молодих учених «Прикладні аспекти електрохімічного аналізу»
| Вид материала | Документы |
- Міністерство освіти І науки україни східноукраїнський національний університет імені, 206.5kb.
- План проведення міжнародних, всеукраїнських організаційно-масових заходів з науково, 53.71kb.
- Про Всеукраїнський конкурс на кращу наукову роботу студентів, аспірантів, молодих учених, 133.91kb.
- Міжнародний науково-практичний семінар, 190.35kb.
- Відомості про конференції, що плануються до проведення кафедрою соціально-економічної, 21.78kb.
- Зміст, 450.68kb.
- V міжнародна науково-практична конференція молодих учених, аспірантів, студентів, 106.58kb.
- Аспірантів та студентів які беруть участь у роботі Міжнародної науково-практичної інтернет-конференції, 4521.97kb.
- Iii міжнародний семінар молодих учених «духовно-моральний аспект у технологізації навчально-виховного, 10.2kb.
- Національна академія наук України оголошує конкурс на здобуття премій молодих учених, 39.89kb.
Міністерство освіти і науки України
Львівський національний університет
імені Івана Франка
Кафедра аналітичної хімії
II науково-практичний семінар студентів, аспірантів і молодих учених
«Прикладні аспекти електрохімічного аналізу»
(програма та тези доповідей)
Присвячено 350 річчю від заснування Львівського університету
3-5 жовтня 2010 року
м. Львів
Оргкомітет семінару
Каличак Я.М. – професор, декан хімічного факультету – голова оргкомітету;
Дубенська Л.О. – доцент кафедри аналітичної хімії – заступник голови оргкомітету;
Пацай І.О. – доцент кафедри аналітичної хімії;
Врублевська Т.Я. – доцент кафедри аналітичної хімії;
Левицька Г.Д. – доцент кафедри аналітичної хімії;
Тимошук О.С. – доцент кафедри аналітичної хімії;
Ридчук П.В. – асистент кафедри аналітичної хімії;
Ридчук М.В. – аспірант кафедри аналітичної хімії;
Писаревська С.В. – аспірант кафедри аналітичної хімії;
Михалина Г.М. – аспірант кафедри аналітичної хімії;
Харчук Р.В. – аспірант кафедри аналітичної хімії.
Тези публікуються в авторській редакції за винятком мінімальних технічних поправок
ПРОГРАМА
II науково-практичний семінар студентів, аспірантів і молодих учених
«Прикладні аспекти електрохімічного аналізу»
3 жовтня 2010 р. (неділя)
з 14:00 до 20:00 Реєстрація учасників семінару (м. Львів, Львівський національний університет імені Івана Франка, хімічний факультет, вул. Кирила і Мефодія, 6/8)
4 жовтня 2010 р. (понеділок)
з 9:00 до 14:00 Реєстрація учасників семінару
14:00 Відкриття семінару (хімічний факультет, вул. Кирила і Мефодія 6/8, Ауд. №1 )
| 14:15 | Дубенська Л.О., Левицька Г.Д. | ВИКОРИСТАННЯ ОРГАНІЧНИХ РЕАГЕНТІВ ДЛЯ ВОЛЬТАМПЕРОМЕТРИЧНОГО ВИЗНАЧЕННЯ МЕТАЛІВ |
| 15:00 | Хома Р.Є., Чеботарьов О.М., Прохоренкова Р.С. | ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ АНТИОКСИДАНТНОЇ АКТИВНОСТІ РОСЛИННОЇ СИРОВИНИ |
| 15:15 | Ковалишин Я., Демидчук І. | Сумісне осадження поліпіролу та пруського синього на графітовому електроді |
| 15:30 | Панасюк Я.В., Янів З.І., Ахметшин А.Г. | ВИКОРИСТАННЯ АМПЕРОМЕТРІЇ ДЛЯ КІНЕТИЧНОГО І ТЕРМОДИНАМІЧНОГО ВИВЧЕННЯ ВЗАЄМОДІЇ ДДТК ІЗ Ni2+ ТА ЙОГО ВИЗНАЧЕННЯ |
| 15:45 – 16:30 СТЕНДОВА СЕСІЯ | ||
| 16:30 | Харчук Р.В., Тимошук О.С. | ВОЛЬТАМПЕРОМЕТРІЯ Ir(IV) У ПРИСУТНОСТІ 4-СУЛЬФОФЕНІЛ-[1-АЗО-2´]-1´,8´-ДИОКСИНАФТАЛІН-3´,6´-ДИСУЛЬФОКИСЛОТИ |
| 16:45 | Рабошвіль К.В., Єфімова І.С., Голобородько А.І., Чеботарьов О.М. | ПРО МОЖЛИВІСТЬ ВИЗНАЧЕННЯ МІКРОКІЛЬКОСТЕЙ Mn(VII) І Cr(VI) ПРИ ЇХ СУМІСНІЙ ПРИСУТНОСТІ З ВИКОРИСТАННЯМ 4-СУЛЬФО-2(4'-СУЛЬФОНАФТАЛІН-1'-АЗО)НАФТОЛУ-1 |
| 17:00 | Ридчук П.В., Тимошук О.С. | Визначення родію У промислових об’єктах методом вольтамперометрії з лінійною розгорткою потенціалу |
| 17:15 | Хома Р.Є., Шестака О.О., Гельмбольдт В.О. | ОЦІНКА ВІДНОСНОЇ СТІЙКОСТІ “ОНІЄВИХ” СУЛЬФІТІВ ЕТАНОЛАМІНІВ |
| 17:30 | Писаревська С.В., Дубенська Л.О., Левицька Г.Д. | ВОЛЬТАМПЕРОМЕТРИЧНЕ ВИЗНАЧЕННЯ ІОНІВ Ga(III) |
| 17:45 | Яцків О.С., Пацай І.О. | ЗМІННОСТРУМОВА АКТИВАЦІЯ АНАЛІТИЧНИХ РЕАКЦІЙ |
15:45 – 16:30 СТЕНДОВА СЕСІЯ
| 1 | Шестака О.О, Хома Р.Є., Гельмбольдт В.О | ЕЛЕКТРОПРОВІДНІСТЬ ВОДНИХ РОЗЧИНІВ АМІНОМЕТАНСУЛЬФОКИСЛОТИ |
| 2 | Куманьова М.О., Ткач В.І. | електрохімічні методи аналізу солей полігексаметиленгуанідіну |
| 3 | Волнянська О.В., Болотін О.В., Ткач В.І. | електрохімічні методи аналізу УРОТРОПІНУ В СУБСТАНЦІЇ ХАРЧОВОЇ ДОБАВКИ Е-239 |
| 4 | Панченко В.В., Толстенко Ю.В., Ткач В.І. | ЕЛЕКТРОХІМІЧНЕ ВИЗНАЧЕННЯ ТІОТРИАЗОЛІНУ |
| 5 | Галапач У. Р., Дійчук В. В., Волощук А. Г. | СУЛЬФІД-ЧУТЛИВІ ЕЛЕКТРОДИ НА ОСНОВІ СИСТЕМИ AgS-Hg3In2Te6. |
| 6 | Ротар Д.М., Білокопита Г.М., Волощук А.Г. | Дослідження електродно-активних властивостей Кальцій гідроксилапатиту |
18:00 – 19:00 ЗАГАЛЬНА ДИСКУСІЯ
ЗАКРИТТЯ СЕМІНАРУ
5 жовтня 2010 р. (вівторок)
ЕКСКУРСІЯ ПО ЛЬВОВУ
ВИКОРИСТАННЯ ОРГАНІЧНИХ РЕАГЕНТІВ ДЛЯ ВОЛЬТАМПЕРОМЕТРИЧНОГО ВИЗНАЧЕННЯ МЕТАЛІВ
Дубенська Л.О., Левицька Г.Д.
Львівський національний університет імені Івана Франка, кафедра аналітичної хімії
dubenskyy@gmail.com
Використання органічних реагентів розширює можливості вольтамперо-метричного аналізу, підвищуючи чутливість і селективність визначення металів, зокрема, неелектроактивних. Під неелектроактивними розумітимемо такі іони (сполуки), які не відновлюються на мікроелектродах на фоні індиферентних електролітів. Можливі випадки використання органічних реагентів у вольтамперометрії можна коротко узагальнити у такій схемі:
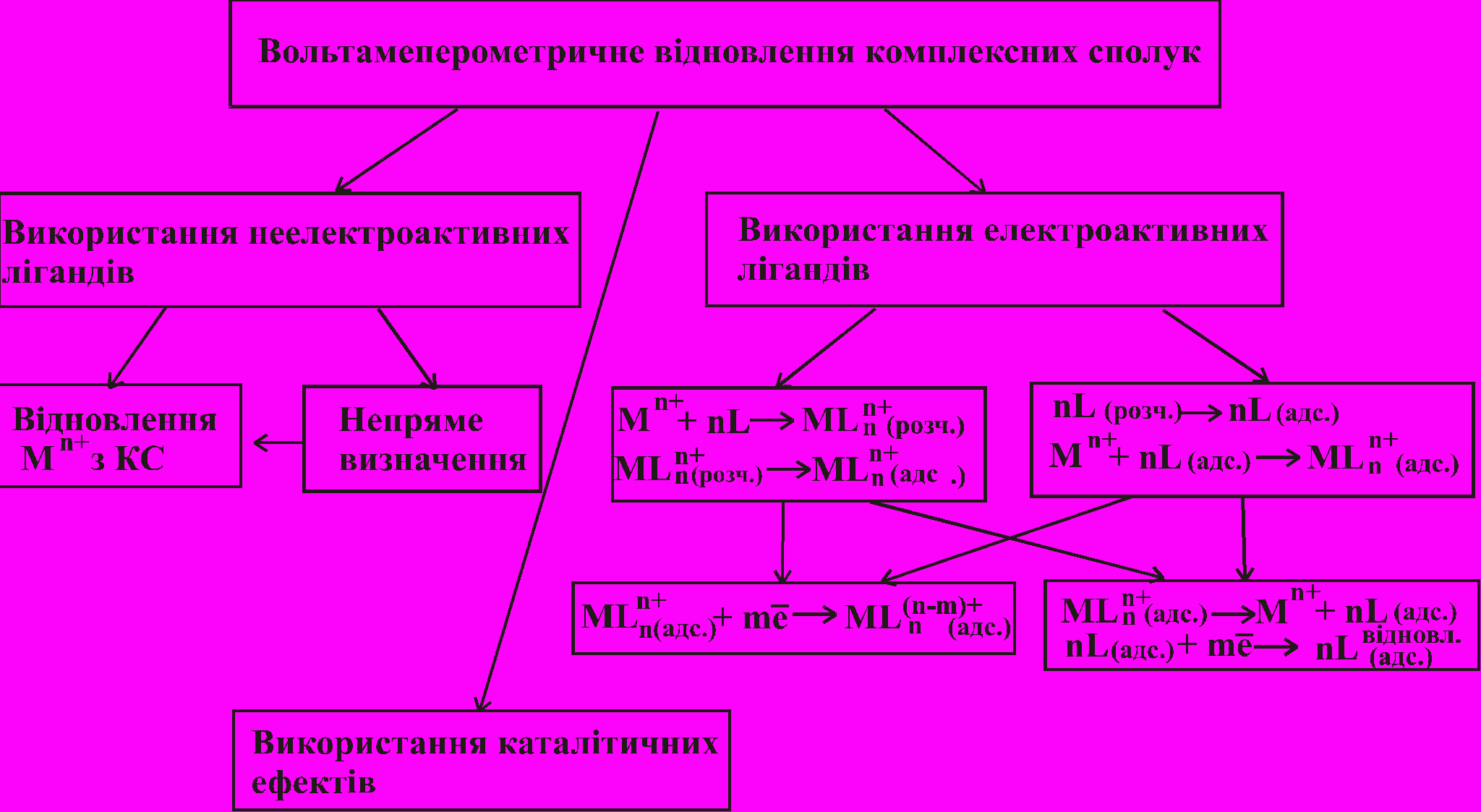
Використовуючи неелектроактивні реагенти можна визначати лише електро-активні метали (Cu, Ni, Eu, In тощо).
Особливий інтерес представляє використання електроактивних комплексуючих реагентів. Серед таких найбільш вивченою та перспективною виявилася група азобарвників. Особливості відновлення вільних азобарвників пов’язані зі структурною будовою молекул, а також зі зміною форм існування реагентів при зміні рН. У разі комплексоутворення з металами здебільшого виникають нові піки, зміщені катодно, порівняно з піками вільних реагентів. Доведено, що нові піки відповідають відновленню лігандів з комплексних сполук. На особливу увагу заслуговують системи Pd і Ga з еріохромом червоним В, Au і Ga з кальцесом, для яких додаткові піки виникають при потенціалах, позитивніших, ніж піки відновлення вільних азосполук. Є припущення, що ці піки пов’язані з відновленням центрального іона з комплексу.
Виникнення каталітичних ефектів характерне, здебільшого, для металів зі змінним ступенем окиснення (Eu, Mo, V) та для таких, які спричинюють каталітичне виділеня водню (Pt, Ru). Проте виникнення таких струмів у присутності електроактивних лігандів можна спостерігати не тільки у кислому середовищі, як зазвичай, а й у лужному (наприклад, для систем Pt з тропеоліном 0 чи арсеназо І).
Усі ці найрізноманітніші процеси відкривають широкі можливості для використання в аналізі, зокрема, для одночасного визначення декількох елементів з однієї проби. Нами розроблені методики одночасного полярографічного визначення Zr (Hf), Cu і Zn, Pd і Ni, In і суми РЗМ, In і Al.
ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ АНТИОКСИДАНТНОЇ АКТИВНОСТІ РОСЛИННОЇ СИРОВИНИ
Хома Р.Є., Чеботарьов О.М., Прохоренкова Р.С.
Одеський національний університет імені І.І. Мечникова
кафедра аналітичної хімії
rek@onu.edu.ua
Використання антиоксидантів (АО), речовин, що переривають радикально-ланцюгові процеси окислення в об'єктах органічного та неорганічного походження, одержало широке поширення останнім часом у різних областях хімії, біології й медицини. Одним із показників доброякісності рослинної сировини є її антиоксидантна активність (АОА)
У даній роботі як метод визначення АОА пропонується використовувати простий в апаратурному оформленні, експресний і високочутливий метод потенціометрії, що має більші потенційні можливості в області електроаналітичної хімії, дослідження властивостей біологічно активних речовин, розробки методів аналітичного контролю складних об'єктів з використанням в якості медіаторної системи Fe3+/Fe2+ [1]:
| aFe(III) + dAOred aFe(II) + dAOox | |
В якості електродної системи у даному методі використані платиновий та аргентум хлоридний електроди.
Вказана методика відрізняється експресністю процедури аналізу, відносно невисокою собівартістю необхідного обладнання. Межа визначення складає у водному розчині 3,510-6 моль/л. Потенціометричним методом у варіанті редоксиметрії оцінена
| АОА 55 об’єктів рослинної сировини (квіти, трава, овочі, фрукти, ягоди) Південного регіону України. Зроблена порівняльна оцінка між вмістом флавоноїдів в рослинній сировині та її антиоксидантною активністю (рис.). Невідповідність даних про вміст флавоноїдів в рослинній сировині та її антиоксидантної активності, ймовірно, пов’язано з тим, що антиоксидантна активність залежить не тільки від сумарного вмісту флавоноїдів у зразку, але і їх природи та присутності інших речовин фенольної будови в ній. Встановлено, що при оцінці якості рослинних зразків доцільно проводити паралельне визначення в ній суми біофлавоноїдів та їх антиоксидантної активності, тому що дані одного із вказаних показників не корелюють з даними іншого. |  Рис. Залежність АОА (ммоль/л) рослинної сировини від вмісту в ній флавоноїдів (Х, %). |
- Brainina Kh.Z., Ivanova A.V., Sharafutdinova E.N., Lozovskaya E.L., Shkarina E.I. Potentiometry as a method of antioxidant activity investigation // Talanta. – 2007. – V. 71. – P. 13–18.
ВОЛЬТАМПЕРОМЕТРІЯ Ir(IV) У ПРИСУТНОСТІ 4-СУЛЬФОФЕНІЛ-[1-АЗО-2´]-1´,8´-ДИОКСИНАФТАЛІН-3´,6´-ДИСУЛЬФОКИСЛОТИ
Харчук Р.В., Тимошук О.С.
Львівський національний університет імені Івані Франка
кафедра аналітичної хімії, хімічний факультет
e-mail: KharchukRoam@ukr.net
Вдосконалення технологій переробки та очистки природної та промислової сировини і вилучення платинових металів, вимагає поглиблення досліджень в галузі аналітичної хімії цих елементів. Незручності при аналізі платинових металів пов’язані з відбором великих проб, з попереднім розділенням та концентруванням, а також подібністю хіміко-аналітичних властивостей цих металів. Визначення також пов’язане із питанням економічного характеру, оскільки елементи платинової групи належать до дорогоцінних металів.
Останнім часом все інтенсивнішого розвитку набувають електрохімічні методи у зв’язку з недорогим обладнанням і новими шляхами вирішення підвищення чутливості та селективності методики, зокрема використанням органічних реагентів.
Попередньо нами досліджувалися електрохімічні властивості 4-сульфофеніл-[1-азо-2´]-1´,8´-диоксинафталін-3´,6´-дисульфокислоти (СФАНДС). На полярограмах спостерігався лише один пік відновлення барвника () в широких межах кислотності середовища (рН 1-12). Встановлено, що зі збільшенням рН середовища потенціал лінійно зсувався в катодну область з кутовим коефіцієнтом 54 мВ/рН, що вказує на участь іонів гідрогену в електрохімічному процесі. Величина аналітичного сигналу в межах кислотності середовища рН = 1-5 лінійно зростає з кутовим коефіцієнтом 0,43 мкА/рН. При рН = 5-6 величина сили струму залишається постійною. Максимальне значення аналітичного сигналу досягається при рН = 8. При подальшому зменшені кислотності середовища відбувається зменшення сили струму з кутовим коецієнтом 0,9 мкА/рН. Природу полярографічного струму досліджували за вдосконаленим критерієм Семерано, адсорбційна обмеження сили струму відновлення СФАНДС залишається суттєвим ку всьому інтервалі кислотності середовища.
При введенні у розчин цього барвника іонів Ir(IV) спостерігається поява нового піку, величина сили струму якого пропорційна концентрації металу. Пік існує у вузькому інтервалі рН = 4-5. На основі цього розроблено методику аналітичного визначення іридію(IV) з мінімальною концентрацією5,5*10-6 моль/л. Встановлено, що визначенню заважають іони інших платинових металів у співвідношенні 1:1. Тому використання даної методики на складних об’єктах є проблематичним.
ВИКОРИСТАННЯ АМПЕРОМЕТРІЇ ДЛЯ КІНЕТИЧНОГО І ТЕРМОДИНАМІЧНОГО ВИВЧЕННЯ ВЗАЄМОДІЇ ДДТК ІЗ Ni2+ ТА ЙОГО ВИЗНАЧЕННЯ
Панасюк Я.В., Янів З.І., Ахметшин А.Г.
Тернопільський національний педагогічний університет
імені Володимира Гнатюка, кафедра хімії
angel_dust.07@mail.ru
А
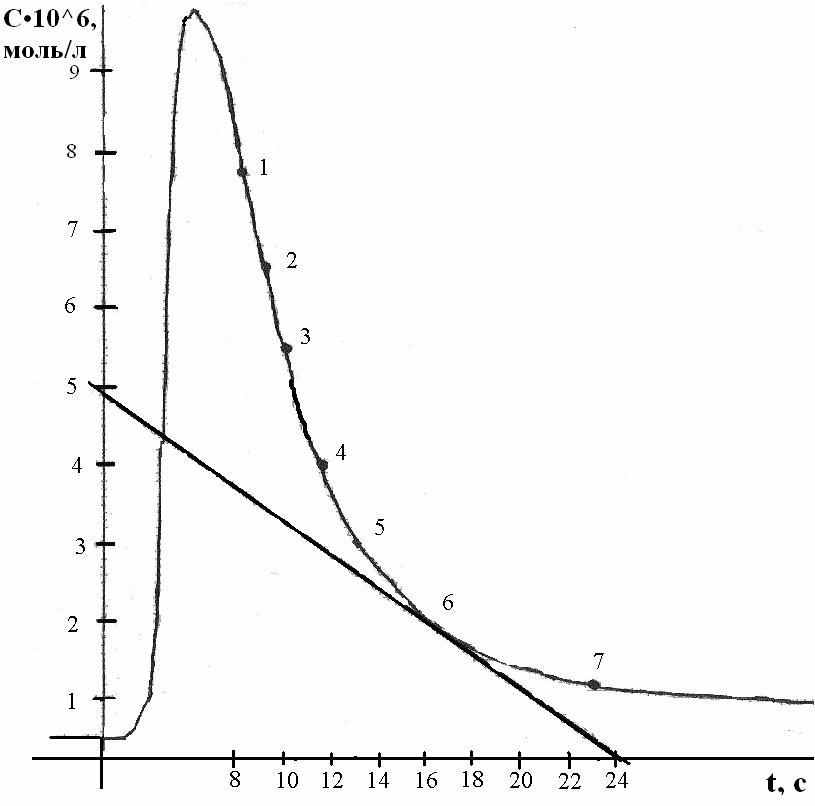 мперометричне титрування можна використовувати не тільки для визначення різних речовин в розчинах, але й для дослідження механізмів реакції, які відбуваються між цими компонентами. Нами була вивчена реакція взаємодії Ni2+ із диетилдитіокар-баматом натрію (ДДТК). Із цих двох компонентів системи тільки ДДТК є електродно активним при використанні даної електродної системи (графітовий та хлорсрібний електроди). Він окиснюється утворюючи хвилю при потенціалі 0,5 В і вище та площину дифузійного струму в цій області потенціалів. При даному потенціалі можна проводити амперометричне визначення катіонів важких металів з фіксуванням моменту еквівалентності за струмом окиснення ДДТК. При титруванні Ni2+ на кривій титрування спостерігається поступовий перехід від горизонтальної ділянки кривої до вертикальної ділянки залежності сили струму від об’єму доданого ДДТК. Відхилення цієї залежності від прямолінійності ми використовували для визначення добутку розчинності (ДР) (ДДТК)2Ni. В даній роботі для вивчення деяких характеристик процесів взаємодії Ni2+ із ДДТК, ми використовували новий, розроблений на кафедрі хімії ТНПУ ім. В.Гнатюка, метод амперодинамічного титрування, який полягає у вивченні залежності фрагментів кривих титрування, які отримують комбінацією дискретного способу додавання реагенту (0,05 мл 10-2 М ДДТК) і безперервного фіксування сили струму від часу за допомогою самопишучого потенціометра. Це дозволило визначити такі кінетичні характеристики реакції, як миттєва швидкість, порядок реакції за ДДТК, енергію активації, константу швидкості реакції. Це також дозволило знайти формальну рівноважну концентрацію ДДТК, яка необхідна для більш точного визначення ДР (ДДТК)2Ni. Амперометричне титрування Ni2+ ДДТК було використане для його визначення, отриманні задовільні результати.
мперометричне титрування можна використовувати не тільки для визначення різних речовин в розчинах, але й для дослідження механізмів реакції, які відбуваються між цими компонентами. Нами була вивчена реакція взаємодії Ni2+ із диетилдитіокар-баматом натрію (ДДТК). Із цих двох компонентів системи тільки ДДТК є електродно активним при використанні даної електродної системи (графітовий та хлорсрібний електроди). Він окиснюється утворюючи хвилю при потенціалі 0,5 В і вище та площину дифузійного струму в цій області потенціалів. При даному потенціалі можна проводити амперометричне визначення катіонів важких металів з фіксуванням моменту еквівалентності за струмом окиснення ДДТК. При титруванні Ni2+ на кривій титрування спостерігається поступовий перехід від горизонтальної ділянки кривої до вертикальної ділянки залежності сили струму від об’єму доданого ДДТК. Відхилення цієї залежності від прямолінійності ми використовували для визначення добутку розчинності (ДР) (ДДТК)2Ni. В даній роботі для вивчення деяких характеристик процесів взаємодії Ni2+ із ДДТК, ми використовували новий, розроблений на кафедрі хімії ТНПУ ім. В.Гнатюка, метод амперодинамічного титрування, який полягає у вивченні залежності фрагментів кривих титрування, які отримують комбінацією дискретного способу додавання реагенту (0,05 мл 10-2 М ДДТК) і безперервного фіксування сили струму від часу за допомогою самопишучого потенціометра. Це дозволило визначити такі кінетичні характеристики реакції, як миттєва швидкість, порядок реакції за ДДТК, енергію активації, константу швидкості реакції. Це також дозволило знайти формальну рівноважну концентрацію ДДТК, яка необхідна для більш точного визначення ДР (ДДТК)2Ni. Амперометричне титрування Ni2+ ДДТК було використане для його визначення, отриманні задовільні результати.Рис. 1. Фрагмент кривої амперодинамічного титрування
ВОЛЬТАМПЕРОМЕТРИЧНЕ ВИЗНАЧЕННЯ ІОНІВ Ga(III)
Писаревська С.В., Дубенська Л.О., Левицька Г.Д.
Львівський національний університет ім. І. Франка,
кафедра аналітичної хімії
pysarevska_s@yahoo.com
Ґалій належить до розсіяних елементів, середній вміст якого в земній корі становить 15 ppm. Елемент широко застосовують у різних галузях завдяки унікальним фізико-хімічним та напівпровідниковим властивостям. Ґалій використовується для виробництва легкоплавких сплавів та напівпровідників, його радіоактивні ізотопи застосовують для виявлення інфекцій та злоякісних утворень у людському організмі. Однак, роль ґалію у функціонуванні живих організмів ще не встановлена. Відомо, що деякі рослини (наприклад, лишайники) можуть акумулювати Ga при його концентрації в ґрунті вище 60 ppm. Отже, існує потреба в точних методах контролю вмісту Ga для одержання високоякісної продукції та розуміння взаємозв’язку між його концентрацією та функціонуванням живих організмів.
Використання високо чутливих фізичних методів (атомної абсорбційної спектрометрії, мас-спектрометрії з індуктивно-зв’язаною плазмою чи нейтронно-активаційного аналізу) є обмеженим через високу вартість апаратури та тривалість аналізу. Більшість спектрофотометричних методів є не достатньо чутливими та селективними. Альтернативою можуть бути відносно недорогі, експресні та достатньо чутливі вольтамперометричні методи.
Пік відновлення іонів Ga(ІІІ) в кислому середовищі на фоні неорганічних електролітів маскується піком відновлення іонів Н+. Вольтамперометричне визначення іонів Ga(III) за піком відновлення на фоні NH4Cl-NH3 є недостатньо чутливим (межа виявлення ~ 10-5 M). Відносно новим напрямом у визначенні неелектроактивних іонів металів є використання органічних комплексоутворюючих реагентів. Такий підхід дозволяє суттєво знизити межу виявлення та підвищити селективність аналізу. Відомі вольтамперометричні методики визначення іонів металів, що базуються на електрохімічному відновленні комплексних з органічними реагентами з межею виявлення до 10-12 M.
Ця робота присвячена розробці нових методик визначення іонів Ga(III) з використанням o,o'-дигідроксизаміщених азобарвників – калькону (КЛК) та кальцесу (КЛС), як комплексоутворюючих реагентів методом циклічної вольтамперометрії з лінійною розгорткою потенціалу.
Іони Ga(III) утворюють комплекси з КЛК та КЛС в межах pH від 2,4 до 7,5. Взаємодія супроводжується зміною забарвлення розчину і спектрів поглинання азобарвників при додаванні іонів Ga(III). Утворені хелати відновлюються на р.к.е. На вольтамперограмах КЛК та КЛС спостерігаються два нові піки. Висоти нових піків пропорційні концентрації іонів Ga(III).
Було встановлено робочі умови (межі рН, Сазобарвник, V (В/с), межі лінійності) для визначення іонів металу. Визначення іонів Ga(III) з КЛК та КЛС є достатньо чутливим, межа виявлення становить 1×10-6М та 5×10-7М відповідно.Також, досліджено вплив деяких катіонів та аніонів з метою застосування розроблених методик для аналізу реальних об’єктів. Запропоновані методики успішно використані для визначення Ga в модельних розчинах, ґалієвмісних сплавах та ґрунтах.
ПРО МОЖЛИВІСТЬ ВИЗНАЧЕННЯ МІКРОКІЛЬКОСТЕЙ Mn(VII) І Cr(VI) ПРИ ЇХ СУМІСНІЙ ПРИСУТНОСТІ З ВИКОРИСТАННЯМ 4-СУЛЬФО-2(4'-СУЛЬФОНАФТАЛІН-1'-АЗО)НАФТОЛУ-1
Рабошвіль К.В., Єфімова І.С., Голобородько А.І., Чеботарьов О.М.
Одеський національний університет імені І.І. Мечникова,
кафедра аналітичної хімії
alexch@ukr.net
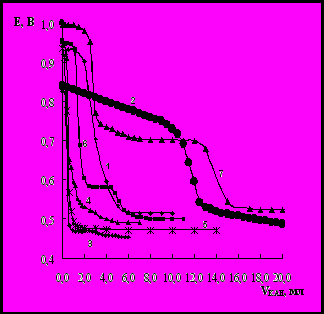
Рис. Редокс-метричне титрування суміші водних розчинів Mn(VII) і Cr(VI) водним розчином КАН (рН 2, t=20 0C) при різних співвідношеннях:
1–Mn:Cr=1:0, 2–Mn:Cr=0:1 (t=80 0C), 3–Mn:Cr=1:1, 4–Mn:Cr=1:5, 5 –Mn:Cr=1:10, 6 –Mn:Cr=5:1, 7 –Mn:Cr=10:1.
Відома велика кількість різноманітних методик визначення іонів металів ( М) з використанням органічних реагентів (ОР) різних класів. Особливий інтерес представляють азосполуки, що здатні при взаємодії з М у вищих ступенях окиснення, без введення допоміжних речовин або зовнішнього підведення потенціалу, виступати в якості відновника. До числа таких ОР, які є редокс-реагентами відноситься азобарвник 4-сульфо-2(4'-сульфонафталін-1'-азо)нафтол-1 (кармоазін - КАН), який пропонується для визначення Cr(VI), Hg(II), Ce(IV) та Mn(II) у вигляді Mn(VII). Однак, у літературі відсутня інформація про можливість визначення вказаних іонів М при їх сумісній присутності. В даній роботі досліджено взаємний вплив іонів Mn(VII) (Е0=1.51 В) і Cr(VI) (Е0=1.33 В) у водних розчинах (СМ = 1∙10-3 моль/л); зміну величини окисно-відновного потенціалу (ОВП) системи в цілому та положення точки еквівалентності (т.е.) при різних кратних співвідношеннях Mn:Cr. За результатами редокс-метричного титрування суміші розчинів Mn(VII) і Cr(VI) водним розчином КАН при рН 2 встановлена зміна величини ОВП редокс-системи. При цьому спостерігається і зміна кількості розчину КАН, яка витрачається на титрування, а також положення т.е. при різних співвідношеннях Mn:Cr. Так, при Mn:Cr = 1:0 — координати т.е. дорівнюють 0,68 В – 4 мл КАН; Mn:Cr = 0:1 — (0,62 В – 12 мл); Mn:Cr = 1:1 — (0,61 В – 1 мл); Mn:Cr = 1:5 — (0,61 В – 2 мл); Mn:Cr = 1:10 — (0,60 В – 1 мл); Mn:Cr = 5:1 — т.е.I (0,75 В – 1,5 мл) і т.е.II (0,55 В – 5 мл); Mn:Cr = 10:1 — т.е.I (0,86 В – 2,5 мл) і т.е.II (0,62 В – 14 мл).
Показано, що починаючи з 5-ти кратного надлишку іонів Mn(VII) до іонів Cr(VI), спостерігається значне підвищення загального ОВП системи, а також зміна положення т.е. і кількості КАН, що витрачається на титрування. При цьому, на потенціометричних кривих редокс-метричного титрування з’являється ще одна т.е.II (криві 6 і 7), що свідчить про можливість участі у редокс-взаємодії при 20 0С з КАН, як Mn(VII) – т.е.I, так і Cr(VI) – т.е.II. Таким чином, враховуючи більшу величину ОВП Mn(VII) порівняно з Cr(VI), можна зробити висновок, що присутність іонів Mn(VII) значно підвищує загальний ОВП редокс-системи і, як наслідок, сприяє окисно-відновній взаємодії іонів Cr(VI) з КАН без нагрівання, а також можливості визначення, як Mn(VII), так і Cr(VI) при їх сумісній присутності.
Визначення родію У промислових об’єктах методом вольтамперометрії з лінійною розгорткою потенціалу
Ридчук П.В., Тимошук О.С.
Львівський національний університет імені Івана Франка
кафедра аналітичної хімії
peter_rydchuk@yahoo.com
Присутність незначних кількостей родію у промислових об’єктах різного роду, зокрема, каталізаторах промислових синтезів, різноманітних деталях електроприладів, надає їм цінних, а подекуди унікальних властивостей. У зв’язку зі значним розширенням промислового застосування родію важливим завданням залишається його контроль в об’єктах різного характеру. Серед сучасних методів аналізу родію вольтамперометрія володіє одними з кращих хіміко-аналітичних характеристик.
Найчастіше вольтамперометричне визначення родію проводять за піками каталітичних струмів виділення водню (КСВ), проте ці методики не характеризуються високою селективністю щодо платиноїдів, здатних спричиняти КСВ: платини, іридію, рутенію та осмію. Тому головним завданням при розробці методик вольтамперометричного визначення родію є досягнення високої селективності, насамперед, щодо вказаних платиноїдів, оскільки вони найчастіше є супутніми складовими в об’єктах аналізу.
Як аналітичні реагенти для вольтамперометричного визначення родію в складних об’єктах нами запропоновані представники оксимового ряду: 5-(2-хлорфеніл)-фуран-2-карбальдегідоксим і 5-(4-хлорфеніл)-фуран-2-карбальдегідоксим; та наступні азобарвники: кислотний хромовий темносиній і саліциловий жовтий. Нами досліджено селективність розроблених методик та перевірено їх правильність на модельних розчинах.
Розроблені методики були успішно апробовані при встановлені вмісту родію у паладієво-родієвому каталізаторі та резисторі СП5-35Б. Проведені дослідження показали застосовність запропонованих методик визначення родію при аналізі складних об’єктів
ОЦІНКА ВІДНОСНОЇ СТІЙКОСТІ “ОНІЄВИХ” СУЛЬФІТІВ ЕТАНОЛАМІНІВ
Хома Р.Є.1,2, Шестака О.О.1, Гельмбольдт В.О.1,3
1Фізико-хімічний інститут захисту навколишнього середовища і людини
Міністерства освіти та науки України і НАН України
2Одеський національний університет імені І.І. Мечникова
3Одеський національний державний медичний університет
e-mail: rek@onu.edu.ua
Раніше [1, 2] в плані систематичних досліджень методів і засобів уловлювання SO2 органічними основами досліджено хемосорбцію оксиду сірки (IV) водними розчинами етаноламінів методами рН-, редокс- та кондуктометричного титрування. З використанням математичного моделювання розраховані компонентний склад систем “оксид сірки (IV) – етаноламіни – вода” в інтервалі температур 283 – 313 К та числові значення констант комлпексоутворення “онієвих” сульфітів [1, 2].
У даному повідомлені представлені виявлені з використанням даних [1, 2] кореляції між характеристиками рН-метричного титрування: висотою напівстрибка на інтегральній кривій (pH1/2), значенням максимуму на диференціальній кривій (dрН/dpQSO2), а також площею напівповерхні під максимумом на диференціальній кривій (S1/2) – і стійкістю (I) “онієвих” сульфітів етаноламінів (моно-, ди-, три-, метилмоно-, метилдиетаноламін) (рис. 1, 2).
 Рис. 1. Зв’язок висоти напівстрибка на інтегральній рН-метричній кривій титрування (pH1/2) з константою стійкості “онієвих” сульфітів етаноламінів (I). |  Рис. 2 Зв’язок площі напівповерхні під максимумом на диференціальній кривій (S1/2) з константою стійкості “онієвих” сульфітів етаноламінів (I). |
Виявлені кореляції дозволяють без проведення додаткових розрахунків з використанням даних рН-метричного титрування здійснювати якісну оцінку відносної стійкості “онієвих” сульфітів, що може виявитися корисним при розробці методів санітарного очищення повітря від оксиду сірки (IV), регенерації хемосорбентів і утилізації продуктів сорбції.
- Хома Р.Е., Шестака А.А., Гельмбольдт В.О. // Вопросы химии и хим. технологии. – 2009. – № 5. – С. 86-89.
- Шестака А.А. // Друга всеукраїнська наукова конференція студентів та аспірантів "Хімічні каразінські читання – 2010" Харків, 19-22 квітня 2010 р.
ЕЛЕКТРОПРОВІДНІСТЬ ВОДНИХ РОЗЧИНІВ АМІНОМЕТАНСУЛЬФОКИСЛОТИ
Шестака О.О.1 Хома Р.Є.1,2, Гельмбольдт В.О.1,3
1Фізико-хімічний інститут захисту навколишнього середовища і людини
Міністерства освіти та науки України і НАН України
2Одеський національний університет імені І.І. Мечникова
3Одеський національний державний медичний університет
e-mail: rek@onu.edu.ua
Аміносульфонові кислоти, зокрема амінометансульфонова кислота (АМСК), використовуються як компоненти буферних середовищ [1]. Сама АМСК відноситися до слабких кислот (pKa = 5,75). Розчинність АМСК у воді складає 0,22 моль/л при 25 0С
Згідно даних прямої рН-метрії із зростанням температури від 298 до 313 К кислотні властивості АМСК збільшуються (зростає ступінь її дисоціації). Причому, при 313 К рН досліджених водних розчинів АМСК змінюється злегка (2,30 ÷ 2,40). Судячи з результатів кондуктометричного дослідження системи АМСК – Н2О збільшення температури від 298 до 313 К супроводжується підвищенням електропровідності системи внаслідок зростання ступеня дисоціації електролітів і рухливості утворюваних іонів.
Дані з електропровідності водних розчинів АМСК, наведені в табл., представляють результат кореляційного аналізу залежності величини λ (Ом-1моль-1м2) від молярної концентрації АМСК в трьохпараметричній залежності за Шедловським (рівняння 1), що описує поведінку розчинів електролітів, і, для порівняння, за Онгазером (рівняння 2). При цьому визначені значення λ0 для всього робочого інтервалу температур (298 – 313 К).
| = B0 + B1C0,5 + B2C + B3C1,5 | (1) |
| = 0 + B1C0,5 | (2) |
Величини достовірності апроксимації (R2 ≥ 0,98) свідчать про задовільний характер кореляції за рівнянням Шедловського (1), а значення граничної електропровідності (λ0), чисельно дорівнює коефіцієнту В0 (за Шедловським), значно розходяться з такими, отриманими екстраполяцією на нульову концентрацію за Онзагером (таблиця).
Таблиця
Параметри рівняння Шедловського (1) та Онгазера (2) для водних розчинів АМСК. CАМСК = (1,0 9,0)10-3 моль/л; n = 9
| T, K | B0 | B1 | B2 | B3 | R2 | 0 |
| 298 | 951 | -37891 | 517722 | -2,010-6 | 0,990 | 203 |
| 303 | 344 | -10548 | 123564 | -4,910-6 | 0,991 | 138 |
| 308 | 850 | -33167 | 447506 | -2,010-6 | 0,980 | 196 |
| 313 | 576 | -19814 | 252850 | -1,010-6 | 0,989 | 193 |
Таким чином, отримане шляхом екстраполяції за Шедловським експериментального значення молярної електропровідності
АМСК λ0 = 951 Ом-1моль-1см2 при 298 К.
- Long R.D., Hiliard N.P., Chhatre S.A. Timofeeva T.V., Yakovenko A.A., Dei D.K., Mensah1 E.A. Comparison of zwitterionic N-alkylaminomethansulfonic acids to related compounds in the Good buffer series // Beilstein J. Org. Chem. – 2010. – V. 6, № 31. – doi:10.3762/bjoc.6.31
ЗМІННОСТРУМОВА АКТИВАЦІЯ АНАЛІТИЧНИХ РЕАКЦІЙ
Яцків О.С., Пацай І.О.
Львівський національний університет імені Івана Франка
кафедра аналітичної хімії
osyatskiv@yandex.ru
Реакції, що використовуються в аналітичній хімії, часто є доволі повільними за звичайних умов. Для їхньої активації використовують термічну обробку розчинів, дію ультразвуку, мікрохвильового та ультрафіолетового випромінювання. У цій праці описано новий ефективний метод активації аналітичних реакцій − дію змінним струмом. Вплив зміннострумової активації досліджували на прикладі реакції Сr(III) з хромазуролом S (САS). Установка для генерування змінного струму є генератором на базі напівмостового інвертора IR2153, що дозволяє пропускати крізь розчин струм з частотою 1...100 кГц та силою до 10 А (рис. 1).
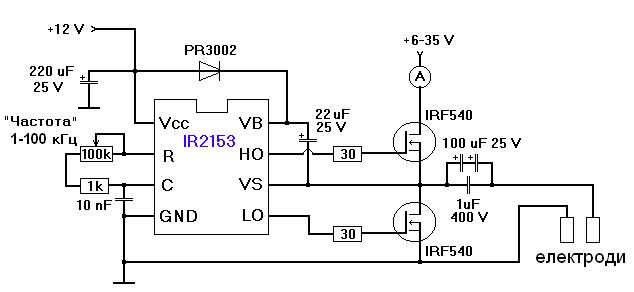
Рис. 1 Схема установки генератора змінного струму
Вивчено швидкість взаємодії Сr(III) з САS залежно від параметрів струму (частоти та сили струму). Здійснено порівняння зміннострумової активації та термічної обробки розчинів. Швидкість реакції контролювали спектрофотометрично за поглинанням продукту взаємодії.
Для досдідження впливу змінного струму у розчин, що містив усі необхідні для утворення продукту CrCAS компоненти, занурювали два прямокутні танталові електроди площею 5 см2, на які подавали змінну напругу з генератора. Початковий струм становив 0,3-0,4 А і поступово зростав до 0,5-0,7 А. Для підвищення електропровідності у розчини додавали NaCl (Cкін = 0,1 М). Для кількісного перебігу реакції Cr(III) з хромазуролом S за оптимальних концентраційних умов та рН середовища достатньою є 20-30 хв тривалість зміннострумової обробки.
Змінний струм призводить до нагрівання розчинів (tкін = 60-80оС), що є додатковим чинником пришвидшення реакцій. Порівнням термічної та зміннострумової активації реакцій за однакових температурних умов встановлено, що запропонований нами метод є значно ефективнішим.
Показано, що швидкість реакцій залежить від характеристик струму – насамперед його частоти та сили. Встановлено, що найоптимальнішим є діапазон частот від 15 до 75 кГц. Доцільно пропускати крізь розчин струм з максимально можливою за даних умов силою. Однак при цьому слід уникати закипання розчину. При використанні термічно нестійких реагентів потрібно забезпечити ефективний відвід тепла за допомогою активних радіаторів з примусовим охолодженням.
Знайдено оптимальні умови та запропоновано спектрофотометричний метод визначення Cr(ІІІ) за допомогою хромазуролу S з використанням зміннострумової обробки розчинів. Нижня межа визначуваних концентрацій становить 6·10-7 M хрому(ІІІ) у фотометрованому розчині.
електрохімічні методи аналізу солей полігексаметиленгуанідіну
Куманьова М.О., Ткач В.І.
ДВНЗ «Український державний хіміко-технологічний університет»
Солі полігексаметиленгуанідіну (ПГМГ) відносяться до групи поверхнево-активних антисептиків та широко використовуються в якості високоефективних біоцидних препаратів.
Згідно літературних даних найбільш поширеними методами визначення кількісного вмісту солей ПГМГ є фотометричні методи з використанням барвників еозину К або еозину Н та йоду. Методики засновані на вимірюванні оптичної густини іонного асоціату ПГМГ з барвником або його комплексу із йодом.
Оскільки існуючі методики мають ряд суттєвих недоліків при роботі із зразками промислової продукції, актуальною аналітичною проблемою є розробка альтернативних способів кількісного визначення солей полігексаметиленгуанідіну в промисловій продукції.
Використання електрохімічних методів є альтернативою існуючим методикам і дає можливість розробити нові прості та експресні способи кількісного визначення вмісту солей ПГМГ в промисловій продукції, що будуть відрізнятися достатніми аналітичними та метрологічними параметрами, простотою та невисокою вартістю обладнання.
Були розроблені методики кількісного визначення найбільш розповсюджених солей ПГМГ (фосфату, хлориду, глюконату) у субстанції та промисловій продукції методом амперометричного титрування за реакцією з 12-молібдофосфатною гетерополікислотою (МФК). На основі отриманих іонних асоціатів солей ПГМГ із МФК були сконструйовані іон-селективні електроди на ПГМГ та продукт його розкладу – гексаметилендіамін, де в якості електродноактивних речовин використані сполуки складу (ПГМГ)3РМо12О40 та (ГМДА)3(РМо12О40)2 відповідно.
Експериментально було вивчено вплив різних чинників на характеристики даного електроду (нахил електродної функції та інтервал лінійності визначуваних концентрацій ПГМГ та ГМДА у розчині) та визначені оптимальні умови проведення аналізу.
Отримані іон-селективні електроди були апробовані на модельних розчинах субстанції солей ПГМГ та розчинах зразків промислової продукції.
Сумісне осадження поліпіролу та пруського синього на графітовому електроді
І. Демидчук, Я. Ковалишин
Львівський національний університет імені Івана Франка,
вул. Кирила і Мефодія, 6, 79005 Львів, Україна
kovalyshyn@yahoo.com
При конструюванні амперометричних біосенсорів широко використовують ферменти, при взаємодії яких з субстратом утворюється пероксид водню. За кількістю утвореного пероксиду водню визначають кількість субстрату. Потенціал окиснення пероксиду водню досить високий. Тому перспективним є аналіз процесу електрохімічного відновлення пероксиду водню. Значний прогрес у створенні біосенсорів став можливий завдяки використанню в них так званих медіаторів або переносників електронів. Часто як медіатори використовують комплекси з центральним іоном перехідного металу, які можуть оборотно окиснюватись та відновлюватись і, відповідно, полегшувати перенесення електрона з субстрату до електрода, чи навпаки. З цією ж метою використовують також модифікацію поверхні електрода плівками електроактивних полімерів.
Для дослідження було вибрано як медіатори пруський синій (РВ) та поліпірол (pPy). Синтез pPy та РВ плівок на поверхні графітового електрода проводили методом циклічної вольтамперометрії (ЦВА). Плівку pPy наносили на поверхню графітового електрода з 0,01 М розчину піролу в 0,01 М HCl, при п’ятиразовому скануванні потенціалу в межах від – 0,40 до + 1,10 В (щодо насиченого хлорсрібного електрода). Полімеризація піролу починається при потенціалах, вищих за + 0,70 В. За потенціалів + 0,30 і + 0,05 В, відповідно, відбувається окиснення та відновлення поліпірольної плівки, струми цих процесів при повторних циклах сканування потенціалу практично не змінюються. Це свідчить про те, що електрохімічну активність виявляє лише частина полімерної плівки. Під час сканувань потенціалу товщина плівки і, відповідно, її електричний опір зростають, що підтверджується зменшенням струмів полімеризації.
Нанесення РВ на поверхню графітового електрода проводили з розчину 3∙10-3 М K3[Fe(CN)6] за наявності 3∙10-3 M FeCl3∙6H2O і 0,01 М HCl. За потенціалів + 0,23 та + 0,05 В відбувається, відповідно, окиснення та відновлення осадженого на поверхні РВ. Струми відповідного редокс-процесу в ході сканування потенціалу практично не змінюються.
Одночасне нанесення pPy і РВ проводили з розчину 3∙10-3 М K3[Fe(CN)6], 3∙10-3 M FeCl3∙6H2O, 0,01 М піролу і 0,01 М HCl. В цьому випадку простежується значне розширення піків та зростання струмів редокс-процесу. Зазначимо, що під час повторних циклів сканування потенціалу відбувається незначне зростання струмів та незначне зміщення потенціалів піків, що засвідчує добру електрохімічну активність осадженого покриття.
Як випливає з наведених результатів, модифікація поверхні графітового електрода шляхом сумісного осадження pPy і РВ дає змогу поліпшити медіаторні властивості системи. Такі покриття можна використати для конструювання біосенсорів, аналітичний відклик яких формується унаслідок відновлення пероксиду водню.
електрохімічні методи аналізу УРОТРОПІНУ В СУБСТАНЦІЇ ХАРЧОВОЇ ДОБАВКИ Е-239
Волнянська О.В., Болотін О.В., Ткач В.І.
ДВНЗ «Український державний хіміко-технологічний університет»
Уротропін, як харчова добавка Е-239, відноситься до консервантів, які здатні збільшувати строк зберігання харчових продуктів шляхом захисту їх від мікробіологічного псування. Додавання консервантів до їжі уповільнює розвиток мікрофлори: бактерій, пліснявих грибів, дріжджів та інших мікроорганізмів, внаслідок чого продовжує строк зберігання продуктів. Їх ефективність, способи застосування залежать від хімічної природи, концентрації, від рН середовища. Інші області застосування уротропіну: у якості консерванту у косметиці (не більше 0,15%), дезінфікуючого засобу для шкіри (13%-ї мазі), для дезінфекції сечовивідних шляхів (таблетки по 0,5–1,0 г), проти вугрів (таблетки по 0,5–1,0 г).
В даній роботі проведено аналітичний моніторинг визначення вмісту уротропіну в субстанції харчової добавки Е-239 іонометричним методом за допомогою іонселективних електродів, чутливих до органічного катіона уротропіну. Значно полегшує вирішення цієї задачі використання як аналітичних реагентів гетерополіаніонів (ГПА) структури Кеггіна, які мають унікальні властивості (сталий склад, іонообмінна та окисно-відновна здатність) і можуть утворювати стійкі асоціати з органічними нітрогеновмісними катіонами, для яких характерна мала розчинність у воді і значна – в органічних розчинниках, що вигідно відрізняє їх від традиційних органічних протиіонів електродноактивних речовин (ЕАР) при розробці іоноселективних електродів (ІСЕ).
Дослідження електрохімічних характеристик розробленого іоноселективного електроду, оборотного до органічного катіона уротропіну дозволило визначити оптимальні параметри і умови функціонування ІСЕ, врахувати особливості хімічної поведінки досліджуваних речовин і розробити просту в виконанні та експресну (5–7 хв) методику іонометричного визначення уротропіну в субстанції харчової добавки Е-239.
Експериментально було вивчено вплив різних чинників на характеристики даного електроду (нахил електродної функції та інтервал лінійності визначуваних концентрацій уротропіну у розчині) та величину pH досліджуваного розчину.
СУЛЬФІД-ЧУТЛИВІ ЕЛЕКТРОДИ НА ОСНОВІ СИСТЕМИ
AgS-Hg3In2Te6.
Галапач У. Р., Дійчук В. В., Волощук А. Г.
Чернівецький національний університет імені Юрія Федьковича
кафедра аналітичної хімії
v_diychuk@ukr.net
Іонселективні електроди активно використовуються для аналізу і контролю об’єктів довкілля. Інтенсивне антропогенне забруднення навколишнього середовища потребує суттєвого розширення асортименту електродно-активних матеріалів, серед яких перспективними є напівпровідники.
В роботі досліджено можливість використання радіаційно стійкої напівпровідникової сполуки Hg3In2Te6, як компонента електродно-активної матриці сульфід-селективного електроду.
Порошок Hg3In2Te6 одержували шляхом подрібнення кристалів, вирощених методом Бріджмана. Порошки хімічно осаджено Ag2S та Hg3In2Te6 добре розтирали в агатовій ступці. З одержаної суміші пресували зразки прямокутної форми, розмірами /1*1*10 мм/ при навантаженні 7 т/см2. Частину зразків піддавали відпалу у вакуумі протягом 5 год. при температурі відпалу 4100С. У якості електродів використовували 2 серії зразків: не відпалені і відпалені.
Узагальнення та аналіз одержання кінетичних Е=f(τ) кривих показує: 1) стаціонарні значення потенціалу для відпалених електродів досягаються за 4-5хв; 2) для невідпалених зразків стаціонарний потенціал встановлюється протягом 60 хв; 3) попередня обробка зразків впливає на хід кінетичних кривих: для невідпалених зразків електродний потенціал з часом зростає, а для відпалених, навпаки, зменшується.
Встановлено, що із збільшенням концентрації домішки Hg3In2Te6 в Ag2S-матриці час досягнення стаціонарних значень потенціалу зростає. Дане явище може бути зумовлене тим, що введення домішки Hg3In2Te6 значно підвищує адсорбційну активність поверхні електроду.
Проведені дослідження показали, що невідпалені електроди характеризуються нестабільними значеннями електродного потенціалу та поганою відтворюваністю результатів.
Встановлено, що підвищення концентрації сульфід-іонів у розчині приводить до зменшення електродного потенціалу досліджуваних зразків. При збільшенні вмісту домішки Hg3In2Te6 знижується чутливість електродів до зміни концентрації сульфідів, але розширюється інтервалу концентрації, в якому хід кривих Е=f(pS) має лінійний характер.
ЕЛЕКТРОХІМІЧНЕ ВИЗНАЧЕННЯ ТІОТРИАЗОЛІНУ
Панченко В.В., Толстенко Ю.В., Ткач В.І.
ДВНЗ «Український державний хіміко-технологічний університет»
vika_panchenko@mail.ru
Проведено комплексні дослідження взаємодії органічного катіону лікарського засобу тіотриазоліну з гетерополіаніонами (ГПА) структури Кеггіна РМо12О403– інструментальними методами аналізу.
Тіотриазолін має широкий спектр біотерпапевтичної активності. Він проявляє дардіопротекторну, антиаритмічну, гепатопротекторну, церебропротекторну, антиоксидантну, протиішемічну, протизапальну, імуномодулюючу дію.
Найбільш поширеними методами кількісного визначення цих лікарських засобів є хроматографічні методи. Основним недоліком цих методів є складність та висока вартість обладнання і реагентів, а також довготривалість аналізу. Таким чином, актуальною аналітичною проблемою є розробка нових альтернативних методик кількісного визначення тіотриазоліну, які відзначаються необхідними аналітичними та метрологічними параметрами, експресністю та простотою обладнання.
Досліджена взаємодія органічного катіону лікарського засобу тіотриазоліну з ГПА структури Кеггіна РМо12О403–, що дає змогу використовувати дану реакцію як аналітичну в амперометричному титруванні, а малорозчинний продукт цієї реакції з іонно-асоціативним характером зв’язку між ГПА і органічним катіоном – як електродноактивну речовину пластифікованих мембран при розробці іоноселективних електродів, оборотних до визначуваного органічного катіону тіотриазоліну. Методом амперометричного титрування підтверджено співвідношення макрочасток реагуючих речовин.
Було вивчено вплив різних чинників на характеристики даних електродів (нахил електродної функції та інтервал лінійності визначуваних концентрацій іонів тіотриазоліну у розчині) та визначені оптимальні умови проведення аналізу: величина рН досліджуваного розчину; природа розчинника пластифікатора для мембрани; природа електродноактивної речовини; умови отримання іонного асоціату для електродноактивної речовини.
Розроблені методики амперометричного та прямого потенціометричного визначення гідрохлоридних солей тіотриазоліну в лікарських субстанціях, які відрізняються чутливістю (10-5 моль/л), селективністю, експресністю, відсутністю коштовного обладнання і складних етапів пробопідготовки.
Дослідження електродно-активних властивостей
Кальцій гідроксилапатиту
Ротар Д.М., Білокопита Г.М., Волощук А.Г.
Чернівецький національний університет імені Юрія Федьковича
v-diychuk@ukr.net
Гідроксилапатит кальцію (ГОА) формули
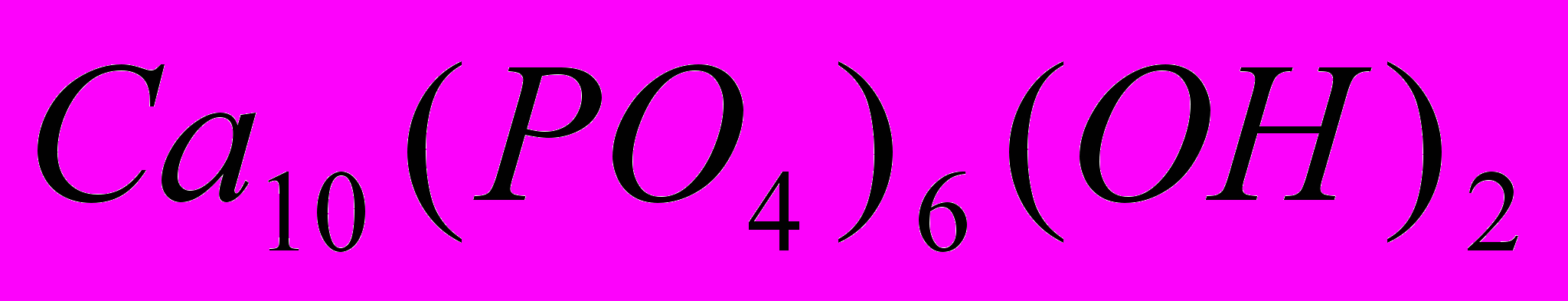 володіє іонною провідністю і характеризується добутком розчинності
володіє іонною провідністю і характеризується добутком розчинності 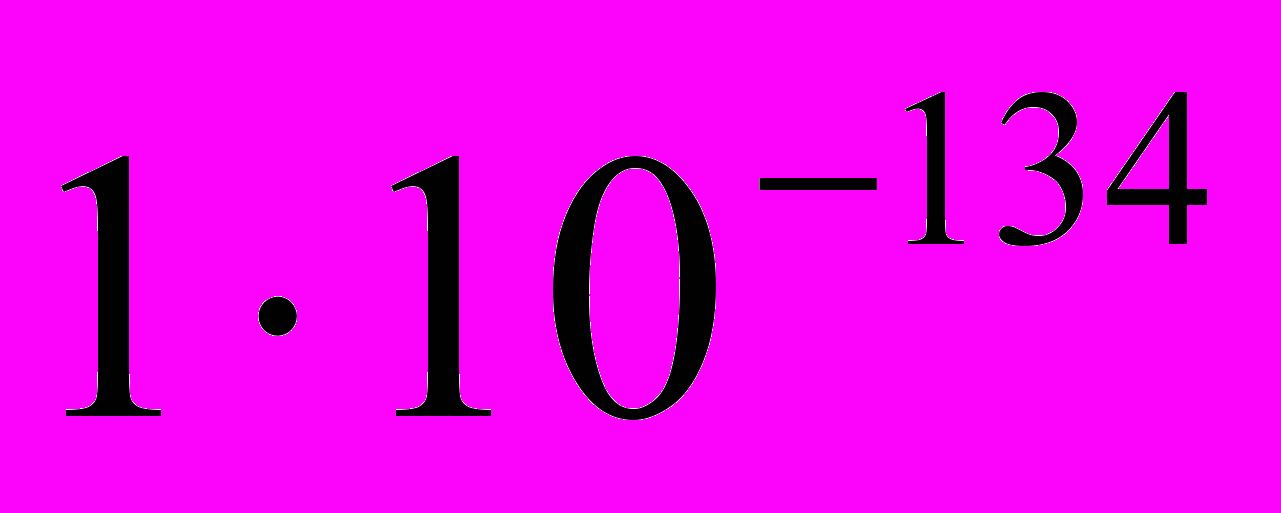 , що робить його перспективним електродно-активним матеріалом. ГОА досить просто одержується з доступних вихідних речовин і є абсолютно не токсичним, оскільки широко використовується в медицині, як біосумісний імплантант.
, що робить його перспективним електродно-активним матеріалом. ГОА досить просто одержується з доступних вихідних речовин і є абсолютно не токсичним, оскільки широко використовується в медицині, як біосумісний імплантант.Враховуючи зазначені властивості ГОА, в цій роботі представлені результати по дослідженню можливості використання його в якості електродно-активної речовини для мембран іон-селективних електродів. Були виготовлені електроди двох типів: електрод з пластифікованою мембраною та електрод дротинкового типу.
Встановлено, що потенціал пластифікованого ГОА-електроду виявляє лінійну залежність від концентрації іонів
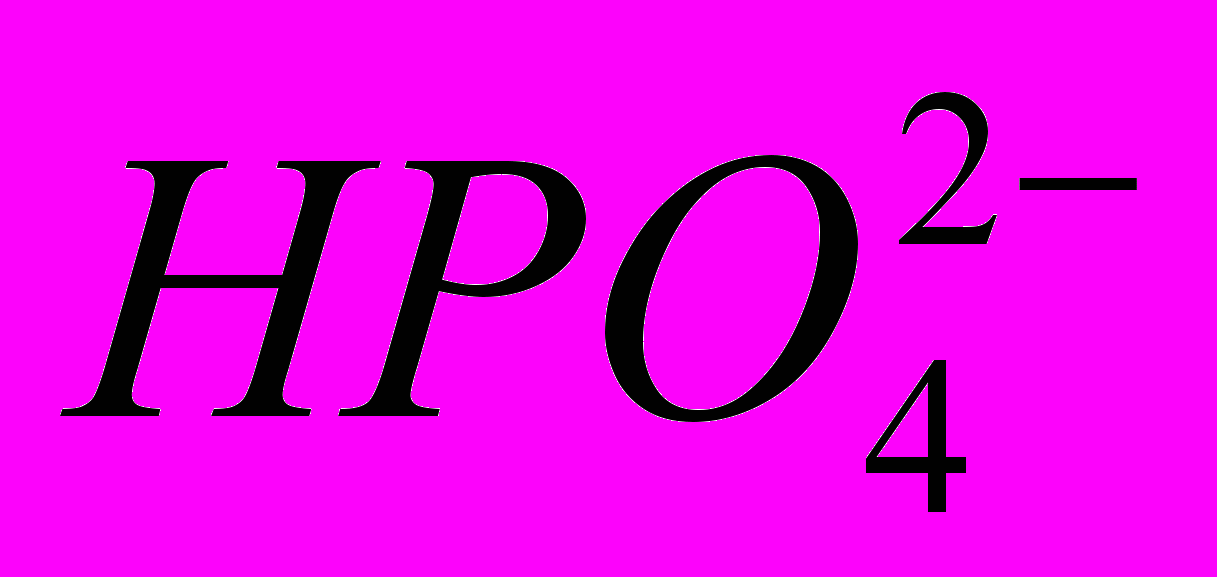 в інтервалі концентрацій від 2·10-5 до 1·10-1 моль/дм3, яка описується рівнянням:
в інтервалі концентрацій від 2·10-5 до 1·10-1 моль/дм3, яка описується рівнянням: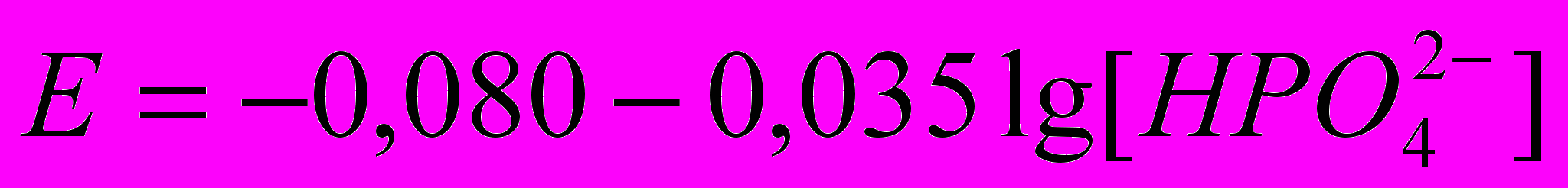 .
.Отже, потенціал пластифікованого ГОА-електроду виявляє практично теоретичну залежність від концентрації іонів
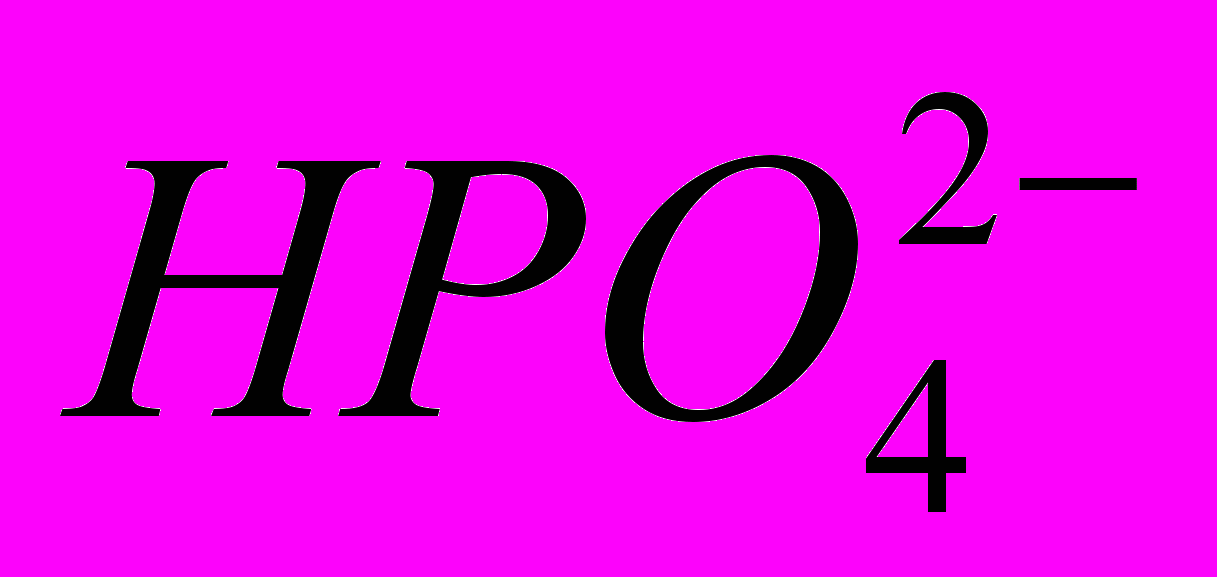 в інтервалі 2·10-5 до 1·10-1 моль/дм3. Нижня границя визначення іонів
в інтервалі 2·10-5 до 1·10-1 моль/дм3. Нижня границя визначення іонів 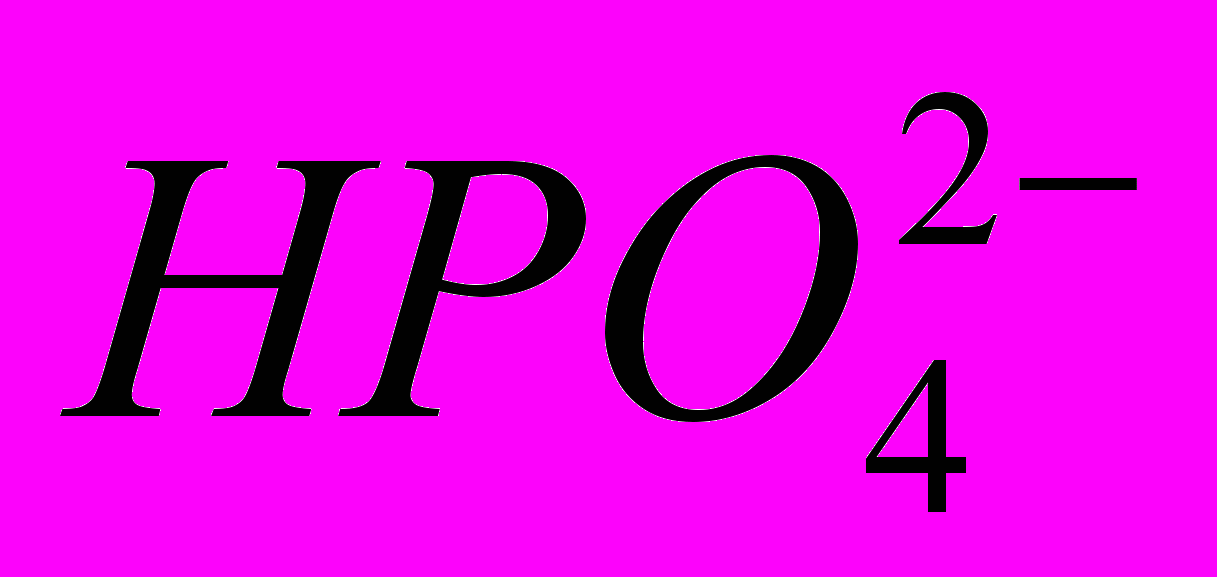 становить 8·10-6 моль/ дм3. При концентраціях іонів
становить 8·10-6 моль/ дм3. При концентраціях іонів 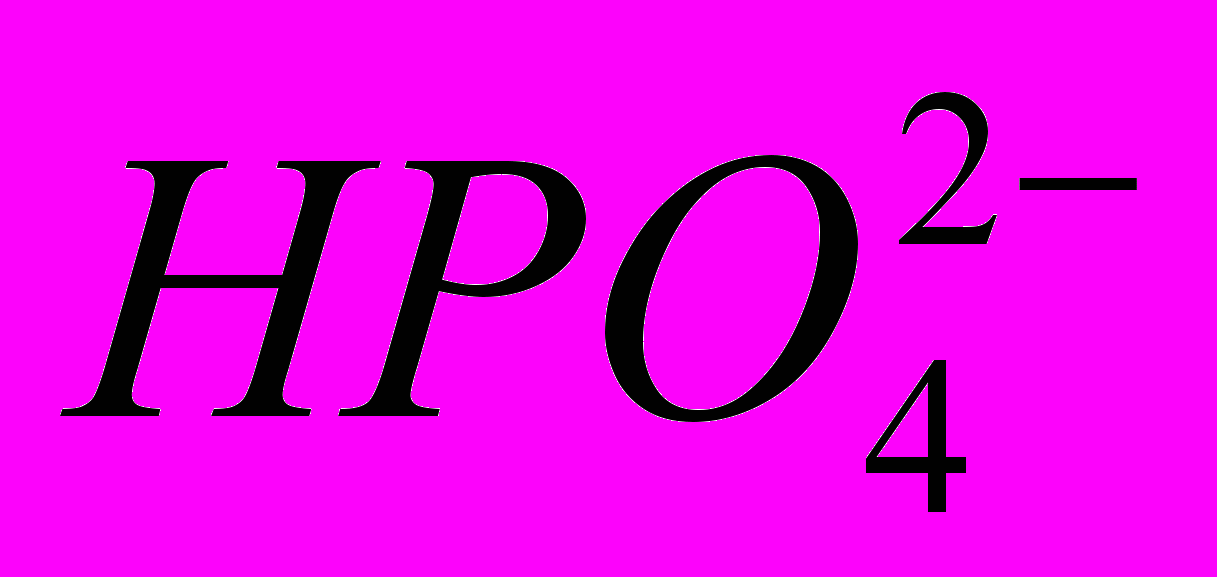 вище 0,1 моль/ дм3 залежність відхиляється від лінійності.
вище 0,1 моль/ дм3 залежність відхиляється від лінійності.Проведені дослідження показали, що ГОА-електрод дротинкового типу є чутливим до зміни концентрації іонів
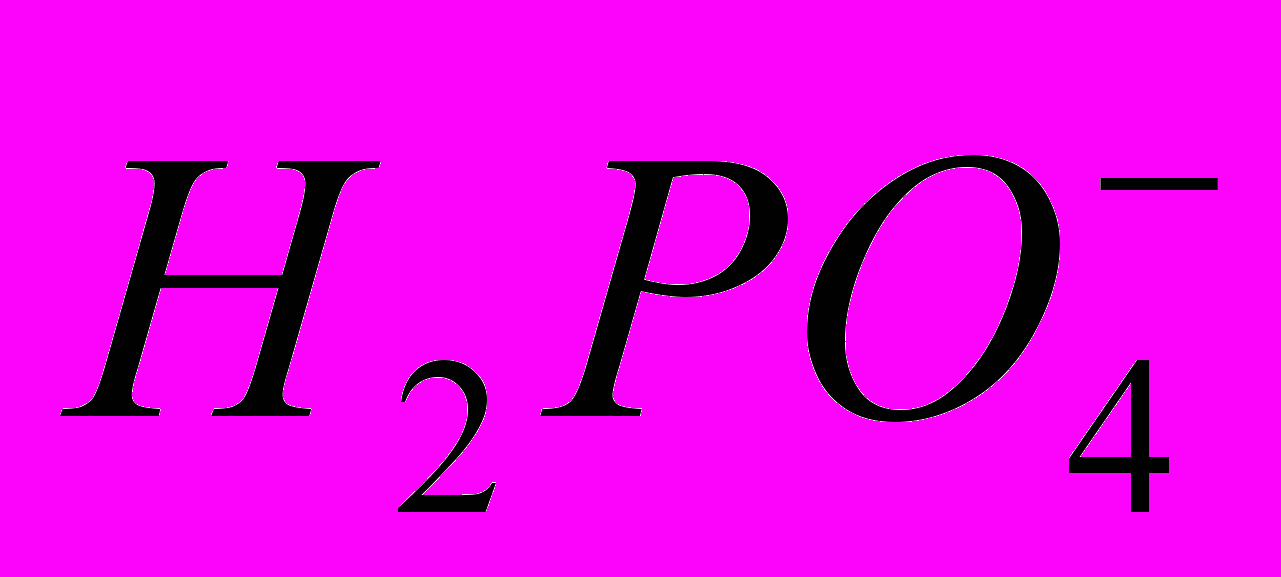 . В інтервалі концентрацій 1·10-4 - 1·10-1 моль/ дм3 ця залежність описується рівнянням:
. В інтервалі концентрацій 1·10-4 - 1·10-1 моль/ дм3 ця залежність описується рівнянням: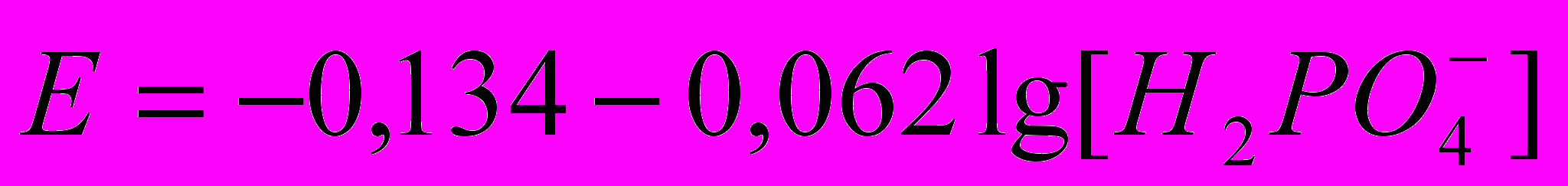 .
.Таким чином, розроблений нами дротинковий ГОА-електрод можна вважати як селективний електрод на іони
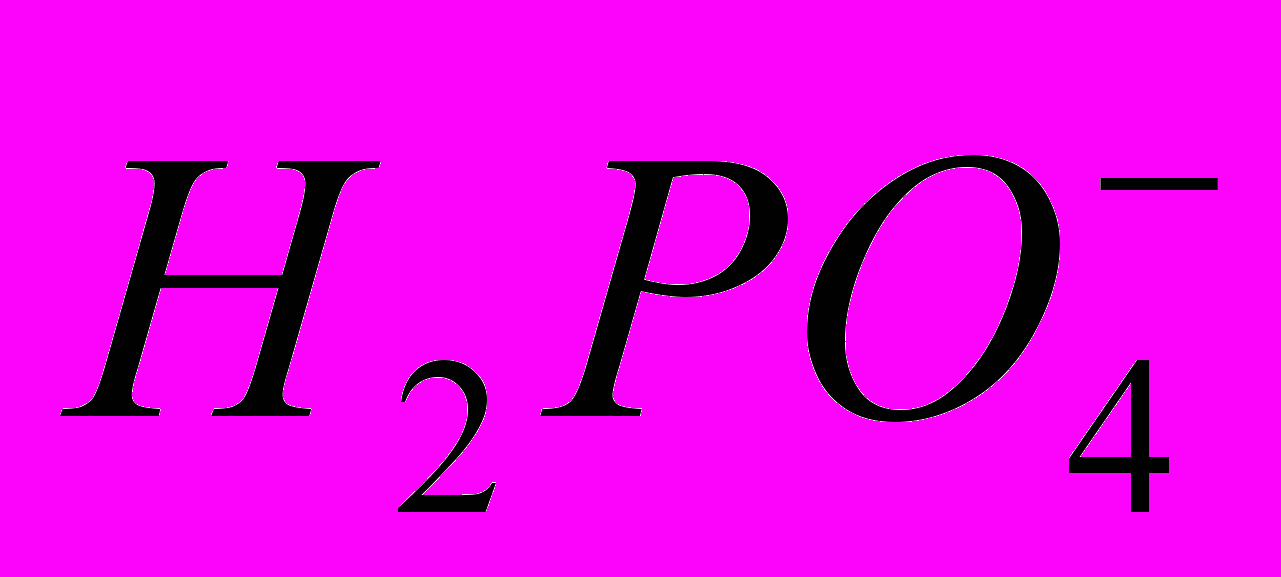 , який володіє такими метрологічними характеристиками:
, який володіє такими метрологічними характеристиками:- інтервал визначуваних концентрацій – від 1·10-4 - 1·10-1 моль дм3/;
- визначуваний мінімум – 6,3·10-5 моль/ дм3.
