«сучасні методи експрес аналізу органічних речовин» Виконав манжос о. В зміст
| Вид материала | Документы |
- «Визначення ступеню дисоціації електроліту методом кріоскопії» Виконав манжос, 284.4kb.
- Предмет, завдання та методи хімії, 223.71kb.
- Зміст, 3842.84kb.
- Обмін речовин, 61.95kb.
- Сучасні інформаційні технології та інноваційні методи навчання у вивченні англійської, 93.41kb.
- Зміст, 545.05kb.
- Затверджено постановою президії вак україни від 10. 11. 1999, 17.49kb.
- Програма для вступних іспитів на кваліфікаційний рівень «Спеціаліст», «магістратр», 720.85kb.
- Правила поводження з реактивами Виконання хімічного експерименту вимагає уваги, зосередженості,, 136.78kb.
- Програма підготовки учнів до ІІ (районного/міського) етапу Всеукраїнських учнівських, 88.82kb.
ВИЯВЛЕННЯ СПИРТІВ, ФЕНОЛІВ, ЄНОЛІВ
Ці речовини мають характеристичні смуги поглинання в ІЧ-спектрі. [9, с. 421-425]
Сполуки з гідроксильними групами дають з розчином церійамоній нітрату забарвлені комплекси. За реакцією з хлоридом заліза(ІІІ) єноли і феноли можна відрізнити від спиртів.
Реакція з церійамонійнітратом
Речовини, розчинні у воді. 0,5 мл розчину реагенту розбавляють 3 мл води і додають 5 крапель концентрованого водного розчину речовини.
Речовини, нерозчинні у воді. До 0,5 мл розчину реагенту додають 3 мл діоксану, потім по краплях воду до отримання прозорого розчину і після цього п'ять крапель концентрованого розчину аналізованої речовини в діоксані.
У присутності спиртів з'являється червоне забарвлення. Феноли у водному розчині дають зеленувато-коричневий або коричневий осад, а в діоксані — темно-червоне або коричневе забарвлення.
Обмеження: реакція дає однозначний результат в разі сполук, що містять не більше 10 атомів вуглецю; в разі більшої кількості атомів вуглецю забарвлення дуже слабке. Багатоатомні спирти також можно виявити цим методом, проте з-за окислення забарвлення може швидко зникнути. Позитивну реакцію дають багато амінів, а також інші речовини, що легко окислюються з утворенням забарвлених продуктів.
Реакція з хлоридом заліза(ІІІ)
1 краплю речовини розчиняють в 5 мл етанолу і додають 1—2 краплі 1%-вого водного розчину хлориду заліза(ІІІ).
При позитивній реакції з'являється забарвлення (від криваво-червоної до волошкової у аліфатичних єнолів і від синьої до фіолетової у фенолів).
Обмеження: позитивна реакція вказує на присутність фенолів або єнолів. Більшість оксимів і гідроксамових кислот дають червоне забарвлення, гідроксіпохідні хіноліну і піридину — червоно-коричневе, сине або зелене. Взаємодія з гідроксіпохідними ароматичних гетероциклів також призводить до червоного забарвлення. При реакції з амінокислотами і ацетатами виходить коричневе або червоне забарвлення відповідно, з дифеніламіном — зелене. Багато фенолів не дають цієї кольорової реакції.
Реакція з солями міді(ІІ)
Багатоатомні спирти утворюють з іонами міді(II) комплекси, особливо в лужному середовищі.
5—6 крапель речовини розчиняють в розбавленому розчині лугу і додають декілька крапель дуже розбавленого розчину сульфату міді.
Якщо осад гідроксиду міді не утворюється, то, ймовірно, присутній багатоатомний спирт.
Реакція з солянокислим розчином хлориду цинку (реактивом Лукаса)
Первинні, вторинні і третинні спирти можна відрізнити один від одного за різною швидкостю заміщення гідроксильної групи на хлорид-іон.
До 1 мл речовини швидко додають 6 мл реактиву Лукаса, суміш струшують, залишають на 5 хв і оцінюють результат.
Первинні спирти, що мають до 5 атомів вуглецю, розчиняються. Часто розчин темнішає, але залишається прозорим.
Вторинні спирти спочатку дають прозорий розчин, проте він швидко стає каламутним, а потім віділяються крихітні крапельки хлориду.
В разі третинних спиртів швидко утворюються дві фази, однією з яких є хлорпохідне.
Обмеження: оскільки проба Лукаса пов'язана з утворенням нерозчинних хлорпохідних, вона може бути застосована лише для тих спиртів, які дають прозорий розчин в реактиві. Алліловий спирт поводиться як вторинний спирт.
Взаємодія з реактивом Деніже[6, с. 151]
Третинні і деякі вторинні спирти легко дегідратуються концентрованою сірчаною кислотою. Олефіни, що утворюються при цьому дають жовті або червоні осади з іонами ртуті.
До 3 мл реактиву Деніже додають декілька крапель досліджуваної речовини і кип'ятять 1—3 хв.
Третинні спирти утворюють осад жовтувато-червоних тонів. В разі первинних і особливо вторинних спиртів також інколи утворюються осади, проте останні в більшості випадків не забарвлені. Складні ефіри третинних спиртів можуть зазнавати гідролізу при дії реагенту, а потім вже давати позитивну реакцію. Тіофен випадає у вигляді комплексу.
ЙОДОФОРМНА РЕАКЦІЯ (РЕАКЦІЯ З ГИПОЙОДІТОМ НАТРІЮ)
Обмеження: позитивну йодоформну реакцію дають сполуки наступних типів: [2, с. 304] [15, с. 254]
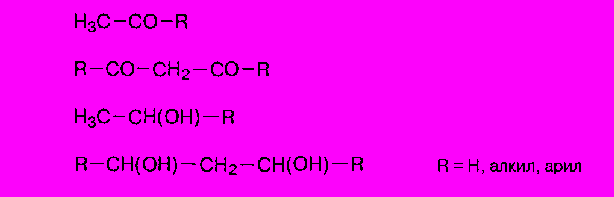
Не дають йодоформної реакції сполуки

ВИЯВЛЕННЯ СПОЛУК, ЩО ЗАЗНАЮТЬ ГІДРОЛІЗУ ПІД ДІЄЮ ЛУГУ
Реакція із спиртовим розчином лугом (проба Рояна)
0,1 г речовини розчиняють в 3 мл спирту, додають 3 краплі спиртового розчину фенолфталеїну і 0,1 н. спиртовий розчин гідроксиду натрію до появи червоного забарвлення. Потім нагрівають 5 хв на водяній бані при
40 °С.
Якщо червоне забарвлення зникає, реакцію вважають позитивною. Для більшої надійності дослід повторюють декілька разів, додаючи до однієї і тієї ж суміші нові порції лугу.
Позитивну реакцію дають складні ефіри, лактони, ангідриди, галогенопохідні, що легко зазнають гідролізу, аміди, нітрили.
Обмеження: вільні кислоти перед виконанням досліду повині бути нейтралізовані. Пробі можуть заважати дикетони, що розщеплюються, або речовини, що легко осмоляються і диспропорціонують.
Реакція з гідроксиламіном (гідроксамова проба)
Основою гідроксамової проби є аміноліз похідних карбонових кислот під дією гідроксиламіну.
До 0,5 г речовини додають 1 мл 0,5 н. спиртового розчину гідрохлориду гідроксиламіну і 0,2 мл 6 н. розчину гідроксиду натрію. Суміш нагрівають до кипіння, охолоджують, додають по краплях 2 мл 1 н. соляної кислоти. Якщо суміш стає каламутною, додають 2 мл етанолу. При додаванні 1—2 крапель 5%-вого водного розчину хлориду заліза (ІІІ) при позитивній реакції з'являється забарвлення (від темно-червоного до фіолетового). Якщо забарвлення нестійке, необхідно додати більшу кількість хлориду заліза (ІІІ).
З галогеновмістних сполук реакцію дають лише ацилгалогеніди та гемінальні тригалогеніди.
