Электрохимическое осаждение композиционных покрытий на основе никеля и меди: кинетические закономерности и свойства осадков
| Вид материала | Закон |
- Д. т н. Елагина О. Ю., Слободянников Б. А., Буклаков А. В. Ргу нефти и газа им., 103.59kb.
- «строение молекул 4-фтор и 3,4-дифторанизола, N,N’-этиленбис(салицилаль- и ацетилацетон-, 369.09kb.
- Структура и защитные свойства алюминидных покрытий на нержавеющей стали, 19.79kb.
- Строение и магнитные свойства координационных соединений меди(II) и никеля(II) с некоторыми, 187.43kb.
- Химическое осаждение никеля с цинком, вольфрамом, молибденом и марганцем, 248.09kb.
- Кулаковская Светлана Ивановна, Куликов А. В., Шестаков А. Ф. Электрохимическое и эпр, 67.34kb.
- Кафедра: ти-6 «материаловедение и технология материалов и покрытий», 107.44kb.
- Carboweld 625 Стандарты, 41.02kb.
- Вопросы к экзамену по дисциплине «поверхностные явления и дисперсные системы», 37.35kb.
- Термодинамика протолитических и координационных равновесий l-аланина, D,L -триптофана,, 330.9kb.
На правах рукописи
ЦЕЛУЙКИН ВИТАЛИЙ НИКОЛАЕВИЧ
ЭЛЕКТРОХИМИЧЕСКОЕ ОСАЖДЕНИЕ КОМПОЗИЦИОННЫХ ПОКРЫТИЙ НА ОСНОВЕ НИКЕЛЯ И МЕДИ: КИНЕТИЧЕСКИЕ
ЗАКОНОМЕРНОСТИ И СВОЙСТВА ОСАДКОВ
Специальность 02.00.05 – Электрохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора технических наук
Саратов 2009
Работа выполнена в ГОУ ВПО
«Саратовский государственный технический университет»
Научный консультант: доктор технических наук, профессор
Соловьёва Нина Дмитриевна
Официальные оппоненты: доктор химических наук, профессор
Лилин Сергей Анатольевич
доктор технических наук, профессор
Фомичёв Валерий Тарасович
доктор технических наук, профессор
Шпак Игорь Евгеньевич
Ведущая организация: Южно-российский государственный
технический университет
(г. Новочеркасск)
Защита состоится «25» июня 2009 г. в 1300 часов на заседании диссертационного совета Д 212.242.09 при Саратовском государственном техническом университете по адресу: 413100, Саратовская обл., г. Энгельс, пл. Свободы, 17, Энгельсский технологический университет (филиал) Саратовского государственного технического университета, ауд.237.
С диссертацией можно ознакомиться в научно-технической библиотеке Саратовского государственного технического университета (410054, Саратов, ул. Политехническая, 77).
Автореферат разослан « » 2009 г.
Ученый секретарь
диссертационного совета В.В. Ефанова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Создание композиционных электрохимических покрытий (КЭП) является одним из актуальных направлений современной гальванотехники. Принцип получения КЭП основан на том, что вместе с металлами из электролитов-суспензий соосаждаются дисперсные частицы различных размеров и видов. Включаясь в покрытия, частицы существенно улучшают их эксплуатационные свойства (твердость, износостойкость, коррозионную устойчивость) и придают им новые качества (антифрикционные, магнитные, каталитические). Благодаря этому КЭП находят широкое применение в различных отраслях промышленности, а разработка новых видов композиционных покрытий и поиск путей управления их свойствами является важной научно-технической задачей.
Эффективность использования КЭП во многом определяется природой дисперсной фазы. Перспективным дисперсным материалом композиционных покрытий является фуллерен С60. Молекулы фуллеренов имеют замкнутую π-оболочку при обилии кратных связей. Они способны легко и обратимо принимать электроны без разрушения структуры, поэтому большой интерес вызывают их электрохимические свойства. Однако целый ряд проблем электрохимии фуллеренов до сих пор остается неисследованным, в частности их совместное электроосаждение с металлами. Между тем, внедрение наноразмерных частиц в металлическую матрицу позволяет получать конструкционные материалы, превосходящие по функциональным свойствам существующие аналоги.
Другие углеродные материалы также представляют существенный интерес в качестве дисперсной фазы КЭП. Среди них выделяются графит и его производные. Слоистая структура графита позволяет получать на его основе соединения внедрения с различными интеркалирующими агентами, в частности с H2SO4 (бисульфат графита). В настоящее время разработаны электрохимические методы синтеза коллоидного графита и бисульфата графита, позволяющие получать конечный продукт высокой чистоты и заданного состава. Включение частиц данных материалов в металлические матрицы КЭП позволяет значительно улучшить их износостойкость и коррозионную стойкость.
Описание кинетики электродных процессов при осаждении металлов, сплавов и КЭП невозможно без детальной информации о строении растворов электролитов. В концентрированных одно- и многокомпонентных растворах происходят процессы взаимодействия между растворителем и растворенными веществами, сопровождающиеся образованием ассоциатов и гидратацией. Изучение физико-химических и термодинамических свойств концентрированных растворов позволяет определить оптимальные составы электролитов для осаждения гальванических покрытий.
Одной из важных характеристик композиционных покрытий является их коррозионная стойкость, которая во многом определяется металлической матрицей. В качестве матрицы КЭП могут быть использованы не только индивидуальные металлы, но и различные сплавы. Поэтому необходимо детально исследовать механизм и кинетику анодных реакций на электроосажденных сплавах. Однако процесс анодного растворения многих электролитических сплавов (в частности, железо-никель и медь-никель), особенно на начальном нестационарном этапе, до настоящего времени остается неизученным.
Таким образом, получение новых композиционных покрытий, исследование кинетических закономерностей их электроосаждения и свойств осадков, а также изучение структурных превращений в концентрированных растворах электролитов является актуальной научной и прикладной задачей.
Диссертация выполнена в рамках госбюджетных НИР «Синтез производных и изучение свойств фуллерена С60» (№ госрегистрации 01200602841) 2006 г. и «Исследование релаксационных эффектов на межфазной границе при электрохимическом формировании наноструктурированных материалов на основе железа и оксида алюминия» (№ госрегистрации 01200703461) 2007 г.
Целью работы является разработка научных основ создания новых композиционных электрохимических покрытий на основе никеля, меди и сплава железо-никель, обладающих улучшенными эксплуатационными свойствами, исследование кинетики их электроосаждения и изучение структурных превращений в концентрированных растворах, содержащих основные компоненты электролитов никелирования и меднения.
Для достижения поставленной цели необходимо было решить следующие задачи:
- изучить физико-химические и термодинамические свойства концентрированных водных растворов, содержащих основные компоненты электролитов для осаждения КЭП на основе никеля, меди и сплава железо-никель;
- разработать методику приготовления водных коллоидных дисперсий фуллерена С60, не содержащих органических растворителей;
- получить КЭП на основе никеля и меди, модифицированные фуллереном С60, исследовать кинетические закономерности их электроосаждения, а также антифрикционные и коррозионные свойства данных покрытий;
- изучить влияние состава электролита, режима электролиза и материала анода на свойства сплава железо-никель (микротвердость, шероховатость, коррозионную стойкость), получить КЭП железо-никель-фуллерен С60, изучить кинетику их электроосаждения и свойства осадков;
- получить КЭП никель–коллоидный графит и никель–бисульфат графита с использованием дисперсной фазы, синтезированной электрохимическим способом, исследовать кинетику их электроосаждения и свойства данных покрытий (коэффициент трения, коррозионная стойкость);
- выявить механизм и кинетические закономерности анодного растворения гальванических сплавов железо-никель и медь-никель в нестационарных условиях.
Научная новизна работы. Доказано наличие структурных превращений в сульфатных и хлоридных одно- и двухкомпонентных растворах, содержащих катионы Ni2+ и Fe2+, а также в сульфатных растворах, содержащих катионы Cu2+. Показана возможность формирования полиионной структуры растворов в области концентраций, близких к насыщению. В рамках теории Эйринга рассчитаны термодинамические характеристики вязкого течения (ΔGη*, ΔHη* ΔSη*), подтверждающие наличие структурных превращений в изучаемых растворах. Сконструирована полиномиальная модель вязкого течения изучаемых растворов. Разработан новый метод получения коллоидных дисперсий фуллерена С60 в воде, не содержащих органических растворителей. Обнаружен сольватохроматический эффект при добавлении растворов фуллерена С60 в толуоле или хлорбензоле к смеси вода – ацетон. Впервые получены КЭП с дисперсной фазой фуллерена С60 на основе никеля, меди и сплава железо-никель, а также исследованы кинетические параметры их электроосаждения. Получены КЭП на основе никеля, модифицированные коллоидным графитом и бисульфатом графита, определены кинетические параметры процесса осаждения данных КЭП. Для получения КЭП впервые использованы коллоидный графит и бисульфат графита, синтезированные электрохимическим способом. Впервые установлено, что в нестационарных условиях гальванические сплавы железо-никель и медь-никель растворяются селективно, с преимущественной ионизацией электроотрицательного компонента. В рамках модели нестационарной объемной диффузии рассчитаны кинетические параметры селективного растворения изученных сплавов (коэффициенты диффузии электроотрицательного металла в твердой фазе, толщина поверхностного слоя, обогащенного электроположительным компонентом).
Практическая значимость результатов работы. Получены КЭП никель–фуллерен С60, обладающие пониженным коэффициентом трения и высокой коррозионной стойкостью. Получены КЭП медь–фуллерен С60 с улучшенными трибологическими свойствами (низкая шероховатость, коэффициент трения). Показано, что покрытия сплавом железо-никель, содержащие 60% Ni и 40% Fe, обладают свойствами, позволяющими использовать их в качестве твердых износостойких и коррозионно-стойких покрытий. Установлено, что включение частиц фуллерена С60 в состав сплава железо-никель приводит к улучшению трибологических и коррозионных свойств осадков. Получены КЭП никель–коллоидный графит и никель–бисульфат графита, обладающие пониженным коэффициентом трения и высокой коррозионной стойкостью. Получены данные по физико-химическим свойствам железо- и никельсодержащих хлоридных, а также никельсодержащих и медьсодержащих сульфатных растворов в широком диапазоне изменения концентрации компонентов и температуры. Сконструированные с помощью системы MATLAB 6.1 полиномиальные модели позволяют рассчитать динамическую вязкость концентрированных водных растворов NiSO4, NiCl2, FeCl2 и NiCl2+FeCl2. Выявлен механизм коррозионного разрушения электролитических сплавов железо-никель и медь-никель в кислых хлоридных средах.
На защиту выносятся следующие основные положения:
- Найденные закономерности концентрационных и температурных изменений в структуре концентрированных одно- и двухкомпонентных водных растворов NiSO4, NiCl2, FeCl2, NiCl2+FeCl2, CuSO4.
- Кинетические параметры процессов электроосаждения КЭП никель–фуллерен С60, медь–фуллерен С60, никель–коллоидный графит, никель–бисульфат графита, железо–никель–фуллерен С60, а также закономерности изменения антифрикционных и коррозионных свойств осадков.
- Влияние технологических параметров процесса электроосаждения на эксплуатационные свойства сплава железо-никель (микротвердость, шероховатость, коррозионную стойкость) и КЭП железо–никель–фуллерен С60 (коэффициент трения и коррозионная стойкость).
- Механизм и кинетические параметры анодного растворения сплавов железо-никель и железо-медь в нестационарных условиях процесса.
Апробация результатов работы. Основные результаты работы докладывались на I, II, III и V Всероссийских конференциях молодых ученых «Современные проблемы теоретической и экспериментальной химии» (Саратов, 1997, 1999, 2001, 2005 гг.); I, II и III Всероссийских конференциях молодых ученых «Актуальные проблемы электрохимической технологии» (Саратов, 2000, 2005, 2008 гг.); VII Международном Фрумкинском симпозиуме «Фундаментальная электрохимия и электрохимическая технология» (Москва, 2000 г.); Международной конференции «Электрохимия, гальванотехника и обработка поверхности» (Москва, 2001 г.); Международных конференциях «Композит 2001», «Композит 2004» (Саратов, 2001, 2004 гг.); VII Международной конференции «Водородное материаловедение и химия гидридов металлов» (Алушта, 2001 г.); Всероссийской научно-практической конференции «Гальванотехника, экология и обработка поверхности» (Москва, 2002 г.); Всероссийской научно-практической конференции «Защитные покрытия в машиностроении и приборостроении» (Пенза, 2002 г.); II Всероссийской конференции «Современные электрохимические технологии» (Саратов, 2002 г.); I и IV Всероссийских конференциях «Физико-химические процессы в конденсированных средах и на межфазных границах» (Воронеж, 2002, 2008 гг.); XVII и XVIII Менделеевских съездах по общей и прикладной химии (Казань, 2003 г., Москва, 2007 г.); Всероссийской научно – практической конференции «Технологии и оборудование для нанесения износостойких, твердых и коррозионно-стойких покрытий» (Москва, 2004 г.); Международной научно-практической конференции «Композиционные материалы: теория, исследования, разработка, технология, применение» (Новочеркасск, 2004 г.); III и V Международных конференциях «Углерод: фундаментальные проблемы науки, материаловедение, технология» (Москва, 2004, 2006 гг.); IX Международной конференции «Водородное материаловедение и химия углеродных наноматериалов» (Севастополь, 2005 г.); III, IV и V Международных конференциях «Покрытия и обработка поверхности» (Москва, 2006, 2007, 2008 гг.); XXI Международной конференции «Математические методы в технике и технологиях» (Саратов, 2008 г.); Научно-практической конференции «Инновационные технологии в промышленности Уральского региона» (Екатеринбург, 2008 г.).
Публикации. По материалам диссертации опубликовано 60 работ, в том числе 21 статья в реферируемых журналах (из них19 статей в журналах, рекомендованных ВАК), 2 патента и 2 положительных решения о выдаче патентов.
Личный вклад соискателя в работы, выполненные в соавторстве, заключается в постановке задачи исследования, участии во всех этапах эксперимента, обработке и интерпретации полученных результатов.
Структура диссертации. Диссертационная работа состоит из введения, пяти глав, выводов и списка использованной литературы из 390 наименований. Она изложена на 307 страницах, содержит 87 рисунков и 55 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дано обоснование актуальности темы, сформулированы цели и задачи исследования, показаны научная новизна и практическая значимость работы.
Глава 1. Литературный обзор
Приведены литературные данные по кинетическим закономерностям процессов электроосаждения металлов и сплавов и влиянию различных факторов на структуру формирующихся осадков. Рассмотрены механизмы и кинетические закономерности селективного растворения (СР) гомогенных бинарных сплавов. Особое внимание уделено формированию и реорганизации неравновесного поверхностного слоя в процессе СР сплава.
Проанализированы известные механизмы и кинетика процессов образования КЭП, а также основные факторы, влияющие на формирование структуры и свойств композиционных покрытий. Рассмотрены методы получения, функциональные свойства и структурные особенности КЭП на основе никеля, хрома, меди и др.
Приведены основные модели и теории строения воды и водных растворов. Проанализированы факторы, определяющие структуру и свойства растворов электролитов в процессе ион–ионного и ион–дипольного взаимодействия при различных концентрациях растворенного вещества.
Глава 2. Методика эксперимента
Объектами исследования являлись водные растворы NiSO4, NiCl2, FeCl2, NiCl2 + FeCl2, CuSO4, хлоридные электролиты осаждения сплава железо-никель, коллоидные дисперсии фуллерена С60 в воде, композиционные электрохимические покрытия на основе никеля и меди, электролитические сплавы железо-никель и медь-никель. Растворы готовили на основе бидистиллированной воды и перекристаллизованных реактивов марки «х.ч.». Физико-химические свойства железо- и никельсодержащих растворов исследовали в области температур 20÷70 0С, медьсодержащих растворов – в интервале 20÷50 0С. Для измерения плотности использовали набор денсиметров (ГОСТ 1300-74), для определения вязкости – вискозиметр ВПЖ–2 (ГОСТ 33-66).
Электронные спектры растворов и коллоидных дисперсий фуллерена С60 регистрировали на спектрофотометре СФ-26 с использованием кварцевых кювет (l = 1 см). В кювету сравнения помещали растворитель. Показатель преломления определяли с помощью рефрактометра УРЛ (модель 1).
Электроосаждение КЭП на основе никеля проводилось на сталь 45 при комнатной температуре с перемешиванием электролита. КЭП медь–фуллерен С60 осаждали на медную основу. Толщина покрытий составляла 40 мкм. Для повышения в покрытиях содержания частиц дисперсной фазы катод располагали под углом 450 к аноду.
Сплав железо-никель осаждали на сталь 45 и сталь 40Х в термостатированной стеклянной ячейке при температуре 50 0С. Толщина покрытий составляла 50 мкм. В качестве анодов использовались стали названных марок и графит ГФ-Г. КЭП железо–никель–фуллерен С60 осаждали на сталь 45 при 50 0С. Состав сплава железо-никель и КЭП никель–фуллерен С60 определяли методом вторично-ионной масс-спектрометрии (ВИМС) на магнитном масс-спектрометре МИ–1305, оснащенном универсальной приставкой для исследования твердых тел. Структуру покрытия исследовали методом рентгенофазового анализа (РФА) на дифрактометре ДРОН 3.0. Микротвердость осадков сплава железо-никель измеряли на приборе ПМТ–3 (ГОСТ 9450-76) методом статического вдавливания алмазной пирамиды. Шероховатость поверхности покрытий определяли с помощью щупового профилографа-профилометра «Калибр 204» (ГОСТ 19300-86). Определение коррозионной стойкости проводилось путем снятия анодных потенциодинамических кривых в 0,5 М H2SO4 и 3% NaCl.
Электрохимические исследования проводили на импульсном потенциостате P–30S и потенциостате П–5848 с помощью методов вольтамперометрии, хроноамперометрии, хронопотенциометрии. Во втором случае для регистрации тока и потенциала во времени использовали самопишущий потенциометр КСП-4. Потенциалы регистрировали относительно насыщенного хлоридсеребряного электрода сравнения.
Глава 3. Структурные превращения в сульфатных и хлоридных
растворах, содержащих ионы Ni2+, Fe2+ и Cu2+
Скорость осаждения металлов, сплавов и КЭП, а также их качество обусловлены составом электролита, концентрацией компонентов, режимом электролиза. Вязкое течение оказывает влияние на электрохимический процесс, в частности на стадии диффузии частиц в объеме раствора и их разряда. Введение электролита вызывает деформацию и разрушение сетки водородных связей в структуре воды. С увеличением концентрации раствора начинают действовать конкурирующие факторы: усиливается разрушающая способность электролита и одновременно возрастает его ориентирующее воздействие на свободные молекулы воды, что приводит к усилению гидратации.
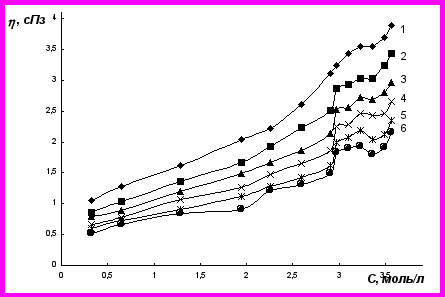
Рис. 1. Зависимость динамическая вязкость – концентрация для растворов NiSO4 при температурах, 0С: 20(1); 30(2);40(3); 50(4); 60(5); 70(6)
Следствием указанных воздействий является изменение скорости возрастания динамической вязкости растворов при увеличении концентрации сульфата никеля (рис. 1). Влияние ионов на структуру воды в первую очередь определяется их природой, радиусом, строением электронной оболочки. Наличие неспаренных d-электронов у никеля приводит к его взаимодействию с диполями воды, к ослаблению, а при увеличении концентрации и к разрушению водородных связей в структуре растворителя. При этом происходит образование гидратированного иона никеля [Ni(H2O)n]2+. Для ионов никеля характерно π- и σ-взаимодействие с молекулами воды. Следовательно, с одной стороны ионы Ni2+ разрушают структуру растворителя, с другой – образуют новые упорядоченные структурные элементы.
Сульфат-ионы образуют с молекулами воды короткие водородные связи и в растворах, их содержащих, возможно появление гидратов S(SO42-) – O(H2O) с переводом молекулы воды в полость. Увеличение концентрации NiSO4 более 2,97 моль/л приводит к резкому возрастанию динамической вязкости. Очевидно, это связано с новым структурированием в растворе, когда все молекулы воды переходят в ближнее окружение ионов, т.е. достигается граница полной гидратации. Незначительные изменения вязкости при дальнейшем увеличении концентрации электролита до 3,30 моль/л свидетельствуют об упорядочивании структуры раствора, перераспределении молекул воды между катионами и анионами, т.к. гидратация катионов энергетически более выгодна. Рост вязкости раствора при увеличении содержания NiSO4 более 3,30 моль/л, видимо, связан с формированием новой структуры, элементами которой выступают гидратированные ионы (полиионная структура).
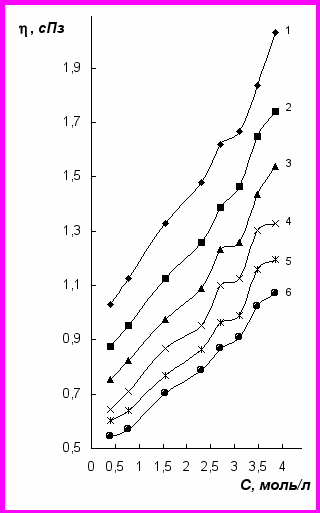
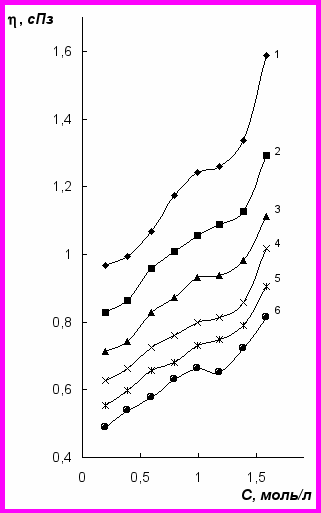
Рис. 2. Зависимость динамическая вязкость – концентрация для растворов NiCl2 при температурах, 0С: 20(1); 30(2); 40(3); 50(4); 60(5); 70(6)
Рис. 3. Зависимость динамическая вязкость – концентрация для растворов FeCl2 при температурах, 0С: 20(1); 30(2); 40(3); 50(4); 60(5); 70(6)
Хлорид-ионы оказывают разупорядочивающее действие на структуру растворителя: молекулы воды вблизи анионов Cl– ориентированы слабее, чем в объеме жидкости, т.к. напряженность электрического поля хлорид-ионов слишком мала, чтобы упорядочить молекулы воды посредством подавления их теплового движения. Разрушающим действием ионов Cl– можно объяснить меньшую динамическую вязкость растворов NiCl2 по сравнению с растворами NiSO4 той же концентрации. Конкурирующее воздействие на структуру воды со стороны катионов и анионов приводит к появлению перегибов на кривых зависимости динамической вязкости от концентрации хлорида никеля (рис. 2). Стабилизация структуры растворов NiCl2, вызванная образованием новой полиионной структуры, достигается при содержании соли более 3,10 моль/л. Это, вероятно, обусловлено скорейшим разрушением начальной структуры растворителя.
Вязкость водных растворов FeCl2 лежит примерно в тех же пределах, что вязкость NiCl2 соизмеримых концентраций (рис. 2, 3). Однако они более структурно чувствительны к изменению температуры в изучаемом диапазоне. Нестабильность растворов FeCl2 может быть обусловлена менее прочной, чем у никеля, связью Me–OH2. Для катионов наблюдается усиление взаимодействия с водой в ряду Mn2+< Fe2+< Co2+< Ni2+< Cu2+. Тот факт, что железо занимает промежуточное положение между марганцем и кобальтом, позволяет предположить, что сила взаимодействия Fe2+ с водой будет больше, чем у Mn2+, но меньше, чем у Co2+ и Ni2+.
Одним из параметров, с которым коррелирует динамическая вязкость, является коэффициент диффузии D. Исходя из теории Эйринга, процесс диффузии описывается аналогично скорости мономолекулярной реакции, включая промежуточное образование такой конфигурации частицы и ее окружения, которое можно считать активированным состоянием. Значения коэффициентов диффузии в растворах NiSO4, NiCl2 и FeCl2 антибатны ходу концентрационных зависимостей их динамической вязкости. Например, с ростом концентрации при 50 0С D уменьшается для NiSO4 от 3,80·10 – 5 до 0,75·10 – 5 см2/с, для NiCl2 от 3,98·10 – 5 до 1,57·10 – 5 см2/с, для FeCl2 от 4,10·10 – 5 до 2,34·10 – 5 см2/с. Менее значительное изменение D наблюдается при концентрациях, для которых становится возможным формирование полиионной структуры, например, для NiCl2 более 3,10 моль/л. Некоторое уменьшение коэффициента диффузии в растворе FeCl2 по сравнению с NiCl2 при соизмеримых концентрациях можно связать с укрупнением ионов, образующихся за счет частичного вытеснения ионами хлора молекул воды из ближайшего окружения Fe2+ при увеличении концентрации FeCl2.
Концентрационная зависимость динамической вязкости должна соотноситься с изменением энергетических затрат процесса вязкого течения. Расчет свободной энергии активации вязкого течения, проводившийся в соответствии с теорией Эйринга:

(где ν – кинематическая вязкость;
 – средний молекулярный вес) показал, что концентрационные зависимости ΔGη* изучаемых растворов качественно соответствуют изотермам их динамической вязкости. Очевидно, дестабилизация структуры раствора сопровождается снижением ΔGη*, структурирование – её возрастанием.
– средний молекулярный вес) показал, что концентрационные зависимости ΔGη* изучаемых растворов качественно соответствуют изотермам их динамической вязкости. Очевидно, дестабилизация структуры раствора сопровождается снижением ΔGη*, структурирование – её возрастанием. Свободная энергия активации вязкого течения ΔGη* связана с энтальпией ΔHη* и энтропией ΔSη* активации вязкого течения соотношением:
ΔGη* = ΔHη* – ТΔSη*. (2)
Анализ температурной зависимости кинематической вязкости растворов NiSO4, NiCl2, FeCl2 в координатах lg ν, 1/T показал наличие двух областей температуры, различающихся энтальпией активации: от 20 до 40 0С и от 40 до 70 0С. Из наклона кривых lg ν, 1/T в соответствии с уравнением

была рассчитана энтальпия активации вязкого течения изучаемых растворов. ΔHη* растворов NiSO4 меняется от 12,0 до 8,3 кДж/моль, NiCl2 – от 12,3 до 8,8 кДж/моль, FeCl2 – от 12,2 до 9,6 кДж/моль. Величины ΔHη* изучаемых растворов соизмеримы, но меньше энтальпии активации вязкого течения воды (ΔHη* воды составляет 16,26 кДж/моль), что свидетельствует об облегченности перехода из одного положения равновесия в другое, следовательно, о разупорядоченности структуры раствора. Наибольшая нестабильность наблюдается в растворах FeCl2, чему соответствуют меньшие по сравнению с NiSO4 и NiCl2 значения ΔHη* при близких концентрациях, что согласуется с результатами измерений вязкости. Преобладание разрушающего действия вводимых ионов и температуры на структуру воды находит отражение в отрицательных значениях энтропии активации вязкого течения (ΔSη* растворов NiSO4 составляет – 48,9 ÷ – 72,6 Дж/мольК, NiCl2 – 47,3 ÷ – 66,0 Дж/мольК, FeCl2 – 47,0 ÷ – 60,0 Дж/мольК). Увеличение концентрации солей приводит к структурированию в растворах и, соответственно, к уменьшению ΔSη*.
Для растворов NiCl2 характерно монотонное и незначительное изменение термодинамических характеристик вязкого течения в изучаемом диапазоне концентраций и температур. Это позволяет предположить, что при изменении концентрации NiCl2 в пределах ±0,25 моль/л в электролите структурные изменения столь малы, что характер массопереноса сохранится неизменным.
Введение FeCl2 (1,20 моль/л) в раствор хлорида никеля приводит к возрастанию динамической вязкости (рис. 4), особенно в области концентраций NiCl2, для которых возможно образование полиионной структуры. Повышение температуры электролита снижает динамическую вязкость, но не влияет на характер изотерм вязкости, т.е. определяющую роль в структурных превращениях в концентрированных бинарных растворах играют природа и концентрация компонентов электролита. Об этом свидетельствует наличие одного наклона температурной зависимости вязкости в координатах lg ν, 1/T. Элементами новой структуры являются гидратированные катионы и анионы, связанные водородными связями.
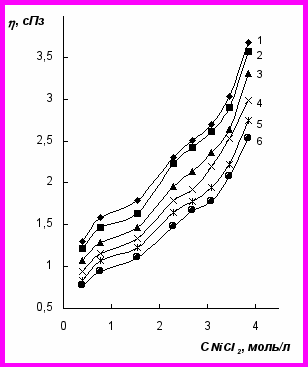 Рис. 4. Зависимость динамическая вязкость – концентрация NiCl2 для растворов NiCl2 + FeCl2 (CFeCl2 = 1,20 моль/л) при температурах, 0С: 20(1); 30(2); 40(3); 50(4); 60(5); 70(6)
Рис. 4. Зависимость динамическая вязкость – концентрация NiCl2 для растворов NiCl2 + FeCl2 (CFeCl2 = 1,20 моль/л) при температурах, 0С: 20(1); 30(2); 40(3); 50(4); 60(5); 70(6)
Рис. 5. Зависимость ΔGη* – концентрация NiCl2 для растворов NiCl2 + FeCl2 (CFeCl2 = 1,20 моль/л) при температурах, 0С: 20(1); 30(2); 40(3); 50(4); 60(5); 70(6)
Наличие в структуре менее стабильных гидратных комплексов железа приводит к снижению энтальпии активации вязкого течения двухкомпонентных растворов (табл. 1) по сравнению с ΔHη* индивидуальных растворов. При этом сохраняется тенденция к снижению ΔHη* при увеличении концентрации NiCl2, которая присуща водному раствору хлорида никеля.
Таблица 1
Энтальпия активации вязкого течения ΔHη*, кДж/моль водного раствора
FeCl2 1,20 моль/л + NiCl2 X моль/л
| t, 0C | Концентрация NiCl2, моль/л | |||||||
| 0,39 | 0,77 | 1,54 | 2,39 | 2,70 | 3,10 | 3,49 | 3,86 | |
| 20-70 | 9,0 | 8,4 | 7,8 | 7,5 | 7,1 | 7,0 | 6,4 | 6,4 |
Энтропия активации вязкого течения двухкомпонентных растворов (табл. 2) меньше ΔSη* хлорида никеля, при этом имеет место ее уменьшение с ростом концентрации раствора, что свидетельствует о его упорядочении. Энергия активации вязкого течения растворов FeCl2 1,20 моль/л + NiCl2 Х моль/л значительно превышает ΔGη* индивидуальных растворов (рис. 5).
