«российский нии гематологии и трансфузиологии»
| Вид материала | Автореферат |
- Методические рекомендации предназначены для врачей и лаборантов спк и лечебно-профилактических, 353.54kb.
- Программа заседаний съезда гематологов и трансфузиологов «Совершенствование гематологии, 138.18kb.
- Синдром эндогенной интоксикации при беременности (патогенетические механизмы и лабораторная, 274.88kb.
- Медицинская газета, 19., 121.53kb.
- Программа научно-практической конференции актуальные вопросы диагностики и лечения, 134.67kb.
- Российско-норвежская конференция по проблемам гематологии, 186.83kb.
- Урогенитальный хламидиоз: клинико-иммунологическая характеристика, иммуногенетические, 872.18kb.
- «Пермская государственная медицинская академия имени академии Е. А. Вагнера Федерального, 315.55kb.
- Влагалища и шейки матки у детей, 313.83kb.
- На правах рукописи габрусенко сергей Анатольевич, 1031.18kb.
Содержание фактора Виллебранда у обследованных пациентов (МSD)
| Группы больных | VWF: Ag, ед/мл | ||
| В целом | Без ГГЦ | С ГГЦ | |
| ОВТ | 1,78±0,60* | 1,64±0,64* | 1,96±0,59* ** |
| ПТБ | 1,88±0,74* | 1,86±0,76* | 1,91±0,71* |
| ААНК | 1,70±0,60* | 1,64±0,78* | 1,84±0,53* |
| ААНК (нарастание ишемии) | 1,69±0,62* | 1,48±0,57* | 1,91±0,66* ** |
| ОИМ в анамнезе | 1,53±0,44* | 1,460,45 | 1,750,41 |
| ИИ в анамнезе | 1,30±0,50* | 1,260,46* | 1,460,52* |
| Рецидивирующие тромбозы | 2,00±0,70* | 1,480,83 | 2,300,57,** |
* - достоверное различие с нормой (0,980,07 ед/мл), р 0,05 **- достоверное различие между группами больных с и без ГГЦ, р 0,05
Во всех рассматриваемых группах у лиц с ГГЦ наблюдалось значительное увеличение активности фактора VIII (фVIII) и фактора Виллебранда (фВ). Так, среднее значение активности фВ у больных с ГГЦ при остром венозном тромбозе было в 1,5 раза, а при ПТБ – в 1,2 раза выше, чем у пациентов с нормальным уровнем ГЦ в плазме (табл. 4).
Таблица 4.
Активность фактора VIII и фактора Виллебранда у
обследованных больных (МSD)
| Группы больных | Пациенты без ГГЦ | Пациенты с ГГЦ | ||
| Активность фVIII, % | Активность фВ, % | Активность фVIII, % | Активность фВ, % | |
| ОВТ | 185,4±63,0* | 162,0±63,7* | 224,2±113,1* | 223,6±103,9* |
| ПТБ | 177,4±55,1* | 168,4±61,7* | 202,3±85,1* | 194,5±107,3* |
| ААНК | 155,9±55,1* | 149,8±57,5* | 163,2±43,2* | 162,1±43,1* |
| ААНК (нарастание ишемии) | 156,1±51,8* | 139,0±55,6* | 157,4±51,2* | 162,4±57,3* |
| ИБС (стабильное течение) | 116,8±45,0 | 126,0±49,4 | 142,2±83,9* | 133,5±28,5* |
| ОИМ (2-е сутки) | 110,8±73,4 | 176,5±53,3* | 130,8±92,2 | 204,1±85,0* |
| ОИМ (14-е сутки) | 156,7±69,8 | 169,7±58,3* | 173,0±78,8* | 167,3±34,7* |
* - р < 0,05, достоверное различие с нормой
(109,137,6 % норма для фVIII; 99,721,9 % норма для фВ)
Однозначных данных в пользу гиперфибриногенемии при ГГЦ получено не было. В то же время оценка фибринолитической активности крови у больных с тромботическими осложнениями подтвердила предположение, что ГГЦ способствует формированию фибринового сгустка, более устойчивого к фибринолизу (табл. 5).
Таблица 5.
Хагеман-зависимый лизис эуглобулиновой фракции
у обследованных больных (М±SD)
| Группы больных | ХЗЛЭФ, с | ||
| В целом | Без ГГЦ | С ГГЦ | |
| ОВТ | 882,7±431,6* | 802,0±408,4* | 967,6±465,9* |
| ПТБ | 752,5±402,9* | 588,0±336,7* ** | 906,2±498,5* ** |
| ААНК | 879,4±310,3* | 780,9±298,5* | 900,4±314,9* |
| ААНК (нарастание ишемии) | 970,0±402,2* | 831,4±328,0* ** | 1020±480,8* ** |
| ИБС | 523,2±317,6* | 522,0±308,0* | 567,6±265,9* |
* - достоверное различие с нормой (367,2±124,8 с ), р 0,05
**- достоверное различие между группами больных с и без ГГЦ, р 0,05
Существенным фактором тромбообразования является нарушение функционирования антикоагулянтной системы. Нами было изучено влияние ГГЦ на резистентность к активированному протеину С (APC-R) и активность антитромбина. Полученные данные отразили тенденцию к активации антитромбина у больных с нормальным уровнем ГЦ в плазме. При повышенном уровне ГЦ подобного эффекта не отмечалось (табл. 6).
Таблица 6.
Активность антитромбина у обследованных пациентов (МSD)
| Группы больных | Активность антитромбина, % | ||
| В целом | Без ГГЦ | С ГГЦ | |
| ОВТ | 118,7±31,6* | 128,0±32,6* | 94,0±5,6 |
| ПТБ | 103,5±14,9* | 104,9±15,0* | 99,0±14,7 |
| ААНК | 100,4±10,9* | 104,6±10,5* ** | 96,8±10,2** |
| ААНК (↑ ишемии) | 110,3±15,4* | 113,0±17,9* ** | 106,5±13,1* ** |
| Стабильное течение ИБС | 103,210,1 | 104,310,7 | 101,05,7 |
| ОИМ (2-е сутки) | 92,827,6 | 96,730,0 | 86,822,9 |
| ОИМ (14-е сутки) | 102,213,8 | 102,214,4 | 102,213,1 |
* - достоверное различие с нормой (95,0 ± 14,0 %), р 0,05 **- достоверное различие между подгруппами больных с и без ГГЦ, р 0,05
Наиболее наглядно угнетение активности антитромбина (АТ) при повышенном уровне ГЦ проявлялось у больных ААНК. Если у пациентов в целом данный показатель был достоверно выше, чем в норме (100,410,9 % против 95,0±14,0 %, р=0,02), то у лиц с ГГЦ наблюдалось снижение активности антитромбина как вне обострения, так и при нарастании ишемии.
Влияние гомоцистеина на степень чувствительности плазмы к активированному протеину С изучали у женщин с ПМС (n=28), т.е. исключив возможность влияния тромботического эпизода на рассматриваемый показатель. Обязательными критериями включения в исследование было отсутствие АФС, мутации фактора V Leiden, беременности и использования гормональной контрацепции, т.е. известных причин APC-R. У пациенток с ГГЦ индекс APC-R был достоверно снижен в сравнении с пациентками с нормальным уровнем ГЦ (2,7 против 3,3; p=0,004). Причиной нарушений в системе протеина С при ГГЦ может быть появление модифицированных гомоцистеином белков, которые в свою очередь индуцируют развитие антител, препятствующих действию APC на активированные факторы V и VIII.
Снижение компенсаторных возможностей системы свертывания крови при повышенном уровне ГЦ прослеживалось в динамике показателей гемостаза на 2-е и 14-е сутки течения инфаркта миокарда. Активность фVIII достоверно увеличивалась в подгруппе пациентов с нарастающей ГГЦ (160,8±76,5 % против 93,1±71,6 %, р=0,00003 в парном тесте). В то же время у этих больных практически не изменялась активность антитромбина (100,1±11,3 % против 99,1±13,2%, р=0,7). Напротив, в подгруппе, где уровень ГЦ снижался, к 14 суткам течения ОИМ активность антитромбина достоверно увеличивалась (103,6 13,8% против 97,5 ±17,8%, р=0,04).
У обследованных больных как при ИБС, так и при венозной патологии наличие ГГЦ было ассоциировано с повышенным содержанием Д-димеров (рис.11).
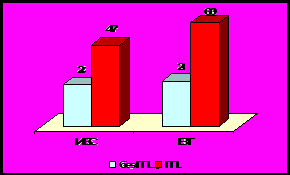
- р < 0,05
Рис. 11. Частота встречаемости высокого уровня Д-димеров
(>2000 нг/мл) у больных с сосудистой патологией.
У больных множественной миеломой при ГГЦ также отмечался достоверно повышенный уровень Д-димеров (рис 12).
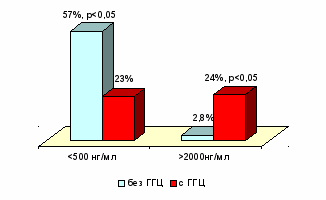
Рис. 12. Частота встречаемости высокого уровня Д-димера у больных множественной миеломой при наличии и в отсутствии ГГЦ.
Ряд других показателей гемостаза у пациентов с ММ также свидетельствовал о наличии более выраженного гиперкоагуляционного синдрома у лиц с повышенным уровнем ГЦ. Так, только в группе больных с ГГЦ отличие АПТВ от нормальных значений достигало статистической значимости. В этой же группе прослеживалась тенденция к более высоким показателям активности факторов VIII и Виллебранда (табл. 7).
Таблица 7.
Показатели гемостаза у пациентов с множественной миеломой
при наличии и в отсутствии ГГЦ (МSD)
| Показатель | Норма | Пациенты с ММ | |
| Повышенный уровень ГЦ | Нормальный уровень ГЦ | ||
| АПТВ (индекс) | 1,0±0,1 | 0,80,1* | 0,90,1 |
| Активность фVIII, % | 11930,5 | 244,490,3* | 220,1108,6* |
| Активность фВ, % | 99,521,7 | 189,7102,4* | 179,767,8* |
| Протромбиновый тест, % | 93,7±5,7 | 99,914,6 | 93,420,9 |
| Фибриноген, г/л | 2,80,7 | 4,11,3* | 4,11,2* |
| Активность АТ, % | 95,014,0 | 99,115,5 | 98,019,1 |
| ХЗЛЭФ, с | 366,7124,8 | 533,6±424,2 | 537,8±373,5 |
* - достоверное различие с нормой, р 0,05
Изменения показателей гемостаза, отмеченные в ходе проведения у больных ААНК метионинового нагрузочного теста (МНТ), который в данном контексте можно рассматривать как экспериментальную модель по созданию транзиторной ГГЦ, полностью подтвердили прокоагулянтный и проагрегантный потенциал ГЦ.
Была выявлена корреляция между уровнем ГЦ и числом дискоэхиноцитов (r=0,9, p=0,03), суммой активных форм тромбоцитов (r=0,6, p=0,03) и числом крупных тромбоцитарных агрегатов (r=0,6, p=0,04), а также между постнагрузочным уровнем ГЦ и активностью фактора Виллебранда (r=0,7, p=0,03). Значимая корреляционная связь между постнагрузочным уровнем ГЦ и временем ХЗЛЭФ (r=0,7, p=0,004) подтвердила угнетающее действие ГЦ на фибринолитическую активность крови. В ходе проведения МНТ было установлено еще два важных момента. Во-первых, на фоне транзиторного повышения уровня ГЦ у пациентов со скрытой ГГЦ в отличие от пациентов без ГГЦ отмечалось нарастание активности факторов VIII и Виллебранда, а также замедление ХЗЛЭФ. Во-вторых, исходно баланс системы гемостаза у пациентов с нарушенным обменом ГЦ был в большей степени смещен в сторону гиперкоагуляции в сравнении с пациентами без ГГЦ. Полученные данные свидетельствуют об участии в индукции протромботических изменений не только явной, но и скрытой ГГЦ.
Существенным доказательством роли ГГЦ в формировании прокоагулянтных изменений, являются результаты исследования системы гемостаза у лиц контрольной группы с повышенным уровнем ГЦ (табл. 8).
Таблица 8.
Показатели гемостаза у асимптомных носителей ГГЦ (МSD)
| Показатель | Норма | Носители ГГЦ (n=23) |
| Активные формы тромбоцитов, % | 19,55,4 | 28,84,9* |
| Кол-во тромбоцитов в агрегатах, % | 6,72,1 | 9,92,1* |
| Активность фактора VIII, % | 11930,5 | 143,434,9* |
| Активность фактора Виллебранда, % | 99,521,7 | 131,936,6* |
| Концентрация фибриногена, г/л | 2,80,7 | 3,60,6* |
| Активность антитромбина, % | 95,014,0 | 79,510,7* |
| ХЗЛЭФ, с | 366,7124,8 | 318,6146,2 |
* - достоверное различие с нормой, р 0,05
Показатели внутрисосудистой активации тромбоцитов (сумма активных форм тромбоцитов и количество тромбоцитов в агрегатах), концентрация фибриногена, активность факторов VIII и Виллебранда у асимптомных носителей ГГЦ не превышали пределов нормальных колебаний, однако были достоверно выше, чем у здоровых доноров. В то же время активность антитромбина у лиц с ГГЦ была достоверно ниже нормы. Подчеркнем, что в рассматриваемой группе не было индивидов с другими формами тромбофилии.
В рамках данного исследования принципиальным для нас являлся поиск наиболее неблагоприятных с точки зрения риска развития и тяжести течения ССЗ сочетаний ГГЦ с другими факторами риска (наследственными и/или приобретенными). Расчетные величины риска тромбообразования при сочетании ГГЦ и мутации фактора V Лейден многократно превысили соответствующие показатели для изолированного носительства указанных факторов. Согласно полученным данным риск развития венозного тромбоза при сочетании ГГЦ и мутации фактора V увеличивается в 41 раз (p<0,0001), а при сочетании ГГЦ и мутации в гене протромбина - в 18 раз (p<0,0001). Сочетание ГГЦ с мутацией фактора V чаще отмечалось у пациентов мужского пола (12% против 6% у женщин). У носителей мутации Лейден при наличии ГГЦ тромбоз манифестировал в среднем на 15 лет раньше, чем при ее отсутствии: в 31,2 ± 12 года против 47,9±15,1 лет. Протромботический потенциал мутации G20210A в гене протромбина при наличии ГГЦ также фенотипически проявлялся в более раннем возрасте – в 35,0±20,3 лет против 45,7±19,2 лет без ГГЦ. Показательно, что у так называемых «двойных гетерозигот» по мутациям в генах факторов II и V в отсутствии классических провоцирующих факторов манифестация тромбоза имела место в возрасте 20,0 ± 10,6 лет при наличии ГГЦ, а без ГГЦ – в 42,4±6,8 года.
Следует подчеркнуть, что если взаимодействие ГГЦ с мутациями фактора V Лейден и G20210A в гене протромбина описано в литературе, пусть и с противоречивыми результатами, то возможное влияние повышенного уровня ГЦ на фенотипическую экспрессию других молекулярных маркеров тромбофилии ранее не изучалось. Поскольку основные патологические эффекты ГГЦ опосредуются через эндотелиальную дисфункцию, особый интерес представляло распределение у больных с ГГЦ аллельных вариантов генов, кодирующих компоненты ренин-ангиотензиновой системы (РАС), аполипопротеина Е (АроЕ) и эндотелиальной синтазы окида азота (eNOS).
У больных с ГГЦ как при артериальных, так и при венозных тромбозах наблюдалось снижение частоты встречаемости генотипов “Е2/Е2” и “Е2/Е3” и, напротив, увеличение частоты аллеля “Е4” гена аполипопротеина Е (ApoE). Различие в частоте встречаемости генотипа “АроЕ Е3/Е4” между больными с ВТ и контролем при наличии ГГЦ достигало пределов статистической значимости (30% против 17,5%, p<0,05).
У больных ИБС и ААНК при наличии ГГЦ прослеживалась отчетливая тенденция к снижению частоты носительства С/C генотипа гена ATGR. У больных ААНК при ГГЦ выявлено двукратное снижение частоты встречаемости генотипа D/D гена ACE в сравнении с контролем и больными без ГГЦ. Возможно, наблюдаемый феномен связан с неблагоприятной прогностической ролью сочетания данного генотипа и ГГЦ. У больных с ВТ ГГЦ была ассоциирована с повышенной частотой носительства генотипов I/I в гене t-PA, 4G/4G в гене PAI-1 и D/D в гене ACE, предрасполагающих к снижению фибринолитической активности.
В группах пациентов с ВТ, ИБС и ААНК у лиц с ГГЦ достоверно чаще, чем при нормальном уровне ГЦ, выявлялся генотип “−786 СС” гена eNOS (рис 13). Снижение активности eNOS у носителей варианта “−786C” может препятствовать защите сосудистой стенки от избытка ГЦ посредством формирования нитрозотиолов, а также действовать синергично с ГГЦ в развитии оксидантного стресса. При относительном дефиците NO избыток ГЦ шунтируется на путь формирования ГЦ-тиолактона – наиболее токсичного производного ГЦ.
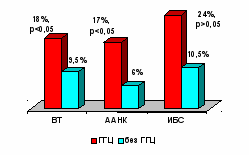
Рис 13. Частота встречаемости генотипа “−786СС” эндотелиальной синтазы оксида азота у больных с и без ГГЦ.
У пациентов с ИБС и ААНК полиморфизм генов, опосредующих активацию тромбоцитарных рецепторов, был ассоциирован с повышенным уровнем ГЦ. Так, у больных ААНК с ГГЦ гомозиготное носительство аллеля 434Т гена GpIbα отмечалось в 2 раза, а гетерозиготное - более чем в 3 раза чаще, чем при нормальном уровне ГЦ. Носительство генотипа 807ТТ гена GpIa при ГГЦ выявлено в 2,2 раза чаще. У больных с ГГЦ доля гетерозиготных носителей гаплотипа Н2 гена рецептора АДФ (P2Y12) в 2 раза превышала таковую у индивидов с нормальным уровнем ГЦ, а гомозиготных – более чем в 3 раза (рис.14).
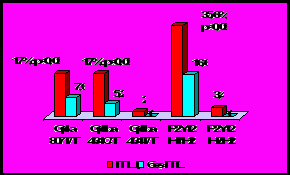
Рис 14. Распределение генотипов тромбоцитарных рецепторов у больных атеросклерозом артерий нижних конечностей.
Установленные ассоциативные связи логично вписываются в известную схему различий патогенеза артериального и венозного тромбоза.
Анализ частоты встречаемости ГГЦ у пациентов с антифосфолипидным синдромом (АФС) представлял особый интерес вследствие сходства их клинических проявлений – рецидивирующие артериальные и венозные тромбозы, нарушение репродуктивной функции. Кроме того, АФС является аутоиммунной патологией, а избыток ГЦ вызывает появление в организме модифицированных белков, потенциально являющихся аутоантигенами. Волчаночный антикоагулянт был выявлен у 5% (12 из 247) больных с ВТ в анамнезе, при этом у 3-х из них (25%) диагностирован повышенный уровень ГЦ. Подобное сочетание приводило к развитию крайне тяжелых клинических проявлений тромбоза. Иммунологическая диагностика АФС была проведена у 81 пациента с ИБС (43 больных с острым инфарктом миокарда и 38 больных с постинфарктным кардиосклерозом). Повышенный титр антител к β2GPI (>10 нг/мл) был выявлен у 12 (27%) больных с острым инфарктом миокарда и у 9 (24%) больных с постинфарктным кардиосклерозом. У больных с ОИМ выявлялась значимая корреляционная связь между уровнем ГЦ плазмы и титром антикардиолипиновых антител класса G (r=0,6, p=0,001 на 2-е сутки и r=0,9, p=0,0001 на 14 сутки). Корреляционный анализ выявил также связь между носительством антител к β2GPI (а-β2GPI) и уровнем гомоцистеина плазмы (r=0,8, p=0,001 на 2-е и r=0,96, p=0,0001 на 14-е сутки течения ОИМ). Волчаночный антикоагулянт не был выявлен ни у одного из пациентов, что позволяет предположить наличие низкоаффинных антител к 2GPI у обследованных больных. Сочетание ГГЦ с носительством а-β2GPI повышало протромботический потенциал: отмечалась достоверно более высокая активность фактора VIII, тенденция к более выраженной гиперфибриногенемии, снижению активности антитромбина, содержания плазминогена, а также замедлению лизиса эуглобулиновой фракции (табл. 9).
Таблица 9.
Показатели системы гемостаза у пациентов с острым инфарктом миокарда и ГГЦ в зависимости от титра антител к β2GPI (МSD)
| Показатель | Норма | Сутки измерения | а-β2GPI > 10 нг/мл n=9 | а-β2GPI< 10 нг/мл n=15 |
| АПТВ (индекс) | 1,0±0,1 | 2-е | 1,20,6* | 1,40,5* |
| 14-е | 0,90,5 | 1,10,2* | ||
| Активность фактора VIII, % | 11930,5 | 2-е | 212,874,2* ** | 127,471,8 |
| 14-е | 234,788,4* ** | 145,441,5 | ||
| Активность фактора Виллебранда, % | 99,521,7 | 2-е | 204,773,4* | 188,889,2* |
| 14-е | 188,329,8* | 172,832,8* | ||
| ПТ,% | 93,7±5,7 | 2-е | 101,515,9* | 86,830,1* |
| 14-е | 102,110,6* | 90,823,2* | ||
| Концентрация фибриногена, г/л | 2,80,7 | 2-е | 4,00,9* | 3,80,8* |
| 14-е | 4,51,1* | 3,91,1* | ||
| Активность антитромбина, % | 95,014,0 | 2-е | 87,235,8 | 95,611,2 |
| 14-е | 104,815,8 | 106,214,1 | ||
| Хагеман-зависимый лизис эуглобулиновой фракции, с | 366,7124,8 | 2-е | 989,4460,5* | 718,3488,0 * |
| 14-е | 813,8450,0* | 761,7589,2* | ||
| Содержание плазминогена, % | 92,217,2 | 2-е | 85,322,5 | 93,718,6 |
| 14-е | 107,619,4* | 125,326,8* |
* - достоверное различие с нормой, р 0,05
** - достоверное отличие от показателей, полученных у пациентов с нормальным уровнем а-β2GPI, р 0,05
Кумулятивное действие ГГЦ и антител к β2GPI на повышение активности фактора VIII прослеживалось также у больных с постинфарктным кардиосклерозом (165,480,2 против 109,747,8, p=0,2). Высокая активность фактора VIII может быть следствием ингибиции протеина С как избытком ГЦ, так и иммунными бивалентными комплексами, включающими антитела, направленные против 2GPI. При сравнении показателей гемостаза больных ОИМ с повышенным уровнем антител к протромбину также была отмечена достоверно более высокая активность фактора VIII при одновременном носительстве антифосфолипидных антител и повышенного уровня ГЦ.
Таким образом, не опровергая самостоятельное значение ГГЦ в формировании протромботических нарушений, наши результаты свидетельствуют о том, что патологические эффекты ГЦ в большей степени проявляются при сочетании с другими наследственными и/или приобретенными факторами риска. Более того, даже при таких тяжелых формах тромбофилии как мутации генов фактора V Leiden и протромбина, антифосфолипидном синдроме, возраст манифестации и/или тяжесть течения тромбоза может определяться наличием повышенного уровня ГЦ.
Важным разделом настоящей работы была оптимизация диагностики тромбофилии, ассоциированной с ГГЦ, в частности установление роли молекулярно-генетического тестирования. Результаты нашего исследования подтвердили влияние С677Т полиморфизма гена МТГФР на уровень ГЦ, как в контрольной группе, так и у больных с невынашиванием беременности (НБ) и сосудистой патологией (рис. 15).
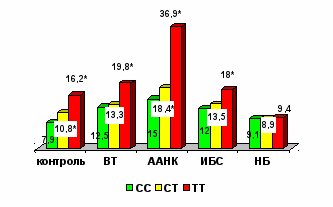
Рис. 15. Влияние полиморфизма С677Т гена МТГФР на уровень
гомоцистеина.
* - достоверное различие уровня ГЦ при СС и СТ генотипе по сравнению с ТТ генотипом, p<0,01
Умеренная и тяжелая ГГЦ, ассоциированная с ранней манифестацией и быстрой прогрессией сердечно-сосудистой патологии, как правило, является результатом комбинации 677ТТ генотипа МТГФР и дополнительных факторов, способствующих повышению уровня ГЦ. В то же время, в 47 % случаев при ВТ, 45 % при ИИ, 35% при ИБС и 42% при ААНК гипергомоцистеинемия развивалась у носителей «нормального» 677СС генотипа МТГФР (рис. 16).
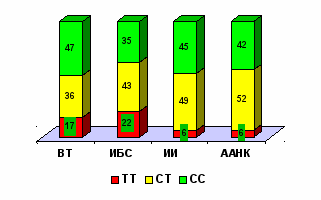
Рис. 16. Распределение генотипов гена МТГФР
у больных с гипергомоцистеинемией.
Таким образом, более чем у трети обследованных больных повышение уровня ГЦ было детерминировано либо другими наследственными, либо приобретенными факторами риска, что свидетельствует как о необходимости определения именно уровня метаболита при данной форме тромбофилии, так и целесообразности дальнейшего изучения наследственных предпосылок повышения уровня ГЦ.
Оценка вариабельности содержания ГЦ в плазме является важным аспектом в диагностике тромбофилии, ассоциированной с ГГЦ, т.к. дает представление о том, насколько информативным является однократное определение уровня ГЦ, адекватно ли оцениваются результаты проводимого лечения, а в научных исследованиях определяет достоверность получаемых результатов.
В группе из 25 пациентов уровень ГЦ был определен двукратно, с интервалом в 7-10 дней, в стандартных условиях, при отсутствии медикаментозных вмешательств. Различие уровня ГЦ в двух пробах обследуемого составило от 0,2 до 2,5 мкмоль/л, в среднем по группе 1,5±0,2 мкмоль/л. Коэффициент вариации результатов измерения одной и той же пробы методом жидкостной хроматографии (серия из 8 определений) в течение одного дня составил 2,1, в разные дни – 2,4. Выборку из 10 индивидов с исходно нормальными значениями ГЦ повторно обследовали через 6 и 12 месяцев. Различия при повторных определениях также не превысили 2,5 мкмоль/л, составив в среднем 1,7 мкмоль/л. Наши результаты согласуются с имеющимися зарубежными, согласно которым у индивида с истинным значением 10 мкмоль/л при повторных определениях в течение года разброс должен быть не более, чем от 8,4 до 11,6 мкмоль/л в 95% определений (Refsum H. et al., 2004). Мы не сочли возможным проводить подобные исследования у лиц с ГГЦ, хотя по данным литературы при значениях ГЦ выше 40 мкмоль/л внутрииндивидуальная вариабельность при отсутствии лечения может составить 25% через 4-8 месяцев и 35% через 2 года (Den Heijer M. et al., 2005). В связи с этим в проспективных исследованиях однократное определение уровня ГЦ может не отражать его истинную последующую концентрацию. Таким образом, более точный результат может быть достигнут несколькими определениями уровня ГЦ у одного больного. В то же время, для установления факта наличия или отсутствия у конкретного пациента тромбофилии, ассоциированной с ГГЦ, в клинических исследованиях мы считаем допустимым однократное определение уровня ГЦ.
Для решения вопроса, какие значения ГЦ в «пограничном» интервале от 10 до 15 мкмоль/л подлежат медикаментозной коррекции с последующим контролем эффективности проводимой терапии, нами был проведен анализ распределения больных и лиц контрольной группы по квартилям в зависимости от уровня ГЦ. Для ААНК достоверное увеличение риска развития заболевания отмечалось уже при уровне ГЦ выше 11,6 мкмоль/л (RR=2,5; 95%CI: 1,6-3,7; р<0,0001), а при ГГЦ >16,2 мкмоль/л риск нарастал до RR=3,4 (95%CI: 2,3-5,06; р<0,0001). Достоверное увеличение риска развития ОИМ отмечалось при уровне ГЦ выше 13,2 мкмоль/л (RR=3,7; 95%CI:1,6-4,7; р<0,0001), ишемического инсульта – при уровне ГЦ выше 12,2 мкмоль/л (RR=2,8; 95% CI: 1,6-4,7; р<0,0001). Для венозных тромбозов риск становился статистически значимым при уровне ГЦ выше 11 мкмоль/л (RR=1,8; 95% CI:1,2-2,6; p=0,0009), а при уровне ГЦ выше 13,4 мкмоль/л относительный риск увеличивался (RR=3,1; 95%CI:2,12-4,51; p<0,0001).
Таким образом, было показано не только отсутствие единого порогового значения ГЦ, превышение которого ведет к увеличению риска тромбоза, но и дозо-зависимость патологического эффекта ГЦ.
Одним из наиболее трудных диагностических моментов является выявление скрытой ГГЦ с использованием метионинового нагрузочного теста. Большинство специалистов, ставящих под сомнение применение МНТ в клинической практике, приводят следующие аргументы: продолжительность и трудоемкость теста, отсутствие доказательств роли скрытой ГГЦ в развитии ССЗ. Наши данные позволяют говорить о том, что как явная, так и скрытая ГГЦ ассоциирована с выраженными прокоагулянтными и прооксидантными изменениями, неблагоприятным клиническим прогнозом сосудистой патологии.
Включение МНТ в стандарт обследования позволяет выявлять лиц с латентными нарушениями обмена ГЦ, т.е. оптимизировать диагностику тромбофилии, ассоциированной с ГГЦ. Наши данные позволяют минимизировать число проводимых тестов путем прогнозирования постнагрузочного уровня ГЦ исходя из его базального значения.
Следует уточнить, что в ходе теста оценивается изменение уровня ГЦ после приема метионина per os из расчета 0,1 мг/кг, что в среднем соответствует приему 200-300 грамм богатых животным белком продуктов питания. Максимальное увеличение уровня ГЦ после нагрузки отмечалось через 4-6 часов, а затем уровень ГЦ снижался (через сутки в среднем на 40-50%). Тот факт, что уровень ГЦ через 24 часа в ряде случаев не возвращается к исходным значениям, отмечался и ранее, однако эту точку измерения не рассматривали как диагностически значимую. По нашим данным, для адекватной диагностики постнагрузочной ГГЦ оптимально определение ГЦ через 4 и 24 часа после приема метионина.
Уровень ГЦ после нагрузки достоверно коррелирует с исходным (r=0,9, р=0,00001 через 4 часа и r=0,4, р=0,003 через 24 часа). Учет вклада базальных значений в результаты МНТ возможен как по абсолютной разнице между постнагрузочным и базальным значением ГЦ – Δ[ГЦ], так и по относительному подъему уровня ГЦ – Δ[ГЦ] %. Анализ результатов теста в контрольной группе и у больных показал более высокую чувствительность показателя Δ[ГЦ] (табл. 10).
Таблица 10.
Варианты расчета допустимого предела подъема уровня
гомоцистеина в ходе МНТ и их информативность
| Показатель | [ГЦ]через 4 часа | Δ[ГЦ] | Δ[ГЦ] % |
| Среднее значение, М | 22,6 мкмоль/л | 13,8 мкмоль/л | 152,9% |
| Стандартное отклонение, SD | 5,9 мкмоль/л | 4,3 мкмоль/л | 56,8% |
| Допустимый подъем ГЦ, М+2SD | 34,4 мкмоль/л | 22,0 мкмоль/л | 264% |
| Выявленная скрытая ГГЦ, % | 25,5 | 30,2 | 11 |
В связи с тем, что МНТ в обозримом будущем вряд ли займет место в рутинной диагностике ГГЦ, мы предлагаем минимизировать число проводимых тестов путем прогнозирования. Использование регрессионного анализа позволило создать формулы для расчета постнагрузочного уровня ГЦ.
ГЦ через 4 часа= 3,5 · ГЦ базальный - 8,5 (1)
ГЦ через 24 часа =1,9+1,6 · ГЦ базальный (2)
ГЦ через 24 часа =5,9+0,47 ГЦ через 4 часа (3)
Модель (1) достоверна по уровню значимости критерия Фишера (p=0,000017) и в целом адекватна описываемому явлению, демонстрируя удовлетворительную степень аппроксимации (RI=0,9). Модель (2) достоверна (р=0,003), однако демонстрирует низкую степень аппроксимации (RI=0,19) и не может быть использована даже для ориентировочных расчетов. Модель (3) достоверна по уровню значимости (р=0,002) и демонстрирует более высокую степень аппроксимации (RI=0,5). Необходимо подчеркнуть, что приведенные формулы рассчитаны для пациентов с артериальными и/или венозными тромбозами и рекомендуются к использованию именно у этих категорий больных.
У подавляющего большинства больных с постнагрузочной ГГЦ базальные значения ГЦ близки к верхней границе референтного интервала. Более того, можно допустить, что скрытая ГГЦ и составляет «пограничные» значения уровня ГЦ, которые уже сопряжены с повышенным риском сосудистой патологии. Проведенный анализ показал, что наличие скрытой ГГЦ высоко вероятно при исходных значениях ГЦ выше 12,5 мкмоль/л, и практически исключено при исходном уровне ГЦ ниже 7 мкмоль/л. При базальном значении ГЦ в интервале между указанными значениями и невозможности проведения МНТ рекомендуется использование формул (1) и (3). Таким образом, разработанный алгоритм диагностики тромбофилии, ассоциированной с гипергомоцистеинемией, предполагает выявление не только явных, но и латентных нарушений обмена ГЦ. Не оспаривая возможность одновременного наличия у больного двух форм ГГЦ (явной и скрытой), мы считаем нецелесообразным проведение теста у больных с базальной ГГЦ, поскольку лечение витаминами группы В является патогенетическим и для скрытой ГГЦ.
Преимущество ранней диагностики ГГЦ состоит в том, что этот фактор риска можно устранить назначением доступных и безопасных витаминных комплексов. Для оценки эффективности терапии фолиевой кислотой и витаминами B6 и B12 на уровень ГЦ в плазме в динамике наблюдалось 175 лиц с исходно различными значениями ГЦ. До начала витаминотерапии у 5% пациентов была выявлена тяжелая ГГЦ (> 50 мкмоль/л), у 25% – умеренная ГГЦ (25-50 мкмоль/л), у 35% – легкая ГГЦ (13,5-25,0 мкмоль/л) и у 35% уровень ГЦ плазмы был ниже 13,5 мкмоль/л. Все обследуемые в течение первого месяца получали лечебные дозировки фолиевой кислоты в сочетании с витаминами В6 и В12. Больные с тяжелой и умеренной ГГЦ получали терапию по двум схемам: 75% больных ежедневно принимали 2 мг фолиевой кислоты, а также витамины В6 (5 мг) и В12 (50 мкг), 25% больных ежедневно принимали 5-10 мг фолиевой кислоты. Пациенты с легкой ГГЦ и с пограничными значениями уровня ГЦ в плазме получали фолиевую кислоту по 1 мг/сут.
Уровень ГЦ на фоне ежедневного приема фолиевой кислоты и витаминов В6 и В12 достоверно снижался у всех пациентов.У пациентов с тяжелой ГГЦ за первый месяц терапии удалось снизить уровень ГЦ в среднем на 55%, за 6 месяцев – еще на 25%. При использовании высоких доз фолиевой кислоты (5-10 мг/сут) нормальные значения уровня ГЦ достигались быстрее. Нормализация уровня ГЦ у пациентов с умеренной и тяжелой ГГЦ при пролонгации приема лечебных доз фолиевой кислоты и витаминов В6 и В12 до 1 года и более достигалась в 92% случаев. При наличии легкой ГГЦ нормальные показатели достигались в 99% случаев, что позволяло переходить на поддерживающие дозы витаминов. Оптимальные сроки (в среднем 1 месяц) достижения желаемых значений уровня ГЦ (ниже 8 мкмоль/л) при использовании низкой дозы фолиевой кислоты (1,0 мг/сут) демонстрировали женщины до 35 лет без вредных привычек и сопутствующих заболеваний. В этой же подгруппе нормальные концентрации ГЦ регистрировались в дальнейшем при использовании поддерживающих дозировок (0,4-0,8 мг/сут). Коррекция уровня ГЦ была затруднена при наличии сопутствующей патологии, приводившей к нарушению всасывания витаминов группы В и/или постоянном приеме лекарственных препаратов – антагонистов фолиевой кислоты. Необходимо отметить, что отказ от приема витаминов группы В, либо попытки перехода с лечебных дозировок фолиевой кислоты на профилактические (0,2-0,4 мг/сут) при наличии у пациента индукторов ГГЦ приводил к нарастанию уровня ГЦ, в ряде случаев практически до исходных показателей.
Общепринятым методом профилактики тромбообразования является использование антикоагулянтов непрямого действия (АНД). По данным некоторых авторов (Sobczynska-Malefora A. et al., 2003) прием АНД индуцирует подъем уровня ГЦ. Нами были обследованы сопоставимые по возрастному и половому составу больные с протезами митрального и/или аортального клапанов сердца, получающие варфарин более 2-х лет, и пациенты с ТГВ и/или ТЭЛА, не менее чем через 6 месяцев после начала приема варфарина. Группу сравнения составили больные, не получающие варфарин более 6 месяцев. Все больные имели значения МНО в рамках целевого терапевтического интервала. Длительность приема АНД у больных с искусственными клапанами сердца на момент обследования была существенно выше, чем у больных с венозными тромбозами (5 лет и 2,3 года соответственно), а средние дозы варфарина были сопоставимы. Уровень ГЦ у пациентов с ТГВ и/или ТЭЛА, как на фоне приема варфарина, так и без него, был достоверно выше, чем в контроле. У больных, получающих АНД, средний уровень ГЦ был достоверно выше, чем у пациентов с венозным тромбоэмболизмом без АНД (17,2±12,3 мкмоль/л против 11,3±3,9 мкмоль/л, р=0,007). Средний уровень ГЦ у больных с протезами сердечных клапанов практически не отличался от показателя в контрольной группе и составил 9,5±3,1 мкмоль/л (табл. 11).
Таблица 11.
Уровень гомоцистеина в обследованных группах
| Показатель | Контроль | Группы больных | ||
| Протезы клапанов сердца | ТГВ и/или ТЭЛА на варфарине | ТГВ и/или ТЭЛА без варфарина | ||
| Число лиц в группе | 120 | 38 | 103 | 55 |
| Возраст (M±SD) | 36,6±14,0 | 47,2±11,7 | 47,8±13,9 | 46,7±12,4 |
| Мужчины/женщины | 55/65 | 11/27 | 56/47 | 32/23 |
| Уровень ГЦ, мкмоль/л, (M±SD) | 9,3±3,9 | 9,5±3,1 | 17,2±12,3*,** | 11,3±3,9* |
* - достоверное отличие от контрольной группы, р < 0,01
** - достоверное отличие от группы сравнения, р < 0,01
Таким образом, длительный прием варфарина при обычной структуре питания не приводил к повышению уровня гомоцистеина. Повышенный уровень ГЦ в группе больных с ТГВ и/или ТЭЛА, получающих пролонгированную терапию АНД, на наш взгляд, был в значительной степени связан с преобладанием в данной группе лиц с исходной ГГЦ. Следует подчеркнуть, что опрос пациентов не выявил приверженности определенному режиму питания. Однако, в последнее время число больных корректирующих структуру питания при приеме АНД растет и поскольку многие продукты с высоким содержанием витамина К, потребление которых ограничено у этих больных, одновременно являются источником витаминов группы В, существует потенциальная возможность повышения уровня ГЦ. Следовательно, при длительной терапии АНД целесообразно проведение профилактики ГГЦ. Последнее особенно актуально для пациентов с протезами клапанов сердца, пожизненно получающих непрямые антикоагулянты, у которых при нарастании уровня ГЦ повышается не только риск тромбоэмболических осложнений, но и риск индукции атеросклеротического повреждения сосудов.
В целом, результаты проведенного исследования свидетельствуют о значимой роли ГГЦ в формировании протромботических нарушений системы гемостаза. Универсальным механизмом, опосредующим патологические эффекты ГГЦ как в артериальном, так и в венозном русле является развитие оксидантного стресса и эндотелиальной дисфункции, инициирующей прокоагулянтные и проагрегантные изменения в системе гемостаза. Патологический потенциал ГГЦ в большинстве случаев проявляется при сочетании с другими наследственными и приобретенными индукторами атеросклероза и тромбоза. Сочетание ГГЦ с генетическими вариантами, ассоциированными с усилением активности тромбоцитарных рецепторов, повышает риск развития окклюзионных поражений артериального русла, а сочетание с неблагоприятными генотипами факторов, влияющих на плазменно-коагуляционную, антикоагулянтную и фибринолитическую активность, повышает риск развития венозных тромбозов. Было бы неправомерно предполагать, что устранение только одного фактора риска позволит радикально изменить статистику заболеваемости и смертности от ССЗ. В то же время своевременная диагностика ГГЦ – фактора риска, задействованного в равной степени в патогенезе атеросклероза и тромбоза, открывает перспективы разработки новых подходов к улучшению жизненного прогноза значительного числа пациентов. Снижение риска ССЗ на индивидуальном и популяционном уровне путем устранения гипергомоцистеинемии имеет большое медико-социальное значение.
