Урок із використанням інтерактивної технології кооперативного навчання «Карусель»
| Вид материала | Урок |
- Л. О. Шевчишина учитель гімназії №34 «Либідь» Подільського району Застосування інтерактивної, 209.97kb.
- Б. Д. Грінченка інститут післядипломної педагогічної освіти кафедра методики мов, 222.79kb.
- Удк 378. 147. 1: 004., 198.01kb.
- 10 Інтерактивні технології кооперативного навчання, 1027.49kb.
- Підручників для дистанційного навчання [1-5], але в жодному з них не висвітлені питання, 83.65kb.
- Особливості технології уроків української мови та літератури, 138.54kb.
- Технології дистанційного навчання Серед сучасних педагогічних технологій найбільший, 275.8kb.
- Удк 37. 026 Неля Самойленко еволюція поняття «педагогічні технології», 176.42kb.
- Сучасні інформаційні технології та інноваційні методи навчання у вивченні англійської, 93.41kb.
- Опис власного методичного досвіду, з актуалізації опорних знань та вмінь учнів в процесі, 366.74kb.
МЕТАЛИ
узагальнюючий урок із використанням інтерактивної технології кооперативного навчання «Карусель»
Металлы отверзают недро земное к плодородию; металлы
служат нам в ловлении земных и морских животных для
пропитания нашего; металлы облегчают купечество
удобную к сему монетою… И кратко сказать, ни едино
художество, ни едино ремесло простое употребления
металлов миновать не сможет.
М.Ломоносов.
Мета уроку: узагальнити, систематизувати знання учнів про розташування металів у періодичний системі, їх будову та властивості; розвивати вміння критично мислити, реалізовувати отримані знання на практиці, здатність до співпраці та відповідальної поведінки; виховувати почуття солідарності, прагнення осягти сутність, такі соціальні якості як дисциплінованість, здатність висловлювати свою думку, слухати інших.
1. Організаційний етап уроку.
2. Мотивація навчально-пізнавальної діяльності учнів.
Нині ми не уявляємо свого життя без металів та їхніх сплавів. І куди б не кинув оком – метали завжди поруч. Вони допомагають людині обробляти землю, будувати, готувати їжу, летіти в космос, обігрівати та освітлювати оселі, видобувати корисні копалини. Вивчивши дану тему, ми з’ясували суть багатьох фізичних і хімічних процесів, що відбуваються з металами. Сьогодні нам потрібно повторити й узагальнити, привести знання до стрункої системи й навчитися застосувати їх у практичній діяльності, а можливо, й у нестандартних ситуаціях.
3. Оголошення теми та очікування результатів.
На уроці ми узагальнимо знання з теми «Загальна характеристика металів» на рівні їхнього застосування у повсякденному житті, продовжимо формування таких загальнолюдських цінностей як здатність до співпраці, відповідальної поведінки, здатність не лише висловлювати свою думку, а й слухати інших. Тест наприкінці уроку оцінить ступінь сформованості ваших компетентностей з теми.
4. Надання необхідної інформації.
«Незвичайне у звичайному»
Демонструються зразки металів, триває обговорення галузей їхнього застосування, звучить багато цікавих фактів про метали, які свідчать, що поряд багато незвичайного.
Мg – у 1,5 рази легший за «крилатий» алюміній, широко використовується у піротехниці. Нагрітий на повітрі до 550 С, він спалахує і миттєво згоряє сліпучим яскравим полум’ям.
Легкість могла б зробити цей метал чудовим конструкційним матеріалом, але чистий магній м’який і неміцний. Застосовується у вигляді сплавів з Al, Zn, Mn. Бере участь у фотосинтезі, бо входить до складу хлорофілу.
Біологи Франції встановили цікавий вплив Са та Мg на стать потомства: якщо їжа матері багата на ці елементи, то в потомстві переважала жіноча стать.
Li – найлегший із легких.
Аналітичним шляхом встановлено, що разом із склянкою гарячого чаю ми випиваємо близько 10-15 мг скла. Якщо при добуванні скла до нього додати Li, його розчинність зменшиться у 100 разів. Використовується в металургії, входить до складу електроліту акумуляторів, є ракетним паливом.
Cs – метал, що можна розплавити на долоні – t пл.. = 28,5 С (другий після ртуті). Від повітря він легко спалахує, при дії води – із вибухом загорається, бурхливо реагує навіть із льодом.
Використовується для одержання вакууму при виготовленні радіоламп.
Солі Цезію застосував у медицині для лікування деяких виразкових процесів.
Ba – помічник лікарів
М’який, легко загоряється на повітрі від удару. Барій – чудовий поглинач рентгенівських променів, тому захисні стінки медичного рентгенівського обладнання роблять із цегли, що містить сполуки Ва. Барієва «каша» (Ba SO4) застосовують при рентгенівських дослідженнях шлунка, бо Ba SO4 затримує рентгенівські промені більше, ніж м’які тканини організму; це дає змогу знайти анатомічні зміни. Суміш Ba SO4 та ZnSO4 білилами, застосовують у малярській справі. Ва (NO3)2 фарбує полум’я в зелений колір, це надає феєрверкам зелених вогнів.
Fe – будівник Всесвіту, основа всієї металургії, машинобудування, залізничного транспорту, суднобудування, грандіозних інженерних споруд. Fe входить до складу гемоглобіну крові, багаті на нього печінка та селезінка. Бере участь в окисних процесах рослинних організмів.
Tl (тантал) – метал високої частоти, незамінний у хірургії, бо має чудову властивість: не подразнює живих тканин, добре обробляється, на нього не діє жоден медикамент.
«Картинна галерея»
Погляньте на цю картину та запишіть у зошит 3-4 слова, що позначають предмети, змальовані на цій картині. Знайдіть у періодичний системі елементи, що починаються з такої ж літери, що і виписані слова. Це елементи металічні чи неметалічні? Як визначили? Де саме розміщені металічні елементи в періодичній системі?
Особлива будова атомів зумовлює характерні особливості будови речовини. Тож:
- Що спільного в будові атомів металічних елементів?
- Закінчить низку міркувань:
невелика кількість низька легко
Me → е- на зовнішньому рівні → електронегативність → віддають е- →
металічний…. + металічні …….
(зв’язок) (кристалічні гратки)
- За рахунок чого утворюються металічний зв’язок? (слайд № 1)
- Види та будова металічних кристалічних граток (слайд № 2)
- Характерні фізичні властивості металів (слайд № 3)
«Хімічне доміно»
Ця гра дасть змогу узагальнити знання з хімічних властивостей металів. У вас в руках картки із зображенням другої частини рівнянь хімічних реакцій, характерних для металів. Перша – на фліп-чарті. З’єднаємо їх для утворення схем реакцій та перетворимо їх на хімічні рівняння.
C
→
 u + НCl
u + НCl C
→ CuCl2 + Au
u + Au Cl3
B
→ Ba O
a + O2
B
→ Ba (OН)2 +Н2
a + Н2O
Z
→ Zn Cl2 + Cu
n + Cu Cl2
F
→ Fe Cl2 + Н2
e + НCl
Тож, з якими речовинами вступають в реакцію метали? (слайд № 4)
5. Інтерактивна вправа «Карусель» (технологія кооперативного навчання)
Вправа одночасно включає в активну роботу зі спілкування для обговорення питань усіх учнів класу. Вона перевіряє глибину наявних знань та розвиває вміння аргументувати власну позицію та здатність до співпраці.
Кожен учень, який сидить у зовнішньому колі, має аркуш із конкретним питанням і під час переміщення збирає максимум інформації, поглядів із зазначеного питання. Наприкінці відповіді заслуховуються, виявляються питання особливо складні, продуктивні, ті, що швидко вичерпалися, а також аналізується робота партнерів.
Питання для інтерактивної вправи:
- Чому мідь більш пластична за цинк?
- В електрохімічному ряду напруг металів алюміній займає позицію досить активного металу. Життєвий досвід говорить про хімічну пасивність металу (посуд). Спростуйте цю невідповідність.
- Чому метали на відміну від більшості твердих неметалічних речовин проводять електричний струм?
- Чому натрій зберігають під шаром гасу чи парафіну?
- Чим обумовлена непрозорість та металічний блиск металів?
- Чому в 1912 році загинула експедиція англійського дослідника Роберта Скотта, яка прямувала до Південного полюса?
Слайд-відповіді:
№ 1

мідь цинк
(кубічна гранецентрована) (гексагональна щільноупакована)
№ 2 4 Al + 3O2 → 2 Al2O3
Поверхня (неполірована) алюмінію вкрита захисною оксидною плівкою, на яку не діють вода, кислоти.
№ 3
В
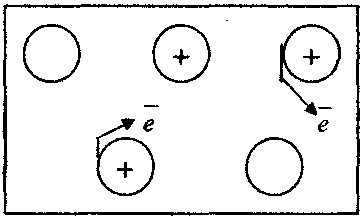 ільним електронам надається
ільним електронам надаєтьсяспрямований рух
№ 4 4Na + O2 → 2 Na2O
№ 5 «Електронний газ»
частину променів сонячного світла
може поглинати (непрозорість),
а більше частину відбивати
(металічний блиск)
№ 6 Посуд з пальним експедиції був запаяний оловом, яке за низьких температур стало крихким і розсипалося на порошок. Пальне витекло.
Перехід пластичного білого олова в порошкоподібне сіре олово при низьких температурах дістав назву «олов’яна чума».
6. Підбиття підсумків уроку.
Підводимо риску під знаннями, що повторені, оглянемося на події, що відбулися на уроці, склавши Ретро-план та відтворивши послідовність ефективних та продуктивних форм роботи (фліп-чарт).
7. Оцінювання результатів уроку
……, ……., …….., …….., ………, …….. вміло протягом уроку добирали необхідну інформацію, логічно обґрунтували твердження, відокремлювали факти від суб’єктивної думки, виділяли причинно-наслідкові зв’язки, робили висновок і тому отримують за роботу на уроці оцінки 10-12. Це оцінка навичок мислення.
Оцінювання ж знань відбудеться за допомогою тесту, завдання якого полягає у виборі однієї правильної відповіді.
Варіант І Варіант ІІ
1. Метал, що має найбільш 1. Метал, що має найвищу температуру
виражений металічний блиск: плавлення:
А Na А Zn
Б Al Б W
В Ag В Co
2. Метал, що має найнижчу 2. Метал, що має найбільшу густину:
температуру плавлення:
А K А Os
Б Ag Б Fe
В Hg В Ca
3. Найтвердіший метал: 3. Найлегший метал, який застосовується
як конструкційний:
А Co А Cu
Б Ni Б Al
В Cr В Zn
4. Найбільш електропровідний 4. Найм’якший метал:
метал:
А Cu А Na
Б Al Б Al
В Ag В Ba
5. Що спільного в будові 5. Що спільного в будові атомів елементів
атомів елементів з порядковими з порядковими номерами 12 і 20:
номерами 11 і 19:
А заряд ядра атома А заряд ядра атома
Б кількість електронних рівнів Б кількість електронних рівнів
В кількість електронів на В кількість електронів на
зовнішньому рівні зовнішньому рівні
6. З водою не взаємодіє: 6. З хлоридною кислотою не взаємодіє:
А Cu А Cu
Б Fe Б Fe
В Zn В Zn
7. Назва хімічної сполуки CaH2 7. Назва хімічної сполуки Al2S3
А кальцій гідрат А алюміній сульфід
Б кальцій гідроксид Б алюміній сульфіт
В кальцій гідрид В алюміній сульфат
8. Установіть відповідність між металами та їх фізичними властивостями:
А K 1. Тугоплавкий метал А Na 1.За звичайних умов - рідина
Б W 2. Рожево-червоний метал Б Au 2. плавиться в гарячій воді
В Cu 3. М’який, легко ріжеться В Ag 3. Жовтий метал, високопластичний
ножем Г Hg 4. сріблясто-білий метал із високою
Г Fe 4. Сріблясто-сірий метал електропровідністю
із високою пластичністю
8. Інформація про домашнє завдання.
Пропонується спеціальне домашнє завдання, що підлягає оцінюванню «Якби колись…» Це есе, в якому потрібно подати ідеї щодо проблемного питання: що було б, якби людина не навчилася добувати метали з руд?
