«Российский научно-исследовательский нейрохирургический институт им проф. А. Л. Поленова»
| Вид материала | Автореферат |
- Глиальные опухоли головного мозга: краткий обзор литературы и протокол лечения больных, 355.75kb.
- При пункционных методах лечения дискогенных радикулопатий, 373.9kb.
- Методические указания му 1 2600-10, 485.46kb.
- Свод правил по проектированию и строительству метрополитены дополнительные сооружения, 1496.85kb.
- Программа научно-практической конференции «новые технологии в экспериментальной биологии, 107.02kb.
- согласован мчс россии письмо n 43-95 от 14., 1639.07kb.
- Минерального питания и сортовых, 302.07kb.
- «Научно-исследовательский институт дезинфектологии», 448.62kb.
- Методические рекомендации мр 6 0050-11, 382.97kb.
- Научная конференция «Образы Италии в русской усадебной культуре», 36.67kb.
Сопоставление анамнестических и интраоперационных данных
На операции кровоизлияния различной давности в ткань опухоли обнаружены в 3,7% наблюдений. Геморрагии чаще локализовались в участках мозгового вещества, прилежащих к менингиомам, и интра- экстратуморозно - на границе опухоли и окружающей мозговой ткани (30% наблюдений соответственно). По срокам кровоизлияния преобладали кровоизлияния различной давности, свежие - в 25% случаев, сочетание их - в 12,5%. Некрозы в ткань менингиом верифицированы во время операции у 3,7% пациентов, в отличие от кровоизлияний они встречались у больных и с внутрижелудочковой локализацией менингиом. У пациентов с острым началом заболевания, связанным с подъемом АД, во время операции кровоизлияния в опухоль или наличие перифокальных размягчений мозговой ткани ни в одном случае не были обнаружены.
Ошибки диагностики в случаях развития инсультоподобных эпизодов были связаны с тем, что врачами они интерпретировались как острые нарушения мозгового кровообращения вследствие атеросклероза мозговых сосудов и ГБ. В дифференциальной диагностике с сосудистыми заболеваниями головного мозга повторный характер острых состояний и АД трактуются ими как проявления сосудистого заболевания головного мозга из-за того, что не учитывается топико-диагностическое значение артериальной гипертонии как локального симптома, возникающего при расположении менингиом вблизи рефлексогенных зон мозга. Не учитываются данные анамнеза (рентгенотерапия волосистой части головы как провоцирующего фактора в развитии менингиом) и наличие очаговых симптомов (локальный гиперостоз) в клинике менингиом до возникновения инсультоподобных эпизодов, а также преобладание моноплегического типа пареза в структуре двигательных нарушений после развития острых эпизодов.
Анамнестические сопоставления выявляют несоответствие между частотой инсультоподобных эпизодов (12,8%) в клиническом течении и редкостью кровоизлияния / некрозов в менингиомы (3,7% соответственно, p<0,01). Кровоизлияния чаще обнаружены при менингиомах серпа большого мозга, некрозы были верифицированы и при внутрижелудочковых менингиомах, протекавших латентно.
При соотнесении клинического течения с результатами оперативных вмешательств установлено, что при некротически-измененных менингиомах чаще отмечены медленное нарастание симптоматики с длительным моносимптомным периодом (50%) и быстро прогрессирующее нарастание (30%). При кистозно-измененных менингиомах - быстро прогрессирующее течение (35%), ремиттирующее - только в 5% случаев. При сочетании типов течения (14,9%) ремиссия клинических проявлений (частичная и кратковременная) при постепенном нарастании симптоматики наблюдалась крайне редко, в двух случаях из трех, против инсультоподобных эпизодов - в 37 (12,8%) случаях. При менингиомах, врастающих в кости свода черепа, преобладал медленно прогрессирующий тип течения с длительной моносимптомной фазой (43,5%), быстро прогрессирующий наблюдался в 2,6 раз реже (16,5%).
Сопоставив клиническое течение с гистологической структурой опухоли, выявили, что при медленно прогрессирующем течении с моносимптомной фазой (36,7%) среди типических менингиом удельный вес менинготелиальных, фиброзных и смешанных вариантов был практически одинаковым, с малосимптомной фазой (17%) удельный вес фиброзного варианта был выше. При быстро прогрессирующем и лавинообразном темпах течения (22,6% и 4,5%), напротив, превалировал менинготелиальный вариант (45% и 62,5%). Сопоставление темпов течения атипических и анапластических менингиом выявило преобладание быстро прогрессирующего (22,8%, p<0,05) и лавонообразного (31,3%, p>0,05) темпов при анапластических менингиомах.
Сопоставление характера морфологических изменений в ткани опухоли с гистологической структурой менингиом обнаружило, что кровоизлияния чаще развивались в типические и анапластические менингиомы (4 больных соответственно), очаги некроза - в анапластические (8 пациентов). Кистозно-измененные менингиомы, напротив, чаще встречались при типических менингиомах (13 наблюдений), среди которых был выше удельный вес менинготелиального варианта.
При сопоставлении характера роста и гистроструктуры менингиом выявлено, что среди типических менингиом удельный вес менингиом, врастающих в кости черепа, составил 24,9% наблюдений (44 больных из 177) с превалированием менинготелиального варианта (45,4%). Среди атипических менингиом их удельный вес составил 35,7% наблюдений (15 больных из 42), а среди анапластических - уже 45,6% (26 больных из 57).
Особенности характера проявлений начальных признаков менингиом полушарий большого мозга
Необходимость совершенствования клинических критериев распознавания менингиом полушарий большого мозга побуждает к тщательному изучению ранних симптомов болезни – их клинических особенностей, динамики развития и основных различий.
При анализе качественных характеристик (частота, структура, выраженность, динамика) начальных симптомов наше внимание акцентировалось на особенностях их проявления в зависимости от локализации менингиом. Среди начальных признаков менингиом разной локализации ведущими были головные боли (38,6%) и судорожные припадки (35,2%) (рис. 2).

Рис. 2. Начальные признаки менингиом полушарий большого мозга.
Головными болями чаще проявлялись внутрижелудочковые менингиомы (72,7%), конвекситальные, парасагиттальные и серпа большого мозга – примерно с одинаковой частотой (41,3%, 33,6% и 38,8% соответственно). При всех локализациях менингиомы начинались изолированными головными болями чаще, чем головными болями, сочетавшимися с другими признаками (p<0,01).
При конвекситальных менингиомах доказано влияние менингиом области лобной доли на возникновение заболевания изолированными головными болями (рассчитанный ² - 5,9), а менингиом области теменной доли – в сочетании их с другими симптомами заболевания (рассчитанный ² - 7,7).
Начальные головные боли главным образом сочетались с подъёмами АД, у 26 (61,9%) больных из 42. Установлена зависимость частоты сочетания головных болей с АД от локализации опухоли - в 9 (90%) случаях из 10 головными болями, сочетавшимися с подъёмами АД, манифестировали менингиомы средней трети ВСС (рассчитанный ² - 4,2).
Менингиомы различных локализаций начинаются в основном парциальными припадками (ПП) (64,7%), значительно реже – первично-генерализованными (ПГ) (18,6%), полиморфными припадками (7,8%), бессудорожными пароксизмами (6,9%) и простыми абсансами (2%). Влияние локализации опухоли на начало заболевания парциальными припадками установлено при менингиомах ВСС и области теменной доли (рассчитанный ² - 4,1 и 5,5), ПГ припадками – при менингиомах области лобной доли (рассчитанный ² - 7,7). При менингиомах ВСС парциальными припадками манифестировали в основном менингиомы средней трети синуса (25 наблюдений). Среди внутрижелудочковых менингиом полиморфными припадками (вегетативно-висцеральными и психосенсорными пароксизмами) с постприпадочным выпадением общемозгового характера манифестировали только менингиомы заднего рога бокового желудочка (9,1%).
Особенности трансформирования неврологических признаков в течении заболевания. Значимость различных признаков в клинической диагностике менингиом полушарий большого мозга
Динамику различных неврологических признаков рассматривали для установления их значимости в клинической диагностике менингиом полушарий большого мозга и определения силы влияния фаз заболевания на их выраженность. Знание этих факторов способствует выработке дифференциально-диагностических критериев в диагностике менингиом с другими схожими заболеваниями мозга.
В целом, головные боли в клинике менингиом полушарий большого мозга отсутствовали почти у 1/3 больных (26,2%). Среди вариантов динамики головной боли медленное нарастание, стабильность, регресс и изменение характера отмечались чаще у пациентов в фазе КСК (70%, 70,2%, 76,9% и 80% соответственно). Нарастание головной боли (постепенное), гипертензионный характер (без уточнения темпа нарастания) и сочетание изменений в динамике головной боли доминировали в фазе УКД (63,6%, 80% и 52,7%). в фазе ГКД также преобладали гипертензионный характер, сочетание изменений (20% и 21,8 %) и нарастание головной боли, но с превалированием удельного веса быстрого темпа (21,4%).
В течении конвекситальных и парасагиттальных менингиом интенсивность ее чаще не изменялась, в течении внутрижелудочковых менингиом чаще нарастала (быстро - только в одном случае). При менингиомах серпа большого мозга она одинаково часто нарастала, проявлялась сочетанием изменений и оставалась стабильной.
В течении менингиом ВСС головные боли сочетались с АД (10 наблюдений) и имели типичную зону ирритации (6 случаев). При этом выявлена зависимость характера этих проявлений от локализации менингиом. Они сочетались с АД только у пациентов с менингиомами средней трети синуса, иррадиировали в половину лица / нижнюю челюсть главным образом у больных с менингиомами средней трети и крайне редко - у пациентов с менингиомой передней трети.
В отличие от головной боли при менингиомах других локализаций в течении конвекситальных менингиом головные боли чаще иррадиировали в половину лица или в нижнюю челюсть (7 случаев), чем сочетались с подъёмами АД (2 наблюдения). Они иррадиировали в половину лица и / или в нижнюю челюсть только у больных с менингиомами латеральной борозды (10%), сочетались с АД у больных с менингиомами латеральной борозды и области теменной доли (1,4% соответственно), носили интенсивно жгучий характер у пациентов с менингиомами области теменной доли.
В течении менингиом серпа большого мозга головная боль иррадиировала в половину лица или в нижнюю челюсть у больных с менингиомами передней и задней трети (2 наблюдения соответственно), сочеталась с подъёмами АД в отличие от менингиом ВСС очень редко (один случай).
В течении внутрижелудочковых менингиом головная боль сочеталась с АД почти у 1/4 пациентов, в отдельных случаях возникая только при повышении АД.
Выраженность головных болей в течении заболевания зависела от локализации менингиом. У больных с конвекситальными и парасагиттальными менингиомами они чаще были хроническими (55,6% и 55,9%), у пациентов внутрижелудочковыми и фалькс-менингиомами, напротив, постоянными (54,5% и 52,1%). Головные боли были главным образом локальными, односторонними и только при внутрижелудочковых менингиомах одинаково часто локальными и смешанными.
Таким образом, сочетание головной боли с АД в начале и течении заболевания затрудняло оценку головной боли как клинического признака менингиом, а наличие зон типичной иррадиации в структуре твердооболочечного болевого синдрома трактовалось врачами как тригеминальные вегетативные цефалгии. Отсутствие головной боли и сохранение ее интенсивного в течении всего периода заболевания у значительного числа больных было основным дезориентирующим моментом в клинической диагностике менингиом.
Сопоставление частоты возникновения инсультоподобных эпизодов и частоты сочетания головной боли с АД от локализации менингиом выявило наличие детерминированности для тех и других. В пределах ВСС и серпа большого мозга острые эпизоды наиболее часто возникали при поражении средней трети синуса и средней трети серпа большого мозга, а головные боли сочетались с АД только при их поражении. При конвекситальной локализации острые эпизоды возникали чаще при поражении области теменной доли и латеральной борозды, а головные боли сочетались с АД только при их поражении.
Внимание клиницистов должно быть обращено и на то обстоятельство, что лавинообразное течение менингиом наиболее часто встречается при поражении ВСС (8,8%), с наибольшим удельным весом при менингиомах средней его трети (54,5%). А при исследовании глазного дна склеротические изменения сосудов сетчатки наиболее часто обнаруживались у больных с менингиомами средней трети синуса (78,9%, p<0,01), средней трети серпа большого мозга (50%) и теменной доли (36,8%).
Поэтому пациенты среднего и пожилого возраста, находящиеся на диспансерном наблюдении по поводу ГБ, атеросклороза сосудов головного мозга, дисциркуляторной энцефалопатии, вегетативно-сосудистой дистонии, составляют резервную группу для активного выявления больных с опухолями мозга на ранней стадии заболевания. Формально-регистрационное проведение диспансеризации, когда больные не подвергаются полноценному периодическому обследованию на современном уровне, приводит к тому, что правильный диагноз ставится запоздало.
В динамике заболевания судорожный синдром усложнялся присоединением других типов припадков или клинических симптомов к структуре начальных приступов, а также заменой или регрессом как самих начальных приступов, так и отдельных составляющих этих приступов. В целом, в течении менингиом полушарий большого мозга однотипность судорожных припадков сохранялась у 65 больных, у 90 наблюдались различные варианты трансформации. При этом характер трансформации припадков зависел от локализации менингиом. В течении менингиом передней трети серпа большого мозга и менингиом области лобной доли сохранялась однотипность судорожных припадков, при менингиомах средней трети серпа большого мозга и менингиомах области теменной доли наблюдалось изменение и усложнение характера припадков (рассчитанный ² - 5,8 при менингиомах серпа большого мозга, рассчитанный ² - 5,1 при конвекситальных).
В течении конвекситальных менингиом однотипность судорожных припадков сохранялась у 38,8% больных. У 61,2% пациентов происходило усложнение припадков, из них у 34,7% больных трансформация припадков ограничивалась только одним из ее вариантов и была связана в основном с ПП (18,3%). При менингиомах области теменной доли трансформация припадков выражалась одинаково часто как одним вариантом трансформации, так и изменениями, последовательно отражавшими динамику судорожного синдрома (37,5% соответственно).
Однотипность судорожных припадков в течении менингиом серпа большого мозга сохранялась у половины больных. У 37,5% пациентов усложнение судорожного синдрома ограничивалось только одним из вариантов трансформации, у 12,5% больных наблюдались изменения, последовательно отражавшие динамику судорожного синдрома (при менингиомах средней трети) (рис. 3).
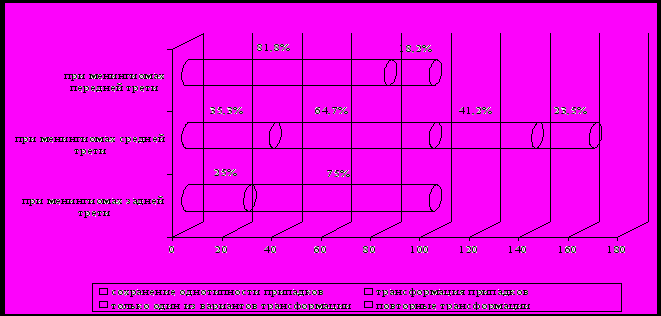
Рис.3. Трансформация судорожных припадков в зависимости
от локализации менингиом серпа большого мозга
При менингиомах средней трети серпа большого мозга направленность трансформации припадков ограничивалась только одним из ее вариантов и в основном касалась ПП (41,3%). Из изменений, последовательно отражающих динамику судорожного синдрома (23,5%), преимущественно наблюдалось присоединение припадков разных типов и постприпадочных выпадений, бессудорожных и полиморфных припадков чаще, чем сложных парциальных припадков (СПП), (вторично-генерализованных) ВГ и ПГ припадков. Другими вариантами изменений были изменения типа и / или локализации ППП и характера постприпадочных выпадений, трансформация очаговых припадков во ВГ и мономорфных припадков в полиморфные.
Для правильной топической диагностики менингиом важен тщательный анализ структуры фокального начала вторично-генерализованного и полиморфного припадков, бессудорожного пароксизма и постприпадочных выпадений. Трансформирование составляющих этих припадков в течении заболевания отражало, с одной стороны, направление роста и преимущественного распространения опухоли, с другой, уровень развития внутричерепной гипертензии. Следует отметить, что постоянным компонентом этих типов припадков в наших наблюдениях были вегетативно-висцеральные пароксизмы. Ранняя диагностика менингиом значительно затруднялась в случаях начала болезни бессудорожными пароксизмами (пароксизмальными приступами рвоты, тошноты, слепоты), полиморфными припадками, вегетативно-висцеральными ППП и ППП с нарушением психики. Они трактовались специалистами только как невротические или сосудистые расстройства.
Частота судорожных припадков по мере углубления клинической декомпенсации заболевания снижалась с 61,8% случаев в фазе КСК до 6,4% в фазе ГКД (табл. 1). Они были доминирующим признаком у больных в фазе КСК (52,4%) и единичными эпизодами - в фазе ГКД (54,5%). Как единственный признак менингиом судорожные пароксизмы выявлялись редко и только в фазе КСК (5,7%).
Таблица 1
Распределение больных в различных клинических фазах
по интенсивности судорожного синдрома (%)
-
Клинические
фазы
Интенсивность судорожного синдрома
Всего
В
среднем
доминирующие
единственный
устойчивые
однократные
эпизоди-ческие
ритмичные
аритмичные
КСК
52,4±4,9
5,7±2,3
10,5±3,0
6,6±2,4
16,2±3,4
8,6±2,7
100
61,8 ±3,7
УКД
24,1±5,8
-
29,6±6,2
12,9±4,6
11,1±4,3
22,2±5,6
100
31,8 ±3,6
ГКД
9,1±9,1
-
9,1±9,1
9,1±9,1
18,2±12,2
54,5±15,7
100
6,4 ±1,9
В среднем
40,6±3,8
3,5±1,4
16,5±2,8
8,8±2,2
14,7±2,7
15,9±2,8
100
100
В целом клиника судорожных припадков была представлена СНВП (52,8%) и обособленно различными типами припадков (47,2%). Среди последних превалировали ПП (24,5%), затем ПГ (11,9%) и наиболее редко встречались различные виды бессудорожных пароксизмов (5,7%) и полиморфные припадки (5,1%).
В течении заболевания менялась «тяжесть» судорожного синдрома (табл. 2). В фазе КСК у наибольшего числа больных выявлено СНВП (48,2%), ПГ - у 16,7%, ПП – у 23,9%, из них ПП с вторичной генерализацией – у 10,2%. В фазе УКД увеличивается число больных с СНВП и уменьшается число больных с генерализованными припадками. В фазе ГКД у пациентов уже не выявлялись обособленно генерализованные припадки, а клиника синдрома была представлена поровну СНВП и ПП с превалированием ППП над СПП, при этом в структуре СНВП также преобладает ПП. Полиморфные припадки и бессудорожные пароксизмы были у больных в фазах КСК и УКД практически с одинаковой частотой.
Таблица 2
Распределение больных в различных клинических фазах
по структуре судорожного синдрома (%)
| Клини-ческие фазы | Структура судорожного синдрома | Всего | ||||||
| ПГ | бессудорожные | СНВП | полиморфные | ВГ | СПП | ППП | ||
| КСК | 16,7±3,5 | 5,6±2,2 | 48,2±4,8 | 5,6±2,2 | 10,2±2,9 | 6,5±2,4 | 7,2±2,5 | 100 |
| УКД | 5,3±3,0 | 7,0±3,4 | 63,2±6,4 | 5,3±3,0 | 3,5 ±2,4 | - | 15,7±4,8 | 100 |
| ГКД | - | - | 45, 5±15,7 | - | - | 18,2±12,2 | 36,3±15,2 | 100 |
| В среднем | 11,9±2,4 | 5,7±1,7 | 52,8±3,8 | 5,1±1,6 | 7,4±2,0 | 5,1±1,7 | 12,0±2,4 | 100 |
Итак, для менингиом полушарий большого мозга динамика его ведущего признака проявлялась не только снижением частоты и выраженности, но и изменением общей картины припадков. По мере углубления клинической декомпенсации наблюдался регресс генерализованных припадков и преобладание ПП в общей структуре синдрома. Если в целом в течении менигиом полушарий большого мозга частота припадков снижалась, то варианты динамики частоты зависели от локализации опухоли. В течении менингиом области теменной доли и средней трети серпа большого мозга частота припадков главным образом оставалась стабильной, в течении менингиом латеральной борозды отчетливо учащалась, в течении менингиом задней трети серпа большого мозга припадки полностью регрессировали.
Гипертензионный синдром в проявлении заболевания сформировался у 46,9% (136) пациентов, и на момент поступления в РНХИ им. проф. А.Л. Поленова большинство из них находилось в фазе УКД (47,8%). По мере углубления клинической декомпенсации увеличивался удельный вес больных с гипертензионным синдромом – с 30,6% в фазе КСК до 59,6% и 76,5% - в фазах УКД и ГКД.
У абсолютного большинства пациентов гипертензионный синдром был представлен комплексно (44,1%). В зависимости от наличия / отсутствия и выраженности определенных симптомов больные были условно разделены на три группы: в первой группе у больных ведущими признаками были головная боль, тошнота и / или рвота (19,8%), во второй группе в структуре гипертензионного синдрома отсутствовали застойные диски зрительных нервов, тошнота / рвота (4,2%), и третью группу составили больные, у которых застойные диски зрительных нервов были объективным проявлением гипертензионного синдрома (19,5%).
Самой важной составляющей гипертензионного синдрома являются застойные диски зрительных нервов, которые выявлялись у пациентов во всех клинических фазах заболевания. Гипертензионный синдром, в структуре которого отсутствовали застойные явления на глазном дне, был чаще зафиксирован у больных в фазах КСК и УКД (34 и 33 пациента соответственно), в фазе ГКД – у 5 больных. Таким образом, у пациентов в фазе УКД застойные диски одинаково часто как выявляются, так и отсутствуют, и это обстоятельство в проблеме дифференциальной диагностики у лиц пожилого возраста осложняет и затягивает распознавание опухолевого процесса.
Итак, среди разнообразных функциональных клинических симптомов менингиом полушарий большого мозга в диагностике заболевания достоверно имеют значение головная боль, судорожные припадки и гипертензионный синдром (табл. 3). При этом сила влияния разных клинических фаз заболевания на проявления этих признаков была неодинаковой.
Таблица 3
Достоверность и сила влияния признаков заболевания
на диагностику менингиом полушарий большого мозга
| Признаки менингиом | Критерий Фишера F табличное значение | Сила влияния ² Критерий Фишера F полученные данные | ||
| КСК | УКД | ГКД | ||
| Динамика головной боли | 4,28-8,47 | 19%-9,0 | 10%-4,5 | 5%-2,0 |
| Структура гипертензионного синдрома | 6,39-15,98 | 30%-9,5 | 7%-3 | 13%-7 |
| Выраженность судорожного синдрома | 5,05-10,97 | 17%-7 | 12%-4,5 | 8%-2 |
| Структура судорожного синдрома | 4,28-8,47 | 9%-3 | 7%-2 | 8%-2 |
| Динамика пареза | 9,28-29,46 | 3%-1 | 1%-0,5 | 4%-1,5 |
| Соотношение пирамидных и экстрапирамидных признаков | 9,28-29,46 | 53%-16 | 22%-4 | 20%-3 |
| Соотношение статико-координаторных нарушений с вторично-стволовой симптоматикой | 19,00-99,01 | 11%-39,5 | 5%-16 | 4%-12 |
| Выраженность диэнцефальных нарушений | 19,00-99,01 | 6%-3,5 | 2%-1 | 3%-1,5 |
| Локальные костные изменения | 161-4052 | 2%-4 | 1%-2,5 | 1%-1 |
| Объём опухоли | 3,44-6,03 | 18%-6 | 9%-2,5 | 5,1%-1 |
| Степень окклюзии синуса | 6,39-15,98 | 2%-0,7 | 1%-0,5 | 8%-2 |
| Направление роста и распространения менингиом фалькса | 5,05-10,97 | 5%-1 | 8%-1,5 | 7%-0,5 |
При дисперсионном анализе не установлено влияния клинических фаз заболевания на динамику пареза, но с надежностью 95% утверждения установлено влияние фазы КСК на соотношения пирамидной и экстрапирамидной недостаточности (табл. 3). Поэтому мы остановимся на характере и динамике этих признаков в течении болезни.
Парезы конечностей в симптомокомплексе менингиом отсутствовали больше чем у половины больных (59,1%). У остальных 119 (40,9%) пациентов в развитии заболевания динамика пареза выражалась главным образом углублением контралатерального гемипареза и присоединением гомолатеральной пирамидной недостаточности или пареза (23,1%) и углублением контралатерального гемипареза (23,1% и 10%). Значительно реже - временным регрессом пареза с различной динамикой двигательных расстройств в дальнейшем (4,7%), полным или частичным регрессом гемипареза (2,8%), углублением нижнего парапареза и присоединением пирамидной недостаточности в руках (0,3%).
По мере углубления клинической декомпенсации в 3,5 раза снижается удельный вес больных с отсутствием пареза конечностей – с 83% в фазе КСК до 23,5% в фазе ГКД. А среди вариантов динамики пареза чаще наблюдалось нарастание двусторонних моторных нарушений – с 6,8% в фазе КСК до 58,8% в фазе грубой декомпенсации. При этом у больных, находящихся в фазе УКД, спектр динамики пареза был представлен наиболее полно.
Влияние локализации менингиом на динамику пареза, как одной из причин направленной диагностики ОГМ, доказано при менингиомах области теменной доли (² - 7,8), средней трети ВСС (² - 8,0 и 5,4), средней трети серпа большого мозга (² - 6,2 и 12,4), которая при каждой из локализаций чаще проявлялась углублением двусторонних моторных нарушений.
В структуре пареза при менингиомах средней трети синуса превалировали неравномерные гемипарезы (28 наблюдений - 64,9%, из них в 20 - с преимущественным поражением ноги и в 5 - с эффектом «зубчатого» колеса), монопарезы выявлялись почти в 2,5 раза реже (27,6%). При менингиомах средней трети серпа большого мозга гемипарезы несколько чаще преобладали в ноге, чем в руке (36,8% и 21%), а фациобрахиальный тип пареза (15,8%) превалировал над моноплегическим с избирательным поражением ноги (10,5% - 2 случая). При менингиомах области теменной доли гемипарезы, наоборот, чаще преобладали в руке (17,9% больных, из них у 15,4% - с эффектом «зубчатого» колеса), чем в ноге (10,2% пациентов), а фациобрахиальный тип пареза (7,7% больных) превалировал над монопарезами руки и ноги (2,6% обследованных соответственно). Парезы конечностей у больных с внутрижелудочковыми менингиомами наблюдались чрезвычайно редко (2 случая - 18,2%).
Удельный вес экстрапирамидных нарушений, преимущественно в форме ригидно-брадикинетического синдрома, в симптомокомплексе менингиом нарастал с 29,6% случаев в фазе субкомпенсации до 70,4% в фазах декомпенсации. При этом выраженность пирамидных и экстрапирамидных симптомов в клинических фазах заболевания разнилась. В фазе КСК у большинства больных (69,2%) пирамидные и экстрапирамидные симптомы были выражены мягко или умеренно. В фазе УКД выраженность этих симптомов наблюдалась наиболее вариабельно с мягкими или умеренными пирамидными парезами и экстрапирамидными симптомами у половины больных (56%). У остальных больных отмечались умеренные (реже выраженные) экстрапирамидные симптомы и имелась мягкая или умеренная пирамидная симптоматика (32%), умеренная пирамидная симптоматика и мягкие экстрапирамидные симптомы (4%), мягкие или умеренные проявления пирамидной и экстрапирамидной симптоматики (8%). В фазе ГКД у больных наблюдались только грубые пирамидные парезы и мягкие или умеренные экстрапирамидные признаки.
Таким образом, по мере углубления клинической декомпенсации нами отмечались обратно пропорциональные соотношения между пирамидными и экстрапирамидными признаками. В фазе субкомпенсации при мягкой или умеренной пирамидной недостаточности в конечностях экстрапирамидная симптоматика превалировала, в фазах декомпенсации при грубых пирамидных парезах экстрапирамидная симптоматика была не выражена.
В общем, в клинике менингиом экстрапирамидные симптомы выявлялись относительно редко (44 больных - 15,2%), прежде всего в качестве присоединившегося признака заболевания (42) и чрезвычайно редко – раннего и не связанного с менингиомой признака. Структура их у абсолютного большинства больных (95,5%) была представлена неполно и диссоциированно основными топическими признаками и лишь у 4,5% пациентов она проявлялась широким диапазоном клинических признаков.
Обособленные нарушения статики и координации в диагностике менингиом полушарий большого мозга также самостоятельного значения не имели, однако по мере углубления декомпенсации они начинают сочетаться с дислокационными стволовыми симптомами (12,2%). В наших наблюдениях подобные сочетания выявлялись у больных во всех клинических фазах. В фазе КСК их удельный вес был минимальным - 1,4%, в фазах УКД И ГКД увеличивался до 21,3% и 29,4% больных соответственно. При дисперсионном анализе с надежностью 95% утверждения установлено влияние фазы КСК на соотношение статико-координаторных нарушений и вторичной стволовой симптоматики (см. табл. 3).
Наряду с этим в симптомокомплексе менингиом во всех фазах заболевания статико-координаторные нарушения сочетались с «истинно» супратенториальными симптомами у 75,1% пациентов, с амбивалентными симптомами – редко (12,7%).
В целом нарушения статики и координации движений выявлялись у 37,9% больных, крайне редко менингиомы ими проявлялись (4,5%). В большинстве случаев в симптоматологии координаторных нарушений статическая атаксия отмечалась в усложненной позе Ромберга, а в структуре соотношений статических и динамических признаков статическая атаксия превалировала над динамической. Динамическая атаксия проявлялась чаще в контралатеральных конечностях (54,2%), в 3 раза реже – в гомолатеральных конечностях и билатерально (16,9% соответственно), крайне редко - только в руках или ногах.
Влияние локализации менингиом на наличие статико-координаторных нарушений в симптомокомплексе поражения доказано при менингиомах средней трети ВСС, на сочетание этих нарушений с вторично–стволовой симптоматикой – при менингиомах задней его трети (² - 5,3).При менингиомах ВСС из общего числа больных (39 наблюдений - 31,2%) с нарушениями статики и координации они чаще выявлялись у больных при поражении средней трети синуса (23 - 59%), почти в 3 раза реже (23,1 и 17,9%, p<0,01) – при поражении задней и передней трети. В симптомокомплексе менингиом средней трети синуса у 10 (43,5%) пациентов они были представлены статической атаксией, преобладающей в усложненной позе Ромберга, у 12 (52,2%) больных различным соотношением статических и динамических признаков и у 4,3% доминировали в клинической картине. Статико-координаторные нарушения сочетались с вторично–стволовой симптоматикой у 17 (13,7%) больных, чаще - у пациентов с менингиомами задней трети синуса (9), затем - с менингиомами средней (5) и передней трети (3).
Другие неврологические признаки (расстройства чувствительности, психические расстройства, нарушения высших корковых функций) в общей картине заболевания носили характер как обособленного признака и сочетания признаков между собой в различных комбинациях, так и компонента судорожного припадка.
Среди клинических проявлений менингиом следует обратить внимание на гипоталамические симптомы, которые в клинике менингиом полушарий большого мозга были представлены тремя основными группами признаков: вегетативными топическими признаками, вегетативными асимметриями и вегетативными приступами. При этом вегетативные топические симптомы проявляются как обособленно разнообразными признаками, так и их сочетанием между собой во всевозможных комбинациях. Вегетативные приступы также имеют характер изолированных «автономных» приступов, компонента судорожного припадка и сочетания этих качественных характеристик. В течении заболевания они были динамичными с варьированием как составляющих пароксизмов, так и степени выраженности отдельных составляющих, а также наблюдалось видоизменение качественных характеристик как самих приступов, так и их составляющих. Это обстоятельство недостаточно учитывается клиницистами в дифференциальной диагностике менингиом с другими патологическими состояниями. Причины их возникновения неправильно интерпретировались у 71,8% больных.
В наших наблюдениях диэнцефальные нарушения проявлялись основными топическими вегетативными признаками у 103 (35,5%) обследованных, из них у 16,4% пациентов они были начальным признаком заболевания, у 1,9% больных полностью регрессировали, у 0,9% - частично с неуклонным их нарастанием в дальнейшем. На момент госпитализации у 59,8% пациентов они были выражены умеренно и являлись основной жалобой больных (p<0,01).
Чаще они выявляются у больных в фазах КСК и УКД (37,3% и 42,1%), в фазе ГКД - у 20,6% больных (p<0,05), но степень их выраженности нарастала по мере углубления клинической декомпенсации заболевания. В фазе КСК они были выражены большей частью умеренно (70%, p<0,01), в фазе УКД – чаще умеренно (57,8%), чем грубо (35,5%), в фазе ГКД – умеренно и грубо одинаково часто (45,5% соответственно). Влияние клинических фаз заболевания на их выраженность не установлено (см. табл. 3).
Воздействие локализации менингиом на проявление диэнцефальных нарушений топическими признаками доказано при менингиомах передней трети фалькса (² - 4,7 и 4,0). В отличие от других менингиом они чаще проявлялись совокупностью признаков (17 пациентов - 63%, p>0,05).
Вегетативные асимметрии, расстройства мочеиспускания и диэнцефальные приступы выявлялись у 106 (36,6%) больных из 290, главным образом в качестве присоединившегося признака (70,7%). Для определения наличия расстройств мочеиспускания и вегетативных пароксизмов требовалась специальная постановка вопроса у 8,5% пациентов.
Проявление диэнцефальных нарушений вегетативной асимметрией (² - 18,3 и 8,7) в виде дистрофических (2 – 2,2%) и трофических (6 – 6,6%) нарушений доказано при менингиомах области теменной доли. Мышечные гипотрофии в дистальных отделах контралатеральной руки выявлялись только у больных менингиомами области теменной доли (8,3%). Трофические нарушения проявлялись отеками руки (2,2%), руки с вегетативно-сосудистыми нарушениями в ней (3,3%) и лица (1,1%), характер их проявлений зависел от локализации менингиом. При поражении области центральных извилин отеки контралатеральной руки и лица появлялись спонтанно на высоте гипертензионного криза и во время вегетативно–висцерального приступа (14,3% соответственно). При менингиомах области теменной доли выявлялись отеки руки (16,7%), в основном (12,5%) в сочетании с субъективными расстройствами чувствительности и / или другими вегетативными признаками (гипергидроз, нарушение трофики кожи и ногтей, нарушение терморегуляции, изменение цвета кожи); в отдельных случаях гипертермия и гипергидроз возникали только приступообразно.
Влияние клинических фаз заболевания на динамику чувствительных расстройств не установлено. Но влияние локализации менингиом на динамику субъективных расстройств чувствительности в течении болезни установлено при менингиомах области теменной доли и латеральной борозды (² - 4,7 и 5,1). Симптоматология субъективных расстройств чувствительности у больных с менингиомами была представлена пароксизмальными болевыми ощущениями (35 пациентов – 12,1%), ощущением «неловкости» (41 – 14,1%), парестезиями (27 – 9,3%) и онемением в различных частях тела (41, из них у 7 – в качестве начального признака заболевания).
В течении конвекситальных менингиом выраженность их чаще оставалась прежней (64,2%), значительно реже усиливалась и учащалась (10,7%), усиливалась (7,1%, p<0,01). Наиболее редко они учащались, регрессировали (в том числе и частично), сохранялись только как обособленный симптом в наблюдениях, где они проявлялись различными сочетаниями, возникали с периодичностью 1 раз в 2 – 3 года, усиливался и учащался один из типов расстройств при стабильной выраженности других (по 3,6%). Так, в течении менингиом теменной доли их выраженность чаще оставалась стабильной, области центральных извилин и латеральной борозды – только стабильной. В симптомокомплексе менингиом области лобной доли удельный вес субъективных расстройств чувствительности был невысоким и в динамике заболевания они чаще нарастали. Спектр динамики нарушений чувствительности был более широким при менингиомах области теменной доли: отсутствие динамики (41,7%), только усиление, усиление и учащение (16,7% соответственно), регресс, повторяемость с определенной периодичностью, усиление и учащение одних видов без изменения других (8,3% соответственно).
Только в клинике менингиом области теменной доли они сочетались с вегетативно–трофическими расстройствами (2,8%) и пирамидной слабостью в дистальных отделах конечностей (2,8%), а также расстройства разных типов чувствительности у одного и того же больного имели качественно различные характеристики (5,6%). Как компонент судорожного припадка они отмечались при каждой из локализаций менингиом (при менингиомах области теменной доли и латеральной борозды - p<0,01, при менингиомах области лобной доли и центральных извилин - p>0,05).
Субъективные расстройства чувствительности преимущественно локализовались в верхних конечностях (спонтанные боли - 66,7%, p<001, парестезии - 53,3%, онемение - 33,3%, ощущение «неловкости» - 76,9%), при этом из всех видов расстройств чувствительности только онемение локализовалось в нижних конечностях (20%).
Среди черепных нервов значение в топической диагностике менингиом получено со стороны II пары нервов, при этом влияние локализации менингиом на характер изменений поля зрения установлено только при менингиомах ВСС и серпа большого мозга. Из общего числа больных с менингиомами ВСС (125) нарушения поля зрения обнаружены у 68 (57,6%) больных, в основном при поражении средней трети (82 - 69,4%), значительно реже - при поражении передней и задней трети (p<0,01). У больных с менингиомами серпа большого мозга они выявлялись чаще, у 41 (75,9%) больного из 67, и также при менингиомах средней трети (22 - 40,7%) чаще, чем при менингиомах передней и задней трети (29,6% и 27,8%). При этом было установлено влияние менингиом передней и средней трети как ВСС, так и серпа большого мозга на изменения поля зрения по типу битемпоральной гемианопсии (² - 8,6 и 4,8 соответственно), менингиом задней трети - по типу гомонимной гемианопсии (² - 10,4 и 4,6 соответственно).
Вместе с тем влияние локализации менингиом на характер изменений глазного дна не установлено. В частности, диски зрительных нервов были в пределах нормы менее чем у 1/4 (34,6%) и у 1/3 (44,9%) больных менингиомами ВСС и серпа большого мозга, наименее часто при поражении задней трети - у 2,9% (p<0,01) и 22,7% (p>0,05) больных соответственно.
Нужно отметить, что выявленные особенности частоты, характера, структуры и динамики разных неврологических признаков в диагностике менингиом полушарий большого мозга необходимо использовать не изолированно, а в сочетании между собой и с учетом последовательности их развития и фазы заболевания.
Менингиомы полушарий большого мозга даже больших размеров могут протекать бессимптомно длительное время либо мягко проявляться симптомами выпадения или раздражения. Для оценки зависимости симптоматики заболевания от размеров опухоли сопоставлены размеры опухоли с клиническими фазами заболевания.
По протоколам оперативных вмешательств чаще обнаружены опухоли объёмом от 51 до 100 см³ (16,7%), от 101 до 150 см³ (12,7%) и свыше 201 см³ (14,1%). Больные с объёмом опухоли до 150 см³ (преимущественно до 50 см³) чаще находились в фазе КСК, с объёмом опухоли свыше 151 см³ - в фазе УКД. По мере углубления клинической декомпенсации заболевания увеличивался удельного веса больных с большим размером опухоли. В фазе КСК было больше больных с объёмом опухоли до 30 см³ (14,7%, p<0,01) и от 51 до 100 см³ (17,5%, p>0,05), в фазах умеренной и грубой декомпенсации - с объёмом опухоли свыше 201 см³ (21,2%, p<0,01 и 26,5%, p<0,05). В фазе ГКД у больных не зафиксирован объёмом опухоли до 30 см³.
При дисперсионном анализе с надежностью 99% утверждения установлено влияние объёма опухоли на фазу КСК (табл. 3).
Влияние локализации менингиом на объём единичного опухолевого узла не установлено. При всех локализациях конвекситальных менингиом был выше удельный вес больных с объёмом опухоли до 150 см³ (p>0,05), при этом при менингиомах латеральной борозды отмечен высокий удельный вес больных с объёмом опухоли свыше 151 см³ (p>0,05).
У пациентов с менингиомами передней трети синуса выявлены чаще опухоли объёмом до 30 см³ (35,7%), средней трети – 51 - 100 см³, 101 - 150 см³ и свыше 201 см³ (24,1%, 18,5% и 22,2%), задней трети - 101 - 150 см³ и больших размеров опухоли (30,7% и 46,2%).
У больных с менингиомами серпа большого мозга при поражении передней трети, напротив, чаще обнаружены опухоли объёмом свыше 201 см³ (26,3%). У пациентов с поражением средней трети верифицированы чаще опухоли объёмом от 51 до 100 см³ (26,3%) и больших размеров (свыше 201 см³ и без указания в сантиметрах – 21,1% соответственно), задней трети – от 101 до 150 см³ (36,4%).
При внутрижелудочковых менингиомах был выше удельный вес больных с объёмом опухоли от 31 до 50 см³ и от 51 до 100 см³ (25% и 37,5%), большой объем опухоли выявлен только при поражении заднего рога бокового желудочка (12,5%).
Менингиомы, врастающие в кости черепа, были обнаружены у 29,8% пациентов. Из числа оперированных больных в фазе КСК (49,1%) удельный вес больных с костными изменениями составил 41,8%, а в фазах умеренной (38,8%) и грубой декомпенсации (12,1%) был практически одинаковым (31,1% и 33,3%). Влияние клинических фаз заболевания на частоту костных изменений при дисперсионном анализе не установлено (табл. 3).
Врастание менингиом в кости черепа при менингиомах ВСС отмечено несколько чаще (48 наблюдений - 40,7%, преимущественно при менингиоиах средней трети - 64,6%), чем при конвекситальных менингимах (37 случаев – 43%, в частности, при менингиомах латеральной борозды, области лобной и теменной долей – 37,8%, 29,7% и 24,3% соответственно). Однако удельный вес больных с костными изменениями среди больных с менингиомами области лобной доли был выше (52,4%), чем среди пациентов с менингиомами области теменной доли и латеральной борозды (40,9% и 38,9%).
В наших наблюдениях ВСС полностью был проходим у большинства больных (66,6%, p<0,01), при этом превалировал I тип поражения (p<0,01). Частичная и полная окклюзия синуса встречались одинаково часто (16,7% соответственно), вместе с тем IV тип поражения выявлен в 2 раза чаще, чем V (p>0,05). Распределение больных, находившихся в разных клинических фазах заболевания, по степени окклюзии синуса представлено в таблице 4.
Таблица 4
| Клинические фазы | Степень окклюзии ВСС | Всего | В среднем | ||||
| I | II | III | IV | V | |||
| КСК | 51,6±6,3 | 16,1±4,7 | 17,7±4,8 | 11,3±4,0 | 3,2±2,2 | 100 | 51,7±4,6 |
| УКД | 55,1±7,1 | 10,2±4,3 | 16,3±5,3 | 12,2±4,7 | 6,1±3,4 | 100 | 40,8±4,5 |
| ГКД | 55,6±17,6 | 11,1±11,1 | 11,1±11,1 | 11,1±11,1 | 11,1±11,1 | 100 | 7,5±2,4 |
| В среднем | 53,3±4,6 | 13,3±3,1 | 16,7±3,4 | 11,7±2,9 | 5,0±2,0 | 100 | 100 |
степени окклюзии синуса (%)
Нами не установлено влияние степени окклюзии на общее состояние больных и характер клинических проявлений, но сила этого влияния нарастала по мере углубления клинической декомпенсации заболевания (см. табл. 3).
Влияние локализации менингиом на степень окклюзии синуса также не установлено. При менингиомах каждого из уровней синуса превалировал I-II тип поражения (p<0,01 - при передней и средней трети). При менингиомах передней и задней трети синуса превалирование полной окклюзии синуса над частичной было статистически не достоверно (p>0,05), при менингиомах средней трети - частичной над полной (p>0,05).
Также анализировалась зависимость общего состояния больных при поступлении в нейрохирургический институт от преимущественного направления роста и распространения менингиом серпа большого мозга. В наших наблюдениях менингиомы располагались в межполушарной щели у 25 (38,5%) больных, из них у 15 пациентов – с глубоким внедрением в мозговое вещество, у одного больного – с вдавлением в полость бокового желудочка. Основное число пациентов с этим направлением роста находились в фазах КСК и УКД (11 и 10) и только 4 больных – в фазе ГКД. Менингиомы серпа большого мозга выходили из межполушарной щели на поверхность коры у 7 (10,8%) пациентов, находившихся в фазах КСК (3 больных) и УКД (4 больных). Они распространялись к основанию передней черепной ямки, в том числе и с распространением на противоположное полушарие, у 3 (4,6%) пациентов - во всех клинических фазах заболевания. Распространение менингиом до нижнего сагиттального синуса встречалось у одного больного (1,5%), находившегося в фазе КСК. Менингиомы серпа большого мозга распространялись на противоположное полушарие с образованием второго узла у 25 (38,5%) пациентов. Из этого числа больных у 3 пациентов опухоль распространялась на противоположное полушарие по нижнему краю фалькса, у 8 обследованных опухоль располагалась в межполушарной щели и прорастала серп большого мозга. Больше чем у половины больных (14) отмечены различные направления роста и распространения опухоли (в межполушарной щели с разной глубиной внедрения в мозговое вещество, выходом на кору, распространением до нижнего сагиттального синуса и п.ч.я.) с прорастанием в дубликатуру серпа большого мозга с образованием второго узла. Двустороннее распространение опухоли встречалось чаще у больных в фазе УКД, в фазе КСК и ГКД – у 7 и 5 пациентов соответственно. При различных направлениях роста и распространения опухоли прорастание дубликатуры серпа большого мозга без распространения опухоли на противоположное полушарие выявлено у 4 (6,1%) больных, находившихся в фазах КСК и ГКД (2 пациента соответственно).
Влияние направления роста и распространения менингиом большого серповидного отростка на клинические фазы заболевания нами не установлено, сила этого влияния нарастала по мере углубления клинической декомпенсации заболевания (табл. 3).
Проведенное исследование показало, что на момент госпитализации в институт по данным анамнеза заболевания и неврологического исследования возникали разной степени сложности и ошибки в определении структуры, топики и нозологии патологического процесса.
У больных с конвекситальными менингиомами гистоструктура опухоли не была ясна у 8,9% (из них у 1,1% - с неясностью детализированной локализации) больных, не была интерпретирована - у 7,9% пациентов и неправильно интерпретирована - у 1,1% обследованных. Расхождения в детализированной локализации опухоли и ошибка в ее локализации отмечены реже (2,2% соответственно). У 4,4% больных диагноз был основан только на данных КТ и МРТ из–за несоответствия клинических проявлений с данными методов нейровизуализации или из-за их регресса на момент осмотра. У 4,4% пациентов дифференциальный диагноз проводился не только по структуре опухоли, но и по нозологии патологического процесса, и у 2,2% обследованных - между костными изменениями при менингиомах и другими патологическими процессами в костях черепа. У подавляющего большинства больных (90,5%) изображения на КТ и / или МРТ были нейроморфологически верифицированы как менингиомы. У 9,5% больных нейроморфологическая верификация вызывала затруднения или была ошибочной.
У пациентов с менингиомами ВСС и серпа большого мозга чаще имели место расхождение в детализированной локализации опухоли (48% и 16,5%), в том числе с неясностью (1,6%), ошибочной интерпретацией (1,6% и 3%) и отсутствием интерпретации гистоструктуры опухоли (4,8% и 3%). Ошибки в локализации опухоли были допущены редко (1,6% и 4,5%). В 3,2% наблюдений диагноз менингиомы ВСС был основан только на данных КТ или МРТ. В других случаях проводился дифференциальный диагноз по структуре опухоли и нозологии патологического процесса (3,2% и 1,5%).
В подавляющем большинстве случаев при поражении ВСС изображения на КТ, МРТ нейроморфологически верифицированы как менингиомы (92,9%), в 3,5% - ошибочно трактовались как нейроэпителиальные (2,6%) и вторичные опухоли (0,9%). В 1,8% наблюдений нейроморфологическая верификация изображения вызывала затруднения. В других наблюдениях диагностирована менингосаркома (0,9%), изменение на КТ интерпретированы как нейрофиброматоз, на МРТ – как менингиома (0,9%).
При поражении серпа большого мозга изображения на КТ, МРТ в 98,4% обследованных нейроморфологически верифицированы как менингиомы, в 1,6% - ошибочно трактовались как нейроэпителиальные опухоли.
Наибольшие трудности возникали при диагностике внутрижелудочковых менингиом - гистоструктура опухоли не интерпретировалась в 63,6% наблюдений, из них в 27,2% - с расхождением в детализированной локализации опухоли. Ошибки в локализации опухоли допускались в 27,3% случаев, из них в 9,1% не была ясна ее гистоструктура, в 9,1% проводился дифференциальный диагноз по локализации опухоли. В 9,1% диагноз был основан только на данных КТ, МРТ. Нейроморфологическая верификация изображения на КТ, МРТ вызывала затруднения в половине наблюдений. В остальных случаях они верифицировались чаще как менингиомы (33,3%), в 2 раза реже – как нейроэпителиальные опухоли.
Дифференциально-диагностические критерии в распознавании менингиом полушарий большого мозга
Дифференциально-диагностическим критерием в распознавании менингиом полушарий большого мозга и ОГМ, имитировавшие их клиническую картину, являются возрастно-половая характеристика больных, локализация опухоли, темп течения заболевания и качественные характеристики судорожного синдрома.
Судорожными припадками ОГМ различной локализации и гистоструктуры проявлялись в основном у мужчин (8 из 9 больных). Средний возраст больных к моменту развития первого припадка составлял 36,4 ± 5,1 лет, у мужчин – 32,4 лет, у женщин – 69 лет. В отличие от менингиом полушарий большого мозга припадками манифестировали, прежде всего, опухоли лобной доли (6 случаев), чрезвычайно редко вегетативно-висцеральными и психосенсорными пароксизмы, но при этом в обеих группах ПГ припадками чаще дебютировали опухоли лобной доли (3 из 4 наблюдений во II группе).
В развернутой клинике заболевания припадки выявлялись часто (12 больных - 66,7%), преимущественно в клинике опухолей лобной доли (7 больных из 8). Структура их была представлена главным образом СНВП (5 пациентов и у 4 из них – с постприпадочными выпадениями) и ПГ припадки (5 больных и у 2 из них - с симптомом Тодда), моторными ПП с симптомом Тодда и полиморфными припадками в единичных случаях. Постприпадочные выпадения у большинства пациентов были очагового характера и чаще развивались у больных с опухолями лобной доли (4).
Типы припадков и локализация опухолей соотнесены по отношению друг к другу следующим образом: СНВП выявлялись при опухолях нескольких смежных долей (3 случая), лобной и теменной долей (1 наблюдение соответственно), полиморфные и моторные ПП – при опухолях лобной доли (1 случай соответственно), ПГ – при опухолях лобной доли (4 наблюдения) и центральных извилин (1 случай). Аналогично менингиомам по мере углубления клинической декомпенсации регрессируют генерализованные припадки - СНВП и ПГ пароксизмы выявлялись у больных только в фазе КСК, полиморфные и моторные ПП – в фазах умеренной и грубой декомпенсации.
В течении опухолей мозга частота и выраженность припадков также снижалась. Частота - с 83,3% (10) наблюдений в фазе КСК до 8,3% (1 соответственно) в фазах УКД и ГКД, выраженность - от отчетливого их доминирования (7 случаев - 53,9%) в структуре клинических проявлений в фазе КСК до устойчивого и ритмичного (1 наблюдение) и однократного (1 случай) развития в фазах УКД и ГКД соответственно. Наряду с этим однотипность припадков сохранялась у половины больных, главным образом у пациентов с опухолью лобной доли (4 больных из 5). У других (5 пациентов) судорожный синдром усложнялся, трансформация которого была связана чаще с ПП: присоединением ПП другого типа / другого типа с локализацией судорог в других мышечных группах, ППП и психосенсорных пароксизмов (1 наблюдение соответственно). Реже присоединялись полиморфные припадки с включением в их структуру других признаков в развитии болезни, и полиморфные припадки трансформировались во вторично-генерализованные с симптомом Тодда (1 случай соответственно). Итак, в отличие от менингиом полушарий большого мозга у данной группы больных крайне редко возникали ПП вегетативно-висцерального типа.
Ошибки врачей общей лечебной сети в тактике ведения больных с ОГМ происходят от незнания, недоучета или игнорирования ими следующих правил: 1) определения объёма лечебно-диагностических мероприятий с учетом общего состояния больного и возможностей лечебного учреждения (квалификация врача, наличие оснащения, развитие нейрореанимации и т.д.); 2) своевременного направления пациента к специалистам; 3) полноценного, детального и быстрого обследования больного; 4) правильного выбора места лечения; 5) квалифицированного ведения больного на всех этапах с обеспечением преемственности медицинского обслуживания.
Нечеткость и несогласованность тактических действий на диагностическом этапе медицинской помощи определяют задачи унифицирования тактики обследования больных и внедрения прогрессивных методик в практику лечебных учреждений.
Рост заболеваемости населения ОГМ, в том числе и менингиомами полушарий большого мозга, требует пересмотра методов их раннего выявления. Правильная организация специализированной помощи данной категории больных, на наш взгляд, должна обеспечивать: 1) раннее выявление медицинскими работниками общей лечебно-профилактической сети больных с ОГМ среди лиц, считающих себя здоровыми; 2) первичную постановку диагноза ОГМ врачами районной поликлиники; 3) уточняющую диагностику ОГМ и выработку тактики лечения, осуществляемую нейрохирургами специализированного учреждения; 4) работу нейрохирургического отделения в муниципальных образованиях как основного лечебного учреждения, осуществляющего организацию специализированной помощи на данной территории, учет и анализ заболеваемости и смертности; 5) воспитание у врачей общей лечебно-профилактической сети нейроонкологической настороженности и повышение их подготовленности в области нейроонкологии; 6) унификацию системы учета в нейроонкологии, экспертизу качества медицинской помощи данной категории больных.
Таким образом, анализ ошибок, определение мер по их профилактике и исправлению создают действительный резерв улучшения результатов лечения. Полученные данные позволят усовершенствовать помощь больным с менингиомами полушарий большого мозга и организацию специализированной службы.
На Рис. 4. представлен диагностических алгоритм при менингиомах полушарий большого мозга на догосиитальном этапе.
Ранняя диагностика
пол, преимущественно женский
анамнестические данные
начало заболевания
возраст, преимущественно 40-69 л.


отягощенный соматический
статус

начальные признаки
посте-
пенное
под-острое
острое





эпилептические
припадки
головная боль
обособленными патологическими факторами
совокупностью патологических факторов
КТ или МРТ
головного мозга





средний возраст - 49,9 л.
редкие
изолированная
преимущественно ПП
константный признак –
головная боль
отсутствие
головной
боли
преимущественно
хроническая

КСК - доминирующий признак
представлен преимущественно СНВП
сочетающаяся
с АД

заболевание сердца

преимущественно
локальная
односторонняя
консультация невролога


КТ или МРТ головного мозга

КСК - преимущественно сохраняется интенсивность головной боли

внечерепные опухоли, струмэктомия
признаки опухоли
нет признаков опухоли
активное динамическое наблюдение
консультация
нейрохирурга
операция
Рис.4. Диагностический алгоритм при менингиомах полушарий большого мозга
на догоспитальном этапе
