Биопрепаратов
| Вид материала | Автореферат диссертации |
- Научно-исследовательская работа на тему: Получение биопрепаратов из крови крупного, 239.84kb.
- Доклад Н. А. Феоктистовой Об итогах выполнения плана профилактических противоэпизоотических, 179.54kb.
- Эффективность применения удобрений и биопрепаратов на урожайность хлопчатника в условиях, 483.84kb.
- Клубом Органического Земледелия, ставящим перед собой такие цели: рассказ, 2161.81kb.
- Краткий отчет о научно-исследовательской деятельности фгуп «государственный научно-исследовательский, 84.53kb.
2.2.4. Усовершенствование способа глубинного культивирования золотистого стафилококка St. aureus для получения протеина А
Глубинное культивирование в реакторе проводили также при получении бактерийной массы, используемой для выделения белка А.
При конструировании иммуносорбентов, диагностических препаратов особый интерес представляет иммобилизация биолиганда через спейсор – протеин А, который встречается у 99% штаммов золотистого стафилококка и составляет 1,7 % сухого веса клетки и 6,7 % веса клеточной стенки (Матвеева И.Н., 2008). В связи с этим осуществляли усовершенствование способа глубинного культивирования золотистого стафилококка St. aureus для получения протеина А.
Культивирование золотистого стафилококка St. aureus проводили в питательной среде на основе бульона Хоттингера и мясопептонного бульона (МПБ) в биореакторе АК-210 объемом 0,01м3. Длительность фазы приспособления культуры золотистого стафилококка St. aureus составила – 0,5-1,5 час, а фазы логарифмического роста - 3,2 - 4,6 час. Максимальная биологическая активность протеина А получена из культуры при сроке культивирования 8 час и посевной дозе 50 млн.кл/мл, скорости перемешивания 100 об/мин, при температуре 37оС, при поддержания рН 7,2 и конечной концентрации St. aureus - 1,9 млрд/мл. Процесс культивирования осуществляли в стерильных условиях, при использовании титановых фильтров для воздуха, системы автоматического контроля и регулирования параметров.
Бактерийную массу золотистого стафилококка инактивировали формалином (10%) или прогреванием при 60оС, 70оС, 80оС в течение 30 мин; и использовали для выделения протеина А после хроматографической очистки. Инактивированная прогреванием клеточная суспензия при ультразвуковой дезинтеграции в течение 10 секунд импульсивно 6 раз, позволила получить биологически активный белок А в количестве - 20 мг. Дезинтеграция же клеточной суспензии, инактивированной формалином, приводила к потере биологической активности белка А. Белок А из клеточной суспензии, инактивированной формалином, извлекали методом солевой экстракции, при этом получали активный препарат, но в небольших количествах (10 мкг).
Использование аффинного сорбента IgG КРС на BrCN-Сефарозе 4B при одноступенчатой обработке дезинтегрированной ультразвуком клеточной суспензии стафилококка, инактивированной прогреванием при 60оС в течение 30 мин, культуральной среды позволило получить протеин А. Анализ чистоты выделенного протеина А показал наличие единственной белковой полосы с ММ 42 кД. Хроматографически чистый протеин А конъюгировали с ферментом пероксидазы и использовали в биотехнологии компонентов диагностических тест-систем.
Таким образом, в результате проведенных исследований усовершенствован способ глубинного культивирования золотистого стафилококка St. aureus в реакторе АК-210 и получен, биологически активный протеин А. Определены, условия культивирования, при этом максимальная концентрация бактериальной массы составила 1,9 млрд. кл/мл. Отработаны методы инактивации культуральной суспензии и дезинтеграции клеток. Установлено, что инактивация клеточной суспензии формалином приводила к потере биологической активности белка А после дезинтеграции ее ультразвуком. Из инактивированной формалином клеточной суспензии протеин А выделяли методом солевой экстракции, но в малых количествах. Активный препарат получали при температурной инактивации клеточной суспензии, ультразвуковая дезинтеграция которой имела минимальные потери, и количество выделенного активного белка А в 20000 раз больше, чем в случае инактивированной формалином клеточной массы. Протеин А использовали для конструирования иммуносорбентов и получения диагностических препаратов.
2.2.5. Усовершенствование технологии различных методов очистки биологических растворов
Применение различных методов очистки при получении питательных сред и растворов для бактерийных и вирусных препаратов необходимо для осуществления культивирования в стерильной среде и повышения качества вакцин. В этой связи проводились исследования по использованию глубинных, мембранных фильтров, оборудования и выбору методов микрофильтрации, ультрафильтрации и электродиализа.
2.2.5.1. Применение материалов на безасбестовой основе для предварительной, тонкой и стерилизующей фильтрации
биологических растворов
При очистке растворов медико-биологического назначения к фильтрующим материалам предъявляются такие требования, как исключение подвижности матрикса, вымывание различных компонентов, в особенности канцерогенных веществ, таких как асбест, что характерно для асбестовых фильтр-пластин. Совместно с сотрудниками ВНИИ ЦБП проведены работы по созданию безасбестовых фильтровальных пластин и картона для фильтрации биологических растворов.
Установлено, что фильтрационные свойства пластин зависели от их состава. Так при увеличении содержания диатомита до 60% в фильтр-пластинах ФП-1 для предварительной очистки по сравнению с композицией (ФП), содержащей 50% этого сорбента, понижало в 4 раза удельную скорость фильтрации воды. Замена в стерилизующих пластинах (ФС) окиси алюминия на диатомит (ФС-1) незначительно снижала скорость прохождения воды, и повышала скорость прохождения сыворотки КРС. Картон марки КФБЖ, КФМП использовали для предварительной фильтрации и в качестве префильтра перед мембранами при очистке желудочного сока, при фильтровании питательных сред, растворов трипсина. Опытные образцы безасбестовых фильтр-пластин размером 200х200 мм, 300х300 мм, 400х400 мм, диаметром 293 мм испытывали по воде, биологическим, солевым и ферментным растворам, питательным средам.
Полученные результаты позволили рекомендовать фильтр-пластины ФП, ФТ, ФС, ФД и картон КФБЖ и КФМП для фильтрования, очистки, стерилизации биологических растворов разного назначения. Фильтровальные виды бумаги и картона освоены на бумажной фабрике (г. Косино, Московской обл.), Красногорском ЭЦБЗ и промышленном производстве ВНИИ ЦБП.
2.2.5.2. Применение микрофильтрации и ультрафильтрации
для очистки биологических растворов
Исследование процессов микрофильтрации. Для получения стерильных питательных сред, растворов трипсина, защитных сред, разбавителей использовали микропористые мембраны отечественного и импортного производства. Максимальную скорость процесса фильтрации наблюдали у комплекта капроновых мембран фирмы Pall. Двухслойные мембраны обладали устойчивостью к стерилизации в автоклаве. На рис. 2 представлена скорость стерилизующей фильтрации различных сред и растворов для вирусных препаратов через микрофильтрационные мембраны в сочетании с префильтрами на безасбестовой основе.
Использование микрофильтрационных мембран в сочетании с префильтрами обеспечило получение стерильных растворов: 3% глютамина, концентрата лактальбумина, защитных сред (СФГА и СФГЖ), концентрата разбавителя и 0,25% раствора трипсина, используемых при культивировании вирусов. Префильтры повышали производительность мембран (с размером пор 0,2 мкм) в 5 раз в процессе фильтрования глютамина 3% и концентрата лактальбумина. При фильтрации защитной среды СФГА производительность мембран возрастала в 4 раза при использовании одного слоя картона КФБЖ и в 7 раз при использовании двух слоев картона между слоями микрофильтрационных мембран. Для объемов до 5 л рекомендуется использовать комбинации КФБЖ и мембраны 0,2 мкм; для больших объемов сочетание КФБЖ + 0,2 мкм + КФБЖ + 0,2 мкм. В качестве префильтра перед стерилизующей мембраной 0,2 мкм при фильтровании защитной среды с желатином использовали микрофильтрационные мембраны большего диаметра пор (0,8 мкм), которые в сравнении с глубинными фильтрами повышали скорость фильтрования. Использование префильтра перед мембраной или между мембранами повышало удельную производительность при микрофильтрации концентрата разбавителя.
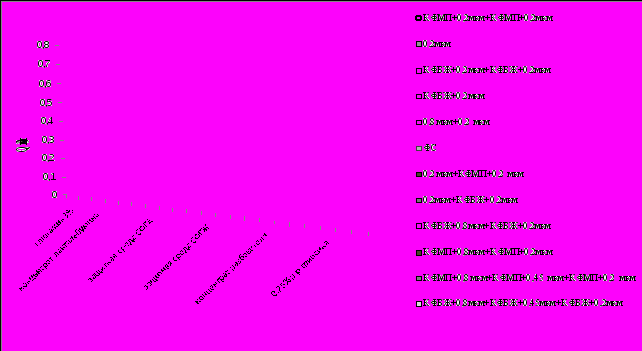
Рис. 2. Результаты стерилизующей фильтрации различных сред и растворов через микрофильтрационные мембраны в сочетании с префильтрами на безасбестовой основе:
глютамин 3%, концентрат лактальбумина; защитные среды - СФГА, СФГЖ; концентрат разбавителя; 0,25% раствор трипсина.
При стерилизации растворов трипсина использовали префильтры КФБЖ или КФМП между мембранами 0,8 мкм – 0,45 мкм – 0,2 мкм. Сыворотку крови фильтровали через мембраны с размером пор 0,45 мкм и 0,22 мкм после предварительной фильтрации через глубинные фильтры.
Технология микрофильтрации питательных сред, сывороток, растворов трипсина, в виде защитных сред, концентрата разбавителя вакцины отработана при производстве вакцины против болезни Марека и инфекционной бурсальной болезни птиц. При этом использовали комплект лабораторного стерилизующего фильтрационного оборудования ЛКСФ-1 с набором фильтродержателей диаметром 12, 25, 47, 90, 142, 293 мм и промышленные установки УСФ-293 и УСФ-0,28/7, которые испытывали на инертность и безвредность. После технических доработок, отечественные образцы были рекомендованы для использования при стерилизации питательных сред, сывороток крови, растворов трипсина.
Исследование процессов ультрафильтрации. Для очистки солевого раствора альбумина и его эффективного концентрирования использовали мембраны Владипор УАМ-300 и УАМ-200 (с селективностью по белку 98-99%), которые обеспечивали процесс ультрафильтраци с минимальными потерями белка. По сульфату аммония селективность этих мембран составила 0-2% и 5-10% соответственно. Процесс осуществляли на ячейке ФМ-02, тонкоканальной ультрафильтрационной установке ФТО-01 и рабочем макете аппарата УФ-5. На установке ФТО-01 концентрировали раствор альбумина до содержания белка 40-45%, а на аппарате УФ-5 - до 15%. В условиях производства Ставропольской биофабрики на установке ФТО-01 осуществляли обессоливание раствора альбумина диафильтрацией. Содержание соли в полученном растворе альбумина составляло 0,2% и белка 10%, что соответствовало требованиям инструкции по приготовлению питательной среды для культивирования патогенных лептоспир. Установка ФТО-01 рекомендована для очистки и концентрирования альбумина объемом до 6 л, а УФ-5 для больших объемов (6-10 л). Использование установки ФТО-01 в 4 раза сокращало время обессоливания альбумина, УФ-5 - в 6 раз по сравнению с простым диализом.
Очистку, концентрирование растворов белков, ферментов, вирусных, бактериальных суспензий осуществляли на ультрафильтрационных аппаратах на полых волокнах с целью снижения концентрационной поляризации на мембранах за счет прохождения потока жидкости. На рис. 3 представлен процесс обессоливания и концентрирование раствора трипсина (0,25%) при диафильтрации на ультрафильтрационных аппаратах разных марок.
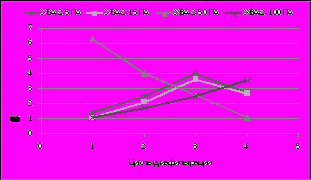
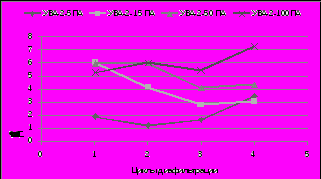
Рис. 3. Обессоливание и концентрирование раствора трипсина при диафильтрации на ультрафильтрационных аппаратах разных марок.
0,25% раствор трипсина обессоливали на аппарате УВА-2-50 в 6 раз за 1-2 цикла диафильтрацииии через полые волокна ВПУ-50ПА при одновременном концентрировании. Разделительный модуль УВА-2-100 с полыми волокнами ВПУ-100ПА концентрировал фермент на всех циклах диафильтрации при постепенном удалении солей из раствора. Степень концентрирования фермента возрастала с 5 на первом цикле до 7 на четвертом цикле диафильтрации.
Замена системы подачи жидкости центробежным насосом марки ЦНГ-0,5/10 вместо перистальтического позволила эффективно использовать разделительные модули фирмы Мем-Текс типа АР-2 с площадью фильтрации 2 м2 различных марок УВА-2-5ПА, УВА-2-15ПА, УВА-2-50, УВА-2-100 ПА, с полыми волокнами типа ВПУ-5ПА, ВПУ-15, ВПУ-50, ВПУ-100 из полиамида с пределом задержания по белку 5, 15, 50, 100 кДа при очистке ферментных и других биологических растворов.
Метод ультрафильтрации использовали для концентрирования суспензии. вируса чумы плотоядных животных. С помощью ультрафильтрации концентрировали 12 л исходной суспензии в 40 раз за 2 часа, а 6 л вирусной суспензии концентрировали до 100 мл за 4 часа (в 60 раз). Метод ультрафильтрации способствовал концентрированию суспензии в 40-60 раз.
Таким образом, исследование процесса микрофильтрации позволило применить отечественные и импортные мембраны на основе ацетата целлюлозы, регенерированной целлюлозы, нейлона (капрона) и других полимеров, а также использовать оборудование для очистки и стерилизации питательных сред и растворов в производстве биопрепаратов. Усовершенствование метода ультрафильтрации за счет применения тонкоканального и плоскопараллельного аппаратов снизило концентрационную поляризацию на поверхности мембран в процессе очистки альбумина и вирусной суспензии. Ультрафильтрационные аппараты с полупроницаемыми полыми волокнами ускорили процессы фракционного разделения, обессоливания и концентрирования биологических жидкостей.
Разработка технологии очистки и концентрирования биологических растворов в настоящее время реализуется согласно требованиям ГОСТ Р 52249-2009 «Правила производства и контроля качества лекарственных средств» с применением валидированных методов и оборудования.
2.2.5.3. Применение электродиализа для очистки альбумина
от солей сульфата аммония
При сотрудничестве с Краснодарским государственным университетом (КГУ) и Ставропольской биофабрикой, нами исследована возможность применения электродиализа для обессоливания альбумина. Процесс электродиализа представляет собой направленный массоперенос ионов солей под действием электрического тока.
Работу на технологической электродиализной установке осуществляли в автоматическом циркуляционном режиме при параллельном включении рабочих камер электродиализатора типа ЭК-04-74 (КГУ) и напряжении 75-85В, температуре не выше 35оС. Содержание солей аммония в растворе альбумина после электродиализа не превышало 0,2%, что соответствовало требованиям инструкции на питательную среду для культивирования патогенных лептоспир. Максимальная производительность аппарата по целевому продукту составляла 4,5 л/час, по исходному продукту 8,1 л/час. Электродиализ сократил в 7,2 раза время обессоливания раствора альбумина по сравнению с ранее проводимым диализом.
3. ВЫВОДЫ
1. Усовершенствована технология промышленного производства трипсина с использованием центрифугирования для разделения суспензии после экстрагирования и высаливания фермента; и крупномасштабного способа высушивания методом распыления для больших объемов раствора фермента и сублимационного для небольших партий фермента.
Разработанная промышленная технологическая линия производства трипсина испытана в опытно-промышленных условиях, а полученные партии фермента рекомендованы для использования в производстве противовирусных вакцин.
2. Применение трипсина позволило получить первичные культуры клеток (ФЭК, ФЭП, ПЭК, ТБ, ПК, ПКШ, ПЩ) и перевиваемые линии клеток (MDBK, MDCK, СПЭВ), которые обладали равноценной чувствительностью к вирусам и обеспечивали максимальное их накопление в производстве вакцин против болезни Марека, инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота и парвовирусного энтерита собак. Подтверждена пригодность трипсина при производственном получении культур клеток ФЭП и выращивании штамма ФС-126 вируса герпеса индеек и штамма ЭПМ вируса чумы плотоядных.
3. Разработан способ иммобилизации протеолитического фермента трипсина на полимерном носителе (сополимере винилиденфторида и гексафторпропилена, а также винилиденфторида и перфторметилвинилового эфира). Протеолитическая активность и диспергирующая способность фермента при этом не снижались; клетки ФЭП и ФЭК, полученные с его применением, обладали жизнеспособностью на уровне контроля, а выход клеток превышал значение контрольного опыта.
4. Получены теплостойкие полимерные материалы на основе фторкаучуков (СКФ-26 и СКФ-260Д), совмещенные композиции с фторсиликоновой смесью и фторсодержащим пластификатором, обладающие повышенной теплостойкостью к температуре 200оС, стойкостью к различным химическим средам (кислотам, щелочам и маслам) и деформационным воздействиям при сжатии.
Разработан способ оценки токсичности полимерных материалов с помощью микроорганизмов (пастерелл) и на культуре клеток (ПТ-80), исключающие использование животных, уменьшающие трудозатраты и время проведения опытов.
5. Усовершенствована технология псевдосуспензионного и суспензионного культивирования первичных и перевиваемых клеток в биореакторах (объемом - 0,005; 0,025; 0,100; 0,250 м3) с системой технологической обвязки.
Разработана технология суспензионного культивирования клеток ПТ-80 и ВНК-21/13 в биореакторах. Максимальный индекс пролиферации клеток ВНК-21/13 - 7,4 получен при использовании питательной среды на основе мышечного гидролизата.
6. Усовершенствована технология глубинного культивирования золотистого стафилококка St. aureus в биореакторе АК-210 объемом 0,01м3; определены условия получения культуры, используемой для выделения биологически активного протеина А: при температуре культивирования 37 оС, скорости перемешивания 100 об/мин, рН 7,2 и аэрации воздухом со скоростью 1,4 л/мин, посевной дозе культуры 50 млн.кл/мл и конечной концентрации St. aureus - 1,9 млрд/мл.
7. Усовершенствована предварительная, тонкая и стерилизующая фильтрация питательных сред, сыворотки крови, ферментных солевых растворов с помощью фильтр-пластин на безасбестовой основе ФП, ФТ, ФС, ФД, а также картона КФБЖ и КФМП. Отработана технология микрофильтрации питательных сред, сывороток, растворов трипсина, защитных сред, концентрата разбавителя вакцины при производстве вакцины против болезни Марека.
8. Усовершенствована система очистки и концентрирования раствора альбумина с помощью ультрафильтрации на мембранной тонкоканальной и “фильтр-прессе” установках. Для получения высокоочищенных и концентрированных растворов трипсина, вирусных суспензий и биологических жидкостей применены аппараты с полупроницаемыми мембранами в виде полых волокон типа ВПУ-5ПА, ВПУ-15ПА, ВПУ-50ПА, ВПУ-100ПА из полиамида с пределом задержания по белку 5, 15, 50, 100 кДа. Полые волокна ВПУ-50ПА за 1-2 цикла диафильтрации в 6 раз снижали содержание солей и обеспечивали концентрирование раствора трипсина. Полупроницаемые полые волокна ВПУ-100ПА эффективно концентрировали фермент в 7 раз при постепенном удалении солей из раствора. Метод ультрафильтрации на полых волокнах позволил концентрировать в 40-60 раз по объему вирусную суспензию чумы плотоядных.
9. Разработана технология глубокого обессоливания раствора альбумина методом электродиализа (до минимального содержания солей 0,2 %) в производстве вакцины против лептоспироза, обеспечивающим сокращение времени диализа в 7,2 раза.
4. ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
Результаты исследований включены в следующие документы.
1. По результатам исследований разработана и утверждена Департаментом ветеринарии Минсельхозпрода Российской Федерации нормативно-технологическая документация:
- Технологический регламент производства трипсина сухого для вирусологических целей, 01.06.1995г.;
- Технические условия ТУ 9358.013.00008064-96 ’’ Трипсин сухой для вирусологических целей’’, 04.03.1996г.;
- Наставление по применению трипсина сухого для вирусологических целей, 04.03.96г., № 13-6-2/540.
- Методические рекомендации по определению специфических антител к антигенам вирусов инфекционного ринотрахеита (ИРТ), парагриппа-3 (ПГ-3), респираторно-синцитиальной инфекции (РС), вирусной диареи-болезни слизистых (ВД-БС), аденовирусной инфекции крупного рогатого скота (АВИ) в комплексной тест-системе иммуноферментного анализа (ИФА), рассмотренные и одобренные 21 сентября 2007 года на секции “Ветеринарная биотехнология” ОВМ РАСХН, протокол №1, утвержденные 18.03.2008г.
2. Разработана технологическая схема производства трипсина. Предложена технология получения трипсина сухого для вирусологических целей, которая освоена на базе ГНУ ВНИТИБП, Омского и Алма-Атинского биокомбинатов, Курганского НПО “Синтез”.
3. Технологический регламент “Культивирование клеток и вирусов с использование экспериментальных образцов оборудования“, утвержден директором ГНУ ВНИТИБП 28.12.1985г. Разработана технологическая схема процесса культивирования клеток и вирусов в аппаратах (реакторах).
4. Опытно-промышленный регламент на производство вакцины антирабической для животных, утвержден 20.09.2009г. директором ВНИТИБП.
5. Лабораторный регламент на производство антирабической вакцины сухой для крупного и мелкого рогатого скота, утвержден директором ВНИТИБП 22.10.2010 г.
6. Технологический регламент “Вирус – вакцина сухая культуральная против болезни Марека из штамма ФС-126 М и вируса герпеса индеек, утвержден ВНИТИБП 28.12.1990 г.
7. Технологический регламент по изготовлению и контролю набора компонентов для определения уровня специфических антител к вирусам ИРТ, ПГ-3, РС, ВД-БС, АВ крупного рогатого скота в комплексной тест – системе иммуноферментного анализа, утвержден директором ВНИТИБП 21.07.2007г.
8. Разработаны полимерные композиции из теплостойких биологически инертных материалов для технологического оборудования биопроизводств. Получены авторские свидетельства (авт. св. № 701129, “Резиновая смесь на основе фторуглеродных каучуков”, бюл. – 1979. - № 44. – С.193.; авт. св. № 770126, “Резиновая смесь на основе фторкаучука”, бюл. - 1980. - № 37. – С.308; авт. св. № 783311, “Резиновая композиция на основе сополимера винилиденфторида”, бюл. - 1980. - № 44. – С.110). Материалы использованы на Щелковском биопредприятии (акты об использовании предложения от 16.02.09г.).
9. Разработан способ переработки смесей, и вулканизации в ГНУ ВНИТИБП, на Щелковском биокомбинате и в ОКБ КП. Организован участок по изготовлению полимерных материалов.
10. Разработан и испытан с положительным результатом в условиях производства способ обессоливания методом ультрафильтрации и электродиализа раствора альбумина, используемого для приготовления питательной среды ГНКИ, предназначенной для культивирования патогенных лептоспир. На Ставропольской биофабрике получено 8 серий альбумина, общим объемом 167 л (Акт испытаний от 12.11.1981 г.).
