Биопрепаратов
| Вид материала | Автореферат диссертации |
- Научно-исследовательская работа на тему: Получение биопрепаратов из крови крупного, 239.84kb.
- Доклад Н. А. Феоктистовой Об итогах выполнения плана профилактических противоэпизоотических, 179.54kb.
- Эффективность применения удобрений и биопрепаратов на урожайность хлопчатника в условиях, 483.84kb.
- Клубом Органического Земледелия, ставящим перед собой такие цели: рассказ, 2161.81kb.
- Краткий отчет о научно-исследовательской деятельности фгуп «государственный научно-исследовательский, 84.53kb.
2.2. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Производство биопрепаратов представляет собой комплекс взаимосвязанных биотехнологических процессов: приготовление компонентов среды и ее изготовление, получение фермента и его раствора для дезагрегации культур тканей; культивирование (клеток, вирусов и бактерий); выделение и очистка биологических растворов, питательных сред и растворов; сушка биопрепаратов. В связи с этим рассматривались вопросы получения отечественного ферментного препарата трипсина для вирусологических целей, процессы культивирования клеток при получении вирусных вакцин, осуществления крупномасштабного культивирования в стерильных условиях; получения бактерийной массы для получения протеина А, разработки мембранных способов очистки, разделения, концентрирования и стерилизации при использовании отечественного оборудования и материалов.
2.2.1. Усовершенствование технологии получения
фермента трипсина
2.2.1. 1. Разработка технологических процессов изготовления трипсина
В производстве противовирусных вакцин для дезинтеграции клеток используется протеолитический фермент трипсин, в основном импортного производства. Нами проведены исследования по разработке технологии получения фермента отечественного производства. Для этого необходимо было решить комплекс задач, таких как выделение, разделение и очистка фермента, его консервация, оценка физико-химических и биологических свойств. В качестве исходного сырья при получении фермента использовали поджелудочную железу (ПЖ) крупного рогатого скота (КРС), свиньи и птиц. ПЖ КРС была наиболее технологична. Исходное сырье использовали после 4-12 месяцев хранения, обеспечивающее активацию профермента трипсина. Двукратное замораживание, оттаивание и последующее измельчение ПЖ до частиц размером 8 мм, разрушающие клеточные оболочки ткани, исключали образование устойчивой суспензии и способствовали полному выделению фермента из исходного сырья и увеличению активности препарата на 40 ЕД (22-27%) по сравнению с сильно измельченной железой ( до частиц 2 мм). Максимальную активность фермента получали через 6 час экстрагирования и 12 час отстоя на первой стадии и в течение 2-3 час экстрагирования на второй стадии. Перемешивание суспензии в процессе экстрагирования проводили в автоматическом режиме (3 мин – перемешивание, 7 мин - простой), обеспечивающее незначительное пенообразование и исключающее получение устойчивой суспензии. Экстрагирование фермента проводили при температуре не выше 16оС, так как при более высокой температуре наблюдается инактивация и самопереваривание трипсина. Снижение температуры суспензии до 7+2 оС позволило получить препарат с максимально высокой активностью. РН на 1 этапе экстрагирования составлял 3,1 - 3,35, а на 2 этапе - 1,7 - 2,0. При осаждении балластных веществ в течение 6 час выход составил 9,5% от объединенного экстракта и 30% от исходного сырья. Выход балластных веществ в сухом виде составил 11% от его общей массы и 2,3% от исходного сырья. После 12-18 час второго этапа высаливания выход трипсина по отношению к фильтрату после удаления балластных веществ составил 2-2,5%. Процент выхода трипсина от исходного сырья колебался от 2,5% до 6%. В сухом виде выход фермента составил 60-80% от осажденного субстрата и 2,5-3,5% от массы исходного сырья.
Проведенные исследования позволили рекомендовать для разделения суспензии после экстрагирования следующее оборудование с учетом массы исходного сырья: до 70 кг - центрифуги ОФСст; от 70 до 100 кг – центрифуги Рапид, ОФСст, от 100 и более - шнековую центрифугу ОГШ отдельно или совместно с центрифугой ОФСст для последующего осветления фильтрата. При разделении суспензии после высаливания балластных веществ и трипсина использовали следующее оборудование: 20-50 кг - центрифугу ОФСст, 20-100 кг - суперцентрифугу ОТР-101К, более 100 кг - сепараторы для отделения балластных веществ и трипсина, и суперцентрифугу для извлечения трипсина после осаждения. Протеолитическая активность препарата после разделения суспензии с помощью центрифуг была на 20-40% выше, чем при использовании обычного фильтрования, при этом снизились потери, и улучшилось качество готового препарата. Кроме того, в 2-3 раза уменьшились затраты рабочего времени и количество обслуживающего персонала.
Остаточное содержание солей в высоле трипсина составляло 30-50%, удаление которых проводили с помощью ультрафильтрационных установок на полых полупроницаемых волокнах из полиамида при диафильтрации, что позволило в 6-7 раз снизить количество сульфата аммония до 3-5 %, при необходимости до полного обессоливания.
В связи с термолабильностью ферментного препарата изучали возможные способы его консервации при использовании различных методов высушивания и влияние их на ферментативную активность трипсина (табл.1).
Таблица 1
Сравнительная оценка влияния методов высушивания на
ферментативную активность трипсина
n=3
| Метод высушивания | Температура высушивания, 0С | Время сушки, ч | Характеристика препарата | ||
| на входе | на выходе | Массовая доля влаги,% | Активность, ЕД | ||
| Распылительный | 130-140 | 60-75 | 2 | 1,56+0,37 | 443+28,6 |
| Сублимационный | -40 | 30 | 30 | 2,30+0,24 | 455+9,0 |
| Кондуктивный (калориферный) | 35-37 | | 24-30 | 4,25+1,11 | 232+17,6 |
| Конвективный | 35-37 | | 24-30 | 3,85+0,82 | 294+25,0 |
| Нативный препарат, контроль | - | - | - | 50,00+3,24 | 492+26,2 |
Результаты проведенных исследований по выбору метода высушивания конечного продукта показали, что кондуктивный и конвективный методы длительны и требуют дополнительных технологических операций измельчения и просеивания трипсина, кроме того кондуктивный метод повышает вероятность обсеменения фермента. Наиболее эффективным по производительности и экономичности для больших объемов является метод распылительного высушивания, позволяющий получить тонкодисперсный порошок трипсина, содержащий не более 3% массовой доли влаги, с активностью близкой к нативной форме трипсина, альтернативным для небольших партий – сублимационный метод. Преимуществом этих двух способов является получение трипсина с высокой протеолитической активностью, низкой массовой долей влаги, не требующих измельчения и просеивания ферментного препарата. Полученный трипсин соответствовал требованиям ТУ9358-013-00008064-96: протеолитическая активность не ниже 150 ЕД по Шоу-Петиколас; массовая доля влаги не более 3 %, значение буфера - 7,4 при растворении образца фермента; значение мутности не фильтрованного раствора не более 6,5х10-3 1/см или не более 0,05 ЕД оптической плотности (ОП); выход клеток из 1 г ткани КЭ в пределах 150-215 млн клеток при 90-96% жизнеспособности. Серия трипсина для получения культур клеток считают активной и нетоксичной, если изготовленный из него 0,25% раствор обеспечивает дезагрегацию и выход из 1 г ткани не менее 90 млн. клеток с жизнеспособностью не ниже 90%, без признаков дегенерации клеток в культуре.
2.2.1. 2. Разработка технологической линии промышленного
производства трипсина
Нами разработана технологическая линия промышленного производства трипсина, включающая эффективное современное оборудование: реакторы с автоматическим перемешиванием суспензии и регулированием температурного режима, оборудование для разделения суспензии после экстрагирования и высаливания, оборудование для высушивания конечного продукта. За счет применения современной техники обеспечен наиболее высокий уровень механизации, автоматизации процессов, что способствовало получению более активного трипсина, повышению производительности труда. Предполагаемый экономический эффект от организации производства трипсина сухого (ТС) для вирусологических целей на 1000 кг в год равен 118 млн. руб.
Освоение технологии изготовления трипсина проводили в ГНУ ВНИТИБП и НПО “Синтез” (г. Курган), на Алма-Атинском и Омском биокомбинатах. Опытно-промышленные серии трипсина использованы для получения культур клеток при изготовлении вакцин против болезни Марека, чумы плотоядных, болезни Ауески и трансмиссивного гастроэнтерита свиней. Пригодность опытно-промышленных серий трипсина для получения культур клеток противовирусных препаратов была подтверждена на Омском, Алма-Атинском биокомбинатах и Курской биофабрике.
2.2.1.3. Использование трипсина при культивировании клеток в производстве противовирусных вакцин
Опытно-промышленные образцы фермента проверялись при культивировании на широком спектре культур клеток совместно с сотрудниками ВГНКИ и на биопредприятиях. Установлена эффективность использования трипсина для получения различных видов первичных культур клеток (выход клеток с 1 г. ткани для ФЭК, ПЭК, ТБ, ПКЩ, ПЩ, ПК составил 137,2; 72; 166; 93,5; 57; 121 млн.кл. соответственно) и перевиваемых культур клеток MDBK, MDCK, СПЭВ.
Клеточные культуры, изготовленные с использованием растворов опытно-промышленных серий трипсина, по чувствительности и уровню накопления вирусов: штаммов: - БУК-628 вируса болезни Ауески; МВА 1/77 вируса парагриппа-3 (ПГ-3); МВА 1/80 вируса инфекционного ринотрахеита (ИРТ) крупного рогатого скота, штаммы С и Д парвовирусного энтерита собак (ПВЭС), по морфологии и срокам проявления ЦПД были сходны с контрольными культурами клеток (Дифко), что говорит о равноценности и перспективности растворов фермента для практического использования.
Трипсин был испытан на Омском биокомбинате для диспергирования ткани перепелиных эмбрионов (ПЭ) при получении культуры клеток ФЭП и вакцины против болезни Марека из штамма ФС-126 герпеса индеек. Фермент обладал равной с контролем диспергирующей активностью в отношении ткани ПЭ и обеспечивал выход 45,8-68,9 млн. кл/г, равноценный контролю, с жизнеспособностью клеток 95-97%. Опытные и контрольные культуры клеток ФЭП характеризовались равноценной чувствительностью и были пригодными для получения штамма “ЭПМ” вируса чумы плотоядных в производственных условиях.
Таким образом, отечественный фермент трипсин, полученный по усовершенствованной технологии, пригоден для культивирования клеток и вирусов и не уступает по эффективности импортному препарату.
2.2.2. Разработка и применение полимерных композиций в
технологии производства биопрепаратов
2.2.2. 1. Разработка способа иммобилизации трипсина
на полимерном носителе
Для консервации трипсина, с целью сохранения его диспергирующих свойств и протеолитической активности, нами разработан способ иммобилизации на фторсодержащем полимерном носителе (СКФ-26 и СКФ-260 ВРТ) с высокой химической, биологической стойкостью и инертностью (табл. 2).
Таблица 2
Влияние иммобилизованного трипсина на получение клеточных культур n=5
| N | Наименование фермента | Наименование носителя | Протеолитическая активность, ЕД | ПЭ | КЭ | ||
| Выход клеток с 1 г. ткани млн. | Жизнеспособность клеток, % | Выход клеток с 1 г. ткани млн. | Жизнеспособно сть клеток, % | ||||
| I | Нативный трипсин | | 235 | 85 | 96 | 120 | 97 |
| II | Иммобилизованный трипсин | СКФ-26 | 235 | 125 | 97 | 150 | 97 |
| СКФ-260ВРТ | 235 | 145 | 96 | 160 | 97 | ||
Испытания иммобилизованного фермента на полимерном носителе в качестве диспергирующего агента показали возможность использования его при дезагрегации тканей перепелиных и куриных эмбрионов (ПЭ и КЭ), выход клеток с единицы ткани превышал уровень контроля. Полученные клетки были жизнеспособны при монослойном культивировании. При соблюдении стерильности рост клеток КЭ был выше уровня контроля на 25-33%, а рост клеток ПЭ на 47-70%.
Таким образом, разработан способ иммобилизации трипсина на полимерном носителе, обеспечивающий сохранение свойств фермента, его протеолитическую и диспергирующую активность. Жизнеспособность клеток, полученных с использованием иммобилизованного фермента, была на уровне контроля, а выход клеток с единицы ткани превышал его.
2.2.2. 2. Разработка полимерных материалов для
биотехнологического оборудования
Полимеры с повышенной термической стабильностью, химической стойкостью и биологической инертностью, такие как фторкаучуки, использовали не только как носители при иммобилизации протеолитического фермента трипсина, но и как конструкционные материалы для биологического оборудования (авторские свидетельства: № 701129, “Резиновая смесь на основе фторуглеродных каучуков”, бюл. – 1979. - № 44. – С.193.; № 770126, “Резиновая смесь на основе фторкаучука”, бюл. - 1980. - № 37. – С.308; № 783311, “Резиновая композиция на основе сополимера винилиденфторида”, бюл. - 1980. - № 44. – С.110).
Испытание деформационных свойств полимеров при длительном старении в течение 502 сут. при комнатной температуре показало, что накопление остаточной деформации у фторуглеродной резины составляло – 16 %, у силиконовой резины – 23 - 25 % (в зависимости от наполнения). Высокая сопротивляемость полимеров при 20% сжатии позволила рекомендовать их для уплотнительных и герметизирующих изделий.
В результате проведенных исследований были разработаны новые полимерные материалы, обладающие теплостойкостью, агрессивостойкостью, инертностью на основе фторкаучука СКФ-26 и СКФ-260 Д. Технологичность фтористых резиновых смесей улучшали при использовании совмещенных композиций с фторсиликоновыми смесями и олигомерными фторсодержащими соединениями, обладающими повышенной теплостойкостью при 200оС. Потеря массы при вуланизации у этих композиций составляли 4-2%. Усадка изделий была 2-1,5 %, в то время как у контрольной смеси с дибутилсебацинатом потери массы и усадка составили соответственно 12% и 10%. Применение совмещенных композиций на основе фторкаучуков и фтосиликоновых смесей, фторсодержащего пластификатора обеспечивало вулканизацию под давлением в прессе, в котле и в воздушной среде термостата или в трубе агрегата непрерывной вулканизации, с последующим термостатированием. В качестве совулканизата бифургина или его замены были предложены новые вулканизующие агенты: производные дитиомочевины и соединение 1,4 бис (2-меркаптобензтиазолилметилен) – пиперазина, позволяющие получать теплостойкие материалы. Для уплотнительных прокладок нами были разработаны пресс-формы, изготовленные на Ставропольском ОЗТО и испытанные во ВНИТИБП и Щелковском биокомбинате.
2.2.2.3. Определение токсичности полимерных материалов с использованием микроорганизмов и на культуре клеток
Разработка и применение конструкций и материалов, обеспечивающих стерильные условия культивирования клеток и микроорганизмов, являются важной задачей биотехнологии. Используемые при этом полимерные материалы должны быть не только прочными, устойчивыми к моющим средствам, химическим реагентам, температурным воздействиям, но и быть инертными. В связи с этим определение токсичности материалов необходимо для их оценки при конструировании технологического оборудования.
Определение токсичности с использованием микроорганизмов. Нами предложен метод определения токсичности полимерных материалов с использованием микроорганизмов. Испытания проводились в лаборатории микробиологии (Анисимова Л.В., Сапегина Е.П., Никитина Р.А, 1984) на культуре Pasteurella multocida, 2 авирулентный (пастеровский) штамм. Установлено, что резина на основе силиконового каучука, совмещенная композиция фторкаучука и фторсиликоновой смеси и резина на основе фторкаучука не оказывали ингибирующего действия на рост микроорганизмов Pasteurella multocida и могут быть использованы в конструкционных узлах технологического оборудования при производстве противобактерийных препаратов.
Определение токсичности на культуре клеток. Наряду с вышеуказанным методом проводили испытание токсичности полимеров на культуре клеток. Для оценки токсичности резиновых изделий использовали культуру клеток ПТ-80. Исследования проводили совместно с сотрудниками лаборатории культур клеток (Гвозденко Н.И., Пухова Н.М., Соловьев Б.В., 1990). Высокий прирост клеток был получен при испытании резин на основе силиконового каучука, совмещенной композиции фторкаучука и фторсиликоновой смеси и резины на основе фторкаучука. Клетки не прикреплялись к стеклу или формировали редкие очаги роста в случае использования токсичных материалов. Метод определения токсичности полимеров исключает использование животных, уменьшает трудозатраты и время проведения опытов.
2.2.3. Усовершенствование способов культивирования клеток при культивировании вирусов
В практике существуют несколько способов получения культур клеток для противовирусных препаратов, среди них: стационарный, динамичный, суспензионный и псевдосуспензионный на микроносителях. Использование роллерных аппаратов при монослойном культивировании клеток, особенно для первичных культур, позволяет экономить потребление питательной среды по сравнению со стационарным способом.
Для совершенствования монослойного культивирования клеток проведены испытания многотрубчатого культиватора V=0,006 м3 с использованием технологической обвязки биореактора. Технологическая обвязка к аппарату включала линии подачи, очистки, стерилизации газовой смеси и отвода отработанных газов; подачи пара; термостатирования и поддержания температурного режима в биореакторе; подачи компонентов (питательной среды, засевной культуральной жидкости) и обеспечивала контролируемый и управляемый процесс культивирования клеток в отличие от роллерной технологии. Первичные клетки куриных и перепелиных эмбрионов росли не только на внутренней, но и на внешней поверхности стеклянных трубок аппарата.
Увеличение площади ростовой поверхности клеток обеспечивалось также с помощью микроносителей, суспензируемых в питательной среде (псевдосуспензии), что способствовало регулированию и поддержанию параметров культивирования, получению однородной культуры и осуществлению контроля качества культуры и выхода клеточной биомассы. При культивировании клеток на микроносителях (МН) в биореакторе объемом 0,005 м3 установлено влияние режимов перемешивания на адсорбцию клеток к поверхности микроносителя, определен тип мешалки. Перемешивание микроносителя (акрилекса) проводили трехлопастной мешалкой с углом поворота лопастей 90о и 45о, а также шестилопастной турбинной мешалкой. Равномерному распределению микроносителя способствовало использование трехлопастной мешалки с углом поворота лопастей α=90о при скорости перемешивания от 40 до 60 об/мин. При 80 об/мин распределение МН такое же, как при 40 об/мин. Клетки, снятые с микроносителя, являлись посевным материалом для 0,025 м3 реактора. Установлена оптимальная посевная концентрация клеток ПТ-80 на микроносителях (8-12 кл/МН). Равномерное распределение клеток после 3 час адсорбции наблюдали при концентрации 10-12 кл/МН, что позволило достичь 95% прикрепления клеток к микроносителю. Полученные результаты были взяты за основу при разработке культивирования клеток ФЭП и ФЭК псевдосуспензионным способом.
Концентрация клеток ПТ-80 в суспензии при скорости перемешивания 40 об/мин и 60 об/мин трехлопастной мешалкой с углом поворота α=90 о изменялась незначительно и увеличивалась при 80 об/мин, процент мертвых клеток ПТ-80 при этом снижался на 12 - 15%.
Для осуществления суспензионного культивирования клеток в реакторах (объемом 0,005; 0,025; 0,1; 0,25 м3) разработана технологическая обвязка. Конструкция биореакторов имела вводы для датчиков контроля параметров процесса (рН, еН, рО2, tоC). При культивировании в биореакторе объемом 0,005м3 температурный режим культивирования обеспечивали системой термостатирования, а снабжение СО2 и воздухом осуществляли с помощью аппарата управляемой подачи газовой фазы (УПГФ).
Суспензионное культивирование клеток ВНК-21/13 в биореакторе (0,005м3) проводили в питательной среде Игла + 199 (1:1) с добавлением сыворотки крови крупного рогатого скота (10%) при посевной концентрации клеток 100000 кл/мл. Перемешивание суспензии осуществляли с помощью трехлопастной мешалки с углом поворота α=90о со скоростью 220 об/мин. В результате получено максимальное накопление клеток после 67 час культивирования, процент мертвых клеток при этом составил 2%, а индекс пролиферации - 4,5.
Применение отъемно – доливного способа позволило продлить процесс деления клеток в суспензии. В процессе суспензионного культивирования ВНК-21/13 первый цикл длился 72 час, затем добавляли свежую порцию среды с сывороткой крови крупного рогатого скота (КРС) 10% в фазе логарифмического роста культуры. Второй цикл длился 71 час, а третий цикл после замены среды с сывороткой (10%) - 40 час. Индекс пролиферации в первом цикле составил 4,5; во втором - 4,2 и в третьем - 1,6.
Наряду с использованием среды Игла и 199 (1:1) применяли также питательную среду на основе мышечного гидролизата (рис. 1).
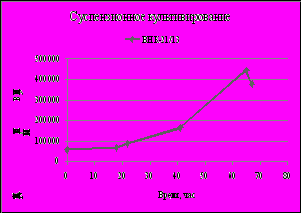
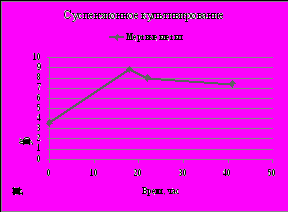
а) б)
Рис. 1. Суспензионное культивирование клеток ВНК-21/13 при использовании мышечного гидролизата:
а) – концентрация живых клеток в мл суспензии;
б) – процентное содержание мертвых клеток в мл суспензии.
Суспензионное культивирование клеток ВНК-21/13 в питательной среде мышечного гидролизата повысило индекс пролиферации до 7,4. После 67 час культивирования добавляли свежую питательную среду в объеме 1 л, и продолжали процесс культивирования до получения индекса пролиферации клеток 7,4. Процесс культивирования клеток проводили при поддержании постоянной температуры (37+0,1)Со; рН 7,0-7,2+ 0,1; концентрации рО2 9-17% (32-96 мм.рт.ст.), при регулировании объемной доли СО2 5-7 % во входящем газе и еН (+75 до +10мв), осуществляли контроль питательной среды и отобранных проб на МПБ, МПА, агаре Сабуро.
При культивировании в биореакторах использовали фильтры в виде фильтроэлементов из фторопласта и титана с диаметром пор 12-20 мкм и 2-6 мкм. Испытание разработанных фильтров показало, что срок службы титановых фильтроэлементов, обладающих устойчивостью к деформациям, был в 1,5-2 раза больше, чем фторопластовых. Для обеспечения стерильности процессов культивирования клеток использовали полимерные теплостойкие материалы в качестве уплотнительных изделий в реакторах и технологической обвязке.
В технологической обвязке биореакторов объемом 0,025; 0,1 и 0,25 м3 применена малогабаритная запорная арматура: вентили МВСП и МВСУ и запорные клапаны с электромагнитным приводом, которые позволили уменьшить в 2 раза габариты и в 8-10 раз вес арматуры по сравнению с серийными вентилями. Технологическая обвязка, состоящая из системы очистки поступающих и отходящих газов, термостатирования, подачи необходимых компонентов (питательной среды, засевного инокулята, титрантов), позволила осуществить культивирование клеток в биореакторах суспензионным и псевдосуспензионным способами при управлении процессом.
Полученные клеток ПТ-80 использовали при разработке биореакторной технологии получения вирусов ИРТ и ПГ-3 в псевдосуспензии (на микроносителях) и конструировании инактивированных вакцин и диагностических препаратов (Иванов В.С., Пухова Н.М., Васько В.Е.). Применение клеток ВНК-21/13 привело к повышению инфекционности вируса ИРТ в 10 раз, а иммуногенности в 3-4 раза, но репродуцированный вирус в монослое клеток ПТ-80 обладал большей активностью, чем вирус, полученный в клетках ВНК-21/13. Суспензионное культивирование клеток ВНК-21/13 было использовано при производстве инактивированной вакцины против бешенства из штамма Щелково-51 (Иванов В.С.).
Разработана технологическая схема культивирования клеток и вирусов, включающая технологические модули с аппаратами для культивирования клеток (объемом 0,005 м3; 0,025; 0,100; 0,250 м3) и вирусов (0,630 м3), а также технологический модуль с аппаратом для приготовления питательной среды (0,250м3), емкости для приготовления моющего раствора (1000м3) и емкости для обезвреживания отработанных жидкостей (1000м3).
Таким образом, нами впервые в производстве ветеринарных препаратов осуществлено культивирование клеток ПТ-80 и ВНК-21/13 в суспензии и псевдосуспензии на микроносителях при культивировании вирусов ИРТ и ПГ-3 с использованием специальных биореакторов, разработанных ВНИТИБП и ИркутскНИИхиммашем. В конструкции реакторов были предусмотрены вводы в среду культивирования датчиков контроля параметров процесса (рН, еН, рО2, tоC). Аппараты оснащены рубашкой для термостатирования и стерилизации, трубой передавливания и перемешивающим устройством с приводом мешалки через магнитную муфту, обеспечивающей герметичность узла в зоне привода. Для осуществления процесса культивирования в реакторах разработана технологическая обвязка. Использование малогабаритной запорной и регулирующей арматуры, а также фильтров из пористого титана для очистки и стерилизации воздуха, применение уплотнительных изделий из теплостойких материалов, выдерживающих воздействие различных химических сред, позволили обеспечить процесс культивирования клеток и вирусов в стерильных условиях.
Проведенные исследования послужили основой для разработки технологического регламента “Культивирование клеток и вирусов с использованием экспериментальных образцов оборудования” и технологической схемы процесса. Использование специализированного оборудования, средств механизации и автоматизации способствовало увеличению выхода продукции при производстве биопрепаратов.
В настоящее время разрабатываемые технологии согласуются с учетом требований международных стандартов ИСО серии 9000:2008 и Правил производства и контроля качества лекарственных средств GMP (ГОСТ Р 52249-2009) с применением аттестованных (валидированных) методов и оборудования.
