Вегетативная регуляция ритма сердца и эндокринный статус подростков и молодых лиц в условиях европейского Севера России 03. 00. 13 физиология
| Вид материала | Автореферат диссертации |
- Федеральный детский центр диагностики и лечения нарушений ритма сердца, 103.08kb.
- Влияние дайвинга на показатели гемодинамики и вариабельности сердечного ритма у детей, 156.63kb.
- Особенности функционирования ведущих адаптационных систем и психофизиологический статус, 298.52kb.
- В. М. Пивоев (Петрозаводский университет), 193.44kb.
- Патогенез нарушений ритма сердца при инфаркте миокарда, 369.49kb.
- «Нарушения ритма сердца у новорожденных детей», 18.33kb.
- Урок географии «Природные ресурсы и промышленность Европейского Севера», 71.3kb.
- Темы практических занятий по клинике внутренних болезней на III курсе факультета клинической, 16.01kb.
- Хозяйство европейского севера, 32.29kb.
- Диагностика и лечение нарушений ритма сердца в Окружном кардиологическом диспансере, 72.79kb.
результаты исследования и их обсуждение
Анализируя среднегодовые показатели вариабельности сердечного ритма, как в покое, так и при ортостазе у подростков на ранних стадиях пубертатного периода (II-III СПР), выявлены половые различия вегетативной регуляции ритма сердца. Так, вегетативный тонус у девочек характеризуется более выраженным влиянием симпатического звена вегетативной регуляции на ритм сердца. ИН составил у девочек 181,27±27,25 усл.ед., у мальчиков 109,27±17,17 усл.ед., р<0,001. В группе IV-V СПР у девочек по сравнению с мальчиками более низкие значения RMSSD (0,06±0,003 против 0,07±0,005, р<0,05) и TP (3,52±0,34 против 4,94±0,74, р<0,001); более высокие значения ИН (171,34±17,40 против 104,91±15,98, р<0,01). Кроме того, в данной возрастной группе у девочек более высокий уровень активности, подкорковых структур (VLF% 19,34±0,97 против 15,06±1,03, р<0,05). Значимых различий параметров ВСР в покое между группой II-III СПР и группой IV-V СПР у мальчиков и девочек не выявлено.
В ортостазе у подростков наблюдается закономерное усиление симпатической реактивности. В группе II-III СПР у девочек более низкие значения ТР (1,85±0,17 против 3,17±0,66, р<0,05), более высокий ИН (303,83±34,90 против 258,32±39,98, р<0,01) по сравнению с таковыми значениями у мальчиков.
Возрастные различия вегетативной реактивности обнаружены только у девочек. Так, в группе IV-V СПР по сравнению с группой II-III СПР более выражено повышение LF% (53,76±1,24 против 45,96±1,90, р<0,001), LF/HF (9,43±0,69 против 7,15±0,92, р<0,05) и IC (5,46±0,35 против 3,88±0,42, р<0,01). В целом различия показателей в группах по уровню полового созревания были минимальны, по-видимому, из-за флуктуаций физиологических показателей под влиянием комплекса природно-климатических факторов Европейского Севера.
Таким образом, у девочек-подростков Европейского Севера в сравнении с мальчиками-подростками более выражены симпатические влияния на ритм сердца в покое за счет активизации подкорковых механизмов регуляции и при ортостазе за счет барорефлекторных механизмов, особенно на завершающих этапах полового созревания.
Изучение среднегодовых уровней тиреоидных гормонов, инсулина и кортизола у подростков показало, что в группе II-III СПР более высокие уровни кортизола (466,64±20,33 нмоль/л против 396,86±14,91 нмоль/л, р<0,01) и инсулина у девочек (12,77±0,96 мкЕд/мл против 10,00±0,62 мкЕд/мл, р<0,001) по сравнению с таковыми у мальчиков.
В группе IV-V СПР также выше уровень кортизола у девочек, чем у мальчиков (460,47±13,38 нмоль/л против 379,65±18,28 нмоль/л, р<0,001), но уровень инсулина возрастает лишь у мальчиков (p<0,05). Уровни ТТГ считаются оптимальными для подростков в диапазоне от 0,5 до 4 мЕд/л (Н. Тиц, 1997; А.Г. Таранов, 2002). Однако ряд авторов считает уровень ТТГ выше 2 мЕд/л признаком субклинического гипотиреоза (J.G. Hollowell et al., 2002; Z. Baloch et al., 2003). В нашем исследовании значения ТТГ в выборках всех испытуемых входили в диапазон 0,5-4 мЕд/л; уровень ТТГ выше 2 мЕд/л наблюдали в среднем у 40,7 % независимо от пола и уровня полового созревания. Уровни Т4 в крови у подростков всех возрастов были в пределах рекомендуемого диапазона 68-146 нмоль/л; содержание Т3 было ниже возрастной нормы (1,5-2,8 нмоль/л) в 20,5 % подростков.
Таким образом, особенностью эндокринного статуса у подростков на Севере является риск развития дефицита функции щитовидной железы, усиление секреции инсулина у мальчиков на завершающих этапах полового созревания и более высокая секреция кортизола у девочек по сравнению с мальчиками.
Выраженные различия показателей вегетативной регуляции ритма сердца у подростков в зависимости от уровня дискомфортности природно-климатических условий среды выявлены в режиме ортостаза. Так, у мальчиков-подростков приполярного района в сравнении с мальчиками-подростками района на границе северных и средних широт более значима симпатическая активность преимущественно на уровне подкорковых вегетативных структур регуляции (VLF% 33,27±1,34 против 25,01±1,57, p<0,001; IC 5,97±0,40 против 4,16±0,36, p<0,01). У девочек выше как барорефлекторная реактивность (LF% 54,09±1,25 против 48,94±1,67, p<0,05), так и активность подкорковых центров (VLF% 26,37±1,25 против 22,16±1,20, p<0,05). В Коношском районе (район границы северных и средних широт) имеется сходная закономерность вегетативных изменений, но только на уровне тенденции.
При оценке особенностей гормонального статуса установлено, что у подростков Приморского района более высока секреция Т4, особенно у девочек (101,48±1,56 нмоль/л против 94,04±1,50 нмоль/л, р<0,001), ТТГ, особенно у мальчиков (2,03±0,07 мЕд/л против 1,82±0,08 мЕд/л), снижена секреция инсулина, особенно у мальчиков (9,99±0,73 мкЕд/мл против 12,17±10,75 мкЕд/мл, р<0,001) и более высок уровень кортизола у мальчиков (415,46±16,42 нмоль/л против 359,29±15,24 нмоль/л, р<0,05). Данные об особенностях секреции тиреоидных гормонов и инсулина у мальчиков-подростков на Европейском Севере, в том числе с учетом географической широты проживания, подтверждают сведения, полученные другими авторами (Р.В. Кубасов, 2006; Д.Б. Дёмин, 2006; О.С. Власова, 2006; Е.В. Типисова, 2007). Более жесткие природно-климатические условия приполярного региона обуславливают активизацию функции коры надпочечников, тиреоидной системы и снижение роли инсулина в регуляции метаболических процессов (Е.Р. Бойко, 1999, А.В. Ткачев, 2001; Ф.А. Бичкаева, 2006, З.Д. Губкина, 2007). Также на формирование гормонального фона у подростков рассматриваемых районов влияют особенности биоэлементного состава воды и почв (А.Л. Горбачев с соавт., 2006).
Таким образом, при нарастании уровня дискомфортности природно-климатических условий Европейского Севера происходит усиление симпатической реактивности на ортостаз за счет подкорковых механизмов вегетативной регуляции и барорефлекторных механизмов на фоне повышения активности тиреоидной системы, снижения секреции инсулина и повышения содержания кортизола в крови у мальчиков.
При анализе динамики параметров ВСР в зависимости от продолжительности светового дня наиболее показательны их изменения в ортостазе. Выявлено, что у мальчиков II-III СПР в марте показатель LF/HF возрастает в 2,5 раза в сравнении с уровнем октября (10,30±1,24 против 4,54±0,74, р<0,001), после чего в июне данный показатель сохраняет свое высокое значение (7,17±1,53, р<0,001). Показатель VLF% также повышается к марту-июню, но на уровне тенденции (от 29,77±2,81 в октябре до 34,46±2,68 в июне). У девочек этой же возрастной группы в марте также как и у мальчиков при ортопробе происходит повышение значения LF/HF в 2 раза в марте (4,97±2,46 в октябре к 10,53±1,82 % в марте, р<0,05). Показатель VLF% в марте был также выше, чем в октябре (16,55±1,92 против 28,78±2,81, р<0,01), достигая максимума в июне (31,55±3,64 %, р<0,01).
У мальчиков IV-V СПР в ортостазе в марте происходит увеличение реактивности подкорковых вегетативных структур – VLF% в марте достоверно выше, чем в октябре (32,48±3,31 против 21,02±2,69, р<0,05). В июне VLF% достигает максимума (35,13±3,61, р<0,05) на фоне снижения суммарной мощности спектра ВСР (TP, р<0,05). У девочек также происходит увеличение VLF% от декабря (18,07±1,66) к июню (29,69±2,11, р<0,05). При этом происходит достоверное увеличение показателя LF/HF почти в 2 раза – 6,38±0,95 в октябре, 11,68±1,72 в марте и 11,84±1,32 в июне (р<0,01-р<0,001). Иначе говоря, у подростков Севера на всех этапах полового созревания происходило усиление симпатической реактивности на ортостаз в весенне-летнее время года; при этом наиболее выражено было усиление барорефлекторной активности.
Динамика эндокринных показателей при смене фотопериодов у подростков показала, что у мальчиков II-III СПР в марте происходит усиление активности инсулярного аппарата (с 7,68±0,57 в октябре до 11,56±1,15 мкЕд/мл, р<0,001), а в июне – максимальный подъем инсулина (13,11±2,01 мкЕд/мл, р<0,001) и кортизола (478,85±26,64 нмоль/л, р<0,001) на фоне снижения Т3 (1,58±0,06 нмоль/л, р<0,01). У девочек II-III СПР изменения гормональных показателей были аналогичными изменениям у мальчиков. В группе подростков IV-V СПР в июне наблюдается снижение уровня Т3, особенно у мальчиков (1,43±0,05 нмоль/л, р<0,01), повышение кортизола, особенно у девочек (531,70±26,13 нмоль/л, р<0,05) и лишь у девочек усиление секреции инсулина (13,93±1,20 мкЕд/мл, р<0,05).
Широтные различия динамики реактивности вегетативной регуляции ритма сердца на ортостаз также проявились в весенне-летний период года (рис. 1 и 2).
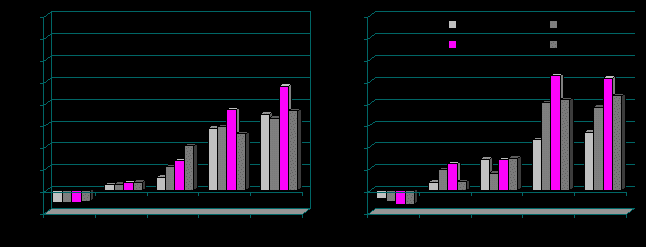
Рис. 1. Приросты показателей ВСР в ортостазе (в %) к значению в покое у мальчиков-подростков Приморского (А) и Коношского (Б) районов в различные фотопериоды года; * p<0,05 – уровни статистической значимости различий данных по сравнению с показателями в октябре.
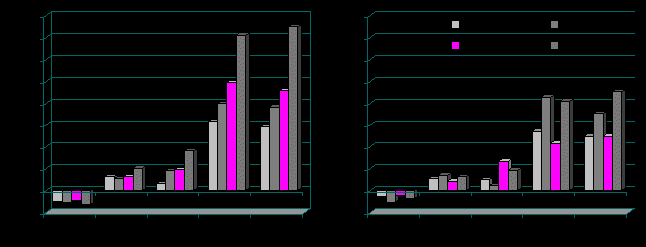
Рис. 2. Приросты показателей ВСР в ортостазе к значению в покое у девочек-подростков Приморского (А) и Коношского (Б) районов в различные фотопериоды года; * p<0,05 – уровни статистической значимости различий данных по сравнению с показателями в октябре.
У мальчиков Приморского района в марте происходила резкая активизация симпатической деятельности. При этом показатель VLF% возрастал в 2,5-3 раза в сравнении с состоянием покоя; уровень барорефлекторной активности (LF/HF) также повышался более чем в два раза в сравнении с таковым показателем в октябре-декабре (p<0,001). У девочек Приморского района изменения вегетативной реактивности при ортопробе аналогичны таковым у мальчиков данного района. У подростков Коношского района изменения показателей вегетативной реактивности при ортопробе были сглажены или носили фазный характер с октября по июнь.
Анализ динамики уровней гормонов в крови у подростков в зависимости от широты проживания (рис. 3 и 4) показал, что в весенне-летний период у подростков Приморского района происходит усиление секреции инсулина и кортизола в сравнении с уровнем данных гормонов в предыдущие периоды. Секреция Т4 при этом снижается, особенно у мальчиков (р<0,05).
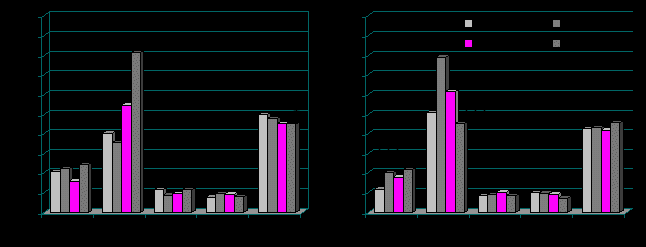
Рис. 3. Уровни кортизола (КОРТ, нмоль/л / 10), инсулина (ИНС, мкЕд/мл ×10), ТТГ (мЕд/л ×10), Т3 (нмоль/л ×10), Т4 (нмоль/л) у мальчиков-подростков Приморского (А) и Коношского (Б) районов в различные фотопериоды года; значимость различий данных (p<0,05-0,001) в сравнении с показателями в октябре.

Рис. 4. Уровни кортизола (КОРТ, нмоль/л / 10), инсулина (ИНС, мкЕд/мл ×10), ТТГ (мЕд/л ×10), Т3 (нмоль/л ×10), Т4 (нмоль/л) у девочек-подростков Приморского (А) и Коношского (Б) районов в различные фотопериоды года; значимость различий данных (p<0,05-0,001) в сравнении с показателями в октябре.
У подростков Коношского района динамика кортизола носила фазный характер с максимумом уровня в июне (р<0,05-0,001). Однако уровень инсулина при этом снижался к июню. Иначе говоря, наблюдается однонаправленный рост активности инсулярного аппарата на фоне усиления секреции контринсулярного гормона кортизола, что свидетельствует о выраженном напряжении работы эндокринной системы в данный период года в приполярном районе Европейского Севера.
У подростков Коношского района максимум секреции инсулина наблюдается в декабре (р<0,05). В июне тиреоидная активность у подростков в данном районе минимальна за счет снижения Т3 (р<0,001). При этом среднее значение Т3 ниже границы возрастной нормы (1,45±0,07 нмоль/л у мальчиков и 1,37±0,04 нмоль/л у девочек). Данная особенность может быть обусловлена повышенной потребностью в гормонах щитовидной железы в условиях снижения йодобеспеченности (А.Л. Горбачев, Р.В. Кубасов, Е.Д. Кубасова, 2007).
Характер межсистемных взаимодействий вегетативной регуляции ритма сердца и эндокринной системы можно оценить с помощью корреляционного и факторного видов анализа.
Выявленные корреляционные связи отражают вклад эндокринных влияний в поддержании всех звеньев вегетативной регуляции как для обеспечения фонового вегетативного статуса (влияние на показатели ВСР в состоянии покоя), так и вегетативной реактивности при нагрузке (влияние на показатели ВСР при ортопробе).
Установлено, что межсистемные взаимодействия рассматриваемых параметров были наиболее интенсивными у подростков на завершающих этапах полового развития (IV-V СПР), особенно у девочек (рис. 5).
Характер связей свидетельствует о том, что гормоны тиреоидной системы (ТТГ, Т3) поддерживают преимущественно симпатические механизмы. При ортопробе корреляционная структура у девочек IV-V СПР увеличивается число прямых связей; в структуре задействованы показатели как симпатической, так и вагусной активности, а также инсулин и тиреоидные гормоны.
Небольшое число корреляционных связей у подростков на начальных этапах полового развития (II-III СПР) объясняется большими вариационными размахами рассматриваемых значений в течение всего периода исследования. Наибольшая зависимость вегетативных параметров от уровней гормонов в крови в данной группе была в весенне-летний период, особенно при ортостазе. Выявлено, что у мальчиков-подростков II-III стадий полового развития в весенне-летний период усиление симпатической реактивности, в том числе и активность подкорковых структур регуляции, происходило под влиянием секреции инсулина, гормонов тиреоидной системы и в меньшей степени кортизола.
У девочек-подростков II-III стадий полового развития в марте при нагрузке и в июне в покое поддержание как вагусных, так и симпатических механизмов, включая активность подкорковых структур регуляции, обеспечивали преимущественно гормоны щитовидной железы и в меньшей степени кортизол. У подростков IV-V СПР наиболее значимые факторные структуры получены в июне у девочек (рис. 6).
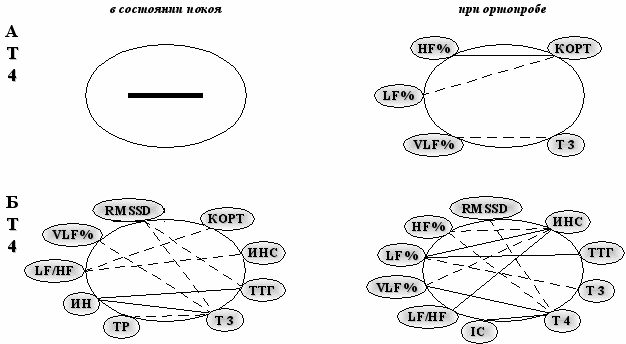
Рис. 5. Корреляционные связи вегетативных и эндокринных показателей у девочек-подростков II-III СПР (А) и IV-V СПР (Б) (r=0,25-0,35; p<0,05-0,01). Сплошная линия – положительная связь; пунктирная – отрицательная связь.
Показано, что роль эндокринных факторов в поддержании вегетативной реактивности возрастает при ортостазе, особенно со стороны секреции Т3, кортизола и в меньшей степени инсулина.
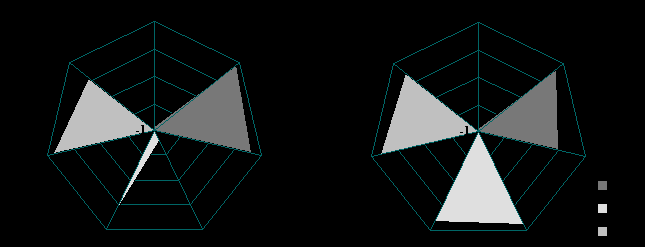
Рис. 6. Факторные структуры взаимосвязей уровней гормонов и вегетативных показателей в покое (А) и при ортостазе (Б) у девочек IV-V СПР в июне; Ф1, Ф2, Ф3 – факторы.
Регрессионные модели подтверждают зависимость симпатической активности в данный период года у девочек IV-V СПР от секреции в первую очередь гормонов щитовидной железы и инсулина.
VLF % ортопроба = 4,16 + 16,26 × Т3, (где VLF % ортопроба – значение VLF % при ортопробе, Т3 – уровень Т3), R2 = 0,40; p<0,002;
ИН_Ln ортопроба = -2,31 + 1,17 × Т3 + 2,22 × Инс_Ln, (где ИН_Ln – натуральный логарифм значения ИН, Т3 – уровень Т3, Инс_Ln – натуральный логарифм значения инсулина), R2 = 0,55; p<0,01.
У подростков в условиях приполярного региона (64°30' с.ш.) наблюдается усиление связей эндокринных показателей и вегетативных параметров при ортопробе. При этом у мальчиков повышение симпатической реактивности обусловлено усилением секреции инсулина, а активность подкорковых центров регуляции – секреции кортизола, особенно в весенне-летний период. У девочек в марте и в июне поддержание симпатических и вагусных механизмов регуляции обеспечивают преимущественно гормоны тиреоидной системы и инсулин (рис.7).

Рис. 7. Факторные структуры взаимосвязей уровней гормонов и вегетативных показателей в ортостазе у мальчиков (А) и у девочек (Б) Приморского района в марте; Ф1, Ф2, Ф3 – факторы.
У мальчиков-подростков в более комфортном климатическом районе Севера (61° с.ш.) эндокринно-вегетативные взаимоотношения были интенсивны как в состоянии покоя, так и при нагрузке на протяжении всего года, особенно в осенне-зимний период. При этом в декабре симпатическая активность зависела преимущественно от секреции инсулина и от функции тиреоидной системы (рис. 8). Таким образом, у подростков на Европейском Севере характер вегетативной регуляции ритма сердца как в покое, так и в ортостазе определяется исходным уровнем гормонов в крови и зависит от уровня дискомфортности среды обитания с учетом продолжительности светового дня.
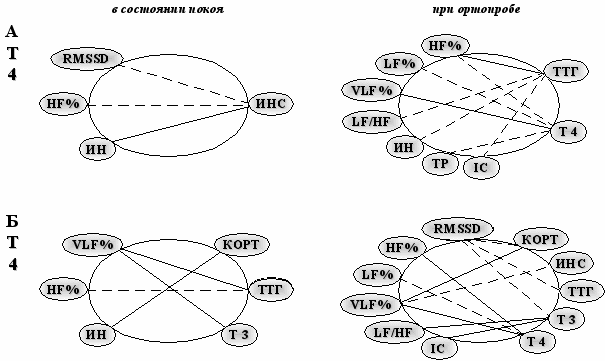
Рис. 8. Корреляционные связи вегетативных и эндокринных показателей у мальчиков (А) и девочек (Б) подростков Коношского района в декабре (r=0,25-0,35; p<0,05-0,01). Сплошная линия – положительная связь; пунктирная – отрицательная связь.
Представляло интерес проследить у подростков особенности вегетативной регуляции ритма сердца при функциональных нагрузках (умственная, физическая) с учетом уровней гормонов в крови и продолжительности светового дня (декабрь, июнь, сентябрь). Установлено, что в группах с разным исходным уровнем гормонов различия в эффективности выполнения умственной нагрузки (количество решенных примеров и сделанных ошибок) и уровней Т4 и Т3 в крови были минимальны.
Наибольшие различия вегетативной регуляции ритма сердца в зависимости от уровня ТТГ, мелатонина и лептина в крови выявлены в сентябре. Так, в группе с уровнем ТТГ выше 2 мЕд/мл у подростков более выражена симпатическая реакция в покое и при выполнении нагрузки (рис. 9).
Известно, что тиреотропин обеспечивает регуляторное действие не только в отношении функции щитовидной железы, но и активности подкорковых вегетативных центров (I.R. Moss, 1989; M. Nink, 1991). Таким образом, у подростков оптимальный уровень ТТГ обеспечивает эффективную работу как тиреоидной системы, так и вегетативной регуляции, что показано при исследовании взрослых лиц (М.Ю. Семченкова с соавт., 2007).
Изучение уровней мелатонина в крови показало, что диапазон разброса уровней мелатонина в утреннее время у лиц во всей выборке составил от 6,8 до 34,23 пг/мл в декабре и от 2,40 до 22,86 пг/мл в июне-сентябре. Выявлены различия в вегетативной регуляции у лиц при умственной нагрузке со значениями выше и ниже медианы в соответствующие сезоны года – минимальные в июне и максимальные в сентябре (рис.10).

Рис. 9. Показатели ВСР у подростков 12-15 лет в покое (А) и в ходе умственной нагрузки (Б) в зависимости от уровня ТТГ в крови (сентябрь).
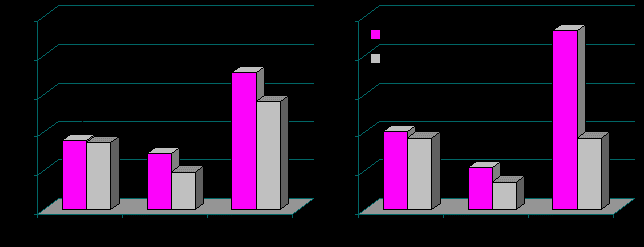
Рис. 10. Показатели ВСР у подростков 12-15 лет в покое (А) и при умственной нагрузке (Б) в зависимости от уровня мелатонина в крови (сентябрь).
Установлено, что у лиц со значением мелатонина ниже 7,7 пг/мл в крови в сентябре более выражена симпатическая активность в покое и особенно при нагрузке. Литературные данные свидетельствуют, что мелатонин оказывает кардиопротективное действие – снижение активности вазоконстрикторных агентов и повышение резерва вагусной активности (Ф.И. Комаров с соавт., 2004; В.Н. Ярцев, 2005; Chester A. Ray, 2003). В рамках настоящего исследования определено, что несмотря на идентичность уровня мелатонина в крови в сравнении с таковым в июне, биологическое его действие на вегетативную регуляцию в эти сезоны было различным. В осенний период относительный дефицит секреции мелатонина обусловливает повышение активности адренергических структур сердечно-сосудистой системы, в результате чего повышаются энергозатраты растущего организма в процессе умственного напряжения.
Лептин как нейропептид, определяющий энергетический резерв организма, осуществляет значимое влияние на функцию сердечно-сосудистой системы (Х.С. Манцорос, 2000). Показано, что в июне-сентябре у лиц с уровнем лептина в диапазоне выше верхней квартили выборки (11,7-28,4 нг/мл) менее выражена симпатическая активность при умственной нагрузке. В декабре, вследствие повышения энергетических потребностей, при предъявлении умственной нагрузки симпатическая активность у лиц данной группы остается такой же выраженной, как в группах со средним и низким уровнями лептина.
Соотношение уровней тестостерона и кортизола является показателем, отражающим баланс эндокринных регуляторов анаболических и катаболических процессов (E. Kaufman, 2002). В период пубертата, когда нарастает мышечная масса, увеличение объема левого желудочка сердца тесно связано с ростом уровня тестостерона, особенно у мальчиков (Kathleen F. Janz, 2000).
Исходя из этого, представляло интерес определить реактивность вегетативной регуляции у мальчиков-подростков с различными вариантами динамики соотношений кортизола и тестостерона в слюне при физической нагрузке (рис. 11). Установлено, что у подростков, у которых есть тенденция к снижению показателя тестостерон / кортизол (от 0,07±0,01 до 0,04±0,01) – 1 группа, на 15 минуте восстановительного периода повышается симпатическая активность – ИН (от 90,2±19,2 до 172,6±18,4; p<0,05), VLF% (от 19,4±1,27 до 28,9±2,51; p<0,05).

Рис. 11. Динамика уровней тестостерона (ТЕСТ) в слюне, соотношения тестостерон / кортизол (ТЕСТ / КОРТ), индекса напряжения (ИН) и диастолического давления (ДАД) у мальчиков-подростков со снижением (1 группа) и повышением (2 группа) соотношения ТЕСТ / КОРТ в ходе физической нагрузки. Уровни статистической значимости различий: * - p<0,05 – в сравнении со значением в покое в группе; # – между группами при p<0,05 на каждом этапе нагрузки.
Также у них сохраняется повышенным диастолическое артериальное давление (73,1±4,0 мм. рт. ст.), в то время как у лиц 2 группы с повышением тестостерона в слюне данный показатель снижается (62,1±2,2 мм. рт. ст., p<0,05). Это может свидетельствовать о повышении конечно-диастолического объема и как следствие, быть одной из причин снижения насосной функции сердца. Таким образом, оптимальное соотношение вегетативной и эндокринной систем, обеспечивающих восстановление анаболического ресурса, определяет степень выносливости подростка к интенсивной нагрузке.
Изучение вегетативной регуляции у молодых лиц показало, что у молодых жителей Европейского Севера (64°30' с.ш.) по сравнению с молодыми лицами южного региона (44°57' с.ш.) в покое более высокая вагусная активность. Так, ИН у лиц Севера составил 66,14 (41,51;114,37) усл. ед. против 128,77 (84,25; 209,07) (р<0,05); ТР 3,11 (2,11;4,39) против 1,80 (1,23;3,25) (p<0,05). Тезис о том, что у местных жителей Севера фоновая активность рецепторов симпатической активности ниже, чем у жителей средних широт, подтверждают другие авторы (В.М. Еськов с соавт., 2005).
При распределении эффективности БОС-тренинга на снижение ИН выявлено, что в 1 сеансе у жителей Севера было большее число лиц с положительным эффектом (65,4%), в то время как в группе лиц южного региона таких лиц было всего 35,3%. Во 2 сеансе доля лиц с положительным эффектом сократилась в «северной» группе почти вдвое (30,8%), а в группе лиц южного региона осталась почти такой же (35,3%). Таким образом, эффект биоуправления с целью снижения симпатической активности у северян на первых сеансах нестабилен, по-видимому, вследствие исходного преобладания вагусных влияний на ритм сердца.
Учитывая наличие зависимости физиологических параметров у жителей Севера от фотопериодики, изучили особенности вегетативной регуляции ритма сердца и эффективность БОС-тренинга на понижение ИН у молодых лиц в контрастные фотопериоды года. Установлено, что ЧСС в покое была выше в ноябре, чем в марте (р<0,01). Также соотношение LF/HF и VLF% были достоверно выше в ноябре (р<0,05-0,01). Эти данные свидетельствуют о более высокой активности симпатической регуляции как на уровне барорефлектроной активности, так и на уровне подкорковых центров вегетативной регуляции у молодых лиц на Севере в период приближения времени «биологической тьмы» (Т.С. Копосова с соавт., 2007). Распределение лиц по типам вегетативной регуляции свидетельствует об отсутствии выраженных различий в спектре типов регуляции в марте по сравнению с ноябрем – в обоих сезонах преобладают лица с нормотонией (ИН от 50 до 150 усл.ед.) и ваготонией (ИН < 50 усл.ед.), что характерно для «северной» специфики вегетативной реактивности.
При выполнении сеансов БОС-тренинга на понижение ИН в марте в 1 сеансе выявлено преобладание положительных эффектов (65,4%), в то время как в ноябре эффективность была лишь в 33,3% случаев.
Таким образом, у молодых лиц в марте именно в этот период выявлена более высокая реактивность вегетативных структур в ответ на биоуправление, чем в ноябре.
При изучении зависимости эффективности биоуправления с целью понижения ИН от свойств темперамента и интеллекта у молодых жителей Севера показано, что высокие показатели пластичности и темпа, обусловленные подвижностью нервных процессов, определяют эффективность БОС-тренинга на первых этапах биоуправления (рис. 12).
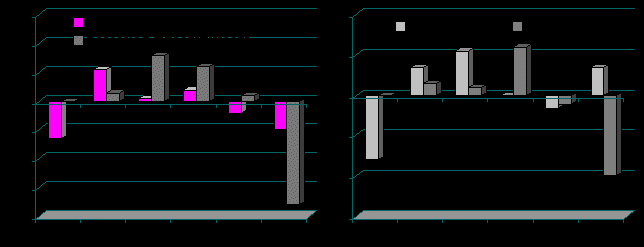
Рис. 12. Приросты ВСР (% к фону) при БОС-тренинге на понижение ИН в зависимости от показателя пластичности (А) и темпа (Б) по В.М. Русалову у молодых лиц г. Архангельска (уровни достоверности в сравнении со значением в первой подгруппе).
Сравнивая приросты параметров ВСР после БОС-тренинга (в % к фоновому значению), можно сделать вывод о неэффективности БОС-тренинга на понижение ИН у лиц с низким показателем интеллекта (ниже 100 баллов). У данных лиц ИН повышался в среднем почти на 50% выше фонового значения и был достоверно выше значения ИН у лиц со средним уровнем интеллекта (р<0,001). Суммарная мощность спектра ВСР у данных лиц после БОС-тренинга была самая низкая и достоверно ниже, чем у лиц со средним уровнем интеллекта (р<0,01). Снижение интеллекта отражает снижение объема и концентрации внимания, а также затруднение в формировании нового «структурного следа» или динамического стереотипа (К.В. Судаков, 2002). Таким образом, оптимальный уровень интеллекта определяет эффективность процесса саморегуляции.
Анализ соотношений показателей вегетативной регуляции ритма сердца и эндокринной системы показал значимость профессиональных условий на формирование межсистемных взаимодействий у молодых лиц на Севере. 1 группу составили сотрудники спецподразделений МВД и учебного центра УВД, которые не выезжали в районы вооруженных конфликтов. 2 группу составили сотрудники, которые выезжали 1-2 раза в данные районы; 3 группу составили лица, которые выезжали в данные районы от 3 до 7 раз.
У лиц 3 группы в покое более высок ИН (медиана от 87,08 в 1 группе до 154,40 усл.ед. в 3 группе; р<0,05), что указывает на усиление симпатической активности. Однако общая вариабельность ритма сердца (RMSSD, TP) при этом имеет тенденцию к повышению. Учитывая, что общая ВСР является основным маркером адаптации человека к дискомфортной среде обитания, можно говорить о сохранном функциональном резерве сердечной деятельности у лиц данной профессии (В.М. Михайлов, 2002).
Уровень кортизола у лиц 1 группы невысок (медиана 282,72 нмоль/л), однако при выездах в районы боевых действий уровень кортизола нарастает (2 группа - медиана 395,16 нмоль/л; р<0,01), 3 группа – медиана 345,93; р<0,05). Уровень тестостерона также возрастает во 2 группе от 18,08 до 23,38 нмоль/л (р<0,05) и остается повышенным относительно 1 группы (21,84 нмоль/л; р<0,05). Согласно исследователям (Л.Х. Гаркави с соавт., 1990; Е.Б. Шустов с соавт., 1998) повышение уровня тестостерона у мужчин служит признаком реакции активации при адаптации к условиям дискомфортности среды. Уровни пролактина и соматотропина снижаются (р<0,01-0,001) в рамках физиологических значений, а значения тиреоидных гормонов значимо не менялись в группах.
Корреляционный анализ (рис.13) соотношений вегетативных параметров и гормональных показателей в покое показал, что у лиц 1 группы уровни большинства гормонов (кортизола, тестостерона, инсулина и Т4) поддерживают вагусные механизмы вегетативной регуляции; и только уровень Т3 положительно взаимосвязан с возрастанием симпатической активности (LF%).
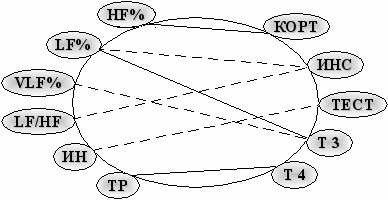
Рис. 13. Корреляционные связи вегетативных и эндокринных показателей у молодых лиц 1 группы (r=0,62-0,82; p<0,05-0,01); сплошная линия – положительная связь; пунктирная – отрицательная связь.
У лиц 2 группы наблюдается увеличение прямых корреляционных связей (рис. 14). При этом довольно выражена связь показателя дыхательной части ВСР-спектра (HF%) с содержанием гормонов в крови (кортизол, ТТГ, пролактин). Влияние гормонов на дыхательную составляющую спектра ВСР у лиц 2 группы можно представить с помощью регрессионного анализа.
HF% = 7,93 + 10,32 × Прол – 33,76 × Инс_Ln + 11,49 × ТТГ + 0,12 × Корт, (где HF% – показатель HF%, Прол – уровень пролактина, Инс_Ln – натуральный логарифм значения инсулина, ТТГ – уровень ТТГ, Корт – уровень кортизола); R2 = 0,79; p<0,02.

Рис. 14. Корреляционные связи вегетативных и эндокринных показателей у молодых лиц 2 группы (r=0,62-0,82; p<0,05-0,01); сплошная линия – положительная связь; пунктирная – отрицательная связь.
Иначе говоря, на первых этапах возрастания фактора экстремальности профессиональных условий на организм молодых лиц происходит усиление эндокринных влияний на поддержание в первую очередь вагусных (парасимпатических механизмов). Это обеспечивает анаболический резерв для оптимальной адаптации организма к экстремальным условиям деятельности.
В 3 группе (рис. 15) число эндокринно-вегетативных взаимодействий минимально. При этом выявлена обратная связь вагусных показателей (ТР, HF%), положительная связь симпатических параметров (ИН) с уровнем тироксина.
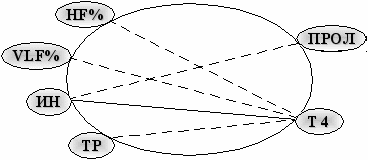
Рис. 15. Корреляционные связи вегетативных и эндокринных показателей у молодых лиц 3 группы (r=0,62-0,82; p<0,05-0,01); сплошная линия – положительная связь; пунктирная – отрицательная связь.
Также обозначена отрицательная связь пролактина и ИН. То есть нарастание симпатической активности у лиц, выезжавших более 3 раз в районы боевых действий, связано в первую очередь с возрастанием влияния тироксина адренергические механизмы, что показано в регрессионной модели.
ИН_Ln = 5,19 + 0,02 × Т4 – 2,18 × Прол_Ln, (где ИН_Ln – натуральный логарифм значения ИН, Т4 – уровень Т4, Прол_Ln – натуральный логарифм значения пролактина); R2 = 0,65; p<0,001.
Таким образом, дальнейшее возрастание фактора экстремальности профессиональных условий приводит к повышению напряжения работы сердечной деятельности в покое (ИН выше 150 усл. ед.) на фоне усиления действия гормонов щитовидной железы на симпатическую активность и снижения влияния гормонов с анаболическим действием на поддержание вагусных механизмов.
