Положение металлов в псхэ
| Вид материала | Документы |
- Урок упражнение по теме: «Металлы», 53.65kb.
- Реферат по теме: «Металлы. Свойства металлов.», 196.2kb.
- Задачи урока: Познакомить учащихся со строением и общими свойствами металлов, исходя, 326.34kb.
- Положение металлов в Периодической системе Д. И. Менделеева, строение их атомов. Физические, 90.2kb.
- Коррозия металлов, 201.83kb.
- Коррозия металлов, 40.27kb.
- Пятый физические основы сваривания металлов, 781.92kb.
- Оренбургский государственный университет вопросы кандидатского экзамена по специальности, 72.88kb.
- Реферат На тему: Коррозия металлов, 45.45kb.
- Примерная программа дисциплины механические свойства металлов, 122.33kb.
Металлы
Металлы и их сплавы повсеместно используются для изготовления конструкций машин, оборудования, инструмента и т. д. Несмотря на широкий круг искусственно созданных материалов (керамики, клеев), металлы служат основным конструкционным материалом и в обозримом будущем по-прежнему будут доминировать. Современная металлургия получает свыше 60 металлов и на их основе более 5000 сплавов.
В природе металлы встречаются как в чистом виде, так и в рудах, оксидах и солях. В чистом виде встречаются химически устойчивые элементы (Pt, Au, Ag, Cu). Масса наибольшего самородка меди составляет 420 т, серебра — 13,5 т, золота — 112 кг.
Такие металлы, как золото, серебро и медь, известны человеку с доисторических времен. В древние и средние века считали, что существует только 7 металлов (золото, серебро, медь, олово, свинец, железо и ртуть). М. В. Ломоносов определял металл как “светлое тело, которое ковать можно” и относил к металлам золото, серебро, медь, олово, железо и свинец” А. Лавуазье в “Начальном курсе химии” (1789) упоминал уже 17 металлов. В начале XIXв. последовало открытие платиновых металлов, а затем щелочных, щелочноземельных и ряда других. Триумфом периодического закона было открытие металлов, предсказанных на его основе Д. И. Менделеевым, - галлия, скандия и германия. В середине XX в. с помощью ядерных реакций были получены трансурановые элементы - не существующие в природе радиоактивные металлы.
Положение металлов в ПСХЭ
Если в таблице химических элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером, иногда их называют полуметаллами. Из 111 открытых элементов, представленных в Периодической системе элементов Д. И. Менделеева, 76 являются металлами; Si, Ge, As, Se, Te — промежуточными между металлами и неметаллами.
К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго). Все элементы, расположенные левее мысленной линии, проведенной от бора до астата (от № 5 до № 85) относятся к металлам, а правее — в основном, к неметаллам. Эта граница недостаточно четко выражена, так как среди элементов, расположенных вблизи границы, находятся и полуметаллы.
Кристаллическое строение металлов
Общее свойство металлов и сплавов — их кристаллическое строение, характеризующееся определенным закономерным расположением атомов в пространстве. Для описания атомно-кристаллической структуры используют понятие кристаллической решетки, являющейся воображаемой пространственной сеткой с ионами (атомами) в узлах.
Атомно-кристаллическая структура может быть представлена не рядом периодически повторяющихся объемов, а одной элементарной ячейкой. Так называется ячейка, повторяющаяся во всех трех измерениях. Трансляцией этого наименьшего объема можно полностью воспроизвести структуру кристалла (рис. 1).
В кристалле элементарные частицы (атомы, ионы) сближены до соприкосновения. Для упрощения пространственное изображение принято заменять схемами, где центры тяжести частиц представлены точками. В точках пересечения прямых линий располагаются атомы; они называются узлами решетки. Расстояния a, b и c между центрами атомов, н
 аходящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм. Для однозначного описания элементарной ячейки кристаллической решетки необходимо знание величин параметров a, b, c и углов между ними.
аходящихся в соседних узлах решетки, называют параметрами, или периодами решетки. Величина их в металлах порядка 0,1–0,7 нм, размеры элементарных ячеек — 0,2–0,3 нм. Для однозначного описания элементарной ячейки кристаллической решетки необходимо знание величин параметров a, b, c и углов между ними. Рис. 1 Кристаллическая решетка
В 1848 г. французский ученый Бравэ показал, что существует 14 типов кристаллических решеток. На рис. 2 показаны три типа элементарных ячеек кристаллических решеток, наиболее характерные для металлов: объемноцентрированная кубическая (ОЦК); гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП), а также схемы упаковки в них атомов. В кубической гранецентрированной решетке (ГЦК; А1) атомы расположены в вершинах куба и в центре каждой грани (рис. 2, а). В кубической объемноцентрированной решетке (ОЦК; А2) атомы расположены в вершинах куба, а один атом — в центре его объема (рис. 2, б). В гексагональной плотноупакованной решетке (ГП; А3) атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы (рис. 2, в).
Д
 ля характеристики кристаллических решеток вводят понятия координационного числа и коэффициента компактности. Координационным числом Iк называется число атомов, находящихся на наиболее близком и равном расстоянии от данного атома. Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12.
ля характеристики кристаллических решеток вводят понятия координационного числа и коэффициента компактности. Координационным числом Iк называется число атомов, находящихся на наиболее близком и равном расстоянии от данного атома. Для ОЦК решетки координационное число равно 8, для решеток ГЦК и ГП оно составляет 12. Из этого следует, что решетка ОЦК менее компактна, чем решетки ГЦК и ГП. В решетке ОЦК каждый атом имеет всего 8 ближайших соседей, а в решетках ГЦК и ГП их 12. Рис. 2. Типы элементарных ячеек кристаллических решеток металлов и схемы упаковки в них атомов:
а) гранецентрированная кубическая (ГЦК);
б) объемноцентрированная кубическая (ОЦК);
в) гексагональная плотноупакованная (ГП) решетка
Если принять, что атомы в решетке представляют собой упругие соприкасающиеся шары, то нетрудно видеть, что в решетке, помимо атомов, имеется значительное свободное пространство. Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности.
Коэффициент компактности Q равен отношению суммарного объема атомов, входящих в решетку, к объему решетки:

где R — радиус атома (иона); n — базис, или число атомов, приходящихся на одну элементарную ячейку; V — объем элементарной ячейки.
Для простой кубической решетки n = (1/8) · 8 = 1; V = a3 = (2R)3, коэффициент компактности Q = 52 %.
Схема определения базиса ОЦК решетки приведена на рис. 3. На решетку ОЦК приходится два атома: один центральный и один как сумма от вершин куба, так как ячейке принадлежит 1/8 атома от каждого угла. Для ОЦК решетки n = (1/8) · 8 + 1 = 2. Учитывая, что атомы соприкасаются по диагонали куба, длина которой равна 4 атомным радиусам, параметр решетки а коэффициент компактности QОЦК = 68 %. Проведя аналогичные вычисления, найдем QГЦК = 74 %, QГП = 74 %. Таким образом, решетки ГЦК и ГП более компактны, чем ОЦК. Итак, самая плотная упаковка достигается при кубической гранецентрированной структуре, где каждый атом окружен 12 ближайшими соседями - восемь атомов расположены в вершинах куба и еще шесть по одному в центре каждой его грани.
Такое строение имеют платина, иридий, палладий, родий, а также золото, серебро, свинец и некоторые другие металлы. Рутений и осмий обладают менее совершенной гексагональной структурой, что и обусловливает меньшее их по сравнению с другими членами семьи "благородство".
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Способность металла существовать в различных кристаллических формах носит название полиморфизма или аллотропии. Принято обозначать полиморфную модификацию, устойчивую при более низкой температуре, индексом α (α-Fe), при более высокой индексом β, затем γ и т.д. Известны полиморфные превращения железа:
Fea « Feg (a-Fe « g-Fe), титана Tia « Tig
(a-Ti « g- Ti) и других элементов.

Рис. 3. Схема определения базиса ОЦК решетки
При полиморфном превращении меняются форма и тип кристаллической решетки. Это явление называется перекристаллизацией. Так, при температуре ниже 911 °С устойчиво Fea, в интервале 911–1392 °С устойчиво Feg. При нагреве выше 911 °С атомы решетки ОЦК перестраиваются, образуя решетку ГЦК. На явлении полиморфизма основана термическая обработка. При переходе из одной полиморфной формы в другую меняются свойства, в частности плотность и соответственно объем вещества. Например, плотность Feg на 3 % больше плотности Fea, а удельный объем соответственно меньше. Эти изменения объема необходимо учитывать при термообработке.
Полиморфизм олова явился одной из причин гибели полярной экспедиции английского исследователя Р. Скотта. Оловом были запаяны канистры с керосином. При низкой температуре произошло полиморфное превращение пластичного белого олова с образованием хрупкого порошка серого олова. Горючее вылилось и испарилось, и на обратном пути экспедиция осталась без топлива. Превращение белого олова в серое называют «оловянной чумой».
Общие физические свойства металлов
1) Пластичность — это способность металлов изменять форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. При этом происходит смещение атомов и ионов кристаллической решетки, однако связи между ними не разрываются, так как соответственно перемещаются и электроны, образующие связь. Пластичность металлов уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn. Fe. Золото, например, можно прокатывать в листы толщиной до 0,003 мм, которые используют для золочения.
2) Блеск, обычно серый цвет и непрозрачность. Это свойство связано со взаимодействием свободных электронов с падающими на металл квантами света.
3) Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. С повышением температуры колебания ионов и атомов металлов усиливаются, что затрудняет движение электронов и тем самым приводит к уменьшению электропроводности. При низких же температурах колебательное движение ионов и атомов, наоборот, сильно уменьшается, и электропроводность возрастает. Вблизи абсолютного нуля электрическое сопротивление у металлов практически отсутствует. Лучший проводник электричества - серебро, за ним идут медь, золото, алюминий, железо. По сравнению с веществами, не имеющими свободных электронов, проводимость металлов больше в 1025 раз.
4) Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути. У неметаллов, в которых тепло распространяется лишь колебанием ионов и атомов кристаллической решетки, теплопроводность в тысячу раз ниже.
5) Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6) Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3). Металлы, имеющие r < 5 г/см3 считаются "легкими металлами".
7) Температуры плавления и кипения. Температуры плавления металлов различаются очень сильно: цезий и галлий можно расплавить теплом ладоней, а температура плавления вольфрама +3410° С. При обычных условиях единственный жидкий металл - ртуть. Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими. Среди металлов наиболее устойчивой, кубической структуры самые выносливые те, у кого энергично работают электроны с d-подуровня . Чемпион по тугоплавкости - вольфрам не жаростоек. Уже при 700 °С вольфрам начинает "потеть", покрывающая изделия прочная пленка его окисла улетучивается. Поэтому он чемпион лишь в условиях вакуума или в атмосфере инертных газов, а во всех более трудных условиях незаменимы платиноиды.
Прочность, температура плавления и твердость зависят от прочности металлической связи. Она особенно велика у тяжелых металлов. В парообразном состоянии все металлы одноатомны, их кристаллическая решетка разрушается.
Металлические материалы обычно делятся на две большие группы: железо и сплавы железа (сталь и чугун) называют черными металлами, а остальные металлы и их сплавы — цветными. Кроме того, все цветные металлы, применяемые в технике, в свою очередь, делятся на следующие группы:
- легкие металлы Mg, Be, Al, Ti с плотностью до 5 г/см3;
- тяжелые металлы Pb, Mo, Ag, Au, Pt, W, Та, Ir, Os с плотностью, превышающей 10 г/см3;
- легкоплавкие металлы Sn, Pb, Zn с температурой плавления 232; 327; 410 °С соответственно;
- тугоплавкие металлы W, Mo, Та, Nb с температурой плавления выше, чем у железа (> 1536 °С);
- благородные металлы Au, Ag, Pt с высокой устойчивостью против коррозии;
- урановые металлы или актиноиды, используемые в атомной технике;
- редкоземельные металлы (РЗМ) — лантаноиды, применяемые для модифицирования стали;
- щелочные и щелочноземельные металлы Na, К, Li, Ca в свободном состоянии применяются в качестве жидкометаллических теплоносителей в атомных реакторах; натрий также используется в качестве катализатора в производстве искусственного каучука, а литий — для легирования легких и прочных алюминиевых сплавов, применяемых в самолетостроении.
О
 бщие свойства металлов обусловлены типом химической связи в металлах, которая называется металлической связью. Металлическая связь - химическая связь, обусловленная наличием большого количества не связанных с ядрами подвижных электронов. Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы:
бщие свойства металлов обусловлены типом химической связи в металлах, которая называется металлической связью. Металлическая связь - химическая связь, обусловленная наличием большого количества не связанных с ядрами подвижных электронов. Атомы металлов отличаются от атомов других элементов тем, что сравнительно слабо удерживают свои внешние электроны. Поэтому в кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы: 
Атомы металлов, если их сравнивать с атомами других элементов, обладают наибольшей силой связи. Вследствие этого они сближены так, что их внешние оболочки перекрывают друг друга. Это облегчает отрыв валентных электронов и превращение в узлах кристаллической решетки нейтральных атомов в положительно заряженные ионы. Оторвавшиеся электроны мчатся с непостижимой скоростью (20 000 км/сек), бомбят ионы, превращая их на миг в атомы и снова ускользая. Единая система электронов в металлических веществах называется электронным газом. Металл можно представить в виде остова из положительных ионов, погруженного в электронный газ, который компенсирует силы взаимного отталкивания положительных ионов.
В свою очередь, электронный газ может свободно двигаться через решетку, состоящую из ионов металла. В кристаллах металлов атомы ионизированы не полностью, и часть валентных электронов остается связанной. В результате возможно появление частично ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи. Такая связь существует не только в твердых кристаллах металлов, но и в расплавах и в аморфном состоянии.
Важнейшим признаком металлов считают высокую электропроводность, которая уменьшается с ростом температуры. Электроны в металле беспорядочно движутся, переходя от одного атома к другому. А положительно заряженные ионы лишь слегка колеблются около своего положения в кристаллической решетке. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Наличие свободных электронов обусловливают высокую теплопроводность металлов и характерный металлический блеск. Их высокая пластичность и ковкость связаны с возможностью взаимного смещения катионов в металлической кристаллической решетке без разрыва химической связи.
Физические свойства металлов, такие как высокую тепло- и электропроводность, пластичность и ковкость, характерный (металлический) блеск можно объяснить исходя из представлений об электронном газе. Однако количественные расчеты с использованием такой модели строения металлических кристаллов не всегда приводят к результатам, совпадающим с экспериментальными данными. Поэтому для более строгого описания состояния электронов в металле используют квантово-химические методы. Рассмотрим образование энергетических зон на примере воображаемого процесса образования кристалла лития (щелочной металл) путем последовательного добавления атомов.

Рис. 4
На рис. 4 изображены схемы энергетических уровней двух изолированных атомов. Если атомы расположены далеко друг от друга (изолированы), то схемы их энергетических уровней будут совершенно одинаковы: два электрона с различной ориентацией спинов на уровнях 1s и по одному электрону на уровнях 2s. При сближении двух атомов на расстояние, где их взаимодействием уже нельзя пренебречь, энергетическая схема должна измениться. На рис. 5 изображена энергетическая схема системы из двух атомов.

Рис. 5
Обратим внимание на то, что верхний подуровень 2s оказался свободным. Величина расщепления уровней ΔE зависит от расстояния между атомами. Величина ΔE1 < ΔE2, так как в состоянии 1s электроны сильнее связаны с ядром, чем в состоянии 2s. Добавим в наш кристалл еще один атом. На рис. 6 изображены энергитическая и пространственная схемы системы из трёх атомов.

Рис. 6
Продолжая добавлять в нашу систему атомы и рассуждая аналогично, мы придем к выводу, что для системы из N атомов каждый из уровней изолированного атома расщепляется на N подуровней. Энергетическая схема системы, состоящей из N атомов лития, изображена на рис.7

Рис. 7
Систему подуровней называют разрешенной зоной. В кристалле лития образовалось две разрешенных зоны: из 1s и 2s уровней изолированного атома. Зона, получившаяся из 1s уровня, полностью заполнена. Зона, образовавшаяся из валентного 2s уровня, заполнена наполовину (на наших схемах заполнение обозначено штриховкой в клеточку). Между этими зонами может находится интервал энергий, запрещенных для электронов: это - запрещенная зона, ее ширину мы обозначаем ΔEзап.
Нетрудно понять, что кристалл с подобной зонной схемой будет хорошо проводить электрический ток: электроны наполовину заполненной валентной зоны могут под действием внешнего электрического поля увеличивать свою энергию и занимать зону проводимости. Все металлы хорошо проводят электрический ток, так как имеют энергетическую схему подобную схеме кристалла лития.
Будет ли проводить электрический ток вещество с изображенной на рис. 8 зонной схемой? Здесь валентная зона полностью заполнена. Зона проводимости свободна. Проводимость вещества с подобной зонной схемой зависит от ширины запрещенной зоны ΔEзап и температуры T.

Рис. 8
При ΔEзап ≤ 3 эВ вещество относят к полупроводникам, при более широкой запрещенной зоне - к диэлектрикам (изоляторам). Резкой границы между этими классами веществ нет. При T = 0 (и отсутствии других внешних воздействий) кристаллы с подобной зонной схемой проводить электрический ток не будут (если ΔEзап ≠ 0). Объясняется это тем, что слабое внешнее электрическое поле не сможет перевести электроны в свободную зону, поэтому, несмотря на приложенное внешнее поле, электроны под его воздействием не начнут упорядоченного движения. У полупроводников ΔEзап ≤ 3 эВ и при комнатной температуре энергии теплового движения оказывается достаточной, чтобы перевести некоторую малую часть электронов в свободную зону. Там электроны могут увеличивать свою энергию под действием слабого внешнего электрического поля на любую малую величину. Возникает упорядоченное движение зарядов - электрический ток.
В заключение изобразим рядом зонные схемы металла, полупроводника и диэлектрика

Рис. 9
Общие химические свойства металлов
В кристаллах металлов и в их расплавах атомные остовы связывает единое электронное облако металлической связи. Как и отдельный атом элемента, образующего металл, кристалл металла обладает способностью отдавать электроны. Склонность металла отдавать электроны зависит от его строения и, прежде всего, от размера атомов: чем больше ионные радиусы, тем легче металл отдает электроны.
Металлы – простые вещества, поэтому степень окисления атомов в них равна 0. Вступая в реакции, металлы почти всегда изменяют степень окисления своих атомов. Атомы металлов, не обладая склонностью принимать электроны, могут только их отдавать или обобществлять. Электроотрицательность этих атомов невелика, поэтому даже при образовании ими ковалентных связей атомы металлов приобретают положительную степень окисления. Следовательно, все металлы в той или иной степени проявляют восстановительные свойства. Они реагируют:
1) С неметаллами (но не все и не со всеми):
4Li + O2 = 2Li2O
3Mg + N2 = Mg3N2 (при нагревании),
Fe + S = FeS (при нагревании).
Наиболее активные металлы легко реагируют с галогенами и кислородом, а с очень прочными молекулами азота реагирует только литий и магний. Реагируя с кислородом, большинство металлов образует оксиды, а наиболее активные – пероксиды (Na2O2, BaO2) и другие более сложные соединения.
2) С оксидами менее активных металлов:
2Ca + MnO2 = 2CaO + Mn (при нагревании),
2Al + Fe2O3 = Al2O3 + 2Fe (с предварительным нагреванием).
Возможность протекания этих реакций определяется общим правилом (ОВР протекают в направлении образования более слабых окислителя и восстановителя) и зависит не только от активности металла (более активный, то есть легче отдающий свои электроны металл восстанавливает менее активный), но и от энергии кристаллической решетки оксида (реакция протекает в направлении образования более " прочного" оксида).
3) С растворами кислот:
Mg + 2H3O+ = Mg2+ + H2 + 2H2O Fe + 2H3O+ = Fe2+ + H2 + 2H2O
Mg + H2SO4p = MgSO4p + H2 Fe + 2HClp = FeCl2p + H2
В этом случае возможность реакции определяется по ряду напряжений (реакция протекает, если металл в ряду напряжений стоит левее водорода).
4) C растворами солей:
Fe + Cu2+ = Fe2++ Cu Cu + 2Ag+ = Cu2+ +2Ag
Fe + CuSO4p = Cu + FeSO4p Cu + 2AgNO3p = 2Ag + Cu(NO3)2p.
Для определения возможности протекания реакции здесь также используется ряд напряжений металлов.
5) Наиболее активные металлы реагируют с водой:
2Na + 2H2O = 2Na
 + H2 + 2OH - Ca + 2H2O = Ca2+ + H2 + 2OH-
+ H2 + 2OH - Ca + 2H2O = Ca2+ + H2 + 2OH-2Na + 2H2O = 2NaOHp + H2 Ca + 2H2O = Ca(OH)2p + H2

Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O = Zn+2O + H02
Неактивные (Au, Ag, Pt) – с водой не реагируют.
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li0 + H2 → 2Li+1H
Ca0 + H2 →Ca+2H2
7) Металлы могут образовывать химические соединения между собой. Такие соединения обычно образуют типичные металлы с металлами, обладающими слабыми металлическими свойствами, например определенные соединения натрия со свинцом: Nа5РЬ2, NaРЬ, Na2РЬ, Na4РЬ. Соединения одних металлов с другими носят общее название интерметаллидов, интерметаллических соединений или металлоидов.
Рассмотренные свойства металлов, связанные с отдачей электронов в химических реакциях, называют металлическими. В различной степени ими обладают все химические элементы. О металлических свойствах судят, сопоставляя электроотрицательности элементов. Эта величина, выраженная в условных единицах, характеризует способность атома в молекуле притягивать электроны. Относительные значения электроотрицательностей элементов. Чем меньше электроотрицательность, тем сильнее выражены металлические свойства элементов.
Электрохимический ряд напряжений металлов
Долгое время металлы удавалось сопоставить только по их физическим свойствам (плотность, твердость, магнитность и т. д.). Этого недостаточно, чтобы предвидеть их поведение при различных химических процессах. Разработать объективный критерий для сопоставления "силы" металлов, их активности, удалось харьковскому профессору Н.Н. Бекетову. В 1860 году Н. Н. Бекетов ввел преподавание физической химии в продолжение традиции Ломоносова. Предмет назывался: “Специальный курс органической химии и отношение физических и химических явлений между собой”. Первый в мире курс физической химии (“физико-химии”) был прочитан в Харьковском университете в 1865 году.
Студенты слушали лекции в течение двух лет, по два раза в неделю. Курс сопровождался практикумом (определение плотности пара, молекулярной массы, получение и исследование спектров и др.), причем в химической лаборатории было оборудовано 18 рабочих мест. Учебник Бекетова «Физико-химия» увидел свет в 1886 году.
До сих пор основоположником физической химии в ее современном варианте на Западе упорно продолжают считать Оствальда, хотя в 1865 году ему было лишь 12 лет. Кроме того, работая впоследствии в Рижском Политехникуме и будучи подданным Российской Империи, Оствальд не мог не знать об опыте Харьковского университета.
Бекетов исследовал «явления вытеснения одних элементов другими», фактически широко используя представления о законе действующих масс и указывая на возможность изменения направленности процессов путем варьирования начальных концентраций. Занимался и термохимическими исследованиями, в частности, выполнил классические определения теплот образования оксидов щелочных металлов и открыл алюминотермию (приоритет Бекетова в последнем случае совершенно бесспорен, но в литературе данное открытие иногда приписывается К. Гольдшмидту). В 1865 году Бекетов защищает докторскую диссертацию «Исследования над явлениями вытеснения одних элементов другими», в которых приведены результаты воздействия водорода на соли различных металлов, что позволило построить «вытеснительный ряд» по скорости и направленности процесса (теперь его называют «электрохимическим рядом напряжений металлов»).
Основным химическим свойством металлов, как уже упоминалось выше, является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы. Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены положительно. Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями. Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Опустим кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением:
Zn + Pb(NO3)2 = Pb + Zn(NO3)2
Из уравнения следует, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам двухвалентного свинца, тем самым превращаясь в ионы цинка, а ионы свинца восстанавливаются и выделяются в виде металлического свинца. Если поступить наоборот, то есть погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Чтобы понять природу электрохимических процессов, обратимся к рассмотрению нескольких достаточно простых ситуаций. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд, как пластинки, так и жидкой фазы.
Б
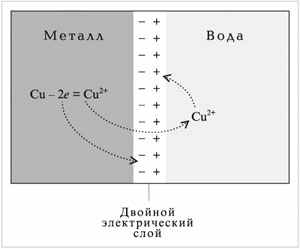 лагодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец, наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, и появляется разность электрических потенциалов, или электродный потенциал.
лагодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец, наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, и появляется разность электрических потенциалов, или электродный потенциал. Ме + mН2О↔Ме(Н2О)mn+ + nē
Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления.
При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом Ле-Шателье смещается влево и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде.
Равновесие можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионов из раствора.
У изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов. Такие пары называют полуэлементами (гальваническими элементами).

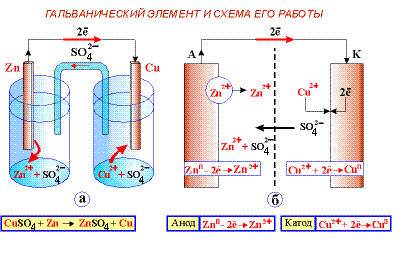
П
 од гальваническим элементом понимают единичные ячейки химических источников тока, предназначенных для однократного электрического разряда. Гальванический элемент представляет собой два электрода различной природы и электролит. Разные виды гальванических элементов представлены на рисунке (батарейки, зарядные устройства, аккумуляторы).
од гальваническим элементом понимают единичные ячейки химических источников тока, предназначенных для однократного электрического разряда. Гальванический элемент представляет собой два электрода различной природы и электролит. Разные виды гальванических элементов представлены на рисунке (батарейки, зарядные устройства, аккумуляторы).У
 словились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С.
словились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода 1 моль/л и омываемой струёй газообразного водорода под давлением 105 Па, при температуре 25 °С. 
Стандартные электродные потенциалы металлов и водорода ( 0, В), расположенные в порядке их возрастания, составляют ряд стандартных электродных потенциалов металлов, или электрохимический ряд напряжений металлов.
| Электрод | 0, В | Электрод | 0, В | Электрод | 0,В |
| Li+/Li | -3,045 | Mn2+/Mn | -1,18 | 2H+/H2 | 0,000 |
| Rb+/Rb | -2,925 | Cr2+/Cr | -0,913 | Sb3+/Sb | +0,20 |
| K+/K | -2,924 | Zn2+/Zn | -0,763 | Bi3+/Bi | +0,215 |
| Сs+/Cs | -2,923 | Cr3+/Cr | -0,74 | Cu2+/Cu | +0,34 |
| Ba2+/Ba | -2,90 | Fe2+/Fe | -0,44 | Сu+/Cu | +0,52 |
| Ca2+/Ca | -2,87 | Сd2+/Cd | -0,403 | Hg22+/2Hg | +0,79 |
| Na+/Na | -2,714 | Сo2+/Co | -2,77 | Ag+/Ag | +0,80 |
| Mg2+/Mg | -2,37 | Ni2+/Ni | -0,25 | Hg2+/Hg | +0,85 |
| Al3+/Al | -0,70 | Sn2+/Sn | -0,136 | Pt2+/Pt | +1,19 |
| Ti2+/Ti | -1,603 | Pb2+/Pb | -0,127 | Au3+/Au | +1,50 |
| Zr4+/Zr | -1,58 | Fe3+/Fe | -0,037 | Au+/Au | +1,70 |
Электродные потенциалы щелочных и щелочноземельных металлов рассчитываются теоретически, так как эти металлы в водных растворах взаимодействуют с водой.
Ряд электродных потенциалов дает полезные знания:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность. Как следует из ряда стандартных электродных потенциалов, металлический литий — самый сильный восстановитель в растворе, а золото - самый слабый. Чем выше алгебраическая величина потенциала, тем выше окислительная способность ионов этого металла. Ион Аu3+ — самый сильный окислитель, а ион лития Li+— самый слабый окислитель, и никогда не восстанавливается из раствора.
2.Металлы, имеющие значения электродного потенциала меньше, чем у водорода, могут растворяться с выделением водорода в кислотах, анионы которых не являются окислителями: Zn + 2НСl = ZnCl2 + Н2. Медь не реагирует с соляной кислотой.
3.Металлы, имеющие большее, чем у водорода, значение стандартного электродного потенциала могут встречаться в природе в самородном виде.
4.Металлы, имеющие меньшее значение электродного потенциала могут вытеснять металлы с большим значением электродного потенциала из растворов их солей:
Fe + CuS04 = Си + FeS04 . Будет ли цинк взаимодействовать с водными растворами NiSO4; Mg(N03)2? Стандартный электродный потенциал цинкового электрода больше, чем магниевого, следовательно, цинк не будет реагировать с растворами солей магния.
5.Металлы, имеющие электродный потенциал меньше, чем потенциал реакции
2H2O + 2e = H2 + 2OH - ; 0 = –0,83В в стандартных условиях могут растворяться в воде с выделением водорода. Но железо, хром, цинк, алюминий при обычных условиях с водой не реагируют. Магний реагирует с горячей водой, а натрий, кальций, калий и литий реагируют с водой при обычных условиях. Это объясняется тем, что на железе, хроме, цинке, алюминии образуются малорастворимые оксидные пленки, исключающие доступ воды к металлу. При удалении слоя оксида начинается взаимодействие этих металлов с водой. Оксиды или гидроксиды натрия, кальция, калия, лития растворимы в воде и не защищают металлы от контакта с водой.
Положение металлов в электрохимическом ряду напряжений не вполне соответствует их положению в периодической системе. Это объясняется тем, что при изменении электродных потенциалов учитывается не только энергия отрыва электронов от отдельных изолированных атомов, но и энергия, которая тратится на разрушение кристаллической решётки, а также энергия, которая выделяется при гидратации ионов. Например, в соответствии с положением в ПСХЭ, Na – более активный металл, чем Li. Однако 0Li < 0Na, то есть в водных растворах литий проявляет большую восстановительную активность, чем натрий. Это объясняется тем, что энергия гидратации ионов лития Li+ значительно больше энергии гидратации ионов Na+ , поэтому процесс образования гидратированных ионов лития (Li + mH2O →Li+ · mH2O + ē) является энергетически более выгодным, чем процесс образования гидратированных ионов натрия.
Способы получения металлов
Огромное большинство металлов находится в природе в виде соединений с другими элементами. Только немногие металлы встречаются в свободном состоянии, и тогда они называются самородными. Золото и платина встречаются почти исключительно в самородном виде, серебро и медь - отчасти в самородном виде; иногда попадаются также самородные ртуть, олово и некоторые другие металлы.
Добывание золота и платины производится или посредством механического отделения их от той породы, в которой они заключены, например промывкой воды, или путем извлечения их из породы различными реагентами с последующим выделением металла из раствора. Все остальные металлы добываются химической переработкой их природных соединений. Минералы и горные породы, содержащие соединения металлов и пригодные для получения этих металлов заводским путем, носят название руд. Главными рудами являются оксиды, сульфиды и карбонаты металлов:
- оксиды: магнетит Fe3O4, гематит Fe2О3 и др.
- смешанные оксиды: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • Аl2O3 • 2SiO2 и др.
- различные соли:
а) сульфиды: галенит PbS, киноварь НgS, серный колчедан FeS2,
б) хлориды: сильвин КСl, галит NaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О,
в) сульфаты: глауберова соль Nа2SO4• 2Н2О, гипс CaSO4 • 2H2O, барит ВaSO4 г) карбонаты: мел, мрамор, известняк СаСО3, магнезит МgСО3,
д) фосфаты: апатит Са3(РО4) 2,
е) нитраты: чилийская селитра NaNO3
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные. Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Человек использует металлы уже не одно тысячелетие. Веками накапливались знания о металлах и способах их получения, совершенствовалась технология извлечения металлов из руд. К XVIII веку сформировались основы науки о промышленных способах получения металлов. У ее истоков стоял великий русский ученый-энциклопедист М. В. Ломоносов. Наука о промышленных способах получения металлов называется металлургией, соответствующие заводы — металлургическими, а отрасль промышленности — металлургической промышленностью. Исторически так сложилось, что различают два вида металлургии. Металлургия чугуна и стали называется черной, способы промышленного получения других металлов относят к цветной металлургии.
Любой металлургический процесс - это процесс восстановления ионов металла с помощью различных восстановителей.
Ме+ + nē → Ме0
По методам получения металлов разделяют три основных вида металлургии:
1. Пирометаллургия - восстановление металлов из руд при высоких температурах с помощью восстановителей С, СО, Н2,активных металлов (по-гречески pyr огонь). Многие из этих способов известны с древних времен.
Важнейший способ получения металлов из руд основан на восстановлении их оксидов углем. Если, например, смешать красную медную руду (куприт) Cu2O с углем и подвергнуть сильному накаливанию, то уголь, восстанавливая медь, превратится в оксид углерода(II), а медь выделится в расплавленном состоянии:
Cu2O + C = 2Cu + CO
Подобным же образом производится выплавка чугуна их железных руд, получение олова из оловянного камня SnO2 и восстановление других металлов из оксидов.
При переработке сернистых руд сначала переводят сернистые соединения в кислородные путем обжигания в особых печах, а затем уже восстанавливают полученные оксиды углем. Например:
2ZnS + 3O2 = 2ZnO + 2SO2
ZnO + C = Zn + CO
В тех случаях, когда руда представляет собой соль угольной кислоты, ее можно непосредственно восстанавливать углем, как и оксиды, так как при нагревании карбонаты распадаются на оксид металла и двуокись углерода. Например:
ZnCO3 = ZnO + CO2
Обычно руды, кроме химического соединения данного металла, содержат еще много примесей в виде песка, глины, известняка, которые очень трудно плавятся. Чтобы облегчить выплавку металла, к руде примешивают различные вещества, образующие с примесями легкоплавкие соединения - шлаки. Такие вещества называются флюсами. Если примесь состоит из известняка, то в качестве флюса употребляют песок, образующий с известняком силикат кальция. Наоборот, в случае большого количества песка флюсом служит известняк.
Во многих рудах количество примесей (пустой породы) так велико, что непосредственная выплавка металлов из этих руд является экономически невыгодной. Такие руды предварительно «обогащают», то есть удаляют из них часть примесей. Особенно широким распространением пользуется флотационный способ обогащения руд (флотация), основанный на различной смачиваемости чистой руды и пустой породы.
Техника флотационного способа очень проста и в основном сводится к следующему. Руду, состоящую, например, из сернистого металла и силикатной пустой породы, тонко измельчают и заливают в больших чанах водой. К воде прибавляют какое-нибудь малополярное органическое вещество, способствующее образованию устойчивой пены при взбалтывании воды, и небольшое количество специального реагента, так называемого «коллектора», который хорошо адсорбируется поверхностью флотируемого минерала и делает ее неспособной смачиваться водой. После этого через смесь снизу пропускают сильную струю воздуха, перемешивающую руду с водой и прибавленными веществами, причем пузырьки воздуха окружаются тонкими масляными пленками и образуют пену. В процессе перемешивания частицы флотируемого минерала покрываются слоем адсорбированных молекул коллектора, прилипают к пузырькам продуваемого воздуха, поднимаются вместе с ними кверху и остаются в пене; частицы же пустой породы, смачивающиеся водой, оседают на дно. Пену собирают и отжимают, получая руду с значительно большим содержанием металла.
Восстановлением углем можно получить Fe, Cu, Zn, Ge, Sn, Pb и другие металлы, не образующие прочных карбидов (соединений с углеродом)
Разновидностью пирометаллургии можно считать металлотермию. Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в. Чаще всего в качестве восстановителя используют алюминий, и метод получения металлов называется алюминотермией.
3MnO 2+ 4Al = 3Mn + 2Аl2O3
Для получения металлов высокой чистоты в качестве восстановителя используется водород (водородотермия)
MоO3+ 3Н 2= Mо + 3Н2O, WO 3 + 3H 2 = W + 3H 2O
2. Гидрометаллургия - восстановление металлов из их солей в растворе более активными металлами. Процесс происходит в два этапа:
1) природное соединение растворяют в подходящем реагенте для получения раствора соли этого металла; 2) восстановление металла из раствора более активным металлом. Чтобы получить медь из руды, содержащей СuO, ее обрабатывают разбавленной серной кислотой, а затем вытесняют медь железом:
CuO + Н 2SO 4 = CuSO4 + Н2O, CuSO4 + Fe = Сu + FeSO4
Таким способом получают серебро, цинк, молибден, золото, уран. Гидрометаллургический способ имеет большое будущее, так как позволяет получать продукт, не извлекая руду из земли.
3. Электрометаллургия - восстановление металлов в процессе электролиза растворов или расплавов их соединений электрическим током. Некоторые наиболее активные металлы получаются исключительно путем электролиза, так как все другие средства оказываются недостаточно энергичными для восстановления их ионов. Таким путем получают наиболее активные металлы, щелочные и щелочноземельные металлы, алюминий, магний. Электрохимическое восстановление применяют также для рафинирования (очистки) «сырых» металлов (меди, никеля, цинка и др.), полученных другими способами. При электролитическом рафинировании в качестве анода используют «черновой» (с примесями) металл, в качестве электролита раствор соединений данного металла. Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей или оксидов. Все руды являются тугоплавкими твердыми ионными соединениями. Для того, чтобы понизить температуру плавления, к ним добавляют примеси, например, добавление криолита понижает температуру плавления боксита с 2045 до 950 0С. Количество металла, выделяющегося на катоде, зависит от силы протекающего тока, поэтому большинство электролитических ячеек работает при очень больших значениях силы тока. Продуктами являются очень активные металлы и неметаллы, поэтому ячейки оборудованы специальными устройствами для их выведения. Процесс является дорогим, поскольку для нагрева ячейки и восстановления руды необходимо большое количество электрической энергии.
В древности алюминиевые украшения были дороже золотых, так как самородного алюминия не было, а получать его было очень трудно. Несмотря на дороговизну, ценные свойства алюминия повлекли за собой его использование не только в виде украшений.
Впервые в 1825 году датский ученый Эрстед получил алюминий электролизом глинозема. Большие затраты электроэнергии, дороговизна производства тормозили широкое развитие алюминиевого производства. В конце IX века найдены дешевые источники электроэнергии – и производство алюминия резко возрастает. На рубеже IX- XX веков автопромышленность, машиностроение, авиация уже не могут обойтись без алюминия. В нашей стране алюминий впервые получен в 1929 году, а с 1932 года налажено его крупномасштабное производство.
Для электролитического получения алюминия необходимы: боксит, криолит, гидроксид натрия, углерод из сырой нефти. Боксит – Al2O3 ·3H2O, горная порода, похожая на глину, источник алюминия; основная часть боксита – оксид алюминия (30-60%), связанный с водой; в качестве вредных примесей боксит содержит кремнезем (SiO2), оксиды железа и титана (Fe2O3, TiO2). Криолит – Na3AlF6 используется для понижения температуры плавления очищенного оксида алюминия. Гидроксид натрия используется для очистки боксита; углерод – для приготовления анодов.
Боксит дробят, перемалывают (в шаровых мельницах), обрабатывают раствором щелочи. Оксид алюминия растворяется, поскольку он амфотерный, и может быть отфильтрован от примесей (Fe2O3, SiO2, TiO2), которые остаются в осадке. Раствор алюмината затравливают чистым оксидом алюминия, а затем при температуре 12000С (в барабанных вращающихся печах) разлагают на оксид и воду. Чистый оксид отфильтровывается, а гидроксид натрия возвращается в производственный цикл.
А
 l2O3 — тугоплавкое и неэлектропроводное вещество (температура плавления 2050 0С), поэтому электролиз проводят в присутствии добавок, снижающих температуру плавления и повышающих электрическую проводимость. Аl2O3 высушивается и смешивается с криолитом. Это понижает температуру плавления до 950 0С. Оксид растворяется (состав шихты: 8-10% Аl2O3 и 90-92% Na3AlF6) и подвергается электролизу в покрытой графитом ванне, играющей роль катода. Расплавленная шихта имеет плотность 2,35г/см2, а образовавшийся из неё алюминий 2,73г/см2, поэтому алюминий, выделяясь на катоде, опускается на дно ванны, откуда выпускается наружу через некоторые промежутки времени. Ионы кислорода окисляются на углеродных (графитовых) анодах, погруженных в расплав. Образующийся газообразный кислород вступает в реакцию с горячими анодами, и в результате получается двуокись углерода. В каждой ячейке расположено несколько анодов, и по мере выгорания они поочерёдно заменяются. Кроме того, необходимо постоянно очищать анодные газы, в которых содержится пыль криолита, оксида алюминия, газы СО2, СО и НF.
l2O3 — тугоплавкое и неэлектропроводное вещество (температура плавления 2050 0С), поэтому электролиз проводят в присутствии добавок, снижающих температуру плавления и повышающих электрическую проводимость. Аl2O3 высушивается и смешивается с криолитом. Это понижает температуру плавления до 950 0С. Оксид растворяется (состав шихты: 8-10% Аl2O3 и 90-92% Na3AlF6) и подвергается электролизу в покрытой графитом ванне, играющей роль катода. Расплавленная шихта имеет плотность 2,35г/см2, а образовавшийся из неё алюминий 2,73г/см2, поэтому алюминий, выделяясь на катоде, опускается на дно ванны, откуда выпускается наружу через некоторые промежутки времени. Ионы кислорода окисляются на углеродных (графитовых) анодах, погруженных в расплав. Образующийся газообразный кислород вступает в реакцию с горячими анодами, и в результате получается двуокись углерода. В каждой ячейке расположено несколько анодов, и по мере выгорания они поочерёдно заменяются. Кроме того, необходимо постоянно очищать анодные газы, в которых содержится пыль криолита, оксида алюминия, газы СО2, СО и НF.
