Абораторный комплекс лкт- 9 в составе: электрочайник, вольтметр, манометр, секундомер и мультиметр
| Вид материала | Лабораторная работа |
- Й диод на панели, соленоид, универсальный источник питания типа уип, стабилизированный, 148.33kb.
- Представлен лабораторный комплекс в составе стенда на базе микропроцессорного модуля, 24.28kb.
- «Тепловые явления», 1536.55kb.
- В. И. Лях учебник физическая культура М. Я. Виленского 5-6-7 классы Урок, 116.74kb.
- В электрических и магнитных полях, 177.46kb.
- Й пусковой комплекс Установка Подсистема обзора и контроля летного поля Системы a-sgmcs;, 2887.6kb.
- Лабораторная работа э-7 Определение горизонтальной составлЯющей магнитного поля земли, 56.36kb.
- Цифровой вольтметр щ-304, 137.06kb.
- Памятка населению «Как экономить энергоресурсы», 145.54kb.
- Материально-техническая база кафедры, 50.88kb.
ЛАБОРАТОРНАЯ РАБОТА № 4
Изучение изотермического процесса. Проверка закона Бойля-Мариотта.
Цель работы: изучить параметры изотермического процесса, экспериментально проверить справедливость закона Бойля-Мариотта.
Приборы и принадлежности: лабораторный комплекс ЛКТ- 9 в составе: электрочайник, вольтметр, манометр, секундомер и мультиметр.
4.1. Теоретическое введение
Уравнение состояния, как для идеальных, так и для реальных газов описывается тремя параметрами P,V,T уравнением состояния идеального газа:
 (1)
(1)Для одного моля любого газа это соотношение принимает вид:
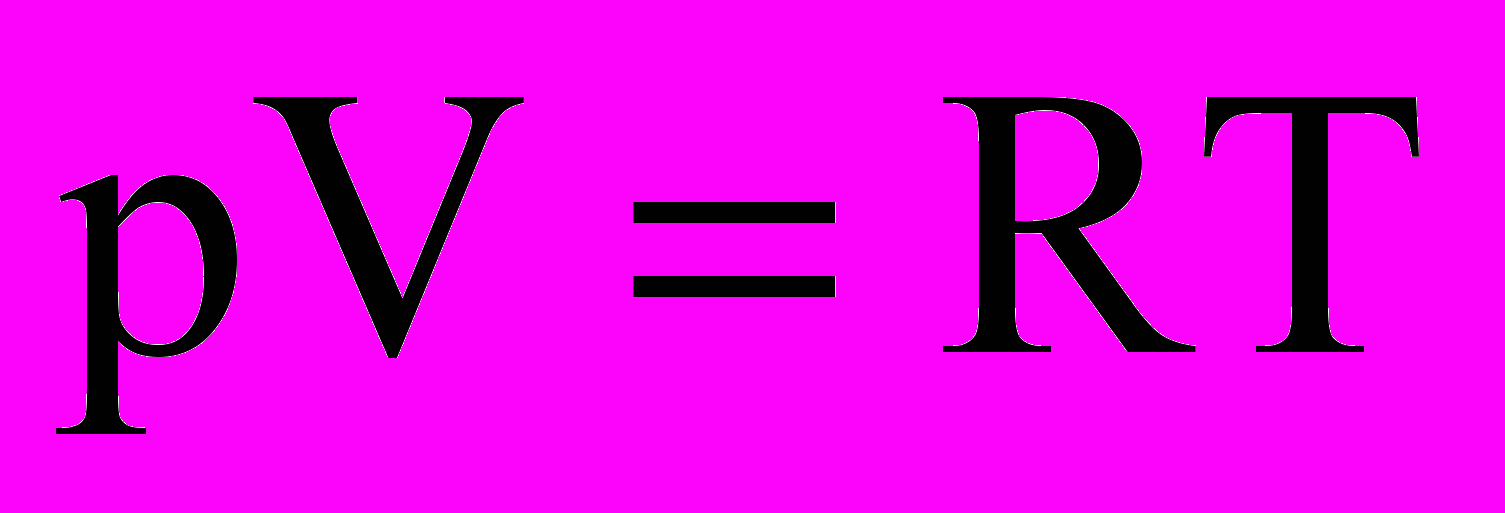
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном и имело вид:
pV = (ν1 + ν2 + ν3 + ...)RT,
В форме (1) оно было впервые записано Д.И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Объединенный газовый закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вид:
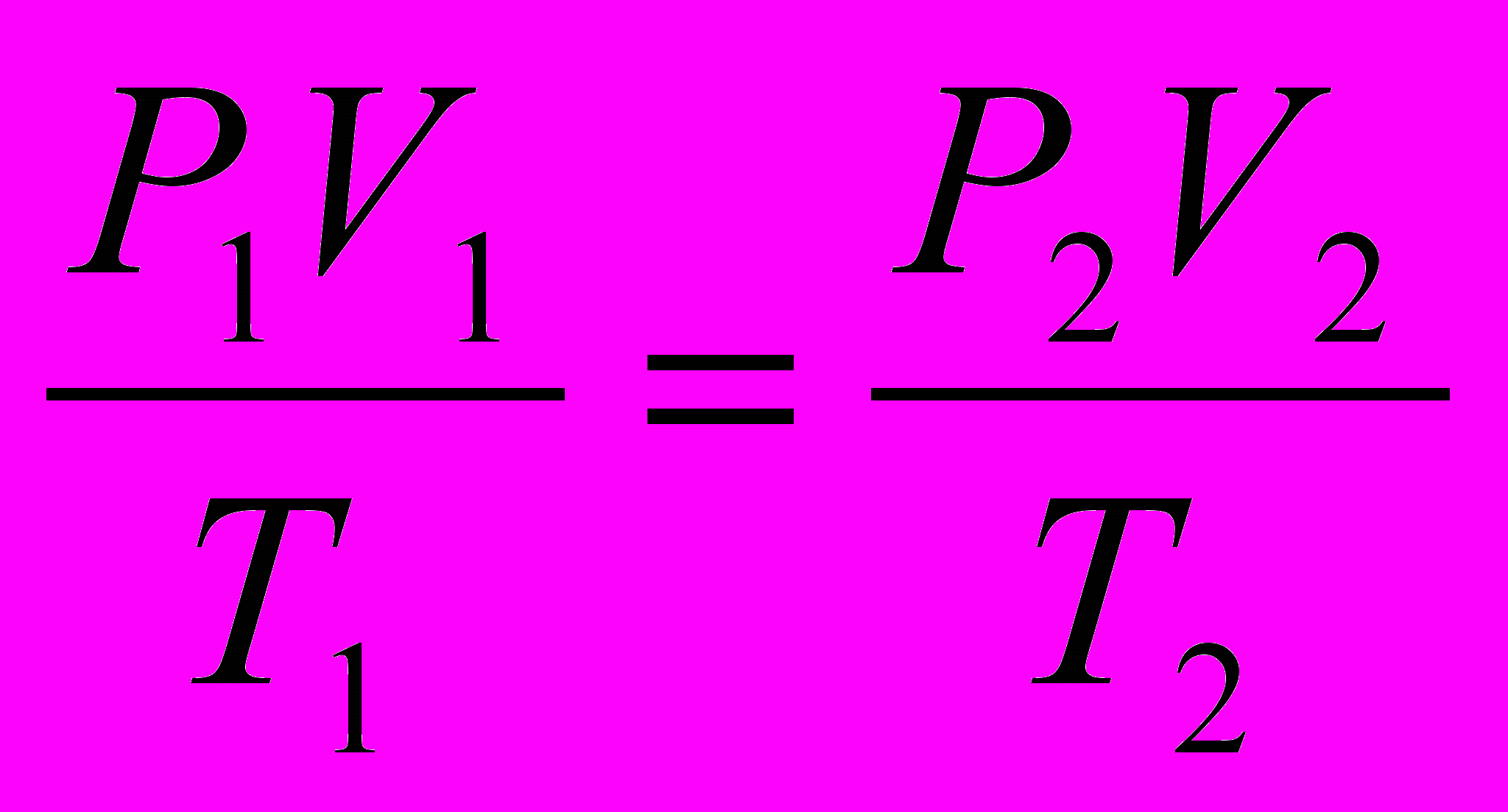
или:
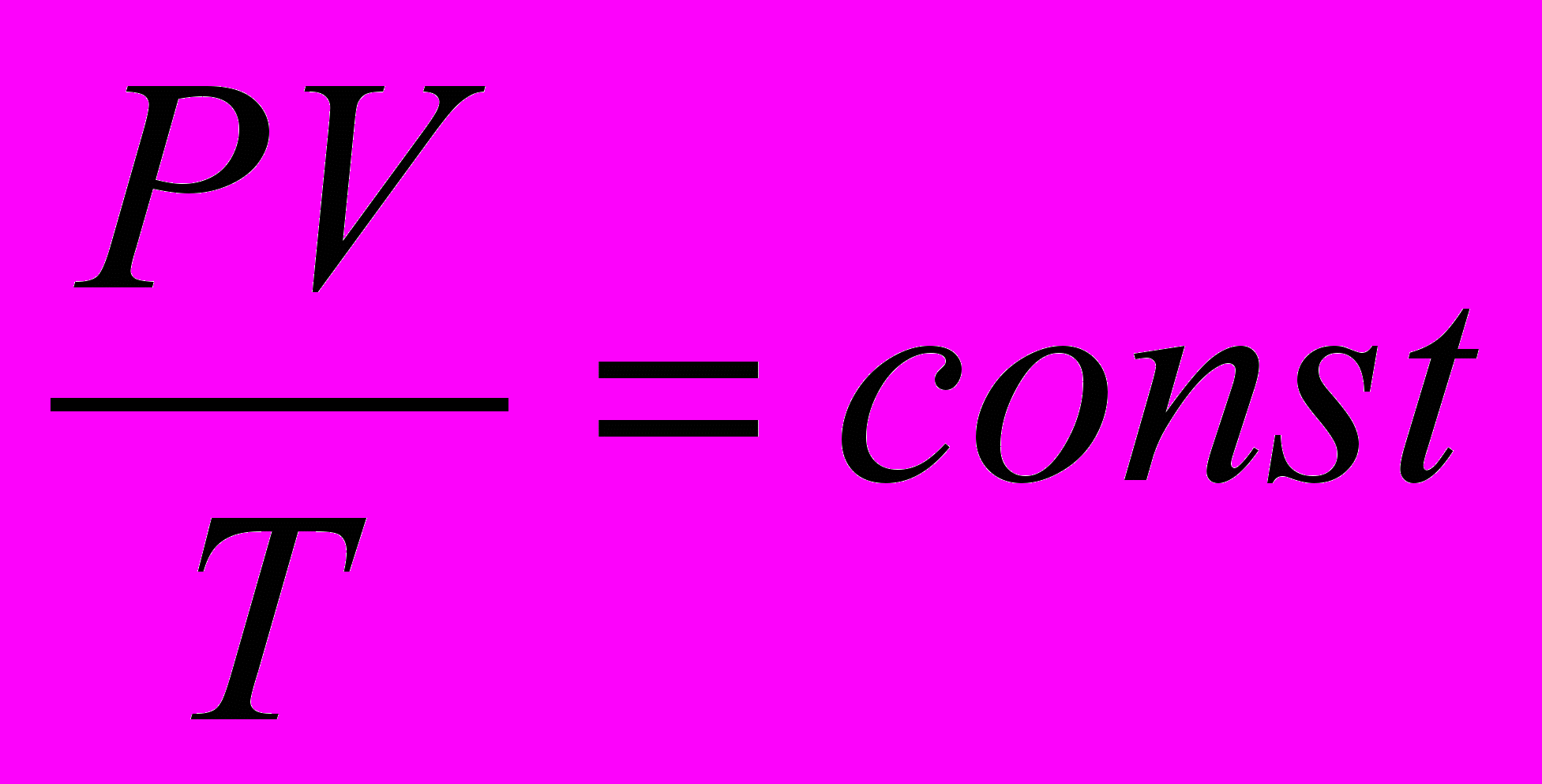
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение
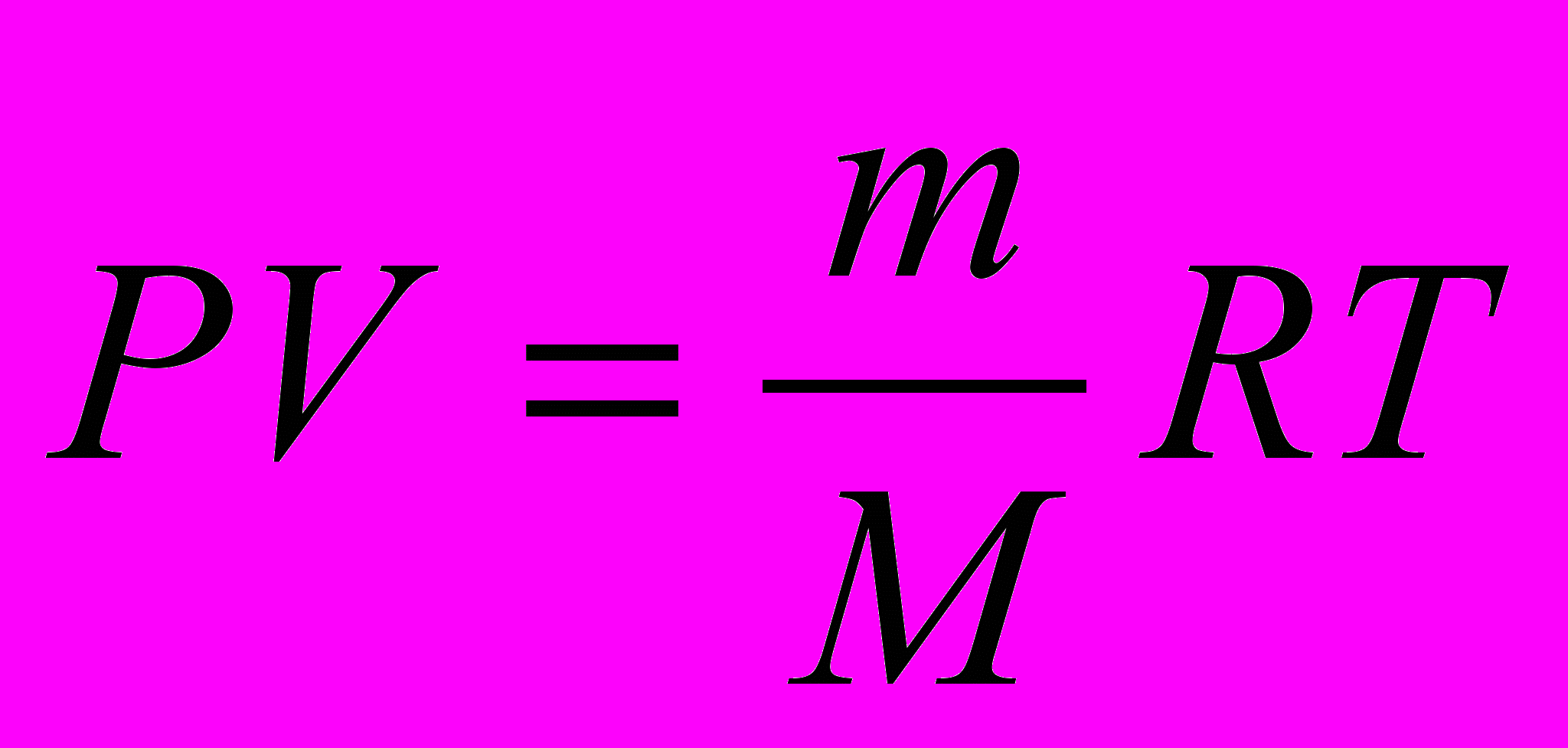 можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории. Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (P, V и T). Процессы могут быть изображены на диаграмме состояний (например, в координатах P, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (P, V или T) остается неизменным. Такие процессы называются изопроцессами.
Для пояснения приведем пример.
Возьмем цилиндрический сосуд с плотно притертым поршнем. Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако если охлаждая сосуд при сжатии газа или нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т=const).
Предоставим газу возможность расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить следующим образом. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщим бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого отверстия наружу, и поместим в струе расширяющегося воздуха термометр. Термометр покажет температуру, заметно более низкую, чем комнатная, а что будет указывать на понижение температуры воздуха в струе.
Следовательно, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением.
Из уравнения
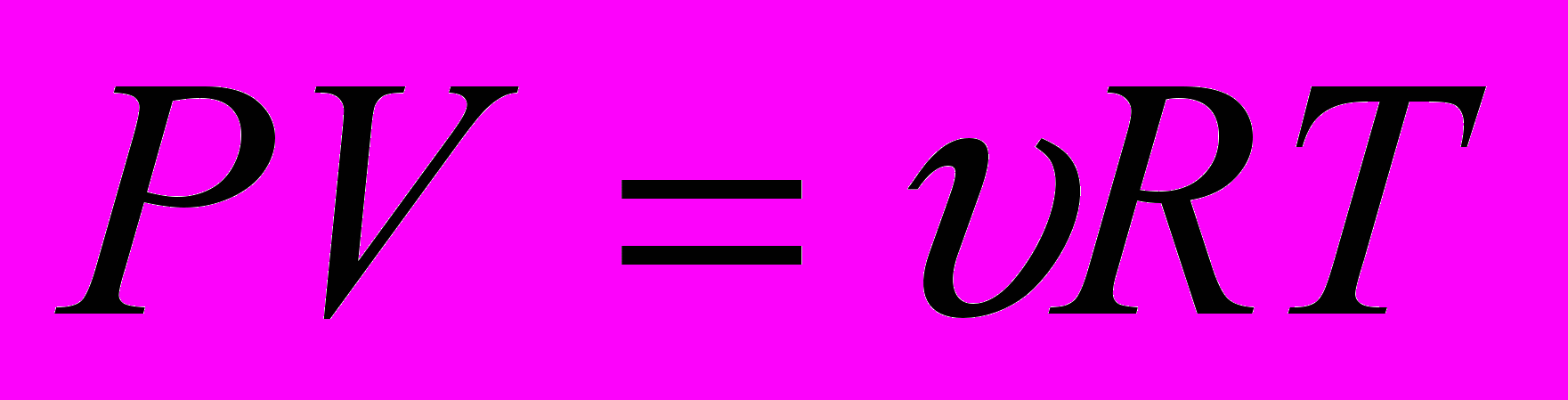 состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным:
состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным:
|
Процесс изменения давления и объема газа при постоянной температуре называется изотермическим процессом. График зависимости давления газа от его объема при изотермическом процессе называется изотермой. На плоскости (P, V) изотермы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V (рис.1).
Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры.
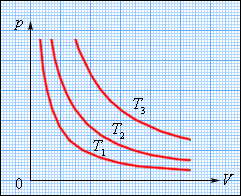
Рис. 1. Семейство изотерм на плоскости
(p, V). T3 > T2 > T1.
Уравнение изотермического процесса, выражающее зависимость давления от объема газа при постоянной температуре было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
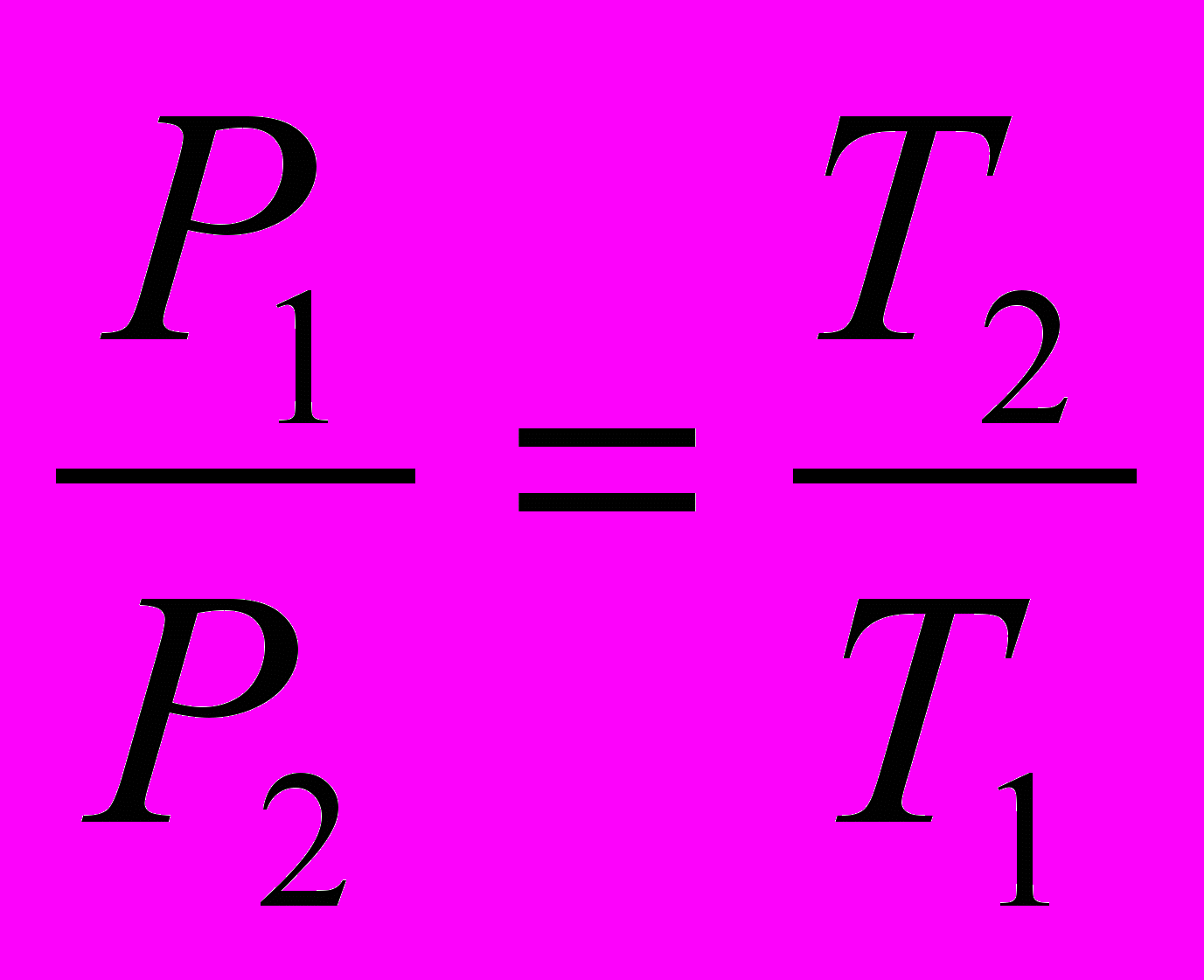
Однако, закон Бойля-Мариотта перестает оправдываться, если перейти к большим давлениям.
4.2. Описание и устройство комплекса ЛКТ-9.
Общий вид комплекса ЛКТ-9 приведен на рис.2. принадлежности показаны на рис.3.
Основной элемент комплекса - электрочайник 8, используемый в качестве водяной бани, нагревателя и калориметра. Чайник постоянно подключен к электрической розетке внутри пульта управления, которая через два предохранителя на 10 А соединена с кабелем питания, заканчивающимся вилкой "Евро". Для подключения к розеткам "Азия" имеется переходник.

Рис. 2 Комплект ЛКТ – 9
Пульт управления установкой позволяет измерять сетевое напряжение вольтметром 2, давление в исследуемом объеме - манометром 3, интервалы времени - секундомером 5, температуру, сопротивление нагревателя и другие параметры - мультиметром 6.
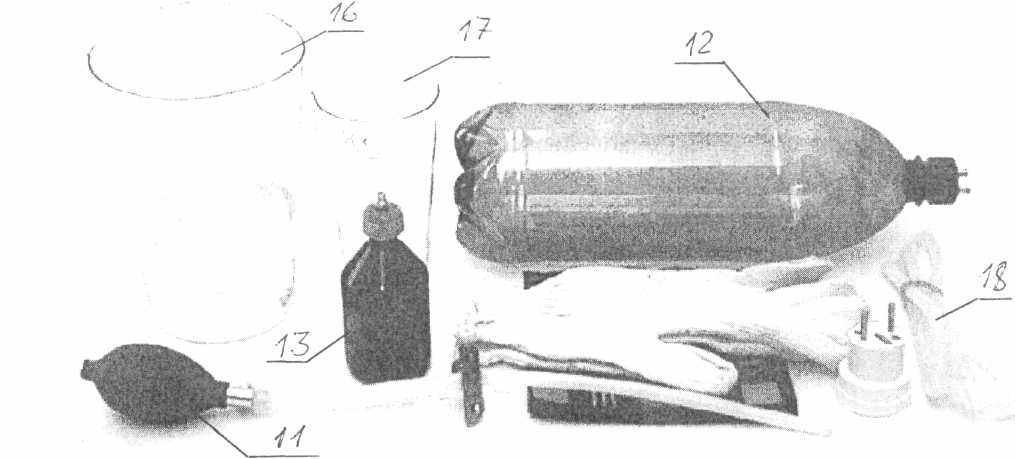
Рис.3. Принадлежности комплекса ЛКТ-9.
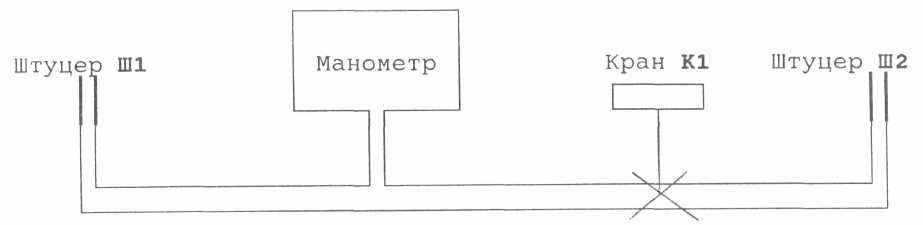
Рис. 4 Схема пневмосистемы.
Штуцер Ш1 подключен к манометру постоянно, штуцер Ш2 - посредством крана-зажима. Нормальное состояние крана - открытое (головка крана не затянута). При вращении головки крана по часовой стрелке пережимается шланг, соединяющий штуцер Ш2 с манометром. Постоянное пережатие шланга не рекомендуется, возможно временное слипание стенок шланга.
4.3. Экспериментальная проверка закона Бойля-Мариотта
Если сосуд объемом V1, в котором находится газ под давлением Р1, соединить с сосудом объемом V2 с газом под давлением Р2, то при одинаковой и постоянной температуре сосудов установившееся в них давление равно:
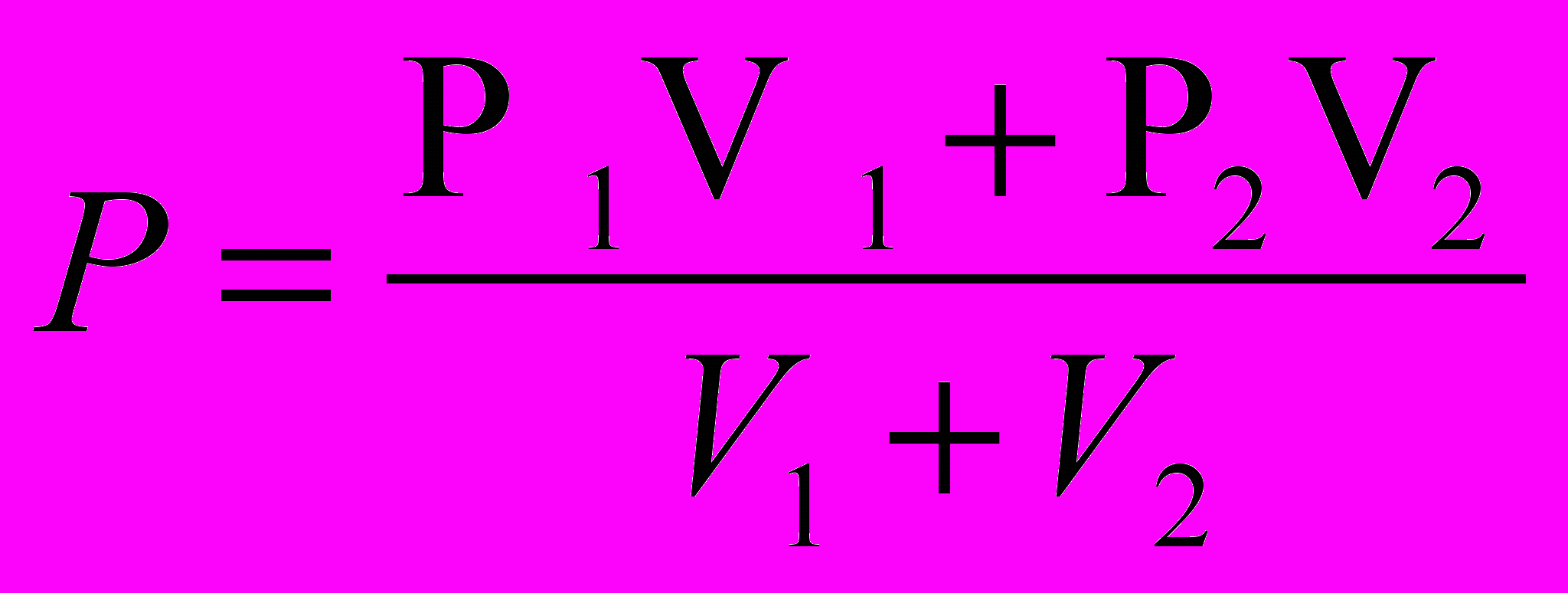 , (1)
, (1)а приращение давления в первом сосуде:
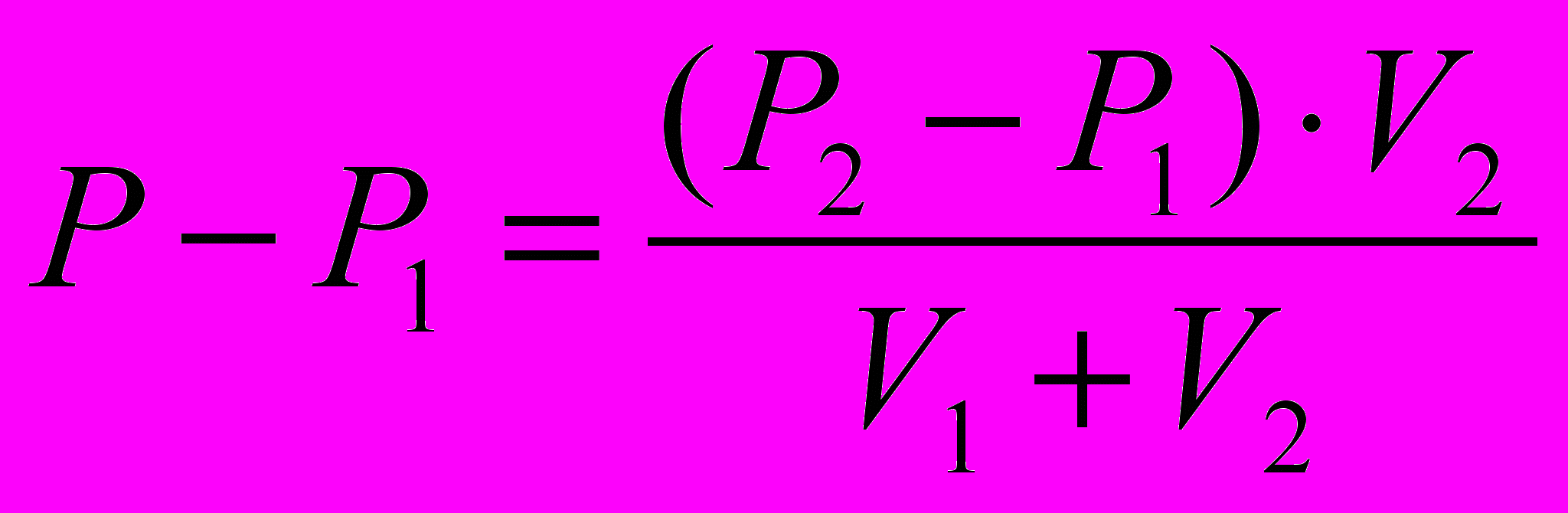 (2)
(2)Примечание. В качестве измеряемых величин использовать избыточные давления.
4.4. Порядок выполнения работы.
1. Подключить баллон (V1=1,06 л) с двумя штуцерами посредством шланга к манометру через штуцер Ш1. Ко второму штуцеру баллона присоединить шланг груши – помпы.
2. Перекрыв кран К1, накачать в баллон воздух до давления 180-220 мм рт.ст., затянуть винтовой шланг – зажим на шланге груши-помпы.
3. Подождать одну – две минуты до установления комнатной температуры T1воздуха в баллоне и снять значение давления Р1.
4. При закрытом кране К1 подключить к штуцеру Ш2 баллон известного объема V2 (0,64 л) в котором находится воздух при атмосферном давлении Р2. и температуре Т2. Для того, чтобы температура Т2 равнялась комнатной температуре Т1, старайтесь не держать баллон в руках, а берите их за горлышко.
5. Откройте кран К1. Подождите 1 – 2 минуты и зарегистрируйте давление Р.
6. Полученные данные занести в таблицу 1
Таблица 1
Экспериментальных и расчетных данных
| Определяемые величины | V1 | V2 | P1 | P2 | Pэксп | Pтеор |
| Расчетные данные | | | | | | |
7. Проверить соотношение (1)
8. Сделать выводы о справедливости закона Бойля-Мариотта.
4.5. Требования к отчету.
Отчет должен содержать:
1. Титульный лист, где указывается номер работы, её название, номер группы, фамилия и инициалы студента.
2. Цель работы.
3. Данные экспериментальной проверки закона Бойля-Мариотта
4. Вывод.
4.6. Контрольные вопросы.
1. Как из уравнения состояния для идеального газа получить закон Бойля-Мариотта.
2. Привести график изотермы на P-V диаграмме.
3. Привести схему пневмосистемы комплекса АКТ-9.
4. Как выглядит график изометрического процесса в P,T и V,T координатах?
5. Как по графику изотермы определить совершённую работу?
6. Поясните порядок проведения экспериментальной работы.
