Дисциплина «Материаловедение» Лекция №1
| Вид материала | Лекция |
- Лекция №1. Введение. Задачи курса, 2403.11kb.
- Примерная программа дисциплины стоматология модуль «материаловедение», 483.54kb.
- Рабочая программа дисциплины «физическое материаловедение полупроводников-1», 98.52kb.
- Лекция 1 Материаловедение. Особенности атомно-кристаллического строения металлов, 2248.88kb.
- Лекция №1 Цели и задачи курса «Материаловедение», 28.4kb.
- Ивановым Иваном Ивановичем по курсу «Материаловедение. Технология конструкционных материалов», 23.34kb.
- Материаловедение 1, 26.57kb.
- Методические рекомендации студентам специальностей 140101 «Тепловые электрические станции», 68.2kb.
- Материаловедение. Особенности атомно-кристаллического строения металлов, 2225.68kb.
- Магистерской программы «Материаловедение металлических и неметаллических материалов, 24.46kb.
Дисциплина «Материаловедение»
Лекция №1
Материаловедение – наука, изучающая строение и свойства материалов и устанавливающая связь между их составом, строением и свойствами при тепловых, механических, химических и физических воздействиях.
Современное материаловедение как наука сложилось во второй половине ХХ века в ответ на возросшую роль материалов в развитии техники и технологий. Только создание принципиально новых материалов, а на их основе сложнейших приборов, машин и агрегатов, позволило за короткое время достичь небывалых успехов в атомной, космической, авиационной технике, электронике, информационных технологиях и т.д. Материаловедение в настоящее время является научной основой изыскания новых материалов с заданными свойствами, а также основой для разработки новых технологий изменения структуры известных материалов для получения требуемых свойств. Материаловедение как раздел научного знания опирается на фундаментальную базу многих разделов физики, химии, механики и смежных дисциплин, а также на различные технологические дисциплины, связанные с получением, обработкой и применением материалов. Материаловедение – одна из важнейших, приоритетных наук, определяющих научно-технический прогресс человечества.
Из истории материаловедения
Вся история человечества связана с освоением и использованием в своей повседневной жизни различных материалов. С помощью камня 500 тысяч лет назад люди научились добывать огонь. Изготовив первые орудия из камня и кости, человек стал обрабатывать древесину, шкуры животных, освоил обжиг глины. Первыми металлами, которые человек научился плавить, отливать и обрабатывать, были золото (1 млн. лет до н.э.), серебро, олово (IV тысячелетие до н.э.), свинец (V тысячелетие до н.э.) и медь (VI тысячелетие до н.э.). Затем человек открыл оловянную бронзу (сплав меди и олова) и, наконец, научился получать железо (III тысячелетие до н.э.). Таким образом, каменный век уступил место медно-каменному, а затем последовала эра бронзового и железного века. Совершенствовалась и технология переплавки металлических руд: прокаливанием и ковкой полуфабрикатов научились получать кузнечное железо.
Использование энергии падающей воды для привода машин позволило нагреть металл до температуры, превышающей температуру плавления, а затем перерабатывать расплав в ковкое железо, очищая его от вредных примесей.
Применение каменного угля вместо древесного в качестве топлива при плавлении руд, а затем открытие процесса коксования каменного угля способствовало ускоренному развитию металлургии. Возрастание спроса на машины привело к возникновению машиностроения как отрасли промышленности.
Превращение ручных мануфактур в фабрики, в которых использовали машины, привело к изменению уровня техники и технологии получения материалов. Расплавленный чугун был впервые превращен в сталь, благодаря изобретенным процессам получения стали, названных по имени их создателей, - бессемеровский, томасовский и мартеновский. Рост промышленности требовал больших объемов металла и улучшения его качества. Возникла необходимость научных обобщений и рекомендаций. Так во второй половине ХIХ века (1868г.) появилась наука – металловедение. Основоположником металловедения и термической обработки стали считают русского ученого-металлурга Дмитрия Константиновича Чернова (1839-1921). Он открыл полиморфизм железа и критические точки фазовых превращений стали (в честь него назваными критическими точками Чернова), положил фактически начало построению диаграмм состояния, установил влияние термической обработки стали на ее структуру и свойства, создал стройную теорию кристаллизации стального слитка. Развитию металловедения способствовали научные открытия и изобретения. Русский металлург П.П.Аносов в 1831г. впервые применил микроскоп для исследования стали. Открытие рентгеновских лучей в 1895г. и установление в 1913г. независимо друг от друга русским кристаллографом Ю.В.Вульфом и английскими учеными отцом и сыном У.Г. Брэгг и У.Л.Брэгг условия дифракции рентгеновских лучей, позволило создать теорию и метод рентгеноструктурного анализа материалов. Это в свою очередь способствовали открытию кристаллической природы металлов и сплавов. Появилась возможность изучать и классифицировать кристаллические решетки различных материалов.
Большинство металлов было открыто в ХIХ в., чему способствовало открытие Д.И.Менделеевым периодической таблицы элементов. Но тогда немногие из открытых элементов получили промышленное применение. И только благодаря фундаментальным исследованиям в области металловедения в ХХ веке было разработано большое число сплавов, обладающих специальными свойствами: антикоррозионными, жаростойкими, жаропрочными, особыми магнитными, с «памятью» заданной формы, появились новые материалы: сверхпроводники, полупроводники.
Развитие органической химии и теории химического строения вещества позволили разработать и получить искусственные полимеры и на их основе – пластмассы. Новый материал бакелит (резол) стал первым продуктом производства пластических масс, которые стали рассматривать также в качестве конструкционных материалов. Одним из направлений получения новых конструкционных материалов стало объединение с помощью различных технологий металлических и неметаллических материалов, которые стали называть композиционными. Так постепенно различные направления теории и практики создания материалов для науки и техники были объединены в один раздел научного знания – материаловедение.
Курс « Материаловедение» состоит из двух разделов:
I Металловедение
1) Элементы теории сплавов;
- Элементы теории и практики термической обработки металлов;
- Промышленные сплавы
II Неметаллические материалы
- полимеры;
- пластмассы;
- резины;
- стекла
Литература.
Т.В.Соколова, В.Н.Цурков Методические указания по курсу «Материаловедение», Раздел «Металловедение», Издательство РУДН 2006г.
Т.В.Соколова Т.В., В.Н.Цурков. Методические указания по курсу «Материаловедение», Раздел Термическая обработка сплавов. Москва, Издательство РУДН 2006г.
В.Н.Цурков Методические указания по курсу «Материаловедение», Раздел «Неметаллические материалы» Издательство РУДН 2005г.
А.П.Гуляев Металловедение. Москва, Металлургия, 1990 г.
Материаловедение и технология конструкционных материалов. Авторы: Солнцев Ю.П., Веселов В.А., Демянцевич В.П. и др. Москва, МИСиС, 1996 г.
Материаловедение и технология конструкционных материалов. Авторы: Г.П.Фетисов, М.Г.Карпман, В.М. Матюнин и др. Москва, Высшая школа, 2001 г.
Раздел I. Металловедение
1. Элементы теории сплавов
1.1. Кристаллическое строение и свойства металлов.
Металловедение – наука, изучающая строение и свойства металлов и металлических сплавов, а также устанавливающая связь между их составом, строением (структурой) и свойствами при тепловых, механических, химических и физических воздействиях.
Металлами называют простые вещества, обладающие определенным кристаллическим строением, высокой тепло- и электропроводностью, пластичностью, а также блеском и непрозрачностью. Эти свойства обусловлены их электронным строением.
Согласно современным представлениям металлы можно рассматривать как вещества, обладающие определенной кристаллической решеткой, в узлах которой находятся положительно заряженные ионы, совершающие колебательное движение с частотой порядка 1013 Гц.1) Этот ионный кристаллический остов погружен в электронный газ. Электронный газ - это электроны, находящиеся на внешней орбите атомов, слабо связанные с ядром, легко переходящие с орбиты одного атома на орбиту другого, своей подвижностью напоминающие перемещение частиц в газе.
1) В ряде случаев под влиянием локальных тепловых процессов атомы могут перемещаться в кристаллической решетке. Это явление называют диффузией. Диффузию однородных атомов называют самодиффузией.
Между положительно заряженными ионами и окружающими их свободными валентными электронами (электронным газом) возникает электростатическое притяжение. Это притяжение является основной связью, так называемой металлической связью, удерживающей отдельные атомы в металле. Сближение ионов ограничивается их взаимным отталкиванием. Уравновешивание сил притяжения и отталкивания приводит к равномерному и закономерному распределению атомов в пространстве, т.е. кристаллическому строению.
При этом каждый ион должен иметь достаточно близких соседей, чтобы обобществленные электроны могли насытить валентности всех атомов. Этим объясняется тот факт, что металлы образуют так называемые плотноупакованные структуры.
Металлическое состояние характеризуется высокой прочностью связи. Мерой ее служит теплота сублимации (испарения), под которой понимают энергию, необходимую для разделения твердого металлического тела на отдельные атомы. Теплота сублимации металлов находится в пределах 100 – 1000 кДж/(г∙атом).
Рассмотренное строение металлов позволяет объяснить характерные свойства металлов. Высокая электропроводность металлов связана с наличием свободных электронов, которые под воздействием даже небольшой разности потенциалов перемещаются от отрицательного полюса к положительному. С повышением температуры амплитуда колебаний ионов возрастает, это затрудняет движение электронов, что приводит к росту электросопротивления. При низких температурах колебательное движение ионов уменьшается, и электропроводность резко возрастает.
Высокая теплопроводность металлов обусловливается как большой подвижностью свободных электронов, так и колебательным движением ионов, способных передавать импульс соседнему иону, вследствие чего происходит быстрое выравнивание температуры в массе металла.
Высокая пластичность металлов объясняется особенностями кристаллического строения металлов (наличием дислокаций), а также ненаправленностью металлической связи, т.е. равномерным распределением электронов по объему кристалла. В процессе пластической деформации металла, при которой происходит смещение отдельных объемов относительно других, связь между ионами не нарушается.
Химические свойства металлов определяются тем, что металлы сравнительно легко отдают валентные электроны и образуют положительные ионы, проявляют положительную степень окисления, образуя основные оксиды и гидроксиды. Большинство металлов замещает водород в кислотах.
Блеск и непрозрачность металлов обусловлены способностью хорошо отражать электромагнитные волны.
Металлическими свойствами обладают более 80 химических элементов и огромное количество сплавов. В технике металлы принято делить на черные (железо и сплавы на его основе) и цветные (все остальные). Металлы (металлические сплавы) играют огромную роль главным образом как конструкционные и электротехнические материалы.
1.2. Кристаллическое строение металлов.
Ключевые слова:
кристаллическая решетка,
кристаллографическая плоскость,
элементарная кристаллическая ячейка,
виды кристаллических решеток: ОЦК, ГЦК, ГПУ
параметры кристаллической решетки,
плотность упаковки, коэффициент заполнения,
координационное число,
полиморфизм, полиморфная модификация,
анизотропия, квазиизотропия
кристаллит, зерно, текстура
Все металлы и сплавы в твердом состоянии имеют кристаллическое строение, которое характеризуется закономерным расположением атомов в пространстве с образованием геометрически правильной системы, называемой кристаллической решеткой. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой – наименьшим комплексом атомов, многократно повторяя который в пространстве можно построить весь кристалл.
Стремление атомов (ионов) металла расположиться возможно плотнее друг к другу приводит к тому, что число встречающихся комбинаций взаимного расположения атомов невелико. В металлах наиболее часто встречаются следующие типы элементарных кристаллических решеток: объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Рис.1. Основные типы элементарных кристаллических решеток металлов:
а - объемно-центрированная кубическая;
б - гранецентрированная кубическая;
в - гексагональная плотноупакованная.
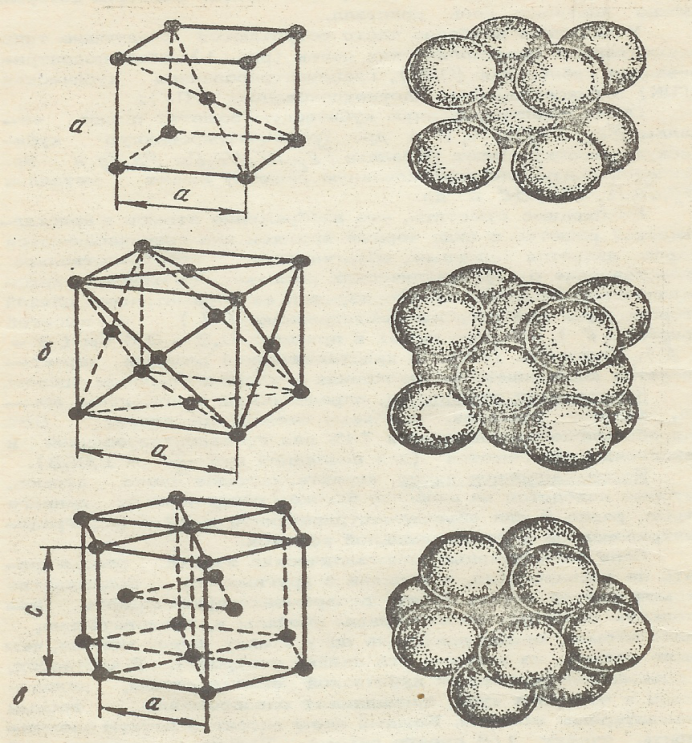
ОЦК решетку имеют α-железо (ниже 911 0С), хром, молибден, вольфрам, ванадий, β-титан (882 – 1672 0С) и др. ГЦК решетку имеют γ-железо (1392 – 911 0С), алюминий, никель, медь, свинец, золото, серебро, платина, β-кобальт (450 – 1480 0С) и др. ГПУ решетку имеют магний, α-кобальт (ниже 450 0С), α-титан (ниже 882 0С), цинк, бериллий и др.
Некоторые металлы меняют свою кристаллическую решетку при изменении температуры. Свойство металлов существовать в нескольких кристаллических состояниях (модификациях) с разной структурой называют полиморфизмом. Полиморфные модификации обозначают первыми буквами греческого алфавита, которые в виде индексов добавляют к символу элемента.
Размеры кристаллической решетки характеризуют ее параметры: длина стороны куба или стороны шестигранника (а) и высота призмы (с), которые лежат в пределах 0,2 – 0,6 нм (2 - 6Å; 1Å=1х10-10 м = 1х10-8 см). Плотность упаковки кристаллической решетки характеризуется коэффициентом заполнения, определяемым отношением объема, занятого атомами, к объему ячейки и составляет 68% для ОЦК и 74% для ГЦК и ГПУ решеток (для последней при с/а=1,633). Воображаемые плоскости, проходящие через центры атомов, называют кристаллографическими плоскостями. Плотность атомов в различных плоскостях и направлениях неодинакова, что определяет существенные отличия в силах связи между ними, а, следовательно, и различные свойства. Зависимость физико-химических и механических свойств в кристалле от направления называют анизотропией. Реальный металл, затвердевший в обычных условиях, состоит из огромного количества кристаллов неправильной формы, произвольно ориентированных в пространстве. Кристаллы неправильной формы называют кристаллитами или зернами. Свойства поликристаллического тела будут усредненными. Поэтому поликристаллические тела квазиизотропны. При обработке металла давлением (прокатке, ковке), если она ведется ниже так называемой температуры рекристаллизации, зерна металла приобретают определенную ориентацию (текстуру), после чего металл становится анизотропным. Свойства металла вдоль и поперек направления главной деформации могут существенно различаться.
1.3. Строение реальных металлов
Реальные кристаллы имеет дефекты, т.е. отклонения от правильного расположения атомов в решетке металла. Дефекты принято подразделять на точечные, линейные и поверхностные.
Точечные дефекты – вакансии (незанятые места в кристаллической решетке); дислоцированные или междоузельные атомы; примесные атомы.
Линейные дефекты – цепочки вакансий, дислоцированных атомов и дислокации.
Поверхностные дефекты – это границы зерен. Граница зерна – переходная область шириной до 10 атомных расстояний, в которой решетка одного кристалла переходит в решетку другого. В переходном слое нарушена правильность расположения атомов, повышена плотность дислокаций. На границах скапливаются примеси.

Рис.2. Точечные дефекты в кристалле:
а – вакансия; б – дислоцированный атом; в – примесные атомы замещения (большой) и внедрения (маленький).
Рис. 3. Краевая дислокация.

1.4. Кристаллизация металлов.
Кристаллизация (первичная кристаллизация) – это процесс образования кристаллов из жидкости (из жидкой фазы), другими словами, это переход металла из жидкого состояния в твердое. Ход процесса кристаллизации можно проследить по кривым охлаждения (кривые в координатах температура – время). При температуре кристаллизации на кривой охлаждения появляется горизонтальная площадка, связанная с тем, что в процессе кристаллизации выделяется тепло, так называемая скрытая теплота кристаллизации, которая компенсирует отвод тепла. По окончании процесса кристаллизации кривая охлаждения плавно под определенным углом опускается до комнатной температуры. Если в металле в твердом состоянии происходят полиморфные или магнитные превращения, то на кривой охлаждения вновь появляются площадки, связанные с выделением тепла превращения.
1.5. Состав и строение металлических сплавов
Чистые металлы обладают низкой прочностью и не обеспечивают требуемых физико-механических и технологических свойств. По этой причине применение чистых металлов в технике весьма ограниченно. В качестве конструкционных материалов широкое применение получили сплавы.
Сплавом называют сложное вещество, полученное сплавлением или спеканием двух или более простых веществ, называемых компонентами.
(При сплавлении компоненты доводят до плавления, а при спекании их порошки смешивают, прессуют и подвергают давлению при высокой температуре.)
Сплав, полученный преимущественно из металлических элементов и обладающий металлическими свойствами называют металлическим сплавом. Металлические сплавы по сравнению с чистыми металлами обладают более высокими механическими свойствами, лучшей технологичностью, ценными физическими и химическими свойствами, которые можно изменять в широких пределах, меняя их состав и структуру. Для простоты понимания ограничимся рассмотрением особенностей строения, происходящих превращений и механических свойств двойных (двухкомпонентных) сплавов. Полученные при этом знания и представления послужат основой для понимания структуры, особенностей превращений и полученных физико-химических свойств многокомпонентных сплавов.
Строение металлического сплава более сложное по сравнению с чистым металлом. Для изучения строения сплавов и превращений, протекающих в них, введем понятия «система», «фаза» и «структура». Система – это совокупность всех сплавов, которые можно получить, сплавляя между собой отдельные элементы (компоненты). Например, двух компонентная система золото-серебро подразумевает всю совокупность сплавов, первым из которых будет первый компонент - чистое золото, а последним будет второй компонент - чистое серебро. Между ними будут располагаться сплавы с растущей концентрацией серебра от 0% до 100%. Фаза – однородная часть системы (сплава), отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав и структура и свойства меняются скачком. Сплав, состоящий из двух компонентов, может быть однофазным или двухфазным. Структура сплава - это взаимное расположение различных фаз, форма и размеры составляющих их кристаллитов (зерен). Структура сплава зависит от особенностей его кристаллизации (как первичной, т.е. из жидкого состояния, так и вторичной, т.е. превращениях, протекающих в твердом состоянии). Структуру сплава изучают в металлографическом микроскопе. В двухкомпонентном сплаве структура также может быть однофазной или двухфазной. Структура подразумевает и наличие структурных составляющих. Структурная составляющая - это обособленная часть структуры с присущими ей характерными особенностями. (При образовании одной фазы структура и структурная составляющая являются синонимами.) Часто количество фаз может быть не равным количеству структурных составляющих, одна структурная составляющая может быть комбинацией фаз. Например, двухкомпонентная система железо - углерод, рассматривает (в числе прочих) сплавы, содержащие менее 2% углерода, которые называются сталями. Все стали данной системы имеют один и тот же фазовый состав (феррит и цементит), но в зависимости от количества углерода - различную структуру (с определенными структурными составляющими) и, соответственно, различные механические свойства.
В зависимости от размера атомов компонентов, их атомного строения, структуры их кристаллической решетки компоненты сплава при кристаллизации могут образовать различные фазы: твердые растворы, химические соединения и механические смеси.
Твердый раствор - это фаза, которая образуется, если возможна растворимость в твердом состоянии, т.е. существует возможность одного компонента размещаться в решетке другого. При этом один компонент сохраняет присущую ему кристаллическую решетку и называется растворителем, а второй компонент, утратив свое строение, в виде отдельных атомов распределяется в решетке растворителя и называется растворимым. Атомы растворенного компонента распределяются в решетке растворителя беспорядочно. По расположению атомов растворимого компонента в кристаллической решетке растворителя различают твердые растворы замещения и твердые растворы внедрения.
Твердые растворы замещения – это растворы, которые образуются путем замещения атомов растворителя в любых узлах его решетки атомами растворенного компонента (атом В на рис.4а). Растворимость в твердом состоянии может быть неограниченной и ограниченной. В сплавах с неограниченной растворимостью при увеличении концентрации растворяемого компонента количество замещаемых атомов в кристаллической решетке растворителя может расти (от 0 до 100%), т.е. до тех пор, пока не будут замещены все атомы. Таким образом, произойдет как бы плавный переход от одного элемента к другому. Образование неограниченных твердых растворов в большинстве случаев происходит при одинаковом типе кристаллических решеток (как говорят, их изоморфности) и при небольшой разности атомных радиусов компонента растворителя и растворенного компонента (для сплавов на основе железа разность не должна превышать 9%, а для сплавов на основе меди-15%). Компоненты, не отвечающие перечисленным условиям, могут образовывать ограниченные твердые растворы. Например, растворимость цинка в латунях (сплавах меди с цинком) не превышает 39%.
Твердые растворы внедрения – это растворы, в которых атомы растворенного компонента размещаются в междоузлиях (порах) кристаллической решетки растворителя. При этом атомы размещаются не в любой поре, а наибольшей. В ГЦК – решетке атом растворенного элемента внедрится в пору, находящуюся в центре элементарной ячейки растворителя (атом В на рис.4б). В ОЦК – решетке наибольшая пора находится в центре грани между двумя соседними ячейками. Твердые растворы внедрения образуются на базе переходных металлов (Fe, Co, Mn, Ti, Mo,W, Zr, V и др.), в которых растворяются неметаллы с малыми атомными диаметрами (C,H, O, N). Твердые растворы внедрения могут быть только ограниченными. Например, растворимость углерода в ОЦК-железе (феррите) не превышает 0,02%, а растворимость углерода в ГЦК-железе – 2,14%.
Поскольку размеры растворенных атомов отличаются от размеров атомов растворителя, образование твердого раствора сопровождается искажением кристаллической решетки растворителя.
Рис.4. Твердые растворы:
а - замещения;
б - внедрения
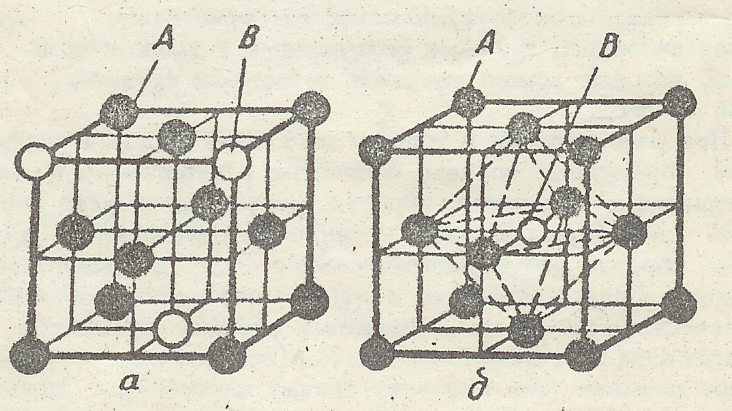
Химическое соединение - это фаза, образуется при химическом взаимодействии между компонентами. В отличие от растворов, в которых свойства меняются плавно, при образовании химического соединения все свойства меняются скачком (физические, химические, механические), образуется новая кристаллическая решетка с упорядоченным расположением и определенным количеством атомов. Химические соединения образуются между элементами, имеющими большое различие по свому строению и свойствам. Химическому соединению присуще стехиометрическое соотношение, т.е. его можно изобразить химической формулой (например, химическое соединение цементит – это карбид железа Fe3 C).
Если компоненты не образуют твердых растворов, не вступают в химическую реакцию, то в результате кристаллизации образуется механическая смесь фаз. При этом структура сплава представляет собой зерна одной фазы и зерна другой. Это случается, когда оба компонента имеют различные по типу кристаллические решетки, существенно различаются по величине радиусов атомов или по температуре плавления. Механическая смесь может состоять из чистых компонентов, из твердых растворов, или из смеси твердого раствора и химического соединения.
1.6. Кристаллизация сплавов и превращения в твердом состоянии
Процесс перехода сплава из жидкого состояния в кристаллическое и возможные превращения в твердом состоянии изучают по кривым охлаждения, построенным в координатах температура – время. Если чистые металлы кристаллизуются при одной температуре, то кристаллизация большинства сплавов происходит в интервале температур. Исключением являются некоторые сплавы, кристаллизующиеся аналогично чистым металлам при постоянной температуре.
Температура начала кристаллизации Тн соответствует началу выделения кристаллов из жидкой фазы. При этом могут образоваться кристаллы одного из компонентов, входящих в сплав, или кристаллы твердых растворов, или химических соединений. В результате состав сплава, остающегося в жидком состоянии (при постепенном уменьшении его количества) непрерывно меняется, а, следовательно, меняется и температура его затвердевания. Поскольку в процессе кристаллизации выделяется скрытая теплота, кривые охлаждения замедляют свой ход и в точке Тн происходит перегиб кривой. Есть сплавы, которые кристаллизуются в интервале температур Тн – Тк, с постепенным снижением температуры до полного затвердевания сплава (рис.а). Есть сплавы, начало кристаллизации которых протекает в интервале температур, однако часть жидкого сплава (эта часть может быть значительней предыдущей) завершает процесс кристаллизации подобно чистому металлу при одной температуре (рис.б). Есть небольшая часть сплавов, кристаллизация которых протекает при одной температуре, как в чистом металле (рис.в). Во всех случаях в точке Тк происходит окончательное затвердевание сплава, и его температура снова начинает уменьшаться по плавной кривой.
После полного затвердевания в сплавах, так же как и в чистых металлах, под действием внешних условий (температуры, давления и др.) могут происходить превращения. Это может быть связано с полиморфными или магнитными превращениями, если одному из компонентов сплава присущи такие превращения. Это может быть связано с особенностями взаимной растворимости компонентов и другими факторами. Все превращения в твердом состоянии сопровождаются тепловыми эффектами, а значит, изменением хода кривой на кривой охлаждения. Температура, соответствующая какому-либо превращению в металле или сплаве, называют критической температурой (или критической точкой).
