Диагностическое и прогностическое значение уровней рарр-а и маркеров воспаления у больных ишемической болезнью сердца 14. 01. 05 Кардиология
| Вид материала | Автореферат диссертации |
- «Диагностическое и прогностическое значение фно-α у больных ишемической болезнью сердца», 288.88kb.
- Прогностическое значение маркеров воспаления у больных ибс, оперированных в условиях, 339.25kb.
- «Пермская государственная медицинская академия имени академика Е. А. Вагнера», 661.68kb.
- Результаты лечения больных ишемической болезнью сердца электромагнитным излучением, 46.66kb.
- Применение инфракрасного широкополосного излучения модулированного терагерцовой частотой, 58.61kb.
- «Факторы коронарного ангиогенеза и влияние на них различных методов лечения у больных, 366.72kb.
- Керимович хроническая сердечная недостаточность у больных ишемической болезнью сердца:, 509.58kb.
- Прогностическое значение клинико-функциональных показателей и воспалительных маркеров, 500.64kb.
- Баймаканова Гульсара Есенгельдиевна Обострение хобл: диагностическое и прогностическое, 757.34kb.
- Влияние гелиогеомагнитной активности на функциональное состояние сердечно-сосудистой, 333.23kb.
На правах рукописи
Слесарева Юлия Сергеевна
Диагностическое и прогностическое значение уровней РАРР-А и маркеров воспаления у больных ишемической болезнью сердца
14.01.05 – Кардиология
Автореферат диссертации
на соискание учёной степени кандидата медицинских наук
Москва 2011
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Министерства здравоохранения и социального развития Российской Федерации
Научный руководитель:
Доктор медицинских наук, профессор Шевченко Олег Петрович
Официальные оппоненты:
Доктор медицинских наук, профессор Евсиков Евгений Михайлович
Доктор медицинских наук, профессор Глезер Мария Генриховна
Ведущая организация:
Московский Государственный Медико-Стоматологический Университет
Защита диссертации состоится « » 2011г. в. 14.00 часов на заседании диссертационного совета Д208.072.08 при РНИМУ им. Н.И.Пирогова (117997, Москва, ул. Островитянова, д.1).
С диссертацией можно ознакомиться в библиотеке РНИМУ им. Н.И.Пирогова (117997, Москва, ул. Островитянова, д.1).
Автореферат разослан « » сентября 2011г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор А.К. Рылова
Актуальность темы
Ишемическая болезнь сердца (ИБС) и её наиболее тяжелая форма – острый коронарный синдром (ОКС), занимают первое место по распространенности и смертности среди населения развитых и развивающихся стран мира. Характерной чертой ИБС является непредсказуемость развития острых коронарных событий. Появление клинических признаков острого коронарного синдрома свидетельствует об уже наступившем повреждении атеросклеротической бляшки и образовании тромба в просвете коронарной артерии (Libby P. 2001, Fuster V. 2005). Поэтому очень важной, но в настоящее время нерешенной проблемой является выявление признаков, предвещающих готовящуюся катастрофу.
Основным патогенетическим фактором развития ОКС является нарушение целостности нестабильной атеросклеротической бляшки, вызывающее образование тромба в просвете коронарной артерии. Сосудистое воспаление является ведущим фактором, способствующим повреждению покрышки атеросклеротической бляшки.
В последние годы большой интерес вызывает выявление у больных ИБС в крови биохимических маркеров, отражающих высокую протеолитическую активность макрофагов в атеросклеротических бляшках коронарных артерий (Fuster V. 2005, Panteghini M. 2004, О.С. Королева и соавт. 2007). Выделяемые макрофагами металлопротеиназы расщепляют коллаген, составляющий основу фиброзной покрышки атеросклеротической бляшки, в результате чего покрышка истончается и теряет прочность. Повреждение истонченной фиброзной покрышки является наиболее частой причиной бысторого формирования тромба в коронарных артериях, наблюдающегося у больных инфарктом миокарда (Braunwald E.,1998, Е.П. Панченко 2000). Острый коронарный синдром объединяет нестабильную стенокардию и инфаркт миокарда, и связан с высоким риском осложнений и смерти.
Для диагностики острого коронарного синдрома широко применяются методы, позволяющие выявить изменения, соответствующие тем или иным звеньям патогенеза острого коронарного синдрома, и большинство из них основано на выявлении очагов некроза или преходящих нарушений функции миокарда. Одной из важных современных задач является выявление таких показателей, которые бы позволили предсказывать развитие острого коронарного синдрома, или диагностировать его у больных до того, как разовьются необратимые изменения в миокарде.
В настоящее время ведется активный поиск биохимических маркеров ИБС, отражающих повреждение атеросклеротической бляшки и являющихся предикторами развития острых атеротромботических событий. В их числе маркеры, характеризующие активность сосудистого воспаления – наиболее изученными и характерными являются С реактивный белок, (СРБ), интерлейкин-6, (ИЛ-6).
В 2001 г. в крови у больных ИБС и в поврежденных атеросклеротических бляшках выявлен ассоциированный с беременностью протеин плазмы А (РАРР-А) – цинксодержащая матриксная металлопротеиназа (Bayes-Genis 2001). Предполагают, что РАРР-А является маркером повреждения атеросклеротической бляшки и может служить предиктором неблагоприятного прогноза больных ИБС. РАРР-А, вероятно, является наиболее перспективным маркером для выявления нестабильной атеросклеротической бляшки. Проведение сравнительного анализа прогностического значения уровней маркеров воспаления – С реактивного белка, интерлейкина-6, а также маркера эндогенной деструкции – РАРР-А в плазме крови у больных различными формами ИБС представляет большую значимость для определения наиболее достоверного предиктора неблагоприятного прогноза ИБС.
Цель исследования
Целью настоящего исследования является оценка диагностического и прогностического значения уровней РАРР А и других маркеров воспаления (интерлейкин-6, С-реактивный белок) в плазме крови больных с различными формами ишемической болезни сердца и проведение сравнительного анализа прогностического значения изучаемых маркеров для выявления маркера, обладающего наибольшей прогностической ценностью.
Задачи исследования
1. Определить значения уровней РАРР А и других маркеров воспаления (С-реактивного белка, интерлейкина-6) в плазме крови у больных с различными формами ИБС и у лиц контрольной группы и изучить связь исследуемых маркеров с клиническими формами ИБС.
2. Изучить корреляцию уровня РАРР А с уровнями воспалительных маркеров в плазме крови у больных ИБС.
3. Изучить корреляцию уровней маркеров воспаления и РАРР А в плазме крови больных ИБС с факторами риска ИБС.
4. Изучить прогноз развития неблагоприятных сердечно-сосудистых событий у больных стабильной стенокардией напряжения со значениями изучаемых маркеров выше и ниже их выявленных прогностических уровней.
5. Провести сравнительный анализ прогностического значения маркеров воспаления (СРБ, ИЛ-6) и РАРР-А у больных ИБС.
Научная новизна
В настоящем исследовании впервые было проведено изучение прогностического значения нескольких маркеров воспаления (СРБ, ИЛ-6) и маркера эндогенной деструкции (РАРР-А) после восьми лет наблюдения у больных ИБС и проведен сравнительный анализ их прогностической значимости. Был определен наиболее чувствительный прогностический маркер течения ИБС – РАРР-А, который является независимым маркером повреждения атеросклеротической бляшки. Была выявлена достоверная связь повышенного уровня РАРР-А и неблагоприятного прогноза больных ИБС.
Впервые было продемонстрировано прогностическое преимущество маркера эндогенной деструкции РАРР-А как более достоверного независимого маркера повреждения атеросклеротической бляшки и предиктора неблагоприятного прогноза ИБС по сравнению с другими маркерами воспаления (СРБ, ИЛ-6) при длительном периоде наблюдения. При этом высокий уровень ИЛ 6 не был ассоциирован с неблагоприятным прогнозом течения ИБС.
Практическая значимость
В результате проведенного исследования выявлен наиболее чувствительный, независимый от факторов риска ИБС маркер повреждения атеросклеротической бляшки и предиктор неблагоприятного прогноза ИБС – РАРР-А, по сравнению с изучаемыми маркерами воспаления (СРБ, ИЛ-6).
Определение повышенного уровня РАРР-А позволит выявлять пациентов с нестабильной поврежденной атеросклеротической бляшкой, не имеющих клинических проявлений нестабильного течения ИБС или имеющих клинику нестабильной стенокардии, а также лиц с высоким риском развития острых атеротромботических событий. Это позволит своевременно приступить к проведению адекватной терапии врачам общей практики, участковым терапевтам, кардиологам поликлинического звена или стационаров, направленной на предупреждение развития острого инфаркта миокарда и внезапной смерти, улучшить прогноз течения заболевания.
Данный метод лабораторной диагностики будет иметь практическую значимость для работы кардиологических отделений, отделений реанимации и интенсивной терапии, а также амбулаторного звена.
Положения, выдвигаемые на защиту
1. Маркеры воспаления и эндогенной деструкции, определяемые в крови, патогенетически связаны с прогрессированием атеросклеротического процесса, развитием деструкции атеросклеротической бляшки и развитием острых атеротромботических событий. Их концентрация отражает степень активности заболевания, свидетельствуя о системности и воспалительном характере атеросклероза.
2. Уровни маркеров воспаления и эндогенной деструкции повышены в плазме крови при остром коронарном синдроме, и их определение может быть использовано для оценки риска развития острого атеротромботического события.
3. Маркер эндогенной деструкции РАРР-А является наиболее значимым среди других маркеров воспаления предиктором неблагоприятного прогноза течения ИБС.
4. Измерение уровней маркеров воспаления и эндогенной деструкции в крови позволяет выявлять больных ИБС с высоким риском развития сердечно-сосудистых осложнений, что позволяет проводить адекватные профилактические и лечебные мероприятия и контролировать их эффективность.
Реализация результатов работы.
Результаты исследования внедрены в клиническую практику отделения коронарной хирургии и трансплантации сердца ФГУ НИИ трансплантологии и искусственных органов им В.И.Шумакова Росздрава, отделения кардиологии Домодедовской центральной районной больницы, отделения терапии поликлиники Минфина России.
Публикации
По теме диссертации опубликовано 15 работ, в т.ч. статей в журналах, указанных в Перечне ВАК для публикации научных материалов соискателей учёной степени кандидата наук.
Материалы и основные положения диссертации доложены и обсуждены: на XIV Pоссийском национальном конгрессе «Человек и лекарство», на IV Национальном конгрессе терапевтов, 2009 г., на Всероссийском научно-образовательном форуме «Профилактическая кардиология - 2010», на Всероссийской научно-практической конференции «Перспективы кардиологии в России», – 2009, на Всероссийской научно-практической конференции «Неотложная кардиология – 2009» , на Всероссийском научно-образовательном форуме и специальной выставке «Кардиология-2009».
Апробация работы
Апробация диссертации состоялась 22 апреля 2011 г. на совместной научно-практической конференции коллектива сотрудников
кафедры кардиологии ФУВ РГМУ и сотрудников кардиологического отделения №1 КБ УДП РФ.
Объём и структура диссертации
Диссертационная работа изложена на 149 машинописных листах и состоит из введения, шести глав, выводов, практических рекомендаций, заключения и списка использованной литературы, который содержит 56 отечественный источник и 191 иностранный источник. Работа проиллюстрирована 12 таблицами и 31 рисунком.
Материалы и методы исследования
Работа основана на анализе данных, полученных при обследовании 170 пациентов в возрасте от 24 до 90 (в среднем 62,3±6,1) лет. У 134 больных (63 мужчины, 71 женщина) была ИБС, 36 пациентов без ИБС составили контрольную группу. Больные ИБС были разделены на 3 группы: 1) у 38 больных нестабильная стенокардия (НС) II B класса (по классификации Браунвальда 2000 г.), 2) у 18 пациентов острый инфаркт миокарда (ОИМ)), 3) у 78 больных стабильная стенокардия напряжения (ССН) II-III функционального класса (по классификации Канадской ассоциации кардиологов, 1976 г.).
Диагноз ИМ основывался на выявлении характерных клинических признаков (ангинозные боли в грудной клетке продолжительностью 20 мин и более), повышения уровней в крови МВ КФК и тропонина Т, а также характерных для ИМ изменений на ЭКГ. У 13 больных был стойкий подъём сегмента ST более чем на 2 мм в двух и более отведениях (у 8 больных инфаркт миокарда был передней стенки и у 5 - нижний). У 5 больных был инфаркт миокарда без подъёма сегмента ST. Больные ОИМ были госпитализированы не позднее 3 дня от времени развития ангинозных болей.
Диагноз нестабильной стенокардии II B класса основывался на клинической картине впервые возникшей стенокардии или снижении толерантности к физической нагрузке, появлении приступов стенокардии покоя на протяжении последних четырёх недель, но не в ближайшие 48 часов, без экстракардиальных факторов, при этом отсутствовали стойкие изменения сегмента ST или зубца Т на ЭКГ, нарушение локальной сократимости миокарда по данным ЭХО-КГ и повышение уровней ферментов (КФК МВ, ЛДГ) и тропонина Т в крови. Развитие последнего приступа нестабильной стенокардии у включенных в исследование больных наблюдалось не позднее 5 дня до госпитализации.
Диагноз стабильной стенокардии напряжения (ССН) основывался на выявлении типичных приступов стенокардии, которые возникали при физической нагрузке (при ходьбе по ровному месту более 500 м, подъеме по лестнице на несколько этажей (IIФК), при медленной ходьбе по ровному месту в пределах 100-300 м, подъеме на первый этаж (IIIФК)). Приступы купировались приемом нитроглицерина. Во время пробы с физической нагрузкой у всех больных регистрировалась горизонтальная или косонисходящая депрессия сегмента ST на 1 мм и более от исходного уровня при сохранении ее снижения не менее 80 мсек от точки соединения (j). Среди обследованных больных стабильной стенокардией II функциональный класс (ФК) был у 47 чел., III ФК – у 31 чел.
Больные в исследуемых группах были сопоставимы по основным демографическим показателям, полу, возрасту и по наличию факторов риска ИБС (табл.1).
Таблица 1. Клиническая характеристика обследованных больных
| Характеристика больных | ОИМ I | НС II | ССН III | Группа Контроля IV | Р |
| Всего | 18 | 38 | 78 | 36 | |
| Возраст | 63,38±1,52 | 65,54±1,21 | 64,09±1,35 | 49,14±1,32 | >0,05 |
| Пол (м/ж, %/%) | 8/10, 44/56 | 20/18, 53/47 | 35/43, 46/54 | 15/21,42/58 | >0,05 |
| Индекс массы тела | 27,36±1,77 | 28,59±1,57 | 28,46±0,56 | 25,28±1,53 | >0,05 |
| Холестерин (ммоль/л) | 7,51±1,52 | 7,48±1,34 | 6,87±1,46 | 5,84±1,3 | >0,05 |
| ЛПНП (ммоль/л) | 3,87±1,15 | 4,1±0,78 | 4,62±1,13 | 3,1±1,15 | >0,05 |
| ИМ в анамнезе | 4 (24%) | 12 (31,6%) | 24 (31%) | 0 (0%) | PI,II,III>0,05 |
| АКШ в анамнезе | 0 (0%) | 1 (2,6%) | 3 (3,8%) | 0 (0%) | PI,II,III>0,05 |
| ОНМК в анамнезе | 4 (24%) | 8 (21%) | 14 (18%) | 0 (0%) | PI,II,III>0,05 |
| гипертоническая болезнь | 16 (89%) | 33 (87%) | 70 (90%) | 24 (69%) | >0,05 |
| СД II типа | 3 (16%) | 4 (10,5%) | 12 (15,4%) | 3 (8,3%) | >0,05 |
| Курение | 5 (27,8%) | 11 (29%) | 24 (31%) | 8(22%) | >0,05 |
В исследование не включались пациенты с признаками острых, инфекционных, аллергических и аутоиммунных заболеваний в течение менее 4 недель после наступления полной клинической и лабораторной ремиссии; с декомпенсированным сахарным диабетом (СД); с выраженной сердечной (фракция выброса левого желудочка <30%), почечной (содержание креатинина в крови >3 мг/дл) и печеночной недостаточностью; злокачественной гипертензией; лица моложе 20 лет, беременные, а также лица с обострением хронических заболеваний.
Общее клиническое обследование больных включало клиническую оценку состояния, общий и биохимический анализ крови (глюкоза натощак, креатинин, ЛДГ, АСТ, АЛТ, КФК, КФК МВ, мочевина) анализ крови на липиды (общий холестерин, ЛПВП, ЛПНП, триглицериды). Оценку состояния свертывающей системы крови проводили по показателям: протромбиновое время, активированное частичное тромбопластиновое время, уровень фибриногена. Всем больным проводилось ЭКГ в 12 отведениях, холтеровское мониторирование ЭКГ в течение 24 часов с двух канальной регистрацией ЭКГ, ЭХОКГ. Проба с физической нагрузкой (велоэргометрия) проводилась у больных стабильной стенокардией напряжения и в группе контроля.
Велоэргометрию проводили методом ступенчатой непрерывно возрастающей нагрузки, начиная со 150 кгм/мин. Через 3 минуты мощность нагрузки увеличивали на 150 кгм/мин до появления клинических или электрокардиографических признаков ишемии миокарда. До нагрузки, на третьей минуте каждой ступени пробы и в течение 10 минут отдыха, измеряли АД и регистрировали ЭКГ в 12 стандартных отведениях. Изменения ЭКГ во время пробы с физической нагрузкой считали ишемического характера при смещении сегмента ST горизонтального или косонисходящего типа более, чем на один мм на расстоянии 80 мсек от точки J.
Лабораторные определение РАРР-А и маркеров воспаления
Лабораторное определение изучаемых маркеров проводилось в течение первых суток после госпитализации.
Уровень РАРР-А определяли методом иммуноферментного анализа с использованием моно- и поликлональных антител РАРР-А (ИФА, «Diagnostics Systems Laboratories», США) с нижней границей концентрации 0,1 мМЕ/л чувствительности до 0,01 мМЕ/л.
Количественное определение интерлейкина-6 (ИЛ-6) проводили иммуноферментными методами с применением набора реагентов производства «Bender Мedsysems», Австрия.
Высокочувствительное определение С-реактивного белка (СРБ) осуществляли методом иммунотурбидиметрии с усилением латексом в микропланшетном формате (Orion Diagnostics, Финляндия и Aptec Diagnostics nv, Бельгия). Оптическую плотность измеряли при температуре 37°С с помощью фотометра для микропланшетов FL 600 «Bioteck», США. Для СРБ чувствительность метода составила 4,7 мг/л.
Оценка отдаленного прогноза
Оценка прогноза проведена у больных стабильной стенокардией напряжения на основании восьмилетнего наблюдения. Информацию о состоянии больных получали по телефону, больные приглашались на повторные консультации, анализировались записи в историях болезней, в случае развития нежелательных событий больные госпитализировались. Выживаемость без нежелательных событий оценивалась на основании выявления конечных точек: смерть от сердечно-сосудистых заболеваний, развитие инфаркта миокарда или острого нарушения мозгового кровообращения.
Статистическая обработка результатов исследования проводилась с использованием пакета прикладных программ для научно-технических расчетов PASW Statistics 17.0 (SPSS Inc.).
Статистические данные представлены как среднее значение ± стандартная ошибка среднего. Для оценки межгрупповых различий по уровням маркеров в крови использован непараметрический U-критерий Манна-Уитни. Оценка корреляционной связи количественных признаков произведена с использованием метода ранговой корреляции Спирмена. Анализ выживаемости без нежелательных сердечно-сосудистых событий выполнялся по методу регрессионного анализа Каплана-Мейера. Сравнение выживаемости без нежелательных сердечно-сосудистых событий проводилось с помощью логрангового критерия.
Результаты исследования
Изучение уровней маркеров воспаления и РАРР-А в крови при различных формах ИБС
Содержание СРБ находилось в интервале от 1,1 до 20 мг/л. У больных в исследуемых группах распределение уровней СРБ носило характер ненормального. У больных ССН медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 2, 1,5, и 3 мг/л. У больных НС медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 4,4; 2,7 и 8,4 мг/л. У больных ОИМ медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 7,6; 6,4 и 16,1 мг/л.
Р





мг/л
исунок 1.Уровень СРБ у больных ИБС и у лиц контрольной группы.













Уровни С-реактивного белка в крови у больных в контрольной группе и у больных стабильной стенокардией напряжения статистически достоверно не отличались (2,3±0,4 и 2,8±1,1 мг/л, соответственно, p>0,05). Уровни С-реактивного белка у больных стабильной стенокардией напряжения были статистически достоверно ниже, чем у больных нестабильной стенокардией и больных острым инфарктом миокарда (2.8±1.1, 7.6±2.6 и 15.1±6.5 мг/л, соответственно, p<0,05). При этом у больных острым инфарктом миокарда и нестабильной стенокардией уровни СРБ достоверно не отличались (15.1±8.5 и 7.6±2.6 мг/л, соответственно, p>0,05) (рис.1).
Содержание ИЛ-6 находилось в интервале от 2 до 70 пг/мл. У больных в исследуемых группах распределение уровней ИЛ-6 носило характер ненормального. У больных ССН медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 13, 6 и 34 пг/мл. У больных НС медиана, 25-й и 75-й перцентили распределения соответствовали значениям 15, 10 и 62 пг/мл. У больных ОИМ медиана, 25-й и 75-й перцентили распределения соответствовали значениям 18,8, 12 и 65 пг/мл.
Р
пг/мл





 исунок 2. Уровень ИЛ-6 у больных ИБС и у лиц контрольной группы
исунок 2. Уровень ИЛ-6 у больных ИБС и у лиц контрольной группы 










Уровни интерлейкина-6 в крови у лиц в контрольной группе и у больных стабильной стенокардией напряжения достоверно не отличались (11,5±1,9 и 12,8±4,6пг/мл, соответственно, p>0,05). Уровни ИЛ-6 у больных нестабильной стенокардией и острым инфарктом миокарда были достоверно выше, чем у больных стабильной стенокардией напряжения и в группе контроля (18.0±8.1, 21.1±6.1 и 12.8±4.6, 11.5±1.9 пг/мл соответственно, p<0,05). При этом у больных острым инфарктом миокарда и нестабильной стенокардией уровни ИЛ-6 достоверно не отличались (21.1±6.1 и 18.0±8.1 пг/мл, соответственно, p>0,05) (рис.2)
Уровни PAPP-A у исследуемых лиц распределились в интервале значений от 1 до 38 мМЕ/л. У больных в исследуемых группах распределение уровней РАРР-А носило характер ненормального. У больных ССН медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 4, 3 и 4,9 мМЕ/л. У больных НС медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 10, 6 и 18 мМЕ/л. У больных ОИМ медиана распределения, 25-й и 75-й перцентили распределения соответствовали значениям 16, 7 и 20,5 мМЕ/л.
Р

мМЕ/л



 исунок 3. Уровень РАРР-А у больных ИБС и лиц контрольной группы
исунок 3. Уровень РАРР-А у больных ИБС и лиц контрольной группы 




















Уровни РАРР-А в крови у больных в контрольной группе и у больных стабильной стенокардией напряжения достоверно не отличались (3.1±1.4 и 4.3±1.4мМЕ/л, соответственно, p>0,05).
Уровни PAPP-A в крови у больных стабильной стенокардией напряжения были достоверно ниже, чем у больных нестабильной стенокардией и острым инфарктом миокарда 4.3±1.4, 13.1±1.7 и 21.3±2.1мМЕ/л, соответственно (р<0,05). В то же время, у больных нестабильной стенокардией уровни PAPP-A были достоверно ниже, чем у больных острым инфарктом миокарда (13.1±1.7 и 21.3±2.1мМЕ/л, соответственно, р<0,05) (рис.3).
Таким образом, выявлен достоверно более высокий уровень РАРР-А, СРБ, ИЛ-6 при остром коронарном синдроме (НС, ОИМ), по сравнению с группой больных стабильной стенокардией напряжения и контрольной группой.
Была проанализирована корреляционная связь между уровнями СРБ, ИЛ-6 и РАРР-А. Установлено, что уровни PAPP-A у исследуемых лиц достоверно коррелировали (p<0,05) с уровнями C-реактивного белка (r=0,361, p=0.043,n=42) (рис. 4) и интерлейкина-6 (r=0,387; p=0,035, n=38) (рис.5).
Рисунок 4. Корреляционная связь между уровнями РАРР-А и СРБ.

r=0,361, p=0.043,n=42
Рисунок 5. Корреляционная связь между уровнями РАРР-А и ИЛ-6.

r=0,387; p=0,035, n=38
В результате анализа полученных данных не выявлено достоверной корреляционной связи уровней РАРР-А, ИЛ-6, СРБ с возрастом, полом, ИМТ, наличием артериальной гипертонии, сахарного диабета 2 типа.
Уровни РАРР-А в плазме крови достоверно слабо коррелируют с уровнями общего холестерина, ХсЛПНП, Хс ЛПВП и триглицеридов в крови больных ишемической болезнью сердца (r=0,348, p=0,047; r=0,375, p=0,039; r=0,382, p=0,042 и r=0,353, p=0,048, соответственно).
Корреляционная зависимость между уровнем РАРР-А в крови больных ИБС и факторами риска ИБС отражена в таблице 2.
Таблица 2. Корреляционная зависимость между уровнем РАРР-А в крови и полом, возрастом, ИМТ, содержанием липидов в крови, наличием ГБ, СД 2 типа.
-
Показатель
Коэффициент Спирмена (r)
Достоверность (р)
Пол
0,11
0,2
Возраст
-0,106
0,087
ИМТ
0,18
0,21
Общий холестерин
0,348
0,047
Хс ЛПНП
0,375
0,039
Хс ЛПВП
0,382
0,042
Триглицериды
0,353
0,048
ГБ
0,047
0,26
СД 2 типа
-0,011
0,19
Анализ связи маркеров воспаления и РАРР-А с восьмилетним прогнозом ИБС
После 8 лет наблюдения из 78 больных ССН у 15 человек (19,2%) больных наступила смерть от сердечно-сосудистого заболевания, у 5 человек (6,4%) развился ИМ, у 2 человек (2,6%) развилось острое нарушение мозгового кровообращения (ОНМК). С 3 больными ССН (3,8%) связь была утрачена. У 53 больных ССН (68%) течение заболевания протекало без осложнений. В группе контроля нежелательных событий в течение периода наблюдения не отмечалось. (рис.6)
Рисунок 6. Клинические исходы у больных ССН после 8 лет наблюдения
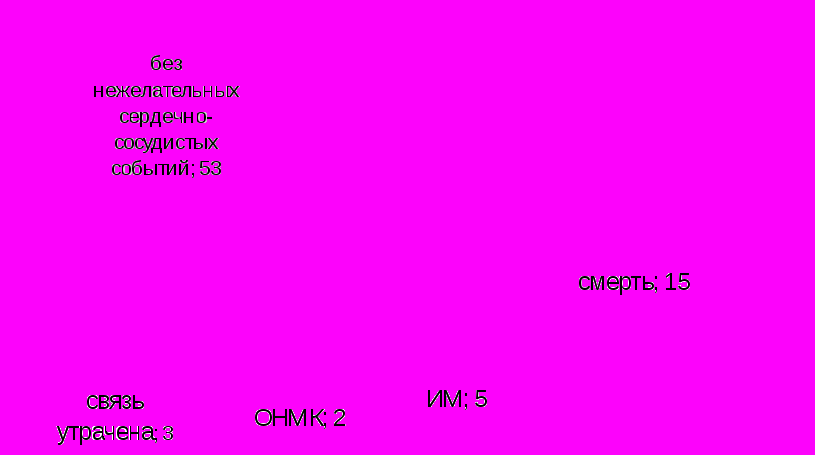
Анализ восьмилетнего прогноза выживаемости у больных ССН с высокими и низкими уровнями СРБ
Для изучения связи уровней СРБ в крови и отдаленного прогноза, больные ССН были разделены на четыре подгруппы в соответствии с квартилями распределения уровней СРБ. В состав подгруппы I вошли больные с уровнями СРБ в крови ниже 1,5 мг/л, в подгруппу II – больные с уровнями СРБ в крови от 1,5 до 1,99 мг/л, в подгруппу III – больные с уровнями СРБ в крови от 2 до 2,99 мг/л, в подгруппу IV – больные с уровнями СРБ в крови более 3 мг/л.
У больных из подгруппы I нежелательные события отмечались у 1 из 7 больных (14,5%), в подгруппе II – у 3 из 11 больных (27%), в подгруппе III – у 2 из 9 больных (22%), в подгруппе IV – у 14 из 38 больных (36,8%). В I, II, III и IV подгруппах средняя продолжительность периода до наступления нежелательных событий составила 6,2±0,76 лет; 5,94±0,55 лет; 5,78±0,63 лет и 4,9±0,6 лет, соответственно. У больных в IV подгруппе нежелательные события развивались достоверно раньше, чем у больных в I подгруппе.
Сравнение кривых выживаемости без нежелательных событий в исследуемых подгруппах показало, что прогноз выживаемости у больных в I (средняя выживаемость к концу периода наблюдения 86% (0,8646±0,063)), II (средняя выживаемость к концу периода наблюдения 80% (0,8071±0,022)), III подгруппах (средняя выживаемость к концу периода наблюдения 77% (0,7791±0,052)) был более благоприятным, чем у больных в IV подгруппе (средняя выживаемость к концу периода наблюдения 61,5% (0,6178±0,019). Выживаемость у больных в IV подгруппе была достоверно ниже, чем у больных в I подгруппе (р<0,05) и ниже, чем у больных во II и III подгруппах, однако разница не достигла статистической достоверности. Достоверной разницы в выживаемости у больных в I, II, III подгруппах не наблюдалось (р>0,05). (рис.7)
Рисунок 7. Восьмилетняя выживаемость у больных стабильной стенокардией напряжения по квартилям распределения уровня СРБ
Р>0,05
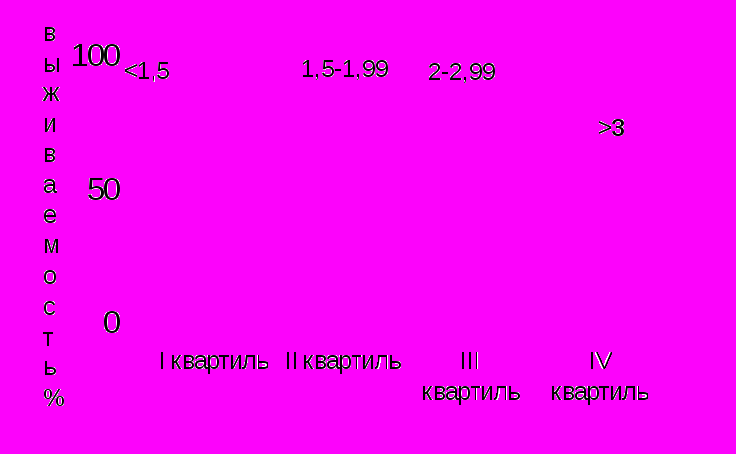


Р<0,05


Для оценки прогностического значения СРБ в качестве предиктора неблагоприятного прогноза стабильной стенокардии напряжения рассматривался уровень 3 мг/л, соответствующий нижней границе четвертого квартиля. Все больные стабильной стенокардией напряжения были разделены на две группы: с уровнями СРБ выше и ниже 3 мг/л.
При оценке восьмилетнего прогноза у больных ССН с уровнями СРБ<3 мг/л нежелательные события (инфаркт миокарда, летальный исход, ОНМК) развились у 6 из 27 больных (22,2%), у пациентов с уровнями СРБ>3 мг/л нежелательные события отмечались у 14 из 38 больных (36,8%). Средняя продолжительность периода до наступления нежелательных событий составила 6,1±0,36 и 4,9±0,6 лет соответственно (р < 0,05).
Средняя выживаемость без нежелательных сердечно-сосудистых событий к концу периода наблюдения у больных ССН с низким уровнем СРБ составила 83% (0,8382±0,081), у больных с высоким уровнем – 61,5% (0,6178±0,019).
Рисунок 8. Сравнение выживаемости без нежелательных событий у больных ССН с высоким и низким уровнями СРБ после 8 лет
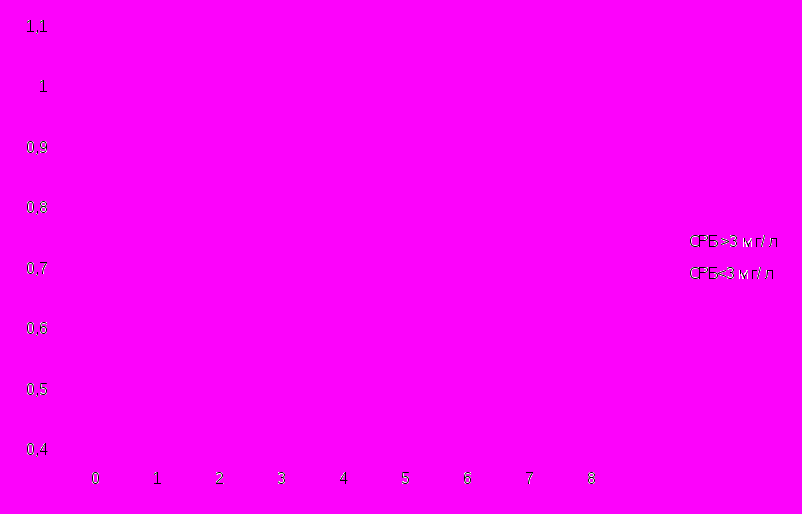
Р=0,049
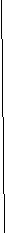
Р>0,05
Сравнение кривых выживаемости показало, что у больных с уровнем СРБ<3 мг/л восьмилетний прогноз, характеризующийся выживаемостью без нежелательных сердечно-сосудистых событий (нефатальный инфаркт миокарда, ОНМК и смерть), был достоверно более благоприятным, чем у больных с уровнем СРБ>3 мг/л (р = 0,049) (рис. 8)
Анализ восьмилетнего прогноза выживаемости у больных ССН с высокими и низкими уровнями ИЛ-6
Для изучения связи уровней ИЛ-6 в крови и отдаленного прогноза, больные ССН были разделены на четыре подгруппы в соответствии с квартилями распределения уровней ИЛ-6. В состав подгруппы I вошли больные с уровнями ИЛ-6 в крови ниже 6 пг/мл, в подгруппу II – больные с уровнями ИЛ-6 в крови от 6 до 12,99 пг/мл, в подгруппу III – больные с уровнями ИЛ-6 в крови от 13 до 33,99 пг/мл, в подгруппу IV – больные с уровнями ИЛ-6 в крови более 34 пг/мл.
Среди больных из подгруппы I нежелательные события отмечались у 1 из 7 больных (14,3%), в подгруппе II нежелательные события отмечались у 3 из 13 больных (23%), в подгруппе III нежелательные события отмечались у 3 из 9 больных (33,3%), в подгруппе IV нежелательные события отмечались у 6 из 22 больных (27%).
В I, II, III и IV подгруппах средняя продолжительность периода до наступления нежелательных событий достоверно не различалась и составила 5,3±0,62 лет; 4,9±0,15 лет и 4,72±0,73 лет; 4,86±0,32 лет, соответственно, р>0,05.
Сравнение кривых выживаемости без нежелательных событий в исследуемых подгруппах показало, что прогноз выживаемости у больных в I (средняя выживаемость к концу периода наблюдения 87% (0,8725±0,82)) и II (средняя выживаемость к концу периода наблюдения 78% (0,7871±0,35)) подгруппах был более благоприятным, чем у больных в III (средняя выживаемость к концу периода наблюдения 63% (0,6377±0,63)) подгруппе (р<0,05). Выживаемость у больных в III подгруппе была достоверно ниже, чем у больных в I подгруппе и ниже, чем у больных во II подгруппе, однако разница не достигла статистической достоверности. У больных в IV подгруппе (средняя выживаемость к концу периода наблюдения 73% (0,7327±0,92)) выживаемость достоверно не отличалась от III подгруппы, но была ниже, чем в I и II подгруппах, хотя разница не достигла уровня статистической достоверности. (р>0,05). (рис.9)
Рисунок 9. Восьмилетняя выживаемость у больных стабильной стенокардией напряжения по квартилям распределения уровня ИЛ-6
Р>0,05
Р <0,05
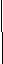





Для оценки прогностического значения ИЛ-6 в качестве предиктора неблагоприятного прогноза стабильной стенокардии напряжения рассматривался уровень 13 мг/л, соответствующий нижней границе третьего квартиля (медиана распределения). Все больные стабильной стенокардией напряжения были разделены на две группы: с уровнями ИЛ-6 выше и ниже 13 мг/л.
У больных ССН с уровнем ИЛ-6 >13пг/мл нежелательные события развились у 9 из 31 больных (29,1%), у пациентов с уровнями ИЛ-6 <13 пг/мл нежелательные события отмечались у 4 из 20 больных(20%). Средняя продолжительность периода до наступления нежелательных событий составила 4,8±0,7 и 5,1±0,16 лет, соответственно (р>0,05).
Средняя выживаемость без нежелательных сердечно-сосудистых событий к концу периода наблюдения у больных стабильной стенокардией напряжения с низким уровнем ИЛ-6 составила 79% (0,7969±0,077), в подгруппе больных с высоким уровнем ИЛ-6 – 70% (0,7035±0,052).
Сравнение кривых выживаемости логранговым методом не выявило достоверной разницы в выживаемости у больных с низким и высоким уровнями ИЛ-6 (р>0,05), что отражено на рисунке 10.
Рисунок 10. Выживаемость без нежелательных событий у больных ССН с высоким и низким уровнями ИЛ-6 в течение 8 лет

Р>0,05


Р>0,05
Анализ восьмилетнего прогноза выживаемости у больных стабильной стенокардией с высокими и низкими уровнями РАРР-А
Для изучения связи уровней PАРР-А в крови и отдаленного прогноза, больные ССН были разделены на 4 подгруппы в соответствии с квартилями распределения уровней РАРР-А. В состав Подгруппы I вошли больные с уровнями PАРР-А в крови ниже 3 мМЕ/л, в подгруппу II – больные с уровнями PАРР-А в крови от 3 до 3,99 мМЕ/л, в подгруппу III – больные с уровнями РАРР-А в крови от 4 до 4,89 мМЕ/л, в подгруппу IV – больные с уровнями РАРР-А в крови более 4,9 мМЕ/л.
Среди больных из подгруппы I нежелательные события отмечались у 2 из 11 больных (18,2%), в подгруппе II нежелательные события отмечались у 4 из 22 больных (18%), в подгруппе III нежелательные события отмечались у 7 из 26 больных (26,7%), в подгруппе IV нежелательные события отмечались у 9 из 19 больных (47,4%).
В I, II, III и IV подгруппах средняя продолжительность периода до наступления нежелательных событий составила 5,88±0,56 лет, 5,64±0,58 лет, 5,72±0,63 лет и 4,1±0,36 лет, соответственно. Средний период до наступления нежелательных событий в I, II и III подгруппах статистически не различались, но были достоверно выше, чем в IV подгруппе.
Сравнение кривых выживаемости без нежелательных событий в исследуемых подгруппах показало, что прогноз выживаемости у больных в I (средняя выживаемость к концу периода наблюдения 82% (0,8237±0,26)), II (средняя выживаемость к концу периода наблюдения 81% (0,8184±0,15)), III подгруппах (средняя выживаемость к концу периода наблюдения 73% (0,7377±0,19)) был достоверно более благоприятным, чем у больных в IV подгруппе (средняя выживаемость к концу периода наблюдения 51% (0,5181±0,51)) (р<0,05). Достоверной разницы в выживаемости у больных в I, II, III подгруппах не наблюдалось (р>0,05) (рис. 11).
Для оценки прогностического значения РАРР-А в качестве предиктора неблагоприятного прогноза стабильной стенокардии напряжения рассматривался уровень 4,9 мМЕ/л, соответствующий нижней границе четвертого квартиля. Все больные стабильной стенокардией напряжения были разделены на две группы: с уровнями РАРР-А выше и ниже 4,9 мМЕ/л.
Рисунок 11. Восьмилетняя выживаемость у больных стабильной стенокардией напряжения по квартилям распределения уровня РАРР-А
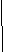


Р>0,05

Р<0,05


У больных ССН с уровнями РАРР-А<4,9 мМЕ/л нежелательные события развились у 13 из 59 больных (22%), у пациентов с уровнями РАРР-А>4,9 мМЕ/л нежелательные события отмечались у 9 из 19 больных(47,4%). Средняя продолжительность периода до наступления нежелательных событий составила 5,8±0,6 и 4,1±0,36 лет соответственно (р = 0,035).
Средняя выживаемость без нежелательных сердечно-сосудистых событий к концу периода наблюдения у больных ССН с низким уровнем РАРР-А составила 79% (0,7971±0,092), у больных с высоким уровнем РАРР-А – 51% (0,5181±0,051). Сравнение кривых выживаемости показало, что у больных с уровнем РАРР А<4,9 мМЕ/л восьмилетний прогноз выживаемости был достоверно более благоприятным, чем у больных с уровнем РАРР-А>4,9 мМЕ/л (р=0,018) (рис.12).
Рисунок 12. Сравнение выживаемости без нежелательных событий у больных ССН с высоким и низким уровнями РАРР-А в течение восьми лет
Р=0,018
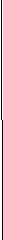

Р=0,038

Достоверно более низкая выживаемость (средняя выживаемость к концу периода наблюдения 72% (0,7251±0,035)) у больных с высоким уровнем РАРР-А, по сравнению с больными с низким уровнем РАРР-А (средняя выживаемость к концу периода наблюдения 96% (0,9673±0,046)), определялась уже после трех лет наблюдения (р=0,038). У больных с высоким уровнем СРБ и ИЛ-6, по сравнению с больными с низким уровнем СРБ и ИЛ-6, после трех лет наблюдения достоверной разницы в выживаемости не выявлено.
Таким образом, высокий уровень РАРР-А и СРБ являются достоверными предикторами неблагоприятного прогноза ИБС с развитием инфаркта миокарда, смерти от сердечно-сосудистого заболевания, острого нарушения мозгового кровообращения, однако для РАРР-А, по сравнению с СРБ, характерна более высокая достоверность, которая определялась уже после трех лет наблюдения. Высокий уровень ИЛ-6 не ассоциирован с неблагоприятным прогнозом ИБС. Таким образом, в результате исследования выявлена более высокая прогностическая значимость РАРР-А перед другими маркерами воспаления.
Выводы
1. У больных острым коронарным синдромом (нестабильной стенокардией и острым инфарктом миокарда) уровни С-реактивного белка, интерлейкина 6, ассоциированного с беременностью протеина плазмы А достоверно выше, чем у больных стабильной стенокардией напряжения, что свидетельствует об участии воспаления в развитии острых процессов при ишемической болезни сердца, в основе которых лежит повреждение атеросклеротической бляшки. У больных стабильной стенокардией напряжения уровни исследуемых маркеров не отличаются от уровня этих маркеров у группы контроля.
2. Содержание РАРР-А, СРБ, ИЛ-6 в крови больных ишемической болезнью сердца не зависит от пола, возраста, индекса массы тела, наличия артериальной гипертонии и сахарного диабета 2 типа.
3. Уровни РАРР-А в плазме крови достоверно коррелируют с концентрацией в плазме крови СРБ и ИЛ-6 и коррелируют с уровнями общего холестерина, ХсЛПНП, Хс ЛПВП и триглицеридов в крови больных ишемической болезнью сердца.
4. Высокие концентрации РАРР-А в крови больных ишемической болезнью сердца связаны с неблагоприятным прогнозом. Уровень РАРР-А выше 4,9 мМЕ/л сопровождается достоверно более частым развитием инфаркта миокарда, острого нарушения мозгового кровообращения, смертью от сердечно-сосудистых заболеваний при наблюдении за больными ишемической болезнью сердца в течение 8 лет.
5. Увеличение уровней в плазме крови выше для РАРР-А 4,9 мМЕ/Л, для СРБ 3 мг/л, для ИЛ-6 13 пг/мл является важным фактором увеличения риска неблагоприятного прогноза.
6. Повышенный уровень РАРР-А и СРБ является неблагоприятным прогностическим фактором у больных ишемической болезнью сердца. Повышение уровня ИЛ-6 не является достоверным предиктором неблагоприятного прогноза ишемической болезни сердца.
7. Повышение уровня РАРР-А у больных ишемической болезнью сердца имеет более высокую прогностическую ценность, по сравнению с повышением уровней СРБ и ИЛ 6.
Практические рекомендации
1. Определение концентрации РАРР-А в крови может являться важным лабораторным маркером в клинической практике, свидетельствующим об активности воспаления в крови у больных ишемической болезнью сердца.
2. Выявление высокого уровня РАРР-А в плазме крови дает возможность выделять группы больных ишемической болезнью сердца с высоким риском развития острого инфаркта миокарда, острого нарушения мозгового кровообращения, сердечно-сосудистой смерти в отдаленном периоде.
3. Наличие статистически достоверной прямой корреляции уровней РАРР-А с концентрациями СРБ и ИЛ-6 в плазме крови свидетельствует о связи воспаления и деструкции в атеросклеротическом процессе, его прогрессировании и развитии осложнений.
4. Определение повышенных уровней РАРР А, СРБ в плазме крови у больных ИБС на амбулаторном этапе может сопровождаться активной профилактической работой, направленной на предупреждение развития осложнений ишемической болезни сердца. Оценка динамики уровней РАРР-А и СРБ на фоне проводимой терапии может служить критерием её эффективности.
Работы, опубликованные по теме диссертации
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. Сравнительный анализ уровня протеина и плазмы и других маркеров воспаления в крови у больных с острым коронарным синдромом. // Российский кардиологический журнал. – 2008. – №6. – С. 14-19.
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. Определение уровня PAPPA в крови при диагностике острого коронарного синдрома. // Сборник материалов клинической больницы УДПРФ. – 2008. – с. .
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. Значение уровня РАРР-А и других маркеров воспаления для диагностики, оценки и прогноза у больных разными формами ИБС. // Материалы XI Всероссийского научно-образовательного форума и специальной выставки «Кардиология-2009». – . – С. 322.
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. РАРР-А и другие маркеры воспаления в диагностике ОКС. // Материалы Всероссийской научно-практической конференции «Перспективы кардиологии в России», – 2009. – с. .
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. Перспективы определения ассоциированного с беременностью протеина плазмы А (РАРР А) в диагностике и оценке прогноза нестабильной стенокардии. // Материалы Всероссийской конференции «Неотложная кардиология – 2009» Роль неотложной кардиологической помощи в снижении сердечно-сосудистой смертности, – 2009. - С.138.
- Шевченко О.П., Шевченко А.О., Слесарева Ю.С., Кунцевич Н.В., Гинзбург Л.М. Актуальность лабораторного определения протеина плазмы PAPP-A, ассоциированного с беременностью, у больных с ишемической болезнью сердца. // IV Национальный конгресс терапевтов. Сборник материалов. – 2009. – С. .
- Шевченко О.П., Шин Е.В., Шевченко А.О., Гинзбург Л.М., Слесарева Ю.С. Уровни адипонектина в крови и атеросклероз сонных артерий у больных ишемической болезнью сердца. // IV Национальный конгресс терапевтов. Сборник материалов. – 2009. – С. .
- Шевченко А.О., Слесарева Ю.С., Эль-Бустани С., Бугров А.В., Шевченко О.П. Диагностическое и прогностическое значение РАРР-А и маркеров воспаления при различных формах ишемической болезни сердца. // Кардиоваскулярная терапия и профилактика. – 2010. – №3. – С. 23-28.
- Шевченко О.П., Шевченко А.О., Кунцевич Н.В., Гинзбург Л.М., Слесарева Ю.С., Орлова О.В. Ассоциированный с беременностью протеин плазмы А РАРР-А и уровни маркеров воспаления у больных ишемической болезнью сердца. // Вестник РГМУ, – №1, – 2010. – с. 34-40.
- Шевченко А.О., Эль Бустани С., Гинзбург Л.М., Слесарева Ю.С., Шин Е.В., Природова О.Ф., Шевченко О.П.. Плацентарный фактор роста PLGF у больных ишемической болезнью сердца. // Вестник РГМУ, – №1, – 2010. – С. 41-47.
- Шевченко О.П., Слесарева Ю.С., Шевченко А.О. Ассоциированный с беременностью протеин плазмы А как перспективный критерий диагностики и оценки прогноза у больных с различными формами ИБС. // Сборник материалов XVII Российского национального конгресса «Человек и лекарство». – 2010. - С. 302.
- Шевченко А.О., Слесарева Ю.С., Шевченко О.П. Актуальные вопросы лабораторной диагностики и оценки прогноза ишемической болезни сердца. // // Материалы Всероссийского научно-образовательного форума «Профилактическая кардиология - 2010». – 2010. – С.123-124.
- Шевченко А.О., Слесарева Ю.С., Шевченко О.П. Роль РАРР-А в развитии повреждения атеросклеротической бляшки у больных ишемической болезнью сердца.//Российский кардиологический журнал, №2,2011, С. 65-71
- Шевченко А.О., Слесарева Ю.С., Шевченко О.П. Лабораторная диагностика повреждения атеросклеротической бляшки у больных ишемической болезнью сердца: РАРР-А. // Клиническая и лабораторная диагностика. – №5, – 2011,- С.3-10.
- Шевченко А.О., Слесарева Ю.С., Шин Е.В., Шевченко О.П. Прогностическое значение РАРР-А при различных формах ишемической болезни сердца. // Российский кардиологический журнал. – №3, – 2011.-С.16-22
