Российская академия наук
| Вид материала | Тезисы |
- Основание Петербургской академии наук, 49.85kb.
- Спонсоры конференции: Фармацевтическая фирма «Санофи-Авентис», 74.5kb.
- Ш. Н. Хазиев (Институт государства и права ран) Российская академия наук и судебная, 297.05kb.
- Научный журнал «Вопросы филологии» Оргкомитет: Сопредседатели, 53.54kb.
- Научный журнал "Вопросы филологии" Оргкомитет: Сопредседатели, 47.73kb.
- Котов Сергей Викторович доктор медицинских наук, профессор Савин Алексей Алексеевич, 547.92kb.
- Н. д кондратьева Международный фонд Н. д кондратьева и Российская академия естественных, 13.13kb.
- Российская академия наук отделение общественных наук ран, 74.85kb.
- Высочество Князь Монако Альберт II и другие. Сдоклад, 38.69kb.
- Ипээ ран www sevin ru, 22.27kb.
СВОБОДНОРАДИКАЛЬНЫЕ ПРОЦЕССЫ В ФОРМИРОВАНИИ БОЛЕЗНЕУСТОЙЧИВОСТИ ЯЧМЕНЯ, ИНДУЦИРУЕМОЙ ФИТОВИТАЛОМ
Полякова Н.В., Шуканов В.П., Недведь Е.Л., Манжелесова Н.Е.,
Корытько Л.А., Полянская С.Н.
ГНУ «Институт экспериментальной ботаники им. В.Ф. Купревича» НАН Беларуси, Минск, e-mail: patphysio@mail.ru
В основе жизнедеятельности инфицированного растения лежат свободнорадикальные процессы. Восстановление нарушений в фитопатосистеме обеспечивается предотвращением свободнорадикальной патологии антиоксидантными ферментами и предотвращением удаления из тканей функциональных соединений. В этом и заключается принцип защитного действия фитовиталов, используемых нами для повышения устойчивости ячменя к грибным патогенам. Первичные изменения, индуцируемые возбудителями листовых пятнистостей, развиваются на уровне плазматических мембран. Судя по полученным результатам, растительные мембраны выполняют ведущую роль в восприятии сигналов, поступающих от патогенов. Под их влиянием нарушается состояние липидного матрикса мембран, обусловленное изменением степени ненасыщенности жирных кислот, уровнем их перекисного окисления, который возрастает в ходе патогенеза. При этом более высокая степень образования продуктов, реагирующих с ТБК, характерна для тканей устойчивого сорта ячменя, тогда как для растений восприимчивого сорта свойственно в большинстве случаев ингибирование интенсивности синтеза ТБК-продуктов. Наиболее активен в своем действии на перекисное окисление липидов чистый фитовитал, который стимулирует данный процесс на всех стадиях онтогенеза ячменя. Под влиянием фитовитала с янтарной кислотой, незначительное активирование степени перекисного окисления липидов сменяется снижением ее до контрольного уровня, тогда как при воздействии фитовитала с салициловой кислотой неменяющийся уровень пораженности растений в начале онтогенеза завершается резким увеличением его на последних этапах развития ячменя. Вероятно, салициловая кислота не столько определяет формирование системно приобретенной устойчивости, сколько участвует в реализации сигнальной трансдукции резистентности и даже может обусловливать восприимчивость. Фитовиталы усиливают защитные реакции ячменя. Реакции, начинающиеся с контакта индуктора с поверхностью мембран растительных клеток, служат условием для последующих этапов. Даже небольшие по величине изменения ПОЛ мембран клеток под влиянием фитовиталов способно быть «запускателем» последующих функциональных изменений в растениях ячменя, подвергшихся инфекции. К ним относятся модификации в выделении водорастворимых веществ из растительных клеток. Этот процесс наиболее резко выражен в тканях восприимчивого сорта по сравнению с устойчивым после обработки генотипов фитовиталами. Наиболее активны в этом отношении чистый фитовитал и фитовитал с янтарной кислотой. Однако фитовитал с салициловой кислотой не столько влияет на активность, сколько ингибирует ее на стадии колошения. Следствием «текучести» мембран в результате нарушения их липидного статуса является изменение состава и свойств липидов, окружающих белки. Активность пероксидазы возрастает при инфицировании обоих генотипов ячменя; она еще более усиливается при обработке фитовиталом, особенно во время симптомообразования. Более высокая активность пероксидазы отмечалась у устойчивого сорта. Как компонент антиоксидантной системы пероксидаза участвует в восстановлении и поддержании стационарного состояния инфицированной клетки. Кроме того, функции пероксидазы, позволяют ей ассоциироваться с хлорофиллом и каротиноидами, обеспечивая контроль генерирования свободных радикалов кислорода и эффективность продукционного процесса.
АЛГОРИТМЫ ПОТЕНЦИОМЕТРИЧЕСКОГО МЕТОДА
ИЗМЕРЕНИЯ ОБЩЕЙ АНТИОКСИДАНТНОЙ АКТИВНОСТИ БИОЛОГИЧЕСКИХ ТКАНЕЙ И КЛЕТОК, ПРИ ВОЗДЕЙСТВИИ НАНОЧАСТИЦ МАГНЕТИТА И БЛАГОРОДНЫХ МЕТАЛЛОВ
Поморцева Е.Л.1, Козицина А.Н.2, Брайнина Х. З.1
1Уральский государственный экономический университет,
620144, г. Екатеринбург 8 марта, 62, (343)251-96-69, ekaterina.pomortseva@yandex.ru
2Уральский государственный технический университет УГТУ-УПИ, 620002, г. Екатеринбург, Мира, 19, kozitsina@mail.ustu.ru
Наночастицы способны вызывать в организме окислительный стресс. Известный потенциометрический метод определения антиоксидантной активности биологических образцов адаптирован для анализа ткани и клеточного материала (гомогенат легкого крысы; линия эмбриональных человеческих клеток легких (WI-38)). Оптимальные соотношение концентраций компонентов медиаторной системы равны K4[Fe(CN)6]:K3[Fe(CN)6]=10-4:10-2 и K4[Fe(CN)6]:K3[Fe(CN)6]=10-6:4·10-4 для тканей и клеточной линии, соответственно. Изучено влияние наночастиц серебра Ag, золота Au (10 и 25 мкг/мл) и оксида железа Fe3O4 (1000 и 5000 мкг/мл) на антиоксидантную активность клеток. Время инкубации – 24 часа и 120 часов. В процессе взаимодействия наночастиц благородных металлов с клетками наблюдали значительное уменьшение антиоксидантной активности. Наночастицы Fe3O4 инициировали незначительный оксидантный стресс (рис. 1).
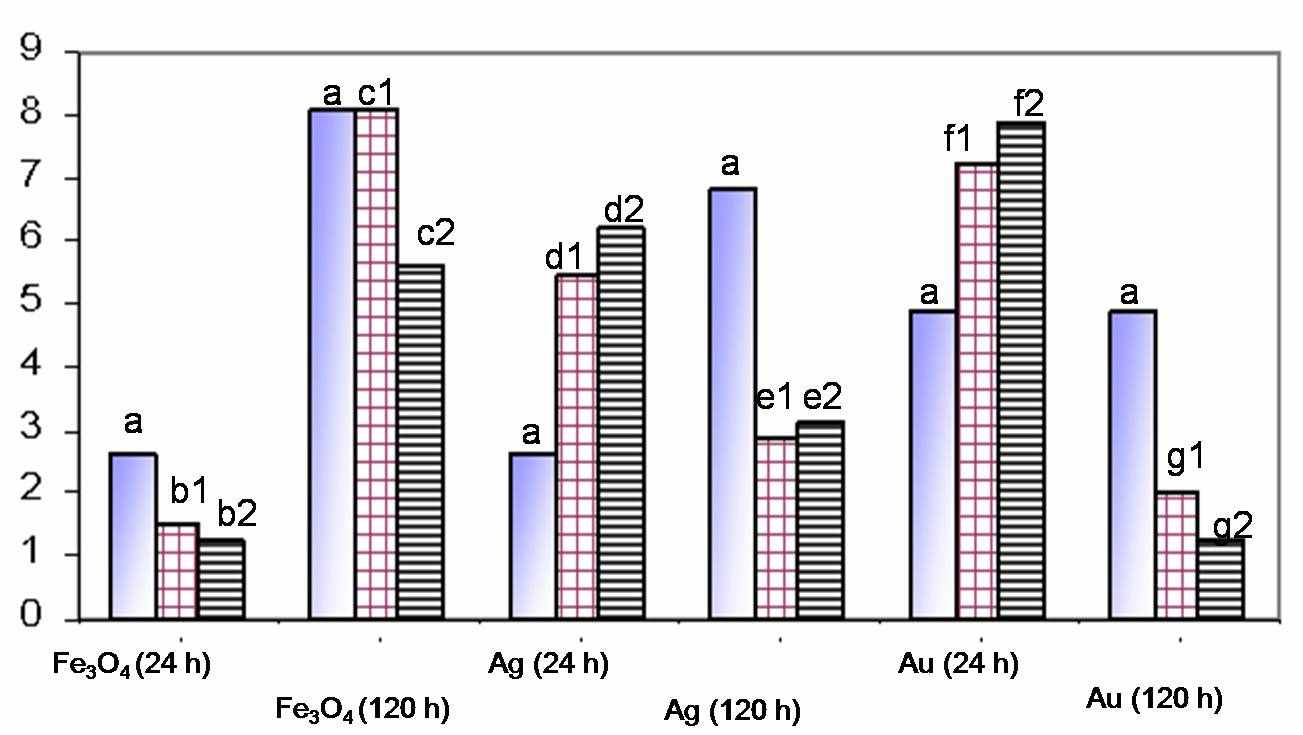
Рисунок 1. Влияние наночастиц Fe3O4, Ag, Au на антиоксидантную активность клеток.
Вероятно, воздействие на клетки металлических наночастиц приводит к окислительному стрессу, развитие которого после суток инкубации нивелируется активным генерированием антиоксидантов компенсаторными системами клеток.
Наночастицы Fe3O4 (10 нм, 50 нм), спустя 24 часа после интратрахеального введения, вызывают окислительный стресс, что характеризуется снижением АОА образцов относительно контрольного (рис. 2). Наночастицы магнетита размером 1 мкм инициируют незначительный оксидантный стресс.
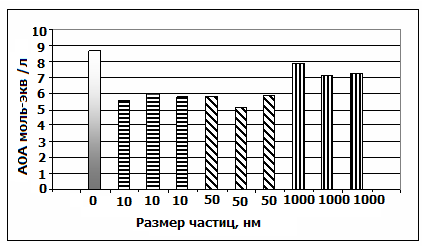
Рисунок 2. Зависимость изменения АОА гомогената крыс от размера наночастиц магнетита
Автор выражает глубокую признательность д.б.н., проф. Б.А. Кацнельсону, д.б.н., проф. Я.Б. Бейкину, д.х.н., проф. Х. З. Брайниной за внимание и обсуждение результатов.
Влияние химической гетерогенности на
антиоксидантные свойства травяных лигнинов
Пономаренко Е. А., Дижбите Т. Н., Лаубертс М. A., Быкова Т.О.,
Телышева Г. М.
Латвийский государственный институт химии древисины, г. Рига, Латвия (ул. Дзербенес 27, LV-1006, тел. +371 67555916, ligno@edi.lv)
В связи с возрастающими требованиями к антиоксидантам, направленными на повышение их эффективности, снижение токсичности и исключение экологических рисков, последние годы ведутся интенсивные исследования в области растительных полифенолов – широко распространённых природных антиоксидантов. Одним из основных компонентов ткани наземных растений является высокомолекулярный полифенол лигнин. В процессах химической переработки фитомассы (производство целлюлозы, биоэтанола) ежегодно образуется около 50-100 млн. тонн технических лигнинов в качестве побочных продуктов. Благодаря пространственно затруднённым фенольным гидроксильным группам в структуре лигнина он имеет большой потенциал в качестве антиоксиданта. Одним из факторов, существенно ограничивающих использование технических лигнинов, является их гетерогенность.
Целью данной работы была оценка влияния гетерогенности лигнинов на их антиоксидантные свойства и возможности получения из технических лигнинов фракций с более высоким антиоксидантным эффектом, чем у исходных лигнинов. В качестве объектов исследования были выбраны 7 щелочных лигнинов производимых в промышленном масштабе из травяных растений (лён, абака, джут, пшеничная солома, сахарный тростник, конопля, сизаль), отличающихся повышенной гетерогенностью. Особенностью таких лигнинов является то, что они, в отличие от лигнинов, полученных из древесины традиционными методами сульфатной и сульфитной варки, не содержат серу.
При помощи метода гель хроматографии были определены молекулярно-массовое распределение (ММР) и полидисперсность образцов. Используя многоволновое UV/VIS-детектирование при ЭЖХ анализе было показано, что коньюгированные фенольные и другие структуры, влияющие на антиоксидантные свойства лигнинов, распределены вдоль кривых их ММР неоднородно и эти показатели существенно варьируются для различных травяных лигнинов.
Используя экстракцию органическими растворителями с возрастающей полярностью из каждого исследуемого лигнина были получены четыре фракции (CH2Cl2, C3H7OH, CH3OH, нерастворимая фракции), проведён функциональный (-OCH3, OHfen, -COOH) и структурный (аналитический пиролиз, ИК-Фурье, ЭПР) анализы, а также оценены антиоксидантные свойства исходных лигнинов и их фракций. Для оценки антиоксидантных свойств были использованы методы дезактивации стабильных катион-радикалов 2,2’-азино-бис(3-этилбензотиазолин)-6-сульфоновой кислоты (ABTS●+) и 2,2-дифенил-1-пикрилгидразил радикалов (DPPH●), а также метод ингибирования генерации анион-радикалов кислорода (O2●-).
Результаты проведённых исследований показали, что травяные лигнины, особенно лигнин абаки, имеют высокий потенциал как антиоксиданты. Большое влияние на антиоксидантную активность лигнинов имеет не только содержание активных структурных единиц, но и их локализация вдоль кривых ММР. Установлено, что фракционирование лигнинов может быть использовано как приём для получения лигнопродуктов с более высокой антиоксидантной эффективностью, чем у исходных лигнинов.
СИНТЕЗ ПОТЕНЦИАЛЬНЫХ АНТИОКСИДАНТОВ РЯДА
ЦИКЛОГЕКСЕН(ДИЕН)ДИКАРБОКСИЛАТОВ С АЗОЛЬНЫМИ ФРАГМЕНТАМИ
Поплевина Н.В., Сорокин В.В., Кривенько А.П., * Плотников О.П.
Институт химии Саратовского государственного университета им. Н.Г.Чернышевского, sorokinvv@info.sgu.ru
*Российский научно-исследовательский противочумный
институт «Микроб»
Ранее нами были синтезированы и запатентованы среды консервирования и хранения коллекционных штаммов микроорганизмов, содержащие соединения ряда циклогексенил(диенил)ариламинов [1,2]. Защитные свойства указанных соединений обусловлены их высокой антиокислительной активностью за счёт сочетания входящих в их структуру арильных, енаминных и сложноэфирных фрагментов.

R = Me, OEt; R' = Ar, Bn, C6H11
Для расширения круга новых антиоксидантов, установления закономерностей структура-свойство, нами были синтезированы новые представители (ди)енаминов, содержащие при атоме азота гетарильные фрагменты - триазольный и тетразольный. Из различных вариантов синтеза наиболее успешным оказалось сплавление реагирующих веществ - гидроксиоксоциклогександикарбоксилатов 1 с C- и N-аминоазолами – 4-амино-1,2,4-триазолом, 5- аминотетразолом. Реакция протекала по наиболее активной карбонильной группе алицикла и, в зависимости от времени, как аминирование с образованием тетразолиламиноциклогексендикарбоксилатов 2, либо как аминирование-дегидратация с образованием триазолиламиноциклогексадиендикарбоксилатов 3 с выходами, пригодными для препаративного получения потенциальных консервантов.

Состав и строение енаминных форм (альтернативных иминным) полученных новых соединений установлены данными элементного анализа, ИК, ЯМР 1H-спектроскопии. В дальнейшем предполагается изучение антиоксидантных совйств синтезированных веществ.
Литература
1. Кривенько А.П., Сорокин В.В., Плотников О.П. // Пат. 2291193 С2. (РФ). - № 2005128208/15. Заявлено 09.09.05; Опубл. 10.01.07.
2. Кривенько А.П., Сорокин В.В., Плотников О.П. // Пат. 2299904 С1. (РФ). - № 2005128211/13. Заявлено 09.09.05; Опубл. 27.05.07.
ГЕМОРЕОЛОГИЧЕСКАЯ АКТИВНОСТЬ НАНОРАЗМЕРНЫХ ГИБРИДНЫХ МАКРОМОЛЕКУЛЯРНЫХ АНТИОКСИДАНТОВ
Попова Е.В., Алиев О.И., Васильев А.С.,
*Домнина Н.С., *Сергеева О.Ю., Плотников М.Б.
НИИ фармакологии СО РАМН, Томск, 634028, пр. Ленина 3, 8(3822)41-42-35, mbp2001@ mail.ru
* Санкт-петербургский государственный университет
Целью работы – оценка гемореологической активности наноразмерных гибридных макромолекулярных антиоксидантов (ГМАО) в условиях гипервязкости крови ex vivo.
Объектами исследования явились водорастворимые наноразмерные ГМАО: Д-КФ – декстран, содержащий химически присоединенную по цепи 3-(3,5-ди-трет-бутил-4-гидроксифенил)пропионовую кислоту (2,6 и 10,8 масс.%) и Д-АзФ – декстран, содержащий химически присоединенную по цепи 4-(4-гидрокси-3,5-ди-трет-бутилбензилиден)-2-фенил-4,5-дигидрооксазол-5-он (3,8 и 12,9 масс.%). Эксперименты проведены на крысах-самцах Вистар. Изучаемые соединения вводили внутривенно однократно в дозе 10 мг/кг. Контрольные животные получали эквиобъемное количество декстрана. Кровь для исследования забирали из общей сонной артерии под эфирным наркозом через 15 мин после введения исследуемых веществ. В качестве стабилизатора использовали 3,8% раствор цитрата натрия в соотношении с кровью 1:9. Вязкость крови регистрировали на ротационном вискозиметре АКР-2 в диапазоне скоростей сдвига от 3 с-1 до 300 с-1 до инкубации и через 60 мин после инкубации проб крови при температуре 20,0±0,4 оС (модель гипервязкости крови).
Инкубирование проб крови контрольной группы животных в течение 60 мин приводило к достоверному повышению вязкости крови при скоростях сдвига от 3 с-1 до 300 с-1 на 7–15% относительно исходных значений. При введении Д-КФ (10,8 масс.%) и Д-АзФ (12,9 масс.%) наблюдалось снижение вязкости крови при скоростях сдвига от 3 с-1 до 100 с-1 на 6–21% по сравнению с контролем, при этом, показатели вязкости крови после инкубации не отличались от исходных значений. Вязкость крови у животных, получавших Д-КФ (2,6 масс.%), была ниже, чем в группе контроля при скоростях сдвига 3 с-1, 5 с-1, 7 с-1, 50 с-1 на 10%, 14%, 9% и 5% соответственно; Д-АзФ (3,8 масс.%) при скоростях сдвига 10 с-1, 50 с-1 на 6% и 9% соответственно. Однако, применение Д-КФ и Д-АзФ с низким содержанием в молекуле антиоксидантов (2,6 и 3,8 масс.% соответственно) не тормозило возрастание вязкости крови при инкубации.
Таким образом, исследуемые наноразмерные ГМАО ограничивают повышение вязкости крови на модели гипервязкости крови ex vivo.
ДИНАМИКА МАЛОНОВОГО ДИАЛЬДЕГИДА ПЛОДОВ ПЕРЦА СЛАДКОГО ПРИ ХРАНЕНИИ С ИСПОЛЬЗОВАНИЕМ ЭКЗОГЕННЫХ АНТИОКСИДАНТОВ
Присс О.П.
Таврический государственный агротехнологический университет пр. Б. Хмельницкого, 18 г. Мелитополь, Украина, 72312; Тел: (+380619) 448103; Email: olesyapriss@mail.ru
Избыток продуктов ПОЛ приводит к изменениям структурных, физико-химических и функциональных свойств мембран, в результате чего, ускоряются этапы старения и порчи продукции и значительно сокращается срок ее хранения.
Оценить интенсивность свободнорадикального окисления в плодах можно путем определения концентрации малонового диальдегида (МДА) в мембранах клеток. МДА - являет собой конечный продукт ПОЛ и может служить критерием физиологичного состояния плодов во время хранения, объективно и точно характеризовать их потенциал и способность адаптироваться к стрессовым условиям.
Одним из механизмов регуляции ПОЛ является достаточное содержание биоантиоксидантов в клетках плода. Согласно современным научным разработкам, использование антиоксидантных препаратов при хранении плодоовощной продукции позволяет стабилизировать систему эндогенных антиоксидантов плодов и овощей.
Исследования проводили в течение 2007-2009 годов на базе кафедры технологии переработки и хранения продукции сельского хозяйства Таврического государственного агротехнологического университета, г., Мелитополь. Исследовали плоды перца сладкого гибридов Геркулес F1, Фламинго F1, Никита F1, обработанные комплексными антиоксидантными препаратами. В состав препаратов входили ионол, лецитин, водный экстракт корня хрена. За контроль принимали необработанные плоды. Плоды закладывали на хранение в технической степени зрелости. Температура хранения 4 оС.
Содержание МДА определяли тиобарбитуровым методом.
Фоновый уровень МДА в начале хранения составляет в плодах перца гибрида Геркулес F1 – 21,883 нмоль/г, гибрида Фламинго F1 – 27,252 нмоль/г, гибрида Никита F1– 18,781 нмоль/г.
Независимо от ботанических особенностей в обработанных антиоксидантами плодах перца в первые 10 суток хранения наблюдается лишь незначительное повышение уровня МДА, в противоположность этому, в контроле его концентрация резко возрастает, что объясняется доминированием процессов перезревания. Кроме того, дефицит эндогенных биоантиоксидантов в плодах технической степени зрелости снижает их адаптивные возможности к низкотемпературному стрессу. На 30 сутки хранения концентрация МДА в контрольных вариантах почти в 2 раза больше по сравнению с обработанными плодами. К концу хранения (50 сутки) в плодах, обработанных антиоксидантными препаратами уровень МДА на 25…40% ниже, чем контроле. Следовательно, применение обработки антиоксидантными композициями способствует адекватному функционированию эндогенной антиоксидантной системы в условиях действия на плод сниженных температур.
Экспериментальные данные позволяют сделать вывод о целесообразности обработки плодов перца комплексными антиоксидантными препаратами с целью дополнения антирадикальной цепи системы антиокислительной защиты плода для профилактики и коррекции нарушений обмена веществ при хранении.
Молекулярные механизмы антиоксидантного действия синтетического дипептида γ-D-Glu-L-Trp
Прокопенко Н.В., Герасимович Н.В.
УО «Международный государственный экологический университет имени А.Д. Сахарова», г. Минск, 220070, ул. Долгобродская, 23,
тел.:+375-017-299-56-36, E-mail: natavprokopenko@mail.ru
Активные формы кислорода (АФК) занимают особое место среди разнообразных регуляторов жизнедеятельности. Показано, что АФК, в частности Н2О2, могут вызвать как регуляторный ответ, так и приводить к окислительному повреждению клеток. При этом отмечают повреждение белковой и липидной компоненты мембран клеток, и, как следствие, нарушение транспорта ионов кальция. Однако, несмотря на многочисленные исследования, проводимые в области свободно-радикальной биологии, четкого представления о данных процессах и их количественных характеристик до сих пор нет.
В настоящее время актуальным является поиск и изучение молекулярных механизмов действия веществ обладающих антиокислительными свойствами. Имеются отдельные сведения, что такими свойствами обладают синтетические дипептиды.
В связи с этим в работе в экспериментах in vitro с помощью флуоресцентных зондов Fura2/AM и пирена было изучено действие синтетического дипептида γ-D-Glu-L-Trp (10-12- 10-3 моль/л) на содержание [Ca2+]i и структурное состояние мембран тимоцитов в условиях «окислительного стресса». Для этого тимоциты инкубировали в течение 30 минут с дипептидом в вышеуказанных концентрациях. «Окислительный стресс» моделировали путем добавления к среде инкубации экзогенной Н2О2 в концентрации 10-6 моль/л. Спектры флуоресценции регистрировали на спектрофлуориметре. SFL-1211 ("Solar", Беларусь).
Было установлено, что инкубация тимоцитов с Н2О2 (10-6 моль/л) приводит почти к трехкратному увеличению содержания [Ca2+]i. При этом было отмечено и увеличение (приблизительно на 55%) показателей микровязкости в области аннулярных липидов и липидного бислоя. Значения показателей полярности аннулярных липидов и липидного бислоя возросли на 27% и 21%, соответственно. Степень тушения белковой флуоресценции почти в 2 раза превышала контрольное значение.
Анализ данных, полученных в случае предварительного инкубирования тимоцитов с γ-D-Glu-L-Trp и с последующим добавлением Н2О2 показал, что происходит приблизительно двукратное уменьшение содержания [Ca2+]i в цитоплазме. Отмечено было снижение (приблизительно на 30%) показателей, характеризующих микровязкость липидной и белковой компоненты мембран тимоцитов, по сравнению с тимоцитами, обработанными Н2О2. Наблюдалось уменьшение (в 1,5 раза) степени тушения триптофановой флуоресценции. Достоверных изменений показателей полярности липидного бислоя и аннулярного липида по сравнению с контролем отмечено не было.
Установленное уменьшение анализируемых показателей под влиянием дипептида γ-D-Glu-L-Trp в условиях «окислительного стресса» дает основание предполагать, что механизмы его действия реализуется путем взаимодействия с липидной фазой плазматической мембраны. Адсорбция молекулы дипептида на поверхности мембран тимоцитов, по-видимому, препятствует доступу молекулы Н2О2 к мембранным компонентам тимоцитов. Кроме того, попав в цитоплазму путем эндоцитоза, γ-D-Glu-L-Trp, возможно, активирует систему антиоксидантной защиты клетки.
