К середине 80-х годов XX века усилиями многочисленных исследователей в биологии сложилась достаточно стройная картина системы регуляции клеточного и тканевого метаболизма
| Вид материала | Документы |
СодержаниеОбразование NO в организме. |
- Складывание сословно-представительной монархии в России, 248.13kb.
- М. А. Мунтян политические системы, 277.48kb.
- Тема паренхиматозные и стромально-сосудистые дистрофии, 2916.41kb.
- Лекция Ethernet, 707.34kb.
- Историко-экономическая наука является междисциплинарной, она сложилась на стыке двух, 482.22kb.
- Валерий Федорович Вахрушев, 242.69kb.
- Воспитания лицеистов, 51.51kb.
- Биологическая химия введение, 90.83kb.
- Ртой медико-социальной проблемы заболеваний сердечно-сосудистой системы является высокая, 159.2kb.
- Программа марксистских курсов, 57.7kb.
К середине 80-х годов XX века усилиями многочисленных исследователей в биологии сложилась достаточно стройная картина системы регуляции клеточного и тканевого метаболизма. Она включает в себя :
1.Клеточные рецепторы, расположенные на внешней стороне клеточной мембраны, реагирующие на гормоны, цитокины и другие биологически активные агенты.
2.С помощью специального внутримембранного белка, выполняющего сигнальные функции (белки этого типа относятся к классу так называемых G-белков), сигнал от рецепторов передается на другой белок.
3. Этот белок, расположенный на внутренней стороне клеточной мембраны, в свою очередь, обеспечивает синтез так называемых вторичных мессенджеров.
4. Последние и осуществляют регуляцию клеточного метаболизма Среди вторичных мессенджеров особое внимание исследователей привлекал циклический аденозинмонофосфат (цАМФ), образующийся из главной энергетической "валюты" биосистем — аденозинтрифосфорной кислоты (АТФ) при участии мембраносвязанного белка — аденилатциклазы. Оказалось, что аналог цАМФ — циклический гуанозинмонофосфат (цГМФ), возникающий из другого нуклеотида — гуанозинтрифосфорной кислоты (ГТФ), также способен влиять на внутриклеточные процессы. Особый интерес вызывало его сосудорасширяющее действие, обусловленное высвобождением из гладкой мускулатуры сосудов внутриклеточного кальция. Попытки выделить фермент, способный осуществлять превращение ГТФ в цГМФ — гуанилатциклазу, привели к неожиданному результату.
Оказалось, что наряду с мембраносвязанной формой этого фермента существует и его водорастворимая форма, достаточно активно продуцирующая цГМФ из ГТФ. Обнаружение этой формы не соответствовало сложившимся к тому времени представлениям о механизме синтеза вторичных мессенджеров, предполагавшего мембраносвязаиную природу ферментов, ответственных за образование цГМФ. Предполагалось, что только в этом случае возможна передача регулирующего сигнала на эти ферменты от находящегося в мембране G-белка, который активируется соответствующим рецептором. Однако было установлено, что растворимая гуанилилциклаза активируется под влиянием различных водорастворимых соединений без участия соединений, вызывающих активацию клеточных рецепторов. Среди них оказались и лекарственные соединения типа органических нитратов и нитропруссида натрия, известные своим сосудорасширяющим (вазодилатируюшим) действием.
Дальнейшие исследования механизмов активации растворимой гуанилатциклазы позволил группе американских исследователей во главе с Феридом Мьюрэдом в конце 70-х годов предположить, что высокая активность нитро- и нитрозосодержащих сердечно-сосудистых лекарств обусловлена их способностью продуцировать оксид азота (N0), который и является активатором гуанилилциклазы. Было предположено, что связывание N0 с тиоловыми группами фермента приводит к конформационным изменениям гуанилилциклазы, что и вызывает ее активацию. Эксперименты по обработке гуанилилциклазы газообразным оксидом азота полностью подтвердили высказанное предположение. Таким образом, впервые было продемонстрировано положительное биологическое действие N0, который раньше рассматривался только как вредный промышленный отход или опасный инициатор синтеза канцерогенных нитрозоаминов в организме животных и человека.
Результаты группы Мьюрэда позволили понять механизм сердечно-сосудистого действия органических нитратов, и среди них наиболее известного — нитроглицерина, использовавшегося в медицине уже более сотни лет. Стало ясно, что способность нитроглицерина купировать сосудистые спазмы обусловлена продуцированием из него оксида азота. Активация им гаунилатциклазы обеспечивает накопление цГМФ, запускающего цепь биохимических процессов, приводящих к выбросу кальция из гладкомышечных клеток сосудов и тем самым к их расслаблению (вазодилатации).
НОБЕЛЕВСКАЯ премия по физиологии и медицине за 1998 г. присуждена трем американским исследователям: Фериду Мьюрэду (Техасский университет в Хьюстоне), Роберту Фёрчготту (Университет штата Нью-Йорк) и Луису Игнарро (Калифорнийский университет в Лос-Анджелесе) за установление функциональной роли оксида азота в работе сердечно-сосудистой системы. Тем самым подведена первая черта под лавинообразным потоком публикаций, посвященных изучению функциональных свойств этого простейшего химического соединения
В настоящее время в этой области работают сотни исследователей. Число публикаций достигает нескольких тысяч в год.
Образование NO в организме.
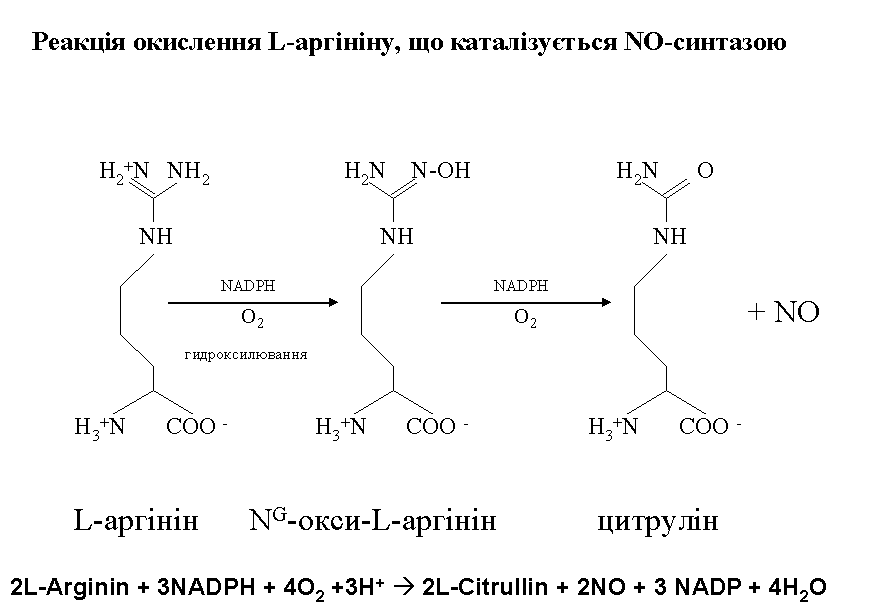
В организме человека и животных радикал NO образуется из аминокислоты аргинина в результате реакции, которая катализируется ферментом, получившим название NO- синтазы (NOS), а не синтетазы (как иногда неверно называют его в некоторых публикациях), так как для его работы не требуется энергия АТФ.
В 90-е годы ХХ века биохимикам удалось выделить в чистом виде три изоформы фермента. Две изоформы, которые постоянно присутствуют в клетках (конститутивные), были получены из эндотеоиальных клеток сосудов (ендотелиальная NOS) и нервной ткани (нейронадбная NOS). Третья изоформа, выделенная из активированных макрофагов, синтезируется под действием цитокинов и других биологически активных веществ, появляющихся в организме при патологиях. Эта изоформа обозначается как индуцибельная NOS. Нерональная и индуцибельная формы фермента находятся в клетках преимущественно в растворимом состоянии – в цитозоле, а эндотелиальная NOS обычно связана с клеточными мембранами.
СЛАЙД
Субъединицы всех изоформ состоят из двух доменов: редуктазного (со стороны С-конца) и оксигеназного (со стороны N-конца).
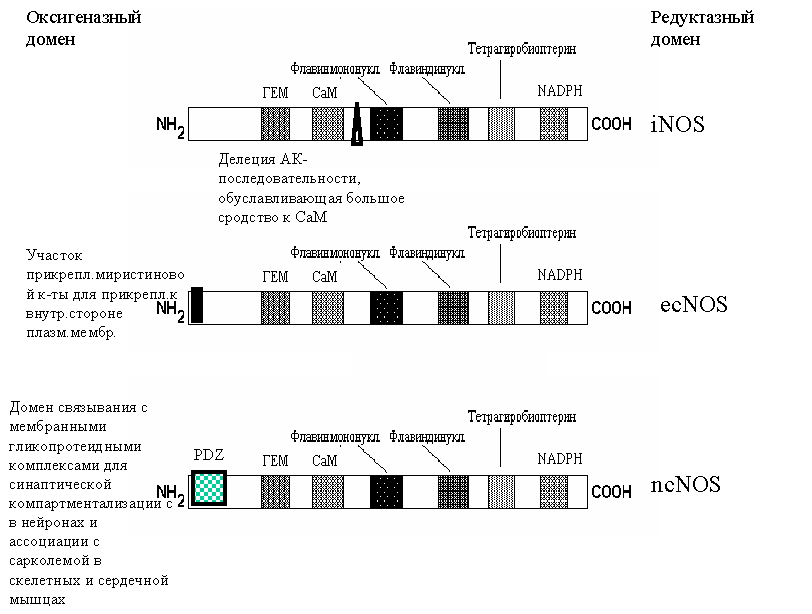
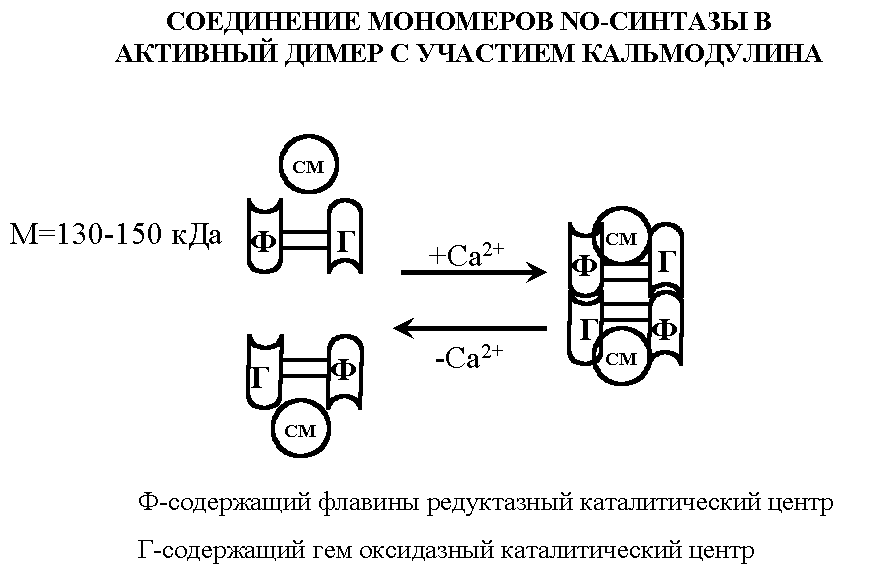
В активном состоянии субъединицы NOS объединяются в димеры
СЛАЙД
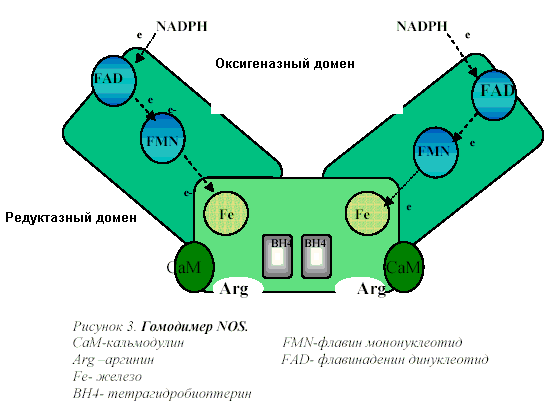
Редуктазный жомен осуществляет перенос электрона от восстановительного субстрата — никотинамиддинуклеотидфосфата (NADPH) по цепи переноса электронов, включающей флавинадениндинуклеотид (FAD) и флавинаденинмононуклеотид (FMN) на оксигеназный домен.
Оксигеназный домен содержит гемовую группу, вблизи которой связываются молекулы аргинина и кислорода. На этом участке фермента происходит оксиление аргинина с выделением из него молекулы NO.
В оксигеназном домене существенную роль играет связывание с ним молекулы тетрагидробиоптерина. Без него продукция NO полностью прекращается и все изоинзимы NOS начинают генерировать только супероксидные радикалы О2*.
Таким образом NO-синтазы уникальны по сложности организации, включают рекордное число разнообразных кофакторов: FMN, FAD, гем и кальций-кальмодулин и по крайней мере 3 субстрата — аргинин, кислород и NADPH.
Одним из важных кофакторов является внутриклеточный кальцийсвязывающий белок кальмодулин. При повышении содержания ионов кальция в клетке он присоединяется к молекуле NOS, что и приводит к активации фермента и синтезу NO.
Активность индуцибельной NOS не зависит от уровня кальция/кальмодулина, поскольку, как полагают, кальмодулин постоянно и прочно связан с ферментом.
Реакция образования NO из аргинина показана на СЛАЙДЕ
Каковы же клеточные мишени NO?
1) железосодержащие ферменты и белки, такие как гуанилатциклаза (Гц), собственно сама NOS
2) Hb
3) митохондриальные ферменты
4) ферменты цикла Кребса
5) ферменты синтеза белка и ДНК.
Связывание NO с железосодержащим
участком ферментов приводит к их изменению активности.
Взаимодействие NO с этими мишенями имеет важное значение в
цитотоксическом действии макрофагов, в расслаблении мышц
сосудов и желудочно-кишечного тракта, в переносе кислорода, образовании АТФ и
формировании долговременной памяти.
Вторая важная молекулярная мишень для оксида азота - это белки,
содержащие сульфгидрильные SH-группы. NO служит эффективным катализатором
образования дисульфидных мостиков. Благодаря взаимодействию
с SH-группами NO может регулировать такой важный для клетки
процесс, как биосинтез белка.
Наконец, третья важная молекулярная мишень - активные формы
кислорода. NO связывается с кислородом с образованием
чрезвычайно токсичных соединений – пероксинитритов.
Последние по токсичности во много раз превосходят сам NO.
Образование пероксинитритов выступает существенным
элементом во многих патофизиологических процессах, включая
септический шок, а также ишемические и язвенные повреждения
органов.
В настоящее время накоплен большой материал о механизме
регуляции активности iNOS в макрофагах (Mаеда Х.,1998;
Corraliza I.M.,et al.,1994) и гладкомышечных клетках (Dudec
R.R.,et al.,1993), об участии вторичных мессенджеров,
протеинкиназ и цитокинов в регуляции синтеза NOS.
Так в работе D.Kunz и соавт. было показано, что в культуре
мезангиальных клеток интерлейкин-1β и вeщества, повышающие
концентрацию цГМФ индуцируют экспрессию гена iNOS. Это
приводит к повышению активности фермента и образованию NO.
К настоящему времени установлено, что кроме интерлейкина-1β
синтез iNOS индуцируется интерфероном-γ, фактором некроза
опухолей (TNFα), липополисахаридами грамотрицательных
бактерий (McCall TB, et al.,1992). Пик продукции этой формы
NOS достигается по одним источникам через 6 часов, по другим -
через 12 часов после начала действия индуктора. К этому времени
независимая от кальция продукция NO достигает уровня, при
котором начинает сказываться влияние NO не только на
гуанилатциклазу, но и на железосодержащие компоненты
дыхательной цепи митохондрий, на аконитазу,
рибонуклеотидредуктазу. В результате этого в клетках,
подвергнутых действию таких количеств NO, нарушается
энергетический обмен и синтез ДНК. В организме эта
способность оксида азота используется для уничтожения
опухолевых клеток макрофагами, которые не только сами
производят NO, но и секретируют фактор некроза опухолей,
который вызывает индукцию NOS в опухолевых и других клетках.
Активация iNOS имеет место при болезнях иммунной системы,
сердечно-сосудистых заболеваниях, злокачественных
заболеваниях, остром и хроническом воспалении (Wizemann T. M.,
et al.,1994). При эндотоксическом шоке активация iNOS и
избыточная продукция NO чревата
немедленными тяжелыми последствиями. Дело в том, что
липополисахариды грамотрицательных бактерий вызывают столь
значительное образование NO в гладких мышцах сосудов, что это
приводит к падению системного кровяного давления и развитию
характерных для шока нарушений кровообращения (Cremers B., et
al.,1997).
Д.Фултоном (2001) предлагается следующая модель посттрансляционной активации еNOS.
СЛАЙД
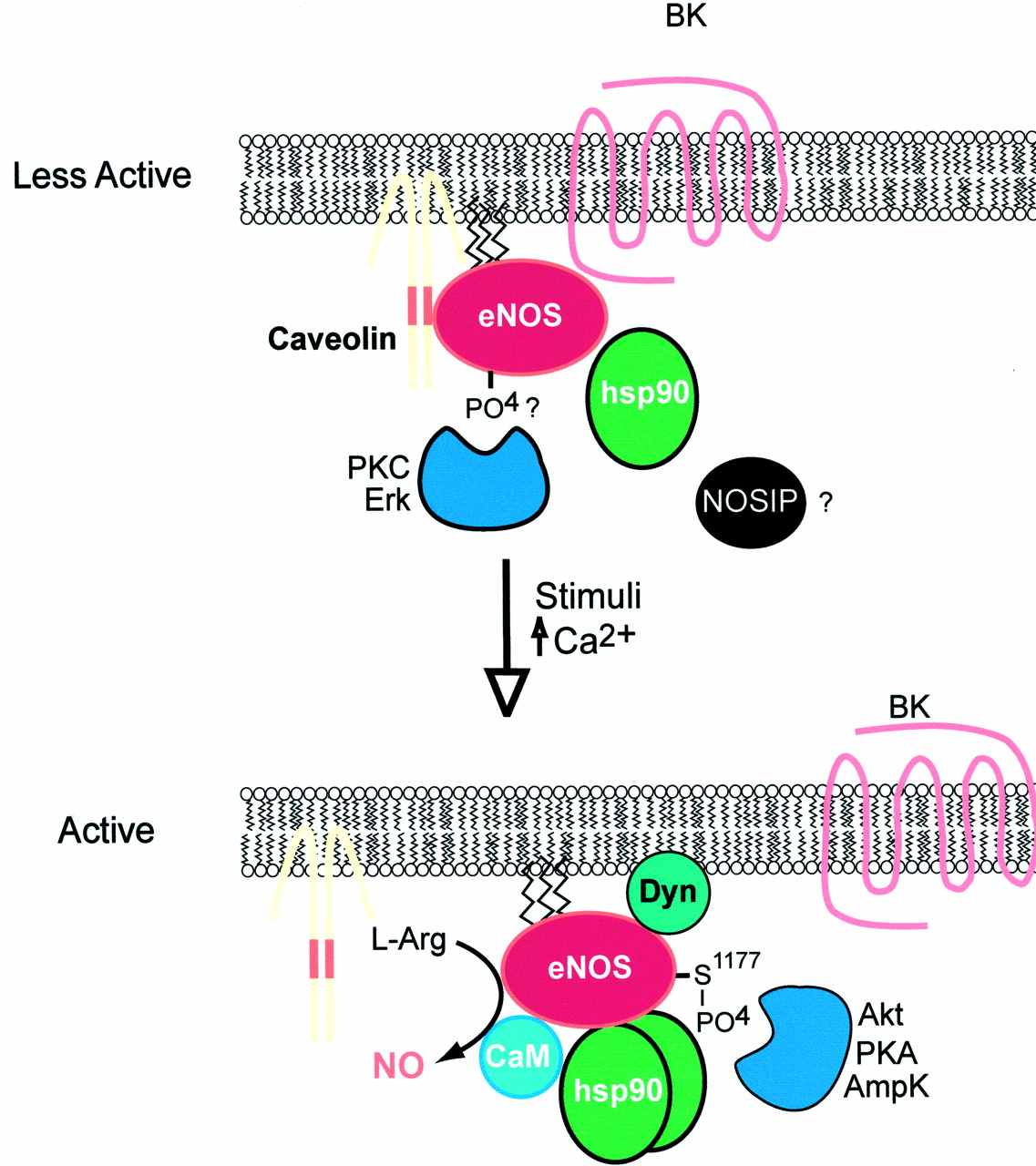
еNOS внутри клетки связана с мембраной остатком меристиновой кислоты. С ней ассоциирован белок кальвеолин и четвертый внутриклеточный домен брадикининового рецептора, который проявляет ингибирующее действие. При действии на клетку разнообразных стимулов происходит активация еNOS через ее ассоциацию с кальмодулином при входе ионов кальция в клетку. Также происходит диссоциация от молекулы еNOS кальвеолина и брадикининового рецептора и ассоциация с ней белка теплового шока 90. Кальций-независимые стимулы стимулируют индукцию фосфорилирования сериновых остатков на молекуле еNOS протеинкиназами В (АКТ) и А или АМР-зависимой киназой (AmpK), что приводит к усилению активности еNOS. В активации еNOS принимают участие также другие белки, такие как динамин и так называемый протеин NOSIP (интерэктинг протеин), роль которого предположительно состоит в инактивации еNOS.
Таким образом, NOS с энзимологической точки зрения обладает
рядом уникальных свойств: NOS - самый регулируемый в
биологии фермент. Это единственный из известных ферментов,
который имеет 5 кофакторов. В результате система генерации
оксида азота представляет собой наиболее чувствительную
систему, реагирующую на многие изменения, происходящие в
организме.
Действие, оказываемое NO на клетки, во многом зависит от его концентрации.
В небольших количествах, обычно продуцируемых конститутивными NO-синтазами, эффект NO обычно связан с его воздействием на гемовую группу растворимой гуанилатциклазы. При этом происходит ее активация и синтез циклического ГМФ. цГМФ в свою очередь регулирует работу мембранных ионых каналов, процессы фосфорилирования белков (через протеинкиназы), активность фосфодиэстеразы а также другие реакции.
Например, рассмотрим механизм вазодилятаторного действия NO.
Эндотелий постоянно продуцирует небольшие количества NO, и при различных воздействиях — механических (например, при усилении тока или пульсации крови), химических, бактериальных или вирусных (это бактериальные липополисахариды, цитокины) — синтез NO в эндотелиальных клетках значительно повышается.
Расширение сосудов связано с диффузией NO из эндотелия к соседним гладкомышечным клеткам.
СЛАЙД
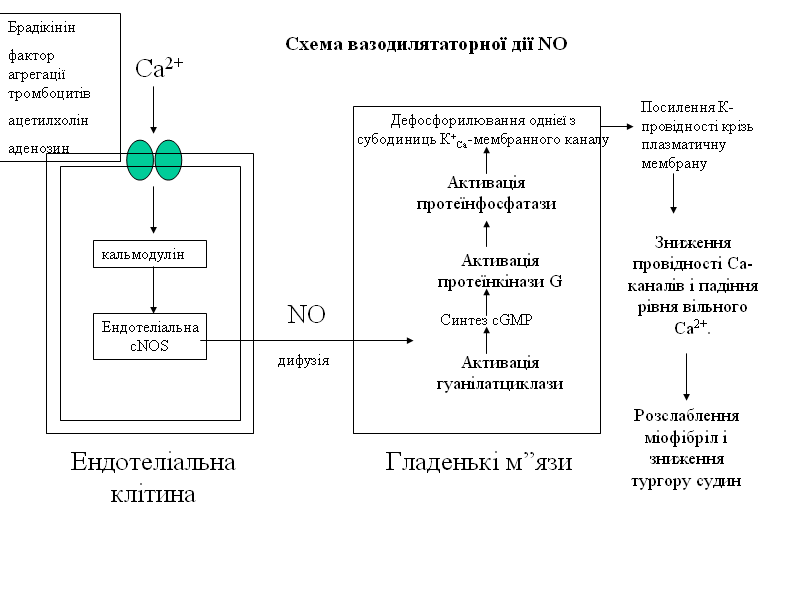
Действует NO очень быстро — образование цГМФ происходит через 5с, а начало расслабления гладких мышц — черз 10с после добавления NO в культуру изолированных кровеносных сосудов.
СЛАЙД
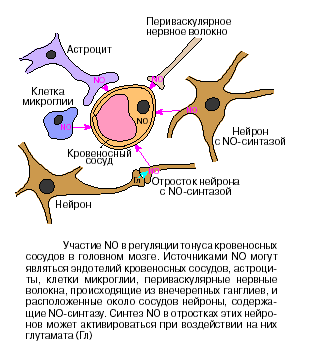
Большое значение NO имеет и в регуляции мозгового кровообращения. Более 100 лет известны данные о том, что в активно работающих участках мозга происходит усиление кровообращения. Имеется несколько источников NO для регуляции просветов мозговых сосудов. Это эндотелий сосудов, нейроны, содержащие NO-синтазу и оплетающие своими отростками стенки кровеносных сосудов и астроциты, образующие периваскулярные оболочки. Активация нейронов какой-либо части мозга приводит к возбуждению нейронов, содержащих NO-синтазу, и/или астроцитов, в которых также может инуцироваться синтез NO, который и приводит к локальному расширению сосудов в области возбуждения.
NO, образующийся в эндотелии, оказывает влияние на взаимодействие клеток крови с эндотелием. NO препятствует прилипанию лейкоцитов и эритроцитов к эндотелию, а также снижает агрегацию эритроцитов. Такое действие NO может иметь большое значение на ранних стадиях развития тромбом и атеросклеротического повреждения сосудов. Также NO может выступать в качестве антиростового фактора, препятствующего пролиферации гладкомышечных клеток сосудов, важного звена в патогенезе атеросклероза.
Нервы, содержащие NO-синтазу, показаны практически во всех внутренних органах, преимущественно в стенках кровеносных сосудов, где они наряду с эндотелием могут оказывать сосудорасширяющий эффект.
Значение NO в ЦНС в нормальных условиях связывают с тремя процессами:
- участие в межнейронной связи в качестве своеобразного нейромедиатора
- регуляции церебрального кровотока
- установление межнейронных синаптических взаимосвязей во время развития нервной системы.
NO может выступать и в качестве нейромедиатора.
Нейромедиаторное действие NO заключается в том, что он синтезируется при возбуждении нейрона в ответ на поступление ионов Са и, диффундируя в сосдение клетки, активизирует в них образование цГМФ, способного влиять на проводимость ионных каналов и, таким образом, изменять электрогенез нейронов.
Действие NO не ограничивается только областью синаптического контакта. Он может влиять на ионные каналы на значтельной площади плазматической мебраны нейрона.
Уастие NO в синаптической пластичности наиболее ярко проявляется в таких процессах, как длительная синаптическая потенциация (повышение эффективности проведения возбуждения через синапс). В этом случае возбуждение постсинаптического окончания приводит к повышению внутриклеточного уровня ионов Са и кальмодулина, активирующих NO-синтазу и образование NO. NO, диффундируя в пресинаптическое окончание, вызывает образование цГМФ, что приводит к усилению и увеличению выделения из пресинапса нейромедиатора, который, в свою очередь, оказывает возбуждающее действие на постсинаптический нейрон и таким образом возникает обратная положительная связь с постоянным усилением.
Такой механизм характерен для синапсов с наиболее сильным и возбуждающим нейромедиатором глутаматом и с особым глутаматным рецептором — NMDA-рецептором, который является трансмембранным каналом для ионов кальция.
СЛАЙД
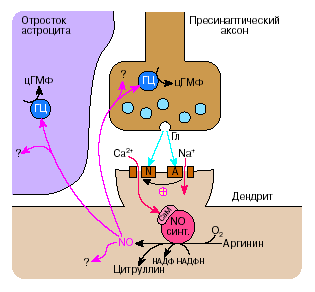
Схема возбуждающего глутаматного синапса ЦНС и возможное участие NO в его деятельности.
Выделяющийся из синаптических пузырьков глутамат влияет на АМРА-рецепторы (А), что приводит к деполяризации плазматической мембраны и открытию NMDA-каналов.
Через NMDA-каналы в клетку поступает большое количество ионов Са, которые активируют конститутивную NO-синтазу. Образующийся при этом NO диффундирует в пресинаптический аксон, активирует в нем растворимую ГЦ и синтез цГМФ. цГМФ способствует усилению выделения нейромедиатора глутамата, что повышает эффективность синаптической передачи.
Весь процесс — от выделения глутамата до начала синтеза оксида азота протекает очень быстро – в течение нескольких миллисекунд.
С такой длительной синаптической потенциацией, прежде всего в гиппокампе, связывают пластичность межнейронных связей, лежащих в основе памяти.
NO принимает также участие в ЗАЩИТНЫХ ИММУНОЛОГИЧЕСКИХ РЕКЦИЯХ
Эта функция оксида азота связана прежде всего со способностью макрофагов в ответ на действие например, липополисахаридов микробного происхождения или цитокинов, экспрессировать индуцибельную NO-синтазу.
СЛАЙД
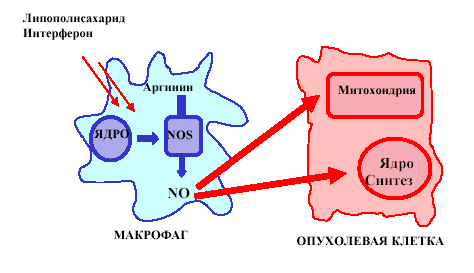
Это приводит к выделению ими огромного количества оксида азота, который, также реагируя со свободными радикалами кислорода и образуя токсический пероксинитрит, оказывает цитостатическое и цитолитическое действие на бактериальные и чужеродные, в том числе и раковые клетки. NO/пероксинитрит проникает в эти клетки и ингибирует там ферменты дыхательной цепи цикла Кребса и синтеза ДНК. При этом энергопродукция и деление клеток становится невозможным и они погибают.
Нейтрофилы также способны продуцировать NO, однако о цитостатическом действии этих клеток, связанном с NO не известно и значение такой способности нейтрофилов остается невыясненным.
Известно, что нейтрофилы и макрофаги способны активно образовывать свободные радикалы кислорода, которые, реагируя с оксидом азота, образуют пероксинитриты, что приводит к усилению антимикробного действия этих клеток.
С таким действием оксида на клетки тесно связана проблема апоптоза.
Вызванный NO апоптоз впервые был продемонстрирован в 1998 году на перитонеальных макрофагах. Затем исследование NO-зависимых механизмов апоптоза проводились на клетках инсулиномы (опухоль из островковых клеток поджелудочной железы), тимоцитах, хондроцитах (основная клетка хрящеой ткани), мезангиальных клетках (пенистые клетки в клубочках, участвуют в процессах фагоцитоза).
Эти исследования выявили следующие признаки воздействия NO.
Индукция индуцибельной NO-синтазы в макрофагах вызывает типичные морфологические и биохимические признаки апоптоза, развитие которых можно было блокировать ингибитором NO-синтазы. С применением спонтанно разрушающихся доноров NO было показано, что степень повреждения пропорциональна концентрации NO. В клетках инсулиномы было обнаружено накопление белка р53 при гибели клеток, вызванной NO. Ингибитор NO-синтазы NMMA подавляет накопление р53, обусловленное действием цитокинов или полисахаридов, что указывает на активную роль NO. И, наконец, было доказано стимулирующее действие NO на активацию каспаз (цистеиновые протеазы, представленные целым рядом белков, которые образуют протеолитический каскад, взаимно активируя друг друга, что приводит к деградации клетки).
Таким образом активация сигнальных путей апоптоза оксидом азота делает его способным убивать клетки. Однако не все клетки после активации NO-синтазы встают на путь апопотоза. Гибель клетки предотвращается суперэкспрессией антиапоптотического белка bcl-2, индукцией гемоксигеназы, супероксидного радикала и белков теплового шока.
Понимание взаимодействия этих сигнальных механизмов поможет выяснить, как NO влияет на жизнь и смерть клеточных систем.
Анафилаксия и оксид азота
Анафилаксия, вызванная IgE-опосредованными механизмами, относится к аллергическим реакциям немедленного типа и характеризуется высвобождением из дегранулированных базофилов и тучных клеток различных медиаторов воспаления (гистамин, цистеиновые лейкотриены, фактор активации тромбоцитов, протеазы, цитокины, простагландин D2, метаболиты арахидоновой к-ты и т. д.). Высвобождаемый из тучных клеток гистамин активирует H1- и H2-рецепторы. Активация гистаминовых рецепторов 1-го типа вызывает зуд кожи, тахикардию, бронхоспазм и ринорею, а H1- и H2-рецепторов — головную боль, гипотензию, гиперемию, гастроинтестинальные симптомы. Со степенью тяжести анафилаксии связывают также уровень высвобождаемой из гранул тучных клеток триптазы.
Повышение уровня оксида азота (NO) способствует появлению бронхоспазма и вазодилатации.
Лейкотриены и хемотаксические факторы, включающиеся в процесс на следующем этапе, могут способствовать поддержанию поздней фазы аллергической реакции. В анафилаксии участвуют также калликреиновая система (ряд ферментов – калликреинов - продуцирует мощный вазодилятатор брадикинин), система комплемента и т. д. [1–3].
Цитокины в свою очередь могут активировать экспрессию индуцибельной NOS, что приводит к избыточной продукции NO, вследствие чего может развиться шок и другие воспалительные реакции, такие как септический шок, что позволило предположить, что индуцибельная NOS является медиатором анафилактического шока.
Однако в августе этого года журнале The Journal of Clinical Investigation были опубликованы результаты исследований ряда авторов (Каувелл и др), доказывающие, что именно эндотелиальная NOS, а не индуцибельная NOS, является критическим медиатором анафилаксии у мышей.
Анафилактический шок вызывали инъекцией мышам фактора активации тромбоцитов – фосфолипидного мессенжера, высвобождаемого антиген-стимулированными тучными клетками и который способствует повышению проницаемости сосудов, гипотензии и смерти вследствие септического и анафилактического шока.
Неселективный ингибитор NOS (н-нитро-метиловый эфир л-аргинина) LNAME препятствовал развитию гипотензии и других симптомов у мышей при этой модели анафилактического шока. То есть в этом случае критическим фактором в развитии анафилаксии было именно активация к-либо типа NOS с высвобождением большого количества NO.
В это же время применение ингибитора растворимой гуанилатциклазы метиленового синего не препятствовало развитию гипотензии и анафилактического шока. Таким образом, действие, оказываемые NO при анафилаксии не зависели от активации им растворимой гуанилатциклазы, уровня цГМФ и связанных с ним разнообразных биологических эффектов в разных тканях организма мышей.
Для выяснения, какая именно изоформа NOS вносит свой вклад в развитие анафилаксии, были использованы разные животные, дефицитные по еNOS и iNOS.
СЛАЙД
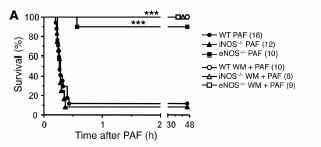
Инъекции фактора активации тромбоцитам мышам, дефицитных по iNOS приводило к анафилактическому шоку и их смерти, в то время как у еNOS-дефицитных животных наблюдали значительное снижение проявлений анафилаксии, что свидетельствовало о такой неожиданной главенствующей роли еNOS в развитии шока, вызванного фактором активации тромбоцитов.
Исследования in vitro, выполненные ранее рядом исследователей, показали, что еNOS активируется при фосфорилировании сериновых групп этого фермента, ионами кальция, связыванием с кальмодулином и другими факторами, что приводит к увеличению продукции NO.
Фосфорилирование сериновых групп NO-синтазы осуществляется фосфатидилинозитол-3-киназным путем с участием протеин киназы В и возможной активацией рецепторов тирозин киназы или G- протеин -связанных рецепторов.
Предварительное введение вортманнина, ингибитора фосфатидилинозитол-3-киназы, предотвращал развитие анафилаксии как у диких мышей, так и у мышей, дефицитных по iNOS, что свидетельствует о исключительном значении фосфатидилинозитол-3-киназы в индуцированном фактором активации тромбоцитов анафилактическом шоке.
Аналогичные результаты получены при сенсибилизации животных бычьим сывороточным альбуминов и овальбумином.
Вестерн-блот анализ показал специфическое фосфорилирование сериновых групп еNOS после введения фактора активации тромбоцитов.
При активации фосфатидилинозитол-3-киназы образуется фосфоинозитид 3,4,5-трифосфат, что приводит к синтезу и активации протеинкиназы В с последующей активацией ряда белков, в том числе и еNOS.
Введение овальбумин-сенсибилизированным животным ингибитора протеинкиназы В перифозина также блокировало развитие анафилаксии.
СЛАЙД
Авторы делают вывод о том, что Фосфатидилинозитол-3-киназа и протеинкиназа В играют существенную роль в продукции оксида азота многими неэндотелиальными клетками – тучными клетками, которые являются эффекторными в инициации и регуляции анафилаксии, а также тромбоцитами, эпителиальными клетками, крардиомиоцитами и др.
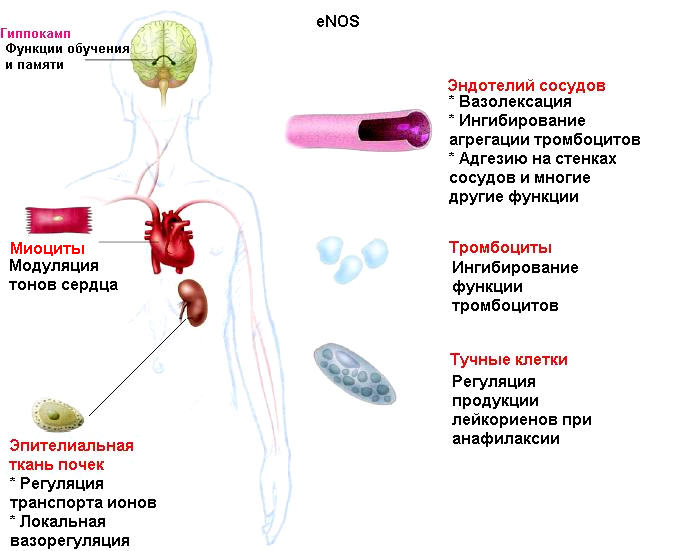
Это осуществляется посредством фосфорилирования еNOS с последующей генерацией большого количества оксида азота, который может активировать продукцию медиаторов воспаления, таких, как простогландины. Например, S-нитрозилирование оксидом азота циклооксигеназы 2 обуславливает повышенный синтез простагландина Е2.
Таким образом, NO, генерируемый еNOS, может обуславливать гипотензию посредством активации синтеза провоспалительных медиаторов, которые в значительной степени могут обуславливать независимые от цГМФ эффекты анафилаксии.
Такие механизмы активации еNOS могут объяснить ранее непонятную роль еNOS в 2-х типах клеток, экспрессирующих еNOS -- тромбоцитах крови и кардиомиоцитах, которые так или иначе могут принимать участие в развитии анафилактического шока.
Тем не менее, такая гипотеза в значительной степени требует дальнейшего исследования.
**************************************************************************
Сигнальная система оксида азота также связана с каннабиноидной сигнальной системой, которая, как известно, имеется как у позвоночных, так и беспозвоночных.
Известно, что каннабиноиды, например, дельта-9-тетрагидроканнабинол при лительном применении приводит к снижению кровяного давления и частоты сердечных сокращений.
Действие эндоканабиноида анандамида также обуславливает гипотензию и брадикардию. Интересно, что обусловленая анадамидом гипотензия не наблюдается у нормотензивных крыс, в то время как у спонтанно гипертензивных он оказывает гипотензивное действие.
СЛАЙД
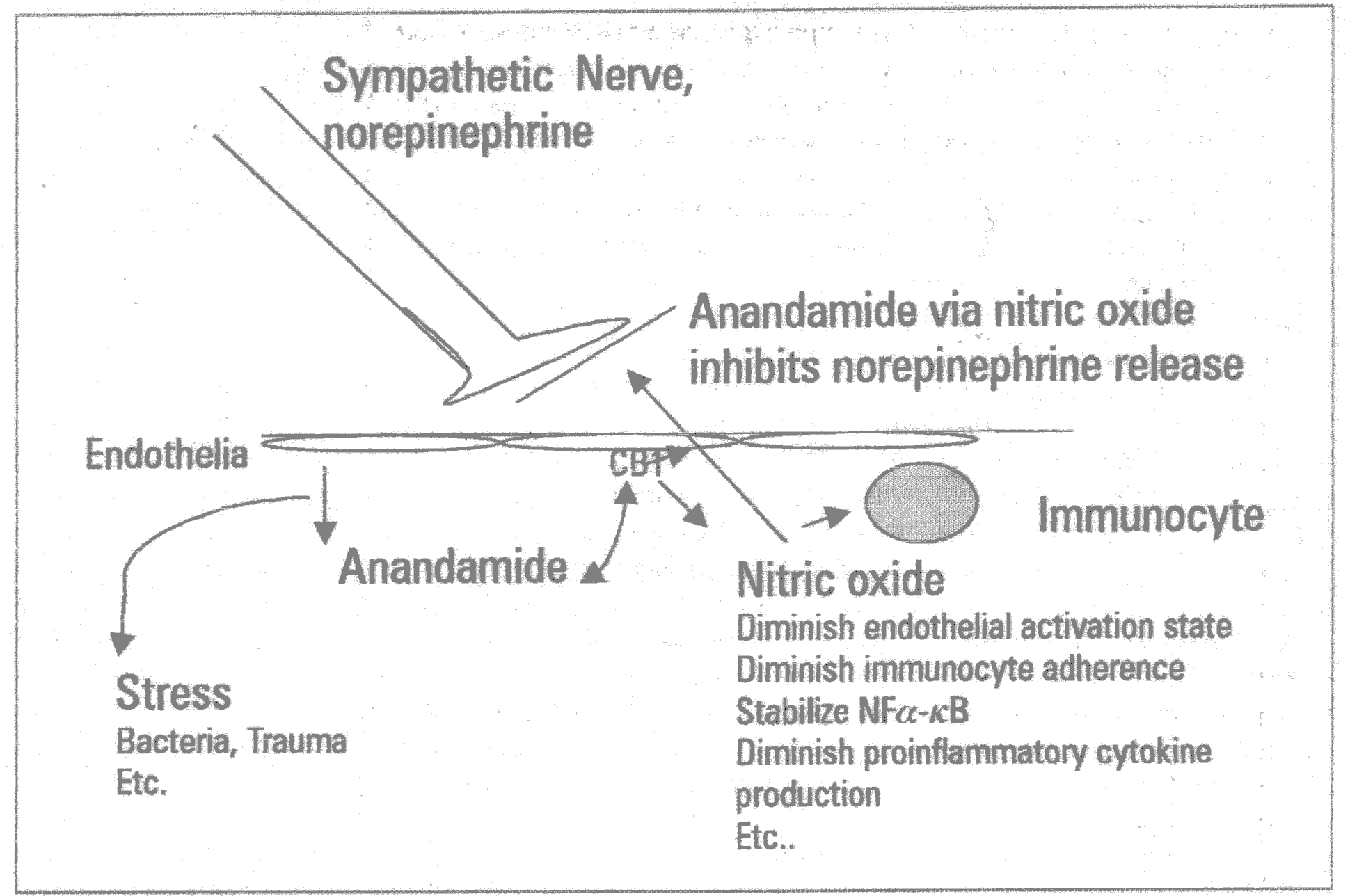
Показано, что анандамид в эндотелиальных и нервных клетках через СВ1 рецепторы стимулирует еNOS. Продуцируемый при этом оксид азота ингибирует высвобождение из симпатических нервов такого мощного вазоконстриктора, как норэпинефрин. Такая связь между эффектами каннабиноидов и продукцией NO, выражающееся в супрессии симпатических нервов (и снижении уровня норэпинефрина) показана у крыс и собак в эпителиальной ткани почек.
Анандамид также стимулирует образование NO в грудной аорте и эндотелии предсердия у человека и эта стимуляция устраняется ингибитором NOS ЛНАМЕ, так же как и антагонистом каннабиноидных рецепторов SR141716A.
Исследования, посвященные изучению влияния каннабиноидов на иммунную систему, свидетельствуют о том, что анандамид-опосредованный синтез NO может препятствовать активации как макрофагов так и эндотелиальных клеток и, следовательно, их взаимодействию.
Анандамид посредством активации еNOS может ингибировать адгезионную способность макрофагов. Также анандамид может уменьшает способность к подвижности и адгезии у гранулоцитов и макрофагов (иммуноцитов) человека и беспозвоночных.
*********************************************************
Преинкубация клеток-мишеней, таких как иммуноциты, с анандамидом устраняет последующую активацию этим эндоканнабиноидом синтеза оксида азота ендотелиальной NOS.
Однако следует отметить, что характер взаимодействия эндогенной каннабиноидной и NO-сигнальных систем может зависеть как от вида клеток, так и от конкретного каннабиноида.
Так, например, Ваксман и соавторы (Вирджинский медицинский колледж, Ричмонд) показали, что каннабиноиды способны подавлять продукцию NO, а также снижать экспрессию NOS в клетках микроглии крысы, стимулированных ЛПС или гамма-интерфероном.
Исследователи из Манчестерского университета установили, что анандамид ингибирует активность индуцибельной NOS в культуре стимулированных ЛПС астроцитах мыши.
Итальянские исследователи в опытах на культуре клеток глиомы С6 крысы показали, что такой эндоканабинноид-подобное вещество, как стеароилэтаноламид ингибирует клеточную NO-синтазу, в то время как преинкубация клеток глиомы с ингибитором СВ1 рецепторов 2-арахидоноилглицеролом приводит сначала к активации NO-синтазы, а затем ее активность опять понижается.
Авторы предлагают следующую схему:
СЛАЙД
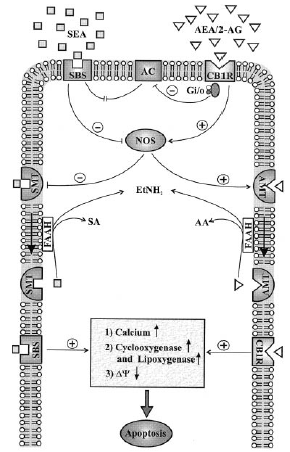
Связывание стеароилэтаноламида со специфическим сайтом связывания SBS приводит к ингибированию активности NOS и не влияет на активность аденилатциклазы.
В противоположность этому, связывание анадамида или 2-арахидоилглицерола активирует NOS и, через определенные G-белки ингибирует аденилатциклазу. NO, генерируемый NOS, ингибирует специфический мембранный траспортер стеароилэтаноламида (SMT) и активирует специфический мембранный транспортер анандамида (АМТ).
Стеароилэтаноламид и анандамид гидролизуются FAAH (fatty acid amid hydrolase) с образованием этаноламина (EtNH2), стеариновой кислоты (SA) и арахидоновой кислоты (АА).
Связывание стеароилэтаноламиа с мембранным транспортером запускает серию реакций, начиная с увеличения внутриклеточного Са и последующей активации циклооксигеназы и липоксигеназы и снижением мембранного потенциала митохондрий, что в итоге ведет к апоптозу.
Активация СВ1 рецепторов в дальнейшем потенцирует про-апоптическую активность стеароилэтаноламида посредством синтеза оксида азота активированной при этом NOS. Оксид азота ингибирует мембранный транспортер стеароилэтаноламида и таким образом удлиняет периодполураспада стеароилэтаноламида во внеклеточной среде.
Авторы работы делают вывод о том, что регуляция оксидом азота про-апоптической активности стеароилэтаноламида в клетках глиомы крыс осуществляется по пути, противоположному тому, что описан для анандамида.
