Применение низкоинтенсивного лазерного излучения для коррекции цитокинового баланса и активности фагоцитоза возбудителей внутрибольничных инфекций (экспериментальное обоснование на модели лабораторных животных ) 03.
| Вид материала | Автореферат диссертации |
- Применение низкоинтенсивного лазерного излучения инфракрасного диапазона в режиме постоянно, 377.48kb.
- Внастоящее время в большинстве стран мира наблюдается интенсивное внедрение лазерного, 809.98kb.
- План: Особенности лазерного излучения. Природа лазерного излучения, 197.08kb.
- С. А. Останин Демодуляция оптического сигнала в усилителе лазерного излучения, 47.91kb.
- Динамика показателей гомоцистеина, функции эндотелия, процессов перекисного окисления, 320.18kb.
- Медико-организационные аспекты внутрибольничных инфекций в стационарах хирургического, 378.76kb.
- Влияние низкоинтенсивного эми квч-диапазона на некоторые показатели гомеостаза животных, 221.3kb.
- Новые фундаментальные знания на службу профилактики инфекционных болезней животных, 124.52kb.
- Обоснование способов хирургической коррекции нарушений углеводного обмена (клинико-экспериментальное, 502.51kb.
- На правах рукописи, 1025.8kb.
На правах рукописи
Водянова татьяна викторовна
применение низкоинтенсивного лазерного излучения для коррекции цитокинового баланса и активности фагоцитоза возбудителей внутрибольничных инфекций
(экспериментальное обоснование на модели лабораторных животных)
03.00.02 – биофизика
14.00.36 – аллергология и иммунология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Саратов – 2007
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Саратовский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научные руководители: доктор медицинских наук, профессор
Заслуженный изобретатель РФ
Елисеев Юрий Юрьевич
доктор медицинских наук, доцент
Бугаева Ирина Олеговна
Официальные оппоненты: доктор физико-математических наук, профессор
Ульянов Сергей Сергеевич
доктор медицинских наук, старший научный
сотрудник Федорова Валентина Анатольевна
Ведущая организация – ФГУ «Государственный научный центр лазерной
медицины Федерального агентства по здраво-
охранению и социальному развитию» г. Москва
Защита состоится «31» мая 2007 г. в 1700 ч. на заседании
диссертационного совета Д 212.243.05 при государственном
образовательном учреждении высшего профессионального образования
«Саратовский государственный университет им. Н.Г. Чернышевского» по адресу: 410012, г. Саратов, ул. Астраханская, 83.
С диссертацией можно ознакомиться в Зональной научной библиотеке ГОУ ВПО «Саратовский государственный университет им. Н.Г. Чернышевского»
Автореферат разослан «25» апреля 2007 г.
Ученый секретарь диссертационного совета,
д
 октор физико-математических наук,
октор физико-математических наук, профессор Дербов В.Л.
общая характеристика работы
Актуальность проблемы. Низкоинтенсивное лазерное излучение (НИЛИ) широко используется в настоящее время в практической медицине в качестве эффективного лечебного и профилактического средства (Козлов, Буйлин, 1993; Илларионов, 1992, 1997; Владимиров, 1994, 1998; Кару, 1995, 1999; Брилль, 1997, 2005; Клебанов, 2001, 2005; Бугаева и др., 2004; Tuner, Hodl, 1996). Актуальность использования НИЛИ обусловлена тем, что небольших доз излучения достаточно для получения выраженной ответной реакции живой клетки, ткани и всего организма (Байбеков, 1991, 1996; Илларионов, 1992, 1994; Козлов, 1993; Девятков и др., 1998; Артюхов, 1999; Брилль, 1999, 2005; Бугаева, 2006; Рудик, 2006).
Известно, что в основе многих патологических процессов лежат нарушения механизмов иммунологической защиты (Сепиашвили, 2000; 2005; Ярилин, 2000; Хаитов и др., 2002; Елисеев и др., 2004). Несмотря на имеющиеся в литературе данные об иммуномодулирующем действии НИЛИ на организм (Каулен и др., 1980; Першин, 1997; Бугаева, 2006), влиянии на процесс фагоцитоза и функциональное состояние фагоцитирующих клеток (Рязанцева и др., 2001; Бриль и др., 2003, 2005; Тихомирова и др., 2004; Рудик, 2006), в отношении его использования в практической медицине при лечении различных гнойно-воспалительных и инфекционных заболеваний многое остается неясным. Актуальность проблемы обусловлена также широким распространением лекарственноустойчивых штаммов возбудителей внутрибольничных инфекций (ВВБИ), которые при тяжелых и генерализованных формах инфекции могут приводить к летальному исходу. Характер течения и исход гнойно-септических заболеваний во многом определяется нарушением цитокинового баланса между про- и противовоспалительными цитокинами. В связи с этим разработка методов активации защитных сил организма, коррекции цитокинового статуса и эффективного киллинга бактерий имеет огромное значение.
Цель работы – экспериментальное обоснование использования НИЛИ, генерируемого полупроводниковыми лазерными диодами, для коррекции цитокинового баланса и активности фагоцитоза ВВБИ при моделировании инфекционного процесса.
Для достижения указанной цели нами были поставлены и решены следующие задачи:
- Изучить активность процесса фагоцитоза возбудителей внутрибольничных инфекций и индукцию провоспалительных цитокинов интактными перитонеальными макрофагами белых мышей в условиях in vitro.
- Определить действие ИК НИЛИ (890 нм) на активность перитонеальных макрофагов белых мышей и синтез цитокинов при моделировании in vitro процесса фагоцитоза ВВБИ.
- Выявить влияние ИК НИЛИ (890 нм) на активность кислородзависимого и кислороднезависимого киллинга бактерий в макрофагах белых мышей при моделировании in vitro процесса фагоцитоза ВВБИ.
- Изучить цитокиновый статус организма экспериментальных животных при моделировании инфекционного процесса возбудителями внутрибольничных инфекций.
- Оценить характер и иммунобиологическую значимость транскутанного облучения ИК НИЛИ (890 нм) инфицированных экспериментальных животных.
- Определить возможность использования различных критериев комплексного иммунологического мониторинга функций фагоцитирующих клеток для оценки эффективности действия НИЛИ.
Научная новизна. Впервые было проведено комплексное исследование на организменном, клеточном и субклеточном уровнях влияния ИК НИЛИ (890 нм) in vitro и in vivo на фагоцитарную, цитокиновую и функциональную активность перитонеальных макрофагов белых мышей в отношении ВВБИ. Установлено, что ИК НИЛИ (890 нм) оказывает стимулирующее действие на все стадии фагоцитоза ВВБИ макрофагами. Показано влияние ИК НИЛИ in vitro и in vivo на синтез провоспалительных и регуляторных цитокинов – ИЛ-1α, ИЛ-4, ИЛ-6, ИЛ-8, ФНО-α и ИФН-γ в процессе фагоцитоза ВВБИ. Дана оценка действия ИК НИЛИ (890 нм) на состояние кислороднезависимого и кислородзависимого киллинга бактерий в макрофагах. Определен комплекс наиболее информативных показателей эффективности действия НИЛИ на процесс фагоцитоза ВВБИ. Впервые экспериментально обоснована возможность использования ИК НИЛИ (890 нм) для коррекции цитокинового баланса на начальных стадиях инфекционного процесса, вызванного ВВБИ.
Теоретическая и практическая значимость. Полученные результаты вносят существенный вклад в понимание эффектов, оказываемых лазерным излучением на различные уровни организации биологических систем, и механизмов активации одного из основных факторов естественной резистентности – фагоцитоза, исход которого во многом определяет развитие специфических иммунологических реакций организма. Отобраны наиболее информативные показатели количественных и качественных иммуноморфологических и функциональных изменений для оценки характера действия НИЛИ на активность фагоцитоза ВВБИ для рекомендации к применению в биологических и медицинских исследованиях. Полученные результаты могут быть использованы в клинической практике для достижения эффекта стимуляции фагоцитарной функции организма в отношении ВВБИ и коррекции цитокинового статуса.
По материалам данной работы подготовлено научно-методическое пособие «Оценка эффективности действия НИЛИ in vitro и in vivo на функциональную активность фагоцитирующих клеток». Материалы диссертационного исследования используются при чтении лекций общих (иммунология, микробиология) и специальных (современные методы иммунологических исследований) курсов студентам биологического факультета СГУ. Полученные результаты использованы при подготовке курсовых и дипломных работ студентами биологического факультета СГУ.
Апробация работы. Основные положения диссертации доложены и обсуждены на III Международном конгрессе молодых ученых и специалистов «Науки о человеке» (Томск, 2002); Международной научно-практической конференции «Цитокины. Воспаление. Иммунитет» (Санкт-Петербург, 2002); V Съезде иммунологов и аллергологов России (Санкт-Петербург, 2003); Симпозиуме по оптическим технологиям в биофизике и медицине «SARATOV FALL MEETING» (Саратов, 2004); Объединенном иммунологическом форуме и III съезде иммунологов России (Екатеринбург, 2004); Международном конгрессе «Иммунитет и болезни: от теории к терапии» (Москва, 2005); общероссийских научных конференциях «Гомеостаз и инфекционный процесс» (Москва, 2006, 2007); X Всероссийском форуме «Дни иммунологии в Санкт-Петербурге (Санкт-Петербург, 2006); Российской научно-практической конференции «Современные технологии в иммунологии: иммунодиагностика и иммунотерапия» (Курск, 2006); II Открытой Всероссийской научно-практической конференции «Молодежь и наука в XXI веке» (Ульяновск, 2007); 1 конференции молодых ученых медико-биологической секции Поволжской ассоциации государственных университетов (ПАГУ, Ульяновск, 2007).
Основные положения, выносимые на защиту:
- ИК НИЛИ (890 нм) оказывает стимулирующее действие in vitro на все стадии фагоцитоза ВВБИ перитонеальными макрофагами белых мышей; усиливает синтез провоспалительных цитокинов, интенсивность «респираторного взрыва» и активность миелопероксидазы в процессе кислородзависимого киллинга ВВБИ.
- ИК НИЛИ (890 нм) in vivo изменяет цитокиновый баланс организма на начальных стадиях инфекционного процесса; транскутанное облучение инфицированных мышей снижает гиперпродукцию ИЛ-1α при стафилококковой, эшерихиозной и цитробактерной инфекциях; ФНО-α – при стафилококковой инфекции. Увеличивает содержание в сыворотке крови мышей ИЛ-6, ИФН-γ и ИЛ-4.
- Наиболее информативными показателями эффективности действия ИК НИЛИ (890 нм) на фагоцитарную функцию макрофагов в отношении ВВБИ являются: индекс завершенности фагоцитоза, содержание провоспалительных цитокинов – ИЛ-1α, ФНО-α и ИФН-γ, уровень активных форм кислорода в индуцированном НСТ-тесте и активность миелопероксидазы.
Публикации. По теме диссертации опубликовано 15 работ и 1 научно-методическое пособие.
Структура и объем диссертации. Диссертация состоит из введения, главы «Современное состояние проблемы (обзора литературы)», главы «Материалы и методы исследований», четырех глав собственных исследований, заключения, выводов и списка использованных литературных источников. Работа изложена на 145 страницах компьютерного текста, иллюстрирована 15 таблицами и 15 рисунками. Список литературы содержит 189 источников, в числе которых 129 отечественных и 60 зарубежных работ.
Работа выполнена в рамках НИР «Изучение механизмов действия низкоинтенсивного лазерного излучения на функциональную активность клеток иммунной системы в норме и при инфекционной нагрузке» и при финансовой поддержке гранта № 45434 в рамках Программы «Развитие научного потенциала высшей школы» министерства образования и науки РФ.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследований
В качестве объекта исследований in vitro были использованы перитонеальные макрофаги белых мышей. Макрофаги выделяли из перитонеального экссудата по общепринятой методике (всего было использовано 26 животных). Количество выделенных клеток подсчитывали в камере Горяева и определяли жизнеспособность в тесте эксклюзии трипанового синего (Лебедева и др., 1989).
При постановке экспериментов использовали НИЛИ в инфракрасном диапазоне. В качестве источника инфракрасного излучения использовали полупроводниковый лазерный диод на основе кристаллов GaAlAs с максимумом спектра испускания λ=890±2,5 нм, непрерывным режимом излучения и мощностью 5 мВт. Применяли рекомендованные для практического использования (Рудик и др., 2004) дозы НИЛИ – 300, 900 и 1500 мДж, действие осуществляли непосредственно на клетки до начала фагоцитоза. В качестве контроля использовали фагоциты, не подвергнутые облучению НИЛИ. Для моделирования процесса фагоцитоза in vitro использовали штаммы ВВБИ, выделенные в клиниках г. Саратова: Staphylococcus aureus 100б; S. haemolyticus 9; S. epidermidis 16; Escherichia coli 27; Enterobacter agglomerans 17; Serratia sp. 13; Citrobacter sp. 42. Бактерии выращивали на скошенном агаре Хоттингера (рН 7,2) при 370С в течение 24 часов, затем готовили взвеси в физиологическом растворе хлорида натрия по стандарту мутности № 5 (ГИСК им. Л.А. Тарасевича, 2002). Бактерии вносили в культуральную среду 199 с макрофагами из расчёта 1:50 и инкубировали в термостате при 37 С в течение 1, 3, 6 и 12 ч. Далее из клеточных взвесей готовили фиксированные и окрашенные препараты для оценки фагоцитарной активности макрофагов на различных этапах фагоцитоза и цитохимического анализа их функциональной активности. Интенсивность фагоцитоза на отдельных этапах учитывали путем оценки следующих показателей: индекса адгезии (ИА), фагоцитарных индексов (ФИ 1,3,6), индекса завершенности фагоцитоза (ИЗФ) (Васильева и др., 1987).
Содержание провоспалительных и регуляторных цитокинов: ИЛ-1α, ИЛ-4, ИЛ-6, ИЛ-8, ФНО-α и ИФН-γ определяли через 3 и 6 ч процесса фагоцитоза в супернатанте среды культивирования фагоцитов, подвергнутых облучению НИЛИ, методом ИФА с коммерческими тест-системами на основе моноклональных антител к исследуемым цитокинам (ООО «Цитокин», г. Санкт-Петербург; НПО ЗАО «Вектор-БЕСТ», г. Новосибирск).
Образование активных форм кислорода (АФК) регистрировали в тесте восстановления нитросинего тетразолия (НСТ-тест) в двух вариантах: спонтанном и индуцированном (Долгушин, Бухарин, 2001). Цитохимические исследования проводили через 1, 3 и 6 ч фагоцитоза бактерий с использованием стандартных тест-наборов производства НПФ «Абрис+» (г. Санкт-Петербург).
Миелопероксидазу в фагоцитирующих клетках определяли методом Грэхема-Кнолля с использованием бензидина (Бакуев, Саидов, 1991).
Определение содержания кислой фосфатазы проводили методом азосочетания Берстона с использованием нафтол-АS-фосфата (Берстон, 1965).
Содержание щелочной фосфатазы оценивали методом азосочетания по Каплоу с использованием раствора α-нафтил-фосфата (Kaplow, 1955; Шубич, 1965).
Содержание катионных белков оценивали по методу Шубича с бромфеноловым синим (Шубич, 1974). На основе результатов исследований рассчитывали средний цитохимический коэффициент (СЦК) с использованием полуколичественного метода оценки по принципу Астальди-Верга, основанному на выявлении различной степени интенсивности специфической окраски (Astaldi, Verga, 1957).
Инфекционный процесс моделировали на 160 беспородных белых мышах-самцах, массой 18-20 г, введением внутрибрюшинно взвеси суточных культур клинических штаммов бактерий в физиологическом растворе хлорида натрия в объеме 0,2 мл с концентрацией 5 млн м.к./мл (7 опытных групп по 20 животных); контрольным мышам вводили аналогично 0,2 мл физиологического раствора (2 контрольные группы по 10 животных). Определяли через 1, 6, 12 и 24 ч после заражения содержание в сыворотке крови цитокинов: ИЛ-1α, ИЛ-6, ИЛ-8, ФНО-α, ИФН-γ.
Облучение передней брюшной стенки животных проводилось аппаратом АЛТ «Узор», который является полупроводниковым лазерным инжектором на арсениде галлия. Инфракрасное лазерное излучение, генерируемое этим аппаратом, имеет длину волны 890 нм. Для транскутанного облучения мышей применяли отработанные ранее и рекомендованные для практического использования (Бугаева и др., 1999, 2003) параметры: мощность излучения – 4 мВт, импульсная частота – 1500 Гц, плотность энергии на поверхности кожи – 12,6х10-3 Дж/см2, разовая экспозиция – 128 с. Облучение проводили через 3 и 6 часов после заражения. Учитывали в динамике содержание цитокинов в сыворотке крови, морфологические особенности макрофагов перитонеального экссудата и степень завершенности фагоцитоза бактерий в группах экспериментальных животных (инфицированные необлученные и инфицированные облученные) после заражения и сеанса облучения.
Для статистической обработки экспериментальных данных использовали непараметрические критерии Уилкоксона-Манна-Уитни и параметрический t-кри-терий Стьюдента. Достоверными считали различия при вероятности ошибки p<0,05 (Ашмарин и др., 1979). Для выявления взаимосвязи между показателями использовали корреляционный анализ. Расчёт результатов осуществляли с применением пакета прикладных программ Statistica 6.0, MS Еxcel 2003.
Результаты исследований и их обсуждение
Моделирование in vitro процесса фагоцитоза ВВБИ и оценка синтеза
цитокинов
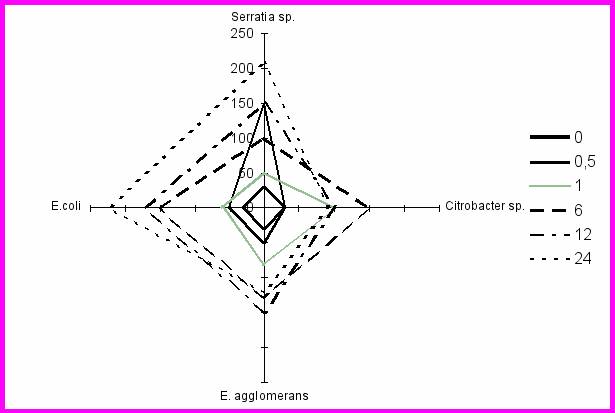
На первом этапе исследований была изучена in vitro активность процесса фагоцитоза перитонеальными макрофагами разных видов ВВБИ: E.agglomerans, Serratia sp., Citrobacter sp. и E. coli. Анализ результатов позволил выявить зависимость числа активных ПМФ от времени их инкубации с микробными клетками. Был проведен сравнительный анализ данных по активности макрофагов, степени завершенности процесса фагоцитоза микробных клеток (рис. 1) и индукции цитокинов (рис. 2).

Рис. 1. Индексы завершенности фагоцитоза перитонеальными макрофагами мышей разных
видов энтеробактерий
Установлено, что процесс фагоцитоза клинических штаммов энтеробактерий характеризовался незначительной активацией ПМФ и частичным перевариванием микробных клеток на фоне активной индукции ИЛ-1α и ФНО-α с максимальной концентрацией к 24 часам. При фагоцитозе клинического антибиотикоустойчивого штамма Е. coli с
Б
одержание ИЛ-1α и ФНО-α к 24 часам было одинаково высоким. Однако динамика активности макрофагов была менее выраженной по сравнению с данными литературы в отношении других эшерихий, что сопровождалось незавершенным фагоцитозом.

ИЛ-1
ФНО-
Рис. 2. Сравнительный анализ динамики синтеза цитокинов в процессе фагоцитоза in vitro перитонеальными макрофагами разных видов энтеробактерий
Был установлен цитопатический характер действия клинических штаммов энтеробактерий на макрофаги к 24 часам процесса фагоцитоза, проявляющийся появлением большого числа разрушенных клеток.
Сравнение индукции провоспалительных цитокинов при фагоцитозе клинических штаммов стафилококков позволило отметить сходную динамику: небольшое увеличение количества цитокинов к 3 часам процесса фагоцитоза и резкое снижение их количества к концу срока наблюдения. В тоже время индукция ФНО-α была высокой для штамма S. aureus. Это сопровождалось снижением числа активных макрофагов и низким индексом завершенности фагоцитоза, показателем частичного переваривания микробных клеток. При фагоцитозе S. epidermidis менее выраженная динамика активности макрофагов и невысокие значения индекса завершенности сопровождались увеличением синтеза ИЛ-1α и снижением содержания ФНО-α до контрольных значений к 24 часам. Аналогичная индукция ФНО-α отмечена и в процессе фагоцитоза микробных клеток S. haemolyticus. При этом максимальное содержание ИЛ-1α отмечено через 6 часов с последующим снижением к 24 часам. Число активных макрофагов и значения индекса завершенности фагоцитоза были выше, чем при фагоцитозе S. aureus.
Влияние НИЛИ in vitro на активность процесса фагоцитоза ВВБИ
и цитокиновую активность макрофагов
Для оценки действия ИК НИЛИ (890 нм) на фагоцитарную и цитокиновую активность макрофагов моделировали процесс фагоцитоза бактерий S. aureus 100б в условиях in vitro. Показано, что под влиянием инфракрасного НИЛИ (890 нм) происходило увеличение числа активных макрофагов на различных этапах фагоцитоза ВВБИ. Был проведен сравнительный анализ индексов адгезии, фагоцитарных индексов и индексов завершенности фагоцитоза ВВБИ в контрольных макрофагах и после облучения в дозах 300, 900 и 1500 мДж (табл. 1). На стадии киллинга и переваривания бактерий (3 ч) процент активно фагоцитирующих макрофагов значительно и статистически достоверно превышал контрольные значения при использовании всех испытуемых доз НИЛИ, однако к 6 ч фагоцитоза значения ФИ возвращались к контрольным.
Таблица 1
Изменение фагоцитарной активности макрофагов при фагоцитозе S. aureus
на фоне воздействия ИК НИЛИ (890 нм)
| Доза излучения, мДж/см2 | ИА, (P±mp%) в % | Фагоцитарный индекс, (P±mp%) в % | ИЗФ,(M±m) в усл. ед. | ||
| ФИ1 | ФИ3 | ФИ6 | |||
| 0 (контроль) | 76,3 ± 5,38 | 35,6 ± 4,6 | 47,5 ± 5,2 | 16,0 ± 4,3 | 0,57 ± 0,03 |
| 300 | 82,8 ± 5,7* | 46,5 ± 3,2* | 66,5 ± 3,3* | 21,5 ± 3,8 | 0,54 ± 0,02 |
| 900 | 93,6 ± 5,7* | 48,7 ± 3,1* | 69,7 ± 4,7* | 22,7 ± 4,3 | 0,51 ± 0,02 |
| 1500 | 94,8 ± 5,3* | 58,6 ± 3,1* | 73,2 ± 3,6* | 20,3 ± 4,5 | 0,65 ± 0,03* |
Примечание: * – наличие достоверных различий по отношению к контрольной группе интактных макрофагов при уровне значимости Р<0,05.
Это свидетельствовало о благоприятном завершении фагоцитарного процесса и эффективном киллинге поглощенных бактерий. Значения ИЗФ увеличивались статистически значимо при действии дозы 1500 мДж/см2.
Показано дозозависимое увеличение содержания ИЛ-1 через 3 ч инкубации макрофагов с бактериями по сравнению с контролем (рис. 3-А). Отмечено, что ИК НИЛИ оказывало значительное стимулирующее влияние на синтез ФНО-α, наибольшее содержание которого отмечено при действии дозой 1500 мДж/см2 по сравнению с контролем. Выявлены достоверные различия в концентрации ФНО-α через 3 и 6 ч фагоцитоза при действии на макрофаги дозами 900 и 1500 мДж/см2 (рис. 3-Б).
Концентрация ИФН-γ увеличивалась в среднем в 1,5 раза по сравнению с контролем, однако это увеличение не имело дозозависимый характер (рис. 3-В). Статистически значимые различия содержания ИЛ-4 в культуральной среде с облученными и необлученными фагоцитирующими макрофагами не были обнаружены при действии всех испытуемых доз излучения (рис. 3-Г). Отмечено увеличение синтеза ИЛ-8 фагоцитирующими макрофагами только через 3 ч процесса фагоцитоза.
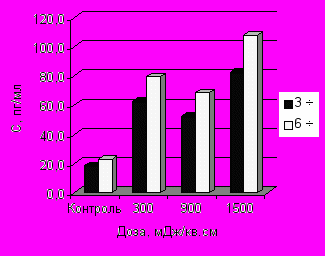 | 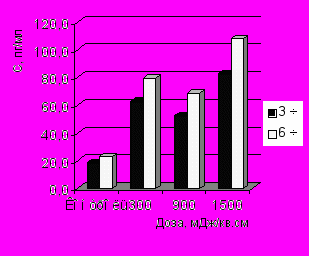 |
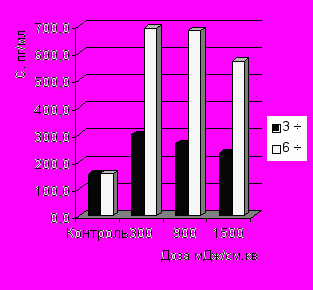 | 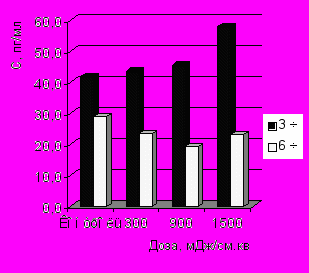 |
| Рис. 3. Динамика продукции ИЛ-1 (А), ФНО- (Б), ИФН-γ (В) и ИЛ-8 (Г) в процессе фагоцитоза S.aureus макрофагами, облученными in vitro ИК НИЛИ (890 нм) | |
Влияние НИЛИ на активность кислороднезависимого и кислородзависимого
киллинга бактерий в макрофагах при моделировании in vitro процесса фагоцитоза ВВБИ
Представляло интерес изучить влияние ИК НИЛИ (890 нм) на механизмы киллинга бактерий в макрофагах при моделировании in vitro процесса фагоцитоза ВВБИ. Для оценки кислороднезависимого киллинга бактерий была изучена активность кислой (КФ) и щелочной (ЩФ) фосфатаз, а также содержание катионных белков (КБ) в цитоплазме перитонеальных макрофагов и нейтрофилов крови. Было показано стимулирующее действие ИК НИЛИ на активность КФ: достоверное увеличение через 1 ч фагоцитоза бактерий макрофагами и сохранение повышенной активности до 6 ч. Оценка значений СЦК для КБ показала достоверное увеличение их содержания в цитоплазме неактивных макрофагов. Однако через 1 ч фагоцитоза происходило снижение содержания КБ последующее достоверное увеличение их содержания только к 6 ч.
При изучении основных показателей кислородзависимого киллинга бактерий фагоцитами под влиянием ИК НИЛИ (890 нм) было показано изменение интенсивность спонтанной и индуцированной реакций НСТ-теста у макрофагов. При постановке индуцированной бактериями реакции значения НСТ-теста значительно увеличивались и достигали максимальных значений при действии НИЛИ в дозе 1500 мДж/см2. Для характеристики другого кислородзависимого механизма киллинга бактерий была изучена активность миелопероксидазы (МПО). При действии НИЛИ на макрофаги не было выявлено достоверных различий в продукции МПО до начала фагоцитоза (рис. 4).
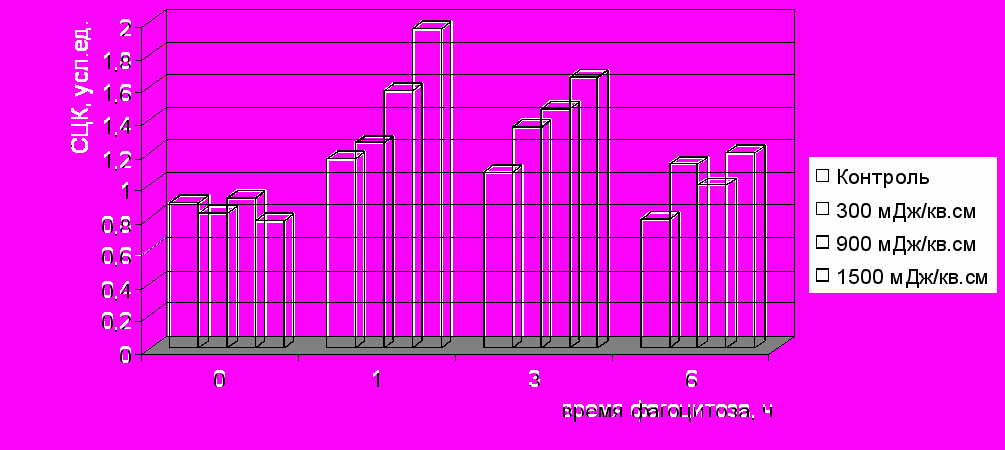 |
| Рис. 4. Активность образования миелопероксидазы при фагоцитозе бактерий макрофагами под влиянием ИК НИЛИ (890 нм) |
Через 1 ч фагоцитоза бактерий отмечено достоверное увеличение активности МПО при действии доз 900 и 1500 мДж/см2 на макрофаги. К 3 ч фагоцитоза активность МПО оставалась на том же уровне, к 6 ч значения активности МПО были на уровне контроля. Таким образом, на клеточном уровне показаны изменения функциональной активности фагоцитирующих клеток на фоне действия НИЛИ.
Влияние ИК НИЛИ in vivo на цитокиновый статус мышей
при моделировании инфекционного процесса
Известно, что результаты, полученные при моделировании реакций in vitro, не всегда соответствуют таковым in vivo, поскольку внутри организма огромное значение имеет взаимное влияние клеток и эффект микроокружения в тканях. В этой связи представляло интерес оценить цитокиновый статус организма экспериментальных животных при моделировании инфекционного процесса клиническими штаммами бактерий на фоне действия in vivo ИК НИЛИ.
В серии предварительных экспериментов была изучена динамика содержания цитокинов в сыворотке крови мышей после заражения различными ВВБИ. Показано, что введение внутрибрюшинно мышам клинического штамма S. aureus сопровождалось динамичным возрастанием к 24 ч инфекционного процесса одновременно содержания в сыворотке крови ИЛ-1 и ФНО-, превышающего контроль в 5-7 раз. Такая гиперпродукция основных провоспалительных цитокинов приводила к развитию у этих животных клинической картины эндотоксического шока. Концентрация ИЛ-6 в сыворотке крови увеличивалась к 6 ч и снижалась к 24 ч, оставаясь при этом выше исходных значений. При введении S. haemolyticus содержание ИЛ-1 было достоверно выше контрольных значений через 1, 6 и 24 ч, ИЛ-6 – через 6 и 24 ч, а ФНО-α через 1 ч, после чего оставалось без изменений в последующие часы наблюдения.
При моделировании инфекционного процесса введением внутрибрюшинно мышам взвеси суточных культур энтеробактерий сопровождалось резкой индукцией ИЛ-1α и ФНО-α, содержание которых в 3-5 раз превышало контрольные значения в сыворотке крови через 12 и 24 часа. Концентрация ИЛ-6 была достоверно выше контрольных значений через 6 и 12 ч, а ИФН-α – через 6 и 24 ч. Выявлен также незавершенный характер фагоцитоза ВВБИ перитонеальными макрофагами в организме инфицированных животных, и содержание в перитонеальном экссудате значительного числа разрушенных и апоптотичных фагоцитов.
 А)  |
 Б)  |
Рис. 5. Содержание цитокинов в сыворотке крови инфицированных животных до облучения (а) и после облучеия ИК НИЛИ (б)
Применение транскутанного облучения инфицированных животных в области передней брюшной стенки аппаратом АЛТ «Узор» через 3 и 6 ч после заражения изменяло цитокиновый статус экспериментальных животных в динамике модельного инфекционного процесса. Отмечено снижение гиперпродукции ИЛ-1 и ФНО-α, наиболее выраженное при стафилококковой инфекции. При эшерихиозной и цитробактерной инфекциях через 6 и 24 часа после заражения отмечена разная степень снижения содержания цитокинов в зависимости от схемы действия НИЛИ и срока инфекционного процесса. Показано динамическое увеличение содержания ФНО-α при действии НИЛИ через 3 ч после инфицирования Citrobacter sp. При эшерихиозной инфекции увеличение содержания ФНО-α происходило через 1 и 6 часов и зависело от схемы действия НИЛИ. Интересен факт определения через 6 и 12 после транскутанного облучения в сыворотке крови инфицированных мышей ИФН-γ и ИЛ-8 в небольших концентрациях (в сыворотках крови животных из контрольных групп он не обнаруживался). Макрофаги, выделенные из перитонеального экссудата мышей через 1 и 6 часов после облучения, имели необычную морфологию – были крупные, раздутые, деформированные. В то же время процессы адгезии и внутриклеточного киллинга ими бактерий проходили активно.
Таким образом, представленные исследования свидетельствуют о влиянии ИК НИЛИ (890 нм) на цитокиновый баланс в организме экспериментальных животных при фагоцитозе ВВБИ. Это дает основание предполагать, что можно осуществлять с помощью НИЛИ коррекцию иммунного статуса инфицированных животных на фоне развития патологического процесса, вызванного ВВБИ.
В результате проведенных исследований были отобраны наиболее информативные показатели эффективности действия НИЛИ на фагоциты: ИЗФ, содержание провоспалительных цитокинов – ИЛ-1 α, ФНО-α и ИФН-γ, уровень образования АФК в индуцированном НСТ-тесте и активность миелопероксидазы. Комплекс этих показателей позволяет судить о характере и иммунобиологической значимости изменений в процессе фагоцитоза бактерий и может быть использован для оценки эффективности действия НИЛИ при лазеротерапии инфекционных заболеваний.
Полученные результаты вносят существенный вклад в представление о биологической активности лазерного излучения в отношении активации факторов естественной резистентности организма.
Выводы
- Выявлены различия в индукции провоспалительных цитокинов и характере фагоцитоза клинических штаммов ВВБИ перитонеальными макрофагами мышей in vitro. Установлено, что незавершенный фагоцитоз Serratia sp. и Citrobacter sp. сопровождался достоверным повышением к 12 часам содержания в среде культивирования макрофагов ИЛ-1α и ФНО-α, и незначительным – ИЛ-6. Частичное переваривание бактерий E.agglomerans и E. coli в макрофагах происходило на фоне динамичного увеличения концентрации ИЛ-1α, ИЛ-6 и ФНО-α в интервале от 3 до 24 часов наблюдения. Показана сходная динамика индукции цитокинов при разной активности процесса фагоцитоза клинических штаммов стафилококков.
- Установлен дозозависимый эффект усиления всех стадий фагоцитоза ВВБИ, синтеза ИЛ-1α и ФНО-α, и дозонезависимый – синтеза ИФН-γ и ИЛ-8 макрофагами мышей при действии in vitro ИК НИЛИ (890 нм) мощностью 5 мВт.
- Показано влияние ИК НИЛИ (890 нм) на активность кислороднезависимого и кислородзависимого киллинга ВВБИ. Отмечено достоверное увеличение активности кислой фосфатазы, фазное изменение содержания катионных белков, значительная активация миелопероксидазы и увеличение образования активных форм кислорода по показателям индуцированного НСТ-теста в макрофагах.
- Установлены различия в динамике содержания основных провоспалительных и регуляторных цитокинов в сыворотке крови экспериментальных животных при внутрибрюшинном заражении ВВБИ. Показано увеличение в 5-7 раз по сравнению с контролем концентраций ИЛ-1α и ФНО-α к 12 ч инфекционного процесса после внутрибрюшинного введения S. aureus, Е.coli и Citrobacter sp.; содержание ИЛ-6 увеличивалось к 6 ч и снижалось к 24 ч, превышая исходные значения.
- Показано, что транскутанное облучение ИК НИЛИ через 3 и 6 часов после заражения животных изменяет баланс провоспалительных цитокинов в сыворотке крови: снижается гиперпродукция ИЛ-1α при стафилококковой, эшерихиозной и цитробактерной инфекциях, ФНО-α – при стафилококковой инфекции; повышается содержание ИНФ-γ. Усиливается процесс фагоцитоза ВВБИ в перитонеальных макрофагах.
- Отобран комплекс наиболее информативных показателей эффективности действия НИЛИ на процесс фагоцитоза ВВБИ: индекс завершенности фагоцитоза, содержание провоспалительных цитокинов – ИЛ-1α, ФНО-α и ИФН-γ, уровень образования активных форм кислорода в индуцированном НСТ-тесте и активность миелопероксидазы.
Список работ, опубликованных по теме диссертации
- Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И. Индукция провоспалительных цитокинов при фагоцитозе возбудителей внутрибольничных инфекций // В сб. материалов научно-практичес. конф., посвящ. 80-летию образования гос. сан-эпид. службы РФ. – Саратов, 2002. – С. 181-184.
- Тихомирова Е.И., Бугаева И.О., Водянова Т.В. Влияние низкоинтенсивного лазерного излучения на активность клеток иммунной системы / Матер. науч.-прак. конф. «Окружающая среда и здоровье». – Саратов, 2002. – С. 123 – 124.
- Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И. Продукция цитокинов перитонеальными макрофагами в процессе фагоцитоза возбудителей внутрибольничных инфекций // В сб. науч. работ «Актуальные проблемы медицины и биологии». – Выпуск 2. – Томск: СГМУ, 2003. – С. 227.
- Тихомирова Е.И., Бугаева И.О., Водянова Т.В. Влияние низкоинтенсивного лазерного излучения на активность фагоцитоза // Межрегион. сб. науч. работ «Проблемы физической биомедицины». – Саратов, 2003. – С. 137 – 142.
- Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И. Сравнительное изучение синтеза провоспалительных цитокинов перитонеальными и альвеолярными макрофагами при фагоцитозе стафилококков // В сб. науч. работ «Актуальные проблемы медицины и биологии». Выпуск 3. – Томск: СГМУ, 2004. – С. 128.
- *Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И. Цитокиновая активность макрофагов при фагоцитозе возбудителей внутрибольничных инфекций // Russian journal of immunology, 2004. – V. 9. – S. 1. – P. 186.
- *Елисеев Ю.Ю., Водянова Т.В. Экспериментальное обоснование возможности применения ронколейкина® для профилактики внутрибольничных инфекций // International J. оf immunorehabilitation. – 2006. – № 3. – С. 86.
- Водянова Т.В. Синтез провоспалительных цитокинов перитонеальными и альвеолярными макрофагами в процессе фагоцитоза возбудителей внутрибольничных инфекций //Russian journal of immunology, 2006. – V. 6. – P. 58.
- *Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И., Шибаева М.А. Индукция провоспалительных цитокинов клиническими штаммами стафилококков при моделировании инфекционного процесса на лабораторных животных // Медицинская иммунология. – 2006. – Т. 8, № 2 – 3 . – С. 127-128.
- Водянова Т.В., Елисеев Ю.Ю., Тихомирова Е.И., Шибаева М.А. Показатели цитокинового статуса лабораторных животных при моделировании инфекционного процесса возбудителями внутрибольничных инфекций // Успехи современного естествознания. – 2006.– №6. – С. 69.
- Водянова Т.В. Использование низкоинтенсивного лазерного излучения для коррекции цитокинового статуса при моделировании инфекционного процесса в организме лабораторных животных //В материалах II Открытой Всерос. научно-практичес. конф. «Молодежь и наука в XXI веке». – Ульяновск, 2007. – С. 36-38.
- Водянова Т.В. Цитокиновая активность фагоцитов in vitro на фоне действия низкоинтенсивного лазерного излучения //В материалах 1-й конф. молодых ученых медико-биологической секции ПАГУ. – Ульяновск, 2007. – С. 42-44.
- Водянова Т.В., Бугаева И.О., Елисеев Ю.Ю., Емельянова Н.В. Влияние низкоинтенсивного лазерного излучения in vivo на содержание цитокинов в сыворотке крови мышей при моделировании инфекционного процесса // Фундаментальные исследования. – 2007.– № 2. – С. 78-79.
- *Водянова Т.В., Шибаева М.А., Елисеев Ю.Ю., Емельянова Н.В. Оценка цитокинового статуса организма экспериментальных животных при моделировании инфекционного процесса возбудителями внутрибольничных инфекций // Медицинская иммунология. – 2007. – Т. 9, № 2 – 3. – С. 67-68.
- *Тихомирова Е.И., Тучина Е.С., Рудик Д.В., Водянова Т.В., Емельянова Н.В. Влияние низкоинтенсивного лазерного излучения на цитокиновую активность макрофагов и нейтрофилов in vitro при фагоцитозе бактерий // Медицинская иммунология. – 2007. – Т. 9, № 2 – 3. – С. 82-83.
Водянова Татьяна Викторовна
применение низкоинтенсивного лазерного излучения для коррекции цитокинового баланса и активности фагоцитоза возбудителей внутрибольничных инфекций
(экспериментальное обоснование на модели лабораторных животных)
03.00.02 – биофизика
14.00.36 – аллергология и иммунология
Автореферат диссертации на соискание
ученой степени кандидата медицинских наук
__________________________________________________________
Подписано в печать ….2007 г.
Формат 60×84 1/16. Бумага офсетная. Гарнитура Таймс. Печать офсетная.
Объем 1 печ. л. Тираж 100 экз. Заказ № ....
___________________________________________________________________________________________________________________
Типография Издательства Саратовского университета.
410012, Саратов, Астраханская, 83.
