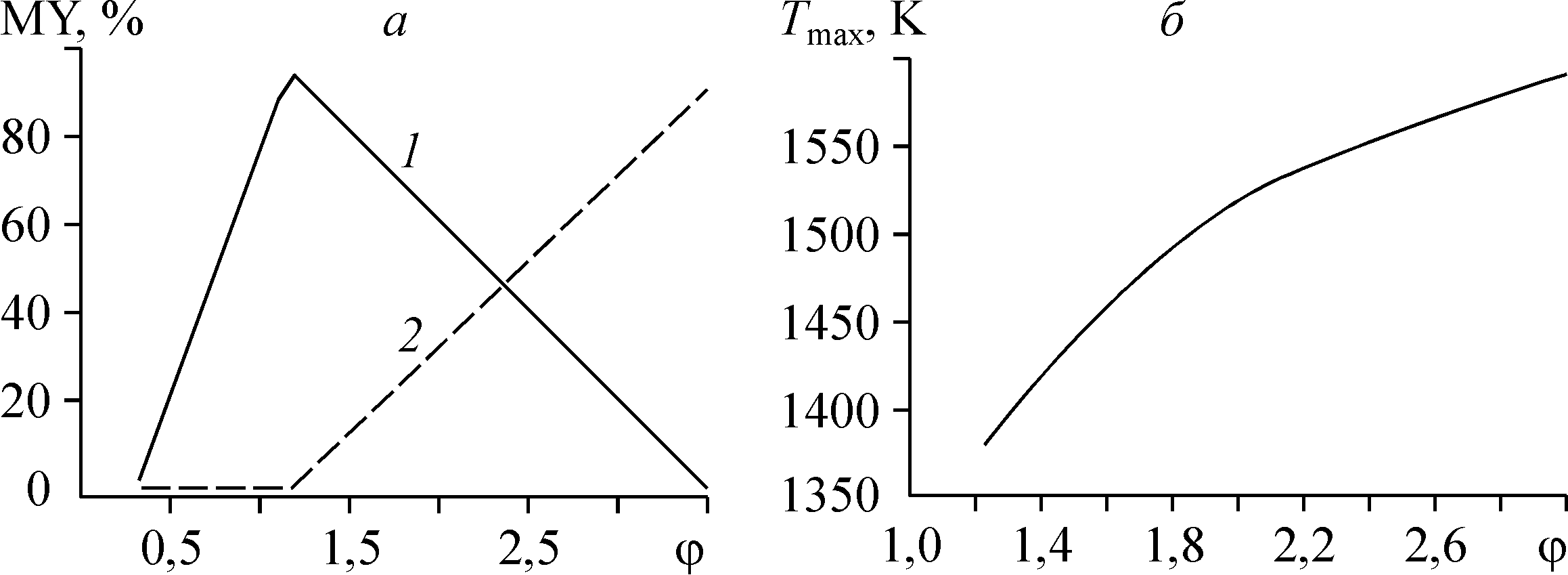Научные основы субхлоридной комплексной переработки нещелочного сырья на примере титаномагнетитовых и ильменитовых концентратов
| Вид материала | Автореферат |
СодержаниеT = 1060 K представлены на рис. 10(а |
- Физико-химические и технологические основы повышения эффективности комплексной переработки, 851.1kb.
- Программа вступительного экзамена в магистратуру по специальности 1-49 80 04 технология, 305.31kb.
- Технология приготовления спиртосодержащего сырья, 513.11kb.
- Организация переработки мяса в сельскохозяйственных потребительских кооперативах характеристика, 1223.51kb.
- Программа дисциплины по кафедре «Строительные и дорожные машины» Обогащение полезных, 211.66kb.
- Задачи рфа: анализ сырья, концентратов, готовой продукции, вспомогательных материалов, 108.85kb.
- Стандартизация и контроль качества лекарственного растительного сырья стандартизация, 615.33kb.
- Стандартизация и контроль качества лекарственного растительного сырья стандартизация, 613.27kb.
- Правила промышленной безопасности для взрывопожароопасных производственных объектов, 1408.48kb.
- Правила промышленной безопасности для взрывопожароопасных производственных объектов, 1414.3kb.
«Субхлоридное восстановление кремния» показано, что тетрахлорид кремния может быть восстановлен при атмосферном давлении в газовом потоке парами субхлорида алюминия в широком диапазоне температур в реакции (φ=1): 0.5SiCl4 + φAlCl 0.5Si + AlCl3 (рис.4(а)). Восстановитель (AlCl) можно получать очень высокой чистоты восстановлением алюминием его хлорида, что используется на практике для рафинирования алюминия до уровня 99,999997÷99,9999 % Al. В результате, основная задача сводится к получению кремния без примеси алюминия, который, хотя и не образует с кремнием химического соединения, хорошо растворяется в нем. Ранее было установлено, что осаждение пленки кремния сублимацией легированного алюминием образца позволяет получать пленку, обладающую улучшенными электрическими характеристиками. Добавки Al оказывают геттерирующие воздействие на примеси и облегчают условия для кристаллизации кремния при напылении, что ведет к увеличению размера зерен осаждаемого кремния. Максимальный размер зерен 1÷5 мкм наблюдается в ходе осаждения кремния с добавками алюминия при T~850K. Возможной причиной улучшения электрических свойств кремния, легированного алюминием, называется пассивация границ зерен за счет значительной диффузии Al из внутренних областей зерен к их границам, и сегрегированием на поверхности роста поступающего извне алюминия при температуре эвтектики Al-Si (850K).
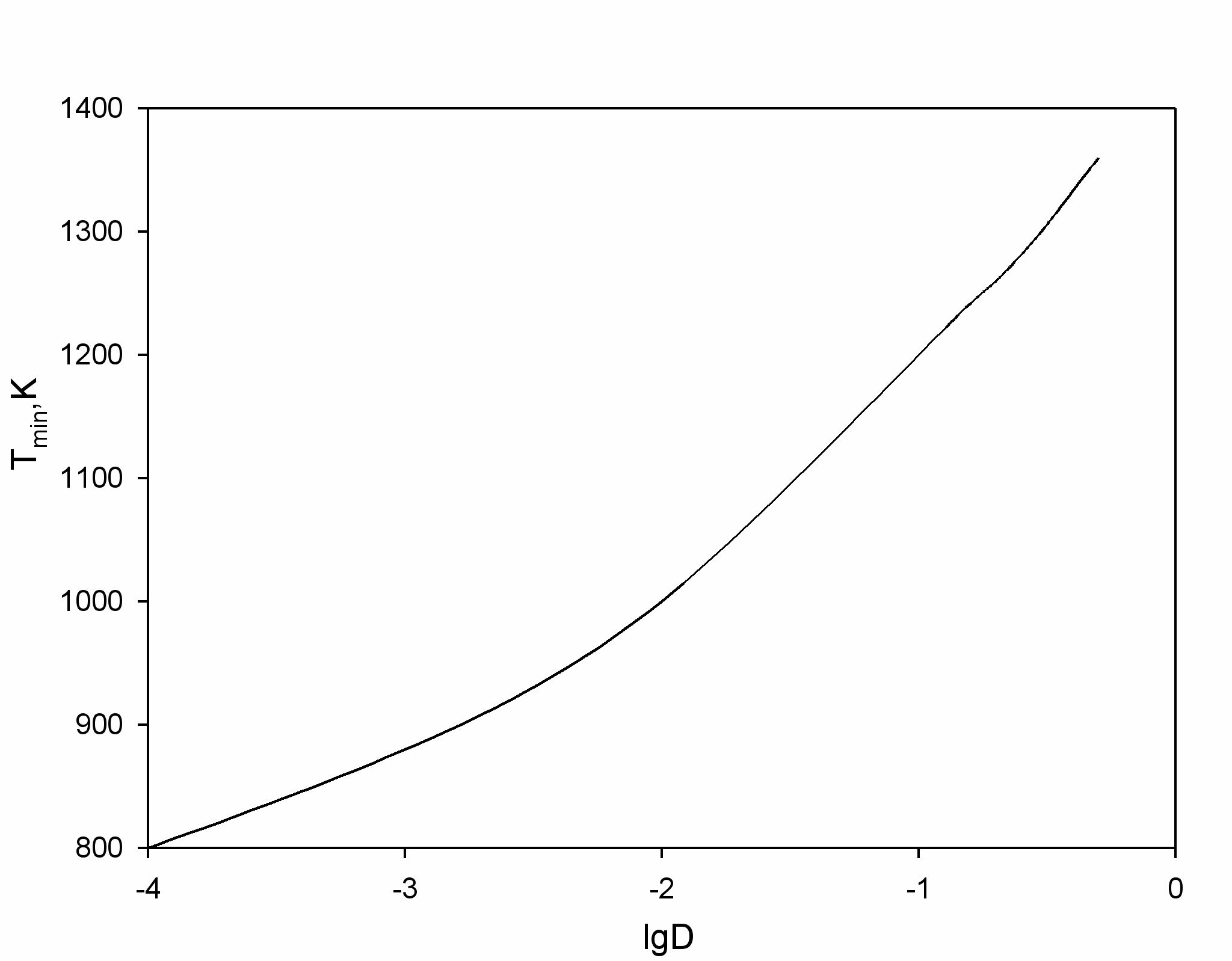
В диссертационной работе проведен анализ зависимости количества выпадающего совместно с кремнием алюминия в зависимости от избытка восстановителя D = (φ-1) > 0. Оказывается, что его количество может составлять долю, по максимуму равную 2/3D от исходного содержания алюминия в монохлориде. При D < 0 пары хлорида кремния должны вытравливать алюминий, осажденный в результате диспропорционирования AlCl. Расчеты в приближении простых веществ показывают, что выделение алюминия при D > 0 запрещено при температурах, выше Tmin (рис.4(б)). В эксперименте при P=0,1 МПа, T=1173K и D < 0 субхлоридным восстановлением паров SiCl4 нами был осажден кремний (рис.5).
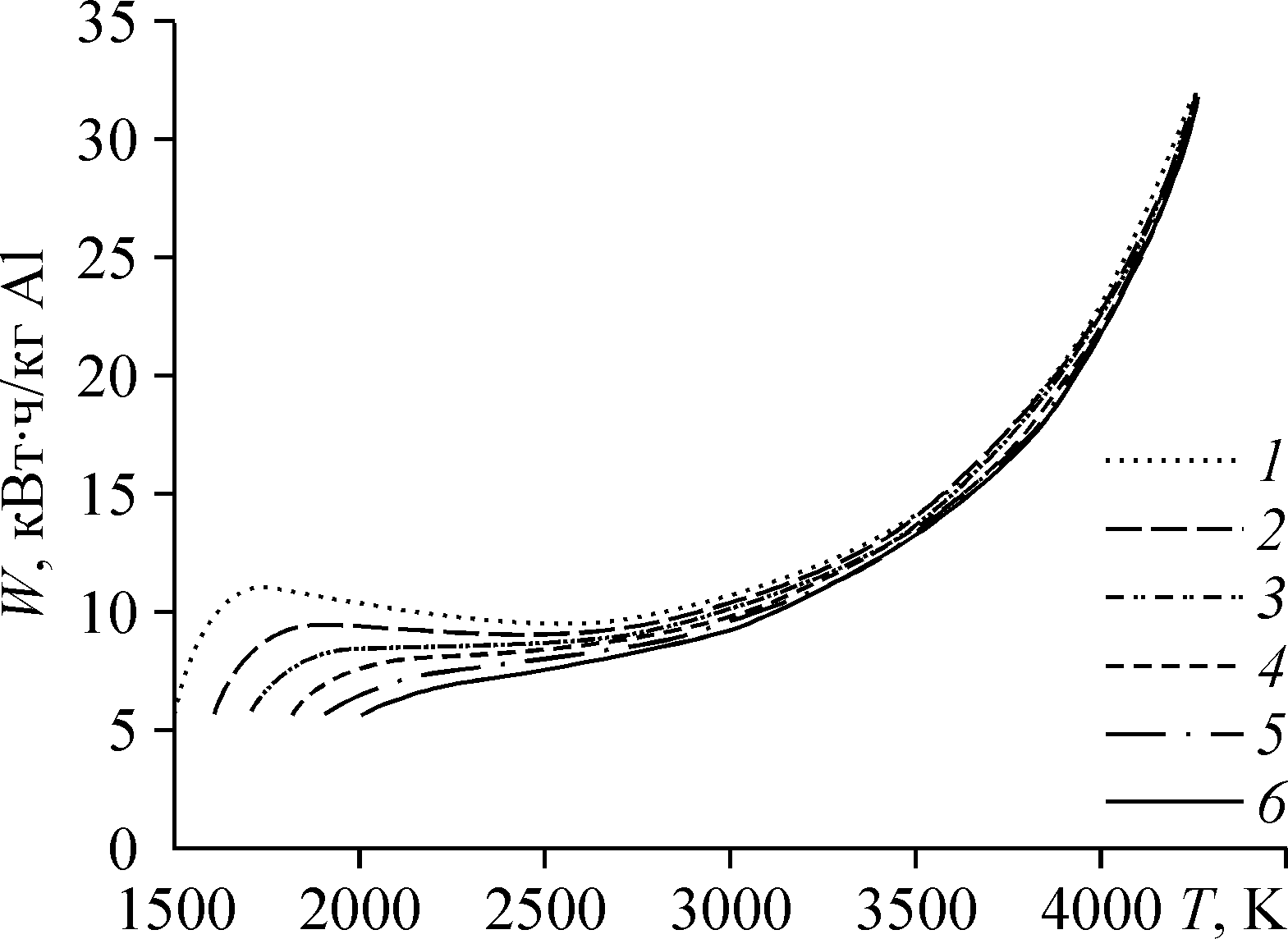
5. Другим, кроме кремния, попутным продуктом при переработке титановых концентратов, может быть алюминий, доли которого от титана, как и ванадия, в титаномагнетитах, например, месторождения Юго-Восточная Гремяха-Вымес, достаточно для синтеза наиболее популярного сплава Ti-6Al-4V. Следует отметить, что содержание Al относительно титана много больше в высокожелезистых бокситах Красноярского края. По этой причине экстракция Al из титановых концентратов и руд представляет практический интерес, равно как и энергоэффективное восстановление его хлорида. В разделе «Термодинамика субхлоридного восстановления алюминия» показано, что помимо известного способа электролизного восстановления AlCl3 возможно применение плазменно-водородного способа восстановления по эндоэргической реакции: AlCl3 + H2 AlCl + 2HCl с меньшими электрической энергии и большей удельной производительностью. Для получения алюминия выделенный из потока AlCl далее должен подвергаться диспропорционированию по экзотермической реакции: AlCl 2/3Al + 1/3AlCl3. Затраты электроэнергии по сравнению с известным плазмотермическим при T~6000K способом разложения AlCl3, в данном случае снижаются за счет четырех факторов: (1) использования восстановителя (при температуре 6000K водород не способен восстанавливать хлориды), (2) повышения к.п.д. объемного энерговклада электродугового разряда в зону реакции, который до 4000K близок к 100%, а при более высоких температурах резко падает, (3) предварительного подогрева AlCl3 дымовыми газами и (4) высокой скорости закалки AlClx. В результате удельные затраты электрической энергии (рис.6) можно снизить в 1.5 и более раз по сравнению с традиционным электролизом в криолитглиноземных расплавах.
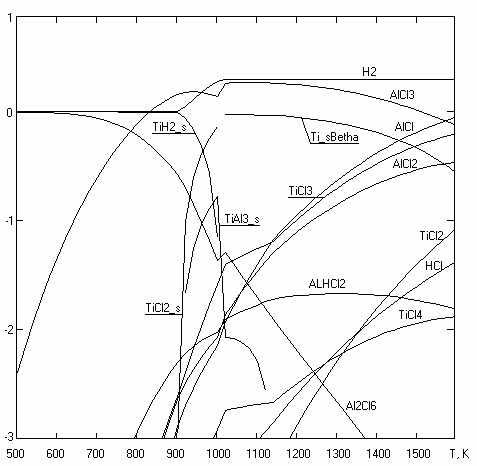
6. Извлекаемые из титановых концентратов в виде хлоридов Ti, Si, V могут быть восстановлены с помощью субхлорида алюминия. Это же относится и к железу, хлорид которого, тем не менее, экономичнее восстанавливать водородом. В главе «Субхлоридный синтез соединений внедрения титана» показано, что используя субхлорид алюминия можно вести синтез, в частности, соединений внедрения титана (TiH2, TiC, TiN, TiB2). Для металлургии титана это имеет важное значение по двум причинам: синтез (1) расширяет номенклатуру выпускаемых продуктов из титановых концентратов, и (2) позволяет восстанавливать титан из его тетрахлорида в иных, более мягких по температуре условиях. Как видно из рис.1, субхлоридное восстановление титана носит пороговый характер. В отличие от магниетермии, где термодинамика позволяет восстанавливать TiCl4 до металла даже при комнатной температуре, алюминотермия требует температуры выше пороговой (T>1000K) и, как следствие, закалки продуктов восстановления. В диссертационной работе предлагается обойти это температурное ограничение в реакции восстановления с помощью субхлоридного синтеза. Он основан на том, что, в отличие от кристаллического титана, его соединения внедрения имеют отрицательную свободную энергию образования как при низких, так, за исключением TiH2, и при высоких температурах. Результаты термодинамического расчета (рис.7) свидетельствуют, что в токе водорода реакция субхлоридного восстановления титана при T<1000K идет без образования TiCl2: TiCl4 + 2AlCl +H2 TiH2 + 2AlCl3 T<1000K (1) TiCl4 + 4/3Al + H2 TiH2 + 4/3AlCl3 T<1000K (1') Из уравнений 1 и 1' и свойств TiH2 следует, что титан можно получать алюминотермией при T<1000K в две стадии. На первой – восстанавливать пары TiCl4 до гидрида титана субхлоридом алюминия в токе водорода, на второй - нагревом до T>650K в инертной среде или вакууме термическим разложением гидрида выделять из него металлический титан. В реакции 1 все три исходных реагента при атмосферном давлении находятся в газовой фазе1, что обеспечивает возможность получения ультрадисперсных порошков TiH2. Следует отметить, что глубокого дегидрирования титана, используемого в конструкционных сплавах с присутствием алюминия, не требуется, поскольку примеси водорода в них улучшают их механические свойства.
Субхлоридный синтез из TiCl4 тугоплавких соединений внедрения титана характеризуется высокой константой равновесия, которая заметно снижается только за пределами указанного ниже оптимального для синтеза температурного диапазона: TiCl4 + 0.5N2 + 2AlCl TiN + 2AlCl3 T < 1500K (2) TiCl4 + NH3 + 2AlCl TiN + 2AlCl3 +1,5H2 T < 1500K (3) TiCl4 + CH4 + 2AlCl TiC + 2AlCl3 + 2H2 T < 2000K (4) TiСl4 + CCl4 + 4AlCl TiC + 4AlCl3 T < 2000K (5) TiCl4 + 2BCl3 + 5AlCl TiB2 + 5AlCl3 T < 1500K (6) Ультрадисперсные тугоплавкие соединения титана используются для дисперсионного упрочнения материалов, поскольку наибольший эффект достигается при размере частиц упрочняющей фазы 10÷50 нм. Известный плазмохимический хлоридно-водородный синтез нанодисперсных порошков TiN при T~500К идет с заметным выходом только при большом избытке азота и водорода в реакционной смеси TiCl4:H2:N2=1:200:50, тогда как реакции 2 и 3 разрешены термодинамикой при любых практически интересных температурах ниже 1500K при стехиометрическом соотношении реагентов (рис. 8). На рис. 9 показана пленка TiN, синтезированная субхлоридным способом при T=873К. Карбид титана реакцией паров его тетрахлорида с метаном можно получить с выходом, близким к 100%, лишь при T>2000K и соотношении TiCl4:CH4:H2=1:1:8. Для субхлоридного синтеза TiC (реакции 4,5) термодинамика не устанавливает нижний температурный предел. Это же относится и к синтезу TiB2 по реакции 6, в то время как плазмохимический синтез в смеси TiCl4:BCl3:H2 = 1:2:10 характеризуется экстремальной зависимостью выхода TiB2 от температуры с максимумом 72% при T~2100K. Субхлоридный синтез тугоплавких соединений в газовой фазе позволяет осаждать пленки и порошки, контролируемый элементный состав которых может варьироваться в широких пределах. 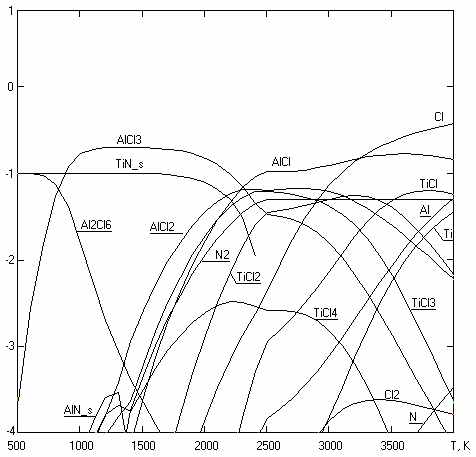 Рисунок 8. Логарифм мольных концентраций продуктов взаимодействия исходной смеси 0.1TiCl4 + 0.2AlCl +0.05N2; P=0.1МПа. Синтез можно проводить, используя восстановительные свойства субхлоридов различных элементов: 3SiCl4 + 2N2 + 6AlCl Si3N4 + 6AlCl3 T < 1500K 3AlCl + N2 2AlN + AlCl3 T <1500K 4TiCl3 + 1/2N2 TiN + 3TiCl4 650< T <1250K VCl4 + 0.5N2 + 2SiCl2 VN + 2SiCl4 900 Использование TiCl3 в качестве восстановителя может оказаться перспективным для крупнотоннажного производства, поскольку, в отличие от плазменно-водородного способа получения субхлорида алюминия, регенерация TiCl3 водородом идет при более низких температурах, не требует прямых затрат электрической энергии, и не сопровождается синтезом хлорводородных производных, как при водородной регенерации SiCl2.
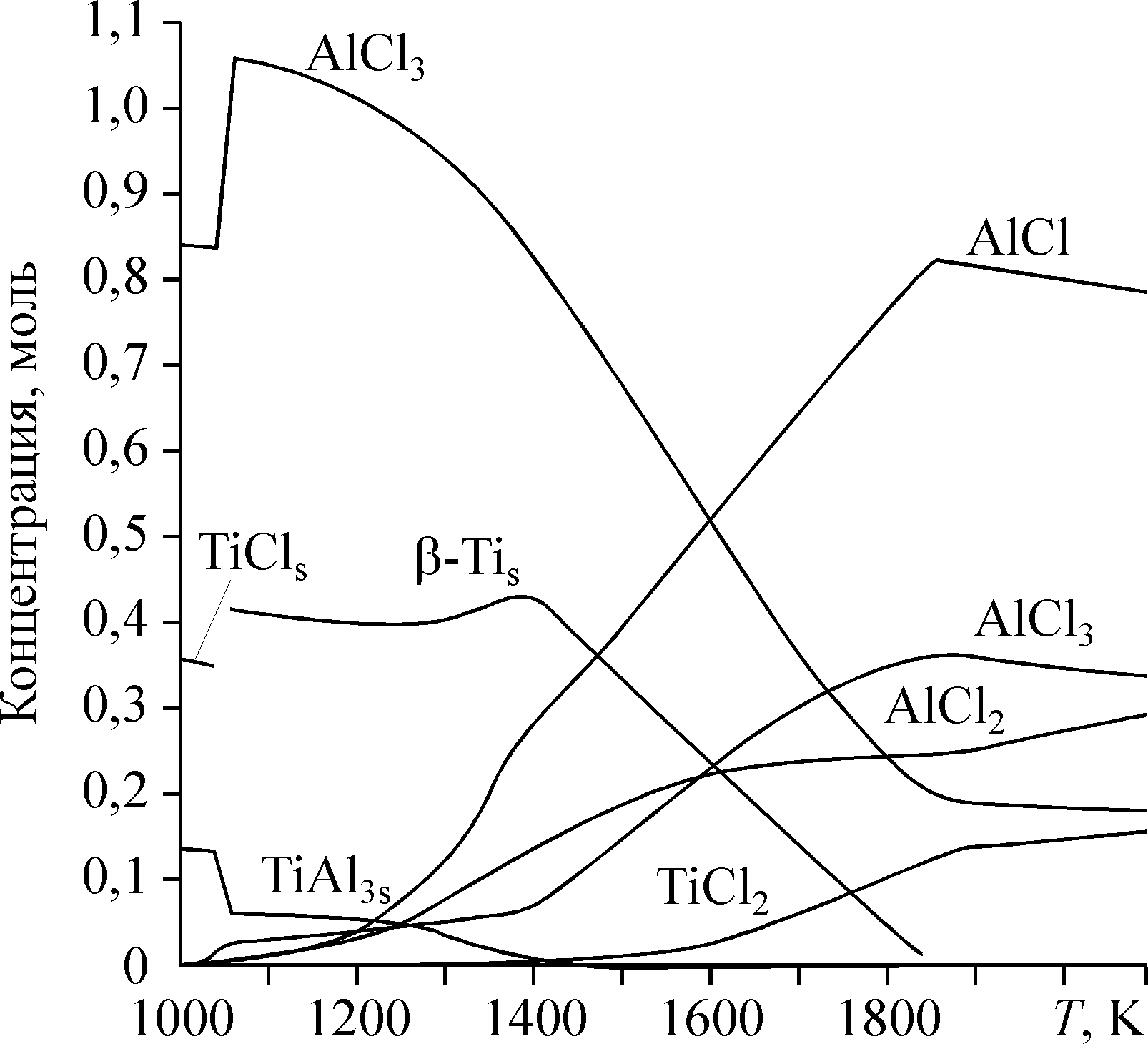
Значения выхода титана2 MY в составе чистого металла и алюминида в зависимости от параметра φ для T = 1060 K представлены на рис. 10(а). При φ > 1 выход титана в диапазоне 1000—1100 K линейно падает, а выход титана в составе TiAl3 растет и достигает максимума при φ = 3. При φ > 3 металлический титан в оптимальном температурном диапазоне (1000—1100 K) не образуется. Его образование идет при T ~ 1600 K, когда термодинамически запрещено образование алюминида. Этим объясняется наличие второго максимума на кривой концентрации Ti (T = 1380 K, рис. 11). То, что восстановление титана идет при температурах, при которых существование металлического Al (T > 1340 K) и TiAl3 (T > 1600 K) в присутствии хлорсодержащих газов термодинамически запрещено, подтверждает вывод о том, что не только алюминий, но и субхлорид алюминия обладает восстановительными свойствами. На рис. 10(б) изображен график температуры второго максимума концентрации металлического титана в зависимости от параметра φ. Температура, при которой в продуктах реакции существует только металлический титан даже в присутствии большого количества субхлорида алюминия в исходной смеси, увеличивается с ростом φ. При этой температуре выход титана не падает ниже 80 % даже для φ > 3. Таким образом, при фиксированных давлении и концентрации инертного газа состав конденсированной фазы в исследуемом диапазоне определяется параметрами φ и T. Варьируя их, можно менять соотношение Al/Ti в металле в широком диапазоне значений. На рис. 11 в качестве примера показана пленка титана без заметных примесей алюминия, нанесенная субхлоридным способом. Третий независимый параметр, который влияет на состав продуктов, — концентрация инертного газа. Ее увеличение сдвигает характерные особенности процесса, связанные с газовой фазой, в низкотемпературную область.
Предлагаемая в работе селективная хлоридовозгонка основана на различии термодинамических характеристик минералов, входящих в состав руд и концентратов, и макрокинетических скоростей реакций их хлорирования. Подбором температуры, состава реагентов, подаваемых на хлорирование, времени хлорирования можно селективно извлекать основные целевые компоненты из титановых концентратов. Вместо традиционного электродугового восстановительного переплава ильменитового концентрата с получением титановых шлаков, в диссертационной работе предлагается селективная отгонка железа (эффективность 98.6%), которая позволяет получать концентрат TiO2 (~90%) в форме искусственного рутила, пригодного для последующего восстановительного хлорирования с минимальным загрязнением TiCl4 хлоридами железа и оксихлорида ванадия. Селективная хлоридовозгонка железа из титаномагнетитовых концентратов (эффективность 99,4%) позволяет попутно с железом извлекать ванадий без восстановительной плавки, без заметных потерь титана и при любом его содержании, в то время как традиционная технология предполагает восстановительную доменную плавку концентратов только с пониженным содержанием титана. На рис. 13 показан продукт селективной хлоридовозгонки Малышевского ильменитового концентрата. При начальном содержании Fe2O3 25,2% через 30 минут воздействия на концентрат тока хлора его остаточное содержание не превышало 0.26%, а содержание TiO2 достигало 90%. Белизна полученного таким образом искусственного рутила не удовлетворяет требованиям к пигменту из-за остаточного содержания железа. Его оказалось невозможно извлечь хлорированием из концентрата полностью без заметных потерь титана, который, как установлено в эксперименте, подвергается возгонке в этих условиях со скоростью ~ 230 раз меньше скорости возгонки железа (раздел «Макрокинетика селективной хлоридовозгонки ИК и ТМК»). 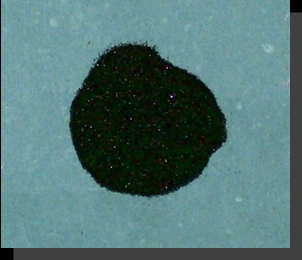  Рисунок 13. Ильменитовый концентрат до и после воздействия на него хлора в течение 30 минут при температуре 1373K. На рис. 14 приведена макрокинетика отгонки хлором железа из ильменитового и титаномагнетитового концентратов по данным весового анализа, на рис.15 – макрокинетика отгонки титана хлором без восстановителя по данным элементного анализа. Скорость хлорирования титана на начальной стадии в присутствии железа примерно в 7 раз выше, чем без него. Ранее каталитическое воздействие железа на скорость хлорирования титановых шлаков отмечалось в солевых расплавах. Отгонка железа, а вместе с ним и ванадия из титаномагнетитового концентрата Медведевского месторождения, как показали эксперименты, позволяет получать концентрат с содержанием TiO2 ~72%. При начальном содержании железа 79,2% после отгонки оно составляет 0,43%. Использование Cl2 или HCl для селективной отгонки железа не исчерпывает всех возможных вариантов селективного воздействия газообразных реагентов на концентраты. Селективно выделить титан из остающейся после отгонки железа в титаномагнетитовом концентрате смеси TiO2 + Al2O3 можно воздействием на нее летучими хлоридами алюминия по реакции: TiO2 + 4/3AlCl3 TiCl4 + 2/3Al2O3. Использование AlCl3 для хлорирования может представлять практический интерес, поскольку, помимо селективности, в данном случае традиционной хлоридовозгонке смесью CO + Cl2 нужно подвергать только оставшийся Al2O3 с использованием отработанного в промышленном масштабе способа получения хлорида алюминия из каолиновых глин. 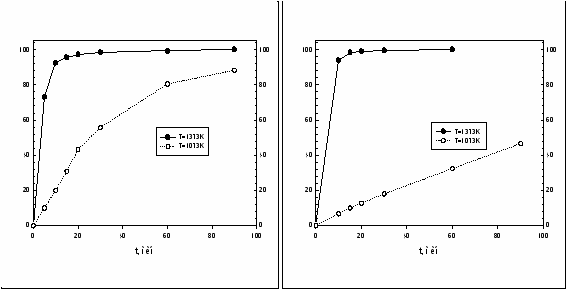 а б Рисунок 14. Кинетика (E,% по уменьшению веса порошка) хлоридовозгонки ильменитового (dE/dt = 25,603 при t=0, T=1373K) (а) и титаномагнетитового (б) концентратов. P=0.1MПа.
9. Минералы группы силлиманита, которые присутствуют в некоторых концентратах в виде примесей, практически не поддаются карбохлорированию. По разведанным рудным запасам алюминия в этих упорных алюмосиликатах Россия занимает первое место. Попытки хлорировать их парами CCl4 или смесью CO + Cl2 показали, что они теряют всего несколько процентов своего веса даже при T~1300K. По этому, в разделе «Субхлоридная безотходная возгонка силлиманитовых концентратов» на примере кианита (Al2O3*SiO2) предложен способ возгонки таких упорных минералов. Она заключается в периодическом воздействии на них субхлорида алюминия с последующим карбохлорированием восстановленного кремния и оксида алюминия. После возгонки алюминия смесью CO + Cl2 с поверхности минерала остающаяся оболочка из оксида кремния препятствует проникновению газовых реагентов вглубь твердого тела и выходу продуктов хлорирования (AlCl3, CO2) на ее поверхность. Для устранения этого препятствия предлагается восстанавливать инертную к хлору оболочку оксида кремния газофазным субхлоридом алюминия по реакции: Al2SiO5+2AlCl Si +2/3AlCl3 +5/3Al2O3 Эта реакция осуществляется в широком диапазоне температур. Твердые продукты реакции, остающиеся на поверхности макрочастицы, на следующем полуцикле подвергаются травлению хлором в присутствии CO и переходят в газовую фазу: 5/3Al2O3 + Si + 5CO + 7Cl2 10/3AlCl3 + SiCl4 + 5CO2 Цикл по восстановителю замыкается реакцией: 2/3AlCl3 + 4/3Al2AlCl Таким образом, в циклическом восстановительно-окислительном процессе при температуре ~ 1000 - 12000C происходит эффективное поверхностное травление кианита. Для его осуществления требуются затраты электрической энергии на возврат субхлорида алюминия в цикл. Ее количество имеет принципиальное значение для промышленной реализации предлагаемого метода извлечения алюминия и кремния из кианита. В работе показано, что при сбалансированном по составу кианита выпуске металлического алюминия и тетрахлорида кремния энергетические затраты на экстракцию алюминия будут примерно равны действующим в промышленности нормативам. А для получения SiCl4 - в 3÷4 раза меньше, чем при карботермическом восстановлении кварцитов. Время возгонки кианита субхлоридным способом сопоставимо со временем возгонки активного к хлорированию каолинита в традиционной технологии получения AlCl3. Предлагаемое попутное извлечение алюминия и кремния преследует цель сократить удельные затраты на экстракцию каждого из продуктов. При таком подходе технология переработки ильменитовых концентратов с экстракцией только титана и железа по существу является составной частью технологии титаномагнетитов. 10. В крупнотоннажном производстве титана ни получаемый попутно селективной возгонкой хлорид железа, ни его оксид, который можно синтезировать окислением хлорида атмосферным кислородом с возвратом хлора на стадию возгонки, не могут являться товарными продуктами, поскольку имеют ограниченную сферу применения. По этому, в главе «Комплексная переработка ильменитовых, титаномагнетитовых и нетрадиционных титановых концентратов. Энергетические и экологические вопросы комплексной переработки» показано, что для восстановления хлорида железа может быть использован как субхлорид алюминия или титана, так и водород, что по экономическим и экологическим показателям может оказаться предпочтительнее традиционных способов выплавки железа из его оксида с применением углерода или содержащих его газов (CO, CH4, …). В настоящее время основная масса металла в мире выплавляется с использованием дорогостоящего кокса. Все известные процессы в черной металлургии гетерогенны и характеризуются низкой удельной производительностью из-за медленного подвода реагентов вглубь конденсированной фазы. Как результат, металлургические предприятия чрезвычайно капиталоемки, громоздки и сильно зависимы от качества исходного сырья. Современные способы выплавки железа, включая т.н. прямое восстановление, не позволяют получать чистый по углероду и породообразующим элементам продукт. Кроме того, традиционная карботермия непригодна для переработки поликомпонентного сырья, например, титаномагнетитов с высоким содержанием титана (> 4%) из-за повышенной вязкости образующихся шлаков. Количество же монометалльного сырья неуклонно сокращается, особенно вблизи действующих металлургических производств. Для производства железа и его сплавов в разделе «Хлорид - водородная металлургия железа» предлагается использовать его хлориды – продукты селективной возгонки титанового сырья. Пары FeClx после отделения VOCl3 подвергаются водородному или субхлоридному восстановлению (или восстановительному синтезу) с получением ультрадисперсных порошков или пленок железа, его сплавов или соединений. Проведение восстановительных реакций при температуре ниже точки Кюри позволяет использовать ферромагнитные свойства железа для вывода его из потока и торможения обратных реакций. Таким способом в эксперименте были получены пленки железа (рис.16,а).
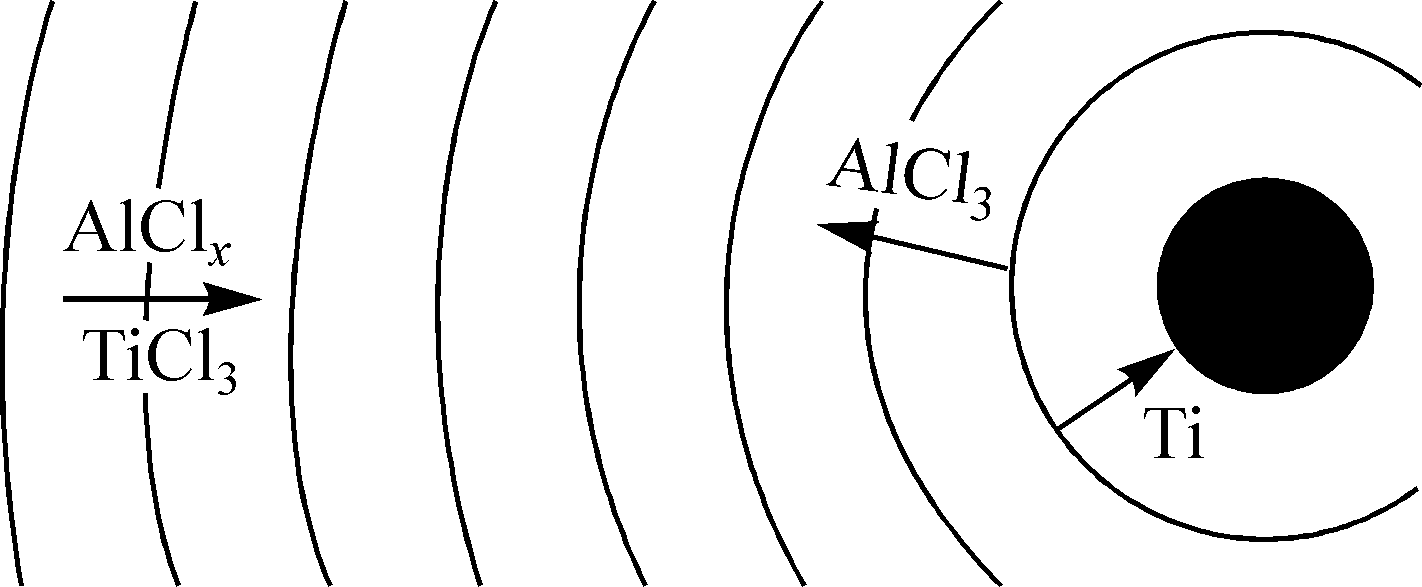
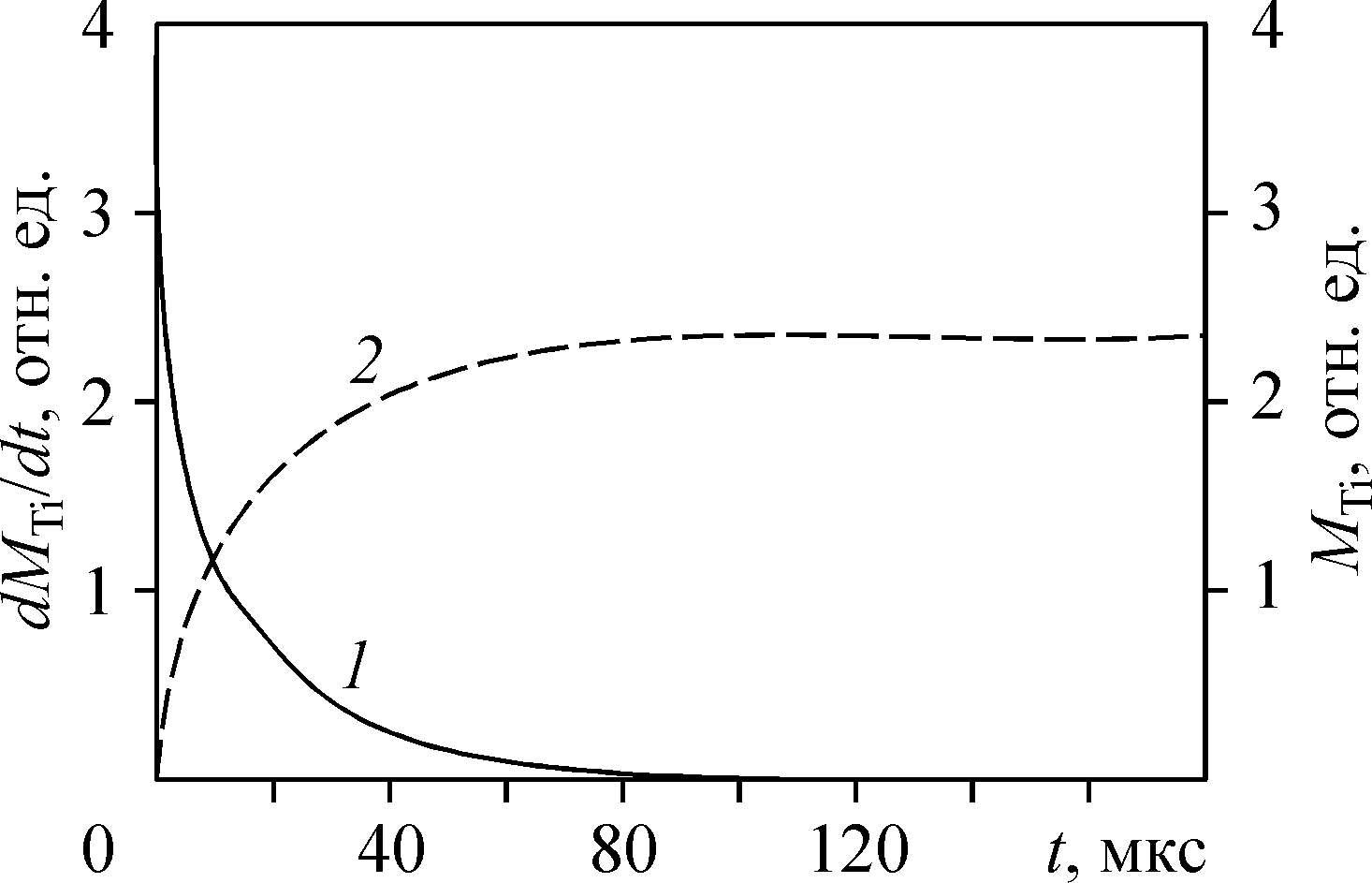
Водород эффективен и для восстановления неподвижного слоя порошка FeCl2. На рис.16(б) изображен продукт такого восстановления. Попутно образующийся гидрохлорид возвращается на стадию селективной возгонки железа: FeO*TiO2 + 2HCl FeCl2 + TiO2 + H2O или 0.5Fe2O3 + 2HCl +0.5H2 FeCl2 + 1.5H2O 11. Титаномагнетитовые и ильменитовые руды – не единственный перспективный источник титанового сырья. К нему следует отнести, например, фосфато-редкометалльные руды (~2÷4%TiO2, ~4% P2O5 в составе LaPO4), и высокожелезистые бокситы (~8%TiO2) зоны Нижнего Приангарья (Красноярский край) (раздел «Перспективы субхлоридной комплексной переработки бокситов»), в которых железо и титан содержатся в составе ильменита. Если схема переработки таких бокситов укладывается в предложенную выше схему переработки титаномагнетитов, то для фосфор - или кальцийсодержащих концентратов, например, для извлечения титана из кальций-титановых концентратов нужен дополнительный технологический передел, связывающий Ca в жидкий продукт, которые легко отделить от твердого остатка, пригодного для последующей хлоридовозгонки сырья без потерь хлора (раздел «О перспективе субхлоридной технологии для комплексной малоотходной переработки фосфатно-редкометалльного и щелочного титанового сырья»). В противном случае хлор будет связываться с кальцием, и для его рециклинга нужны затраты электроэнергии. Известно, что азотная кислота связывает кальций в кальций-титановых концентратах и дает возможность хлорировать остаток (TiO2) в замкнутом по хлору цикле. По этому, для отделения кальция была выбрана плазмохимическая азотная кислота, что позволяет попутно получать комплексные азотные удобрения, и выполнен цикл работ по производству из природного сырья удобрений с использованием азотной кислоты, полученной фиксацией атмосферного азота в неравновесной плазме. В вихревом тлеющем разряде нам удалось экспериментально продемонстрировать сокращение в 2,5 раза прямых затрат электрической энергии на синтез NO по отношению к известному с начала XX века синтезу в квазиравновесной азот-кислородной плазме. Полученная слабая (4-5%) азотная кислота использовалась для наработки опытных партий комплексных азотно-фосфорных, органо-азотнофософорных удобрений и нитрата кальция, которые были испытаны и показали высокую эффективность в сельскохозяйственных опытах. Этот процесс может встраиваться дополнительным блоком в схему переработки поликомпонентных руд и концентратов, в том числе содержащих кальций. 12. В среднем по России удельная энергоемкость металлургического производства на 20-30% выше, чем в зарубежных компаниях. По этому, повышение энергоэффективности металлургических производств – одна из важнейших задач современной металлургии. Для металлургии алюминия или, например, плазмохимического синтеза азотной кислоты из воздуха она имеет первостепенное значение. Только лимит дешевой электроэнергии ограничивают мировой объем выплавляемого алюминия. Высокие удельные энергозатраты фиксации атмосферного азота в электрическом разряде вынудили в свое время азотную промышленность перейти на аммиачный способ получения кислоты. Ее высокая цена будет сдерживать масштабное освоение титанокальциевых руд по указанной выше схеме. По некоторым оценкам, до 15-20% потребляемой промышленностью Японии электроэнергии генерируется непосредственно на предприятиях путем утилизации отходящего тепла. В связи с этим, в разделе «Минимизация затрат электроэнергии в субхлоридной металлургии» указывается на то, что газофазные металлургические экзотермические субхлоридные процессы удобны для прямого преобразования выделяющейся в ходе реакций тепловой энергии в электрическую, что позволит снизить зависимость от внешних источников. Процессы субхлоридного восстановления титана сопровождаются выделением тепловой энергии в количестве, кВт*час/кг Ti - 1,75, и в субхлоридном синтезе при температуре 960K, соединений внедрения титана в смеси субхлорида алюминия и TiCl4 с компонентами 2H2, 0.5N2, CH4, B2Cl6 соответственно, 2,67, 3,82, 2,36, 3,57. С другой стороны, для получения стехиометрического количества субхлорида алюминия, используемого в этих реакциях, необходимы прямые затраты электроэнергии 7,5 кВт*час/кг Ti. Возможны два варианта рекуперации этой электрической энергии: паротурбинный цикл с к.п.д. ~35%, и МГД-паротурбинный. Используемый на современных электростанциях газо-паротурбинный цикл (к.п.д. ~54%) в данном случае не подходит из-за химической активности газовых потоков, что запрещает их контакт с лопатками газовой турбины. В целом задача рекуперации электрической энергии в металлургическом процессе достаточно сложна и выходит за рамки диссертационной работы, однако в ней анализируется принципиальная возможность использования для этой цели токовых слоев в магнитном поле. В работе указывается, что МГД-канал может совмещать функции генератора и химического реактора. В отличие от чисто энергетических приложений токовых слоев, где температурная неоднородность создавалась мощным импульсным нагревом, в проточном субхлоридном реакторе (рис.2) локальная температурная неоднородность возникает в ходе экзотермических реакций в области повышенной концентрации зародышей титана. В свою очередь эта концентрационная неоднородность формируется периодической подачей аргона в кювету с расплавленным металлом и далее в реактор уже с потоком зародышей, сконденсировавшихся над кюветой из паров металла. 13. Изложенные выше результаты по субхлоридному восстановлению и синтезу, селективной хлоридовозгонке получены с помощью специально разработанных автором как программы термодинамических и макрокинетических расчетов, так и экспериментального оборудования, описанных в главе «Методика и программа термодинамических расчетов. Оригинальное лабораторное оборудование». Показано, что для математического моделирования макрокинетических высокотемпературных процессов в газовой фазе можно использовать интегрированный термогазодинамический (ИТГ) подход, который позволяет в приближении локального термодинамического равновесия рассчитывать в каждой точке реакционного объема химический состав и газодинамические параметры течения (температуру, скорость, давление) реагирующих потоков. Для повышения точности материального баланса при расчете равновесного химического состава вместо традиционного метода неопределенных множителей Лагранжа предложено использовать метод штрафных функций, описанный в разделе «Применение метода штрафных функций для численного решения задач химической термодинамики». Помимо точности, он больше подходит для интегрированной термо-газодинамики, т.е. для совместного численного решения уравнений тепло-массопереноса и химического состава реагирующей газовой смеси. Для этого реакционный объем разбивается на расчетные ячейки – элементарные области (ЭО), в каждой из которых химический состав рассчитывается в приближении локального термодинамического равновесия (ЛТР), а тепло- и массоперенос между ячейками - на основе уравнений газодинамики. Для высокотемпературных химико-металлургических процессов, которые лимитируются скоростью диффузионного подводи реагентов, ИТГ – подход призван облегчить составление физической модели для математического моделирования, поскольку субхлоридная металлургия Ti, Al, Si не располагает достаточно полной базой данных констант скоростей газофазных реакций, которые можно было бы использовать для численного решения кинетических уравнений совместно с уравнениями газодинамики, как это принято сегодня, например, для расчета процессов горения метана в воздухе, отягощенного синтезом окислов азота. Анализ имеющихся в литературе отрывочных данных по константам скоростей реакций, входящих в суммарную реакцию субхлоридного восстановления, показал, что при характерной температуре процесса 1000 - 1100K относительно медленными реакциями первого порядка можно пренебречь ввиду их малых констант равновесия. Так, например, реакция первого порядка TiCl3 TiCl2 + Cl при T=1100K и атмосферном давлении имеет характерное время Δt = 4,5*108сек. Наоборот, в тех же условиях характерное время реакций второго порядка, например, TiCl2 TiCl + Cl, Δt = 1,18*10–10с, или TiCl4 + H TiCl3 + HCl, Δt = 4,35*10–10с пренебрежимо мало по сравнению с характерными временами тепло- и массопереноса в газе. Это позволяет при моделировании расщепить физические процессы по временному масштабу: установление полного ЛТР в ЭО полагать практически мгновенным, а тепло- и массоперенос рассчитывать, исходя из разности интенсивных параметров на границах ЭО (раздел «Интегрированный термогазодинамический подход»). Учитывая экспоненциальную зависимость характерного времени реакции от температуры, можно утверждать, что существует температура, выше которой всегда применим ИТГ-подход. Это же относится и к минимальной концентрации реагентов в смеси. Вопреки сложившейся практике использования метода неопределенных множителей Лагранжа, для расчета равновесного состава многофазной смеси n химически реагирующих компонентов минимизацией суммарного потенциала Гиббса при заданных мольных концентрациях вводимых в систему исходных реагентов, температуре и давлении, в диссертационной работе применен метод штрафных функций по двум причинам. Во-первых, метод штрафных функций гарантирует более высокую точность массового баланса (в нашем случае она составляла 10-5-10-8%). Это имеет принципиальное значение при расчете примесей в особо чистых целевых продуктах. Во-вторых, метод штрафных функций при расчете небольшого числа компонент требует меньшего расчетного времени: время счета для метода неопределенных множителей Лагранжа пропорционально (n+m)2 (n - число компонентов, m-число элементов в системе), для метода штрафных функций – n2. В результате для макрокинетики роста макрочастицы титана при субхлоридном восстановлении выигрыш по времени счета составил (n+m)2/n2 ~ 2 раза. Это имеет важное значение в ИТГ-подходе, где химический состав считается на каждом временном слое в каждой ячейке (ЭО). В расчетах использованы открытые термодинамические данные Национального института стандартов и технологии США (NIST). В тех случаях, когда в базе данных NIST отсутствуют или приведены явно ошибочные данные (например, для S3), использовалась демонстрационная часть базы данных ИВТАНТЕРМО, недостающие значения вводились из базы данных NASA Glenn Research Center, научной литературы и ссылка скрыта Sandia National Laboratories. В работе сформулированы условия, при которых наблюдаемая (макрокинетическая) скорость химических реакций второго порядка будет определяться скоростью диффузионного подвода реагентов к поверхности и, соответственно, становится применим ИТГ-подход: 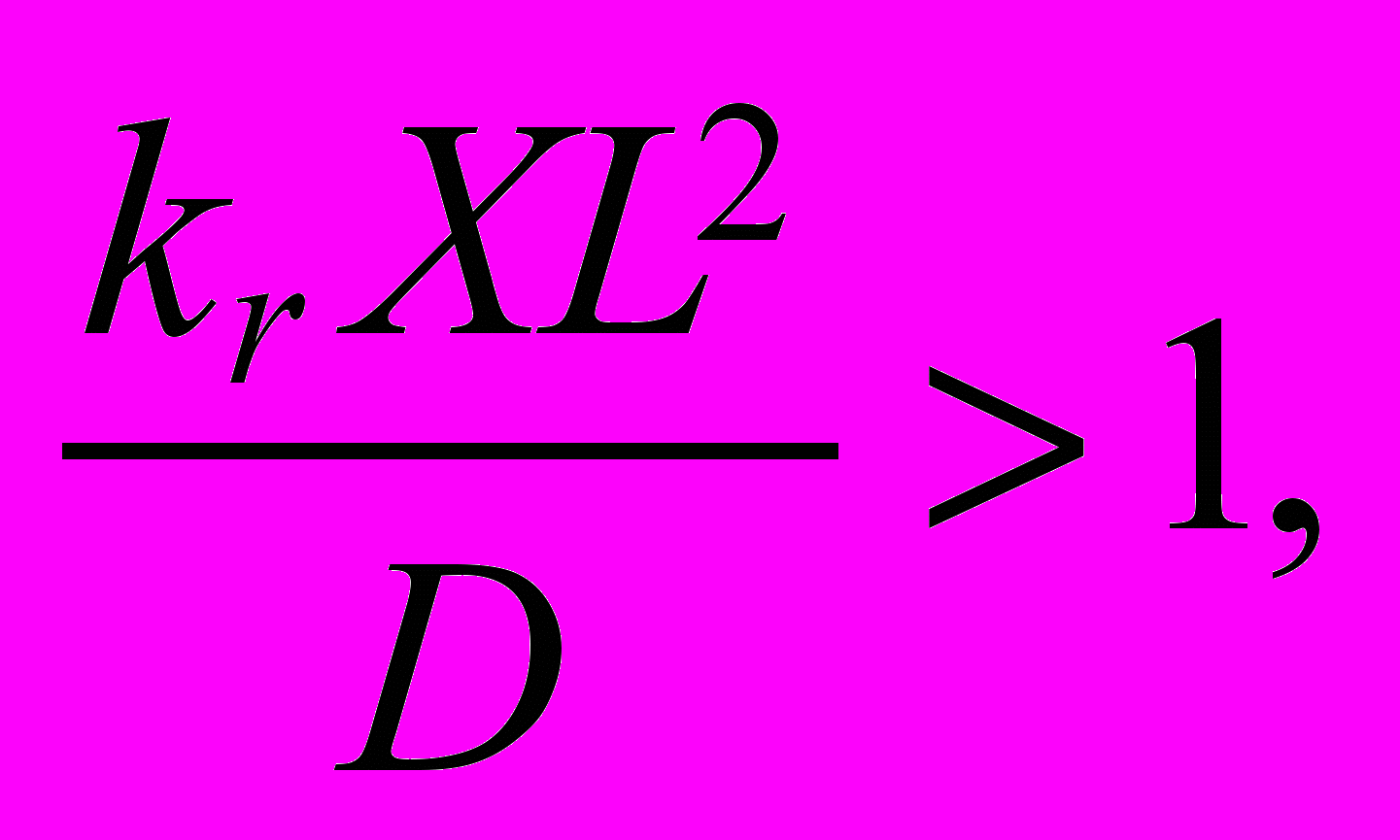 где D, L, X, kr — соответственно коэффициент массовой диффузии, характерный пространственный размер неоднородности концентрации реагентов, мольная концентрация реагентов, константа скорости самой медленной реакции второго порядка из набора практически реализуемых в данной задаче с константой равновесия много больше 1. где D, L, X, kr — соответственно коэффициент массовой диффузии, характерный пространственный размер неоднородности концентрации реагентов, мольная концентрация реагентов, константа скорости самой медленной реакции второго порядка из набора практически реализуемых в данной задаче с константой равновесия много больше 1.ИТГ-подход предполагает разбиение расчетной области на ячейки с линейными размерами LЭО > (D/krX)1/2. На такой пространственной сетке в работе был проведен расчет диффузионной кинетики реакции субхлоридного восстановления титана вблизи сферической частицы-зародыша. Цель расчета — определить скорость увеличения массы зародыша и связанную с этим удельную производительность реактора. Нагретая исходная смесь AlCl, TiCl4, Ar равномерно по объему запыляется N зародышами с r >> rc. Объем реактора разбивался на N одинаковых ячеек, аппроксимированных для простоты сферическими объемами радиуса L с металлическим зародышем в центре. В свою очередь, этот сферический объем разбивался на ряд полых сфер (ЭО) толщиной dr ~ LЭО << L. Равновесные значения концентраций химических компонентов в ЭО рассчитывались путем минимизации суммарной энергии Гиббса. Задача решалась в двух вариантах: с фиксированной температурой металла, что соответствует осаждению титана на термостатированную подложку, и с зародышем, температура которого определяется конкуренцией процессов выделения в нем энергии конденсации, теплоподвода и теплоотдачи избыточного тепла в окружающую среду. Установлено, что во втором варианте с целью эффективного отвода тепла от зародыша и удержания его температуры в оптимальном диапазоне, мольная концентрация инертного газа (Ar), выполняющего функцию термостата, должна быть как минимум на порядок больше концентрации остальных компонентов исходной газовой смеси. На рис. 17(а) показан фрагмент расчетной области — сферического объема с шагом dr разбитого на полые сферы (ЭО) с титановым зародышем в центре. В ближайшей к зародышу сфере осуществляется реакция восстановления TiCl3. Образующиеся атомы Ti осаждаются на металлической поверхности. Временная динамика прироста массы зародыша (М) и скорости осаждения этой массы (dM/dt) приведены на рис. 17(б). Поскольку процесс лимитируется диффузионным подводом реагентов к реакционной зоне в пленке вокруг зародыша, а общее количество титана в его хлоридах в выделенной сфере вокруг зародыша фиксировано, скорость осаждения быстро падает до нуля, а 99 % титана, первоначально сконцентрированного в сфере радиусом 50 мкм, осаждается за 88 мкс. Это соответствует производительности реактора ~1 кг Ti/(м3с).
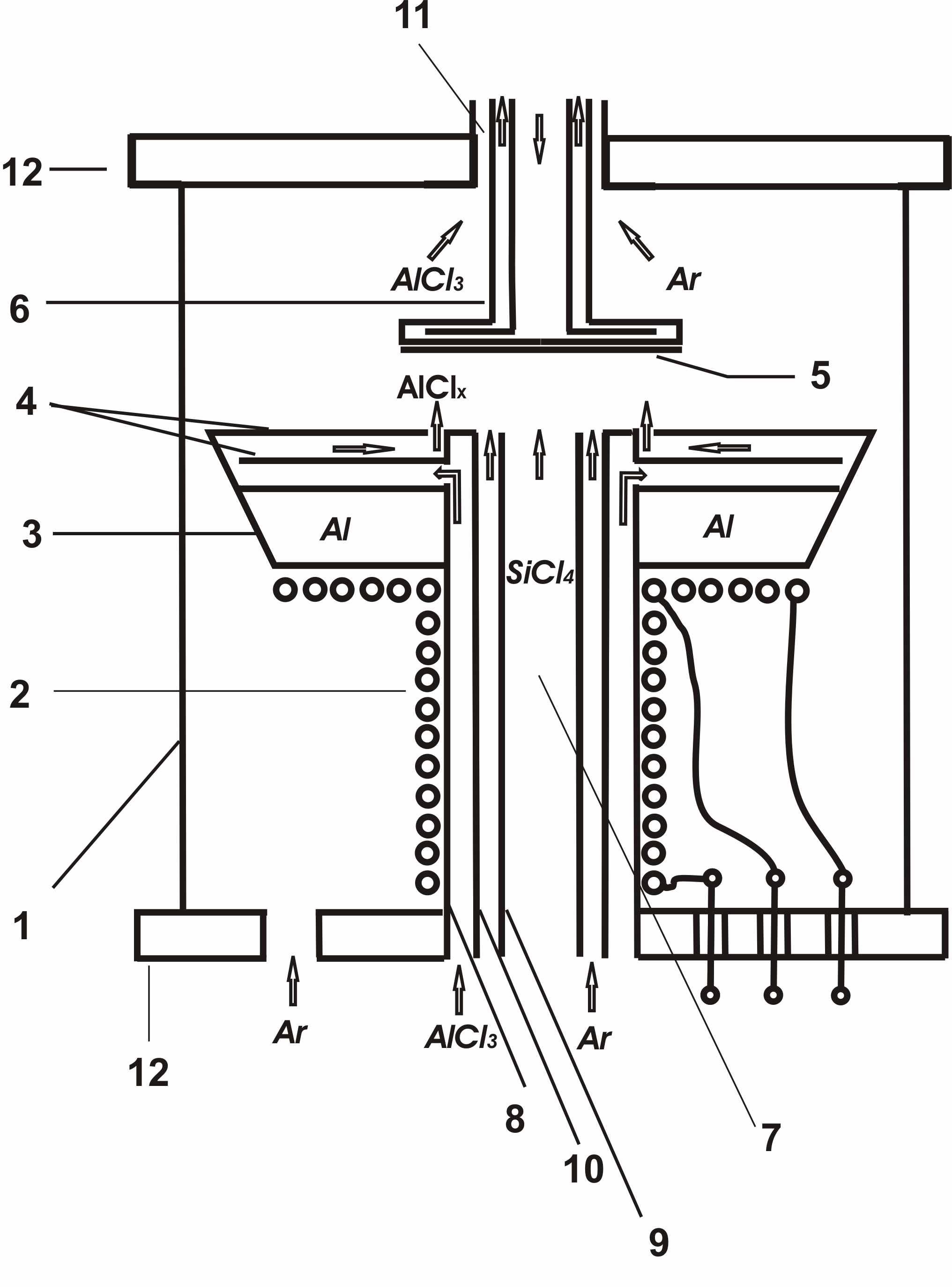
14. Для экспериментального изучения описанных выше субхлоридного процессов восстановления TiCl4, SiCl4 был разработан, изготовлен и запатентован реактор для осуществления субхлоридных реакций восстановления кремния и титана (рис.18), описанный в разделе «Лабораторное оборудование для субхлоридных процессов». Установлено, что целесообразно использовать проточный химический реактор, состоящий как минимум из двух пространственно разнесенных по потоку зон для предотвращения выпадения алюминия в продуктах. В первой зоне (кювете 3 с расплавленным алюминием) проводится восстановление алюминием его хлорида, во второй – субхлоридное восстановление или синтез. Этот же принцип был использован для разработки и изготовления плазмохимического реактора для субхлоридных процессов, в котором синтез AlClx осуществляется с использованием низкотемпературной электродуговой плазмы V-плазмотрона, что позволяет многократно увеличить удельную производительность узла, генерирующего субхлорид алюминия. Проанализирована стойкость конструкционных материалов в окислительно-восстановительной среде Cl2, AlClx, TiClx, SiClx, Al, Ti, Si. На основании термодинамических расчетов, анализа литературных данных и лабораторного эксперимента установлено, что единственным стойким до T<1900K материалом в этих средах является материал (покрытие) на основе Al2O3: керамика или лейкосапфир (корунд).
Для других конструкционных материалов найдена предельная температура, до которой возможна их эксплуатация в окислительной и/или восстановительной среде в субхлоридной металлургии титана, алюминия, кремния. В заключение следует отметить, что изложенные в работе научные основы субхлоридной комплексной переработки ильменитовых и титаномагнетитовых руд и концентратов дают возможность более широкого толкования комплексности переработки поликомпонентного сырья. Показана принципиальная возможность малоотходной переработки концентратов в замкнутом по хлору цикле. В том числе, в присутствии упорных к хлорированию алюмосиликатов, фосфор - и кальцийсодержащих минералов. И с минимальными затратами электроэнергии за счет исключения из технологии сильно экзотермических реакций магние- и натриетермии, замены электролизного способа восстановления алюминия плазменно-водородным восстановлением AlCl3, рекуперации электроэнергии за счет прямой трансформации высокоэнтальпийного тепла субхлоридных реакций синтеза и восстановления. | |||||||||||||||||||||||||||||||

 б
б