Приложение 1 Знание только тогда знание, когда приобретено усилием мысли, а не памятью
| Вид материала | Закон |
- Проектно-исcледовательская деятельность учащихся на уроках литературы, 186.24kb.
- Технология проблемного обучения, 546.42kb.
- Публичный доклад директора моу сош №2 п. Спирово Тверской области, 274.22kb.
- Тема знание до цивилизаций и знание первых цивилизаций, 176.47kb.
- Образования Общества «Знание», 68.41kb.
- Образования Общества «Знание», 48.13kb.
- И что спасительнее быть может, как, поучаясь в делах Господних, на высокий славы Его, 779.65kb.
- Цель: Обобщить и систематизировать знания о топографическом плане и географической, 51.45kb.
- 1. Мифологическое знание, представляя собой минимальный набор данных, необходимых для, 15.99kb.
- Менеджер фронт-офиса, 5.46kb.
Орлова Ольга Дмитриевна
Приложение 1
Знание только тогда знание, когда приобретено усилием мысли, а не памятью. Л.Н. Толстой
Исходя из основной цели образования – воспитание творческой личности учащегося, способности к саморазвитию, самосовершенствованию – в качестве приоритетного подхода в обучении и воспитании может стать поисково-исследовательский подход. Практика показывает, что без целенаправленной организации учебной, исследовательской деятельности учащихся формирование и развитие соответствующих навыков идет очень медленно.
По мнению С. Соловейчика, есть три силы, заставляющих детей учиться: послушание, увлечение и цель. Послушание подталкивает, цель манит, а увлечение движет. Если дети равнодушны к предмету, то увлечение становится тяжелой повинностью. Поэтому не случайно, каждый учитель в процессе своей деятельности стремится решить вопросы: как учить с увлечение, как сделать радостным и творческим процесс познания, как подтолкнуть ученика к самостоятельному “добыванию” знаний.
Как видно из вышеуказанного, один из способов решения этого вопроса – организация на уроке проблемно поисковой деятельности учащихся. Эта деятельности по сравнению с другими имеет ряд преимуществ: 1) усиливает познавательный интерес учащихся, 2) способствует получению более глубоких знаний и показывает их прикладную направленность, 3) развивает умение творчески мыслить, 4) позволяет максимально направить учащихся на овладение мысленными примами.
Основная цель проведения исследовательских уроков, организации творческой работы учащихся заключается в том, чтобы повысить качество усвоенных знаний, дать возможность применять их на практике, иметь всегда обоснованную точку зрения, критическое мышление – то есть стать “конкурентноспособной” личностью в условиях стремительного развития науки и техники.
Закон Кларка гласит: «Единственный способ установить границы возможного – это выйти за них в невозможность».
Качество усвоения знаний проявляется в следующих этапах (рис.) и одним из важнейших является “Знание-творчество”, которое невозможно развивать без проведения самостоятельной исследовательской работы учащихся, без освоения ими методик основных мыслительных процессов.


Знание-убеждение
З

 нание-
нание-Творчество (исследование!)


З
 нание-
нание-применение
З

 нание-
нание-Понимание


Знание-
воспроизведение
Исследовательская деятельность учащихся - творческий процесс совместной деятельности двух субъектов (двух личностей) по поиску решения неизвестного, результатом которого является формирование мировоззрения. В исследование происходит не пассивное восприятие сведений, а активное взаимодействие, благодаря выполнению конкретно-функциональных обязанностей каждого из участвующих сторон: активность учителя и ученика, самостоятельность “идущего за ведущим”.
Учителю приходится решать непростую задачу нахождения баланса между соблюдением научной традиции исследования и новизной, неординарностью и жизненностью поставленного вопроса. Решение такой задачи создает не менее, а более творческую проблему для учителя. Самое важное для учителя – это не проложить и отработать “работающий” путь в своей деятельности и зафиксировать его, а постоянно отвергать наработки, иначе будет теряться собственный интерес к исследовательской деятельности.
Внутренняя мотивация и интерес к проблеме исследования у самого педагога – основа успеха реализации исследовательской деятельности учащимися.
Приложение 2
Последовательные этапы составления схемы
«Химический состав растений»
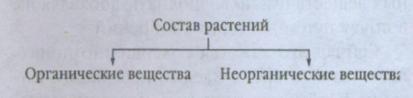
Часть 1.
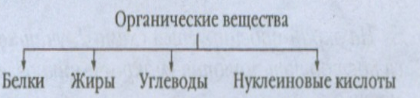
Часть 2.

Часть 3.
Окончательный вид схемы
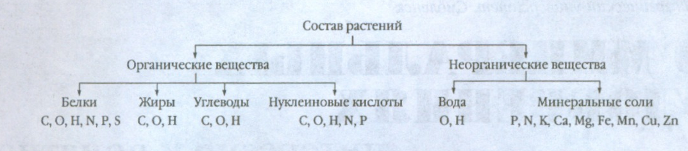
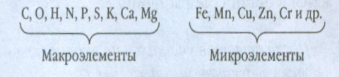
Приложение 3
Огородные «забавы» Д.И.Менделеева
Как рассказывают историки, в 1865 году произошел поворот в отношении Д.И.Менделеева к естественным наукам. Его научное творчество получило, наряду с теоретическим, и практическое направление. Зимой 1865 - 1866 года Менделеев обдумывал свои возможности, советовался с коллегами и друзьями, обсуждал варианты проведения сельскохозяйственных опытов в своем имении Боблово, под Москвой. И уже летом присмотрел в северном углу имения заброшенный участок, давно не удобрявшийся навозом. Он – то, как раз хорошо и подходил для опытов.
Поле было разбито на три делянки и вспахано. В это же время был приобретен необходимый инвентарь, прикупили и лошадей. Самым трудным было приобретение веществ необходимых для питания растений. Их тогда в России не производили. И Дмитрий Иванович решил развернуть настоящее производство у себя в усадьбе. Он нанял крестьян, которые скупали во всей округе кости забитого скота и привозили в специально отведенный угол имения. Здесь кости обжигали, толкли и просеивали. Затем смешивали с серной кислотой и получали дигидрофосфат кальция. В тоже время местные крестьяне и ребятишки, за плату прочищая лес, складывали в кучу сучья лиственных деревьев и сжигали. Полученную золу, содержащую соли калия, несложной обработкой превращали в поташ – карбонат калия. Печную золу Менделеев покупал у крестьян. Некоторые соли выписывал из Петербурга: серно – аммиачную соль, чилийскую селитру.
Приложение 4
Информационные характеристики минеральных удобрений
Натриевая селитра NaNO3 - в химически чистом виде бесцветные кристаллы, хорошо растворимые в воде. В сельском хозяйстве применяют техническую натриевую селитру представляющую собой кристаллы сероватого или желтоватого цвета. В первом сорте должно содержатся NaNO 3 - не менее 99%, влаги не более 1%, во втором соответственно 98% и 2%. Удобрение гигроскопично, при хранении слеживается, рассеиваемость удовлетворительная лишь в сухом состоянии.
Впервые это вещество стало использоваться как удобрение в 1825 г в Гамбурге.
Удобрение физиологически щелочное, поэтому целесообразно применять на кислых почвах. Входящие в состав Катины натрия обуславливают положительное действие на урожай сахарной и кормовой свеклы. Натриевую селитру также применяют в пищевой промышленности для консервирования, в металлургии, в стекольной промышленности.
Добывается из природных залежей в Чили, известна под названием чилийской селитры. В промышленности получают путем адсорбции оксилов азота раствором щелочи с последующим окислением образовавшихся нитратов натрия азотной кислотой. Другой способ получения основан на обменной реакции между нитратами кальция и аммония с натриевыми солями.
Сульфат аммония (NH4) 2SO4 - сернокислый аммоний содержит 20,5% азота. И до 24% серы. Представляет собой кристаллический продукт белого или серого цвета. В нем могут присутствовать небольшие примеси серной кислоты, что придает удобрению слабокислую реакцию. Технический сульфат аммония, выпускаемый на удобрение, может иметь примеси Ca, Mg, SiO2, следы родананистого аммония и некоторое количество органических веществ, смоляных кислот, фенола.
В сухом состоянии обладает хорошими физическими свойствами и при хранении сохраняет рассыпчатость. Производится в крупнокристаллическом виде.
Растения из сернокислого аммония быстрее поглощают катион, чем анион, так как потребность их в азоте больше по сравнению с серой. Находясь в поглощенном состоянии, ионы аммония приобретают меньшую подвижность. Поэтому устраняется опасность вымывания азота в сильно влажную почву. Сульфат аммония наиболее эффективен в условиях орошения или избыточного увлажнения.
Хлористый калий KCl - основное калийное удобрение во всем мире. Содержание оксида калия составляет: в химически чистой соли - 63,2%, в технической соли, в том числе идущей на удобрения - 52,4 - 61,9%. Он отличается повышенной гигроскопичностью, особенно если кристаллы его мелкие. Поэтому современная технология производства дает продукт крупнокристаллический в результате обработки аминами. По внешнему виду его кристаллы розовой или оранжевой окраски. В удобрении 1 сорта содержится 60% оксида калия; 2 сорта - 58%. Влажность обоих сортов - не более 1%
Хлористый калий - самое концентрированное калийное удобрение. В нем минимальное содержание хлора на единицу калия в сравнении со смешанной калийной солью и сильвинитом. Вследствие этого при отсутствии сульфатов его применяют под чувствительные к хлоридам культуры, но вносят его заблаговременно, чтобы по возможностям Cl - удалился за пределы пахотного слоя почвы.
Двойной суперфосфат Ca (H2PO4) 2 - содержит 45% P2O5 и 3-5% свободной фосфорной кислоты. Это - аморфное вещество светло-серого цвета, растворимое в воде и подкисляющее почву. Выпускается в гранулированном виде.
Фосфор - один из важнейших элементов питания растений, так как входит в состав белков. Если азот в почве может пополняться путем фиксации его из воздуха, то фосфаты - только внесением в почву в виде удобрений. Главные источники фосфора - фосфориты, апатиты, вивианит и отходы металлургической промышленности - томасшлак, фосфатшлак.
Для получения двойного суперфосфата из природного фосфата выделяют сначала фосфорную кислоту:
Ca3 (PO4) 2 + 3H2SO4 = 2H3PO4 + 3CaSO4
Отделив осадок, полученной кислотой, затем обрабатывают новую порцию фосфорита:
Ca3 (PO4) 2 + 4H3PO4 = 3Ca (H2PO4) 2.
Суперфосфат - Сa (H2PO4) 2*H2O содержит 19,5% фосфора из апатитового концентрата и 14% из фосфоритов, а также некоторое количество свободной фосфорной кислоты (до 5,5%), что значительно ухудшает его качества. Для устранения этого недостатка применяют нейтрализацию твердыми добавками: известь, мел, доломит, аммиак. Простой суперфосфат - рассыпчатый продукт темно-серого цвета с характерным запахом фосфорной кислоты.
В удобрении первого сорта содержится не менее 19,5% Р2О5, 2-го сорта-19%, 3-го сорта - 14%, содержание воды 15-16%, гипса-до 40%.
Для лучшего рассеивания его часто вносят в смеси с перегноем, торфом, фосфоритной мукой для улучшения физических свойств удобрение увлажняют и окатывают в гранулы.
Гранулированный суперфосфат обладает лучшей сыпучестью и рассеиваемостью. (Диаметр гранул 1-4 мм).
Английский ученый Лооз в 1843 г. полевыми опытами на Ротамстедской опытной станции доказал, что наряду с зольными элементами в состав удобрений должен входить фосфор.
В том же году на этой станции впервые было изготовлено заводским путем минеральное удобрение _ суперфосфат.
Гранулированный суперфосфат рекомендуется для предпосевного внесения под различные сельскохозяйственные культуры в дозе 7,5 - 20 кг/га P2O5: кукурузу, подсолнечник, хлопчатник, свекла.
Получение суперфосфата производят следующим образом:
[Ca3 (PO4) 2] 3*CaF2 + 7H2SO4 + 3H2O - > 3Ca (H2PO4) 2*H2O + 7CaSO4 + 2HF
А также изготовляется из высокопроцентного (39-40% Р2О5) апатитового концентрата или из природных фосфатов - апатитов и фосфоритов разложением их с 61-67% серной кислотой.
Ca3 (PO4) 2 + 2H2SO4= Ca (H2PO4) 2 + 2CaSO4
Жидкая смесь при выходе затвердевает вследствие кристаллизации монокальцийфосфата.
Приложение 5
Алгоритм действий при распознавании минеральных удобрений
на примере сульфата аммония
Сухое удобрение в ложечке на огне не плавится или в пламени пахнет аммиаком

Удобрение в воде растворяется полностью или почти полностью

Раствор удобрения от прибавления щелочи при нагревании выделяет аммиак
Раствор удобрения от прибавления азотнокислого серебра осадка не образует, но может дать муть
Раствор удобрения от прибавления хлористого бария образует белый, нерастворимый в слабой соляной кислоте, осадок
Сульфат аммония (NH4)2SO4
Приложение 5
Инструктивная карта для исследования
по распознаванию минеральных удобрений
Ход работы
1. Установите цвет удобрения:
- белого цвета чаще всего встречаются азотные удобрения;
- серой окраски различных оттенков до темноземлистого – фосфорные;
- пестрой окраски чаще всего встречаются калийные.
2. Установите соответствие удобрения (аморфное или кристаллическое):
- аморфные – фосфорные, зола, известь, гипс, мел;
- кристаллические – азотные и калийные.
3. Определите растворимость удобрения в воде:
- возьмите около 1г.удобрения, залейте до 2/3 пробирки дистиллированной водой, хорошо взболтайте;
- растворимые – полностью: азотные и некоторые калийные; частично – некоторые калийные;
- нерастворимые и слабо растворимые – фосфорные, зола, мел, гипс.
4. Дальнейший ход работы осуществляйте по ключу А.В. Петербургского.
Приложение 6
Три элемента жизни растений
- Азот входит в состав белков. При его недостатке задерживается образование зеленой массы, растения плохо растут, их листья становятся бледно-зелеными и даже желтеют. Азотные удобрения особенно нужны растениям в весенний период.
- Фосфор содержится в нуклеиновых кислотах, которые участвуют в окислительно – восстановительных процессах, протекающих в растениях. Фосфор особенно необходим при росте и развитии цветков и плодов.
- Калий ускоряет процесс фотосинтеза и способствует накоплению углеводов. У злаковых обеспечивает укрепление стебля, чем препятствует их полеганию.
- Три элемента жизни: азот, фосфор и калий – это устойчивость посевов к заморозкам и засухе, сопротивляемость их вредителям, болезням.

P


K

N
Приложение 7
Химический диктант
- Закончите фразу: «Химические элементы, необходимые растениям в больших
называют....»
- Закончите фразу: «Химические элементы, необходимые растениям в небольших количествах, называют....»
- Запишите знаки макроэлементов
- Закончите фразу: «Вещества, содержащие три важнейших питательных элемента
N, Р, К и способные в почвенном растворе диссоциировать на ионы, — это....»
- Напишите, на какие группы классифицируют удобрения по питательному элементу
- Закончите предложение: «Удобрения высоким содержанием питательного элемента называют...»
- Закончите предложение: «Минеральные удобрения, содержащие один питательный элемент, называют....»
- Закончите предложение: «Минеральные удобрения, содержащие два и более питательных элемента, называют...»
- Запишите химический состав удобрений: простого суперфосфата, натриевой селитры, аммиачной селитры, сильвинита, сульфата аммония.
- Назовите фамилию ученого, разработавшего теорию минерального питания растений.
Ключ
Выберите из массива правильный ответ
| Макроэлементы | Ультрамикро-элементы | Минеральные удобрения | С, Н, О, N | Комплексные |
| Ca, S, Na, Cu, Fe | Простые | Смешанные | Электролиты | Микроэлементы |
| Комбинированные | Азотные | J, Zn, B | Фосфорные | Калийные |
| Концентрированные | Бедные | KCl | (NH4)2SO4 | NH4NO3 |
| NaNO3 | Ca(H2PO4)2 | Ca3(PO4)2 | H2O | Ю.Либих |
Приложение 8
Схема записи основных моментов урока – исследования в тетрадях учащихся
Проблема: расход питательных веществ нужно восполнять, добавляя их в почву путем внесения удобрений.
Тема исследования: состав и классификация минеральных удобрений.
Цель исследования: получить знания о составе и классификации минеральных удобрений, влиянии каждого определенного вида на процессы жизнедеятельности растений.
Гипотеза: минеральные удобрения с точки зрения химика
Подтверждение гипотезы:
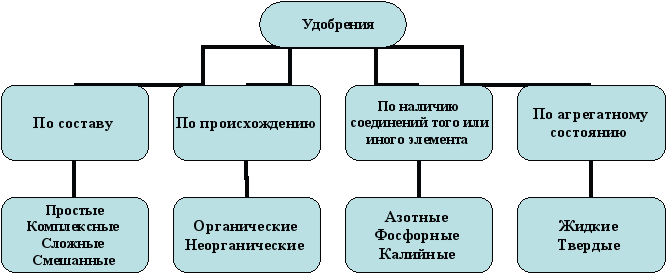
Значение азота, фосфора и калия в жизни растения
| Элемент | Где содержится | Признаки нехватки элемента | Сроки внесения удобрения, содержащего элемент |
| Азот | Входит в состав белков | Задерживается образование зеленой массы, растения плохо растут, их листья становятся бледно-зелеными и даже желтеют. | Весна |
| Фосфор | Нуклеиновые кислоты | Угнетение роста и развития цветков и плодов. | Осень |
| Калий | Хлоропласты | Замедляется процесс фотосинтеза, накопление углеводов идет медленно. | Весна, осень |
Вывод: зная состав, свойства и роль в жизни растений важнейших азотных, фосфорных и
калийных минеральных удобрений, можно значительно повысить урожай
сельскохозяйственных культур.
