Дмитрия Ивановича Менделеева, и я, как гражданин своей страны, выбрала тему Торжество периодического закон
| Вид материала | Закон |
- Дмитрия Ивановича Менделеева и её значение для естествознания Введение Открытие, 488.96kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 59.45kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 89.99kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 128.23kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 106.51kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 74kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 88.08kb.
- Доклада, 5.45kb.
- Д. И. Менделеева Изучая периодический закон, 308.68kb.
- Программа духовно-нравственного воспитания младших школьников «я гражданин своего города,, 672.62kb.
Введение
«Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает»
Д. И. Менделеев
В этом году все мировое сообщество празднует 175-летний юбилей великого русского учёного-химика Дмитрия Ивановича Менделеева, и я, как гражданин своей страны, выбрала тему «Торжество периодического закона» для того, чтобы показать гениальность русского ученого, широту его научных взглядов. Ведь вклад этого выдающегося учёного в развитие химии и промышленности России бесценен. Но главной его заслугой является открытие Периодического закона, который стал основой современной химии. Его имя навечно вошло в список имён учёных всех времён и народов. Крупнейшие достижения современного знания являются следствием его гениальных открытий. Менделеев сумел предсказать существование новых химических элементов, их свойства и положение в его Периодической системе. Он совершил научный подвиг, приведший к всеобщему признанию Периодического закона. Исследования Менделеева дали прочный и надёжный фундамент попыткам объяснить строение атома: после открытия Периодического закона стало ясно, что атомы всех элементов должны быть построены по единому плану, что в их устройстве должна быть отображена периодичность свойств элементов.
Тема данного исследования актуальна и в наши дни. Об этом свидетельствует весь курс общей химии, связанный с изучением основных вопросов на основании Периодического закона и Периодической системы химических элементов Д. И. Менделеева, к тому же, на мой взгляд, эта тема не достаточно глубоко изучается в школьной программе.
Моя работа направлена не только на раскрытие сущности Периодического закона и его значения для всего человечества, но и на повышение интереса к такому важному факту, как история его создания и обоснования, а также на освещение имени выдающегося учёного Д.И. Менделеева. Содержимое работы показывает колоссальные способности нашего учёного и результаты его многолетнего кропотливого труда. Заслуги Менделеева должны вызывать у нас патриотические чувства и гордость тем, что благодаря этому гениальному русскому учёному открытие Периодического закона вписалось в страницы истории России как уникальный научный подвиг и результат целеустремлённой деятельности.
Целью данной работы является:
- установление места периодического закона в системе современных научных взглядов;
- выявление функций периодического закона;
- доказательство гениальности русского ученого.
Цель исследования определила следующие задачи:
- Проанализировать первые попытки создания систематизации химических элементов.
- Сравнить достижения Дмитрия Ивановича Менделеева и других исследователей по классификации химических элементов.
- Подтвердить значение периодического закона открытием химических элементов, предсказанных Дмитрием Ивановичем Менделеевым.
- Рассмотреть Периодическую Систему Химических Элементов как графическое отображение периодического закона.
- Подготовить соответствующие выводы по исследованию.
- Расширить свой кругозор в области химических знаний.
Для решения поставленных задач в процессе исследования использовались следующие методы:
- Анализ научно-популярной литературы о жизни и деятельности Д. И. Менделеева; статей периодических изданий;
- Социологический опрос.
Форма представления результатов работы:
Реферат и мультимедийная презентация, включающая таблицы, схемы, иллюстрации, рисунки.
Основная часть
Глава 1 Первые попытки систематизации химических элементов
«Истина одна, а путей отыскания много»
Д. И. Менделеев
В
 опросы о том, из каких элементов состоит наш мир задавали еще в глубокой древности. Однако только в 1668 года была высказана идея поиска неразложимых химических элементов и спустя столетие Антуан Лоран Лавуазье составил первый список химических элементов. С этого момента начались бесчисленные опыты и работы по выявлению закономерностей в мире химических элементов. [1]
опросы о том, из каких элементов состоит наш мир задавали еще в глубокой древности. Однако только в 1668 года была высказана идея поиска неразложимых химических элементов и спустя столетие Антуан Лоран Лавуазье составил первый список химических элементов. С этого момента начались бесчисленные опыты и работы по выявлению закономерностей в мире химических элементов. [1]Первую попытку систематизации элементов предпринял немецкий химик Иоганн Вольфганг Дёберейнер, сформулировавший в 1829 г. закон триад. Дёберейнер обратил внимание на то, что в рядах сходных по свойствам элементов наблюдается закономерное изменение атомной массы. В выделенных Дёберейнером триадах элементов атомный вес среднего элемента триады примерно равен полусумме атомных весов двух крайних элементов:
| Cl – 35.5 Br – 80 I – 125 | P – 31 As – 75 Sb – 122 | S – 32 Se – 79 Te – 129 | Ca – 41 Sr – 88 Ba – 137 | Li – 7 Na – 23 K – 39 |
Х
 отя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.
отя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, тем не менее, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в порядке возрастания их атомных весов.В
 1843 г. Леопольд Гмелин привёл таблицу химически сходных элементов (Приложение 1), расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов, т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз.
1843 г. Леопольд Гмелин привёл таблицу химически сходных элементов (Приложение 1), расставленных по группам в порядке возрастания "соединительных масс". Вне групп элементов, вверху таблицы, Гмелин поместил три "базисных" элемента – кислород, азот и водород. Под ними были расставлены триады, а также тетрады и пентады (группы из четырех и пяти элементов), причём под кислородом расположены группы металлоидов, т.е. электроотрицательных элементов; электроположительные и электроотрицательные свойства групп элементов плавно изменялись сверху вниз. Важным этапом систематизации элементов стали так называемые дифференциальные системы, направленные на выявление общих закономерностей в изменении атомного веса элементов. В 1850 г. немецкий врач Макс фон Петтенкофер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную восьми. На этом основании Петтенкофер высказал предположение, что элементы, возможно, являются сложными образованиями каких-то субэлементарных частиц.
У
 ильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил таблицу (Приложение 2), не сопровождаемую какими-либо пояснениями. В этой таблице видны, по словам Д. И. Менделеева, «начатки периодического закона».
ильям Одлинг, пересмотрев предложенную им в 1857 г. систематику элементов, основанную на эквивалентных весах, предложил таблицу (Приложение 2), не сопровождаемую какими-либо пояснениями. В этой таблице видны, по словам Д. И. Менделеева, «начатки периодического закона».Александр Эмиль Бегуйе де Шанкуртуа в 1862 г. предложил винтовой график элементов, расположенных в порядке возрастания атомных весов – так называемая "земная спираль" (vis tellurique) (Приложение 3). Шанкуртуа нанёс на боковую поверхность цилиндра, размеченную на 16 частей, линию под углом 45°, на которой поместил точки, соответствующие элементам. Таким образом, элементы, атомные веса которых отличались на 16, или на число, кратное 16, располагались на одной вертикальной линии. При этом точки, отвечающие сходным по свойствам элементам, часто оказываются на одной прямой. Винтовой график Шанкуртуа фиксировал закономерные отношения между атомными массами элементов, однако данная система не могла быть признана удовлетворительной.
Д

 жон Александр Рейна Ньюлендс в 1864 г. опубликовал таблицу элементов (Приложение 4), отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав чрезвычайно скептически.
жон Александр Рейна Ньюлендс в 1864 г. опубликовал таблицу элементов (Приложение 4), отражающую предложенный им закон октав. Ньюлендс показал, что в ряду элементов, размещённых в порядке возрастания атомных весов, свойства восьмого элемента сходны со свойствами первого. Такая зависимость действительно имеет место для лёгких элементов, однако Ньюлендс пытается придать ей всеобщий характер. В таблице Ньюлендса сходные элементы располагались в горизонтальных рядах; однако, в одном и том же ряду часто оказывались и элементы совершенно непохожие. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица Ньюлендса не содержит свободных мест. Вследствие присущих системе Ньюлендса недостатков современники отнеслись к закону октав чрезвычайно скептически.Несколько попыток систематизации элементов предпринял в 60-е годы XIX века немецкий химик Юлиус Лотар Мейер. В 1864 г. он опубликовал свою первую таблицу, в которую были включены 42 элемента (из 63), размещённые в шесть столбцов согласно их валентностям. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерное (аналогичное триадам Дёберейнера) изменение атомной массы в рядах подобных элементов.
-
4
Таблица Мейера (фрагмент)
val
3 val
2 val
1 val
1 val
2 val
C=12
N=14.4
O=16
F=19
Na=23
Mg=24
Si=28.5
P=31
S=32
Cl=35.5
K=39
Ca=40
...
As=75
Se=78.8
Br=80
Rb=85.4
Sr=87
Sn=117.6
Sb=120.6
Te=128.3
I=126.8
Cs=133
Ba=137.4
Pb=207
Bi=208
...
...
(Tl=204)
...
В 1870 году вышла ещё одна работа Мейера, содержащая новую таблицу и график зависимости атомного объёма элемента от атомного веса, имеющий характерный пилообразный вид (Приложение 5).
Конечно, число попыток классификации химических элементов до Д. И. Менделеева, считая варианты таблиц, насчитывается немало (около 50). Некоторые из ученых очень близко подошли к открытию закона. И все же им не удалось довести свои попытки до завершения и создать классификацию, включающую все известные в то время химические элементы. Но все это дало почву, на которой вырос Периодический закон и Периодическая система.
Глава 2 Периодический закон и Периодическая система химических элементов
2.1. Работа Д. И. Менделеева над систематизацией химических элементов
«Чтобы найти, надо ведь не только глядеть и глядеть внимательно, но надо знать и знать многое, чтобы знать, куда глядеть».
Д.И.Менделеев
Д
 о сих пор многих тревожит вопрос, каким образом Д.И. Менделеев открыл свой закон. Конечно, всем известна история о том, как ученый увидел свою таблицу во сне, однако этому предшествовали долгие годы работы. Но ничто не происходит просто так, и открытие Периодического закона имеет свои причины. Одной из предпосылок послужили решения международного съезда химиков в городе Карлсруэ в 1860 году, когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а так же атомного веса. Именно это понятие, как неизменную характеристику атомов химических элементов, Д. И. Менделеев положил в основу своей классификации. Так началась его долгая и кропотливая работа над Периодической таблицей. [2]
о сих пор многих тревожит вопрос, каким образом Д.И. Менделеев открыл свой закон. Конечно, всем известна история о том, как ученый увидел свою таблицу во сне, однако этому предшествовали долгие годы работы. Но ничто не происходит просто так, и открытие Периодического закона имеет свои причины. Одной из предпосылок послужили решения международного съезда химиков в городе Карлсруэ в 1860 году, когда окончательно утвердилось атомно-молекулярное учение, были приняты первые единые определения понятий молекулы и атома, а так же атомного веса. Именно это понятие, как неизменную характеристику атомов химических элементов, Д. И. Менделеев положил в основу своей классификации. Так началась его долгая и кропотливая работа над Периодической таблицей. [2]Прежде всего, он выписал на карточки все известные сведения об открытых и изученных в то время химических элементах и их соединениях. Менделеев перекладывал карточки из одного горизонтального ряда в другой. В который раз на помощь ему пришло доскональное знание неорганической химии. Постепенно начал вырисовываться облик будущей Периодической системы химических элементов (Приложение 6). Постепенно Дмитрий Иванович пришел к окончательному выводу, что элементы, расположенные по возрастанию их атомных масс, выказывают явную периодичность физических и химических свойств.
Вечером 1 марта 1869 года он набело переписал составленную им таблицу и под названием "Опыт системы элементов, основанной на их атомном весе и химическом сходстве" послал ее в типографию, сделав пометки для наборщиков и поставив дату "17 февраля 1869 года" (это по старому стилю) (Приложение 7). Так был открыт Периодический закон, формулировка которого такова: Свойства химических элементов и образованных ими соединений находятся в периодической зависимости, от относительных атомных масс элементов. Менделееву тогда было всего 35 лет. Отпечатанные листки он разослал многим отечественным и зарубежным химикам и только после этого выехал из Петербурга, но до отъезда еще успел передать Н. А. Меншуткину рукопись статьи "Соотношение свойств с атомным весом элементов». 18 марта 1869 года Меншуткин сделал от имени Менделеева небольшой доклад о Периодическом законе, который сначала не привлек особого внимания химиков и вызвал неодобрение Н. Н. Зинина. Но через два года, прочтя статью Дмитрия Ивановича "Естественная система элементов и применение ее к указанию свойств некоторых элементов", Зинин изменил свое мнение и написал Менделееву: "Очень, очень хорошо, премного отличных сближений, даже весело читать, дай Бог Вам удачи в опытном подтверждении Ваших выводов. Искренне Вам преданный и глубоко Вас уважающий Н. Зинин".
2.2. Функции периодического закона
«Посев научный взойдет для жатвы народной»
Д. И. Менделеев
Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной.
Интегративная роль периодического закона проявилась и в том, что некоторые данные об элементах, якобы выпадавшие из общих закономерностей, были проверены и уточнены как самим автором, так и его последователями. [3]
Так случилось с характеристиками бериллия, который считался трехвалентным аналогом алюминия из-за их так называемого диагонального сходства, поэтому во втором периоде оказывалось два трехвалентных элемента и ни одного двухвалентного. Менделеев заподозрил ошибку в исследованиях свойств бериллия. Но он нашел работу российского химика Авдеева, утверждавшего, что бериллий двухвалентен и имеет атомный вес 9. Работа Авдеева оставалась не замеченной ученым миром, автор рано скончался, по-видимому, получив отравление чрезвычайно ядовитыми бериллиевыми соединениями.
Такие изменения и уточнения значений и атомных весов, и валентностей были сделаны Менделеевым еще для девяти элементов (In, V, Тh, U, La, Се и трех других лантаноидов). Еще у десяти элементов были исправлены только атомные веса. И все эти уточнения впоследствии были подтверждены экспериментально.
Прогностическая (предсказательная) функция периодического закона получила самое яркое подтверждение в открытии неизвестных элементов с порядковыми номерами 21 (скандий), 31 (галлий) и 32 (германий). Их существование сначала было предсказано на интуитивном уровне, но с формированием системы Менделеев с высокой степенью точности смог рассчитать их свойства. Хорошо известная история открытия скандия, галлия и германия явилась триумфом менделеевского открытия. Всего же им были предсказаны двенадцать элементов. Свою предсказательную функцию периодический закон сохраняет и до наших дней.
2.3. Свойства и функции Периодической системы химических элементов.
«
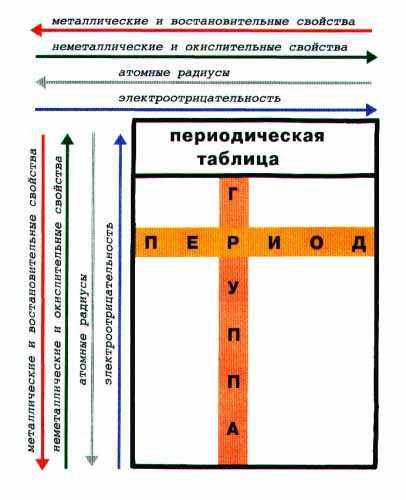 Таблица Менделеева есть таблица истории и жизни мироздания»
Таблица Менделеева есть таблица истории и жизни мироздания»Академик А. Е. Ферсман
Периодическая таблица элементов является графическим выражением Периодического закона (Приложение 8). Заглянем еще раз в Периодическую таблицу. Помимо глубокой фундаментальной связи между элементами, она отражает ряд полезных для изучения химии закономерностей. Важнейшие из этих закономерностей, схематично изображенных на рисунке 1.
а
Рис.1 Закономерности для элементов Периодической таблицы (кроме инертных газов).
) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1
Рис.2 Полуметаллы
. При перемещении СПРАВА НАЛЕВО вдоль периода М
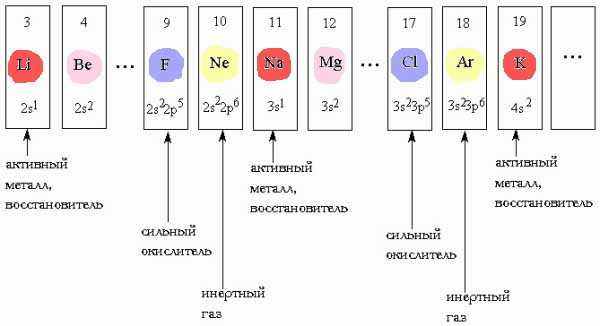
 ЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические.
ЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические. С
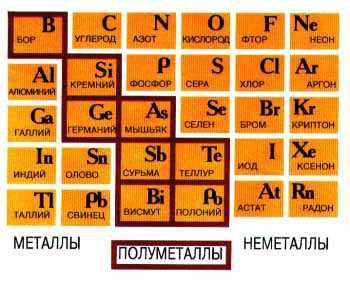
 лева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Но некоторые элементы относят к полуметаллам (рис. 2). Они занимают места на границе между металлами и неметаллами, так как валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками, роль которых в электронной технике чрезвычайно важна.
лева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы. Но некоторые элементы относят к полуметаллам (рис. 2). Они занимают места на границе между металлами и неметаллами, так как валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер. Некоторые полуметаллы (кремний, германий) являются полупроводниками, роль которых в электронной технике чрезвычайно важна. 2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
3
 . Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов. Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы.
. Перечисленные выше причины объясняют, почему СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов. Последняя закономерность распространяется даже на такие необычные элементы, как инертные газы. 4. По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету.
5. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
6
 . Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке не приводит к увеличению размеров атома.
. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке не приводит к увеличению размеров атома.7. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек.
г) Закономерности, связанные с валентностью элементов.
8. Элементы одной и той же ПОДГРУППЫ имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
9. s-Элементы имеют валентности, совпадающие с номером их группы.
10. p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы (число электронов на внешней оболочке).
| | LiCl | BeO | BCl3 | H2O | . HF |
| | NaCl | MgO | AlCl3 | H2S | ... HCl |
| | KCl | CaO | GaCl3 | H2Se | ... HBr |
| | . . . . . . | . . . . . . | . . . . . . | . . . . . . | . . . . |
| Обобщенная формула | RCl | RO | RCl3 | H2R | HR |
| | хлориды | оксиды | хлориды | Летучие водородные соединения | Летучие водородные соединения |
12. d-Элементы обнаруживают много разных валентностей, которые нельзя точно предсказать по номеру группы.
П
 ериодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов.
ериодическая таблица систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов.2.4. Этапы развития Периодического закона.
В
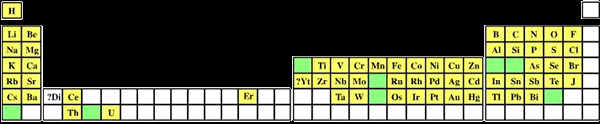
Рис. 3 Расположение в периодической таблице элементов, известных в 1870 г. Зелёным цветом показаны ячейки, соответствующие элементам, свойства которых предсказывал Д. И. Менделеев
развитии периодического закона принято выделять два этапа – химический и физический. Химический этап (1869-1900) развития периодического закона начался с открытия предсказанных элементов. В 1875 г. французский химик Поль Эмиль Лекок де Буабодран открыл новый элемент, который был назван галлием (экаалюминий). В 1879 г. шведский химик Ларс Фредерик Нильсон опубликовал сообщение об открытии скандия (экабор). В 1886 г. немецкий химик Клеменс Александр Винклер открыл германий (экасилиций).
Полное подтверждение предсказаний Менделеева означало торжество периодического закона. С середины 1880-х годов учение о периодичности было окончательно признано в качестве одной из основ теоретической химии.
Тем не менее, в периодическом законе оставались некоторые проблемы. Предстояло определиться с местом в периодической таблице для двух групп элементов – инертных газов, имеющих нулевую валентность, и тринадцати редкоземельных элементов. В периодической системе не было свободных мест для этих элементов, и они были выделены в самостоятельную группу. С целью подчеркнуть большую химическую инертность этих элементов группа была названа нулевой.
Модернизация периодической системы в начале XX века завершила химический этап её развития. Химия в принципе не могла объяснить причину периодичности свойств элементов и их соединений. Дальнейшее развитие периодического закона в XX веке связано с блестящими успехами физики, приведшими к революционным изменениям в естествознании.
Ф
 изический этап (с 1895 года) развития периодического закона можно в свою очередь разделить на несколько стадий:
изический этап (с 1895 года) развития периодического закона можно в свою очередь разделить на несколько стадий:1. Установление делимости атома на основании открытия электрона (1896 – 1897);
2. Разработка моделей строения атома (1911 – 1913);
3. Открытие и разработка системы изотопов (1913);
4. Открытие закона Мозли (1913);
5. Разработка теории периодической системы на основании представлений о строении электронных оболочек атомов (1921 – 1925);
6. Создание основ квантовой теории периодической системы (1926 – 1932).
2.5. Триумф Периодического закона.
«Границ познанию предвидеть невозможно»
Д.И. Менделеев
Н
 аконец, пришло время триумфа. В 1875 году французский химик Поль-Эмиль Лекок де Буабодран открыл в минерале вюртците - сульфиде цинка ZnS - предсказанный Менделеевым "экаалюминий" и назвал его в честь своей родины галлием Ga (латинское название Франции - "Галлия"). Менделеев точно предсказал свойства экаалюминия: его атомную массу, плотность металла, формулу оксида El2O3, хлорида ElCl3, сульфата El2(SO4)3. Менделеев предугадал, что это будет очень легкоплавкий металл, и действительно, температура плавления галлия оказалась равной 29,8 оС. П
аконец, пришло время триумфа. В 1875 году французский химик Поль-Эмиль Лекок де Буабодран открыл в минерале вюртците - сульфиде цинка ZnS - предсказанный Менделеевым "экаалюминий" и назвал его в честь своей родины галлием Ga (латинское название Франции - "Галлия"). Менделеев точно предсказал свойства экаалюминия: его атомную массу, плотность металла, формулу оксида El2O3, хлорида ElCl3, сульфата El2(SO4)3. Менделеев предугадал, что это будет очень легкоплавкий металл, и действительно, температура плавления галлия оказалась равной 29,8 оС. П о легкоплавкости галлий уступает только ртути и цезию.
о легкоплавкости галлий уступает только ртути и цезию. В 1879 году шведский химик Ларс Нильсон открыл скандий, предсказанный Менделеевым как экабор Eb. Нильсон писал: "Не остается никакого сомнения, что в скандии открыт экабор. Так подтверждаются нагляднейшим образом соображения русского химика, которые не только дали возможность предсказать существование скандия и галлия, но и предвидеть заранее их важнейшие свойства". Скандий получил название в
 честь родины Нильсона Скандинавии, а открыл он его в сложном минерале гадолините, имеющем состав Be2(Y3Sc)2FeO2(SiO4)2.
честь родины Нильсона Скандинавии, а открыл он его в сложном минерале гадолините, имеющем состав Be2(Y3Sc)2FeO2(SiO4)2.В 1886 году профессор Горной академии во Фрайбурге немецкий химик Клеменс Винклер при анализе редкого минерала аргиродита состава Ag8GeS6 обнаружил еще один элемент, предсказанный Менделеевым. Винклер назвал открытый им элемент германием Ge в честь своей родины (Приложение 9).
Но кроме "экаалюминия", "экабора" и "экасилиция" Менделеев предсказал существование аналогов марганца (будущие технеций (Тс) и рений (Re)), теллура - полоний (Po), иода – астат (At), цезия – франций (Fr), бария – радий (Ra), тантала - протактиний (Pa).
Предугадать существование группы благородных газов Менделеев не мог, и им поначалу не нашлось места в Периодической системе. Но открытие аргона Ar английскими учеными У. Рамзаем и Дж. Релеем в 1894 году сразу же вызвало бурные дискуссии и сомнения в Периодическом законе и Периодической системе элементов. Менделеев вначале посчитал аргон аллотропной модификацией азота и только в 1900 году под давлением непреложных фактов согласился с присутствием в Периодической системе "нулевой" группы химических элементов, которую заняли другие благородные газы, открытые вслед за аргоном. Теперь эта группа известна под номером VIIIА.
