Дмитрия Ивановича Менделеева, и я, как гражданин своей страны, выбрала тему Торжество периодического закон
| Вид материала | Закон |
СодержаниеН. Г. Чернышевский Академик А.Е. Ферсман Таблица Уильяма Одлинга, 1857 г. Таблица Ньюлендса, 1864. Таблица Мейера 1870 г. Зависимость атомного объёма от атомной массы элемента |
- Дмитрия Ивановича Менделеева и её значение для естествознания Введение Открытие, 488.96kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 59.45kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 89.99kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 128.23kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 106.51kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 74kb.
- Дмитрия Ивановича Менделеева стоит в первом ряду самых значимых и выдающихся людей., 88.08kb.
- Доклада, 5.45kb.
- Д. И. Менделеева Изучая периодический закон, 308.68kb.
- Программа духовно-нравственного воспитания младших школьников «я гражданин своего города,, 672.62kb.
| Глава 3 Менделеев как человек и гражданин «Гений – просто человек, который говорит и действует так, как должно на его месте говорить и действовать человеку со здравым смыслом; гений – ум, развившийся совершенно здоровым образом, как высочайшая красота» Н. Г. Чернышевский Жизнь и творчество Д. И. Менделеева – пример органичного сочетания полета фантазии, воображения и умения работать и мыслить конкретно, сосредоточенно, не разбрасываясь. Дмитрий Иванович был личностью незаурядной и в высшей степени самобытной. Он был ярко выраженной индивидуальностью, поэтому с равным успехом занимался математикой, и химией, астрономией и философией, метрологией и экономикой, техникой и искусством. [4] Одной из покоряющих черт личности ученого была его преданность тому, что он считал делом своей жизни. В одном из своих первых дневников он записал: «Не могу я ничего делать, не привязавшись к делу». Главным в жизни человека Д. И. Менделеев считал труд, который ведет к развитию и к счастью человека. Правда, трудом ученый называл не всякую работу, а работу осмысленную, сознательную, нужную людям. Поэтому, отдаваясь сам целиком работе, Дмитрий Иванович предъявлял жестокие требования и к своим подчиненным, давая им вместе с тем большую самостоятельность. Однако, вместе с тем, ученый вовсе не вел отшельническую жизнь. Напротив, в его доме нередко было полно друзей, родных, визитеров. Столь серьезный и тщательный подход ко всему характеризует Д. И. Менделеева как ученого и человека. Он многое успел за 55 лет творческой жизни. Знания его были поистине энциклопедическими. Им сделано немало научных и технических открытий, написано около 500 различных трудов, статей, заметок. Результаты его деятельности оказали огромное влияние на некоторые стороны и интеллектуальной и материальной жизни страны. Остается удивляться, как это все мог сделать один человек. [5] Ученый не раз говорил, что разнообразные стороны деятельности имеют один источник: постоянный и напряженный труд. В книгу истории развития человеческих знаний вписано немало подвигов. Но очень немногие из них можно сопоставить с тем, что было сделано Дмитрием Ивановичем Менделеевым. Величие его научного подвига не меркнет со временем, его слава продолжает расти. Заключение «Будут появляться и умирать новые теории, блестящие обобщения. Новые представления будут сменять наши уже устаревшие понятия об атоме и электроне. Величайшие открытия и эксперименты будут сводить на нет прошлое и открывать на сегодня невероятные по новизне и широте горизонты, - все это будет приходить и уходить, но периодический закон Д.И. Менделеева будет всегда жить и руководить исканиями». Академик А.Е. Ферсман Периодический закон и Периодическая система химических элементов Д. И. Менделеева – основа современной химии. Они относятся к таким научным закономерностям, которые отражают явления, реально существующие в природе, и поэтому никогда не потеряют своего значения. Их открытие было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы. Используя Периодический закон, Д.И. Менделеев стал первым исследователем, сумевшим решить проблемы прогнозирования в химии. Это проявилось уже через несколько лет после создания Периодической системы элементов, когда были открыты предсказанные Менделеевым новые химические элементы. Периодический закон помог также уточнить многие особенности химического поведения уже открытых элементов. Успехи атомной физики, включая ядерную энергетику и синтез искусственных элементов, стали возможными лишь благодаря Периодическому закону. В свою очередь, они расширили и углубили сущность закона Менделеева, расширили пределы Периодической системы элементов. [6] Неоценимо значение Периодического закона в преподавании общей и неорганической химии. Его открытие было связано с созданием учебника по химии «Основы химии», когда Менделеев пытался предельно четко изложить сведения об известных на тот момент 63 химических элементах. Сейчас число элементов увеличилось почти вдвое, и Периодический закон позволяет выявлять сходство и закономерности свойств различных химических элементов с использованием их положения в Периодической системе. За истекшее время закон Менделеева – подлинный закон природы – не только не устарел и не утратил своего значения, наоборот, развитие науки показало, что его значение до конца еще не познано и не завершено, что оно много шире, чем мог предполагать его творец, чем думали до недавнего времени ученые. Недавно установлено, что закону периодичности подчиняется не только строение внешних электронных оболочек атома, но и тонкая структура атомных ядер, что говорит о том, что открытие Д. И. Менделеева действительно гениально. Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о ссылка скрыта, были уточнены представления о простых веществах и соединениях. Прогнозирующая роль периодической системы, показанная ещё самим Менделеевым, в ссылка скрыта проявилась в оценке химических свойств ссылка скрыта. Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть. Так, например, уже после открытия периодического закона, в XX веке, учеными было открыто 30 химических элементов, а в XXI - уже 4 элемента (Приложение 10).Это говорит о подлинном триумфе Периодического закона В 1964 году имя Д. И. Менделеева было занесено на Доску Почета Бриджпортского университета штата Коннектикут в США наряду с именами Эвклида, Архимеда, Коперника, Галилея, Ньютона и др. С целью выявления знаний старшеклассников о Периодическом законе, Периодической системе и свойствах химических элементов, мною был проведен социологический опрос 70 учащихся (Приложение 11). Анализ данных показал, что для 98,6% учащихся 10-11 классов Периодическая система химических элементов помогает в изучении химии, 77,1% опрошенных используют Периодическую систему химических элементов при характеристике химических элементов и их соединений, 64,3% знают, что Д. И. Менделеев 40 лет работал над созданием и развитием Периодического закона, однако только 45,7% могут рассказать о строении атома химического элемента, пользуясь Периодической системой химических элементов, и всего 12,9% учеников 10-11 классов известно, какие ученые - предшественники Д. И. Менделеева, стали заслужено известными за свои попытки установить закономерность в мире химических элементов. Данная работа может быть использована для того, чтобы расширить кругозор знаний учеников на уроках химии и во внеурочное время. Библиографический список использованной литературы.
Интернет:
 Приложение 2 Таблица Уильяма Одлинга, 1857 г.
Приложение 3 В 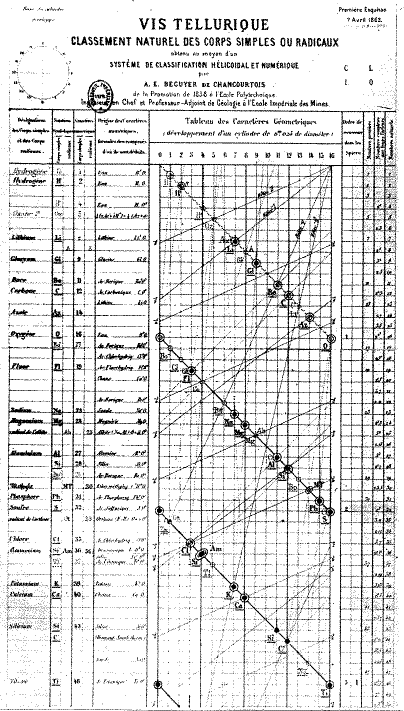 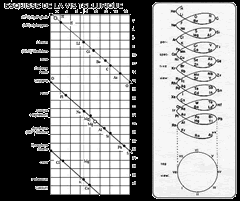 интовой график Шанкуртуа, 1862 г. интовой график Шанкуртуа, 1862 г.Приложение 4 Таблица Ньюлендса, 1864.
Приложение 5 Таблица Мейера 1870 г.
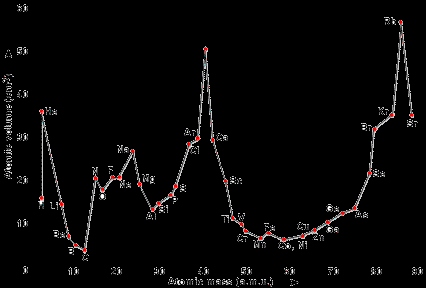 Зависимость атомного объёма от атомной массы элемента | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
