Анотація матеріалів
| Вид материала | Документы |
- Методика написання реферату. Загальні правила оформлення результатів наукових досліджень., 17.56kb.
- Зміни до Порядку проведення експертизи матеріалів на лікарські засоби, що подаються, 2751.76kb.
- Відповідно до постанови Кабінету Міністрів України від 26., 3656.85kb.
- Робоча навчальна програма предмет Методи дослідження властивостей матеріалів (Р-32), 48.64kb.
- Правила підготовки та оформлення друкованих матеріалів ужурналІ «електротехнічні, 78.2kb.
- Вимоги до оформлення матеріалів тез доповідей, 134.94kb.
- Діагностика сектору будівельних матеріалів, 235.87kb.
- Робоча навчальна програма предмет Фізика матеріалів (П-54) Спеціальність, 33.89kb.
- Актуальні проблеми економічних коливань в україні. Анотація, 133.75kb.
- Економіко-математичні моделі та інформаційні технології в дослідженнях соціально-економічних, 134.46kb.
Анотація матеріалів
- Предмет: Хімія.
- П.І.Б. вчителя: Сидорова Ольга Юріївна.
- Місце роботи: Дніпропетровська область, місто Жовті Води ліцей пиродничо-наукового навчання
- Проблема, над якою працює вчитель: «Розвиток творчої особистості на уроках хімії»
- Матеріал: Збірка уроків з теми «Основні класи неорганічних сполук»
- Педагогічний стаж роботи – 13 років.
- Кваліфікаційна категорія – вчитель хімії вищої категорії, Старший вчитель.
Клас: 8 Урок №
Тема: «Основи, їх склад і назви, фізичні властивості. Класифікація основ»
Мета: Продовжити формувати уявлення учнів про класифікацію неорганічних речовин, ознайомити з класом основ, навчити визначати формулу основ серед інших речовин, називати їх за систематичною номенклатурою, ознайомити з фізичними властивостями.
Розвивати вміння аналізувати, порівнювати, робити висновки, формування основних інтелектуальних навичок.
Виховувати активну світоглядну позицію в навчанні та прагнення досліджувати навколишній світ.
Тип уроку: Формування нових знань.
Обладнання: Періодична система хімічних елементів, картки для індивідуальної роботи, зразки розчинних та нерозчинних основ.
Хід уроку:
| Етапи уроку | Зміст уроку | Форми, методи |
| Перевірка домашнього завдання Перевірка раніш засвоєних знань | Організація початку уроку. Фронтальне опитування:
Завдання на картках
Mg(OH)2, BaO, HPO3, Na2CO3, HCl, Ca3(PO4)2, Cr2O3, Ca(OH)2, HNO3, SO3.
Гра «Хто такий, що таке?» Поясни сутність запропонованих слів чи формул:
| Контрольно - корекційні Усне опитування Наявність установки на запам’ятовування |
| Мотивація навчальної діяльності | Викликати інтерес до вивчення матеріалу, спрямувати навчальну діяльність на досягнення поставленої мети. | Зв’язок з набутим досвідом |
| Сприйняття та первинне усвідомлення нового матеріалу | Проаналізувати формули речовин, отриманих в розрахункових задачах. Учні самостійно визначають особливості складу нових речовин та пропонують означення. Обговорити значення слова «основа» (велике, масивне, стійке). Виписати окремо і назвати основи: SO3, Al(OH)3, H2SiO3, H2CO3, Ba(OH)2, P2O5, MgCl2, LiOH, Pb(NO3)2. Ознайомити учнів з принципами номенклатури основ. Розповідь вчителя про мило, мийні засоби, необхідність захисту від їдких речовин. Завдання «Виправ помилки».
Розповідь вчителя про фізичні властивості основ, класифікація на розчинні та нерозчинні, заповнення опорної схеми в зошитах. Обговорення техніки безпеки під час роботи з лугами. Ознайомлення учнів з тривіальними назвами деяких основ. | Вербальні та невербальні засоби викладу матеріалу Проблемний підхід Демонстрація зразків основ |
| Засвоєння знань, умінь, навичок. | 1 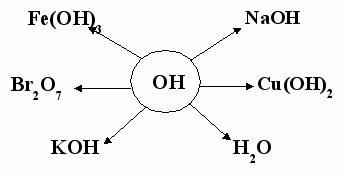 . Учні вибирають формулу основи в сніжинці і називають його за систематичною номенклатурою, визначаючи валентність металу в цих формулах . Учні вибирають формулу основи в сніжинці і називають його за систематичною номенклатурою, визначаючи валентність металу в цих формулах2. Складіть для сусіда чотири формули основ. Учень повинен назвати і класифікувати їх. 3. Добрати відповідні оксиди до складених формул основ. | Колективна робота Самоперевірка та взаємоперевірка |
| Узагальнення та систематизація знань | Закінчити речення очікування.
| Стимуляційні |
| Підведення підсумків | Учні демонструють результати своєї роботи, взаємно перевіряють, виправляють помилки та роблять висновки. Учитель підводить підсумки. Оцінка роботи окремих учнів. | Самоконтроль результату з встановленням ступеня досягнення мети |
| Повідомлення домашнього завдання | | Пояснення |
Клас: 8 Урок №
Тема: «Хімічні властивості оксидів»
Мета: Вивчити хімічні властивості основних та кислотних оксидів, навчити використовувати основні методи вивчення хімічних сполук та явищ - спостереження та експеримент.
Формувати в процесі викладання науковий світогляд учнів, вчити використовувати методи наукового пізнання та науково-пошукову діяльність.
Закріпити вміння спостерігати і фіксувати результати дослідів.
Розвивати активну позицію в житті і навчанні, доброзичливість у спілкуванні, відповідальність за свої дії у навколишньому середовищі.
Тип уроку: Урок застосування знань, формування умінь і навичок.
Обладнання: періодична система хімічних елементів, зразки оксидів натрію та фосфору, колби, пробірки, вода, індикаторний папір, комп’ютерна програма «Химия для всех ХХІ ст. Химические опыты со взрывами и без» видавництва 1С
Хід уроку:
| Етапи уроку | Зміст уроку | Форми, методи |
| Перевірка домашнього завдання Перевірка раніш засвоєних знань | Організація початку уроку. Узагальнити знання учнів про можливість виведення хімічної формули речовини, використовуючи різні данні:
| Контрольно - корекцій ні |
| Мотивація навчальної діяльності, | Повідомлення теми, мети і задач уроку. Повторити основні шляхи пізнання Спрямувати навчальну діяльність на досягнення мети, сформувати в учнів усвідомлення проблеми, осмислення її суті, розробити гіпотезу та спрямувати учнів на пошук раціональних шляхів її розв’язання. | Врахування особистісно-значущих інтересів. |
| Сприйняття та первинне усвідомлення (осмислення) нового матеріалу | Поставити проблемне питання: Чи будуть основні та кислотні оксиди мати однакові хімічні властивості? Запропонувати учням на основі своїх спостережень скласти гіпотезу про хімічні властивості оксидів Для розв’язку цієї проблеми учням пропонуються зразки двох оксидів: натрію та фосфору.
Проаналізувати отримані результати всім класом, обговорити результати, скласти і записати рівняння реакцій на дошці та в зошитах у вигляді таблиці. Ознайомити учнів з принципом взаємодії протилежностей, на його основі розглянути можливість взаємодії основних оксидів з кислотами, кислотних оксидів з основами та основних і кислотних оксидів між собою. | Проблемний підхід |
| Корекція і розвиток знань, умінь, навичок. | Тренувальні вправи:
P2O5, CuO, Ag2O, FeO, BaO, SO3, N2O5, SO2, Na2O, CaO.
б) KOH в)Al(OH)3 г)HNO3
а) Li2O + H2O → б) Mn2O7 + H2O → в) As2O5 + H2O → г) K2O+ P2O5 → д)Cl2O7 + H2O → е)Li2O + H2O →
| Робота під контролем вчителя Посилення наукового рівня навчального матеріалу шляхом самостійної роботи Взаємозв’язок теорії та практики |
| Підведення підсумків | Учні демонструють результати своєї роботи, взаємно перевіряють, виправляють помилки та роблять висновки. Учитель підводить підсумки. | Бесіда |
| Повідомлення домашнього завдання | | Пояснення |
Додаток 1 Принцип взаємодії протилежностей
Основний оксид Кислотний оксид





 Основа Кислота
Основа Кислота
 Сіль
СільДодаток 2 Таблиця «Хімічні властивості оксидів»
| Основні оксиди | Кислотні оксиди |
Li2O + H2O →2LiOH BaO + H2O → Ba(OH)2 |
SO3 + H2O → H2SO4 Mn2O7 + H2O → 2HMnO4 |
H2SO4 +Na2O → Na2SO4 + H2O 2H3PO4 + 3Li2O → 2Li3PO4 +3H2O |
2NaОH +CO2 → Na2CO3 + H2O P2O5 + 6LiOH → 2Li3PO4 +3H2O |
BaO + CO2 → BaCO3 3K2O+ P2O5 → 2K3PO4 | |
Клас: 8 Урок №
Тема: «Хімічні властивості кислот»
Мета: За допомогою практичного експерименту сформувати уявлення про хімічні властивості кислот, особливості взаємодії металів з кислотами, ознайомити учнів з рядом активності металів.
Формувати вміння прогнозувати можливості перебігу хімічних реакцій, розвивати навички складання хімічних формул та хімічних рівнянь, вчити використовувати методи наукового пізнання та науково-пошукову діяльність.
Закріпити вміння спостерігати і фіксувати результати дослідів.
Розвивати активну позицію в житті і навчанні, доброзичливість у спілкуванні, відповідальність за свої дії у навколишньому середовищі.
Тип уроку: Урок застосування знань, формування умінь і навичок.
Обладнання: періодична система хімічних елементів, витиску вальний ряд металів, зразки кислот в пронумерованих пробірках, індикатори, метали, колби, пробірки, вода, індикаторний папір, комп’ютерна програма «Химия для всех ХХІ ст. Химические опыты со взрывами и без» видавництва 1С
Хід уроку:
| Етапи уроку | Зміст уроку | Форми, методи |
| Перевірка домашнього завдання Перевірка раніш засвоєних знань | Організація початку уроку. Узагальнити знання учнів про можливість виведення хімічної формули речовини, використовуючи різні данні:
Проаналізувати отримані відповіді, скласти рівняння взаємодії оксидів з водою. | Контрольно - корекційні |
| Мотивація навчальної діяльності | Повідомлення теми, мети і задач уроку. Повторити основні шляхи пізнання. Спрямувати навчальну діяльність на досягнення мети, сформувати в учнів усвідомлення проблеми, осмислення її суті, розробити гіпотезу та спрямувати учнів на пошук раціональних шляхів її розв’язання. | Врахування особистісно-значущих інтересів. |
| Сприйняття та первинне усвідомлення (осмислення) нового матеріалу | Поставити проблемне питання: З якими речовинами можуть реагувати кислоти? Запропонувати учням на основі своїх спостережень скласти гіпотезу про хімічні властивості кислот. Для розв’язку цієї проблеми учням пропонуються зразки двох кислот: хлоридної та сульфатної.
Подорож в країну Кислот Дослідження №1. Тема: Виявлення кислот. Мета: Розглянути зміну кольорів індикаторів в кислотах. Хід роботи.
Зробити висновки. Розповідь вчителя про індикатори. Необхідність виявлення кислого середовища. Лабораторна робота №6. Тема: Дія кислот на індикатори. Мета: Вивчити як змінюють свій колір індикатори у кислому середовищі. Хід роботи.
Зробити висновки, результати занести в таблицю. Використавши принцип протилежності учні пропонують гіпотезу про хімічні властивості кислот і перевіряють її виконуючі дослідження. Дослідження №2. Тема: Взаємодія кислот з металами. Мета: Розглянути можливість взаємодії різних металів з кислотами. Хід роботи.
Зробити висновки, результати занести в зошит. Запропонувати учням поставити метали в ряд збільшення їх активності. Ознайомити з поняттям про витиску вальний ряд металів. Учні самостійно складають рівняння реакцій. Після перевірки та виправлення помилок учням пропонується самостійно скласти математичний узагальнений вираз рівняння взаємодії металів з кислотами. Дати означення реакцій заміщення. Вчитель проводить демонстрацію взаємодії кислоти з основним оксидом на прикладі розчинення купрум (ІІ) оксиду з сульфатною кислотою. Учні роблять висновок про можливість взаємодії, записують рівняння і отримують завдання: Доберіть початкові кислоту та основний оксид, щоб після реакції отримати: а) FeSO4; б) AlCl3. Дослідження №3. Тема: Реакція нейтралізації. Мета: Розглянути можливість взаємодії кислот з основами та умови проходження реакції нейтралізації. Хід роботи.
Зробити висновки, результати занести в зошит. Учні самостійно складають рівняння реакцій. Після перевірки та виправлення помилок учням пропонується самостійно скласти математичний узагальнений вираз рівняння взаємодії основ з кислотами. Дати означення реакцій обміну. Проаналізувати отримані результати всім класом, обговорити результати, скласти і записати рівняння реакцій на дошці та в зошитах у вигляді опорної таблиці. | Проблемний підхід Практичний експеримент Демонстраційний матеріал на комп’ютері Творча робота учнів Практичний експеримент Взаємозв’язок теорії та практики Творче завдання Практичне дослідження Демонстраційний матеріал на комп’ютері Взаємозв’язок теорії та практики |
| Підведення підсумків | Учні демонструють результати своєї роботи, взаємно перевіряють, виправляють помилки та роблять висновки. Учитель підводить підсумки. | Бесіда |
| Повідомлення домашнього завдання | | Пояснення |
Клас: 8 Урок №
Тема: «Оксиди в природі»
Мета: розглянути поширення оксидів в різних географічних оболонках Землі;
- розвивати логічне та аналітичне мислення;
- закріпити вміння розв’язувати задачі;
- формувати стійку потребу в самоосвіті.
Тип уроку: засвоєння нових знань.
Міжпредметні зв’язки: природознавство, географія.
Обладнання: періодична система хімічних елементів, зразки оксидів, колекції мінералів, комп’ютерна програма «Химия для всех ХХІ ст. Химические опыты со взрывами и без» видавництва 1С, варіанти тестів,
Хід уроку:
| Етапи уроку | Зміст уроку | Форми, методи |
| Актуалізація опорних знань |
а) розрахувати масову частку Оксигену в манган (ІV) оксиді; б) масова частка тривалентного елемента в оксиді становить 70%. Визначите цей елемент. | Фронтальне опитування. Робота біля дошки і в зошитах. Диференційний підхід |
| Мотивація навчальної діяльності, повідомлення теми, мети і задач уроку. |
| Розповідь вчителя Зв’язок з набутим досвідом |
| Сприйняття та первинне усвідомлення (осмислення) нового матеріалу | 1. Давайте пошукаємо оксиди на нашій планеті, які оболонки має Земля як планета?
| Запис матеріалу на дошці та в зошитах, повторення раніш вивченого, розгляд мінералів, комп’ютерна підтримка. |
| Узагальнення та систематизація знань | Тестування за варіантами (додаток) | Пізнавально - рефлексивні |
| Підведення підсумків | Аналіз учнями своєї роботи та роботи інших, обговорення результатів діяльності, оцінка роботи в цілому та окремих учнів. | Бесіда |
| Повідомлення домашнього завдання | | Пояснення |
Додаток Тестування
І варіант
- Кислотами називаються речовини, що складаються з :
а) атомів Гідрогену та гідроксидної групи;
б) атомів металу та кислотного залишку;
в) атомів Гідрогену та кислотного залишку;
г) атомів металу та гідроксидної групи.
- Визначте зайвий елемент:
а) скло; б) цвях; в) пластмаса; г) золото.
- Розрахуйте відносну молекулярну масу речовини, що складається з 2 атомів Калію, 1 атому Силіцію та 3 атомів Оксигену:
а) 164; б) 154; в) 145; г) 28.
- Яку валентність має атом Фосфору в сполуці Р2О5:
а) 1; б) 2; в) 4; г) 5.
- Визначити спільне і записати двома-трьома словами для кожного ряду:
а) алюміній, цукор, золото; б) Fe2O3, CO2, SO3;
в) Na, K, Ca; г) C + O2 → CO2, 3Na + P → Na3P;
д) фільтрування, відстоювання, дистиляція.
- Виконайте за зразком:
2Мg + O2 → 2MgO, S + O2 → ?
а) SO3; б) H2SO4; в) H2S; г) SO2.
- Встановіть відповідність: А – оксиди, Б – кислоти, В – основи, Г – солі.
1.SO3 5.H3PO4 9. Al2S3
2.KOH 6.Fe(OH)3 10. S8
3.CaCO3 7. Na2O 11. HNO3
4.NH3 8. C6H6 12. O3
- Речовина складається на 32,4% з Натрію, 22,53% Сульфуру та Оксигену. Формула речовини: а) Na2S; б) Na2SO3; в) Na2S2O6; г) Na2SO4.
- Визначте зайве у кожному ряду:
а) NaOH, KOH, Al(OH)3, Ba(OH)2; б) СаO, Li2O, BaO, Cl2O7;
в) H2S, HCl, H2CO3, HBr; г)Na2CO3, NaCl, K2CO3, CaCO3.
- Встановіть відповідність між назвами і формулами сполук:
1. BaCl2 A. Кальцій гідроксид
2. FeO Б. Ферум (ІІІ) оксид
3. Ca(OH)2 В. Барій хлорид
4. Fe2O3 Г. Ферум (ІІ) оксид
- Маса 4моль вуглекислого газу дорівнює:
а) 174г; б) 176г; в) 44г; г) 17,6г.
- Який об’єм водню можна отримати при взаємодії 10моль магнію з сульфатною кислотою?
а) 224л; б) 22,4л; в) 112л; г) 10л.
- КОН – калій гідроксид, основа, луг;
Мg(ОН)2 - ?
- Оксид елемента ІІІ групи має відносну молекулярну масу 160. Визначте елемент.
Тестування
ІІ варіант
- Солями називаються речовини, що складаються з :
а) атомів Гідрогену та гідроксидної групи;
б) атомів металу та кислотного залишку;
в) атомів Гідрогену та кислотного залишку;
г) атомів металу та гідроксидної групи.
- Визначте зайвий елемент:
а) нафта; б) повітря; в) сметана; г) золото.
- Розрахуйте відносну молекулярну масу речовини, що складається з 2 атомів Натрію, 1 атому Сульфуру та 4 атомів Оксигену:
а) 164; б) 142; в) 145; г) 28.
- Яку валентність має атом Феруму в сполуці Fe2О3:
а) 1; б) 2; в) 4; г) 3.
- Визначити спільне і записати двома-трьома словами для кожного ряду:
а) повітря, молоко, нафта; б) HNO3, HCl, H3PO4;
в)C, P, S; г) NH3 → N2 + H2, Fe3O4 → Fe + O2;
д) колір, запах, розчинність.
- Zn + 2HCl → ZnCl2 + H2, Al + H2S → ? + H2
а) Al2S3; б) H2SO4; в) Al2(SO4)3; г) SO2.
- Встановіть відповідність: А – оксиди, Б – кислоти, В – основи, Г – солі.
1.SO3 5.H3PO4 9. Al2S3
2.KOH 6.Fe(OH)3 10. S8
3.CaCO3 7. Na2O 11. HNO3
4.NH3 8. C6H6 12. O3
- Речовина складається на 37,71% з Натрію, 22,95% Силіцію та Оксигену. Формула речовини: а) Na4Sі; б) Na2SіO3; в) Na2Sі2O6; г) SіO2.
- Визначте зайве у кожному ряду:
а) Mg(OH)2, KOH, Са(OH)2, Ba(OH)2; б) SO3, K2O, CO2, P2O5;
в) H2SО3, HNО3, H2CO3, H2SО4; г)Na2S, K2S, CaSO4, Fe2S3.
- Встановіть відповідність між назвами і формулами сполук:
1. Na2SiO3 A. Алюміній гідроксид
2. NO2 Б. Нітроген (ІV) оксид
3. Al(OH)3 В. Натрій силікат
4. H2S Г. Сульфідна кислота
- Маса 3моль сульфатної кислоти дорівнює:
а) 29,4г; б) 294г; в) 98г; г) 17,6г.
- Який об’єм водню необхідний для взаємодії з 16моль купрум(ІІ)оксиду для добування чистої міді?
а) 35,8л; б) 22,4л; в) 358,4л; г) 16л.
- HNО3 – нітратна кислота, одноосновна, оксигенвмисна;
H2CO3 – ?
- Оксид елемента V групи має відносну молекулярну масу 142. Визначте елемент.
Урок – аукціон з теми:
«Генетичний зв’язок між найважливішими класами неорганічних сполук»
Мета: Проконтролювати знання учнів з теми; розвивати в них пізнавальний інтерес.
Хід уроку
Всі учасники перед початком аукціону одержують у банку (функції робітників банку виконують вчитель і двоє учнів) первісний капітал у виді короткострокового кредиту у розмірі 1000 монет (скорочено – м.) – ігрових грошових знаків – під 30% річних (до кінця аукціону). Це означає, що в кінці аукціону всі, хто одержав кредит, повинні повернути у банк 1300 м. (з яких 1000 м. – це сума кредиту і 300 м. складають 30% річних від суми кредиту). Розписуючись у банківській книзі за його отримання, учень одночасно с грішми отримує номер учасника аукціону. Тільки маючи такий номер, учасник може претендувати на той чи інший лот, виставлений на аукціоні.
Запитання пропонуються у вигляді лотів, продаваних на аукціоні. Вірна відповідь на придбане запитання приносить учаснику визначений прибуток.
Перед наступним туром оголошую порядок проведення торгів і характер пропонованих лотів.
Перший тур
Відкритий лот – це конкретне питання.
Повідомляю учасникам аукціону, що цей тур буде проходити за наступними правилами:
- Задається конкретне запитання по темі уроку.
- Право на відповідь може придбати кожен з учасників, які мають номер, заплативши найбільшу суму в ході відкритих торгів.
- Первісна стартова ціна кожного лоту (право на відповідь) складає 100 м., а торговий (аукціонний) крок – 50 м. Наприклад, один з учасників називає свою ціну за конкретне запитання, запропонований аукціоністом: 150 м. Якщо хтось інший має бажання отримати цей лот, він називає свою ціну: 200 м., чи 250 м., чи 300 м. тощо, тобто кожний раз збільшуючи ціну на 50 м. (чи одразу на 100 м., чи на 150 м. і т.д.).
- Учасник, який називає свою ціну, повинен підняти і показати аукціоністу номер, який він отримав перед початком аукціону.
- Учасник, який запропонував найбільшу суму за наступний лот, платить у банк суму, за яку він придбав цей лот.
- За вірну відповідь на запитання, їм куплений, учасник отримує грошову винагороду від 1000 м. до 1500 м. в залежності від складності запитання.
- Учасник, який невірно відповів на питання, платить в банк штраф у розмірі 100 м., а лот знімається з торгів і може бути виставленим у кінці тура для повторного продажу. Гроші, які були сплачені в банк за відповідь на це запитання, учаснику не повертаються.
- Учасник, у якого закінчилися гроші, може з дозволу координатору (функції якого виконує вчитель) узяти у банку додатковий кредит, але не більше ніж 1000 м. і під 50% річних.
Після оголошення правил відкриваються торги першого туру і оголошую грошову винагороду за вірну відповідь.
Первісна стартова ціна запитання – 100 м.
Відкритий лот.
- До складу кислот завжди входить:
а) атоми Гідрогену; б) атоми Оксигену;
в) молекули водню; г) атоми Сульфуру.
Грошова винагорода за вірну відповідь – 1000 м. Нагадую, що первісна стартова ціна запитання – 100 м. Хто дасть більшу суму? (Далі так оголошується кожний лот).
- Формула магній оксиду:
а) MgCl2; б) MgO;
в) Mg(OH)2; г) MgO2.
Грошова винагорода – 1000 м.
- Найпоширеніший оксид у природі:
а) Fe2O3; б) Al2O3;
в) CaO; г) H2O.
Грошова винагорода – 1000 м.
- Вкажіть розчинну у воді сіль:
а) аргентум хлорид; б) барій сульфат;
в) кальцій нітрат; г) купрум сульфід.
Грошова винагорода – 1000 м.
- Знайдіть відповідність між назвою речовини та її формулою:
а) берилій гідроксид; 1) MnO2
б) ортосилікатна кислота; 2) Be(OH)2
в) манган (ІV) оксид; 3) KHSO3
г) калій гідрогенсульфіт. 4) H4SiO4
Грошова винагорода – 1200 м.
Другий тур
Напівзакритий лот – це хімічні властивості неорганічних сполук найважливіших класів.
У цьому турі на продаж висувається не конкретне запитання, а визначена область знань з даної теми. Довідатись про формулювання запитання можна лише після отримання виставленого лоту, тобто заплатив максимально високу ціну зі всіх запропонованих в ході торгів.
Учасник, який купив лот і який невірно відповів на запитання, також платить штраф у розмірі 100 м., а лот знімається з торгів і може бути знову виставлений, але вже у якості відкритого лоту, тому що запитання відомо учасникам аукціону.
Оголошую початок торгів.
Первісна стартова ціна – 100 м. хто дасть більшу суму? Після того, як хтось з учасників аукціону купить лот, задаю запитання.
1-й лот «Вибери речовину »
Запитання:
- Виписати окремо і назвати кислоти і основи:
Mg(OH)2, BaO, HPO3, Na2CO3, Ca3(PO4)2, Cr2O3, Ca(OH)2, SO3.
- Виписати окремо і назвати оксиди і солі:
SO3, H2SiO3, H2CO3, Ba(OH)2, P2O5, MgCl2, LiOH, Pb(NO3)2.
Грошова винагорода за вірну відповідь – 1600 м.
2-й лот «Хімічні властивості»
Запитання:
- З якими речовинами буде взаємодіяти сульфатна кислота: H2O, Al2O3, HCl, Na, CaCO3, Na2SO4.
- З якими речовинами буде взаємодіяти натрій гідроксид:
CO2 ,H3BO3, CuSO4, Na2SO4, H2O, HPO3
Грошова винагорода – 1500 м.
3-й лот «Хімічні реакції»
Запитання:
- Напишіть рівняння реакцій за поданими схемами. Вкажіть тип реакцій:
а) Mg + HBr→ б) Na2SO4 + BaCl2→
в) Zn + P→ г) Fe(OH)3 →
д) BaO + H2O → е) Cr2O3 + H2CO3 →
- Напишіть рівняння реакцій за поданими схемами. Вкажіть тип реакцій:
а) MgCl2 + Ca(OH)2 → б) Cr2O3+ HNO3→
в)Na2SO4 + Al(NO3)3→ г) Al(OH)3 →
д) P2O5 + H2O → е) Al + S →
Грошова винагорода – 2000 м.
Третій тур
Закритий лот – це невідоме питання.
Оголошую, що в цьому турі учасники купують закритий лот, не знаючи, яке запитання буде у цьому лоті.
Оголошую початок торгів.
Первісна стартова ціна кожного запитання – 100 м.,
аукціонний крок – 50 м.
1-й лот.
Запитання.
- Складіть рівняння за схемою:
Fe → Fe2O3 → FeCl3 → Fe(OH)3 → Fe2(SO4)3→ Fe
- На хлорування 13,7 г барію витрачено 7,1 г хлору. Яка маса барій хлориду утвориться ?
Грошова винагорода за вірну відповідь – 2000 м.
2-й лот.
Запитання.
- Складіть рівняння за схемою:
Mg → Mg O → MgBr2 → Mg(OH)2 → MgSO4 → Mg
- Скільки потрібно взяти г міді, щоб при її взаємодії з киснем одержати 16 г купрум (II) оксиду?
Грошова винагорода за вірну відповідь – 2000 м
3-й лот.
Запитання.
1. Записати рівняння реакцій таких перетворень:
Cu → CuO → CuCl2 → Cu(OH)2 → CuO → Cu
2. Скільки солі утвориться при взаємодії 9,2 г натрію, що містить 5% домішок, з хлоридної кислотою?
Грошова винагорода за вірну відповідь – 2000 м.
По завершенню аукціону прошу усіх учасників визначити суму наявних грошей. Потім учасники обчислюють розмір свого прибуткового податку по ставці 12 % і віднімають його з цієї суми. Кожен учасник повинен повернути в банк кредит і 30 % річних. Після цього оголошується переможець, тобто учасник, у якого на руках залишається більше всього грошей.
