Статус и перспективы развития ядерой медицины и лучевой терапии в россии на фоне мировых тенденций (аналитическая справка) москва
| Вид материала | Документы |
- Учебная программа дополнительной переподготовки (клиническая ординатура) согласовано, 700.57kb.
- Тематический план лекций по лучевой диагностике и лучевой терапии для студентов 3 курса, 196.63kb.
- Эффективность локальной лучевой терапии костных метастазов, 42.57kb.
- Календарно-тематический план лекций по лучевой диагностике и лучевой терапии для студентов, 165.91kb.
- Использование радиопротекторов в лучевой терапии онкологических больных, 99.16kb.
- Информационно-аналитическая справка, 123.95kb.
- России Москва Россия 11: 00 11: 40 Перспективы исследования маркеров повреждения мозга, 30.01kb.
- Пояснительная записка, 332.93kb.
- Пояснительная записка, 279.81kb.
- История отечественной медицины, 121.51kb.
4.3. Протонная лучевая терапия.
Основной принцип протонной лучевой терапии (ПЛТ), а равно и всех других лучевых методов терапии рака, сводится к максимально возможному снижению лучевой нагрузки на здоровые ткани, органы и структуры, уменьшению облучаемых объемов здоровых тканей и/или уменьшению поглощенной дозы в них. Развитие технических и методических средств лучевой терапии на протяжении всей ее истории всегда преследовало именно эту цель. Причина неуклонного следования этому стратегическому направлению в течение более чем ста лет заключается в следующем. Доза на опухоль (мишень) определяется, к сожалению, не только желанием лучевого терапевта достигнуть локального контроля опухоли в максимальном числе случаев, а практически всегда лимитируются допустимой лучевой нагрузкой на здоровые ткани, которая неизбежно растет при увеличении дозы на мишень и, в свою очередь, определяет количество (частоту) и тяжесть постлучевых осложнений. Поэтому лучевой терапевт всегда вынужден балансировать в узком интервале поглощенных в мишени доз, чтобы с одной стороны обеспечить высокий процент случаев локального контроля (ликвидация опухоли или стабилизация ее роста), а с другой стороны ограничить частоту и тяжесть постлучевых осложнений уровнем, безопасным для здоровья и жизни больных. Любое уменьшение лучевой нагрузки на здоровые ткани позволяет поднять дозу в мишени, что резко повышает вероятность локального контроля опухоли: повышение дозы в мишени на 1% повышает вероятность локального контроля опухоли на 2%÷4%.
Протонные пучки являются лучшим и, вероятно, последним (если говорить о редкоионизирующих типах излучения) средством снижения лучевой нагрузки на здоровые ткани. Сравнение двух дозно-анатомических планов облучения одной и той же мишени – плана гамма-облучения и плана протонного облучения – всегда показывает, что в последнем случае лучевая нагрузка на здоровые ткани оказывается примерно в два раза меньше. Полученный выигрыш используется в протонной лучевой терапии, как правило, для выполнения трех задач:
- разумное (на 20÷30%) повышение дозы в мишени и соответствующее (до полутора раз) увеличение вероятности локального контроля;
- уменьшение числа входных портов (направлений) облучения;
- уменьшение числа фракций в курсе.
Реализация двух последних задач позволяет уменьшить время облучения за фракцию, длительность курса и время госпитализации больных и, соответственно, улучшает экономические показатели (затратная часть) протонной лучевой терапии.
Кроме того, протонная лучевая терапия в силу особенностей прохождения протонов через вещество - возможность создания на дистальной (задней) и боковых границах мишени высочайших краевых градиентов дозы - открыла еще две абсолютно новые возможности в лучевом лечении:
- облучение малых и сверхмалых мишеней;
- облучение мишеней, расположенных практически вплотную к критическим (боящимся лучевого воздействия) органам и структурам.
Эти две возможности наиболее активно использовались на начальном (экспериментальном) этапе развития ПЛТ с 1954 по 1990 гг. В этот период около 75% облученных больных лечились по поводу злокачественных новообразований (ЗН) и других патологий в области глаза, орбиты и внутри черепа.
Сегодня в клинических центрах ПЛТ технически и методически обеспечено облучение ЗН любых размеров и локализаций. Это отнюдь не говорит о том, что средства конвенциональной лучевой терапии должны быть вытеснены адронной терапией. Более того, центр ПЛТ может работать лишь в составе и/или тесном взаимодействии с радиологическим отделением, хорошо оснащенном средствами конвенциональной лучевой терапии, а ПЛТ должна использоваться лишь там, где ее эффективность несомненна. Усредненная оценка мнений ведущих мировых специалистов – лучевых терапевтов определяет сегодня эту эффективную область использования ПЛТ (в зависимости от этимологии, морфологии, локализации опухоли, распространенности процесса и т.п.) как 30% от всей структуры онкологической заболеваемости.
Существуют и другие, более высокие оценки сферы применения протонной лучевой терапии. Так, Г. Сьют, один из ведущих лучевых терапевтов США, руководитель крупнейшего в США лучевого отделения Массачусетского госпиталя и медицинской части работ в Центре протонной терапии Гарвардской циклотронной лаборатории (с 1961 г. здесь получили протонную терапию 9116 больных, 21% мирового опыта) в 2001 г. в своей Греевской лекции «Грядущие технические достижения в радиоонкологии» утверждает: «Потенциальными мишенями, которые могут лечиться при помощи ПЛТ, являются опухоли у детей, опухоли головы и шеи, центральной нервной системы, желудочно-кишечного тракта и мочеполовой системы, гинекологические, легочные и мезенхимальные опухоли мягких тканей и костей». Если спроецировать этот перечень на структуру онкологической заболеваемости, скажем, в России, то приведенную выше оценку применимости ПЛТ (30%) следует, по крайней мере, удвоить.
Еще один пример. Легко показать, что в Японии, по завершению к 2015 году программы сооружения пятнадцати префектурных центров протонной терапии и 5-6 центров адронной терапии (ионы углерода), адронная терапия может быть обеспечена каждому четвертому-третьему больному (25÷30%) из массива больных, направляемых на дистанционную лучевую терапию. Аналогичную ситуацию следует ожидать в Западной Европе и в США.
Существуют и более скромные оценки сферы использования адронной терапии. Группы лучевых терапевтов Австрии, Франции, Германии и Италии, опираясь на национальные данные (структуру онкологической заболеваемости), провели детальный анализ потенциальных пациентов адронной терапии. Они показали, что в адронной терапии нуждаются 16% больных, получающих сегодня гамма-терапию (13% - в протонной терапии, 3% - в ионной терапии). Но, даже опираясь на эти минимальные цифры, легко показать, что в России в адронной терапии ежегодно нуждаются около 40 тысяч больных, в Москве – около 3 тысяч. Следует отметить, что в зависимости от комплектации (числа лучевых установок в центре адронной терапии) годовой поток больных в одном центре составляет около 800-1500 больных в год.
Второе направление развития лучевой терапии сводится к увеличению дифференцированности откликов на одну и ту же поглощенную дозу злокачественных клеток и их коллективов (злокачественных новообразований) и здоровых тканей или, иными словами, к увеличению терапевтического интервала. Это направление особенно важно для получения (или улучшения) возможностей лучевого лечения радиорезистентных опухолей. Зачастую, в этих случаях речь идет не о расширении терапевтического интервала, а о его создании. Он либо отсутствует (клетки ЗН и доброкачественные ткани реагируют на облучение одинаково), либо, что еще хуже, клетки ЗН реагируют на облучение гораздо слабее, чем доброкачественные.
Радиорезистентность ЗН определяется в основном двумя причинами: гипоксия (из-за ухудшенного кровообращения) тканей ЗН и не адекватный цикл развития злокачественных клеток. Облучение радиорезистентных опухолей конвенциональными типами излучения и протонами бесперспективно. Для реализации этого стратегического направления и снижения радиорезистентности ЗН используются различные модифицирующие факторы (искусственная оксигенация ЗН, гипоксия здоровых тканей, применение электроноакцепторных соединений, локальный нагрев ЗН и т.п.).
В силу ряда радиобиологических причин облучение плотноионизирующими типами излучений (π- мезоны, нейтроны, ионы тяжелее протонов) позволяет преодолевать радиорезистентность ЗН без использования специальных модификаторов. Общепризнанна и уже показана перспективность лучевого лечения радиорезистентных опухолей пучками нейтронов (нейтронная и нейтронозахватная терапия) и пучками ионов тяжелее протонов. Наибольшее распространение (если говорить о тяжелых ионах) получило использование ионов углерода. Они обладают по сравнению с более легкими ионами уже достаточно высокой биологической эффективностью для преодоления радиорезистентности и, в то же время, искажение кривой Брэгга в конце пробега ионов углерода еще не столь велико, как у более тяжелых ионов. Дозные распределения, создаваемые пучком ускоренных ионов углерода сравнимы с дозными распределениями протонных пучков: соотношение дозы на входе и в конце пробега моноэнергетического пучка ионов углерода несколько выше, чем у протонов; рассеивание ионов в веществе меньше, чем у протонов и, соответственно, выше градиент дозы на боковой границе пучка (или мишени); но несколько хуже градиент дозы на дистальной (задней) границе мишени в конце пробега ионов.
Именно сочетание этих качеств - высокая биологическая эффективность и возможность создавать резко очерченные, высокоградиентные дозные поля позволяет полагать, что при прочих равных условиях применение пучков ионов углерода в лучевой терапии радиорезистентных опухолей может оказаться более эффективным, нежели пучков нейтронов, при использовании которых хорошо очерченные дозные распределения создать невозможно в принципе.
Тем не менее, во всем мире активно продолжаются исследования в области нейтронной и нейтронозахватной терапии. Невозможность создавать при использовании нейтронов хорошо очерченные дозные распределения в определенной мере компенсируется методами нейтронозахватной терапии и/или сочетанным облучением нейтронами и другими (гамма, рентген, протоны) видами излучений.
Если анализировать историю развития адронной терапии, то необходимо отметить следующее. С 1954 г. до 1990 г. все клинические исследования велись в экспериментальных центрах, базирующихся на физических (не медицинских) исследовательских ускорителях. Лишь в 1990 г. после получения достоверно успешных результатов лечения был сооружен базирующийся на специальном медицинском ускорителе первый в мире клинический центр протонной терапии в крупном госпитале в г. Лома-Линда (США). Именно с этого момента наблюдается стремительный рост числа центров (в основном уже не экспериментальных, а клинических) адронной терапии (таблица 8, рис.15).
Таблица 8. Темп сооружения центров адронной терапии.
| Категория центра | 1988 | 1990 | 2005 | 2006 | 2015 прогноз |
| Экспериментальные центры | 11 | 13 | 20 | 20 | 20 |
| Клинические центры | - | 1 | 11 | 20 | 35 |
| Всего | 11 | 14 | 31 | 40 | 55 |
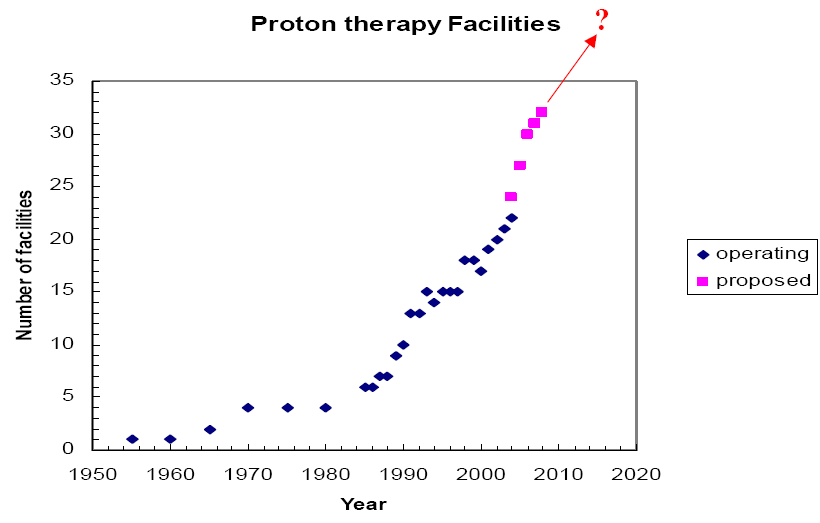
Рис. 15. Темп сооружения центров адронной терапии.
В мире, наряду с протонами, сегодня активно работают, аккумулируя результаты радиобиологических, предклинических и клинических исследований, три центра ионной терапии, еще четыре центра сооружаются. В ближайшие годы следует ожидать резкого роста темпа сооружения центров ионной терапии и быстрого приближения их числа к числу клинической центров протонной терапии.
В настоящее время оборудование центров протонной терапии «под ключ» поставляется целым рядом известных зарубежных фирм (Мицибуси, Хитачи, IBA, Сименс и др.). Стоимость центров в зависимости от комплектации и локальных условий колеблется от 70 до 100 миллионов долларов США.
Сегодня в клинических центрах адронной терапии достоверно подтверждено улучшение результатов лечения онкологических больных по большинству критериев:
- повышение уровня локального контроля первичного очага после проведения однократного (самостоятельного, сочетанного, комбинированного) курса лечения;
- снижение уровня и тяжести постлучевых реакций и осложнений;
- увеличение уровня безрецидивной 5-ти летней выживаемости больных, улучшения качества жизни.
Социальный эффект при повышении результатов лечения несомненен и не требует специальных объяснений. Для оценки экономической эффективности достаточно привести лишь один (он далеко не единственный) показатель, статистически достоверно исследованный в Западной Европе и США. Среднестатистическая стоимость лечения больного, которому локальный контроль первичного очага и безрецидивная пятилетняя выживаемость была обеспечена путем проведения одного курса лечения, в 5 (пять!) раз ниже, чем стоимость лечения при двукратном и более курсах лечения. Уровень локального контроля и 5-ти летней безрецидивной выживаемости после однократного курса лечения в центрах адронной терапии несомненно выше, чем в традиционных, функционирующих сегодня радиологических отделениях, использующих рентгеновское, электронное и гамма - излучения.
В России с 1967 года введены в строй и активно функционируют три экспериментальных центра протонной терапии. Центр ПЛТ Объединенного института ядерных исследований (Дубна, с 1967 г., 514 больных), Центр ПЛТ Института теоретической и экспериментальной физики (Москва, с 1969 г., 4000 больных), Центр ПЛТ Центрального научно-исследовательского рентгенорадиологического института и С.Петербургского института ядерных исследований (С.Петербург, с 1974 г., 1200 больных). К моменту запуска в 1990 г первого в мире клинического центра ПЛТ (г. Лома-Линда, США) в России было сосредоточено почти треть клинического мирового опыта протонной терапии – около 3000 больных (рис.16). Развитие и увеличение масштабов применения адронной терапии в России с 1990 г. практически прекратилось. Лишь в 2006 году стартовал и успешно развивается один региональный Проект – клинический Центр ПЛТ в ГКБ им. С.П. Боткина в Москве.
Проект выполняется в соответствии с общепринятыми во всем мире требованиям к подобным центрам. Ход проекта показывает, что создание Центра может быть полностью осуществлено силами отечественных разработчиков и изготовителей.

Рис.16. Число пациентов в год по странам и континентам.
Как уже отмечалось, к 1990 г. (к моменту пуска первого в мире клинического центра ПЛТ в Лома-Линде, США) в России в трех экспериментальных центрах ПЛТ была накоплена почти треть мирового клинического опыта протонной терапии. Проект первого в стране клинического центра протонной терапии был предложен в начале 1990-х годов, но по понятным причинам реализован не был. Лишь в начале 2006 г. Правительство г. Москвы открыло финансирование для сооружения клинического центра ПЛТ при ГКБ им. С.П. Боткина. Сегодня завершен этап предпроектных предложений и эскизный проект всего оборудования Центра. Таким образом, Россия, имея прекрасный задел в области ПЛТ, отстала от мирового сообщества на 15 лет. Факт очень неприятный, но в нем есть и своя позитивная сторона. За эти годы в мире основные принципы сооружения госпитальных адронных центров, их состав и структура клинически востребованы и доказали свою клиническую состоятельность и результативность. Подходы и решения, показавшие свою несостоятельность «отбракованы». Таким образом, начиная сооружение клинических центров адронной терапии сегодня, Россия избавлена от этапа выбора концептуальных решений методом «проб и ошибок». Но это справедливо лишь в отношении принципиальных, концептуальных решений, обусловленных клиническими требованиями. Поиск конкретных технических решений по отдельным элементам оборудования, их параметрам и характеристикам, взаимная адаптация и корелляция этих характеристик без нарушения клинических требований и концепций продолжается и сегодня.
Основные клинические требования к составу, структуре и основным параметрам клинических центров. Именно они определяют общепринятые и апробированные сегодня принципы их сооружения.
- Центр может сооружаться лишь в составе крупной современной больницы, имеющей хорошо оснащенные онкологическую службу и радиологическое отделение со всей присущей им атрибутикой – широкий арсенал диагностических (топометрических) средств, установки конвенциональной (рентген, гамма, электроны) лучевой терапии. Если такого рода больница отсутствует, ее необходимо создавать одновременно с Центром ПЛТ.
- Центр может сооружаться как для совместного использования двух типов излучения (пучки протонов и пучки ионов), так и для использования лишь одного типа излучения.
- Основными элементами центра являются: ускоритель, лучевые установки, системы топометрии, системы дозно-анатомического планирования, мощное информационное технологическое обеспечение.
- Ускоритель является необходимой, но не самой сложной и дорогой частью Центра. Возможно использование синхротрона, циклотрона, линейного ускорителя. Основные требования к ускорителю – надежность и длительный срок непрерывной (без профилактик и ремонта) работы. Основные параметры пучка должны обеспечить облучение как небольших, так и крупных (несколько литров) ЗН, локализованных в любой части тела. При современном состоянии ускорительной техники параметры пучков, генерируемых ускорителями для получения требуемых дозных распределений, легко достижимы. Размер ускорителя, не принципиален.
- Необходимо наличие трех-пяти процедурных кабин для выполнения каждой из задач (протонная терапия, ионная терапия), причем в двух-четырех из них размещаются протонные лучевые установки для ротационного и многопольного облучения лежащего и зафиксированного больного (гантри). К одной из кабин для облучения ионами желательно осуществить подвод пучка с трех направлений: горизонтально, вертикально сверху, под углом 450 сверху. Одна-две кабины оснащаются лучевыми установками, работающими на горизонтальных пучках (онкоофтальмология и радионейрохирургия). Минимальное число кабин для каждой из задач (протонная терапия, ионная терапия) – три и соответствующий годовой поток больных (1000 и более) определяется экономическими соображениями. Максимальное число кабин (не более пяти) лимитируется невозможностью обеспечить пучками адронов от одного источника (ускорителя) большее число лучевых установок. Соотношение числа кабин с гантри и горизонтальными пучками определяется тем, что на последних можно облучать лишь 5÷7% локализаций ЗН от их полного спектра. Сооружение Центров ПЛТ без гантри признано сегодня абсолютно нецелесообразным. Гантри должно обеспечивать возможность облучения больного с любых направлений (4π) без каких либо ограничений. Ввод ограничений по возможным направлениям облучения делает протонную терапию не конкурентоспособной с конвенциональной (рентген, гамма, электроны) лучевой терапией. Необходимость наличия гантри для ионной терапии сегодня окончательно не ясна и не апробирована, хотя и желательна из общих соображений.
В качестве примера показаны планы первых (лечебных) этажей двух центров протонной терапии (рис. 17,18).

Рис. 17. Центр ПЛТ в Мюнхене, Германия 2006
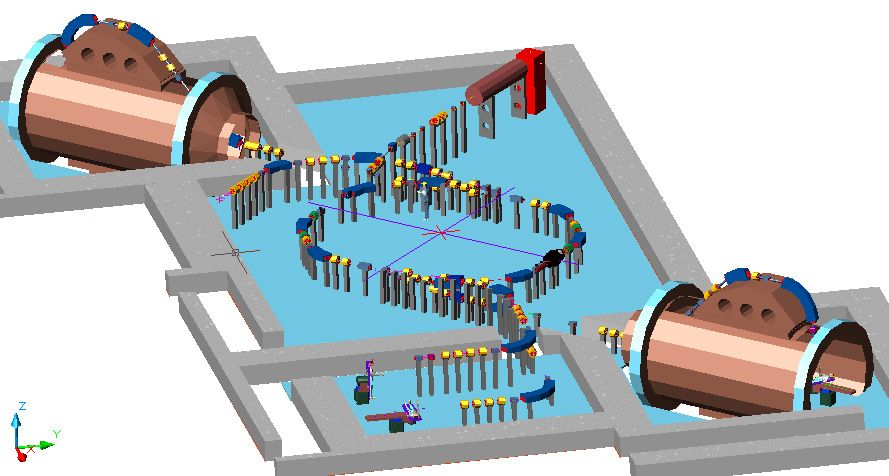
Рис. 18. Проект Центра ПЛТ при ГКБ им. С.П. Боткина, лечебный этаж.
В центре - синхротрон на энергию 250 МэВ; в правом верхнем углу – инжектор (линейный ускоритель); в левом верхнем и правом нижнем углу – установки для ротационного облучения лежащего пациента; в центре внизу – процедурная с двумя лучевыми установками на горизонтальных фиксированных пучках. Основная новация проекта – облучение больных во всех трех процедурных осуществляется одновременно.
Суммируя, можно отметить:
- Адронная терапия является естественным этапом развития дистанционной лучевой терапии.
- Адронная терапия позволяет поднять уровень локального контроля ЗН, снизить частоту и тяжесть постлучевых осложнений, эффективно лечить малые и сверхмалые ЗН, вести облучение ЗН, расположенных вплотную к критическим органам и структурам, эффективно лечить радиорезистентные ЗН.
- Во всем мире активно сооружаются центры протонной и ионной терапии, которые в ближайшие годы позволят осуществлять лечение больших массивов онкологических больных.
- В России по-прежнему работают лишь три экспериментальных центра протонной лучевой терапии в Москве, Дубне и С.Петербурге, где облучено более 5,5 тысячи больных. Максимальный опыт в России накоплен в Центре протонной лучевой терапии Института теоретической и экспериментальной физики (ИТЭФ, Москва) – 4000 больных.
- Клинические испытания терапии быстрыми нейтронами ведутся в России в трех научных центрах – в Обнинске, Томске и Снежинске. Получены успешные клинические результаты при лечении различно локализованных ЗН у более чем 1300 больных. Актуальным является создание нейтронных генераторов, пригодных для размещения в клиниках.
- Поскольку адронная терапия является одним из наиболее эффективных и современных методов лучевого лечения, сооружение в России головного клинического Центра адронной терапии и его тиражирование представляется в высшей степени целесообразным и своевременным.
- В России активно продвигается лишь один региональный проект клинического Центра протонной лучевой терапии для Городской клинической больницы имени С.П. Боткина; проект финансируется Правительством г. Москвы; научный руководитель проекта – Институт теоретической и экспериментальной физики Федерального агентства по атомной энергии РФ.
- Как показало развитие Московского проекта, сооружение клинических центров в России можно и необходимо полностью осуществлять силами отечественных разработчиков и изготовителей – НИИ и заводов (в большой мере ААЭ РФ), опираясь на накопленный отечественный опыт адронной терапии, на научный и производственный потенциал страны.
- Успешное решение проблемы можно осуществить лишь при принятии специальной Федеральной Программы сооружения головного клинического центра адронной терапии и его тиражирования для различных регионов страны и зарубежного рынка; эта Программа наиболее эффективно может быть реализована в рамках национального проекта «Здравоохранение».
- Уже сегодня можно назвать 6-8 регионов России, где подобные центры могут быть сооружены и легко адаптированы к нуждам здравоохранения этих регионов.
- Сооружение подобных центров, несомненно, резко повысит уровень и эффективность онкологической помощи в стране, которая сегодня явно и сильно проигрывает результативности лечения онкологических больных в развитых и развивающихся странах.
4.4. Ионная лучевая терапия.
Пучки легких ионов являются совершенным инструментом для терапии глубоко расположенных радиорезистентных опухолей. Легкие ионы движутся в веществе практически по прямолинейным траекториям, рассеиваясь в нем существенно меньше, чем протоны, и останавливаясь на глубине, определяемой энергией пучка. Как и для протонов, выделение энергии растет с глубиной, достигая Брэгговского максимума, и затем резко уменьшается на расстоянии около миллиметра.
Основное преимущество ионной лучевой терапии в сравнении с протонной связано с радиобиологическими свойствами, позволяющими эффективно разрушать даже резистентные к традиционным видам излучения опухоли.
Преимущественно исследования по ионной лучевой терапии проводятся с пучками ионов углерода.
Клинических центров, в которых используется лучевая терапия ионами углерода, до настоящего времени существенно меньше, чем протонных. Это связано как с относительной сложностью, так и с большой стоимостью их создания.
В России работы по лучевой терапии ионами углерода до последнего времени не велись.
Наиболее интенсивные подобные исследования осуществляются в настоящее время в Японии. С 1994 года в японском Национальном радиологическом институте (NIRS, Чиба) начал работу первый в мире центр-госпиталь, специализирующийся на радиационной ионной терапии. На ускорителе имеется возможность работы на горизонтальных и вертикальном пучках. В этом центре к настоящему времени уже проведено лечение около 2500 пациентов. Основным типом терапевтического пучка на этом ускорителе вплоть до настоящего времени является пучок углерода. Клинические результаты доказали, что применение этой методики позволяет достичь очень высокого уровня излечения раковых заболеваний. Так, двухлетняя местная излеченность при местнораспространенных опухолях головы и шеи составляет 69-80%, гепатоме 78%, раке легкого (T1-2N0M0) 60%, а при раке предстательной железы (T2С) 100%.
В г. Хиого (Япония) завершено строительство еще одного центра протон-ионной терапии с 6 процедурными кабинами. В системах наведения пучков на мишень используются как фиксированные направления, так и гантри, что существенно расширяет терапевтические возможности.
Практические исследовательские работы по ионной лучевой терапии в Европе вплоть до настоящего времени проводятся лишь в Германии, на ускорителе GSI. Работы по радиационной терапии были начаты в 1993 году после многих лет биофизических исследований. В 1997 году в GSI было проведено первое в Европе лечение онкологических больных пучком ионов углерода. К 2006 году число пациентов, прошедших курс ионной лучевой терапии в GSI, достигло более 300. По общему мнению специалистов, лечение первых пациентов прошло чрезвычайно успешно, что послужило толчком к созданию в Германии специализированного ускорительного центра для ионной лучевой терапии в Гейдельберге. Так как ускорители пучков ионов углерода способны ускорять и пучки протонов, а во многих случаях возможно эффективное лечение протонными пучками или совместно протонными и ионными пучками, то разработчики многих проектов полагают, что совершенный центр лучевой терапии должен обеспечивать облучение как ионами углерода, так и протонами.
Преимущества лечения ионной терапией:
- Облучение пучком ионов углерода эффективно подавляет все виды опухолей, включая радиорезистентные.
- Отношение между эффективной дозой в конце пробега к дозе на поверхности больше для ионов углерода, одинаковый биологический эффект в мишени может быть получен при меньших общих дозах облучения.
- Многократное рассеяние для ионов углерода примерно в 4 раза меньше, чем для протонов. Улучшенная локализация углеродного облучения позволяет существенно слабее воздействовать на критические органы, находящиеся вблизи мишени.
- При прохождении пучка ионов углерода через вещество часть пучка превращается в нестабильные изотопы. Наблюдение позитронных распадов этих изотопов позволяет контролировать во время облучения реальное дозовое распределение.
При оценке потребности страны в том или ином виде лучевого лечения необходимо ориентироваться как на мировой опыт, так и на реально имеющиеся в России в настоящее время возможности по эффективной реализации тех или иных технологий.
Целесообразно создать в России на имеющихся ионных пучках 1-2 центра ионной терапии, а затем 2-3 клиническиз центра ионной терапии.
