Статус и перспективы развития ядерой медицины и лучевой терапии в россии на фоне мировых тенденций (аналитическая справка) москва
| Вид материала | Документы |
- Учебная программа дополнительной переподготовки (клиническая ординатура) согласовано, 700.57kb.
- Тематический план лекций по лучевой диагностике и лучевой терапии для студентов 3 курса, 196.63kb.
- Эффективность локальной лучевой терапии костных метастазов, 42.57kb.
- Календарно-тематический план лекций по лучевой диагностике и лучевой терапии для студентов, 165.91kb.
- Использование радиопротекторов в лучевой терапии онкологических больных, 99.16kb.
- Информационно-аналитическая справка, 123.95kb.
- России Москва Россия 11: 00 11: 40 Перспективы исследования маркеров повреждения мозга, 30.01kb.
- Пояснительная записка, 332.93kb.
- Пояснительная записка, 279.81kb.
- История отечественной медицины, 121.51kb.
Перспективные направления развития отечественной радиофармацевтики: - индикаторы для выявления атеросклеротических бляшек; - индикаторы апоптоза; - индикаторы гипоксии; - индикаторы ангиогенеза; - высокоспецифические РФП для диагностики различных новообразований; - предикторы реакции на медикаменты (основанные на оценке рецепторики); - препараты для радиотерапии альфа- и бета-излучателями; - широкое распространение моноклональных антител и пептид-связанной диагностики и радиотерапии; - расширение области применения фтора-18 для ПЭТ и развитие его радиохимии; - развитие лигандных технологий; -применение наномодифицированных материалов для направленной доставки лекарственных средств к органам-мишеням. Основные задачи отечественной ядерной медицины: - модернизация и переоснащение действующих отделений лучевой терапии и радионуклидной диагностики; - организация производства отечественной аппаратуры для лучевой и радионуклидной диагностики и терапии; - организация специализированных производств радионуклидов и радиофармацевтических препаратов по международным правилам GMP; - создание Центров ядерной медицины, включая ПЭТ- центры, в ведущих клиниках страны; - проектирование и строительство палат для лучевой терапии открытыми источниками. 3. Основные направления ядерной медицины. 3.1. Радионуклидная диагностика in vivo. Радионуклидная диагностика (синоним: радиоизотопная диагностика) - лучевое исследование, основанное на использовании соединений, меченных радионуклидами. В качестве таких соединений применяют разрешенные для введения человеку с диагностической и лечебной целью радиофармацевтические препараты (РФП) - химические соединения, в молекуле которых содержится определенный радионуклид. В клинической практике применяют следующие виды радионуклидных исследований: визуализация органов, т. е. получение их радионуклидныx изображений; измерение накопления РФП в организме и его выведения; измерение радиоактивности биологических проб жидкостей и тканей человеческого организма, тесты in vitro. Визуализацию органов осуществляют путем сцинтиграфии и сканирования. В основе сцинтиграфии лежит избирательное накопление и выведение РФП исследуемым органом. Она позволяет изучить топографию органа, выявить в нем морфологические, функциональные и метаболические нарушения. Сканирование, выполняемое для получения статических радионуклидных изображений, так же как и сцинтиграфия, отображает распределение РФП в органе, характеризуя величину органа, его топографию, наличие патологических очагов. Однако, в отличие от сцинтиграфии, этот метод не позволяет провести анализ функциональных нарушений. Отрицательными свойствами данного метода являются большая продолжительность получения сканограммы (несколько десятков минут) и невозможность обработать полученные данные на ЭВМ, что также снижает информативность исследования. Измерение накопления РФП в организме и его выведения, предназначенное в основном для получения информации о функциональном состоянии органа, осуществляют с помощью радиометрии и радиографии. Радиометрия заключается в определении с помощью радиометра величины накопления данного РФП в интересующем органе или патологическом очаге. Типичным примером данного вида paдионуклидного исследования является изучение функции щитовидной железы методом радиометрии накопленного в ней радиоактивного йода. Информация, получаемая с помощью радиографии, идентична полученной при динамической сцинтиграфии, однако точность ее значительно ниже, чем при исследовании на гамма-камере. Преимуществом радиографии являются невысокая стоимость метода и простота исследования. Наиболее широко ее применяют при исследовании почек. Измерение радиоактивности биологических проб (крови, мочи, цереброспинальной жидкости, фекалий и др.) производят для определения функционального состояния систем пищеварения, кроветворения, мочевыделения и др. С этой целью больному различными способами (в вену, внутрь) вводят радиофармацевтический препарат, который благодаря метаболическим превращениям или путем механического переноса может оказаться в той или иной биологической среде. Затем с помощью радиометра определяют активность стандартного количества биологического материала. Таким методом, например, исследуют всасываемость в кишечнике меченых радиоактивных жиров. Радионуклидная диагностика заключается в анализе информации, полученной после введения в организм пациента определенного химического или биохимического соединения, меченного γ-излучающим радионуклидом, с последующей регистрацией пространственно-временного распределения этого соединения в организме с помощью позиционно-чувствительного детектора гамма-излучения. Конечным результатом функциональных радионуклидных исследований является совокупность временных гистограмм (гамма-хронограмм). Полученные в лаборатории статические изображения изучаемого органа свидетельствуют о наличии и размере патологической области с аномальным распределением радиофармпрепарата. Изображения органов, избирательно концентрирующих препарат, получают методом сцинтиграфии. Пространственно – временная картина распределения радионуклида дает представление о топографии, форме и размерах органа, а также о наличии в нем патологических очагов. Радионуклидная диагностика даёт информацию о функциональной активности ткани. Распределение радиофармпрепаратов зависит от кровотока и метаболической активности, поэтому методы ядерной медицины в большей степени направлены на функциональное исследование органов и систем, и в меньшей - на анализ их анатомо-морфологических особенностей. Этим методы ядерной медицины принципиально отличаются от рентгенологических и ультразвуковых методов исследования, которые фиксируют лишь анатомо-морфологические особенности органов или тканей. Функциональные изменения, намного опережающие анатомические, делают методы ядерной медицины уникальными как в ранней диагностике заболеваний, так и при динамическом наблюдении, при этом разовая лучевая нагрузка на пациента приблизительно в 100 раз меньше, чем при обычном рентгенологическом обследовании. Методы ядерной медицины являются альтернативой так называемым методам функциональной диагностики (электрокардиография и электроэнцефалография), электрические феномены которых косвенно отражают кровоток и метаболизм. Прямое отображение кровотока, микроциркуляции и метаболизма (в том числе и объемное) миокарда и головного мозга методами ядерной медицины обеспечило стремительный прогресс кардиологии и неврологии. Радиофармпрепараты дают возможность получать изображения мест с аномальным метаболизмом, что позволяет визуализировать опухоли, воспаления или места тромбоза. Кроме того, радионуклидная диагностика предназначена для решения таких задач, как определение показаний к проведению хирургической операции резекции печени у больных первичным раком; своевременная корректировка курсов лучевой терапии больных с метастазами опухолей различных локализаций; оптимизация плана прицельного лечения на клеточном уровне в послеоперационном периоде; точная локализация границ оперативного вмешательства при саркомах нижних конечностей; установление возможности отказа от калечащей операции ампутации нижних конечностей при саркоме после химиотерапии; определение пригодности кожного лоскута для пересадки при пластической операции восстановления молочной железы у женщин после мастэктомии по поводу рака молочной железы; выработка оптимальной тактики послеоперационного лечения и реабилитации больных после операции по поводу саркомы, в частности, установления возможности и сроков протезирования нижней конечности. Для проведения радионуклидных исследований необходимы соответствующие, меченные радионуклидами, препараты и аппаратура для получения изображений распределения радионуклида в теле пациента. Современное развитие ядерной медицины характеризуется прежде всего разработкой уникальных новых радиофармпрепаратов, которые позволяют оценивать состояние различных органов и тканей организма на клеточном уровне. Наиболее перспективным является создание пептидных препаратов, меток рецепторов, которые позволяют проводить исследования патогенных заболеваний. Не все радионуклиды могут быть использованы при диагностике. Существуют критерии выбора радионуклида: - оптимальным радионуклидом для радиофармпрепарата является тот, который позволяет получить максимум диагностической информации при минимальной лучевой нагрузке на больного; - радионуклид должен быть чистым гамма-эмиттером; - 100 < гамма-энергия радионуклида < 250 кэВ; - эффективный период полураспада должен составлять величину не менее 1,5 продолжительности проведения теста; - желательно выбирать такой РФП, который быстро поступает в исследуемый орган и быстро выводится из организма, тем самым снижая лучевую нагрузку; - по физическим характеристикам радионуклид должен обладать коротким периодом полураспада; - быстрый распад нуклида также обеспечивает безопасность исследования; - к числу основных требований следует отнести наличие у нуклида γ-излучения, удобного для наружной регистрации; - пригодность РФП обуславливается еще и биологической характеристикой отражения функций организма или отдельного органа (например, избирательное поглощение 131I щитовидной железой). Однако этот критерий не является первостепенным, т. к. в настоящее время стало возможным включать радионуклиды в состав различных химических соединений, биологические свойства которых резко отличаются от используемого нуклида (например, распределение в организме 99mТс в соединении с технефитом, пентатехом, броммезидой и др. совершенно иное, чем собственно 99mТс); - РФП, вводимые внутрь организма, не должны содержать токсических примесей или радиоактивных веществ, которые в процессе распада образуют долгоживущие дочерние нуклиды. На рис. 5 показаны примеры использования некоторых реакторных и ускорительных радионуклидов при диагностике «in vivo». Около 80% всех in vivo диагностических процедур в ядерной медицине связано с использованием технеция-99м или содержащих его препаратов. В настоящее время в Российской Федерации для обеспечения потребностей клиник в подобных препаратах используется комбинированный подход. Производитель поставляет в клинику так называемый сорбционный генератор технеция-99м с активностью 2,4-19,0 ГБк на дату поставки, а также наборы реагентов к нему. Набор реагентов представляет лиофилизованную форму препарата. При добавлении к ней пертехнетата натрия с технецием-99м образуется радиофармпрепарат. К очевидным достоинствам такой комбинированной поставки относятся возможность приготовления препаратов по мере необходимости, а также достаточно длительный срок хранения наборов реагентов. Однако у данного подхода существует ряд важных недостатков.  Рис. 5. Примеры использования различных радионуклидов при диагностике «in vivo». Во-первых, в течение срока эксплуатации генератора объемная радиоактивность пертехнетата натрия с технецием-99м, элюируемого из генератора, падает, причем значительно. Такое изменение сильно влияет на качество радиофармпрепаратов, получаемых с помощью набора реагентов. Во-вторых, каждый пользователь вынужден наладить в отделении ядерной медицины систему контроля качества препаратов, приготовляемых с использованием технеция-99м. Фактически в настоящее время такая работа по контролю качества осуществляется только в небольшом числе российских клиник. По мере ужесточения требований к контролю качества медицинской помощи затраты клиник на работу с генераторами технеция-99м существенно возрастут. В-третьих, даже в крупных городах велико число небольших отделений радионуклидной диагностики. В таких отделениях возможности генератора не используются полностью, что вызывает неоправданные расходы. Современные подходы к организации поставок препаратов с технецием-99м предполагают заказ клиникой препарата с технецием-99м у производителя в режиме реального времени и поставку радиоактивности в городских условиях в течение 1,0-1,5 часов. В этом случае используются так называемые централизованные экстракционные генераторы технеция-99m. Подобная схема является более сложной для производителя, но более удобной и выгодной для клиник. Использование этих радиофармпрепаратов требует оснащение соответствующей техникой в первую очередь эмиссионными и, особенно, позитронными томографами. Для получения изображений при радионуклидной диагностике используются в настоящее время, в основном, две технологии – ОФЭКТ и ПЭТ. 3.1.1. Однофотонная эмиссионная компьютерная томография (ОФЭКТ). Гамма-камеры используются для фиксации изображений, полученных с помощью излучения, испускаемого специальными введенными внутрь радионуклидами. Этот метод позволяет исследовать анатомию и функционирование различных органов, а также выявлять костные патологии. Широкое разнообразие радиофармацевтических препаратов и используемых методик позволяет производить диагностику практически любого органа. На рис.6 показана схема получения изображения распределения радионуклида при диагностике «in vivo» методом ОФЭКТ.  Рис. 6. Принцип получения изображения распределения радионуклида при диагностике «in vivo». Однофотонная эмиссионная компьютерная томография (ОФЭКТ, SPECT) наиболее часто используется для получения изображений костей (все тело), исследований перфузии (прохождение крови через сосудистое русло) мозга, кардиоисследований, на которые приходится примерно треть всех ОФЭКТ-процедур. С помощью последовательного получения изображений гамма-камера может отобразить протекание крови через различные органы, включая мозг, легкие, печень, почки. Также гамма-камера помогает врачам в диагностике патологических изменений, таких как кисты, опухоли, гематомы, надломы костной ткани, области остеогенеза (хрупкости костей), патологии коры и белого вещества. В дополнение к этому гамма-камера может работать в паре с компьютером и оценивать кардиологические функции и перфузии, например, ОФЭКТ может выполнить визуализацию перфузии сердечной мышцы с помощью таллия-201 и технеция-99m. Кроме того, ОФЭКТ используется для выявления бессосудистого некроза (омертвления) головки бедра, остеоартрита (дегенерация суставного хряща) колена, метастатической болезни печени, патологии височно-нижнечелюстного сустава, глубоко расположенных гемангиом (врожденная аномалия, при которой пролиферация клеток эндотелия приводит к образованию скоплений, напоминающих опухоль) малого размера, метаболизма в костной ткани при гиперпаратиреоидизме (повышенная секреция паращитовидными железами) и тиреотоксикозе (состояние, вызванное избыточным количеством эндогенного или экзогенного тиреоидного гормона). Эти методики уменьшают необходимость инвазивной радиологии. Мозговые ОФЭКТ-исследования используются для прогнозирования инсультов, СПИДа, комплекса слабоумия, психиатрических заболеваний и болезни Паркинсона. Точное совпадение (одинаковость) при формирования изображений успешно используется для достоверной диагностики в нейрологии, онкологии и кардиологии. Гамма-камера регистрирует и подсчитывает количество фотонов, испускаемых исследуемым органом и формирует карту вспышек каждого из них в пространстве, строя таким образом изображение органа. Статические изображения отображают данные, полученные в конкретной точке в течение исследования, динамические изображения отображают изменения результатов измерения с течением времени. Гамма-камера состоит из коллиматора, детектора на базе сцинтилляционного кристалла, фотоэлектронных умножителей, электронной схемы определения положения и величины вспышек, компьютера для отображения и консоли оператора. Также используются интегрированный компьютер и/или отдельная система захвата изображения и рабочая станция для визуализации. Система для диагностики всего тела требует также наличия подвижного детектора, который проходит вдоль пациента, либо подвижного стола, который движется под неподвижным детектором. ОФЭКТ-системы требуют наличия подвижного гантри для крепления и вращения головки камеры и коллиматоров по круговой, эллиптической или повторяющей контур тела траектории. Некруговые траектории позволяют головке камеры быть ближе к телу пациента, таким образом увеличивая пространственное разрешение. Программное обеспечение содержит большое количество протоколов для обработки изображения. Наиболее распространенными функциями являются: - сглаживание изображения, нормализация и интерполяция; - соединение и вычитание изображений; - вычитание фона; - увеличение контраста; - циклический показ последовательности изображений (режим кино); - реконструкция и отображение зоны интереса; - построение и отображение графиков и гистограмм. Кардиологические приложения включают съем данных за один проход, распределительный режим съема данных, автоматическое распознавание границ, определение конечно-систолического и конечно-диастолического объемов, ударного объема сердца, минутного сердечного выброса, общей фракции выброса и т. д. Системы с несколькими детекторами позволяют уменьшить время получения изображения и получить более высокое разрешение, однако стоимость двухдетекторной системы может вдвое превышать стоимость системы с одним детектором. В зависимости от планируемых клинических применений может быть создана и определенная ОФЭКТ-система. Камера с двумя детекторами идеально подходит для исследования всего тела за один проход и общих ОФЭКТ-исследований. Двухдетекторная камера с изменяемым углом между детекторами (90, 101 и 180 градусов) позволяет лечебному учреждению планировать гораздо более широкий спектр исследований. Сканирование всего тела и общие ОФЭКТ-исследования выполняются в положении 180 градусов, а кардио- и некоторые другие исследования требуют положения 101 и 90 градусов. Лечебные учреждения, планирующие приобретение более одной гамма-камеры или дополнительных камер к уже имеющимся, должны проработать вопрос об их интеграции в компьютерную сеть. Для обеспечения совместимости желательно приобретать системы ядерной медицины одного производителя. Это облегчит обучение персонала, техническое обслуживание и приобретение запасных частей. Еще одним немаловажным фактором при выборе системы следует считать ее размеры и вес, а так же требование к температуре и влажности в помещении. 3.1.2. Позитронная эмиссионная томография (ПЭТ). Позитронная эмиссионная томография — радионуклидный ссылка скрыта метод исследования внутренних органов ссылка скрыта. Метод основан на регистрации пары гамма-квантов, возникающих при аннигиляции позитронов из радиофармпрепарата, вводимого перед исследованием. В основе этого метода лежит возможность при помощи специального детектирующего оборудования (ПЭТ - сканера) отслеживать распределение в организме биологически активных соединений, меченных позитрон-излучающими радионуклидами. ПЭТ, основы которой заложены в середине 1970-х годов, в настоящее время является мощнейшим и уникальным инструментом, одним из самых информативных диагностических методов, применяемых в ядерной медицине. Она представляет собой неинвазивный метод определения концентраций соединений, меченных позитронными эмиттерами, в заданных исследователем биологических тканях. Неоспоримое преимущество ПЭТ заключается в его уникальной чувствительности, примерно на два порядка большей, чем у однофотонной эмиссионной компьютерной томографии. Присутствие среди позитронных эмиттеров радионуклидов основных элементов-органогенов (углерод, азот, кислород) позволяет использовать меченные этими радионуклидами самые разнообразные биологически активные соединения, содержащиеся в нормально функционирующем живом организме. ПЭТ - метод, который позволяет выявлять ранее неизвестные отклонения от нормы в функционировании систем, например, головного мозга, дает клиницисту возможность связывать и количественно оценивать наблюдаемые патологические отклонения с дисфункцией биохимических и/или физиологических параметров и таким образом открывает перед ним новые возможности, как в терапии, так и в хирургии. В основе принципа ПЭТ (рис.7) лежит явление регистрации двух противоположно направленных гамма-лучей одинаковых энергий, возникающих в результате аннигиляции. Процесс аннигиляции происходит в тех случаях, когда излученный ядром радионуклида позитрон встречается с электроном в тканях пациента. 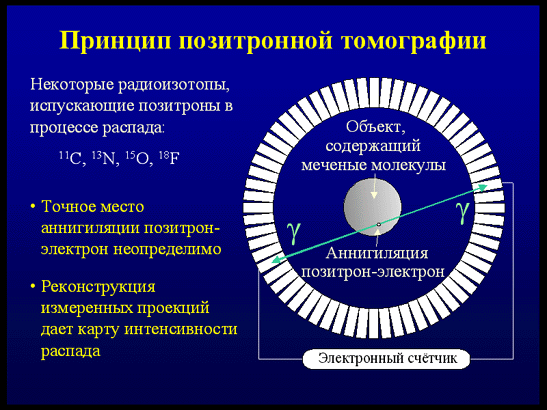 Рис. 7. Принцип позитронной эмиссионной томографии. Радиофармацевтические препараты (РФП), использующиеся при ПЭТ, представляют собой, как правило, вещества, участвующие в различных метаболических процессах. В таких соединениях стабильные нуклиды замещаются на соответствующий радионуклид. Особенностью РФП для ПЭТ является также необычность условий их синтеза - использование так называемых ультракороткоживущих радионуклидов (УКЖР) и работа с ничтожными количествами. Потенциал ПЭТ в значительной степени определяется арсеналом доступных РФП. Именно выбор подходящего РФП позволяет изучать с помощью ПЭТ такие разные процессы, как метаболизм, транспорт веществ, лиганд-рецепторные взаимодействия, экспрессию генов и т.д. Использование РФП, относящихся к различным классам биологически активных соединений, делает ПЭТ достаточно универсальным инструментом современной медицины. Поэтому разработка новых РФП и эффективных методов синтеза уже зарекомендовавших себя в настоящее время становится ключевым этапом в развитии метода ПЭТ. На сегодняшний день в ПЭТ в основном применяются позитрон - излучающие радионуклиды элементов второго периода Периодической системы: углерод-11 (ссылка скрыта= 20,4 мин.), азот-13 (T½=9,96 мин.), кислород-15 (T½=2,03 мин.) и фтор-18 (T½=109,8 мин.). Фтор-18 обладает оптимальными характеристиками для использования в ПЭТ: наибольшим периодом полураспада и наименьшей энергией излучения. С одной стороны, относительно небольшой период полураспада фтора-18 позволяет получать ПЭТ изображения высокой контрастности при низкой дозовой нагрузке на пациентов. Низкая энергия позитронного излучения обеспечивает высокое пространственное разрешение ПЭТ изображений. С другой стороны, период полураспада фтора-18 достаточно велик, чтобы обеспечить возможность транспортировки РФП на основе фтора-18 из централизованного места производства в клиники и институты, имеющие ПЭТ сканеры (т.н. концепция сателлитов), а также расширить временные границы ПЭТ- исследований и синтеза РФП. Для наработки основных УКЖР, применяемых в ПЭТ, чаще всего используют специализированные малогабаритные циклотроны или радионуклидные генераторы. Из-за короткого времени жизни (от 2 минут у кислорода-15 до 110 минут у фтора-18) этот циклотрон, а также установки для синтеза соответствующих РФП должны находиться в непосредственной близости от позитронного эмиссионного томографа. Исключение составляют РФП с фтором-18. Его относительно большой период полураспада (110 минут) позволяет поставлять меченные им соединения в виде уже приготовленных РФП в клиники, не имеющие своего производства позитронных эмиттеров и РФП. Ежедневно один специализированный циклотрон может обеспечивать работу до 10 позитронных эмиссионных томографов. Важным обстоятельством является то, углерод-11, азот-13 и кислород-15 являются радионуклидами биогенных элементов, что выгодно отличает ПЭТ от других методов радионуклидной диагностики, например, от ОФЭКТ, в которой используют радионуклиды металлов, а меченое соединение вводится в организм в составе комплексного соединения, что создает определенные проблемы при интерпретации полученных данных, связанных с неопределенностью его судьбы в организме. Что касается использования в ПЭТ фтора-18, который не является радионуклидом биогенного элемента, то следует отметить, что введение его в РФП вместо атомов водорода практически не изменяет, с некоторыми оговорками, химических свойств соединения. Разработан многочисленный ряд тестов с использованием позитронной эмиссионной томографии, позволяющих изучать различные биологические характеристики опухолей. Наиболее широкое применение в онкологии получили исследования клеточной энергетики с использованием меченной фтором-18 дезоксиглюкозы. Принцип теста основан на том общеизвестном факте, что опухолевая ткань по сравнению с нормальной поглощает значительно большее количество глюкозы. Меченая глюкоза, введенная внутривенно, аккумулируется в опухолевых клетках в количестве, позволяющем выявлять очаги ее повышенного накопления с помощью детекторной системы позитронного эмиссионного томографа. Ещё одним из важных достоинств позитронной эмиссионной томографии является то, что одно единственное исследование позволяет за 40-60 минут выявлять очаги опухолевого процесса и в печени, и в тканях головного мозга, в легких, в различных отделах скелета, лимфатических узлах. В некоторых случаях применение ПЭТ может исключить необходимость применения всех других диагностических методов. Являясь одним из наиболее информативных, точных и чувствительных методов обнаружения патологических изменений в организме, позитронная эмиссионная томография определяет сегодня научный и практический уровень клинической медицины. Кроме перечисленных выше четырех УКЖР для ПЭТ могут быть применяться и другие позитронные эмиттеры, для производства которых могут быть использованы ядерные реакторы (медь-62), радионуклидные генераторы, как вторичные источники (медь-62, цинк-62, галлий-68, рубидий-82, индий-110 и другие), а также ускорители заряженных частиц (кобальт-55, медь-64, бром-75,76, иттрий-86, цирконий-89, йод-124 и другие). Применение в ПЭТ других позитронных эмиттеров обусловлено разными причинами. Некоторые из них с успехом могут заменить УКЖР при сравнительной дешевизне и простоте обращения. Другие, например, галлий-68, индий-110 являются радионуклидными аналогами широко используемых в ОФЭКТ радионуклидов – галлий-67, индий-111, которые уже несколько десятилетий применяются для визуализации самых разнообразных систем и процессов в организме. Поэтому их использование целесообразно не только потому, что оно может проводиться на хорошо разработанной методической основе, но также дает возможность сравнения данных, полученных двумя независимыми методами. Использование в ПЭТ таких позитронных эмиттеров, как бром-76 и йод-124 в силу их медленного радиоактивного распада дает возможность визуализации таких процессов в организме, которые протекают с относительно незначительной скоростью. Первые исследовательские позитронные эмиссионные томографы появились в начале 1970-х годов. Первые коммерческие томографы появились только к концу 1970-х годов. Первые аппараты были оборудованы малым числом детекторов. Не было возможности одновременного сбора информации для нескольких срезов, толщина срезов была большая. Но даже отсутствие возможности детализации анатомических структур по данным ПЭТ не смогло сдержать распространение метода в клиниках. ПЭТ непрерывно совершенствуется. Появляются новые РФП, протоколы клинических исследований и сами позитронные эмиссионные томографы. В последние годы все крупные зарубежные производители медицинского диагностического оборудования, стремясь сделать метод ПЭТ доступным для клиник разного уровня, предлагают ПЭТ-сканеры с различными характеристиками и качеством получаемых изображений. К ним относятся томографы с конструкцией детекторов в виде сплошного и незамкнутого кольца, гаммы-камеры двойного назначения с двумя либо с тремя детекторными головками, работающие в режиме совпадений и однофотонного детектирования, а также ПЭТ-сканеры, совмещенные с многосрезовыми компьютерными томографами (КТ). Такие аппараты позволяют за одно исследование получать функциональные (ПЭТ) и анатомические (КТ) данные. Исходно предполагалось, что основным применением ПЭТ станет кардиология, однако в настоящее более 90% исследований составляет онкология. Расширяются возможности этого метода для диагностики в неврологии. Постоянное совершенствование аппаратного и программного обеспечения позитронных эмиссионных томографов позволило существенно снизить лучевую нагрузку на пациента и одновременно повысить информативность исследований. В мире на начало 2005 г. функционировало около 300 полных ПЭТ-центров и ежегодно открывается свыше 15 новых ПЭТ-центров. Число ПЭТ-сканеров – более 2000, а общее количество ПЭТ-исследований составило около 2 500 000. Под термином «Полный ПЭТ-центр» подразумевается медицинский комплекс, в состав которого входит специализированный циклотрон для производства УКЖР, радиохимическая лаборатория для синтеза РФП и один или несколько позитронных эмиссионных томографов. В настоящее время в США и других странах получила развитие и другая система организации ПЭТ-исследований. В этом случае один полный ПЭТ-центр снабжает мечеными соединениями близкорасположенные к нему другие медицинские учреждения, имеющие только позитронные эмиссионные томографы. При такой организации резко выросло, как количество медицинских учреждений, проводящих ПЭТ-исследования, так и число позитронных эмиссионных томографов. Если в 2000г. в США было около 200 томографов, то по оценкам американских специалистов в области медицинских услуг в 2020г. их будет установлено более 2000. Такой сценарий развития ПЭТ в США обусловлен еще и тем, что более 500 медицинских страховых компаний страны включили этот вид услуг в свои программы медицинского страхования. В России по состоянию на январь 2008 г. работало только 4 полных ПЭТ-центра (2 – в Петербурге, 2 – в Москве) и 10 позитронных эмиссионных томографов. По оценкам специалистов, использование самой современной высокой технологии в ядерной медицине – метода ПЭТ – требует организации полных ПЭТ-центров из расчета 1 центр на 1,0-1,5 млн. человек населения. Статус и перспективы технологий позитронной эмиссионной томографии в медицине. Периоды полураспада, характерные для большинства позитрон-излучающих радионуклидов (единицы, десятки минут), требуют наличия в составе госпитально-дислоцированных ПЭТ-центров следующего достаточно сложного и дорогого оборудования:
Все это обусловило довольно высокую стоимость ПЭТ-метода, что существенно сдерживало внедрение его в клинику, особенно в первые 15-20 лет. В эти годы большинство специалистов считало, что ПЭТ должен использоваться в основном для исследований фундаментальных проблем медицины и биологии. Однако за более чем 30-летний период метод успешно прошел стадию экспериментальных исследований, продемонстрировал свои широкие возможности для клинической диагностики и в последние годы активно внедряется в клиническую практику. Важность клинического значения ПЭТ состоит в том, что этот метод позволяет:
В последние 10-15 лет современные госпитали в мире стали активно оснащаться ПЭТ-центрами. На возникшем и быстро расширяющемся рынке оборудования для ПЭТ центров стали работать такие ведущие мировые фирмы как «Дженерал Электрик» (США), CTI (США) и IBA (Бельгия), которые разработали и выпускают циклотроны специально для ПЭТ-центров, фирмы «Сименс» (Германия), «Дженерал Электрик» (США), «Филипс» (Голландия), которые и организовали выпуск различных ПЭТ-сканеров (томографов) для ПЭТ-исследований. Необходимо отметить, что, если до начала второго тысячелетия этими фирмами выпускались ПЭТ-сканеры только для ПЭТ-исследований, то, начиная с 2005 эти фирмы прекратили выпуск таких ПЭТ-сканеров и перешли на производство комбинированных томографических систем, так называемых ПЭТ-КТ, где совмещены ПЭТ и компьютерный многосрезовый томограф. Несмотря на более высокую стоимость такого оборудования (порядка 3,5-4,5 млн. долларов США по сравнению с 1,5-2,5 млн.), заметное улучшение качества диагностики, получаемое при их использовании, не только уменьшило, а даже увеличило спрос на эти установки. В 2005-2006 г. эти фирмы выпустили и продали по несколько сотен таких ПЭТ-КТ. Различные подходы при организации ПЭТ-исследований. В настоящее время в зависимости от ориентации основной деятельности госпиталя, его местоположения и популяции населения, которое он должен обслуживать, возможны различные подходы при организации ПЭТ-исследований. 1. Исследовательские ПЭТ-центры. В таких центрах, которые создаются на базе крупных научно-исследовательских медицинских центрах, помимо клинической работы ведется большой объем исследований ПЭТ-методами в области биология и физиология, ведется разработка новых радиофармпрепаратов и методов ПЭТ-диагностики, изучается фармакинетика препаратов. Поэтому в составе оборудования такого центра обычно предусматривается циклотрон с энергией 16-18 МэВ по протонам, причем зачастую эта машина может ускорять и дейтроны до энергии 8-9 МэВ. ПЭТ-центр оснащается обычно 2-3 ПЭТ-сканерами, в том числе и мини-ПЭТ для исследований на животных, имеет хорошо оснащенную для ведения широкого спектра исследований лабораторию для синтеза и анализа РФП. Стоимость оборудования такого центра может составлять 9-15 млн. долларов США. 2. Клинические ПЭТ-центры. Такие центры создаются при госпиталях, ведущих большой объем клинической работы в различных областях медицины. В этом случае в составе ПЭТ-центра необходимо иметь небольшой циклотрон для наработки ПЭТ-радионуклидов (обычно это ускоритель на энергию протонов 9-13 МэВ), специализированную лабораторию для экспресс-синтеза РФП и ПЭТ-сканеры (от 1 до 3 томографов в зависимости от пропускной способности госпиталя) для диагностических исследований методом ПЭТ. Стоимость такого центра может составлять 6-10 млн. долларов США.
Обычно такие центры создаются при небольших клинических учреждениях и имеют в своем составе только 1-2 ПЭТ-сканера, для которых препараты должны быть привозными (например, из близлежащего ПЭТ-центра с собственным ускорителем), и где широко могут использоваться генераторные ПЭТ-препараты. Стоимость такого центра может составлять от 3 до 6 млн. долларов США.
Такие фабрики создаются на базе достаточно мощного ускорителя с энергией протонов от 10 до 20 МэВ и имеют в своем составе хорошо оснащенные лаборатории для синтеза препаратов, анализа готовой продукции, точной расфасовки. Фабрика должна быть способна обеспечить препаратами (в основном на основе F-18) несколько десятков ПЭТ-сканеров, находящихся в радиусе до нескольких сотен километров от нее. Стоимость такой фабрики, с учетом оснащения радиохимической лаборатории и необходимых служб, может составлять до 5-6 млн. долларов США.
Для обеспечения ПЭТ-диагностикой населения небольших населенных пунктов в отдельных регионах используются ПЭТ-сканеры, установленные в специально подготовленном и оснащенном автомобиле-траке. Такой мобильный ПЭТ может перемещаться по определенному графику по территории региона и осуществлять диагностику пациентов, получая привозные препараты или используя генераторные ПЭТ-препараты. 6. Мобильные ПЭТ-комплексы. В конце 90-х годов в США был разработан специальный линейный ускоритель протонов на энергию частиц 7 МэВ для использования в ПЭТ-центрах. Малые габариты и вес такого ускорителя позволили разместить его в автомобиле (траке), и создать мобильный ускоритель, на котором можно нарабатывать радионуклида для ПЭТ-исследований. Таким образом, это позволяет создавать самостоятельные мобильные ПЭТ-комплексы, в которых есть весь необходимый набор оборудования для обеспечения ПЭТ-диагностики (рис.8).   Рис.8. Мобильные ПЭТ-комплексы. В мире сегодня уже действует несколько сотен ПЭТ-центров с собственными ускорителями и тысячи функционирующих ПЭТ-сканеров. В ряде развитых стран уже созданы или активно развиваются сети ПЭТ-исследований для обеспечения этим методом населения всех регионов страны. При этом, создаются как полноценные ПЭТ-центры, так и “саттелитные” ПЭТ-центры. В США создаются и успешно эксплуатируются мобильные ПЭТ, с помощью которых ПЭТ-диагностикой обеспечивается население небольших населенных пунктов, где экономически нецелесообразно создавать полноценные ПЭТ-центры. Метод имеет большое будущее и эксперты считают его наиболее перспективным среди методов радионуклидной диагностики. Потенциальный рынок метода весьма велик, т.к. по оценкам специалистов сегодня потребность в ПЭТ-методе может быть обеспечена при наличии 1 ПЭТ-сканера на популяцию населения около 0,5 миллиона человек. Выполненные и ведущиеся отечественные разработки. В России работы по созданию оборудования для отечественных ПЭТ-центров были начаты в 1990 г. в ГНЦ РФ ИТЭФ (Москва) и ФГУ РНЦ «Курчатовский институт» (Москва). К настоящему времени наибольшее развитие эти работы получили в ГНЦ ИТЭФ, ООО «Научно-производственная фирма ПОЗИТОМ-ПРО» (Москва) и НИИЭФА им Ефремова (С.-Петербург) при активном участии таких медицинских учреждений как ЦНИРРИ (С.-Петербург), Центр сердечно-сосудистой хирургии им. Бакулева (Москва) и РКНПК МЗ РФ (Москва). В состав необходимого технологического оборудования ПЭТ-центра входят:
Ускорители для ПЭТ-центров.
Рис.9. Специальный ускоритель СС-18 для наработки позитронных радионуклидов.
Рис.10. Циклотрон СС-12 на энергию протонов 12 МэВ для клинических ПЭТ-центров. Мишени и мишенные системы.
     Рис.11. Газовые и жидкостные мишени для наработки углерода-11, фтора-18 и азота-13.
Блоки радиохимичекого синтеза.
Рис.12. Блоки автоматизированной радиохимии для синтеза РФП.
Специальное защитное оборудование для ПЭТ-центров.
ПЭТ-сканеры (томографы).
Рис.13. Полномасштабный прототип полнотельного ПЭТ-сканера.
Радионуклидные генераторные системы для ПЭТ-диагностики. Учитывая, что стоимость ПЭТ-центра с собственным ускорителем довольно высокая, внедрение в клинику этого весьма перспективного метода идет не теми темпами, которого он заслуживает. Одним из возможных способов решения этой экономической проблемы является использование генераторных позитрон-излучающих нуклидов, когда можно обойтись без специального ускорителя и радиохимической лаборатории в госпитале. К числу таких генераторов, которые могли бы доставляться в клиники и широко использоваться в рутинной диагностике, относятся Rb-82, Ga-68, I-122, Cu-62 и др. Технология производства таких генераторов в России не только возможна, но для многих из них уже разработана.
Перспективы отечественных ПЭТ-технологий и оборудования. Россия располагает учеными и специалистами, технологиями и производственными возможностями для освоения выпуска технологического оборудования для ПЭТ. Задача организации выпуска отечественного конкурентоспособного оборудования для ПЭТ-исследований представляется вполне реальной и может быть реализована в достаточно короткие сроки. Полученные, проверенные и отработанные при разработке опытных образцов научные, технологические и инженерные решения позволят соответствовать самым современным мировым параметрам аналогичных технологий и оборудования, тенденциям их дальнейшего развития. Целесообразность создания и конкурентоспособность отечественного комплекса определяется, прежде всего, тем, что его стоимость по сравнению с зарубежными аналогами будет ниже на 30-50% при аналогичных технико-технологических параметрах и аналогичных (а для большей части оборудования даже более высоких) эксплуатационных и функциональных характеристиках. Действительно, стоимость ПЭТ-центра с использованием отечественного оборудования (циклотрон на энергию протонов 12 МэВ или 18 МэВ, мишенная система для наработки радионуклидов, автоматизированная радиохимическая лаборатория, специальное защитное оборудование для радиохимической лаборатории), и ПЭТ-сканеров одной из зарубежных фирм (например, фирмы «Филипс») составит – от 6 до 11,0 млн. долларов, в зависимости от комплектации, по сравнению с 9-15 млн. долл. полностью импортной комплектации. Вторым, не менее важным фактором, является гораздо более дешевая (в несколько раз) эксплуатация отечественного оборудования и возможность заметно сократить сроки устранения возможных неполадок с помощью отечественных разработчиков. И, наконец, отечественная техника имеет более полную адаптация к условиям работы в отечественных клиниках (русификация программ, большая функциональная гибкость программных комплексов, доступность для модернизации и т.п.). Поэтому такие комплексы или их компоненты (циклотроны, аппаратура синтеза РФП, защитное оборудование и т.п.) при соответствии мировым параметрам, качестве и надежности будут обладать более привлекательным параметром «цена-качество» не только на внутреннем рынке, но и имеют реальные перспективы для выхода на зарубежный рынок. В процессе разработок будет создан большой объем интеллектуальной собственности, обладающей патентоспособностью и лицензионными возможностями как в части новых технологий (технологии получения радионуклидов, технологии синтеза РФП и т.п.), так и в области научных и инженерных решений при создании столь наукоемкой аппаратуры (ускорительные технологии, принципы создания детектирующих колец ПЭТ-сканеров, процедуры сборы и математической обработки данных, принципы построения цифровой электроники, программные комплексы и т.п.). Перспективы для коммерциализации. Организация выпуска отечественного комплекса оборудования для ПЭТ имеет достаточно высокие перспективы для коммерциализации. Сегодня потребность в ПЭТ-методе может быть обеспечена при наличии 1 ПЭТ-сканера на популяцию населения около 0,5 миллиона человек. В частности, потребность в ПЭТ-исследованиях только для г. Москвы составит 8 - 20 тысяч исследований в год, даже при условии, что ПЭТ диагностике будут подвергнуты лишь от 3% до 5% наиболее сложных диагностических случаев. Даже исходя из условия, что необходимо обеспечить население нашей страны хотя бы 1 ПЭТ-сканером на популяцию в 1 миллион населения, организация в России соответствующей сети по обеспечению населения ПЭТ- диагностикой потребует около 150 ПЭТ-сканеров и 70 - 80 ПЭТ-центров с собственными циклотронами. |