Статус и перспективы развития ядерой медицины и лучевой терапии в россии на фоне мировых тенденций (аналитическая справка) москва
| Вид материала | Документы |
- Учебная программа дополнительной переподготовки (клиническая ординатура) согласовано, 700.57kb.
- Тематический план лекций по лучевой диагностике и лучевой терапии для студентов 3 курса, 196.63kb.
- Эффективность локальной лучевой терапии костных метастазов, 42.57kb.
- Календарно-тематический план лекций по лучевой диагностике и лучевой терапии для студентов, 165.91kb.
- Использование радиопротекторов в лучевой терапии онкологических больных, 99.16kb.
- Информационно-аналитическая справка, 123.95kb.
- России Москва Россия 11: 00 11: 40 Перспективы исследования маркеров повреждения мозга, 30.01kb.
- Пояснительная записка, 332.93kb.
- Пояснительная записка, 279.81kb.
- История отечественной медицины, 121.51kb.
Поэтому реальный потенциальный рынок России в среднесрочной перспективе (в ближайшие 5-8 лет) может составить 10-15 ПЭТ-центров с собственными ускорителями и радиохимическими лабораториями и около 30-50 ПЭТ-сканеров. На этом этапе развитие рынка следует ожидать за счет наиболее развитых регионов России, где могут создаваться региональные ПЭТ-центры, и где есть условия (специалисты, техника и технологии) для их эксплуатации.
Социальная значимость позитронной эмиссионной томографии.
Создание современного отечественного комплекса оборудования и технологий для ПЭТ-исследований и дальнейшая коммерциализация результатов этой работы при создании сети ПЭТ-центров дадут заметные социально экономические эффекты, в числе которых:
- заметное снижение смертности населения от кардиологических и онкологических заболеваний, на долю которых приходится наибольшее число смертей населения России;
- улучшение жизни и здоровья населения за счет более качественной и ранней диагностики, которая позволит гораздо эффективнее осуществлять лечение больных;
- улучшение трудоспособности и увеличение трудоспособного периода населения;
- использование имеющегося и развитие научного потенциала отечественных ученых и разработчиков;
- создание сотни дополнительных рабочих мест для ученых и инженерно-технического персонала;
- развитие импортозамещающих производств;
- увеличение экспортного потенциала отечественных производителей.
Предлагаемая программа работ.
Создание конкурентоспособного отечественного комплекса оборудования для ПЭТ-технологий, пригодного для последующей коммерциализации может быть выполнено в два этапа.
На первом этапе (2008-2010 г.г.) может быть завершено изготовление, технические испытания и сертификация комплекса оборудования для ПЭТ-центров. В таблице 4 представлен перечень первоочередных работ, сроки и объемы их финансировании для обеспечения дальнейшей успешной коммерциализации этого проекта.
Для более успешной коммерциализации выполненных разработок представляется целесообразным вступить в кооперацию с одной из зарубежных фирм, выпускающих ПЭТ-сканеры. Такая кооперация уже вызывает серьезный интерес со стороны фирмы «Филипс», которая выпускает самые современные ПЭТ-КТ, но не имеет собственного производства циклотронов и оборудования для радиохимических лабораторий ПЭТ-центров. Не менее полезным для дальнейшей коммерциализации отечественных разработок может оказаться создание и организация в одном из клинических учреждений России демонстрационного отечественного ПЭТ-центра. Однако создание такого центра потребует и заметных капитальных вложений (порядка 150-180 млн. рублей).
На втором этапе (вторая половина 2010 – 2011 гг.) в процессе выполнения возможных заказов на 1-3 отечественных центра можно будет организовать промышленное производство комплекса оборудования и технологий для ПЭТ-исследований. Мощности такого производства должны обеспечивать выпуск не менее 3 комплексов в год. При этом следует рассмотреть возможность организации выпуска ПЭТ-КТ на одном из этих предприятий совместно, например, с фирмой «Филипс».
Учитывая долгосрочные перспективы (150 ПЭТ-сканеров и порядка 70-80 ПЭТ-центров), следует отметить, что результаты предлагаемой программы могут явиться основой для создания в стране самостоятельной отрасли промышленности с хорошими коммерческими показателями по разработке и производству сложной наукоемкой техники для ядерной медицины.
Таблица 4. Мероприятия первого этапа коммерциализации производства технологического оборудования для позитронной эмиссионной томографии.
| №№ | Мероприятие | Сроки | Стоимость, тыс. руб. |
| 1 | Завершить изготовление, запустить, отладить и сертифицировать циклотрон СС-12 | 2009– изготовление и запуск 2010 - сертификация | 9000 900 |
| 2 | Разработать и изготовить автоматизированные мишенные системы для отечественных циклотронов МСС-18/9 и СС-12 | 2009 | 1600 |
| 3 | Завершить разработку, изготовление и провести технические испытания ПЭТ-сканера для животных. Экспериментальные исследования на животных и оснащение программного комплекса | 2009 2010 | 11 000 600 |
| 4 | Модернизировать и доработать опытные образцы специализированных защитных боксов для ПЭТ-центров. Сертификация боксов. | 2009 | 800 |
| 5 | Расширить номенклатуру аппаратуры для синтеза 1-2 препаратов, перспективных для ПЭТ-исследований. Сертификация разработанной аппаратуры. | 2009 2010 | 1300 400 |
| 6 | Разработать промышленный образец системы для автоматизированной фасовки РФП | 2009-2010 | 1 800 |
| ИТОГО | 27 400 | ||
Предпосылки и необходимое обеспечение работ по выпуску технологического оборудования для ПЭТ.
В настоящее время необходимым требованиям, предъявляемым к разработчикам и производителям сложной медицинской техники, отвечают ГНЦ РФ ИТЭФ (г. Москва) и НПК ЛУЦ НИИЭФА им. Д.В.Ефремова (г. С.-Петербург), которые имеют многолетний опыт создания оборудования для лучевой терапии и диагностики, для ядерной медицины. С точки зрения технической оснащенности и квалификации научных и инженерных кадров ГНЦ РФ ИТЭФ и НПК ЛУЦ НИИЭФА им. Д.В.Ефремова наиболее подготовлены к реализации проекта по организации производства комплекса наукоемкого оборудования для ПЭТ технологий.
ГНЦ РФ ИТЭФ ведет работы в области ПЭТ-технологий с 1986 г. и сегодня уже располагает большей частью необходимого технологического оборудовании, аппаратурой, испытательными и наладочными стендами для реализации 1 этапа. Созданная при ИТЭФ научно-производственная фирма «ПОЗИТОМ-ПРО», ориентированная на работы в области ядерной медицины, располагает научной аккредитацией, лицензиями на конструирование и изготовление изделий и оборудования, содержащих радиоактивные вещества, имеет аттестацию по международному стандарту ISO 9001-2001. В Институте и НПФ «ПОЗИТОМ-ПРО» накоплен самый большой в стране опыт разработок в области ПЭТ-технологий, имеется необходимый научный, инженерно-технический и административный персонал. В Институте есть все предпосылки для организации производства таких частей комплекса, как мишенная система для наработки радионуклидов, автоматизированная радиохимическая лаборатория, специальное защитное оборудование для радиохимической лаборатории, ПЭТ-сканеры. ИТЭФ имеет возможность выделить дополнительные помещения для организации выпуска оборудования при необходимости увеличения объемов тиражирования.
НПК ЛУЦ НИИЭФА обладает современным производством, получившим международную аттестацию по стандарту ISO 9001. На нем реализуются самые сложные технологические процессы обработки материалов, имеется прецизионный станочный парк, цеха сборки и наладки электроники, аттестационные и испытательные стенды. Предприятие располагает необходимыми производственными мощностями, обладает опытом конструкторской разработки и промышленного изготовления ускорительной техники, в частности, циклотронов с энергией до 30 МэВ. Производственные мощности НИИЭФА способны уже сегодня обеспечить выпуск до 3-4 циклотронов в год и для организации выпуска ускорительной части ПЭТ-комплексов институту потребуются совсем небольшие финансовые вложения, на уровне 10 млн. рублей.
3.2. Радионуклидная диагностика in vitro.
К радионуклидной диагностике относится также и метод радиоиммуных исследований «in vitro», то есть «в стекле (пробирке)», без введения радиоактивных препаратов в организм. С помощью радиоиммуного анализа (РИА) можно определять концентрацию биологически активных соединений (гормонов, ферментов, лекарств и других) в биологических жидкостях организма. РИА осуществляют с помощью наборов меченых органических соединений (антигенов, антител, гормонов и т.д.). В качестве радиоактивной метки чаще всего используется йод-125. Его ядерно-физические характеристики удобны для осуществления исследований, а химические свойства йода подходят для осуществления реакций синтеза меченых соединений.
Невизуализирующие радионуклидные методы, в частности РИА, достаточно широко используются в практической ядерной медицине. Так, в странах Западной Европы вклад таких методик в общую структуру радиодиагностических исследований достигает 10-12%.
На сегодня остаются актуальными с практической точки зрения, следующие невизуализирующие методы ядерной медицины:
- радиоимунный анализ,
- определение объема циркулирующей крови,
- дыхательный тест для выявления Helicobacter pylori,
- исследование продолжительности жизни эритроцитов,
- диагностика потери белка и крови желудочно-кишечным трактом,
- ренография, о
- определение йодпоглотительной функции щитовидной железы,
- изучение метаболизма витамина В12 и железа.
РИА был впервые разработан Berson & Yalow (1960) для определения уровня эндогенного инсулина в плазме крови человека. Метод основан на конкуренции определяемого вещества со своим меченым аналогом за ограниченное число мест связывания у высокоспецифичных антител. В тест-системе радиоактивный лиганд связывается со специфическими антителами к немеченому лиганду, в результате чего образуется комплекс «меченый лиганд - антитело». Определяемый гормон (лиганд) плазмы крови конкурирует с меченым аналогом за связывающие места антитела и тем самым снижает взаимодействие последнего с меткой. Вследствие этого соотношение концентраций свободного и связанного с антителом лигандов уменьшается. Связанную и свободную формы меченого соединения разделяют одним из известных способов (адсорбция, фракционное осаждение, метод двойных антител и т.д.)
Заключительными этапами РИА являются радиометрия одной из фракций, построение калибровочной кривой, отражающей динамику изменений радиоактивности связанного (или свободного) лиганда в зависимости от количества внесенного в пробирку немеченого аналога (стандарта). Концентрация гормона в анализируемом образце устанавливается путем сравнения радиоактивности этого образца с уровнем счета в стандартных пробах и перенесения полученного значения на калибровочную кривую.
К преимуществам РИА относятся:
- высокая чувствительность - способность выявлять минимальные количества вещества;
- специфичность - измерение количества только одного строго определенного вещества;
- точность - определение истинного количества вещества;
- возможность повторения результатов в одной пробе при анализе наборами из разных партий.
Недостатками РИА считаются:
- недолговечность хранения меченого лиганда по причине физического распада метки, ее отщепления и радиолиза носителя;
- разрушение лиганда при йодировании;
- необходимость высокой очистки лиганда;
- недостаточная чувствительность при низком содержании определяемого вещества в биологических жидкостях;
- низкая специфичность, обусловленная неселективным связыванием меченого соединения компонентами плазмы крови;
- необходимость предварительной экстракции определяемого лиганда в тех случаях, когда он связан с белками или липопротеидами плазмы, а также при наличии в крови веществ, обладающих перекрестной иммунореактивностью по отношению к определяемому лиганду.
Несмотря на все вышеперечисленные недостатки, РИА в настоящее время является самым распространенным методом радиолигандного анализа.
Для проведения РИА-исследований необходимы так называемые наборы реагентов для радиоиммунологического анализа (РИА-наборы).
На территории бывшего СССР РИА-наборы производились лишь на Опытном заводе при Институте биоорганической химии БССР в г. Минске. В настоящий момент в России отсутствует производство этого вида продукции, и все необходимые диагностические наборы закупаются во Франции, Чехии, Беларуси, Финляндии и США. В 2000 году на закупку РИА-наборов 18 наименований Минздрав России затратил около 52,0 млн. рублей. Примерно столько же собственных средств направили на эти цели медицинские учреждения ведомственного и территориального подчинения. Общая величина российского рынка этой продукции составила в 2000г. 100-105 млн. рублей. В натуральном исчислении закупки 2001г. изменились не сильно.
Динамика Государственного заказа на РИА-наборы выражается следующими показателями:
1998г. -13000 наборов,
1999г. – 2000 наборов,
2000г. – 5000 наборов,
2001г. – 9000 наборов,
2002г. – 15000 наборов.
Затраты на закупку РИА-наборов в 2001г. составили 43% от общей суммы затрат на приобретение различной нуклидной продукции медицинского назначения.
Данные по закупкам РИА-наборов в 2003-2006 годах отсутствуют. Но можно сделать вывод, что спрос на эту продукцию в России существует. Так, например, из 300 млн. рублей, затраченных в 2006 году Минздравом России на централизованную закупку нуклидной продукции медицинского назначения, 119 млн. рублей были израсходованы на РИА-наборы с йодом-125.
Поставку РИА-наборов в Российскую Федерацию выполняют специализированные торговые организации: ГУП В/О «Изотоп», ООО НТЦ «Нуклон», ООО НПФ «Нуклид-Транс».
Естественный вывод. Для того чтобы обеспечить в России проведение РИА-исследований в необходимом объеме нужно срочно организовывать отечественное производство этой продукции.
3.3. Радионуклидная терапия.
В лечении злокачественных и неопухолевых заболеваний эффективно применяются современные технологии с использованием радионуклидов, так называемая радионуклидная терапия (РНТ).
К преимуществам РНТ относятся:
- избирательность повреждения опухоли или патологического очага;
- хорошая переносимость процедуры терапии;
- относительно короткое время госпитализации;
- возможность использования лечения тяжелобольных.
Для РНТ выбирают радионуклиды с оптимальными для этих целей ядерно-физическими свойствами. К числу наиболее значимых свойств относят наличие частиц с высокой линейной передачей энергии при ограниченной длине пробега.
Радионуклидами выбора для РНТ являются:
- α –излучатели с высокой линейной передачей энергии (~80 кэВ/мкм) и коротким пробегом частиц (50-90 мкм), например , 211At, 212Bi;
- β –излучатели с относительно коротким пробегом частиц (520 мкм), например, 33P, 121Sn, 177Lu, 191Os, 199Au;
- β –излучатели со средним пробегом частиц (≥200 мкм при средней величине ~1 мм), например, 47Se, 67Cu, 77As, 106Rh, 109Pd, 111Ag, 131J, 143Pr, 161Tb, 188Re;
- β –излучатели с относительно большим пробегом частиц (в среднем >1мм), например, 32P, 90Y, 186Re;
- радионуклиды, распадающиеся электронным захватом или внутренней электронной конверсии, например, 77Ge, 103Pd, 109Sb, 131Cs, 193Pt, 197Hg.
Особенно перспективным для радионуклидной терапии рака, при лечении микрометастазов опухолей, считают α–излучатели, благодаря более высокой линейной передачи энергии их излучения по сравнению с «мягкими» β–излучателями. Посчитано, что количество α-распада на единицу массы ткани, необходимое для достижения одного и того же терапевтического эффекта, примерно на 3 порядка меньше, чем число β-распадов. Например, “макроскопическая” доза α–излучения 211At (E α = 5.87 МэВ) в 300-400 раз выше, чем от 125I (Eβ = 27,2; 35,5 КэВ).
Но наличие радионуклида с оптимальными, с точки зрения терапии, свойствами является необходимым, но еще недостаточным условием успешного проведения лечения. Нужно еще разработать метод доставки этого радионуклида к очагу поражения. Возможность селективного воздействия большинства терапевтических РФП достигается за счет использования различных носителей и способов введения (внутриартериальное, внутриполостное, внутриопухолевое, эндолимфатическое).
За последние 20 лет ученые разработали «почтовые» (homing) материалы (моноклональные антитела, пептиды, нановещества), которые присоединяются к различного типа раковым клеткам. Такие соединения обладают специфической особенностью связываться только с определенной антигенной детерминантой, в результате чего происходит процесс направленной доставки терапевтического радионуклида к определенной злокачественной клетке.
При использовании в качестве терапевтического радионуклида того или иного альфа-эмиттера, благодаря короткому пробегу альфа-частиц (десятки мкм) формируется чрезвычайно высокая (1-2 кГр) локальная доза облучения именно этой клетки.
Технология радионуклидной терапии основана на применении так называемых терапевтических радиофармпрепаратов, которые, попадая в определенное место в организме, испускают излучение с коротким пробегом, которое разрушает ткань. Таким образом, происходит, например, лечение опухолевых заболеваний.
Закрытые радионуклидные источники могут быть помещены непосредственно в опухоль или рядом с ней, что также дает терапевтический эффект (брахиотерапия). В настоящее время радионуклидная терапия стала эффективным средством как самостоятельного, так и комбинированного лечения больных, появились многообещающие разработки с использованием новых радионуклидов для лечения рака, резистивного к другим видам терапии, а также для снятия болей при метастазах и артритах.
Следует отметить отсутствие побочных эффектов и осложнений при терапии с радионуклидами. В последние годы наблюдается неуклонный рост интереса к лечению методами брахиотерапии. Она особенно интенсивно используется при лечении рака простаты и просветления артерий. Более чем десятилетний опыт лечения рака простаты в США показывает, что в случае применения радионуклидов наблюдается меньше осложнений (импотенция и недержание) по сравнению с хирургией. В брахиотерапии применяют закрытые источники излучений в виде зерен, игл, проволок.
На «активных» койках больные проходят курс радионуклидной терапии в режиме закрытого клинического стационара. При некоторых формах злокачественных образований, например, при отдаленных метастазах дифференцированного рака щитовидной железы, радионуклидная терапия является единственно эффективным методом лечения. За последнее время с хорошим результатом, а в ряде случаев с полным исчезновением метастазов рака щитовидной железы, пролечены десятки тысяч больных в крупных медицинских центрах США, Японии, Европы и других стран. Широко используется метод радионуклидной терапии в лечении метастазов в печени, в легких, рака почки, предстательной железы.
В нашей стране несколько «активных» коек имеется только в медицинском центре в Обнинске, куда едут больные со всей страны.
Отличительные черты радионуклидной терапии со специальными терапевтическими РФП:
- высокая толерантность нормальных тканей;
- несущественные побочные эффекты;
- полная реализация энергии бета-частиц на расстояниях не более нескольких миллиметров, а альфа-частиц – на расстояниях нескольких десятков микрон;
- возможность формирования в патологических очагах больших поглощенных доз (100-1000 Гр.).
Применяемые в настоящее время для терапии радионуклиды представлены в таблице 5.
Таблица 5. Некоторые терапевтические радионуклиды.
| Радионуклид | Период полураспада | Тип распада, ( %%) | Энергия основных линий, кэВ | Область применения |
| Фосфор-32 | 14, 3 сут. | β- (100) | Ср. 694, макс. 1710 | Терапия костных опухолей |
| Скандий-47 | 3,4 сут. | β - (100) | Ср. 160, макс. 601 | Терапия опухолей внутренних органов (печень, селезенка) |
| Медь-67 | 61,7 ч | βˉ (100) | Ср. 146, макс. 577 | Терапия опухолей с МКАТ |
| Бром-77 | 57,0 ч | ЭЗ(100) | γ 239, 521 | Биохимическое поведение с МКАТ, РИТ |
| Иттрий-86 | 14,7 ч | ЭЗ (66) β+ (34) | γ 1077, 628 | РИТ |
| Иттрий-88 | 106,6 сут. | ЭЗ (100) | γ 1836, 898 | РИТ |
| Иттрий-90 | 64,1 ч | βˉ (100) | Ср. 934, макс. 2281 | Терапия опухолей |
| Рутений-97 | 2, 9 сут. | ЭЗ(100) | γ 216, 324 | РИТ с МКАТ |
| Палладий-103 | 17, 0 сут. | ЭЗ(100) | | Терапия опухолей простаты |
| Серебро-111 | 7,47 сут. | β -(91,9) | Ср. 360, макс. 1050 | Терапия лимфосистемы |
| Индий-111 | 2.81 сут. | ЭЗ(100) | γ 171, 245 | РИТ с МКАТ |
| Кадмий-115 | 53,5 ч. | β - (100) | Ср. 318, макс. 1110 | Терапия артритов |
| Йод-124 | 4,15 сут. | ЭЗ(75) β+ (25) | γ 608, 1691 | РИТ с МКАТ |
| Йод-125 | 60, 0 сут. | ЭЗ(100) | γ 35 | РИТ с МКАТ |
| Йод-131 | 3,0 сут. | β - (100) | γ 364, 637 βˉ ср.180, макс. 810 | Терапия опухолей щитовидной железы, почек, печени |
| Самарий-153 | 46,7 ч. | β - (100) | Ср. 255, макс. 810 γ 364 | Терапия костных опухолей и метастазов |
| Гадолиний-159 | 18,5 ч. | β - (100) | βˉ ср.306,макс.975 | Терапия опухолей |
| Гольмий-166 | 26,8 ч. | β - (100) | βˉ ср. 610 макс.1850 | Терапия ревматоидных артритов |
| Европий-169 | 9,4 сут. | β - (100) | Ср.96, макс.340 | Терапия ревматоидных артритов |
| Туллий-170 | 128,6 сут. | β - (99,85) | Ср.315, макс.1000 | Терапия лейкемии |
| Иттербий-175 | 4,2 сут. | β - (100) | Ср.126, макс.469 | Терапия опухолей |
| Лютеций-177m | 160,0 сут. | β - (100) | γ 208, 228, 327, 419 βˉср. 40, макс. 152 | Терапия опухолей с МКАТ |
| Рений-186 | 90,62 | βˉ (93,1) ЭЗ(6,9) | γ 137, βˉ сред.150, макс.1075 | Терапия опухолей костной системы |
| Рений-188 | 17,0 ч. | β - (100) | γ 155 βˉср.764, макс.2120 | Терапия карциномы мозга, костных метастазов |
| Иридий-192 | 74, 0 сут. | β - (95) ЭЗ(5) | γ 296,308,317,468 604 βˉср.181,макс.675 | Терапия опухолей |
| Золото-198 | 2,7 сут. | β - (100) | γ 97,180,204,215, 412 βˉср. 312, макс.961 | Терапия ревматоидных артритов |
| Золото-199 | 3,1 сут. | β - (100) | γ 158, 208 | Терапия ревматоидных артритов |
| Висмут-212 | 60,6 мин. | β - (64) γ(36) | γ 727, α 6051 βˉср.770, макс. 2240 | Терапия опухолей с МКАТ |
| Астат-211 | 7,2 ч. | α (100) | γ 687, α 5870 | Терапия асцитных опухолей |
| Фермий-253 | 20,5 сут. | α (100) | α 6683 | Терапия лейкемии с МКАТ |
| Фермий-255 | 20,1 ч. | α (100) | α 7016 | Терапия с МКАТ |
В таблице 5 приведены ядерно-физические характеристики и области применения около 30 терапевтических радионуклидов. Однако отечественной промышленностью для радионуклидной терапии выпускаются РФП только на основе 131I и 198Au, а номенклатура новых РФП сильно ограничена.
Наиболее важной мерой по изменению сложившегося положения должна стать разработка и организация серийного выпуска новых терапевтических РФП, характеризующихся высокой функциональной эффективностью, а также клинической и радиационной безопасностью. Это, прежде всего: 153Sm – оксибифор; микросферы альбумина, меченные 165Dy, 166Ho, 90Y; йодомикс (смесь 133I,131I,132I); микросферы альбумина и оксиэтилидендифосфорная кислота, меченные 188Re; РФП на основе 166Но-РАТ-7; пептиды, меченные 188Re и 90Y, РФП с α-излучателями.
Их наиболее важные достоинства:
- оптимальные ядерно-физические характеристики для создания терапевтической дозы внутреннего облучения. Кроме того, перечисленные радионуклиды (кроме 90Y) имеют слабые гамма-линии с оптимальной энергией квантов для наблюдения за распределением РФП в организме и для определения очаговых доз;
- простота технологий введения РФП, отсутствие необходимости использования дорогостоящего оборудования, сокращение сроков госпитализации в несколько раз по сравнению с традиционными технологиями лучевой терапии;
- высокая избирательность радиационного воздействия на опухолевые и другие патологические очаги с минимальными повреждениями окружающих нормальных тканей;
- сохранение и, в ряде случаев, повышение иммунного статуса организма благодаря практическому отсутствию побочных эффектов;
- радионуклидная терапия может быть единственно возможным методом лечения при неоперабельных и запущенных формах заболеваний.
По радиобиологическому эффекту воздействия на опухолевые очаги к радионуклидной терапии весьма близко внутритканевое контактное облучение некоторых типов рака (например, рак предстательной и молочной желез) с помощью множества закрытых микроисточников низкоэнергетического фотонного излучения, вводимых с помощью эндостатов непосредственно в опухолевый очаг. В этом плане весьма перспективна разработка и серийный выпуск закрытых источников, содержащих 125I и 103Pd.
В конце 1990-х годов начались активные исследования по разработке принципиально новых методов радионуклидной терапии онкологических заболеваний. Особенно перспективной, в частности, для терапии острой и хронической лейкемии, меланомы, рака молочной железы, рака простаты, рака легких, а также микрометастаз, считается радиоиммунотерапия с использованием -излучающих радионуклидов (клеточно-направленная доставка радионуклида с помощью специфических молекул-носителей к очагам опухолевого роста). В биологически активные соединения (например, моноклональные антитела, синтетические пептиды) вводят -излучающий радионуклид. Образовавшееся меченое соединение вводят пациенту. Так как, например, моноклональные антитела обладают специфической способностью связываться только с определенной антигенной детерминантой, происходит процесс направленной доставки -излучающего радионуклида к злокачественной клетке. Радионуклид при распаде излучает -частицу, которая, имея значительную (5–8 МэВ) энергию и короткий (десятки мкм) пробег, создает высокие дозы облучения в пределах локализации злокачественной клетки. В результате реализуется щадящий режим радиотерапии — происходит поражение, в основном, злокачественных клеток. Тем самым -излучатели выгодно отличаются от применяемых в настоящее время -излучающих радионуклидов. Схематически сущность альфа-радиоиммунотерапии представлена на рис.14.
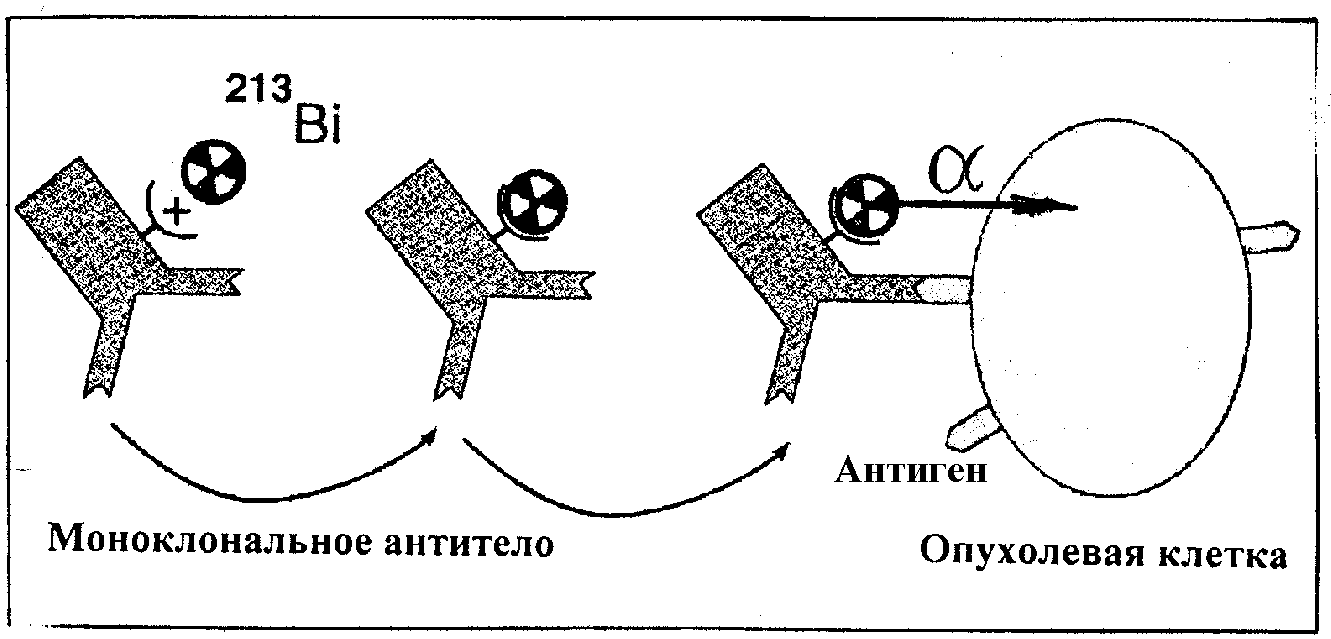
Рис.14. Схема альфа-радиоиммунотерапии висмутом-213.
В настоящее время известно более 100 -излучателей. Но не все они могут использоваться для радиоиммунной терапии. К потенциальным -излучателям, которые могут быть использованы в радиоиммунотерапии, предъявляется несколько требований:
- в идеале -излучающие радионуклиды при своем распаде не должны излучать жестких -квантов;
- энергия -частицы должна быть такой, чтобы она проходила в тканях расстояние порядка нескольких диаметров клетки;
- время полураспада радионуклида, с одной стороны, должно быть достаточно большим для его производства, транспортировки и превращения в требуемую фармацевтическую форму, с другой стороны, оно должно быть относительно коротким, чтобы минимизировать риск токсического воздействия препарата. При этом необходимо принимать во внимание и возможное воздействие на организм всех дочерних радионуклидов, образующихся в результате распада применяемого альфа-излучающего радионуклида.
По совокупности предъявляемых требований перспективными для медицинского применения -излучающими радионуклидами являются Bi-213 (Т1/2=46 мин), Bi-212 (Т1/2=60 мин), Ra-223 (Т1/2=11,4 сут.), Ac-225 (Т1/2=10,0 сут) и At-211 (Т1/2=7,21 час). Недостатком Bi-212 является сопутствующее ему и продуктам его альфа-распада интенсивное жесткое -излучение с энергией 1,3–2,6 МэВ, которое может отрицательно сказаться на здоровье пациента и требует принятия дополнительных мер по защите персонала клиник. Что касается Ra-223 и Ac-225, то они имеют в своих цепочках распада относительно долгоживущие альфа-излучающие радионуклиды: Pb-211 с периодом полураспада (Т1/2 = 36 мин) и Bi-213 (Т1/2 = 46 мин) соответственно. А поскольку атомы дочерних радионуклидов, образующиеся после распада материнских радионуклидов, присоединенных к антителам, отрываются от них и начинают двигаться в теле пациента самостоятельно, то, чтобы не повредить здоровые клетки, распад до стабильного нуклида должен протекать практически мгновенно. Данное условие для Ra-223 и Ас-225 не выполняется. Кроме того, радий входит в одну подгруппу вместе с кальцием и может, замещая его, накапливаться в костных тканях.
К недостаткам At-211 относится необходимость его получения в непосредственной близости от клиники, поскольку период полураспада в 7,21 ч не позволяет транспортировать его на большие расстояния. Основным способом получения At-211 является его наработка по реакции: Bi-209стаб (, 2n) At-211. Ускорители -частиц являются несерийным специализированным дорогостоящим оборудованием и позволить их себе клиники не могут. Поэтому, в начале исследований по α – радиоиммунотерапии по совокупности ядерно-физических, химических и медико-биологических параметров, наиболее перспективным альфа-излучающим радионуклидом, с точки зрения применения в медицине, считался Bi-213. Наличие у Bi-213 слабого -излучения с энергией около 0,4 МэВ не было его недостатком, а, наоборот, давало возможность визуализировать опухоль с помощью гамма-камер.
Клинические испытания радиофармпрепаратов, меченных Bi-213, для лечения раковых заболеваний проводились более чем в десяти клиниках мира. В США фаза III клинических испытаний этого метода с применением в качестве -излучателя висмута-213 показала, что его эффективность при лечении острой лейкемии составляет более 85%. Предварительные дозиметрические оценки показывают, что если опухолевой клетки достигли ~ 6 атомов Bi-213, то вероятность ее уничтожения составляет 99,9 %. Многие специалисты за рубежом считают, что метод радиоиммунотерапии может быть использован для лечения ранних стадий практически всех онкологических и некоторых инфекционных заболеваний (например, менингита), то есть когда потенциальными мишенями являются клетки или небольшие кластеры. Помимо этого -терапия может проводиться в качестве дополнительной после выполнения хирургических операций и химиотерапии. Использование -излучателей считается весьма перспективным и при лечении микрометастаз. Поскольку пробег -частицы превышает средний диаметр клетки, то это означает, что облучаются и клетки, находящиеся вблизи той, к которой прикрепилось антитело. Эффект возрастает, когда больше 10 -частиц поглощается в области, приходящейся на одну клетку. Данное свойство с успехом может быть использовано при лечении микрометастаз.
Выбор молекулы-носителя радионуклида определяется видом ракового заболевания. При некоторых болезнях, таких как лейкемия, мишенями являются единичные клетки. Одноклеточными мишенями могут служить и нераковые клетки, например, в случае стеноза коронарных артерий. В этом случае носители должны хорошо передвигаться по кровеносным сосудам. В случае твердых опухолей носителем радионуклида может быть коллоидный раствор, легко диффундирующий внутрь опухоли.
Так как Bi-213 имеет небольшой период полураспада (46 мин), то его использование в клинике возможно только при генераторном способе получения из Ac-225. Таким образом, ключевой задачей является получение Ac-225. Имеются несколько способов наработки Ас-225.
Помимо генераторного способа, Ас-225 также может быть получен одним из следующих методов:
- по фотоядерной реакции на линейных ускорителях электронов
226Ra (γ,n ) 225Ra 225Ac
- на циклотроне
226Ra (p,2n ) 225 Ac
- в пучке быстрых нейтронов
226Ra (n,2n) 225Ra
 225 Ac
225 Ac - по спалогенным реакциям при облучении тория или урана
232Th (p, spall) 225 Ac
238U (p, spall) 225 Ac.
Сравнительный анализ особенностей различных методов получения Ас-225 позволяет сделать следующие предварительные прогнозы относительно их перспектив для коммерческого производства данного радионуклида:
- Радиохимическое выделение Ас-225 из Th-229 в ближайшие несколько лет останется единственным источником наработки Ас-225.
- В среднесрочной и долгосрочной (более пяти лет) перспективе основными методами производства Ас-225 станет получение нуклида на циклотронах и линейных ускорителях электронов. Серьезным недостатком указанного метода является использование радиоактивного Ra-226 в мишени и связанная с этим потенциальная опасность радиоактивного загрязнения циклотрона. Безусловно, на пути реализации данного метода предстоит предпринять значительные усилия по совершенствованию технологий производства и облучения мишеней для минимизации указанного риска.
Производство Ас-225 из Rа-226 по реакции (I) с использованием -тормозного излучения привлекательно с точки зрения отсутствия опасности загрязнения облучательной установки, однако, характеризуется значительно меньшими выходами целевого нуклида. Какой из двух методов окажется предпочтительнее — ответ на этот вопрос должен дать детальный анализ технико-экономических показателей производства в каждом конкретном случае.
В долгосрочной перспективе весьма привлекательным представляется метод получения Тh-229 из Rа-226 при облучении нейтронами в высокопоточных реакторах. Основной недостаток этого метода — образование высокоактивного Th-228, что требует довольно значительного времени остывания полученной смеси радионуклидов тория прежде, чем станет возможным использование полученного Th-229 для производства Ас-225.
В первое время для целей радиоиммунотерапии применяли 211At(Т1/2 = 7,2 ч), 212Bi(Т1/2 = 60,5 мин.). Однако, эти α-излучатели имеют относительно короткие периоды полураспада, ограничивающие время обработки больных органов.
Поэтому в качестве альтернативного α-излучателя стали использовать актиний –225, свойства которого, в основном, отвечают требованиям, предъявляемым к радионуклидам для радиотерапии. Кроме того, 225Ac может служить в течение продолжительного времени источником для получения короткоживущего 213Bi. Как радионуклид, перспективный для радиотерапии, 225Ac был упомянут еще в 1981 году.
Как и в случае с ультракороткоживущими радионуклидами для ПЭТ при исследованиях с альфа -излучателями предпочтение отдается работе с генераторами этих радионуклидов (таблица 6).
Таблица 6. Генераторы α-излучателей, пригодных для радиоиммунотерапии.
| Материнский радионуклид (Т ½) | Тип распада | Дочерний радионуклид (Т ½) | Тип распада | Еα , МэВ |
| 211Rn(14,2 ч) | ЭЗ(74%) α (26%) | 211At(7,21 ч.) 211Po(0,56 с) | α (42%) ЭЗ(58%) α (100%) | 5,868 (100%) 7,450 (98,86%) 6,570 (0,58%) 6,893 (0,56%) |
| 212Pb(10,6 ч) | βˉ(100%) | 212Bi(60,5мин) | α (64%) | 6,090 (26,8%) 6,050 (70,2%) 5,768 (1,67%) 5,626 (0,15%) 5,607 (1,08%) 5,486 (0,016%) |
| 225Ac(10,0 сут) | α (100%) | 221Fr(4,8мин) | α (100%) | 6,341 (83,4%) 6,243 (1,34%) 6,1264 (15,1%) 5,4799 (0,49%) |
| 221Fr 217At(32,2 мкс) | α (99%) | 215Bi(47мин) | α (39,4%) | 6,775 (60%) |
Из данных таблицы 6 видно, что один распад 225Ac приводит к испусканию трех альфа-частиц с энергией около 6 МэВ непосредственно в месте нахождения исходного атома актиния. Среди дочерних продуктов распада актиния имеются два радионуклида со сравнительно большими периодами полураспада 213Bi(T1/2 = 45,6 мин) и 209Pb(T1/2 = 3,25 час), что в принципе должно привести к необычным радиационным эффектам. Однако выносимый кровотоком из опухоли 213Bi сильно разбавляется в теле пациента, что снижает радиационный эффект. Снижение сравнительно небольшой дозы от наполняющегося в печени мягкого β-излучателя 209Pb может быть достигнуто путем внутривенного введения раствора ЭДТА. В начале 2001 г. была предложена молекулярная конструкция, которая доставляет атом 225Ас не на поверхность раковой клетки, а в ее ядро. В этом случае оболочка раковой клетки служит неким барьером, который защищает кровоток от попадания в него дочерних продуктов естественного распада 225Ас. Такая технология получила название «In vivo генератор 225Ас». Кроме этой технологии в настоящее время получили развитие транспортеры для доставки α-излучателей с использованием достижений нанотехнологий.
В таблице 7 приводятся ядерно-физические свойства 225Ас и основных продуктов его естественного радиоактивного распада.
Таблица 7. Ядерно-физические характеристики 225Ac и основных дочерних продуктов его естественного радиоактивного распада.
| Радионуклид, (T1/2) | Тип распада (ветвление, %%) | Выход в цепочке (%%) | Eγ, кэВ (%%) | Eα, кэВ (%%) | Eβmax[Ēβ],кэВ (%%) |
| 225Ac (10,0 сут) | α(100) | | 62,95(0,45) 99,64(0,62) 99,92(1,01) 150,04(0,80) | 5830,02(50,71) 5792,52(18,12) 5790,62(8,60) 5732,02(8,00) | |
| 221Fr (4,9 мин) | α(100) | 100 | 99,50(0,11) 218,20(11,6) 410,70(0,14) | 6341,01(83,40) 6243,02(1,34) 6126,32(15,10) | |
| 217At (32,3 мс) | α(100) | 100 | | 7066,92(99,89) | |
| 213Bi (45,59 мин) | βˉ(97,91) α(2.09) | 100 | 292,8(0,43) 440,46(26,10) | 5869,10(1,94) 5549,46(26,10) | 982[320](31,0) 1422[492](66) |
| 213Po (4,2мс) | α(100) | 97,91 | | 8375.93(100) | |
| 209Tl (2,20мин) | βˉ(100) | 209 | 117,21(84,32) 465,13(96,22) 1567,09(99,82) | | |
| 209Pb (3,25ч.) | βˉ(100) | 100 | | | 644[198](100) |
К перспективным в этом направлении радионуклидам следует отнести 223Ra. Во многих странах, являющихся ведущими в этой области, проводятся исследования по разработке радиофармпрепаратов на основе этого радионуклида. Рынок таких препаратов бурно развивается. Так по оценке американских специалистов в настоящее время он составляет 100 млн. долларов, а в ближайшие 10-20 лет может составить 6 млрд. долларов. К 2007 году в США потребность в указанном радионуклиде оценивается в 8400 Ки. К сожалению, аналогичные отечественные препараты отсутствуют и даже не ведутся по ним разработки. В то же время в России есть все предпосылки для прогресса в этой области, т.к. имеется достаточный запас стартового радионуклида - 226Ra, составляющего Государственный Радиевый фонд России, сохранение которого может обеспечить существующие и прогнозируемые потребности не только России, но и международного рынка медицинских услуг.
Главным результатом данных работ должны стать:
- доступность и для клиник и для пациентов перспективных терапевтических радиофармпрепаратов;
- улучшение медицинского обслуживания населения и, в первую очередь, самых нуждающихся – онкологических больных.
Для проведения РНТ необходимы специализированные радиологические центры или отделения с так называемыми «активными» койками.
Средний показатель обеспеченности РНТ в Европейских странах составляет 1 «активная» койка на 340 тысяч населения. В наиболее развитых странах ЕС (Германия, Англия, Австрия – 1 койка на 100-200 тысяч. В России имеется только 50 коек. Обеспеченность «активными» койками для РНТ в РФ в 15 раз меньше от необходимого числа, исходя из статистических данных больных, нуждающихся в этой терапии. Удовлетворению минимальных потребностей может содействовать изменение норм радиационной безопасности, позволяющих проводить эту процедуру (как в США) в амбулаторном режиме.
В настоящее время в России полноценно функционирует единственное отделение РНТ в Медицинском радиологическом научном центре РАМН (Обнинск), которое удовлетворяет потребность населения страны в данном виде радиологического лечения менее чем на 3%. Существует ещё одно отделение РНТ в Российской медицинской академии последипломного образования (Москва), но из-за отсутствия современной системы очистки жидких радиоактивных отходов его работа не отвечает необходимым клиническим и радиоэкологическим требованиям.
РНТ заболеваний щитовидной железы, костных метастазов, радиоиммунотерапии лимфом страховыми компаниями в развитых странах определена как метод выбора.
По оценкам специалистов в России из полумиллиона больных с доброкачественными и онкологическими заболеваниями щитовидной железы ежегодно потенциально нуждаются в РНТ более 30 тысяч впервые заболевших. Применение радиоактивного йода в комбинированном лечении дифференцированного рака щитовидной железы у молодых больных в 98%случаев имеет положительный эффект. Наиболее показательны результаты радиойодтерапии отдаленных метастазов. Полное излечение легочных метастазов рака щитовидной железы у детей и подростков достигается в 75% случаев, что позволяет им вместо пожизненной инвалидности стать полноценным членами общества.
В течение последних десятилетий применение радионуклидов с паллиативной и лечебной целью экстенсивно развивается при множестве болезней и не только в онкологии. Физиологические механизмы доставки РФП (йода-131) избирательно к патологическим очагам или органам успешно применяется при диффузном токсическом зобе.
Радиойодтерапия не имеет альтернативы при тяжелых формах тиреотоксикоза у больных с большим риском оперативного лечения и непереносимости медикаментов. Заболеваемость диффузным токсическим зобом составляет 15-20 взрослых и 2-3 ребенка на 100 тыс. населения в год, что составляет по России более 28 тыс. человек. При этом в результате длительного, часто многолетнего, медикаментозного лечения и повторных оперативных лечений тратятся огромные средства и в итоге приводящие к инвалидности больного. Эффективное в 95% случаев при поглощенной дозе 200Гр/г ткани и безопасное лечение тиреотоксикоза радиоактивным йодом избавляет от болезни в течение 2-3недель.
Перспективные разработки, которые в ближайшем будущем должны сделать еще более эффективной, доступной и безопасной РНТ, связаны созданием вольфрам-рениевого генератора и генераторов альфа-излучающих радионуклидов. Создание вольфрам-рениевого генератора по своей значимости и влиянию на развитие ядерной медицины может быть таким же, как генератор технеция-99m для радионуклидной диагностики.
Основной и главный вывод по состоянию РНТ в России – этот вид лечения практически недоступен больным и значительно отстает от потребностей в нем.
Этот вывод является следствием того, что в российском здравоохранении:
- ограниченное число терапевтических РФП и методов РНТ;
- недостаточное число специализированных радиологических отделений и «активных» коек;
- практически отсутствует индивидуальное дозиметрическое планирование;
- недостаточно финансируются фундаментальные исследования в области РНТ;
- плохая информированность о возможностях и преимуществах РНТ.
