Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии
Бактерии-деструкторы фенола и его хлорированных производных
Автореферат докторской диссертации по биологии
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
2. Сравнительный анализ особенностей конверсии хлорфеноксиуксусных кислот
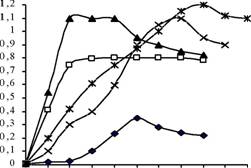
Исследование динамики использования вновь выделенными изолятами
фенола, 2,4-дихлорфенола,аа 4-хлорфеноксиуксусной,аа 2,4-
дихлорфеноксиуксусной и 2,4,5-трихлорфеноксиуксусной кислот в качестве источников углерода и энергии показало, что накопление биомассы культур в модельных системах коррелировало с убыванием субстратов (рис. 4).
Сравнительный анализ значений остаточного содержания фенола, 2,4-ДХФ, 4-ХФУК, 2,4-Д и 2,4,5-Т обнаружил различия в уровнях утилизации указанных источников питания (Табл. 1).
Наиболее существенное снижение фенола, до 97% - 99%, наблюдалось для культур A. irakense38D, В. cereusЗЗТ, R. planticola36Т и S. marcescens22S.
Меньший уровень использования субстрата - до 93% - 95%, был обнаружен для P. kilonensis34Т и Stenotrophomonassp. ЗЗТ.
В периодической культуре 2,4-дихлорфенол активно утилизировали, до 85% - 70%, штаммы Agromycessp. 34DCP, В. subtilis16, P. aeruginosa36DCP и R. planticola33 4CPA. Вместе с тем, данный субстрат не метаболизировали культуры A. xyloxidansЗЗР, A. tumefaciens21SG, В. cereusЗЗТ, В. salcis38Р, G.
17
oxydans 2T, P. kilonensis 34T, R. planticola 36T, R. planticola 36D, R. rubropertinctus 5D и Stenotrophomonas sp. 33T.
По отношению к 4-ХФУК наиболее активными оказались P. agglomerans36Р (90%), Xanthomonassp. 33DCP (?%%) к P. fluorescens39D (81%).
Культуры В. cereusЗЗТ, P. fluorescens39D и Stenotrophomonassp. 33T утилизировали до 82% - 88% 2,4-Д от начальной концентрации.
![]()
![]()
|
7а 8а 9 |
0 12а 3аа 4а 5
Время культивирования, сутки
.Citrobacter sp . 36 4СРА .Raoultella planticola 36T |
|
ЧАЧ |
.Pseudomonas aeruginosa 36DCP |
ЧXЧ |
.Azospirillum irakense 38D |
ЧЖЧ |
. Serratia marcescens 22S |
ЧЧ |
-Raoultella planticola 36D |
------- 1 |
.Pantoea aggllomerans 36P |
.Agrobacterium tumefaciens 21SG |
0,7аа -. |
||
5 o,6 . О о I '5' 1аа 0,4аа . л 0,3 . |
жаа /)EL |
|
sаа 0,2аа . / W /X^x |
||
0а 1аа 2а 3а 4а 5а 6а 7а 8а 91011121314 |
||
Время культивирования, сутки |
||
Фа Xantomonas sp. 33DCP |
||
ЧпЧBacillus cereus ЗЗТ |
||
ЧАЧRaoultella planticola 33 4СРА |
||
Ч?.Ч Enterobacter asburia 33D |
||
ЧЧStenotrophomonas sp. 33T |
||
![]()
![]()
![]()
![]()
|
|
0а 123456789аа 10 Время культивирования, сутки
0 1 2аа 3 4аа 5 6аа 7 8аа 9 10 1112 1314 15K Время культивирования, сутки
![]()
![]()
![]()
![]() -ФЧAgromyces sp . 34DCP
-ФЧAgromyces sp . 34DCP
-?ЧPseudomonas kilonensis 34T
-дЧGluconobacter oxydans 2T
-?.Ч Rhodococcus rubropertinctus 5D -Ж-ЧEnterobacter cloacae 34 4CPA
-?^ Arthrobacter globiformis 17S
-?ЧBacillus subtilis 16
-AЧPseudomonas putida 19S
-?.Ч Pseudomonas fluorescens 39D
Рисунок 4 - Графики динамики зависимости значений оптической плотности клеточной суспензии от времени инкубации штаммов бактерий в условиях использования 2,4,5-Т в качестве единственного источника углерода и энергии в периодической культуре. Штаммы сгруппированы по месту обитания.
18
Таблица 1 - Остаточное содержание субстратов в среде культивирования
ШТАММ |
Концентрация субстрата, % |
||||
Фенол |
2,4-ДХФ |
4-ХФУК |
2,4-Д |
2,4,5-Т |
|
Achromobacter xyloxidans ЗЗР |
80,3 |
- |
32,8 |
58,7 |
36,3 |
Agrobacterium tumefaciens 21SG |
21,8 |
- |
37,6 |
34,1 |
18,0 |
Agromyces sp. 34DCP |
26,4 |
27,0 |
65,2 |
34,1 |
33,0 |
Arthrobacter globiformis 17S |
45,3 |
53,0 |
38,2 |
59,4 |
16,2 |
Azospirillum irakense 38D |
2,1 |
56,0 |
36,8 |
37,3 |
36,4 |
Bacillus cereus 33T |
1Д |
- |
62,0 |
12,4 |
23,9 |
Bacillus subtilis 16 |
67,1 |
30,2 |
29,0 |
19,8 |
22,0 |
Brenneria salcis 38P |
90,3 |
- |
53,3 |
62,7 |
- |
Citrobacter sp. 36 4CPA |
84,2 |
46,4 |
26,9 |
34,0 |
24,2 |
Enterobacter asburia 33D |
77,5 |
39,9 |
38,2 |
30,3 |
37,0 |
Enterobacter cloacae 34 4CPA |
85,4 |
41,2 |
45,9 |
- |
40,0 |
Gluconobacter oxydans 2T |
79,3 |
- |
84,9 |
31,1 |
18,2 |
Pantoea agglomerans 36P |
74,1 |
31,9 |
Ю,1 |
62,0 |
26,6 |
Pseudomonas aeruginosa 36DCP |
15,2 |
14,3 |
55,1 |
62,0 |
33,9 |
Pseudomonas fluorescens 39D |
62,7 |
75,3 |
19,0 |
18,4 |
34,6 |
Pseudomonas kilonensis 34T |
5,2 |
- |
27,4 |
51,7 |
39,0 |
Pseudomonas putida 19S |
67,0 |
30,1 |
62,4 |
65,0 |
55,2 |
Raoultella planticola 33 4CPA |
48,4 |
27,3 |
77,0 |
62,7 |
50,9 |
Raoultella planticola 36D |
64,3 |
- |
56,0 |
67,8 |
25,0 |
Raoultella planticola 36T |
3,1 |
- |
29,8 |
61,4 |
55,3 |
Rhodococcus rubropertinctus 5D |
85,1 |
- |
50,4 |
45,0 |
60,1 |
Serratia marcescens 22S |
1,1 |
56,4 |
65,4 |
41,0 |
33,2 |
Stenotrophomonas sp. 33T |
8,7 |
- |
58,1 |
16,3 |
27,0 |
Xanthomonas sp. 33DCP |
69,3 |
95,2 |
21,4 |
40,1 |
35,3 |
Наиболее активными по отношению к 2,4,5-Т являлись G. oxydans2Т, А. tumefaciens21SG и A. globiformis17S, утилизировавшие примерно 82%-84% хлорфеноксикислоты. Довольно высокий уровень конверсии 2,4,5-Т показали культуры Citrobactersp. 36 4СРА (76%) и В. subtilis16 (78%).
Из данных, приведенных в таблице 1, следует, что для большинства штаммов была характерна полисубстратная активность, при этом фенол и 4-ХФУК метаболизировали все изоляты, а наиболее трудно подвергался ассимиляции 2,4-ДХФ. Штаммы A. oxidansЗЗР, A. tumefaciens21SG, В. cereusЗЗТ, В. salcis38Р, G. oxydans2Т, P. kilonensis34Т, R. planticola36D, R. planticola36T, R. rubropertinctus5D и Stenotrophomonassp. ЗЗТ не использовали 2,4-ДХФ в качестве источника углерода и энергии.
Ранее было обнаружены представители рода Achromobactex(Quan X. et al, 2004; Vedler E. et al, 2000), Arthrobacter(Sandman E. et al, 1988; Karigar Ch. et al, 2006; Margesin R. et al., 2004), Bacillus(Gunther K. et al., 1995; Kim I.C., Oriel P.J., 1995), Citrobacter(Narde K. et al, 2004; Martinez M. etal, 2000) и Pseudomonas(Bhat M.A. et al, 1994; Radjendirane V. et al., 1991; Friedrich B. et al, 1983; Herrmann H. et al., 1995) способные к конверсии фенола и его хлорированных производных.
Вместе с тем, сравнивая обсуждаемые данные с исследованиями других авторов, можно сделать вывод о том, что на примере вновь выделенных и исследованных бактерий впервые показана способность к ассимиляции (хлор)ароматических субстратов для некоторых видов бактерий.
В частности, впервые установлена конверсия фенола, 4-ХФУК и 2,4,5-Т для вида Achromobacterxyloxidansна примере штамма A. xyloxidansЗЗР, а также метаболизм фенола, 2,4-ДХФ, 4-ХФУК и 2,4,5-Т для вида Arthrobacterglobiformisна примере штамма A globiformis17S.
При изучении представителей бациллярной линии, а именно, штамма В. subtilis16 для представителей рода Bacillusвпервые обнаружен катаболизм фенола, 2,4-ДХФ, 4-ХФУК, 2,4-Д и 2,4,5-Т, а на примере В. cereusЗЗТ -установлено участие представителей данного вида в конверсии фенола, 2,4-Д, 4-ХФУК и 2,4,5-Т.
Исследование штамма Citrobactersp. 36 4СРА впервые выявило, что штамм данного рода способен катаболизировать фенол, 4-ХФУК, 2,4-Д и 2,4,5-Т.
Для представителей рода Pseudomonasна примере P. fluorescens39D описана реализация реакций конверсии 4-ХФУК и 2,4,5-Т, а также деструкция 2,4-ДХФ, 4-ХФУК и 2,4,5-Т для вида P. putidaна примере штамма P. putida19S. Кроме этого, показана возможность участия штаммов вида P. aeruginosaв ассимиляции 4-ХФУК, 2,4,5-Т и 2,4-ДХФ на примере штамма P. aeruginosa36DCP и установлена способность P. kilonensisвовлекать в обмен веществ фенол, 4-ХФУК, 2,4-Д и 2,4,5-Т.
На примере вновь выделенного штамма R. rubropertinctus5D установлено, что 4-ХФУК и 2,4,5-Т доступны для бактерий вида Rhodococcusrubropertinctus.
20
Таблица 2 - Результаты идентификации метаболитов штаммов-деструкторов
№ |
Интермедиат (метиловый эфир) |
Характеристические пики ионов в масс-спектре m/z, % |
ШТАММ |
1 |
2,4-дихлор-6-метил феноксиуксусная кислота |
М+ 264 (30), 233 (30), 19 (100), 175(25), 147(30), 87(15), 59 (20) |
A. tumefaciens 21SG S. marcescens 22 S |
2 |
2,4- дихлорфеноксиуксусная кислота |
М+ 234 (89), 236 (55), 199 (69), 178 (64), 175 (100), 161 (50), 163 (32), 148 (30), 146 (42) |
Citrobacter sp. 36 4CPA G. oxydans 2T |
3 |
2,3- дихлорфеноксиуксусная кислота |
М+234(20), 199(30), 175(100), 45(60) |
B. subtilis 16 |
4 |
5-оксиметил-2,4- дихлорфеноксиуксусная кислота |
М+264(80), 233(10), 191(100) |
B. subtilis 16 |
5 |
4-хлор-6- метилфеноксиуксусная кислота |
М+200 (100), 202 (32), 143 (32), 141 (100), 141 (100), 113(38), 111 (58) |
Citrobacter sp. 36 4CPA |
6 |
4-хлорфеноксиуксусная кислота |
М+200 (100), 202 (32), 143 (32), 141 (100), 141 (100), 113(38), 111 (58) |
A. xyloxidans 33P G. oxydans 2T R. planticola 36D R. planticola 36T R planticola 33 4CPA |
7 |
2-хлорфеноксиуксусная кислота |
М+200(60), 155(100), 141(80), 107(100) |
B. subtilis 16 |
4- оксиметилфеноксиуксусная кислота |
М+196(45), 137(10), 123 (100), 107(10), 92(10), 77(10) |
A. xyloxidans 33P |
|
9 |
феноксиуксусная кислота |
М+ 166 (50), 107 (120), 77 (80) |
A. xyloxidans 33P G. oxydans 2T S. marcescens 22 S P. kilonensis 34T R. planticola 36D R planticola 36T R planticola 33 4CPA Stenotrophomonas sp. ззт Xanthomonas sp. 33DCP |
10 |
2-гидрокси-2-гексендионовая кислота |
М+ 45 (100), 55 (20), 59 (8), 87 (5), 115(6), 129(20),а 125(2), 188(0,1) |
A. tumefaciens 21SG Citrobacter sp. 36 4CPA S. marcescens 22 S |
11 |
3-метил-2,6-диоксо-4-гексеновая кислота |
М+156(2), 126(6), 111 (10), 97 (20), 95 (20),85 (21), 83 (21), 71 (16), 57(100), 44(50) |
G oxydans 2T R planticola 33 4CPA R planticola 36D R planticola 36T |
12 |
2-гексеналь |
М+ 98 (5), 83 (30), 69 (70), 57 (100), 44(50) |
P. kilonensis 34T Stenotrophomonas sp. ззт Xanthomonas sp. 33DCP |
В ходе анализа интермедиатов, появлявшихся в культуральной жидкости в условиях использования молекул ксенобиотиков в качестве единственных источников углерода и энергии, были идентифицированы ключевые молекулы конверсии^, tumefaciens 21SG, A. xyloxidans ЗЗР, Citrobacter sp. 36 4СРА, В. subtilis 16, G. oxydans 2T, P. kilonensis 34T, R. planticola 33 4CPA, R. planticola 36D, R. planticola 36T, S. marcescens 22S, Stenotrophomonas sp. 33T и Xanthomonas sp. 33DCP (табл. 2).
В частности, 2,4-дихлорфеноксиукусная кислота была идентифицирована среди метаболитов G. oxydans2Т и Citrobactersp. 36 4СРА.
Метилированное производное 2,4-дихлорфеноксиукусной кислоты, а именно, 2,4-дихлор-6-метилфеноксиукусная кислота, была выявлена у А. tumefaciens21SG и S. marcescens22S.
Кроме этого, в культуральной жидкости A. xyloxidansЗЗР, Goxydans2Т, R. planticola33 4СРА, R. planticola36D и R. planticola36Т была обнаружена 4-хлорфеноксиуксусная кислота, а ее метилированное производное, 4-хлор-6-метилфеноксиуксусная кислота, присутствовала в периодической культуре Citrobactersp. 36 4СРА.
Среди промежуточных продуктов В. subtilis16 отмечены 5-гидрокси-2,4-дихлорфеноксиукусная, 2-хлорфеноксиукусная и 2,3-дихлорфеноксиукусная кислоты.
В культуральной жидкости нескольких штаммов, а именно, A. xyloxidansЗЗР, Goxydans2Т, P. kilonensis34Т, R. planticola33 4СРА, R. planticola36D, R. planticola36T, S. marcescens22S, Stenotrophomonassp. 33T и Xanthomonassp. 33DCP, наблюдались молекулы феноксиуксусной кислоты.
P. kilonensis34T, Stenotrophomonassp. 33T и Xanthomonassp. 33DCP образовывали 2-гексеналь.
3-метил-2,6-диоксо-4-гексеновая кислота присутствовала у культур Goxydans2Т, R. planticola33 4СРА, R. planticola36D и R. planticola36Т, а 2-гидрокси-2-гексендионовая кислота образовывалась в ходе инкубации А. tumefaciens21SG, Citrobactersp. 36 4СРА и S. marcescens22S.
Присутствие среди метаболитов 2,4-дихлорфеноксиукусной, 4-хлорфеноксиуксусной, феноксиуксусной кислот и их производных позволяет сделать вывод, о том, что изучаемые бактерии способны выполнять реакции конверсии хлорфеноксикислот через последовательное дегалогенирование ароматического кольца до стадии его расщепления (рис. 5).
Следует заметить, что штамм В. subtilis16, являющийся представителем бациллярной линии грамположительных протеобактерий, реализует реакции гидроксилирования ароматического кольца с последующей миграцией и отрывом ионов хлора.
Наличие 2-гидрокси-2-гексендионовой кислоты (производного муконата) в культуральной жидкости штаммов A. tumefaciens21SG, Citrobactersp. 36 4СРА и S. marcescens22S указывает на то, что у данных штаммов раскрытие ароматического кольца происходило по орто- пути, для которого при расщеплении ароматического субстрата характерно образование цис, г/иомуконата и его производных, в дальнейшем метаболизируемых до ?-
22
осн,соон |
||||||
Cl^ |
||||||
цл, |
||||||
С1 |
||||||
ж |
Т |
4 |
||||
ОСН2СООН |
ОСН2СООН 1аа L |
OCpCOOH 1а z |
OCH,COOH 1а z |
|||
НзСч^^^а |
&ха |
^yciаа . |
^rcl |
|||
V |
W |
ho^V^ |
4^ACI |
|||
С1 |
С1 |
Cl |
B.subtilis 16 |
|||
A.tumefaciens 21SG |
Citrobacter sp. 36 4СРА |
B.subtilis 16 |
||||
S.marcesc |
ens 22S |
G.oxydans 2 / |
T |
/ |
||
i |
< |
У |
/ |
|||
ОСН2СООН |
ОСН2СООН |
OCpCOOH |
||||
"'?^ |
^Cl |
|||||
М |
м |
kJ |
||||
т С1 |
т Cl |
B.subtilis 16 |
||||
Citrobacter sp. 36 4СРА |
R.planticola 36D R.planticola 36T R.planticola 33 4CPA |
|||||
G.oxydans 2T Achromobacter sp. 33P |
||||||
i |
? |
N |
ч |
|||
i |
' |
^4 |
||||
OCpCOOH 1 |
OCpCOOH 1аа z |
|||||
.^1 |
M |
|||||
i |
г |
R.planticola 36D R.planticola 36T R.planticola 33 4CPA |
T OH Achromobacter sp. 33P |
|||
G.oxydans 2T |
||||||
S.marcescens 22S |
||||||
Stenotrophomonas sp. 33T |
||||||
P.kilonensis / |
34T 4 |
|||||
соон ho^S^а соон |
/ ______________ |
N СОН |
4 сон |
|||
LJ |
[Га COOH |
U |
||||
^Ч^ A.tumefaciens 21SG |
lV^o |
Stenotrophomonas sp. 33T |
||||
S.marcescens 22S |
pC |
P.kilonensis 34T |
||||
Citrobacter sp. 36 4CPA |
R.planticola 36D R.planticola 36T R.planticola 33-4CPA G.oxydans 2T |
Xantomonas sp. 33 DCP |
Рисунокаа 5аа -аа Схем деградацииаа хлорфеноксикислотаа вновьаа выделенных штаммов-деструкторов.
|
Страницы: | 1 | 2 | 3 | 4 | 5 | 6 | |
 Авторефераты по всем темам >>
Авторефераты по биологии
Авторефераты по всем темам >>
Авторефераты по биологии

 СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА
СКАЧАТЬ ОРИГИНАЛ ДОКУМЕНТА