«Новосибирский государственный медицинский университет»
| Вид материала | Автореферат |
- «Новосибирский государственный медицинский университет», 742.93kb.
- Всероссийское общество неврологов всероссийское общество стоматологов новосибирский, 46.94kb.
- С. С. Кутателадзе Сибирского отделения ран, Новосибирский государственный технический, 183.14kb.
- С. С. Кутателадзе Сибирского отделения ран, Новосибирский государственный технический, 166.34kb.
- Новосибирский Государственный Университет Медицинский Факультет реферат, 164.07kb.
- Новосибирский государственный педагогический университет, 43.06kb.
- Новосибирский Государственный Технический Университет; Специальность по диплом, 18.99kb.
- Нарушения обмена биометаллов при вибрационных воздействиях и их коррекция 03. 00., 236.45kb.
- Программа всероссийской научно-практической конференции «здоровое питание», 155.41kb.
- Новосибирский Государственный Университет Медицинский факультет реферат, 375.71kb.
На правах рукописи
УСОВА
АННА ВЛАДИМИРОВНА
ОЦЕНКА ОСНОВНЫХ ПОКАЗАТЕЛЕЙ ЦИТОКИНОВОГО ПРОФИЛЯ У ЖЕНЩИН С УГРОЗОЙ ПРЕРЫВАНИЯ БЕРЕМЕННОСТИ
И НА ФОНЕ ЕЕ ЛЕЧЕНИЯ
14. 01. 01 – акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Омск
2010
Работа выполнена на кафедре акушерства и гинекологии стоматологического факультета ГОУ ВПО «Новосибирский государственный медицинский университет»
^ Научный руководитель - Соколова Татьяна Михайловна, доктор медицинских наук, профессор «Новосибирский государственный
медицинский университет»
^ Официальные оппоненты:
доктор медицинских наук, профессор Рудакова Елена Борисовна,
ГОУ ВПО « Омская государственная медицинская академия Росздрава»
доктор медицинских наук Поздняков Иван Михайлович,
МБУЗ «Новосибирский городской перинатальный центр»
Ведущая организация:
ГОУ ВПО «Сибирский государственный медицинский университет Росздрава», г. Томск
Защита диссертации состоится
"____" _______________ 2010 г.
в ____ часов на заседании диссертационного совета Д 208.065.01 в Омской государственной медицинской академии по адресу: 644043, г. Омск, ул. Ленина, 12
С диссертационной работой можно ознакомиться в библиотеке Омской государственной медицинской академии (644043, г. Омск, ул. Ленина,12)
Автореферат разослан "____" _______________ 2010 г.
Учёный секретарь
диссертационного совета
доктор медицинских наук, профессор Федотов В. К.
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность
Особенности демографической ситуации в России характеризуются низкой рождаемостью, депопуляцией населения и ставят проблему невынашивания беременности в ряд важнейших медико–социальных задач, требующих всестороннего изучения и решения (Фролова О.Г., 2005; Халтурина Д.А., 2006; Григорьева Е.Е., 2007; Радзинский В.Е., 2007). Невынашиванием завершаются не менее 15%, а по некоторым данным – 25–30% беременностей (Сидельникова В.М., 2007; Buss L. et al., 2006). Неразвивающиеся беременности составляют 46–88% в структуре всех выкидышей ранних сроков, к сожалению, без клинической и морфологической верификации.
Несмотря на большое количество исследований (Тетруашвили Н.К., 2008), посвященных выявлению роли различных факторов в развитии невынашивания беременности, единого мнения об этиологии и патогенезе этой патологии не существует. Это связано с тем, что свести в единую систему все многообразие факторов достаточно трудно, так как невынашивание беременности является результатом действия не одной, а нескольких причин. Более 40% первых беременностей прерываются искусственными абортами, наиболее существенную роль в генезе невынашивания играет хронический персистирующий эндометрит, сопровождающий каждую четвёртую, даже «нормальную» беременность, и не менее 60% – при повторных невынашиваниях. Именно хронический аутоиммунный эндометрит остается причиной невынашивания в 2 раза более значимой, чем дефицит прогестерона, обнаруживаемый не более чем у 12% женщин с ранним выкидышами (Радзинский В.Е., 2008). Эта проблема обсуждалась первой на пленарном заседании Всемирного конгресса акушеров–гинекологов (FIGO, 2006).
Значимыми факторами в возникновении невынашивания являются нарушения иммунной и эндокринной регуляции, которые, зачастую, реализуются в рамках прогестероновой недостаточности и дисбаланса биологически активных медиаторов иммунных и межклеточных взаимоотношений – цитокинов (Сидельникова В.М., 2005). В настоящее время известно, что около 80% ранее необъяснимых случаев повторных потерь беременности связаны с нераспознанными иммунологическими нарушениями, где ведущая роль отводится иммунным механизмам – эмбриотоксическим антителам, клеткам–хелперам 1 типа, естественным киллерам (NK–клеткам), инициирующим каскад патофизиологических процессов, приводящих к отторжению плодного яйца и повышению сократительной активности миометрия (Сидельникова В.М., 2007; Druckmann R. et al., 2005). Большинство авторов связывают эти процессы с переходом иммунного ответа, опосредованного Т–хелперами 2 типа, на иммунный ответ, в котором Т–хелперы 1 типа играют превалирующую роль.
Создание локальной иммунносупрессии контролируется обоими типами Т–хелперов, а именно количеством провоспалительных и регуляторных цитокинов, которые играют важную роль в регуляции межклеточных взаимодействий в эндометрии и реализации эндокринных эффектов, что во многом определяет процесс инвазии трофобласта (Сухих Г.Т., 2005). Нарушения или изменения в данной системе могут вести к срыву саморегуляции и изменению иммунологического ответа, а выявление и устранение причин этих изменений позволит нам повысить вероятность вынашивания беременности. При этом прогестерон, взаимодействуя с рецепторами цитотоксических лимфоцитов, стимулирует продукцию прогестерон–индуцированного блокирующего фактора (PIBF), который увеличивает секрецию цитокинов Т–хелперов 2 типа (Salomon L.J. et al., 2005; Druckmann R. et al., 2005).
Несмотря на значительные успехи, достигнутые в области профилактики и лечения невынашивания беременности, в последние годы отсутствует тенденция к их снижению (Тетруашвили Н.К., 2008). Ситуацию осложняет ухудшающееся общее и репродуктивное здоровье женщин фертильного возраста, которые неспособны выносить и родить здорового ребенка. Отсутствие четких представлений о механизме прерывания беременности препятствует проведению эффективной патогенетической терапии (Серов В.Н., 2005; Сидельникова В.М., 2005; Тихомиров А.Л., 2008). Патология беременности и плода во втором триместре – наименее изученный раздел акушерства и перинатологии. Практика родовспоможения, ориентированная на решение конкретных вопросов именно с 22 недель беременности – сроку разграничения выкидыша и родов, не имеет стандартов диагностики, лечения и способов прогнозирования исхода беременности и родов. Изучение механизмов формирования угрозы прерывания беременности ставит новые задачи – поиск новых доклинических маркеров осложненного течения беременности и разработку эффективных методов профилактики и лечения (Тетруашвили Н.К., 2008).
^ Цель исследования: снижение осложнений беременности на основе усовершенствования протокола ведения женщин с угрозой прерывания беременности во II триместре с учётом динамического анализа цитокинового профиля.
^ Задачи исследования
1. На основании комплексного клинико–лабораторного обследования выявить группы риска развития невынашивания беременности во II триместре.
2. Провести сравнительный анализ цитокинов, возможных маркеров невынашивания беременности – Th1–опосредованного провоспалительного иммунного ответа (ИЛ–1β, ИЛ–8, ФНО–α и ИНФ–γ) и Тh2–опосредованного регуляторного иммунного ответа (ИЛ–4, ИЛ–6 и ИЛ–10, ГМКСФ), с оценкой их межсистемного взаимодействия у беременных с угрозой прерывания во II триместре.
3. Оценить диагностическое и прогностическое значение определения уровня цитокинов у женщин с угрозой прерывания беременности во II триместре и на фоне комплексного лечения.
4. Оценить эффективность комбинированной терапии, направленной на пролонгирование беременности во II триместре, с включением прогестерона.
^ Научная новизна
Установлено, что наличие неблагоприятных исходов предыдущих беременностей (с превалированием самопроизвольных гестационных потерь в анамнезе – самопроизвольные выкидыши, неразвивающиеся беременности, преждевременные роды) и отсутствие лечения между гестациями, являются факторами риска развития невынашивания беременности.
При угрозе прерывания беременности во II триместре впервые выявлено статистически значимое смещение цитокинового баланса в сторону активации Th1–опосредованного иммунного ответа ИЛ–1β, ИЛ–8, ФНО–α и ИНФ–γ и подавление Тh2–опосредованного иммунного ответа со снижением уровня регуляторных цитокинов ИЛ–4, ИЛ–6 и ИЛ–10, ГМКСФ, что свидетельствует о нарушениях эффекторных функций иммуно–компетентных клеток.
Впервые установлено, что уровень провоспалительных цитокинов у женщин с угрозой прерывания беременности, выше в 2 раза в сравнении с физиологической беременностью.
Установлено, что применение прогестерона влияет на соотношение Th1 и Th2–опосредованного иммунного ответа, блокирует воспалительный процесс, тем самым, вызывая сдвиг провоспалительной реакции в сторону Th2 парадигмы, при этом вероятность сохранения беременности возрастает.
Впервые определено, что комбинированная схема лечения, включающая прогестерон, изменяет структуру внутренних корреляционных соотношений показателей цитокинового профиля, приближая ее на 65% к структуре взаимосвязей при нормальной беременности.
^ Практическая значимость диссертационного исследования заключается в том, что реализация разработанных и обоснованных в ней методологических подходов, с включением в алгоритм обследования беременных с угрозой прерывания во II триместре УЗИ, допплерометрии и определения содержания цитокинов Th1 парадигмы с опосредованным провоспалительным иммунным ответом (ИЛ–1β, ИЛ–8, ФНО–α и ИНФ–γ) и Тh2 парадигмы с опосредованным регуляторным иммунным ответом (ИЛ–4, ИЛ–6 и ИЛ–10, ГМКСФ) позволила:
– дать объективную оценку характеру изменений, с определением важных индикаторов (маркеров невынашивания) при угрозе прерывания беременности во II триместре.
– повысить эффективность комбинированного лечения при угрозе прерывания беременности во II триместре с использованием β–адреномиметиков и прогестерона (утрожестана).
Предложенный комплекс лечения беременных с угрозой прерывания во II триместре с использованием β–адреномиметиков и прогестерона (утрожестана), позволил уменьшить дозу β–адреномиметиков, ускорить их токолитический эффект и снизить риск развития сердечно–сосудистых осложнений.
^ Научные положения, выносимые на защиту
Важным патогенетическим звеном при угрозе прерывания беременности во II триместре является выраженный дисбаланс в системе цитокинов. Наблюдается активация уровня Th1–опосредованного провоспалительного иммунного ответа (повышение концентрации ИЛ–1β, ФНО–α , ИНФ–γ) и подавление Th2–опосредованного регуляторного иммунного ответа (снижение концентрации ИЛ–4, ИЛ–6, ИЛ–10, ГМКСФ).
Прогестерон (утрожестан), который подавляет Th1–опосредованный провоспалительный иммунный ответ и активизирует Th2–опосредованный регуляторный иммунный ответ, обладает иммуномодулирующем эффектом, что обосновывает его применение при угрозе прерывания беременности во II триместре.
^ Апробация работы результатов исследования
Основные положения диссертации доложены и обсуждены на Всероссийской научной конференции «Актуальные вопросы акушерства и гинекологии» (Тюмень, 2009); на заседании кафедры акушерства и гинекологии стоматологического факультета ГОУ ВПО НГМУ Росздрава (Новосибирск, 2009); на региональной конференции «Актуальные вопросы акушерства и гинекологии» (Омск, 2010); на IV Региональной научно–практической конференции «Основные мероприятия и пути снижения материнской и перинатальной смертности на территории Сибирского федерального округа в рамках национального проекта «Здоровье» (Новосибирск, 2010); на Всероссийской конференции «Актуальные вопросы акушерства и гинекологии» (Кемерово, 2010).
Автор принимала личное участие в выполнении всех подготовительных и основных этапов работы, в клиническом обследовании и лечении пациенток в условиях стационара, ею проведен анализ состояния вопроса по данным современной литературы и анализ полученных результатов.
^ Внедрение результатов исследования в практику. Результаты исследования внедрены в преподавательскую и научно–исследовательскую работу кафедр акушерства и гинекологии лечебного и педиатрического факультетов ГОУ ВПО Новосибирского государственного медицинского университета, а также в лечебную работу муниципальной женской консультация №1 (Новосибирск), НО Фонд развития и оказания специализированной медицинской помощи «Медсанчасть 168» (Новосибирск), МБУЗ КДЦ «Клинико–диагностический центр им. А.П.Гумилевского» (Новосибирск), МБУЗ «Городской Перинатальный центр» (Новосибирск).
Публикации. По теме диссертации опубликовано 14 научных работ, в том числе 3 в изданиях, рекомендованных ВАК.
^ Структура и объём диссертации. Диссертационная работа изложена на 130 страницах машинописного текста, написана в традиционном стиле, состоит из введения, обзора литературы, описания материалов и методов исследования, четырёх глав собственных исследований, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Указатель литературы содержит 186 литературных источников, из них 101 – зарубежных, 85- на русском языке. Работа содержит 15 таблиц и иллюстрирована 6 рисунками.
^ Содержание работы
Материалы и методы исследования
Исследовательская работа проводились в МБУЗ «Клинико–диагностический центр им. Гумилевского А.П.» (Новосибирск) в 2006–2009 гг. Комплексное клинико–лабораторное обследование выполнено у 160 беременных. В соответствии с целями и задачами были сформированы 3 группы:
I группа (основная) – пациентки с угрозой прерывания беременности во II триместре, получавшие комбинированную терапию β–адреномиметиками и прогестероном (утрожестан) (n=65);
ІI группа (сравнения) – пациентки с угрозой прерывания беременности во II триместре, получавшие терапию β–адреномиметиками (n=65);
III группа (контрольная) – пациентки с физиологическим течением беременности, состоявшие на учете в женской консультации того же учреждения (n=30).
Учитывая срок гестации, клинические признаки, результаты УЗИ и допплерометрии, лечение угрозы прерывания беременности во II триместре проводили β–адреномиметиками и прогестероном (утрожестан):
– в I группе в 1 день с инфузией β–адреномиметиков (50 мкг гинипрала в 400 мл физиологического раствора в течение 6 часов) применяли 100 мг прогестерона вагинально через 6 часов (суточная доза 400 мг), во 2 день применялся только прогестерон 3 раза в день вагинально через 8 часов (доза снижалась до 100 мг, суточная доза 300 мг) в течение 14 дней, затем доза прогестерона постепенно снижалась, в последнюю неделю до 100 мг в сутки до 28 недель беременности.
– во II группе в 1 день проводилось внутривенное капельное введение β–адреномиметиков (50 мкг гинипрала в 400 мл физиологического раствора в течение 6 часов) с последующим переходом на таблетированный прием препарата (доза 500 мкг (1 таблетка) каждые 6 часов в течение 5 дней) (рис. 1).










Рисунок 1. Дизайн исследования
Все женщины были сопоставимы по возрасту (30,3±2,11 лет) и сроку беременности (24,3±2,01 недель). Для изучения эффективности методов проводимой терапии во время беременности все женщины были поделены на равные группы методом случайных чисел. Первичные данные были рандомизированы.
^ Критериями включения в исследование являлось информированное согласие, невынашивание в анамнезе, включающее в себя потери беременности (выкидыш или неразвивающаяся беременность на любом сроке, отсутствие лечения после прерывания беременности) и угроза прерывания беременности во II триместре. Инструментальными критериями служили данные УЗИ – повышенная возбудимость и тонус матки (локальное утолщение миометрия в области прикрепления плаценты, уменьшение толщины нижнего маточного сегмента) менее 6 мм, веретенообразные сокращения мускулатуры матки, указывающие на сокращение того или иного участка мышц матки, свидетельствующие, в сочетании с клиническими данными, о признаках угрозы прерывания беременности. Критериями исключения из исследования являлось наличие многоплодной беременности, пороки развития плода и матки, доброкачественные и злокачественные опухоли гениталий, истмико-цервикальная недостаточность, наследственные тромбофилии, генетические заболевания женщины и ее партнера, острые инфекционные заболевания, экстрагенитальная патология.
Лабораторные исследования были проведены в Областном клинико–диагностическом центре (Новосибирск) и включали в себя общий и биохимический анализ крови, с использованием стандартных наборов реагентов «Вектор-Бест» и «VERNO» (Италия); исследование системы гемостаза, с определением концентрации фибриногена по методу Рутберг; тромбоэластографическое исследование крови на тромбоэластографе фирмы Hellige (Германия); определение агрегации тромбоцитов по методу Born J.U.R. (1962), количества тромбоцитов на счетчике «Trombocaunter» (Франция).
Микробиологическое исследование проводили по данным микроскопии вагинального отделяемого, окрашенного по Граму и изучением микрофлоры цервикального канала, определением клеток поверхностного слоя эпителия, лейкоцитов, палочек Дедерлейна и других сапрофитных микроорганизмов, с определением 4 степени чистоты влагалищного содержимого и 3 уровня лейкоцитарной реакции по Е.А. Медведевой. При бактериологическом исследовании содержимое влагалища сеяли на набор стандартных питательных сред и культивировали в аэробных, анаэробных условиях и в условиях пониженного содержания кислорода. Материал исследовали на следующие группы микроорганизмов – аэробы, факультативные анаэробы, облигатные анаэробы, дрожжеподобные грибы. При определении видовой принадлежности энтеробактерий учитывали их биохимическую активность в 12 тестах. Для видовой идентификации стрептококков анализировали характер гемолиза на 5% кровяном агаре, редукцию 1% метиленового синего в молоке, рост в 40% желчном бульоне. Штаммы золотистого стафилококка типировали фагами международного набора. Дифференциацию грибов рода Candida проводили по результатам проб на способность к ферментации глюкозы, лактозы, мальтозы и сахарозы. Для выполнения pH–метрии использовали универсальную индикаторную бумагу с эталонной шкалой.
Определение антител к возбудителям ТОРCH–инфекциям (ВПГ, ЦМВ, хламидий) в сыворотке крови (иммуноферментный анализ) и исследование гормонов проводилось в лаборатории ЗАО «ИмДи» врачом–лаборантом И.Ю. Зиминой (Новосибирск) (лицензия № 540174/02 от 21.07.2002). Определение прогестерона и эстриола в сыворотке крови определяли методом иммуноферментного анализа наборами «Architect 2000SR» фирмы «Abbott» (США), результаты регистрировали на вертикальном фотометре Multiskan MСС 340 при длине волны 450 нм. Для уточнения клинического варианта течения вирусной инфекции производили определение специфических антител классов IgG и IgM в сыворотке крови к ВПГ II типа и ЦМВ. Определение уровня провоспалительных и регуляторных цитокинов – ФНО–α, ИНФ–γ, ИЛ–1β, ИЛ–4, ИЛ–6, ИЛ–8, ИЛ–10 и ГМКСФ было выполнено в лаборатории иммунологии репродукции ГУ НЦКЭМ СО РАМН (руководитель – д.м.н., профессор А.Н. Трунов) на тест–системах Pro Con производства ООО «Цитокин» С.–Петербург.
УЗИ и допплерометрию проводили на аппарате SonoAce–6000 CMT (конвексный датчик C2–5ED/40/89) фирмы Medison.
Статистическая обработка полученных результатов была выполнена с помощью программного пакета «Statistica – 6» (Россия).
^ Результаты собственных исследований и их обсуждение
В соответствии с поставленными задачами у 130 пациенток с угрозой прерывания беременности и 30 беременных с физиологически протекающей беременностью проведено изучение соматической, гинекологической заболеваемости, менструальной и репродуктивной функций, анализ анамнестических данных и результатов клинико–лабораторного исследования.
Средний возраст пациенток составил 30,3±2,11 лет, срок гестации 24,3±2,01 недель. Средний возраст начала менструации в I группе составил 13,1±0,11 лет, во II – 13,8±0,19 лет, III – 12,8±0,1 лет, у подавляющего большинства (89,7%) менструальный цикл был регулярным, длительностью 28,1±0,6 дней. Роды в срок, через естественные родовые пути в анамнезе имели 9,23% пациенток I группы, 10,7% – ІI группы и 36,6% – III группы. Преждевременные роды в анамнезе отмечалось только у пациенток I и II групп, что составило 18,5% и 17% соответственно. Обращает внимание наличие в анамнезе большого числа проведенных артифициальных абортов: в I группе – у 90,8% пациенток, во II группе – у 100%, в III группе – 56,7%. В подавляющем большинстве случаев отмечены ранние гестационные потери – самопроизвольные выкидыши и неразвивающиеся беременности (в I и II группах 90,7% и 83,1% соответственно). Проведенный анализ позволяет сделать вывод о высоком уровне неблагоприятных исходов беременности у пациенток I и II групп, где превалировали самопроизвольные гестационные потери (самопроизвольные выкидыши, неразвивающиеся беременности, преждевременные роды).
При анализе гинекологической заболеваемости выявлена высокая частота воспалительных заболеваний органов малого таза в анамнезе у пациенток 35,6% I и II групп (в сравнении с III группой – 13,3%), что согласуется с результатами исследований других авторов (33% до 73%) (Серова О.Ф., 2005).
Экстрагенитальные заболевания имели место у 55% пациенток. В анамнезе превалировали заболевания мочевыделительной системы воспалительного характера (цистит, пиелонефрит) (39,3%) и желудочно–кишечного тракта (23,1%). ВСД по гипотоническому типу встречалась у 29,3% пациенток. Сердечно–сосудистая патология встречалась у 11,5% пациенток в основных группах и у 3,3% – в контрольной. Частота встречаемости соматической патологии в группах с угрозой невынашивания беременности была достоверно (p<0,05) выше, чем у беременных с физиологической гестацией.
Ретроспективный анализ показал высокую частоту мочеполовой инфекции в I и II группах, из них у 16,9% имело место поражение специфического характера – трихомонадный вагинит; хламидийная инфекция диагностирована у 33,8%, вагинальный кандидоз отмечен у 85,4%. Отмечена высокая частота дисбиотических изменений микроценоза влагалища у 74,6% пациенток. Со слов пациенток, все они были пролечены с положительным эффектом. Ретроспективный анализ, проведенный в III группе, показал отсутствие инфекций, передаваемых половым путем, в структуре урогенитальной инфекции на 1 месте был вагинальный кандидоз (40%), на 2 – бактериальный вагиноз (36,7%). Таким образом, урогенитальная инфекция в основных группах встречалась в 2,6 раз чаще, чем у пациенток контроля, что еще раз подтвердило влияние хронического аутоиммунного эндометрита на угрозу прерывания настоящей беременности. Ретроспективный анализ показал, что у пациенток I и II групп на 1 месте был генитальный кандидоз (20%), на 2 – бактериальный вагиноз (16,4%), что практически не отличалось от структуры урогенитальных инфекций в III группе (генитальный кандидоз и бактериальный вагиноз был диагностирован 16,7%). Инфекции, передаваемые половым путем у исследуемых пациенток всех групп во время настоящей беременности не наблюдались. Определение вирусной инфекции методом ИФА–диагностики позволило выявить у беременных I и II групп ЦМВ в 79,8%, ВПГ II типа в 23,8% (в контрольной группе ЦМВ был выявлен в 80,1%, ВПГ II типа – в 21,9%). Для уточнения клинического варианта течения вирусной инфекции было произведено определение специфических антител классов IgG и IgM в сыворотке крови к ВПГ II типа и ЦМВ, которое свидетельствовало о наличии вирусоносительства у беременных I, II и контрольной групп.
При бактериологическом исследовании влагалищного содержимого в I и II группах у 51,5% и в III группе у 43,3% был обнаружен рост условно–патогенных микроорганизмов по количественной характеристике (1 и 2 степень роста) в пределах нормы. Стерильные посевы обнаружились у большинства исследованных – в I и II группах в 48,5%, в III группе в 46,7%. Учитывая 1 и 2 тип чистоты мазка, отсутствие роста патогенной микрофлоры или рост в пределах нормы, согласно количественной характеристики, условно–патогенной микрофлоры, на момент поступления в стационар беременные в санации не нуждались.
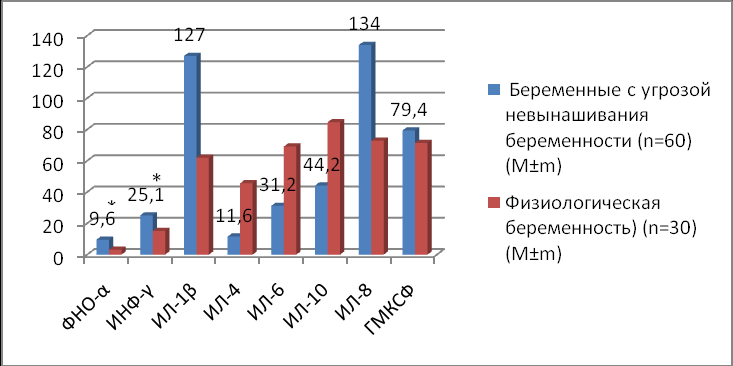
ИФН–γ, ФНО–α, ИЛ–1β активируют клеточный иммунитет, способствует прерыванию беременности и относятся к провоспалительным цитокинам Th1 парадигмы, их повышение у пациенток с угрозой невынашивания беременности можно расценивать как проявление системного иммунологического нарушения. Уровень ИНФ-γ у пациенток с угрозой прерывания беременности составил 25,1±2,2пг/мл, что в 1,6 раза выше по сравнению с контрольной группой - 15,1±0,2пг/мл (р<0,05). Уровень ФНО-α у пациенток с угрозой невынашивания беременности составил 9,6±1,9 пг/мл, что в 3 раза выше по сравнению с контрольной группой - 3,2±0,1пг/мл (р<0,05). Уровень ИЛ-1β в сыворотке крови составил 127±12,4 пг/мл у пациенток с угрозой невынашивания беременности, что более чем в 2 раза выше по сравнению с контрольной, где уровень составил 62,3±7,2 пг/мл (р<0,05) (рис.2). Снижение уровня ИЛ–4 у пациенток с угрозой невынашивания беременности в 4 раза подтвердило данные о том, что нормальное течение беременности ассоциируется с преобладанием в сыворотке крови регуляторного цитокина ИЛ–4. Уровень ИЛ–6 и ИЛ–10 у пациенток с угрозой невынашивания беременности был также снижен практически в 2 раза. ИЛ–8 в сыворотке крови был повышен в 2 раза, а ГМКСФ остался без значимых различий (рис.2). Суммируя полученные данные, можно констатировать, что в случаях угрозы прерывания беременности наблюдалась диссоциация между уровнем Th1 и Th2 цитокинов.
*
*
*
*
*
*
Примечание: * (р<0,05) – достоверность различий между группами беременных с угрозой прерывания беременности и женщинами с физиологической беременностью, n-число наблюдений. Данные представлены в виде средней и стандартной ошибки (M±m)
Рисунок 2. Значения иммунологических показателей при физиологическом течении беременности и при угрозе прерывания беременности во II триместре
Сравнительный анализ уровней цитокинов у пациенток с угрозой прерывания беременности, с физиологическим течением беременности и на фоне и комплексной терапии через 14 дней от начала показал, у пациенток I - основной группы ФНО-α снизился до 5,3±1,4 пг/мл (р<0,05), что практически в 2 раза меньше по сравнению с пациентками I- основной группы до лечения, а у пациенток II - группы сравнения ФНО-α не снижался и составил 10,2±3,8пг/мл. ИНФ-γ достоверно снизился в 1,3 раза до 18,4±2,2пг/мл (р<0,05) в I группе, во II группе достоверного снижения нет и уровень ИНФ-γ оставался почти на прежнем уровне 24,1±1,1 пг/мл. ИЛ-1β достоверно (p<0,05) снижался в 1,5 раза в I-ой группе (86,1 ± 2,1пг/мл) - у пациенток, получавших прогестерон, в сравнении с результатами при поступлении при угрозе прерывания во II триместре (127± 12,4 пг/мл) и приближался к результатам пациенток с нормальным течением беременности (62,3±7,2 пг/мл) (р<0,05). ИЛ-4 в I группе пациенток повысился в 1,5 раза до 16,2 ±3,1пг/мл (р<0,05) по сравнению с результатом (11,6±1,6 пг/мл) при угрозе прерывания беременности. Наблюдалось значительное в 3,7 раза (p<0,01) повышение ИЛ-6 до 111,3 ±1,4 пг/мл (р<0,05) в I-ой группе пациенток, получавших прогестерон, по сравнению с результатами при угрозе прерывания беременности (31,2±1,4 пг/мл) и группой контроля (69,1±11,8 пг/мл). ИЛ-8 достоверно (p<0,01) повысился в 1,5 раза до 205,6±2 в группе пациенток, получавших прогестерон, по сравнению с результатами при угрозе прерывания беременности (134±19 пг/мл) и группой контроля (72,8±10,2 пг/мл). Отмечается повышение в 1,8 раза ИЛ-10 до 68,1±1,5пг/мл у пациенток, получавших прогестерон по сравнению со II группой (38,1±10,2 пг/мл) (р<0,05).Отмечается достоверное повышение ГМКСФ (p<0,05) в 1,5 раза у пациенток, получавших прогестерон до 119,8±4,5 пг/мл, по сравнению со II группой 71,4±6,6 пг/мл.
Таким образом, в группе леченной прогестероном, наблюдалось достоверное повышение уровня регуляторных цитокинов ИЛ–4, ИЛ–6, ИЛ–8 ,ИЛ–10 и ГМКСФ (p<0,01) и снижение уровня прововоспалительных цитокинов ИЛ–1β,ФНО–α ,ИФН–γ по сравнению с II группой сравнения, где этих изменений не наблюдалось (p<0,01).
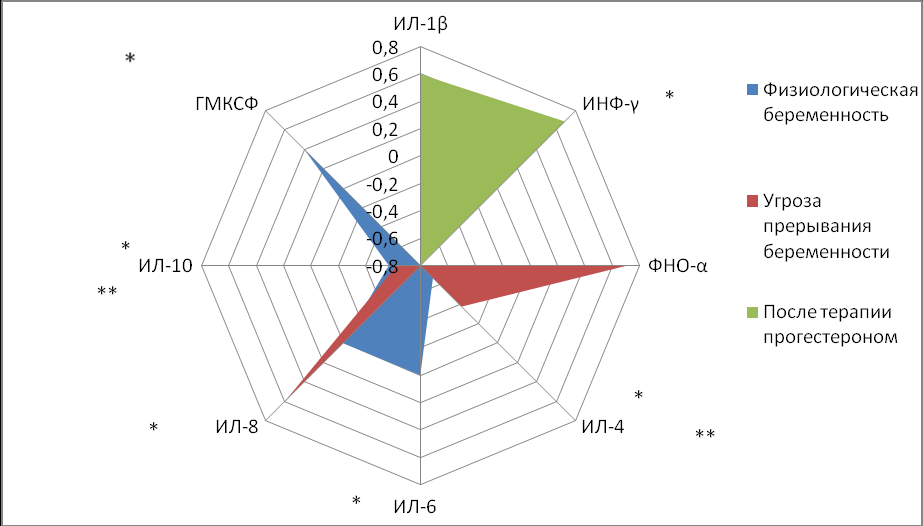
П
римечание: * (р<0,05) – достоверность различий между I и контрольной группами,** (р<0,05) – достоверность различий между I и II группами, n-число наблюдений. Данные представлены в виде средней и стандартной ошибки (M±m)
Рисунок 3. Значения иммунологических показателей при физиологическом течении беременности и на фоне лечения через 2 недели
Для оценки корреляционных связей между цитокинами использовался показатель межсистемных соотношений, который учитывал выраженность взаимодействия отдельного показателя со всеми остальными, а его величина определялась как сумма коэффициентов корреляции (суммировались только значимые коэффициенты независимо от знака корреляции, по формуле: n
у=∑ ri
i для всех ri<0,05, где у – cуммарная взаимосвязь (Ед).
Сила корреляционных связей оценивалась следующим образом: а) сильная – от 0,7 до 1; б) средняя – от 0,3 до 0,699; в) слабая – от 0 до 0,299.
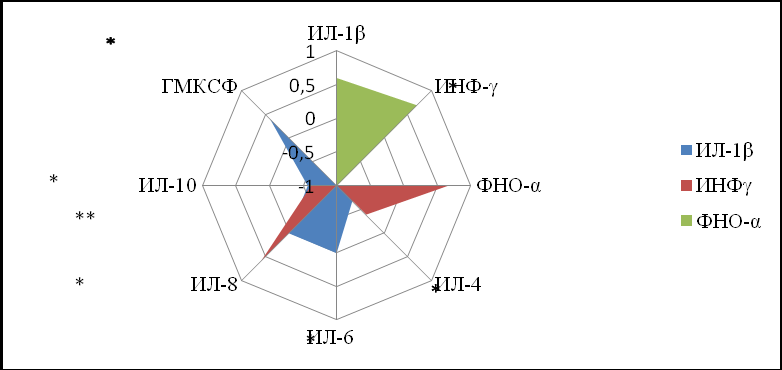
При нормальном течении беременности ИФН–γ был связан обратной корреляционной зависимостью с ИЛ–10 (r–0,62, р<0,05) и ИЛ–4 (r–0,36, р>0,05). В то же время, с ФНО–α и ИЛ–8 обнаруживалась прямая корреляционная зависимость (r+0,71 и r+0,68, р<0,05). ИФН–γ у данной группы беременных тесно коррелировал с двумя показателями ИЛ–4 и ИЛ–1β (r+0,54 и r+0,67, р<0,05). По результатам корреляционного анализа ФНО–α обнаруживалась достоверная корреляционная зависимость с ИФН–γ и ИЛ–4 (r+0,69 и r–0,63, р<0,05), в остальных случаях корреляционная зависимость оказывалась недостоверной. ИЛ–8 обнаруживал две корреляционные зависимости с ИФН–γ и ИЛ–4 (r+0,6 и r+0,65, р<0,05) (рис. 4). Наибольшее количество взаимосвязей выявлено с ИЛ–1β: ФНО, ИЛ–4, ИЛ–10, ИЛ–8 (r–0,67, r+0,57, r–0,6, r+0,37 соответственно, р<0,05).
Лидирующее место по количеству межсистемных взаимосвязей при физиологическом течении беременности занимали два показателя – ИЛ–4 (3,11 Ед) и ИЛ–1β (3,02 Ед). Далее в порядке убывания расположились ИЛ–10 (2,44 Ед), ИНФ–γ (2,29 Ед), ФНО–α (1,94 Ед), ИЛ–8 (1,51 Ед), ИЛ–6 (1,49 Ед) ГМКСФ (1,35 Ед).
ИЛ–4>ИЛ–1β>ИЛ–10> ИНФ–γ>ФНО–α>ИЛ–8>ИЛ–6>ГМКСФ (результат I)
Рисунок 4. Структура корреляционных соотношений между показателями, отражающими иммунный статус женщин при физиологическом течении беременности
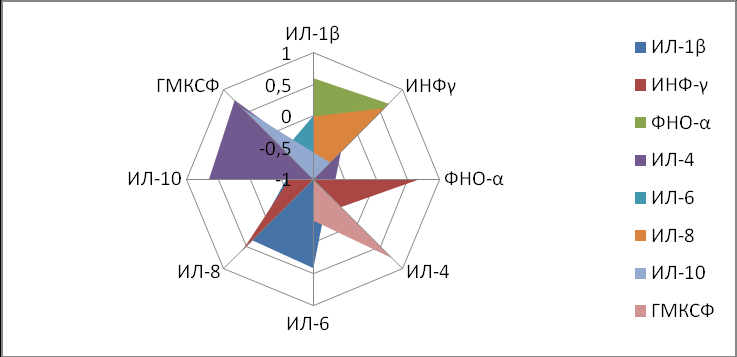
Указанный выше подход к анализу корреляционных зависимостей использовался для оценки особенностей иммунного статуса при угрозе прерывания беременности, при этом выявлено, что у ИЛ–1β обнаруживались одна достоверная корреляционная зависимость с ИНФ–γ (r +0,6, р<0,05), а у ИЛ–8 – три взаимосвязи с ИФН–γ, ФНО–α и ИЛ–4. ИФН–γ имел две достоверные корреляционные взаимосвязи с ФНО–α и ИЛ–8 (r +0,69 и r +0,83, р<0,05). С ИФН–γ при угрозе прерывания беременности коррелировала только концентрация ИЛ–1β (r +0,6, р<0,05), ФНО–α оказался взаимосвязан с ИФН–γ (r +0,6, р<0,05), ИЛ–4, ИЛ–8, при этом степень взаимосвязи определялась величиной r –0,75, r –0,4, соответственно (рис. 5).
ИЛ–1β>ФНО>ИЛ–8>ИНФ–γ>ГМКСФ>ИЛ–6>ИЛ–4>ИЛ10 (результат II )
Рисунок 5. Структура корреляционных соотношений между показателями, отражающими иммунный статус беременных женщин с угрозой прерывания беременности во II триместре
При сравнении интегральных характеристик взаимодействия иммунологических показателей при физиологическом течении беременности и угрозе прерывания беременности лидирующее место в структуре изучаемых параметров иммунного статуса занимал ИЛ–4, при угрозе прерывания беременности он смещался на предпоследнее место, а его место занимал ИЛ–1β, перемещаясь со второго места на первое место. Интересен тот факт, что при угрозе прерывания беременности лидирующее место занимал ФНО–α, т.к. при физиологической беременности он находился на последнем месте в структуре цитокинового профиля, что может указывать на активацию провоспалительных звена. Другие показатели статистически значимо не изменялись.
Преобладание при угрозе прерывания беременности провоспалительных цитокинов подтвердило перемещение ФНО–α, активирующего Th1 ответ, с пятого места (при нормальном течении беременности) на второе (при угрозе прерывания беременности). Выявленные изменения в структуре межсистемных взаимодействий можно интерпретировать следующим образом. Высокий уровень провоспалительных цитокинов в периферической крови свидетельствовал о нарушениях принципа локальности цитокиновой системы у женщин с угрозой прерывания беременности с ОАГА, и, скорее всего, был связан с длительно текущими воспалительными процессами, которые сопровождались генерализованной активацией клеток иммунной системы, что приводило к морфологическим изменениям эндометрия. В результате, не происходило местной иммуносупрессии, которая является основополагающим механизмом при нормальной гестации. Вероятнее всего, эти причины были связаны с активацией воспалительного процесса во время II триместра беременности, где не последнюю роль сыграл инфекционный агент, что, в свою очередь приводило к активации иммунных агентов, а именно повышенному содержанию ФНО–α, ИНФ–γ, ИЛ–1β в крови и иммунный ответ сдвигался в сторону Th1. На фоне лечения имели место статистически значимые улучшения в параметрах интерлейкинов – повышение ИЛ–4 и ГМКСФ на фоне снижения ИЛ–1β и ФНО–α (рис. 6).
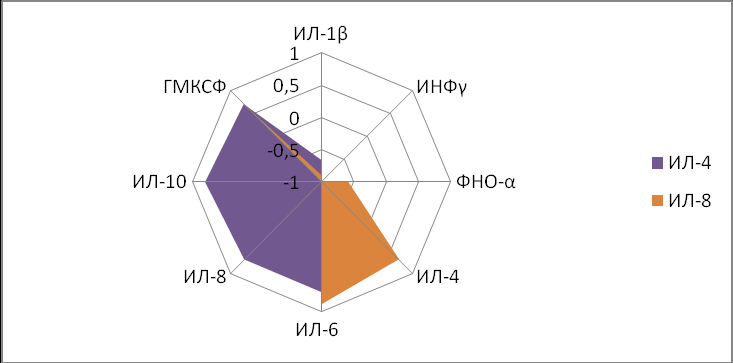
ИЛ8>ИЛ4>ИЛ6>ИЛ1β>ГМКСФ>ИЛ10>ФНОα>ИНФγ (результат III)
Рисунок 6. Структура корреляционных соотношений между показателями, отражающими иммунный статус беременных женщин с угрозой прерывания беременности во II триместре после терапии прогестероном
Таким образом, при нарушении течения беременности, в частности, при угрозе прерывания, несмотря на сохраняющиеся в абсолютных значениях концентрации ИЛ–4, ФНО–α и т.д., система их внутреннего взаимовлияния нарушалась. ФНО–α, перемещаясь на второе место при угрозе прерывания беременности в ряду межсистемных взаимосвязей, как бы «ускользал» из-под регулирующего влияния ИЛ–10 и ИЛ–4, запуская иммунный ответ типа Th1, при этом перемещение ИЛ–8 на третье место свидетельствовало о снижении его функциональной активности, что снижало вероятность преждевременного самопроизвольного родоразрешения (рис. 7).
Данное предположение подтверждает перемещение ИЛ–4 с первой позиции (при нормальном течении беременности) на седьмую (при угрозе прерывания беременности), что также указывает на снижение Th2 типа ответа на фоне повышения Th1 (перемещение ИЛ–1β со второго на первое место). Эти данные указывали на то, что в основе угрозы прерывания беременности значительное место занимали нарушения иммунного статуса. Максимальные значения провоспалительных цитокинов у женщин с угрозой прерывания беременности, превосходили нормальные значения в два раза. Применение прогестерона влияло на соотношение Th1 и Th2– блокировало воспалительный процесс, тем самым, вызывая сдвиг провоспалительной реакции в сторону Th2, а вероятность сохранения беременности возрастала до 96,7%.
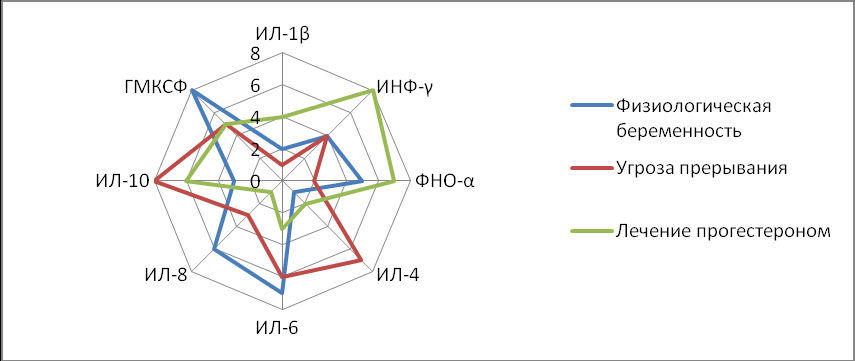
Рисунок 7. Перестройка в структуре суммарной выраженности взаимодействия между показателями иммунного статуса при угрозе прерывания беременности и на фоне терапии микронизированным прогестероном к нормальному течению беременности
Анализируя результаты ультразвукового исследования, мы выявили, что при поступлении в стационар у женщин с угрозой прерывания беременности в 100% случаев отмечался ультразвуковой признак – веретенообразные сокращения мускулатуры матки (увеличение толщины маточной стенки на том или ином участке), которые говорят о локальном сокращении того или иного участка миометрия матки. Тотального сокращения миометрия у пациенток исследуемых групп не лоцировалось.
На фоне проводимой терапии при контрольном УЗИ через 5 дней у 9,2% пациенток I и у 14,6% пациенток II групп сохранялось локальное утолщение плаценты. При контрольном УЗИ через 10 дней у 4,6% пациенток II группы сохранялось локальное утолщение плаценты, в I группе изменения не лоцировались. Таким образом, на фоне проводимой терапии отмечена положительная динамика в обеих исследуемых подгруппах. Однако, данные в І группе были более убедительными.
Допплерометрические исследования маточного кровотока на протяжении неосложненной беременности показывали постепенное снижение резистентности маточных артерий и усиление диастолического кровотока (Kahler С. et al., 2003). Анализ полученных результатов показал, что в основных группах при угрозе прерывания беременности систоло–диастолическое соотношение в ПМА и ЛМА незначительно превышали норму и были равны 2,4, в группе контроля данные показатели находились в пределах 2,11 и 1,93 соответственно. Следует обратить внимание на отсутствие асимметрии между показателями обеих маточных артерий в основных группах. Достоверные различия в показателях асимметрии кровотока выявлены только у пациенток при физиологическом течении беременности. Таким образом, можно предположить, что отсутствие асимметрии кровотока у пациенток основных групп с угрозой прерывания беременности является признаком осложненного течения беременности, что подтвердили и полученные нами данные. На фоне терапии через 10 дней в I группе систоло–диастолическое соотношение в ПМА и в ЛМА составило 2,01 и 2,23, во II – 1,88 и 2,1 (соответственно). В сравнении с исходными данными этот показатель в обеих маточных артериях был снижен в 1,1 и 1,2 раза (соответственно). Отмечались достоверные различия в показателях асимметрии кровотока у пациенток обеих групп, отрицательного влияния прогестерона на показатели маточного кровотока зарегистрированы не были. Таким образом, для полной оценки состояния беременности необходим динамический мониторинг с использованием УЗИ и допплерометрии, что позволит значительно снизить перинатальные потери.
^ Результаты комплексной схемы лечения угрозы прерывания беременности во II триместре беременности.
Учитывая срок гестации, клинические признаки и результаты УЗИ, лечение угрозы прерывания беременности во II триместре проводили β-адреномиметиками и прогестероном (утрожестан).
В зависимости от способа лечения все пациентки были разделены на две клинические группы:
I - основная группа пациенток с угрозой прерывания беременности во II триместре, получавшие комбинированное лечение: β-адреномиметики и прогестерон (утрожестан) (n=65);
ІI – группа (сравнения): пациентки с угрозой прерывания беременности во II триместре, получавшие только лечение β-адреномиметики (n=65);
В I группе для купирования маточных сокращений в первый день с инфузией β-адреномиметиков - 50 мкг гинипрала в 400 мл физиологического раствора в течение 6 часов применяли 100 мг утрожестана вагинально через 6 часов – (суточная доза 400 мг), со следующего дня применялся только прогестерон (утрожестан), доза снижалась до 100 мг - 3 раза в день вагинально, через 8 часов (суточная доза 300 мг) в течение 14 дней, затем доза прогестерона постепенно снижалась, в последнюю неделю до 100 мг в сутки до 28 недель беременности. Во II группе сравнения для купирования маточных сокращений проводилось в 1-ый день внутривенное капельное введение β-адреномиметиков -50 мкг гинипрала в 400 мл физиологического раствора в течение 6 часов с последующим переходом на таблетированный прием препарата, в дозе 500 мкг (1 таблетка) каждые 6 ч в течение 5 дней, без применения прогестерона.
Положительный эффект от проводимой терапии в первые сутки был достигнут в I основной группе у 96, 9 % женщин, и только в двух потребовалась повторная инфузия β-адреномиметиков. В дальнейшем признаков угрозы прерывания беременности не отмечалось. Во II группе сравнения 8 (12,3 %) беременным потребовались повторные инфузии раствора гинипрала в последующие сутки в связи с неполной релаксацией матки. В обеих группах родились живые доношенные дети.
Полученные результаты показали, что вагинальное применение прогестерона оправдано для лечения угрозы прерывания во II триместре беременности, а сочетание его с внутривенным введением β-адреномиметиков привело к более быстрому достижению токолитического эффекта. Кроме того, назначение поддерживающей дозы прогестерона по 200–300 мг/сутки способствовало дальнейшему благоприятному течению беременности без лечения β-адреномиметиками. Снижение дозы назначаемых β-адреномиметиков является чрезвычайно важным, так как эти препараты приводят к опасности развития сердечно-сосудистых осложнений. Безопасность прогестерона делает его препаратом выбора для лечения угрозы прерывания беременности во II триместре, а сочетание его приема с внутривенным введением β–адреномиметиков дает большие терапевтические возможности.
Выводы
1. Женщины с угрозой прерывания беременности во II триместре имеют неблагоприятные исходы предыдущих беременностей (самопроизвольные гестационные потери: выкидыши, неразвивающиеся беременности, преждевременные роды), превышающие показатели в популяции в 90,7% , 83,1% и 64% случаев соответственно.
2. У женщин с угрозой прерывания беременности во II триместре наблюдается выраженный дисбаланс в системе цитокинов периферической крови. Активация уровня Th1–опосредованного провоспалительного иммунного ответа (повышение концентрации ИЛ–1β, ФНО–α, ИНФ–γ) и подавление Th 2–опосредованного регуляторного иммунного ответа (снижение концентрации ИЛ–4, ИЛ–6, ИЛ–10, ГМКСФ) позволяет прогнозировать развитие невынашивания беременности в 92,9% случаев.
3. Комбинированное лечение, включающее прогестерон, изменяет структуру показателей цитокинового профиля: снижает ИЛ–1β, ФНО–α, ИНФ–γ в периферической крови - показателей Th1–опосредованного иммунного ответа и увеличивает ИЛ–4, ИЛ–6, ИЛ–10, ГМКСФ, активируя Th2-опосредованный иммунный ответ, приближая ее на 65% к структуре взаимосвязей при нормальной беременности.
4. Применение прогестерона снижает активность воспалительной реакции, вызывая ее сдвиг в сторону Th2 парадигмы, вероятность сохранения беременности возрастает до 96,9%.
5. Сочетание β–адреномиметиков и прогестерона позволяет уменьшить дозу гинипрала, ускорить его токолитический эффект, снизить необходимость повторных инфузий.
^ Практические рекомендации
1. В качестве маркеров прогноза невынашивания беременности, определения показаний к иммунокоррекции и оценки эффективности лечения в динамике, рекомендуется использовать исследование системы цитокинов:
– активация уровня Th1–опосредованного провоспалительного иммунного ответа (ИЛ–1β, ФНО–α, ИНФ–γ);
– подавление Th 2–опосредованного регуляторного иммунного ответа (ИЛ–4, ИЛ–6, ИЛ–10, ГМКСФ).
2. При уже имеющей угрозе прерывания беременности и во избежание новых потерь, патогенетически обоснованной является комплексное лечение, с использованием β-адреномиметиков и прогестерона.
^ Список сокращений
ВЗОМТ – воспалительные заболевания органов малого таза,
ВСД – вегето–сосудистая дистония,
ГКГС – главный комплекс гистосовместимости,
ГМКСФ – гранулоцитарно–макрофагальный колониестимулирующий фактор,
ИЛ–1β, ИЛ–4, ИЛ–6, ИЛ–8, ИЛ–10 – цитокины (интерлейкины),
НБ – невынашивание беременности,
ПН – плацентарная недостаточность,
ФНО–α – фактор некроза опухоли–α,
ThI, Th II – Т хелперы I класса, Т хелперы II класса,
СДО – систоло–диастолическое отношение,
УЗИ – ультразвуковое исследование,
УПР – угроза преждевременных родов.
^ Список опубликованных работ по теме диссертации:
- Усова А.В., Соколова Т.М. Течение беременности и родов у женщин с врожденными пороками сердца и после их коррекции //Бюллетень НЦССх им. А.Н. Бакулева РАМН «Сердечно–сосудистые заболевания». – 2007. – Т. 8, №2 – с. 268-268.
- Усова А.В., Соколова Т.М. Невынашивание беременности у женщин с врожденными пороками сердца и после их коррекция //Сибирский консилиум. – 2007. – № 7 (62). – с. 81-82.
- Усова А.В., Соколова Т.М. Исходы беременности у женщин с пороками сердца, осложненными эндокардитом //Тезисы научно–практической конференции «Актуальные проблемы перинатологии, акушерства и гинекологии». – 2008. – с. 195-200.
- Усова А.В., Соколова Т.М. Современный взгляд на иммунологические аспекты невынашивания беременности //Тезисы научно–практической конференции «Актуальные проблемы перинатологии, акушерства и гинекологии». – 2008. – с. 221-231.
- Усова А.В., Соколова Т.М. Исходы беременности у женщин с врожденными пороками сердца, осложненные инфекционным эндокардитом //Патология кровообращения и кардиохирургия. Новосибирск. – 2008г. – №1. – с. 60-61.
- Усова А.В., Начаров Ю.В., Соколова Т.М. Содержание про– и провоспалительных цитокинов у женщин с невынашиванием беременности после проведения сохраняющей терапии //Вестник новых медицинских технологий. – 2008. – Т. ХV, №2. – с. 50-52.
- Усова А.В., Дереколенко Н.С., Пустоветова М.Г., Филатова О.В. Изменение концентрации IL–1β, IL–4 у женщин с невынашиванием беременности и на фоне проведения сохраняющей терапии //Тезисы конкурс–конференции студентов и молодых ученых «Авиценна-2008». Новосибирск. – 2008. – с. 247.
- Усова А.В., Пустоветова М.Г., Соколова Т.М. Влияние прогестерона на уровень цитокинов у женщин с угрозой преждевременных родов //Тезисы Всероссийской научно–практической конференции с международным участием для молодых ученых «Вопросы патогенеза типовых патологических процессов». Новосибирск. – 2009. – с. 369-373.
- Усова А.В., Начаров Ю.В., Соколова Т.М. Содержание провоспалительных цитокинов с невынашиванием беременности на фоне сохраняющей терапии// Тезисы Всероссийской научно–практической конференции «Амбулаторно–поликлиническая практика–платформа женского здоровья». Москва. – 2009. – с. 274-275.
- Усова А.В., Макаров К.Ю., Яшенко Е.В. Возрастные особенности формирования мотивационной сферы у женщин, планирующих прерывание беременности// Тезисы конкурс–конференции студентов и молодых ученых «Авиценна-2009». Новосибирск. – 2009. – с. 19-20.
- Усова А.В., Соколова Т.М. Особенности влияния прогестерона на уровень цитокинов у женщин с невынашиванием беременности //Тезисы III Международного молодежного медицинского конгресса «Санкт–Петербургские научные чтения – 2009». С.-Пб. – 2009. – с. 215.
- Усова А.В., Полякова Л.В., Соколова Т.М. Взаимосвязь между прогестероном и цитокинами при угрозе преждевременных родов //Тезисы конкурс–конференции студентов и молодых ученых «Авиценна–2009». Новосибирск. – 2009. – с. 16.
- Усова А.В., Соколова Т.М., Трунов А.Н. Роль цитокинов при угрозе преждевременных родов у женщин с привычным невынашиванием беременности //Естественные и технические науки. – 2009. – №6. – с. 220-223.
- Усова А.В., Соколова Т.М. Взаимосвязь эндокринной и иммунной систем в невынашивании беременности //Современные наукоемкие технологии (ISSN 1812–7320). – 2009. – №10. – с. 71.
На правах рукописи
УСОВА
^ АННА ВЛАДИМИРОВНА
ОЦЕНКА ОСНОВНЫХ ПОКАЗАТЕЛЕЙ ЦИТОКИНОВОГО ПРОФИЛЯ У ЖЕНЩИН С УГРОЗОЙ ПРЕРЫВАНИЯ БЕРЕМЕННОСТИ
И НА ФОНЕ ЕЕ ЛЕЧЕНИЯ
14. 01. 01 – акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Омск
2010
Подписано в печать 10.09.2010
Формат 60×84/16
Бумага офсетная
П.Л.-1,0
Способ печати – оперативный
Тираж 100
Издательско-полиграфический центр ОмГМА
644043,г. Омск, ул. Ленина,12;тел.23-05-98
