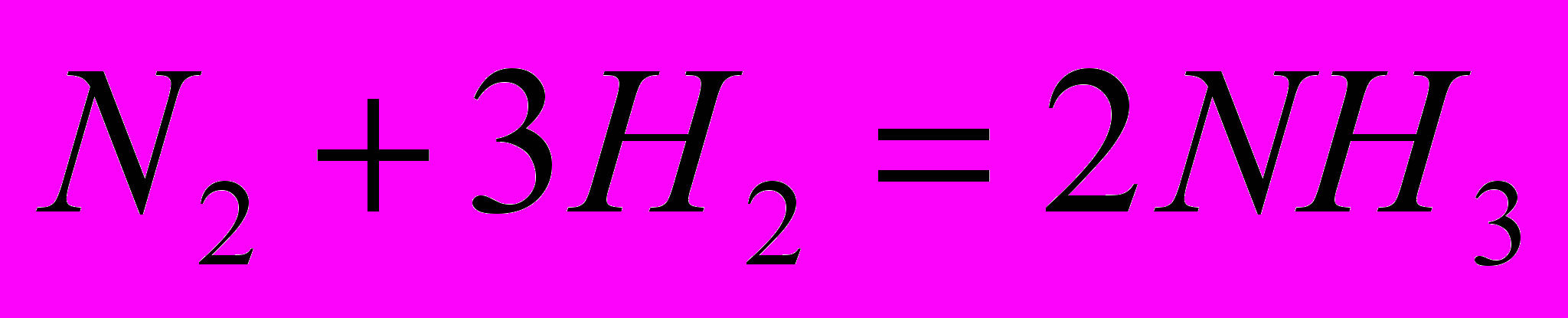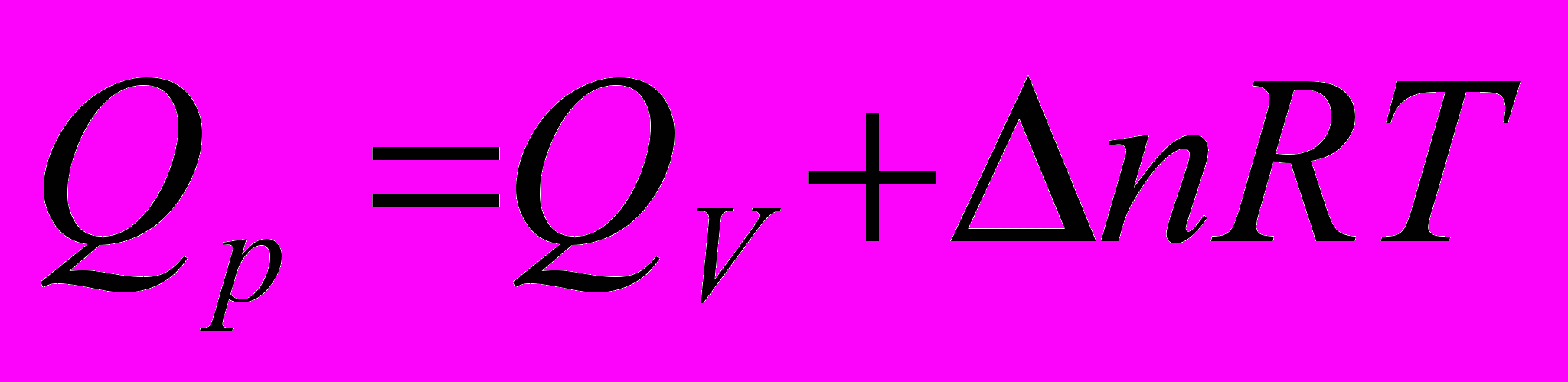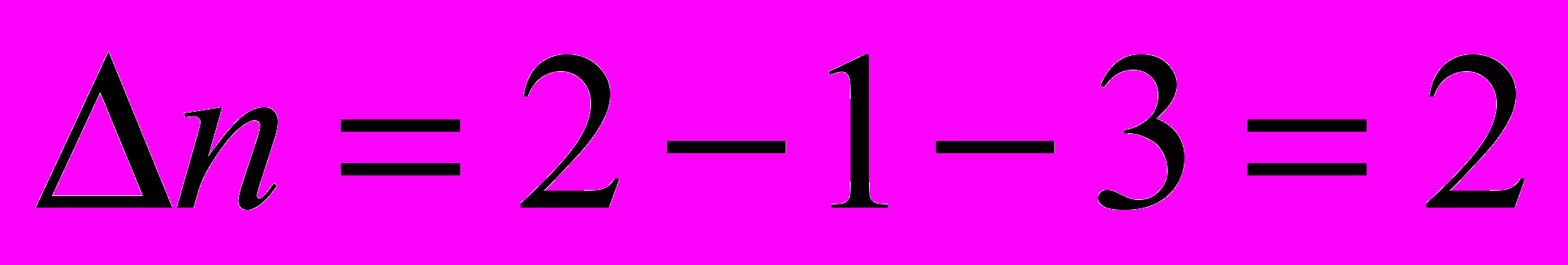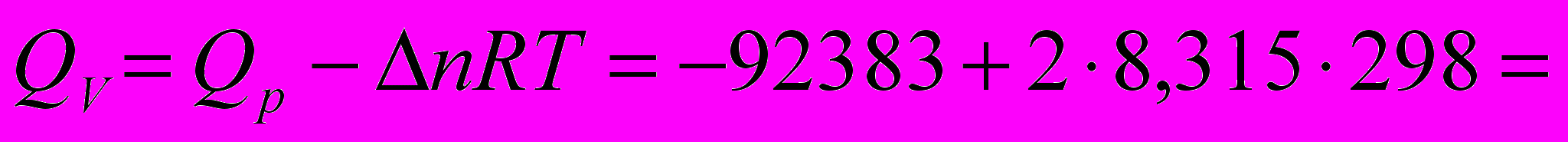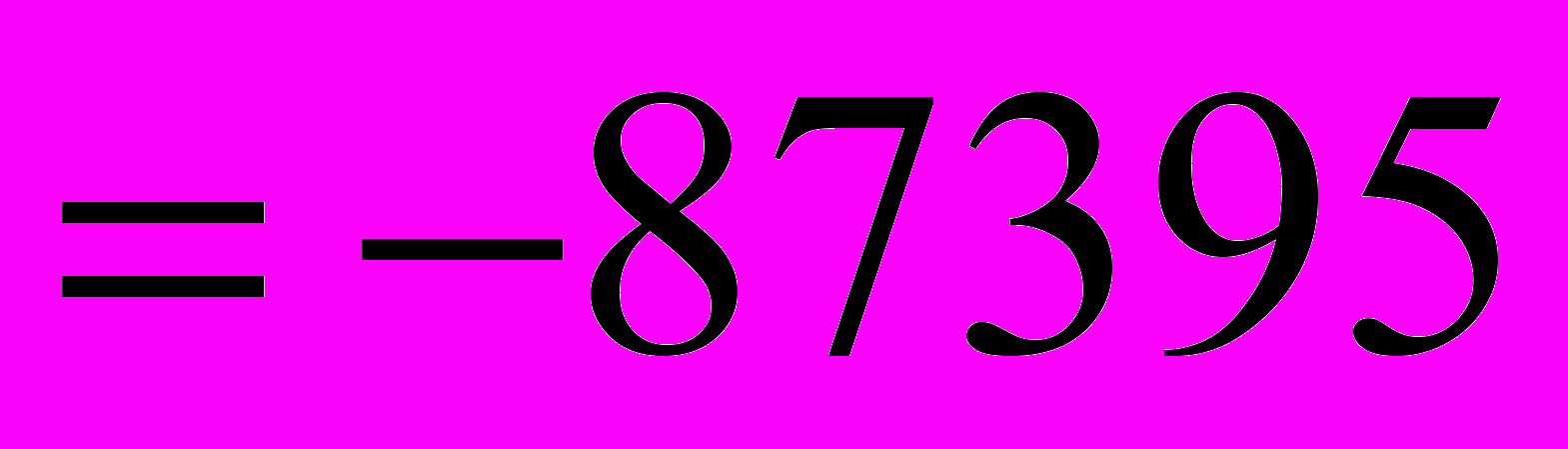Конспект лекций для бакалавров по направлению «металлургия» профиль «Технология литейных процессов»
| Вид материала | Конспект |
СодержаниеКаждое состояние системы может быть охарактери- зовано определенной вероятностью. |
- «теория литейных процессов», 20.07kb.
- Рабочая программа дисциплины по выбору для подготовки бакалавров по направлению 080600, 279.05kb.
- Учебный план подготовки бакалавров по направлению 150400. 62 Металлургия, 428.23kb.
- Программа вступительного испытания по направлению «Металлургия», 51.65kb.
- Аннотация рабочей программы дисциплины «Международный маркетинг» по направлению 080100., 49.47kb.
- Аннотация дисциплины «технологическое оборудование литейных цехов», 30.22kb.
- Конспект лекций Для студентов вузов Кемерово 2006, 1068.06kb.
- Аннотации рабочих программ дисциплин подготовки бакалавров по направлению 150400., 1630.48kb.
- Конспект лекций по дисциплинам «Информатика и компьютерная техника», 550.15kb.
- Конспект лекций по направлению "Ядерная физика и технологии" для бакалавров 1 курса, 782.71kb.
Федеральное агентство по образованию РФ
Московский государственный институт стали и сплавов
(технологический университет)
(МИСиС)
______________________________________________________________
Е.И. Гущина
«ТЕРМОДИНАМИКА»
Конспект лекций
для бакалавров по направлению «МЕТАЛЛУРГИЯ»
профиль «Технология литейных процессов»
Москва 2007 г.
Лекция №1
Физическая химия, как показывает само название этой дисциплины, охватывает проблемы, находящиеся в пограничной области между физикой и химией.
Известно, что химические процессы, связанные с превращением веществ, сопровождаются и инициируются физическими.
Предметом физической химии является взаимосвязь химических и физических явлений.
Проблемы, решаемые ФХ:
- Влияние физических параметров на химические превращения;
- Влияние химического состава на физические свойства систем.
Методы решения этих проблем:
- Термодинамика
- Статистическая механика
- Квантовая механика
Круг конкретных практических задач, решаемых этими методами:
- Расчеты равновесий
- Вопросы скоростей процессов, лежащие в основе интенсификации и автоматизации технологических процессов.
- Проблема получения материалов с заданными свойствами
Теоретической основой всего этого является физическая химия.
Традиционные, классические металлургия и металловедение непосредственно опираются на физическую химию, обосновывающую теорию химических процессов в металлургических агрегатах, позволяющую рассчитывать скорости этих процессов и определить пути их интенсификации.
Основные понятия термодинамики
- Термодинамическая система – материальный объект, выделенный из внешней среды с помощью реально существующей или воображаемой граничной поверхности и способный обмениваться с другими телами энергией и (или) веществом.
Системы бывают:
- Гомогенные – физически однородные системы, имеющие одинаковые физические свойства во всех своих частях;
- Гетерогенные – системы, состоящие из нескольких однородных частей с разными физическими свойствами;
- Изолированные, в которых нет обмена с окружением ни энергией, ни веществом.
Любая термодинамическая система является моделью реального объекта.
- Состояние системы – совокупность физических и химических свойств, характеризующих систему.
Состояние термодинамической системы характеризуется термодинамическими параметрами. К ним относятся T, p, V, концентрации.
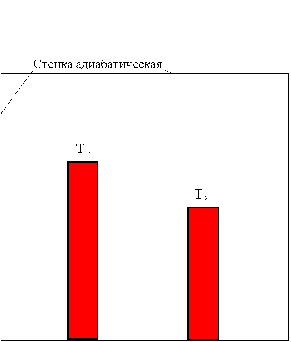
Термодинамическое равновесие – это такое состояние, в которое приходит система при неизменных внешних условиях, т.е. т/д параметрах.
Частные случаи т/д равновесия:
тепловое равновесие
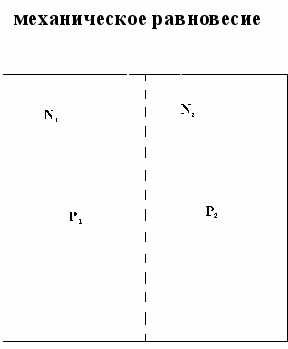
P1=P2
химическое равновесие
3. Термодинамический процесс. Если параметры, характеризующие состояние системы (p, T, V) меняются, то в системе будет протекать т/д процесс.
Различают процессы:
- самопроизвольные, для осуществления которых не надо затрачивать энергию;
- не самопроизвольные, происходящие только при затрате энергии;
- обратимые, когда переход системы из одного состояния в другое и обратно может происходить через последовательность одних и тех же состояний, и после возвращения в исходное состояние ни в системе, ни в среде не остается никаких изменений.
- равновесные, которые происходят под действием бесконечно малых изменений внешних параметров.
- Термодинамические функции разделяют на:
- функции состояния;
- функции перехода.
- функции состояния;
Функции состояния зависят только от состояния системы и не зависят от пути по которому это состояние получено.
Примеры функций состояния:
U – внутренняя энергия;
H – энтальпия;
F – энергия Гельмгольца;
G – энергия Гиббса;
S – энтропия
Термодинамические переменные – объем V, давление p, температуру T – также можно считать функциями состояния, т.к. они однозначно определяют состояние системы
Функции перехода. Их значение зависит от пути, по которому происходит изменение системы.
Примеры функций перехода:
Q – теплота,
W – работа.
Математические свойства функций состояния и функций перехода различны.
Функции состояния характеризуются следующими свойствами:
- бесконечно малое изменение функции состояния является полным дифференциалом
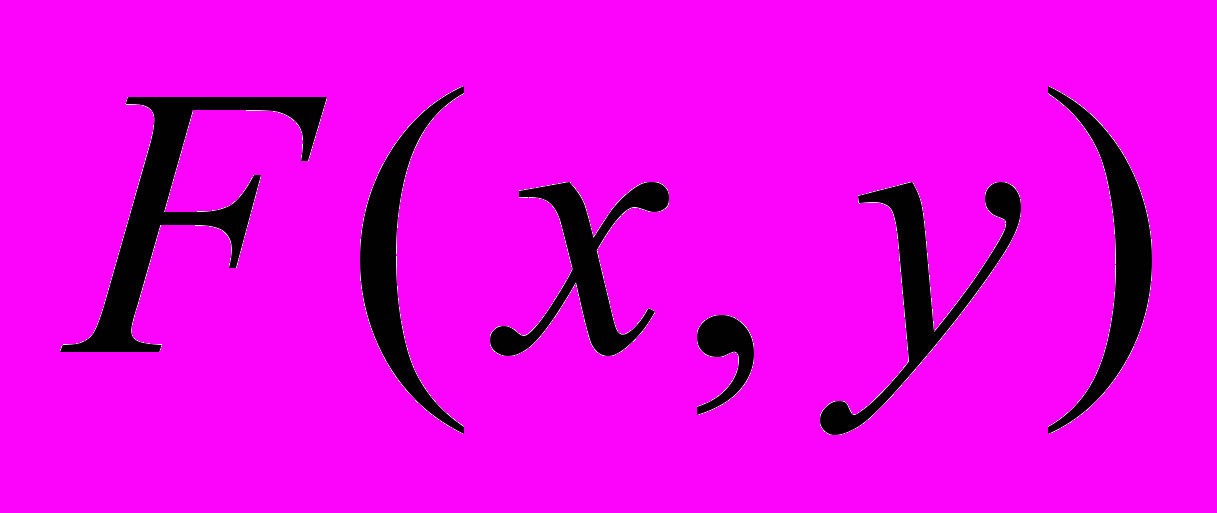 - функция состояния
- функция состояния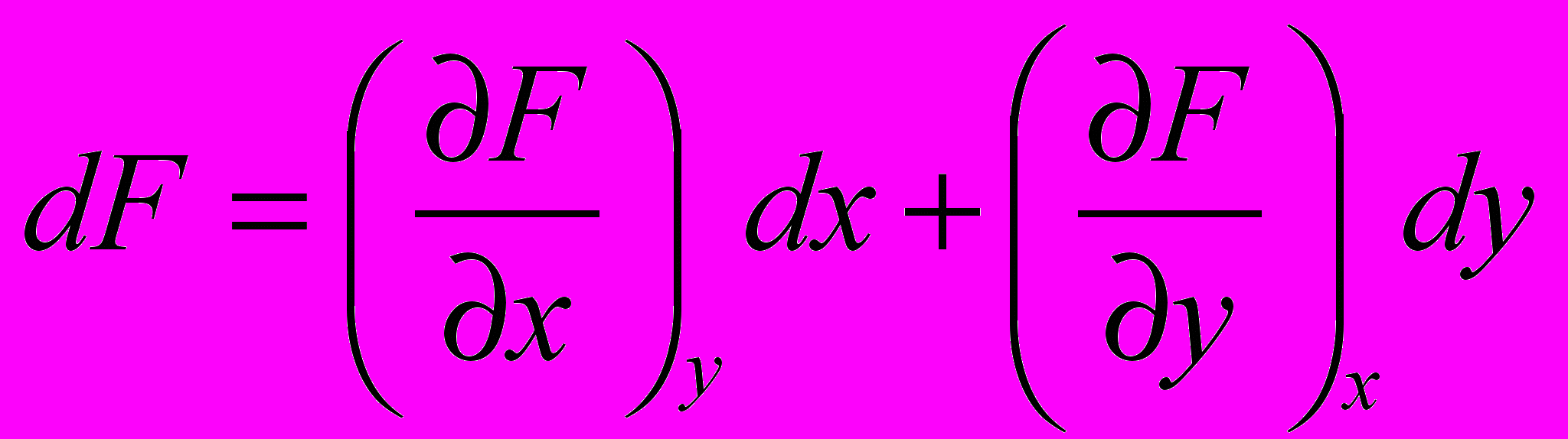
- изменение функции состояния при переходе из состояния 1 в состояние 2 определяется только этими состояниями
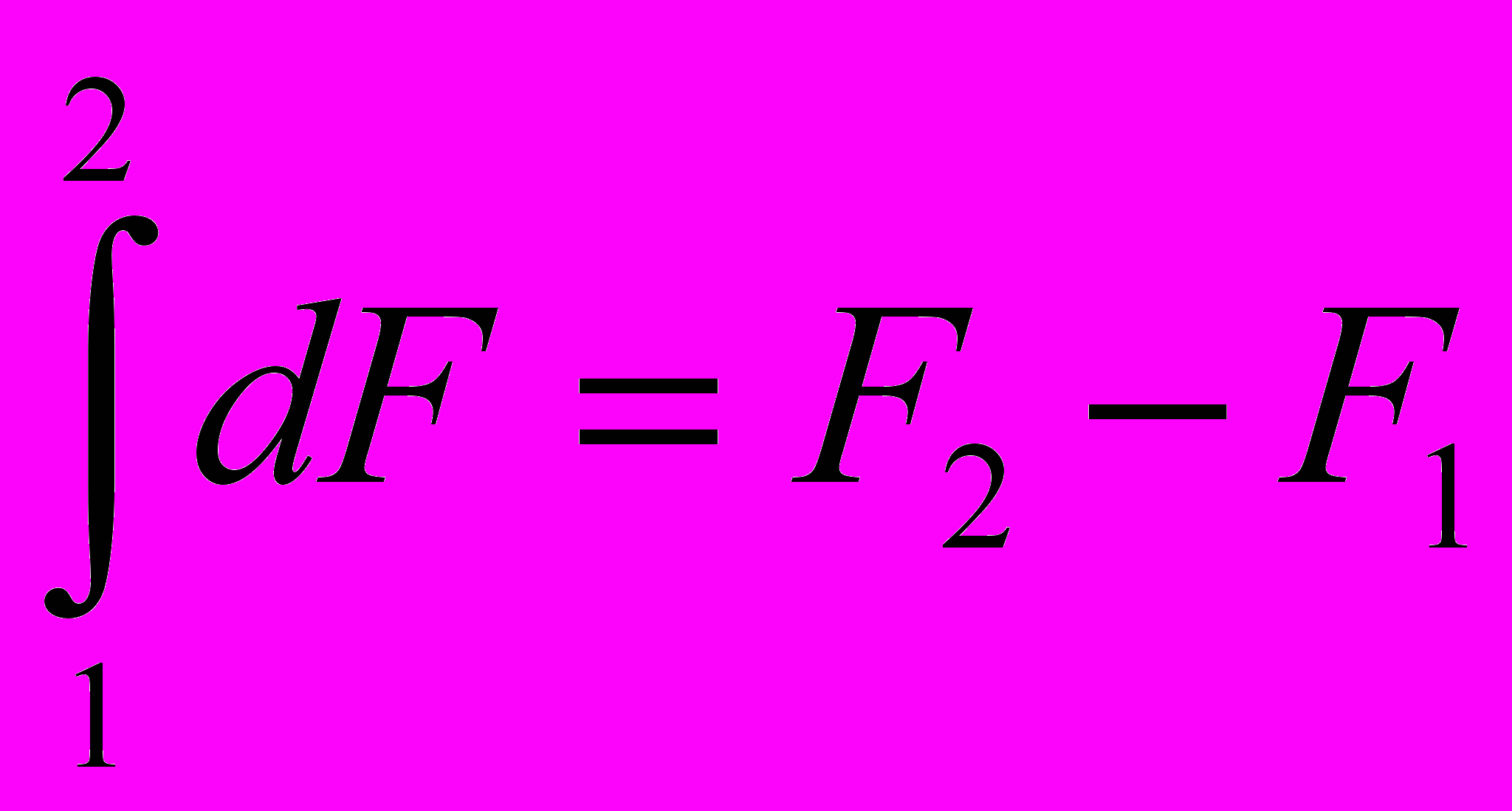
Все выводы и соотношения термодинамики можно сформулировать на основании двух постулатов и трех законов.
Основной постулат
- Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно не может из него выйти.
Самопроизвольный переход системы из неравновесного состояния в равновесное называется релаксацией.
Основной постулат ничего не говорит о времени релаксации.
В классической термодинамике вообще нет понятия времени.
Выводы
Мы ознакомились с
- предметом
- проблемами
- методами
- значением физической химии для металлургии
- основными понятиями термодинамики
Лекция №2
Первый закон термодинамики.
Применение к различным процессам в идеальном газе
- Формулировка I закона
- Дифференциальная и интегральная формы записи закона
- Комментарии
- Правило знаков
- Применение I закона к различным процессам
- изохорный
- изобарный
- изотермический
- адиабатический процессы
- изохорный
- Примеры расчетов
| Q теплота | W работа | U внутренняя энергия |
Q – одна из форм передачи энергии. Связана с неупорядоченным движением молекул
W – другая форма передачи энергии. Связана с упорядоченным (организованным) движением молекул
В химической т/д рассматривается только работа расширения
Для элементарного процесса
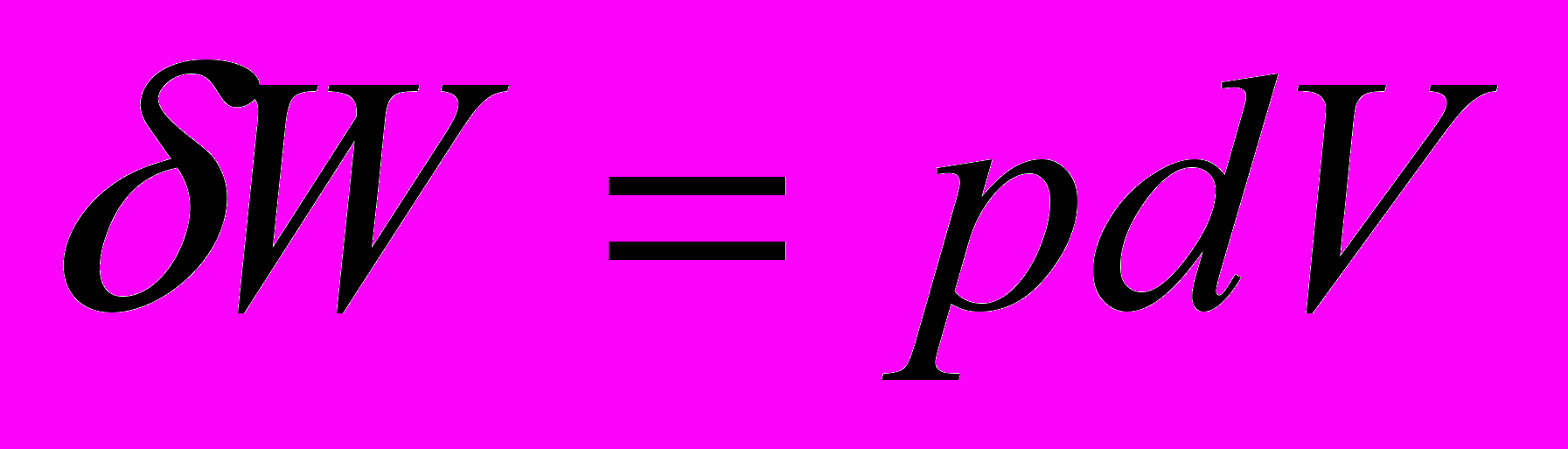
Работа всего процесса
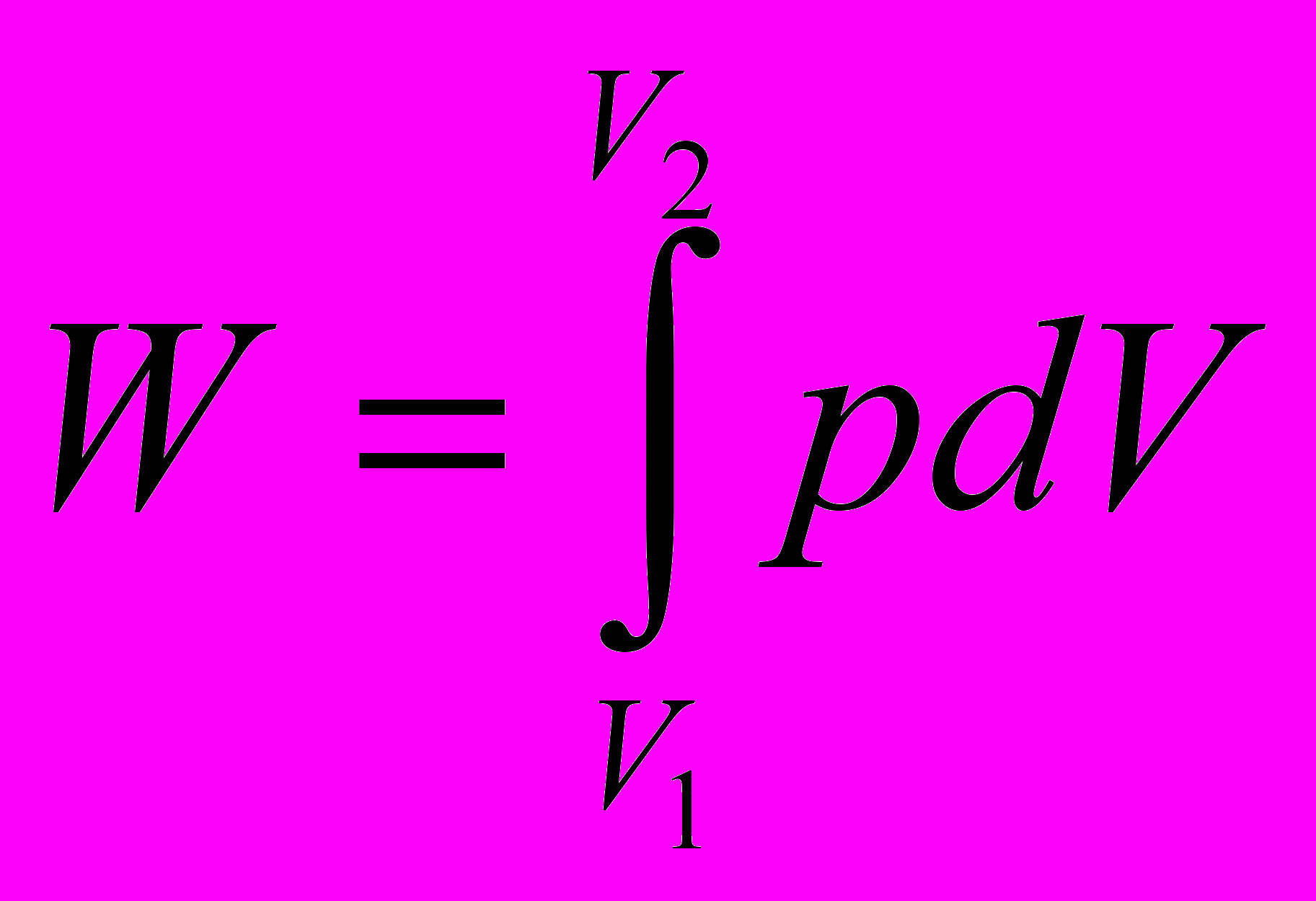
U – совокупность всех видов внутреннего движения системы
В общем случае
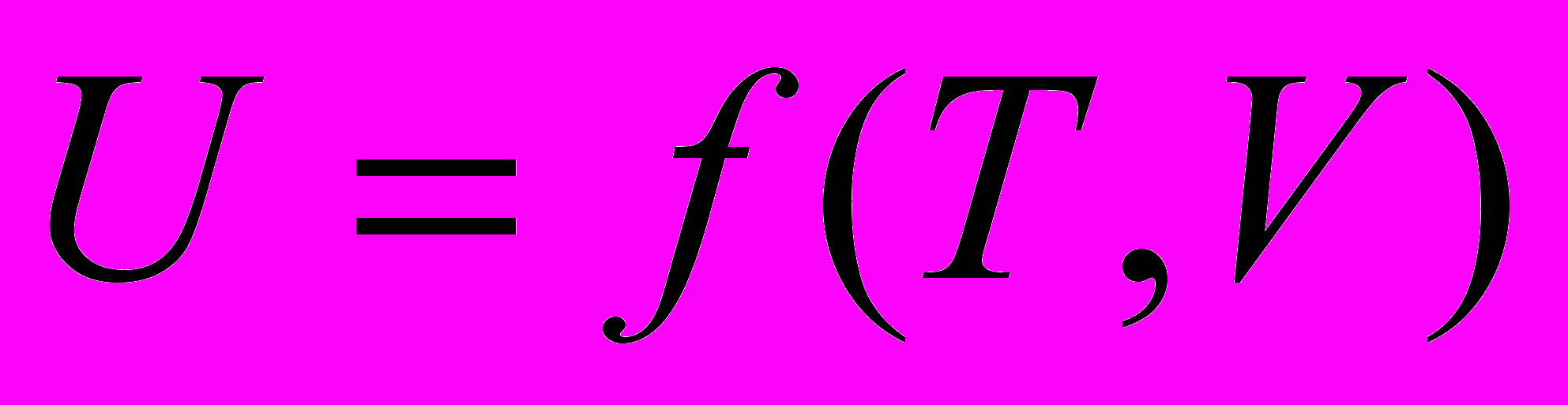
Для идеального газа -
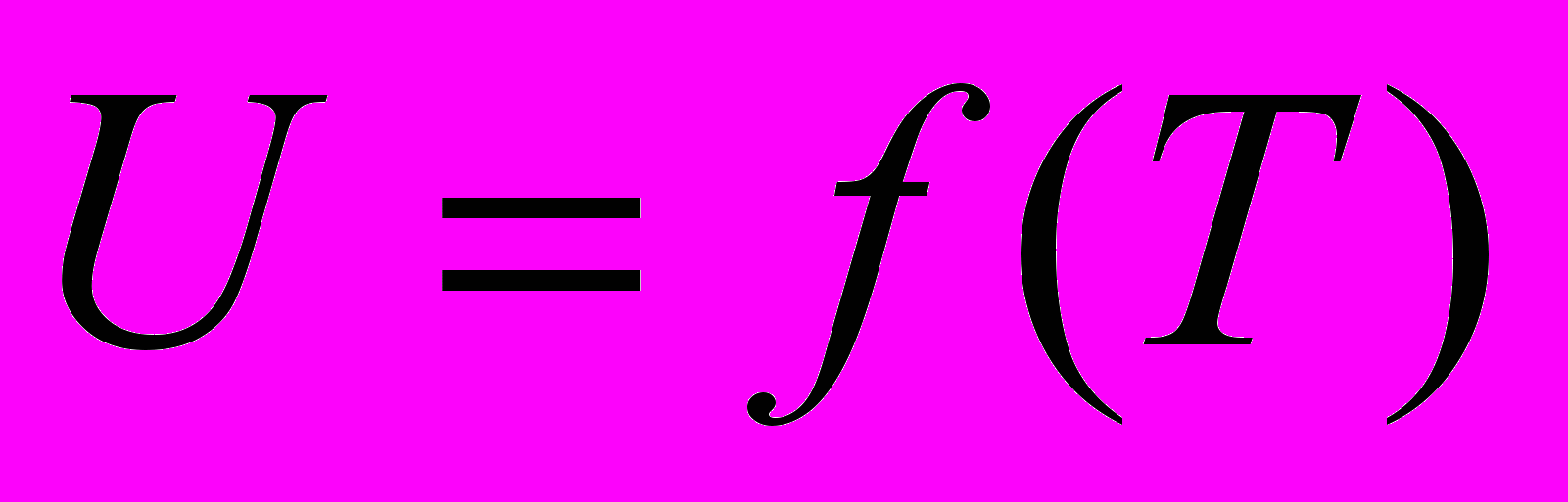
Идеальный газ – газ, взаимодействием между молекулами которого и размерами молекул можно пренебречь.
- Тепло, сообщаемое системе, расходуется на изменение внутренней энергии и работу, совершаемую системой.
Математическая запись I закона
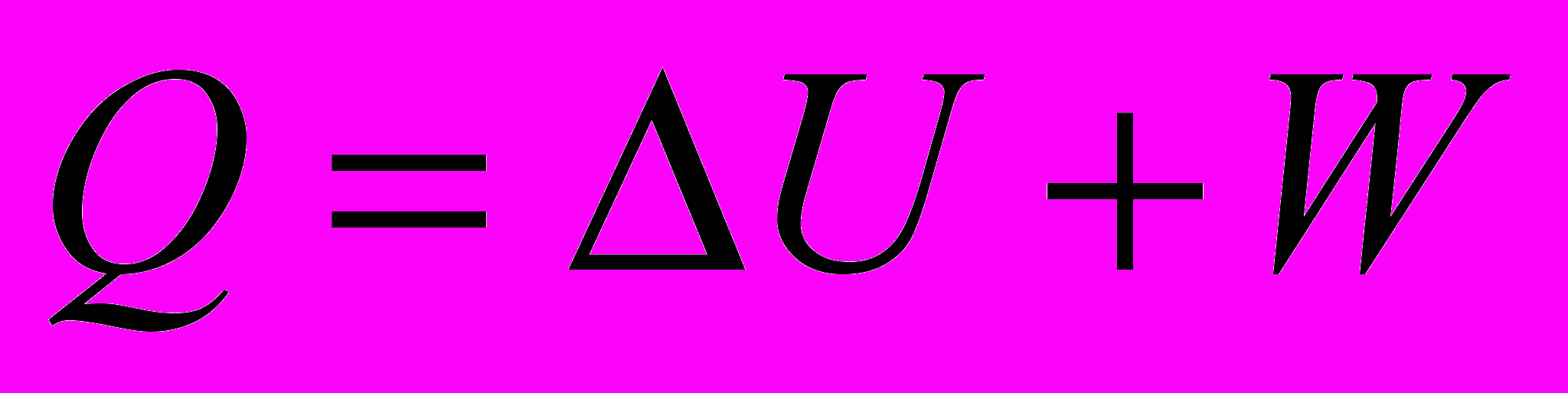 - интегральная форма.
- интегральная форма.Используется для процесса между двумя конечными состояниями системы
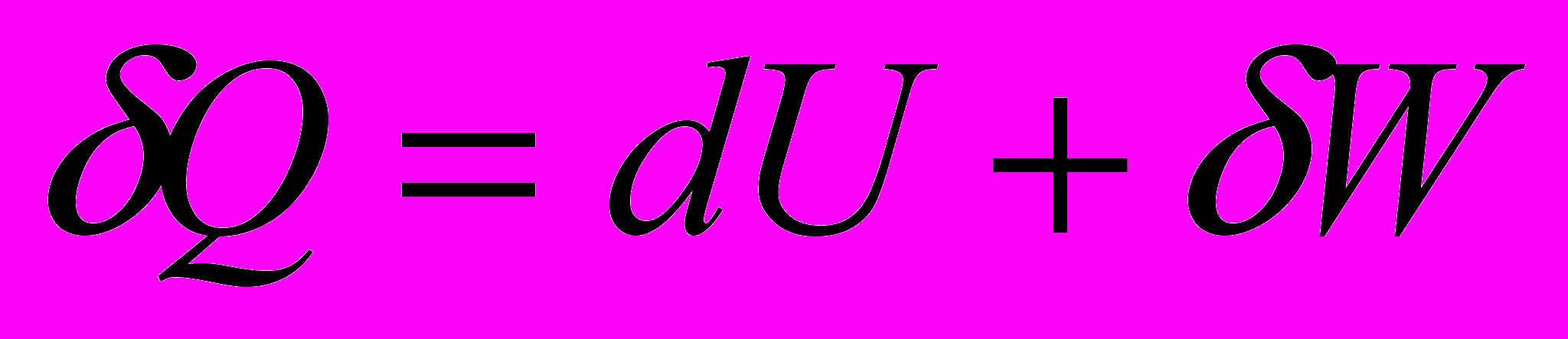 - дифференциальная форма.
- дифференциальная форма.Используется для элементарного процесса, т.е. для процесса между двумя бесконечно близкими состояниями системы.
Комментарий 1. Ни теплота, ни работа (каждая в отдельности) не являются функциями состояний
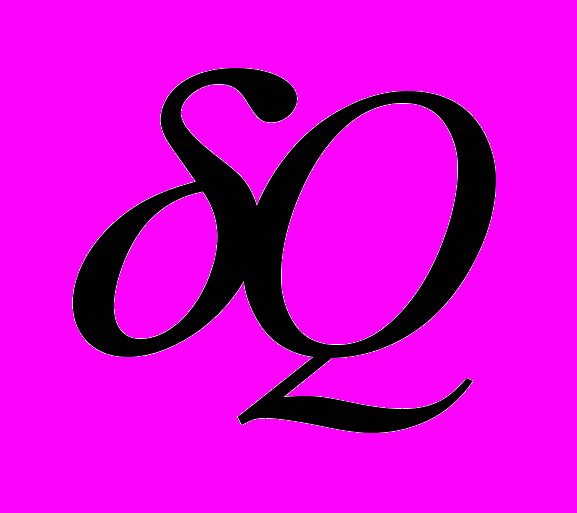 и
и  - бесконечно малые величины
- бесконечно малые величины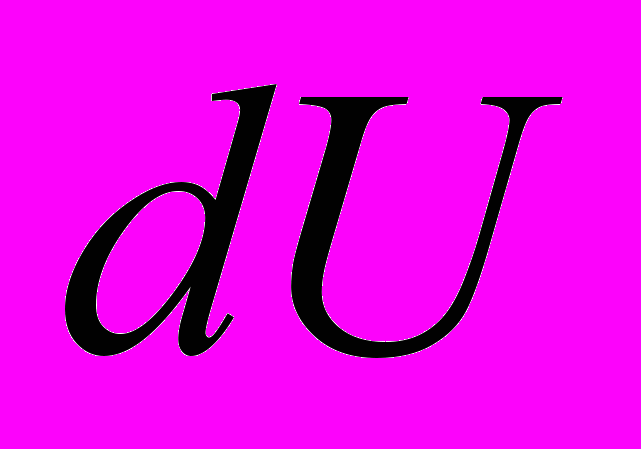 - полный дифференциал функции состояния.
- полный дифференциал функции состояния.Комментарий 2. Первый закон т/д связан с именами:
- Майер Роберт Юлиус
- Гельмгольц Герман Людвиг Фердинанд
- Джоуль Джеймс Прескотт
Правило знаков в термодинамике
- Работа W считается положительной, если система сама совершает работу над окружающими телами.
- Теплоту Q принято считать положительной, если система получает тепло, и отрицательной, если система отдает тепло.
Приложения I закона к различным процессам
- Изохорный процесс. Система – идеальный газ
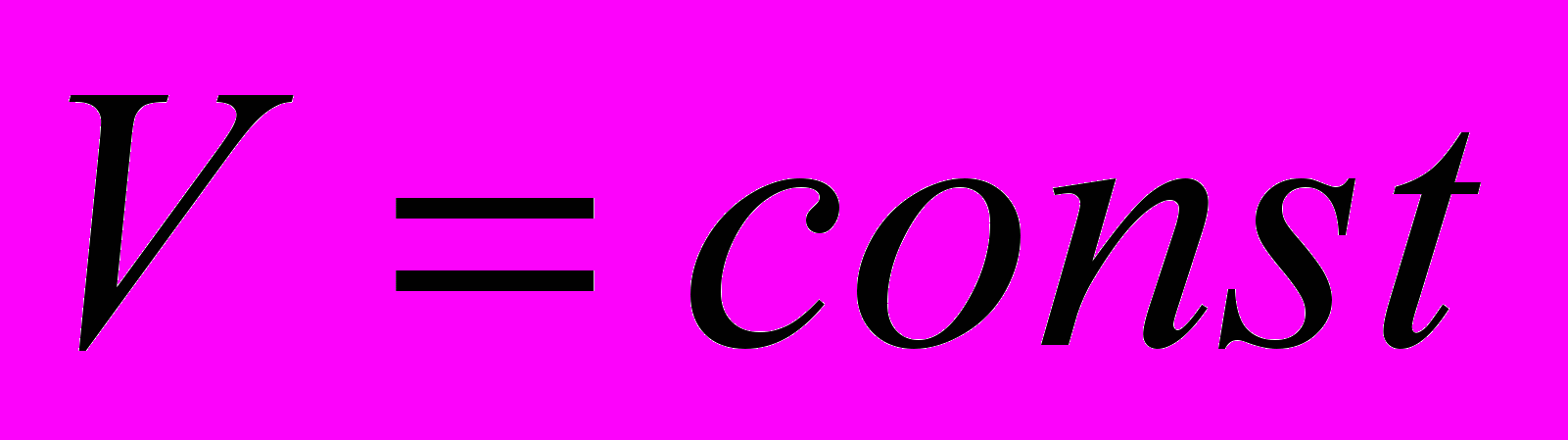
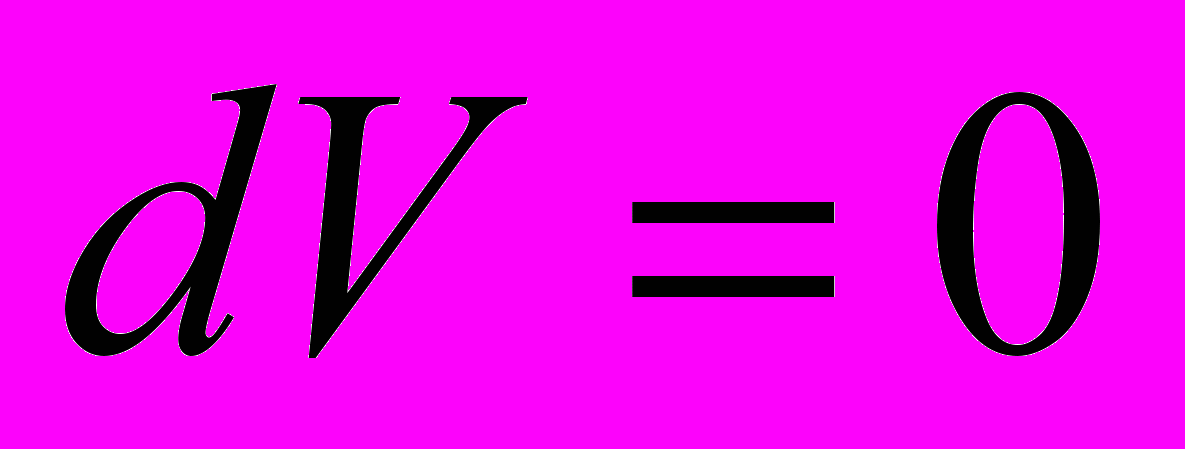
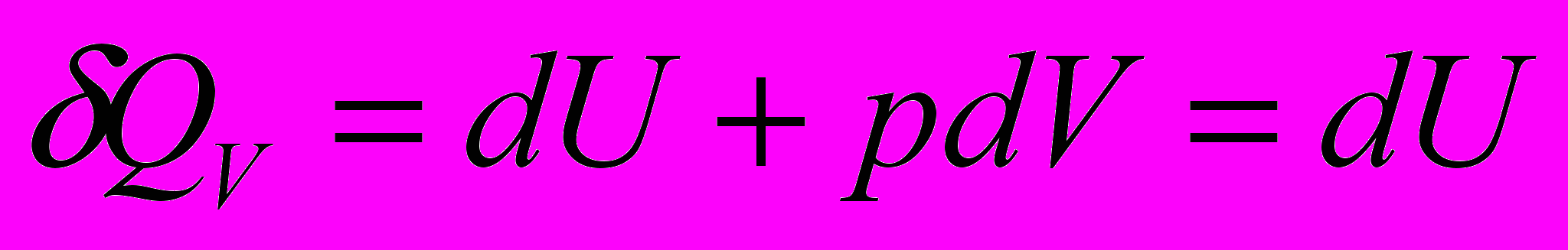
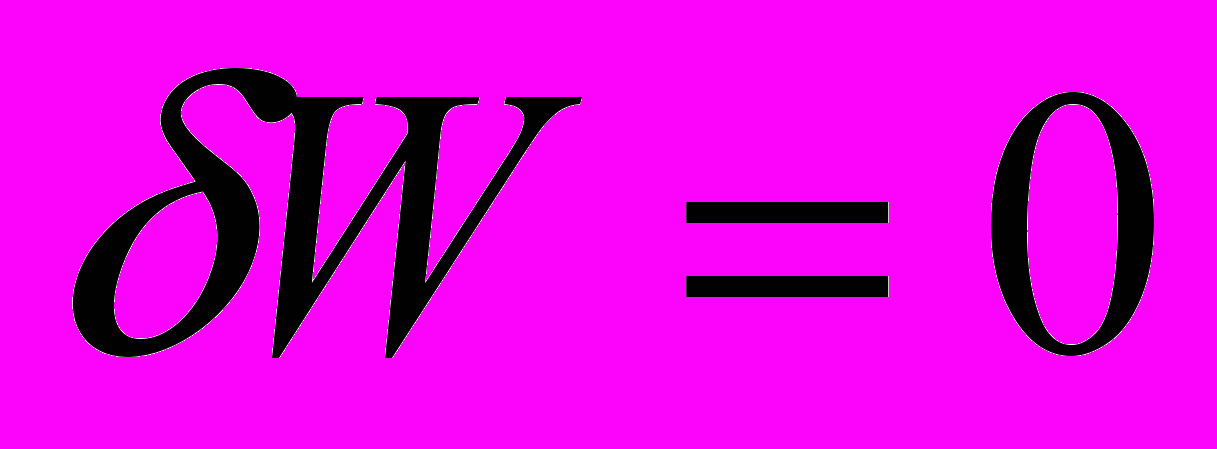
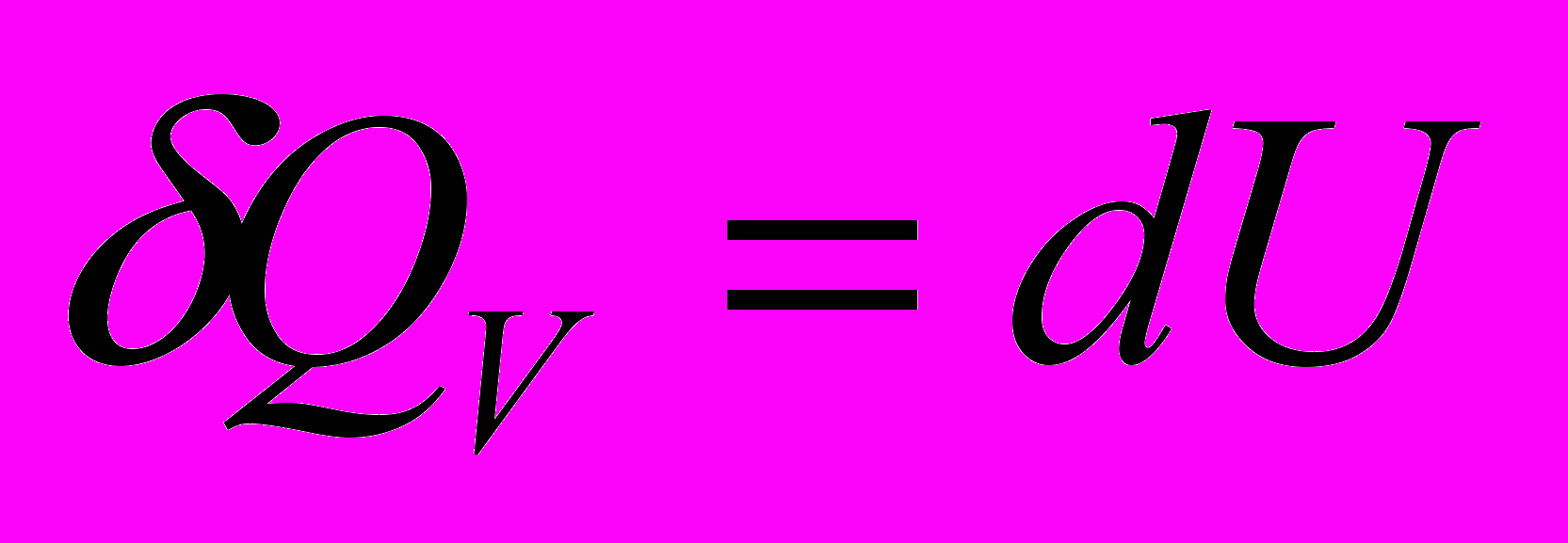
Тепло, сообщаемое системе при
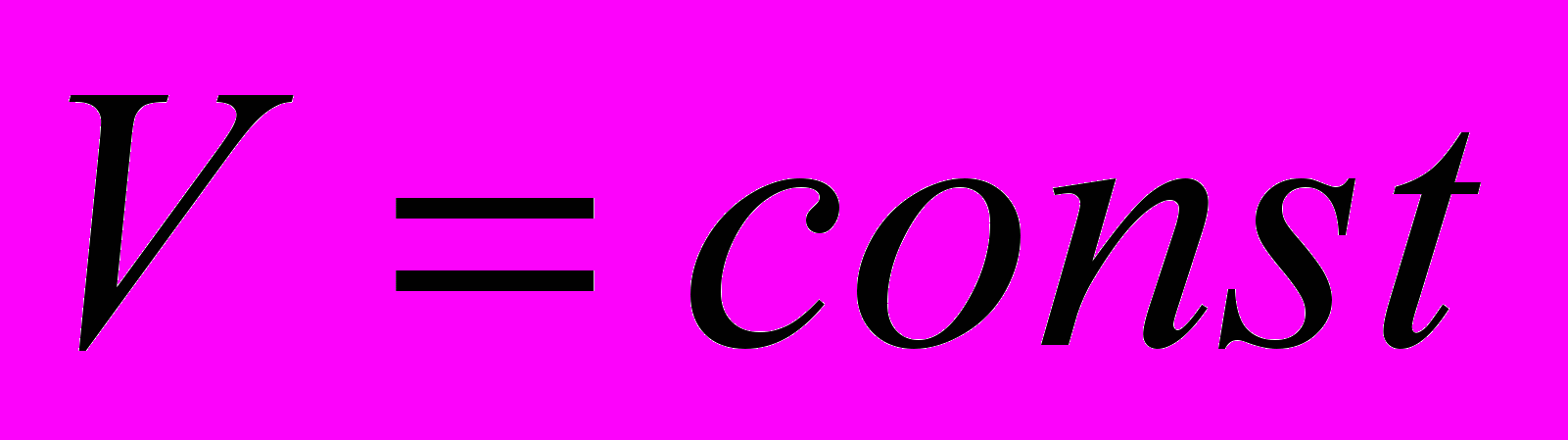 , расходуется на изменение внутренней энергии системы.
, расходуется на изменение внутренней энергии системы.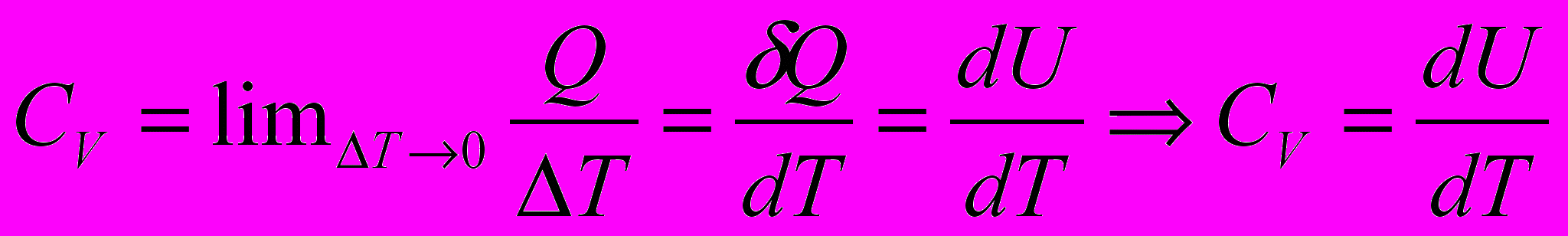
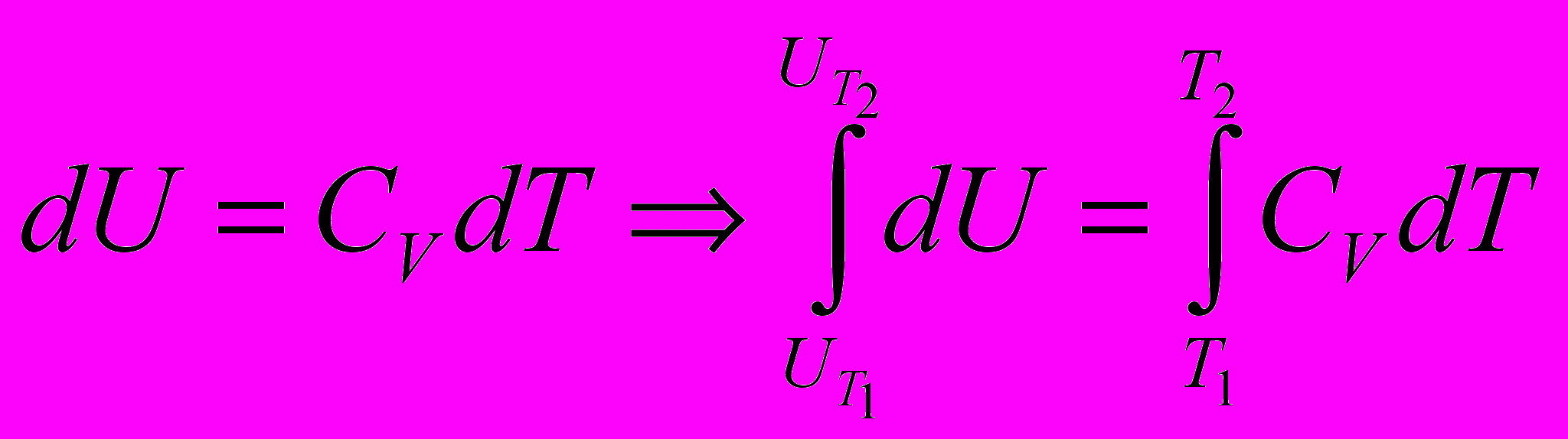
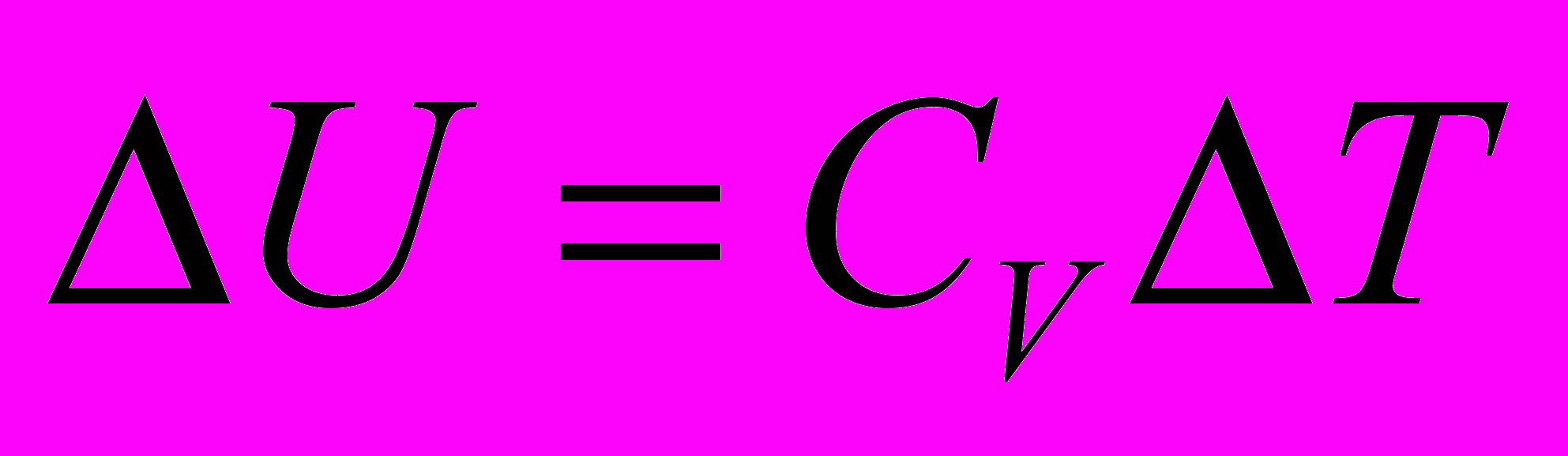
- Изобарный процесс. Система – идеальный газ
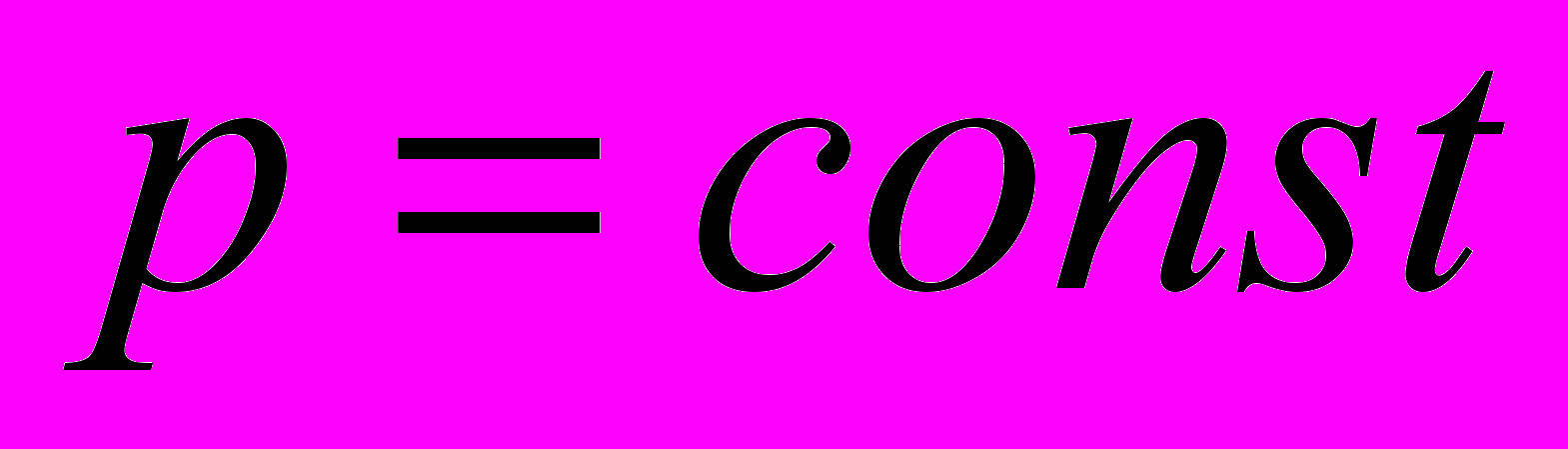
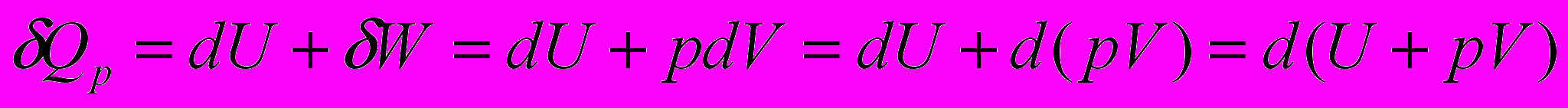
Обозначим
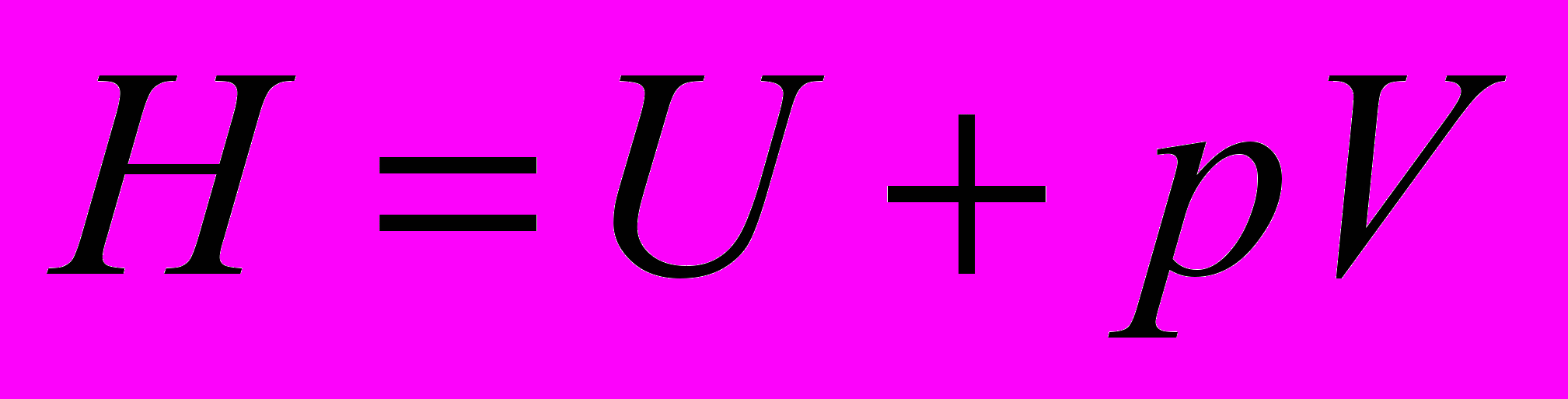 - энтальпия
- энтальпия - функция состояния
- функция состояния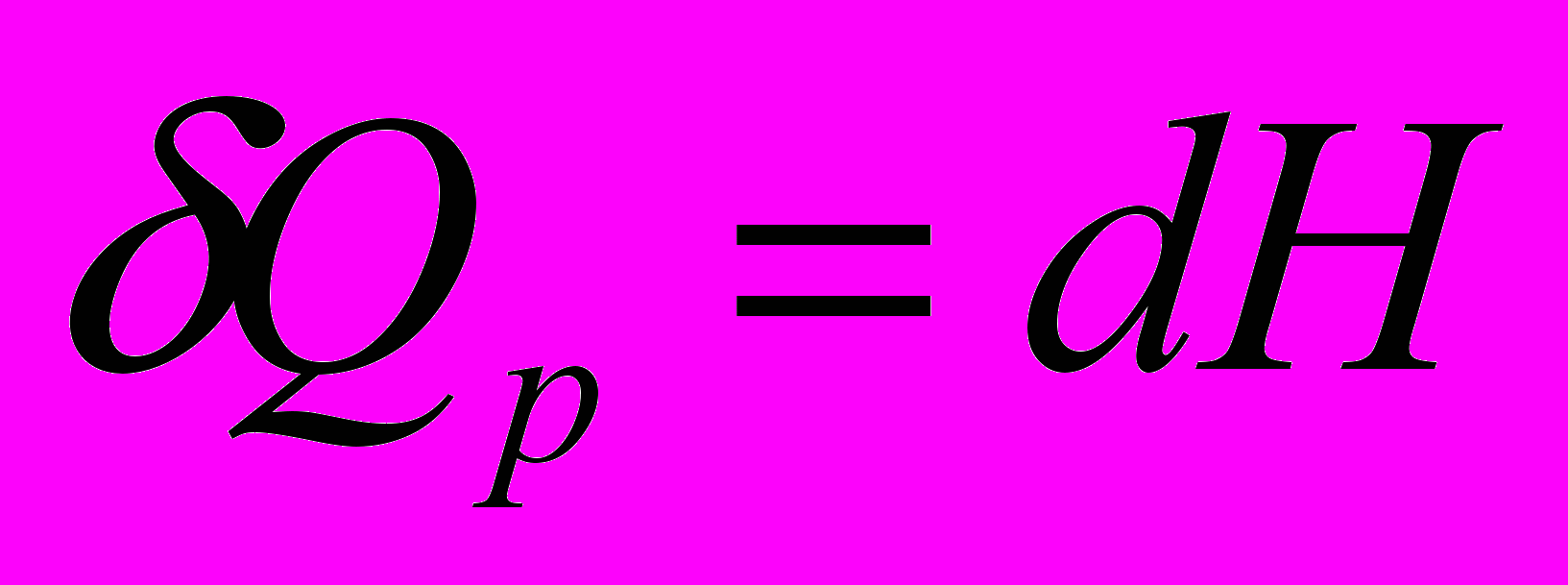
Тепло, сообщаемое системе при изобарном процессе, расходуется на изменение энтальпии системы.
Для процесса между конечными состояниями системы
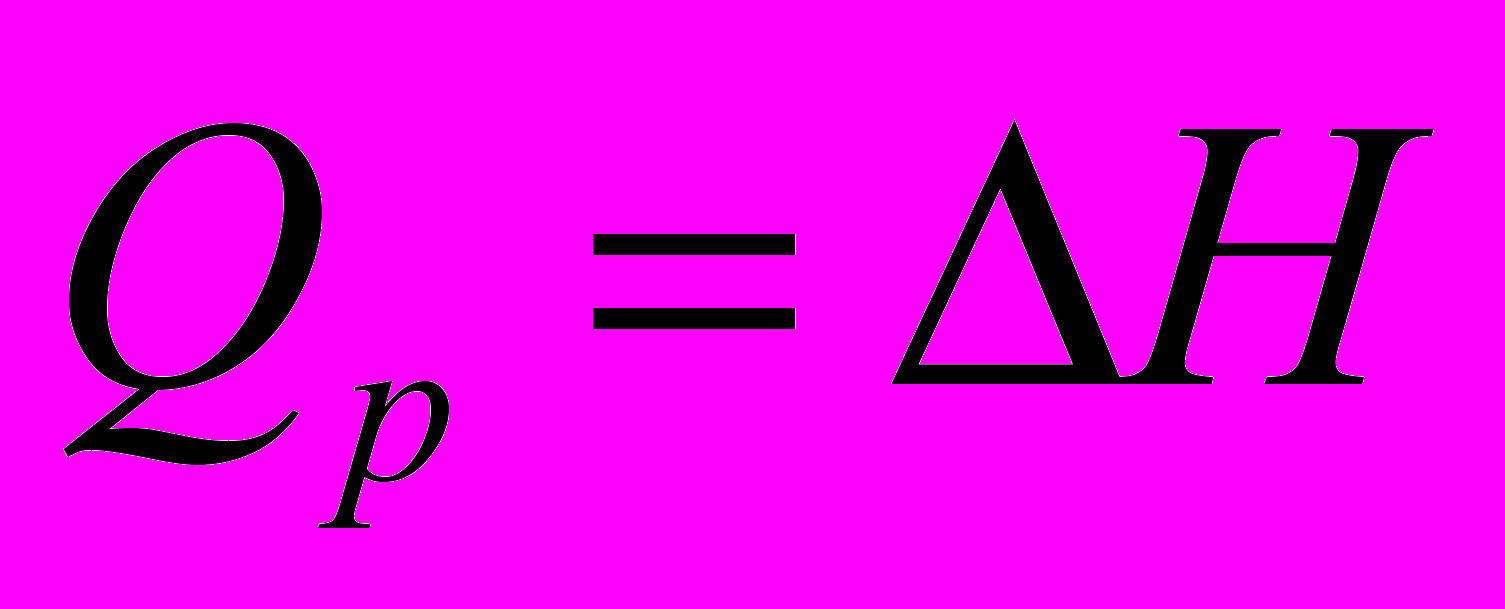
Работа при изобарном процессе
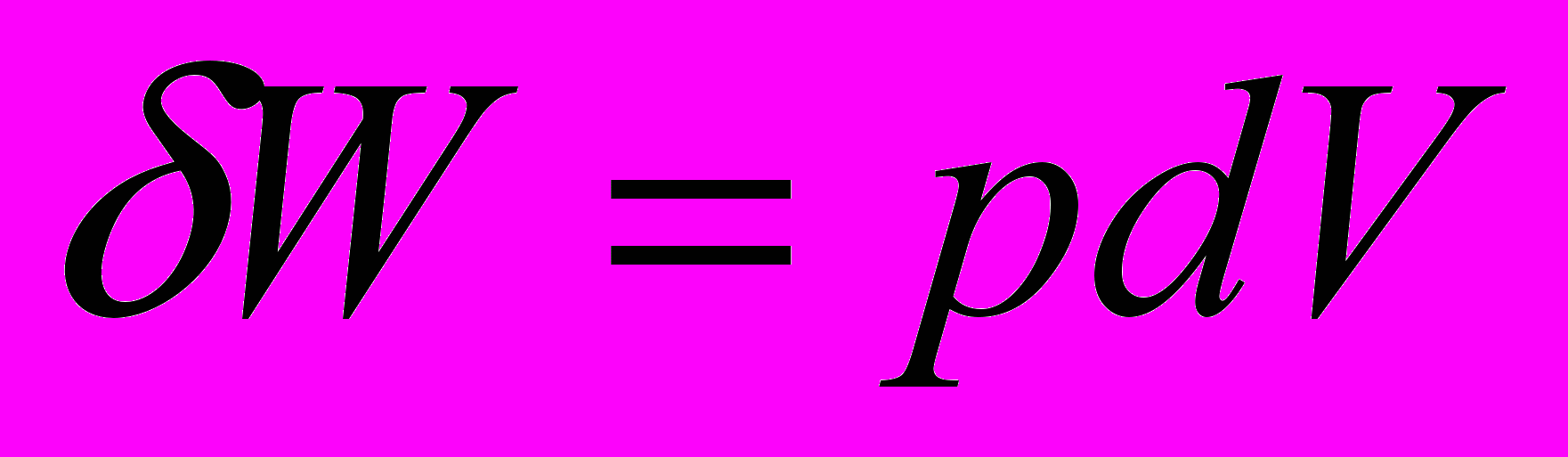
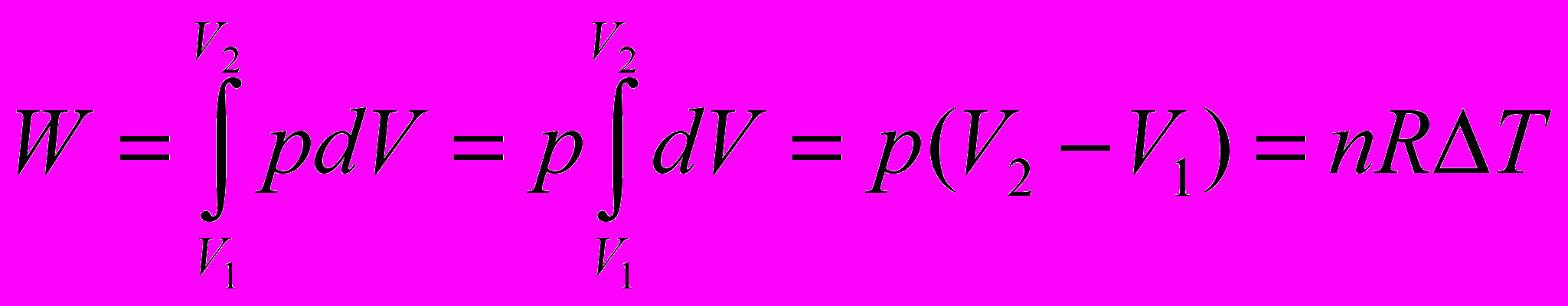
Теплоемкость системы при изобарном процессе
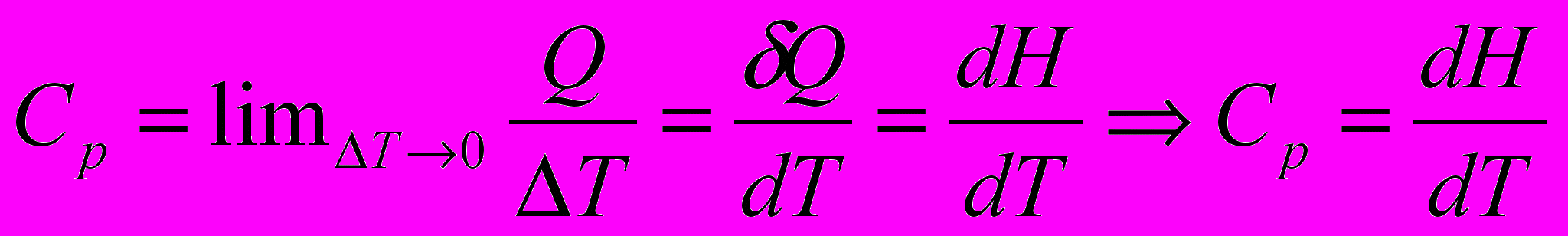
Получим уравнение зависимости энтальпии индивидуального вещества от температуры
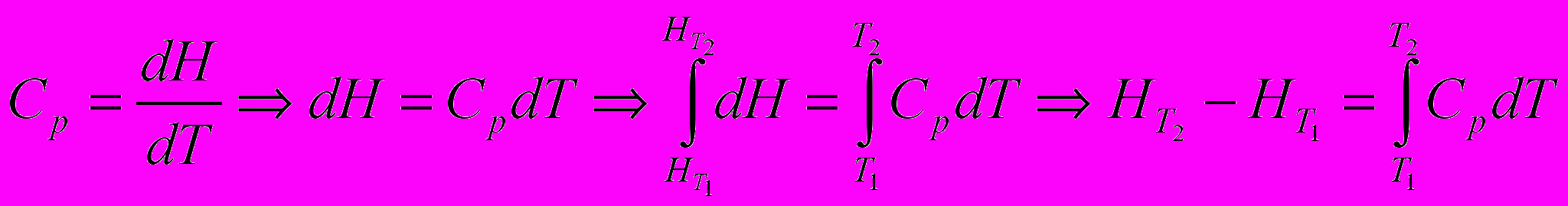
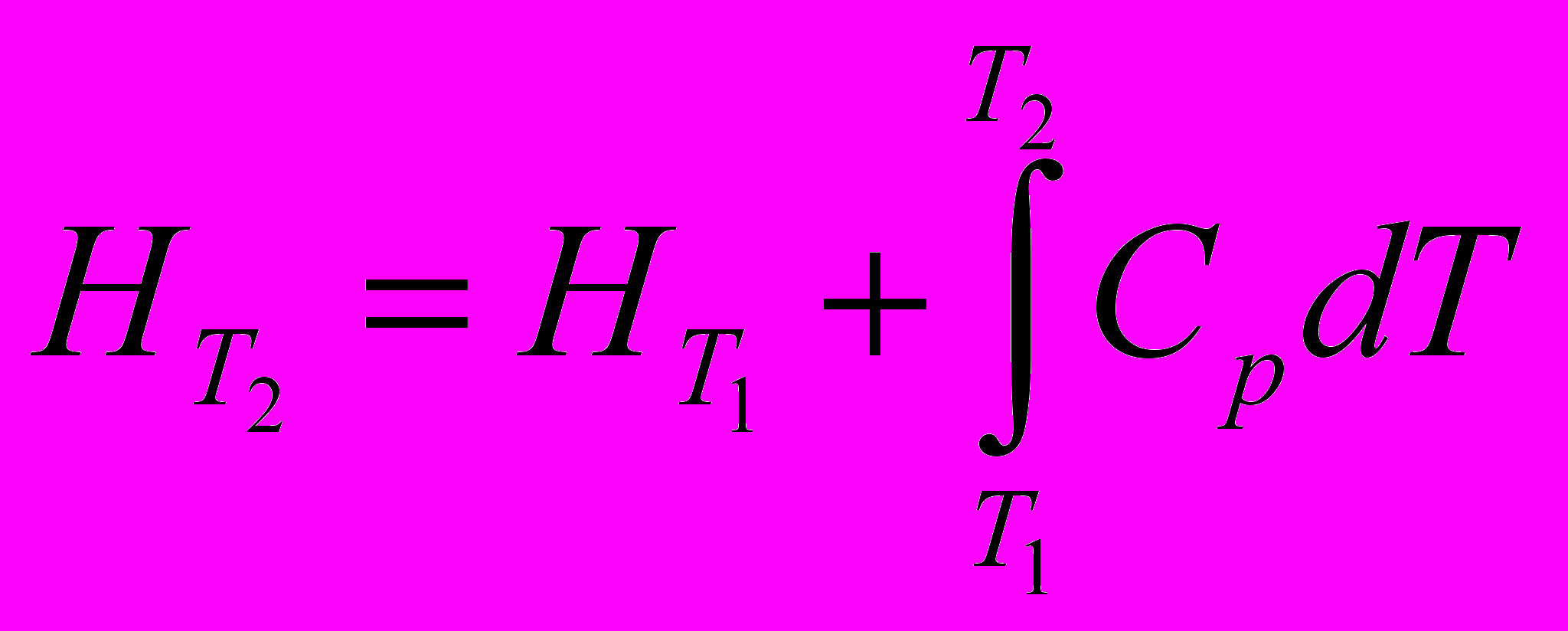
Уравнение связи теплоемкостей
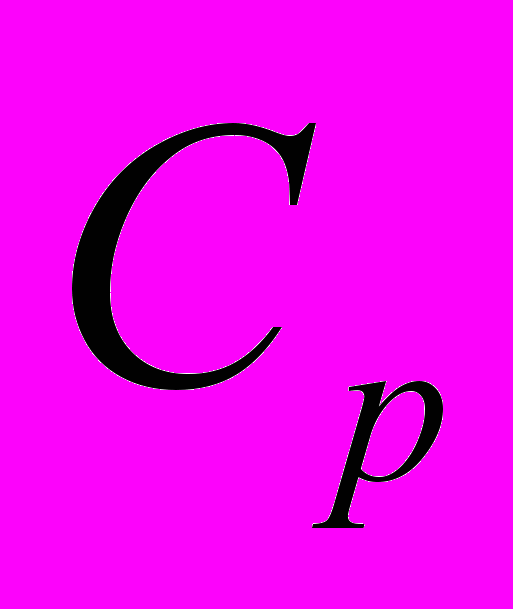 и
и 
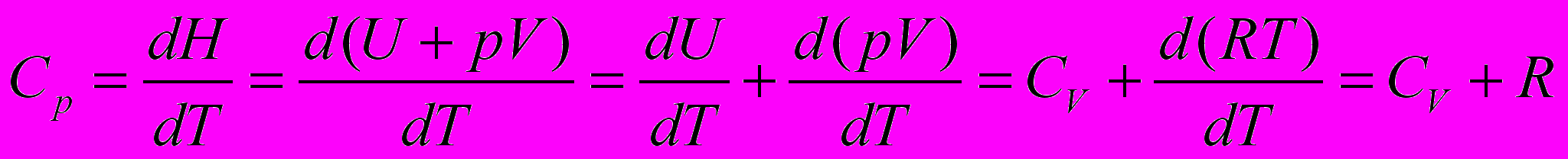
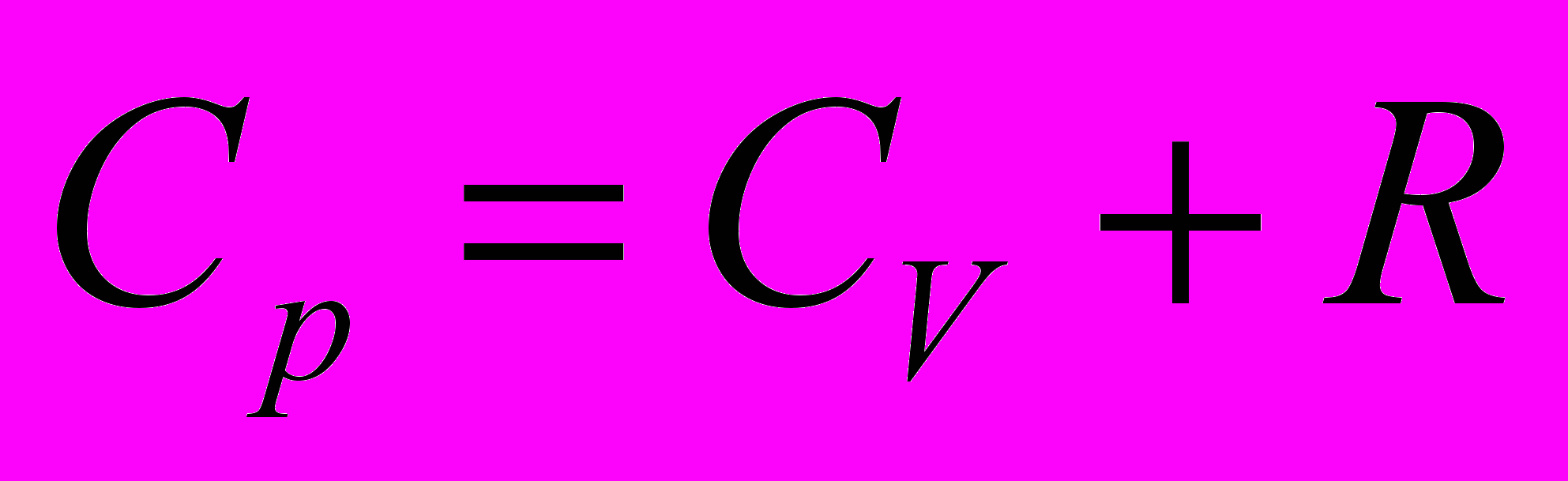 - справедливо только для идеальных газов
- справедливо только для идеальных газов- Изотермический процесс. Система – идеальный газ
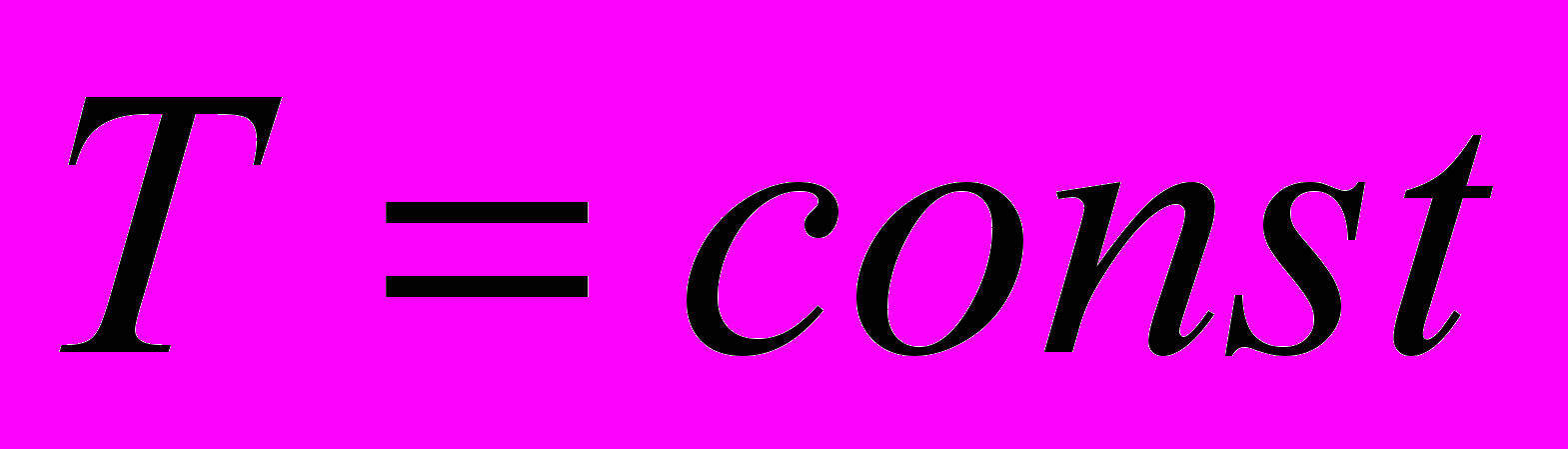
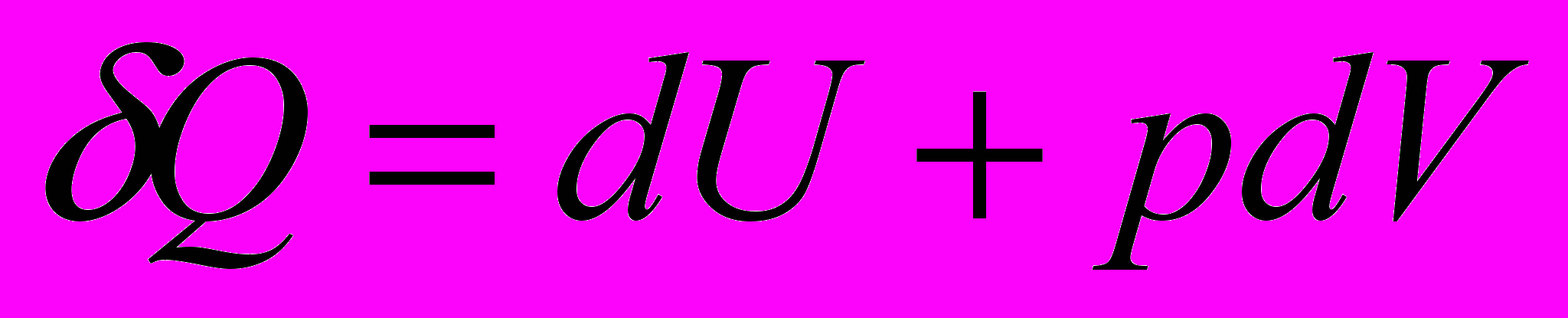
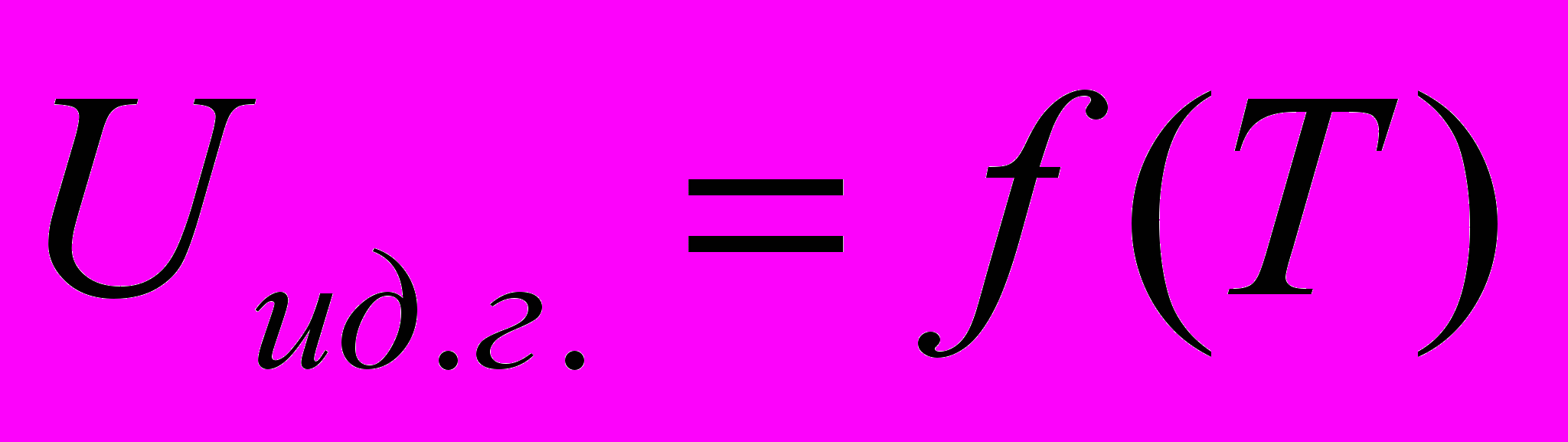
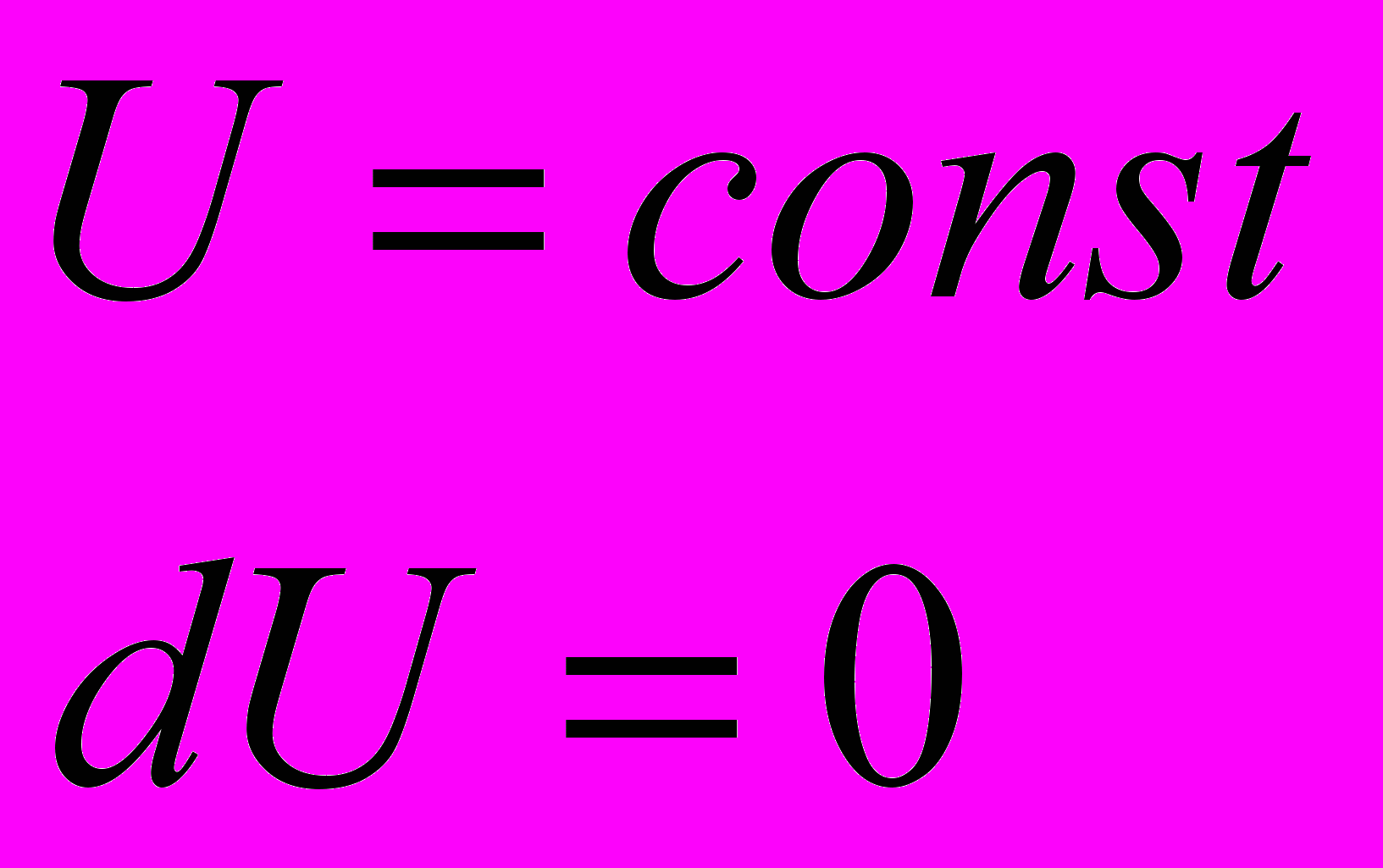
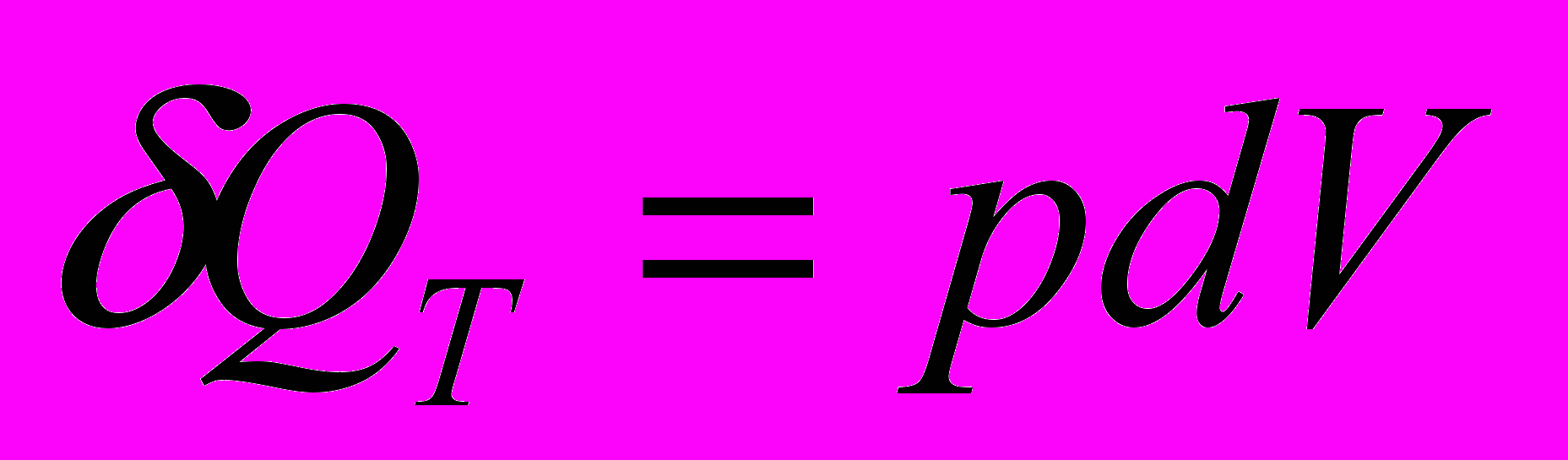
Оценим величину работы при изотермическом процессе
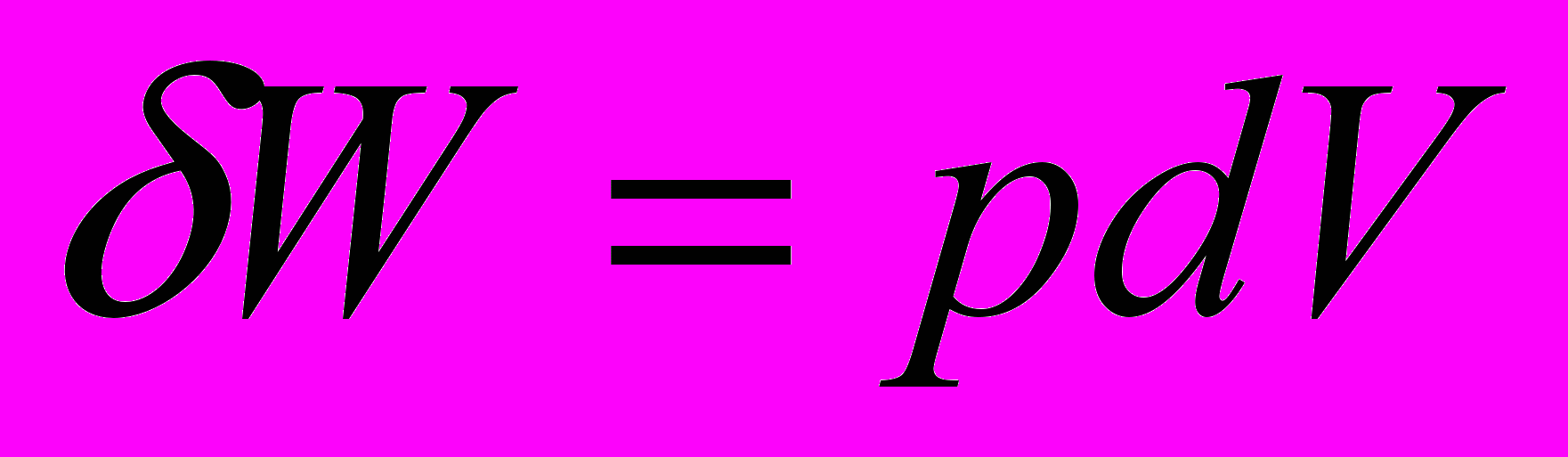 для
для 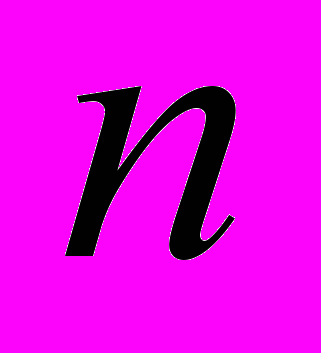 молей идеального газа
молей идеального газа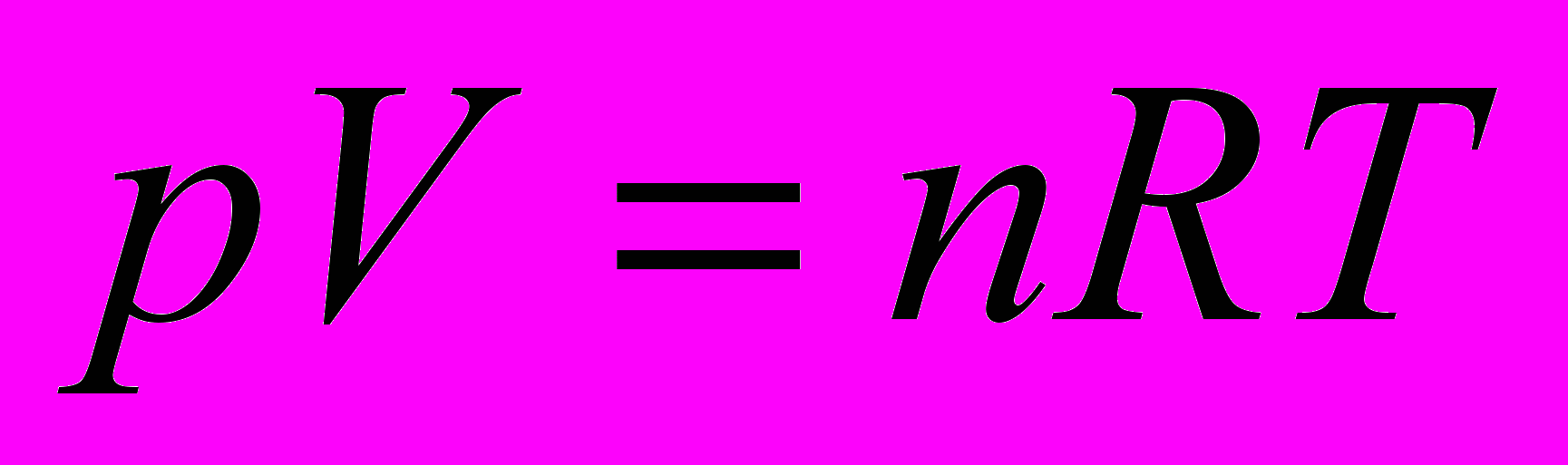
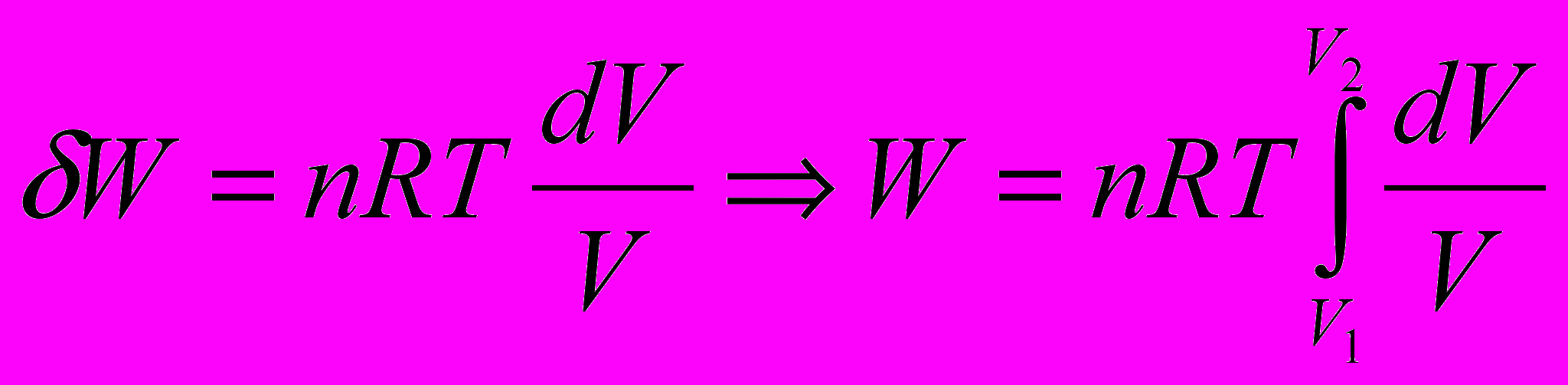
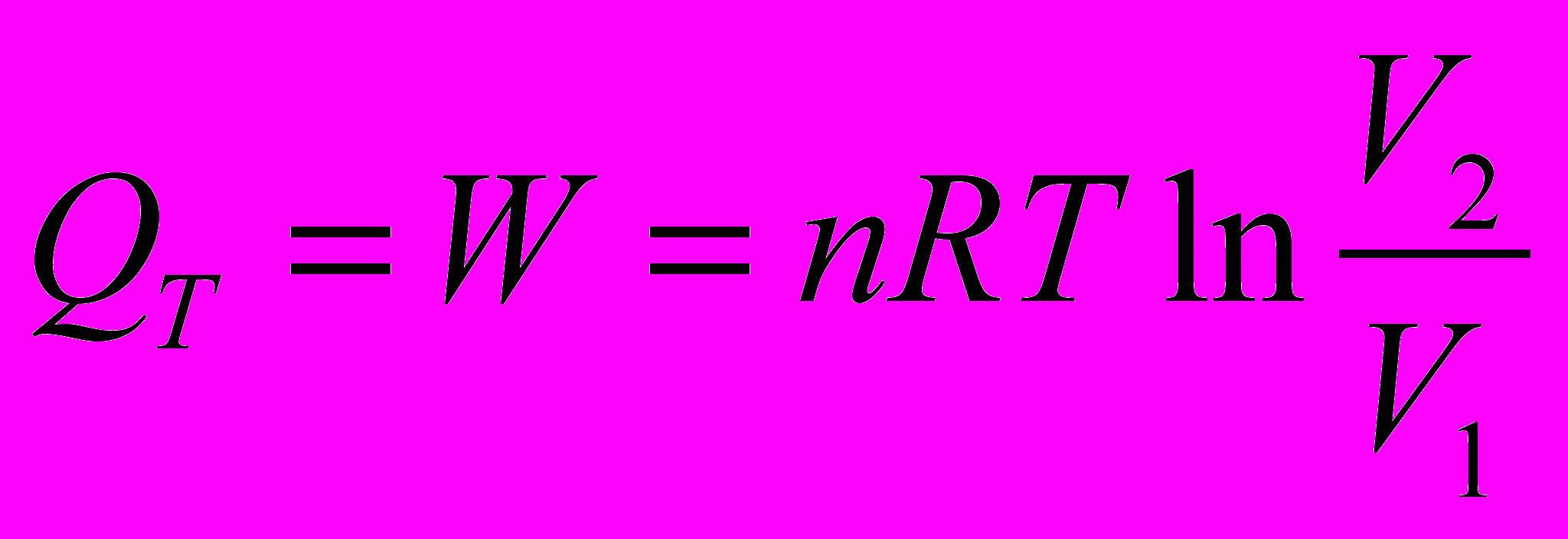
Тепло, сообщаемое системе при изотермическом процессе, расходуется на работу, совершаемую системой
- Адиабатный процесс. Система – идеальный газ
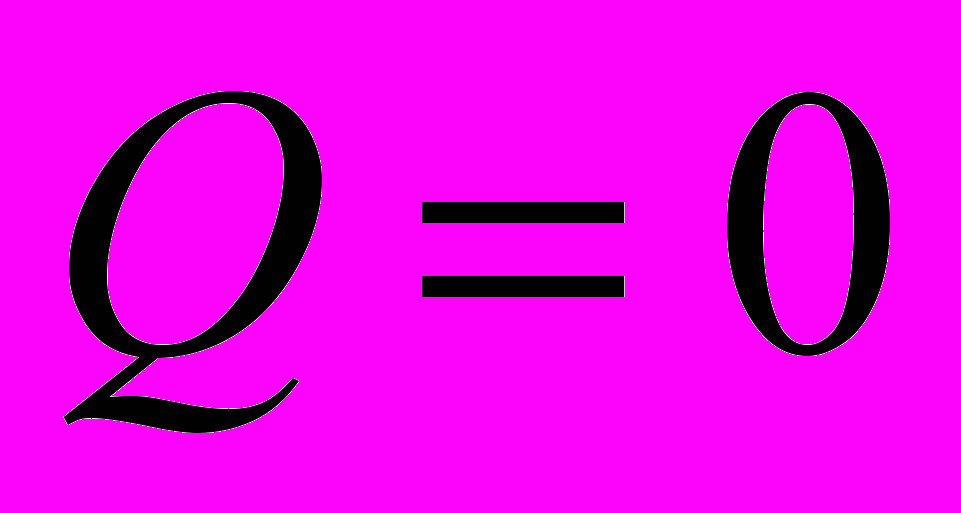 ;
; 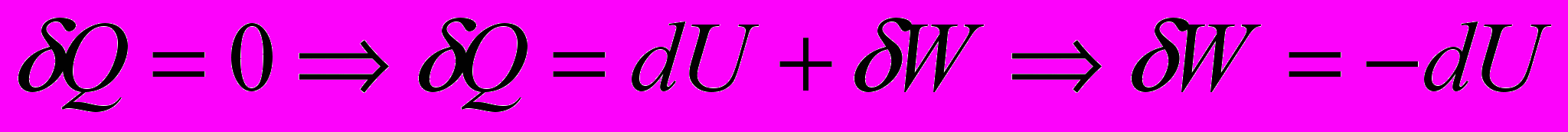
При этом процессе вся работа совершается за счет убыли внутренней энергии системы
Без вывода (см. [2] стр. 15-16)
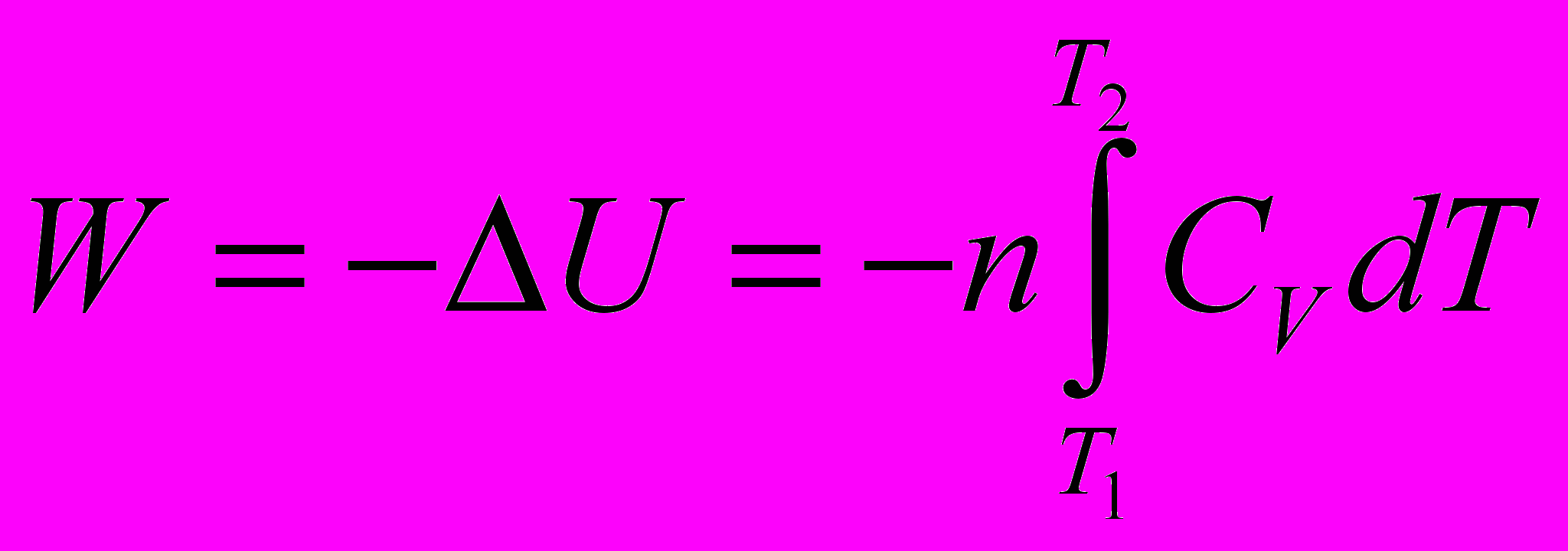
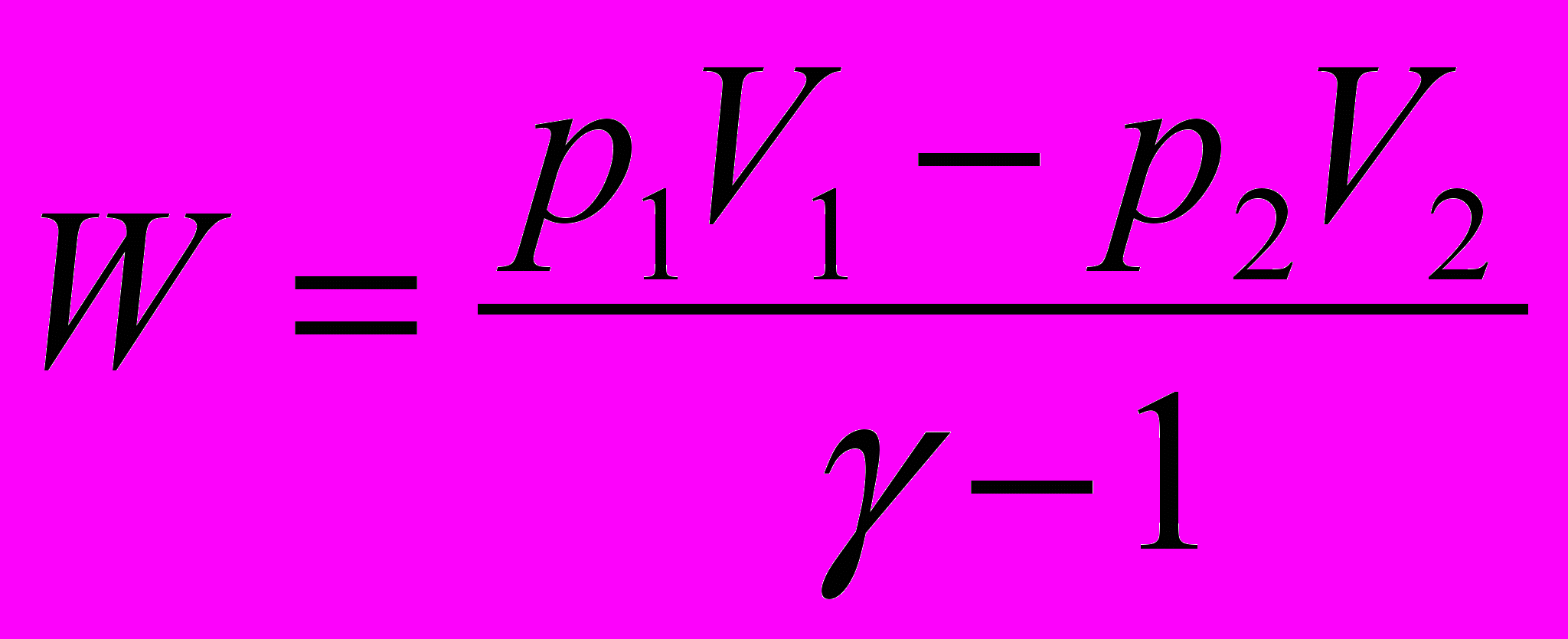 где
где 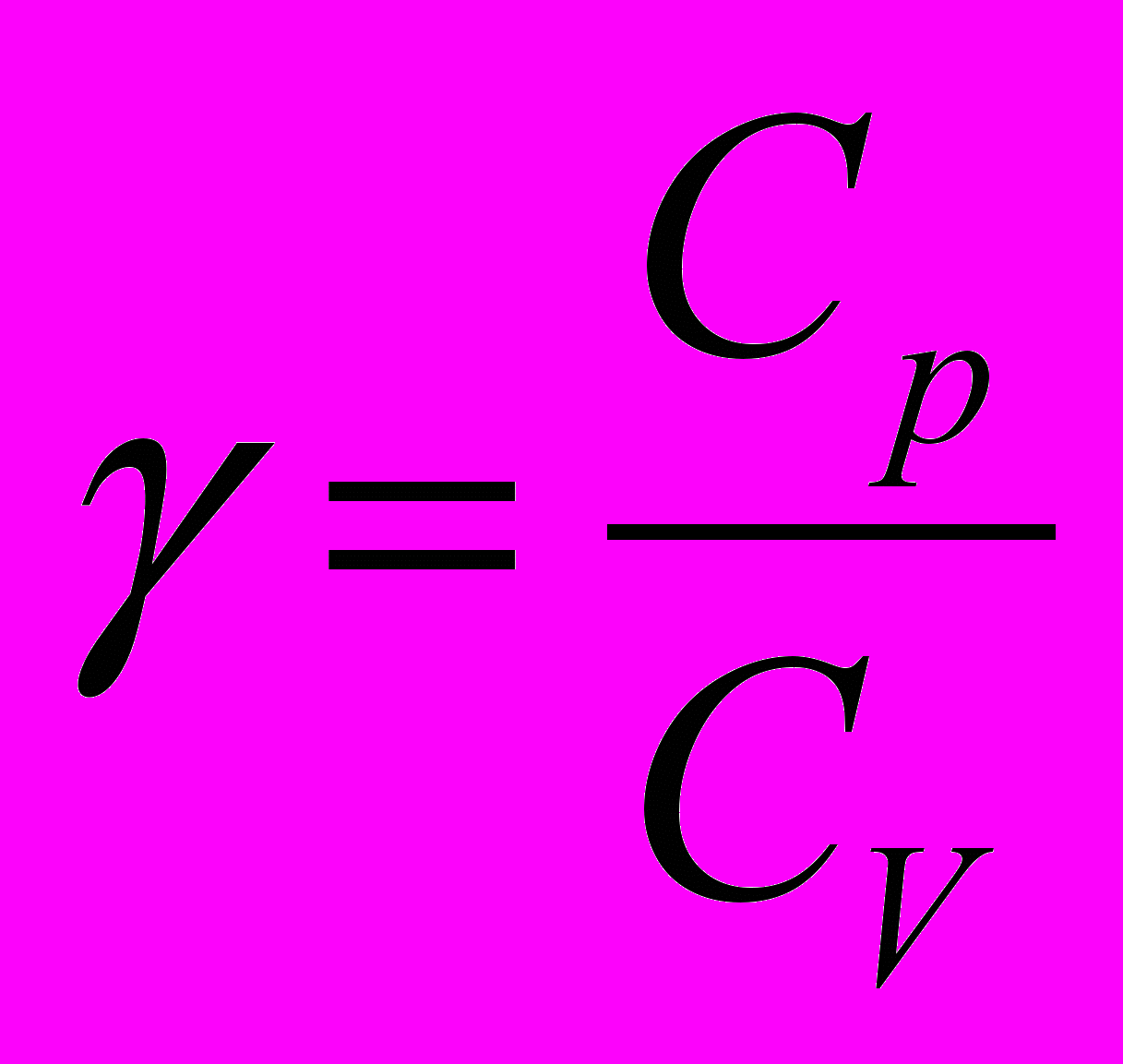
Отступление. О теплоемкости.
Теплоемкость системы – количество теплоты необходимое для нагревания данной массы вещества на 1 К
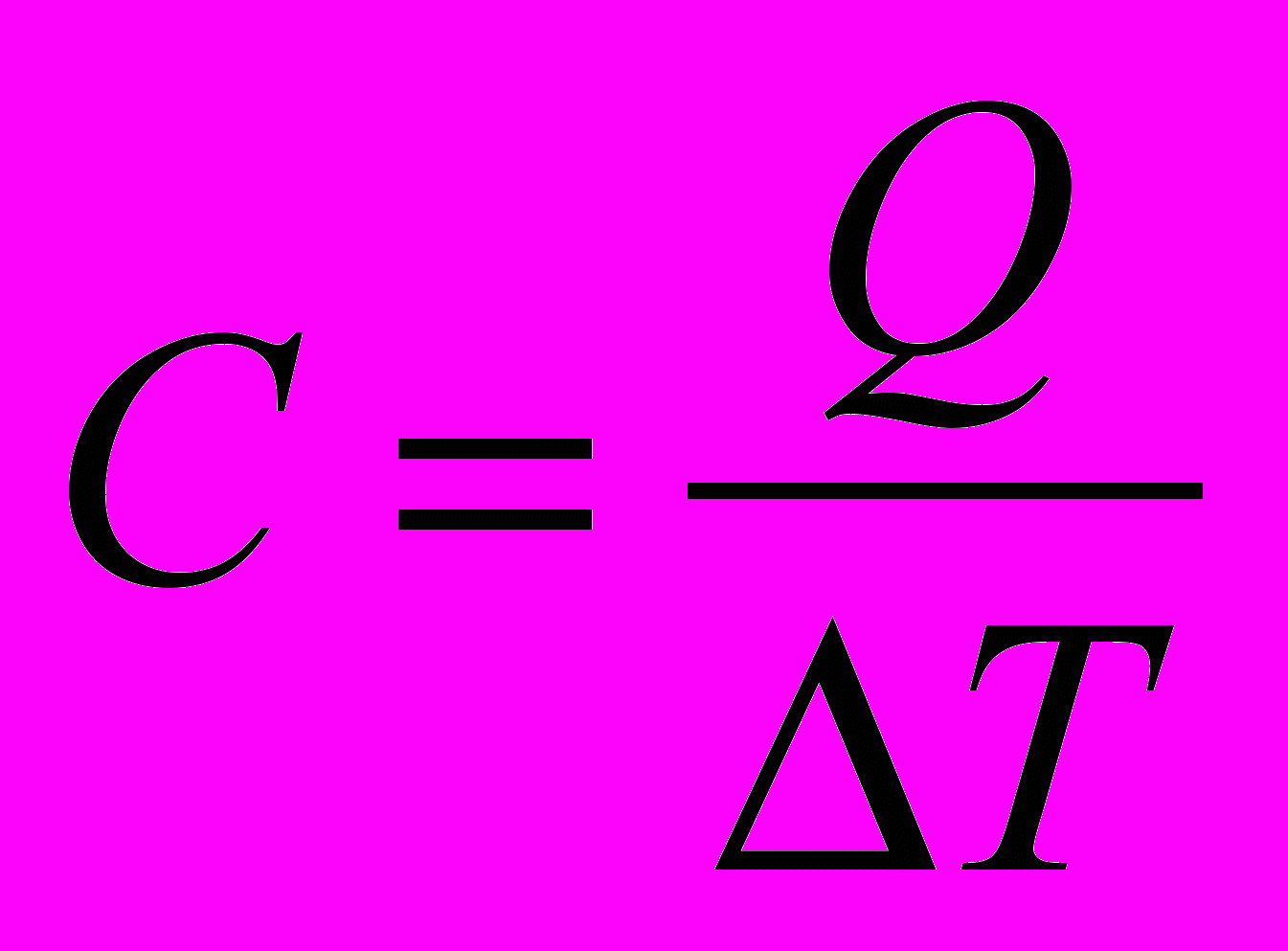
Различают:
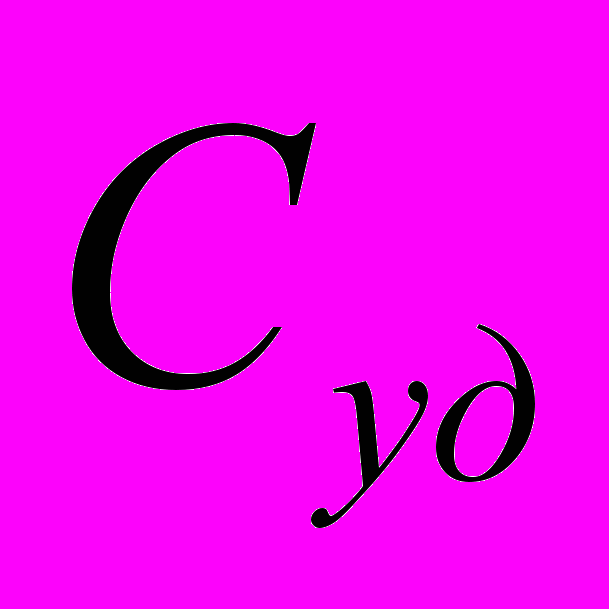 - удельная теплоемкость – теплоемкость кг или г вещества
- удельная теплоемкость – теплоемкость кг или г вещества - мольная – теплоемкость моля вещества
- мольная – теплоемкость моля вещества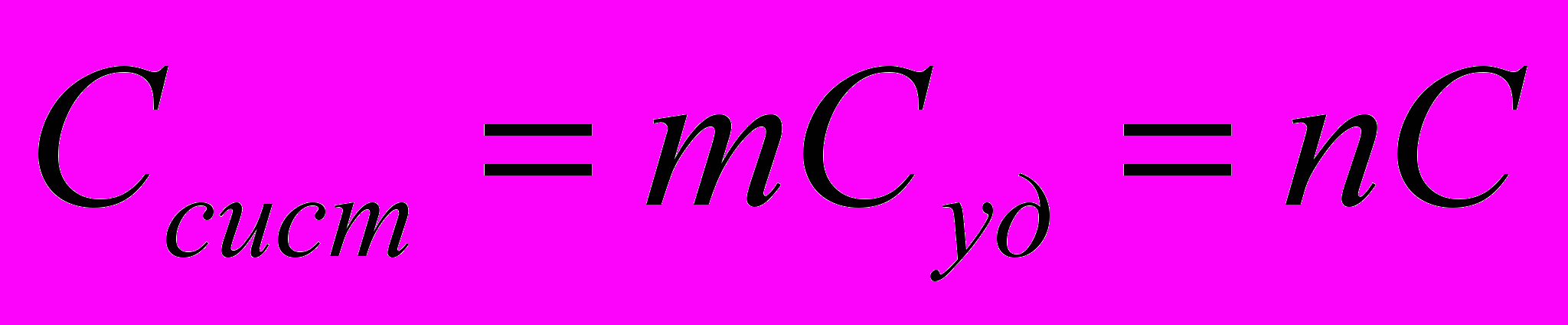
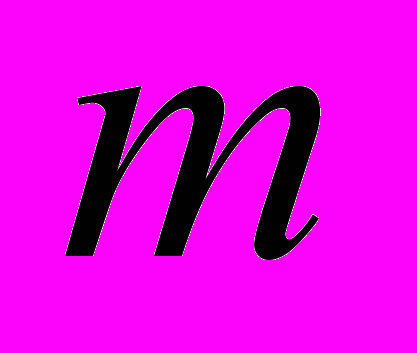 - масса
- масса 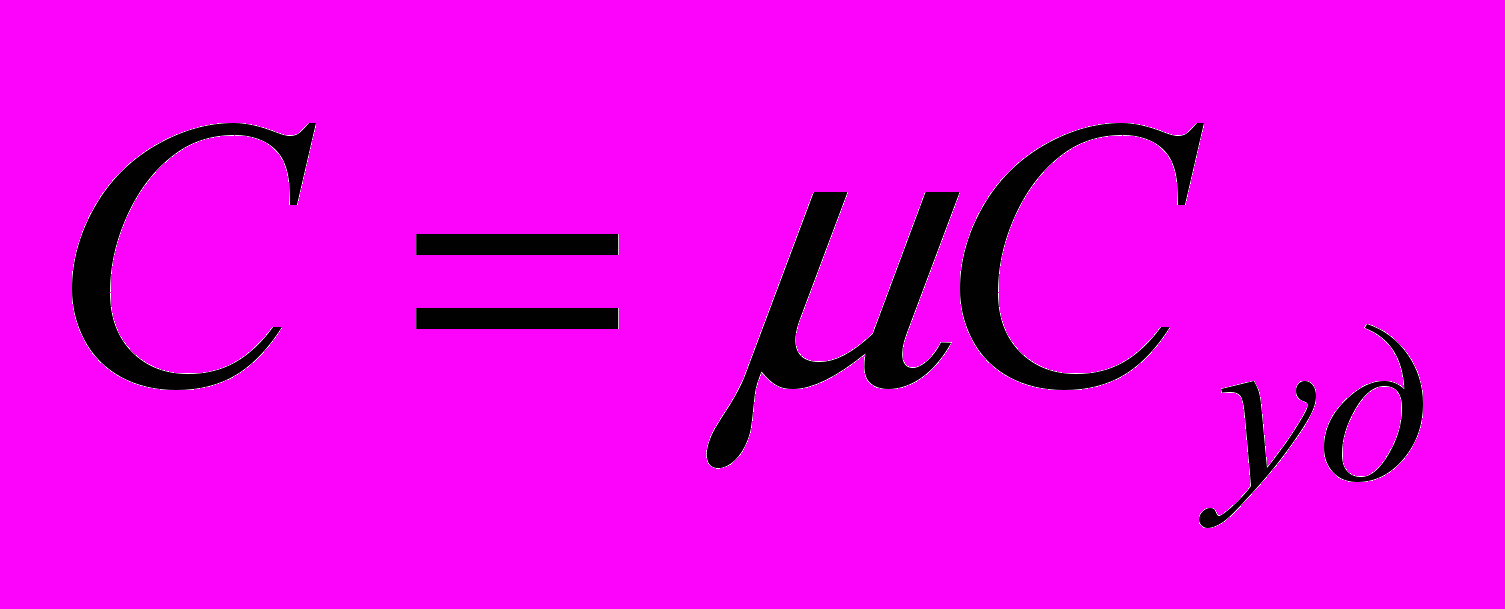
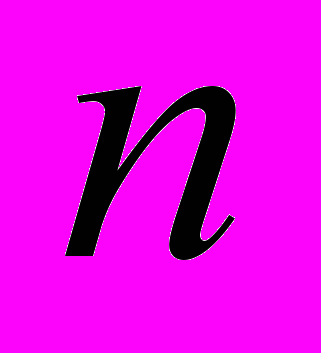 - число молей
- число молей  - молекулярная масса
- молекулярная массаИстинной мольной теплоемкостью называют отношение бесконечно малого количества теплоты, которое нужно сообщить 1 молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается
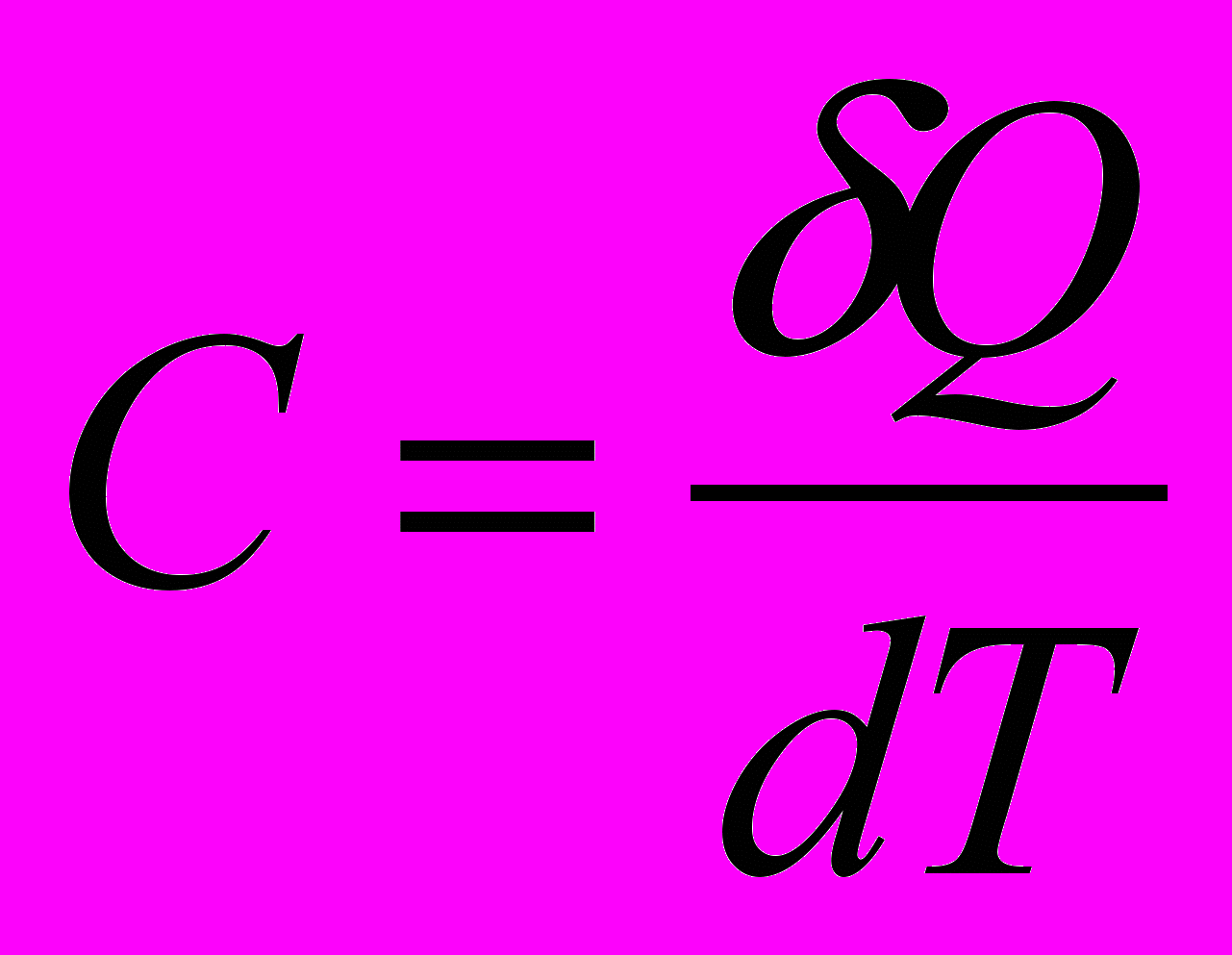
Средней мольной теплоемкостью
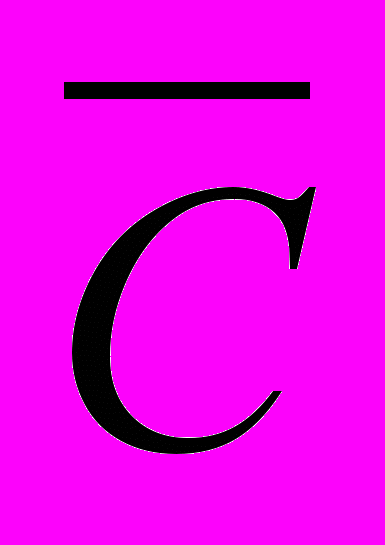 в интервале температур от
в интервале температур от 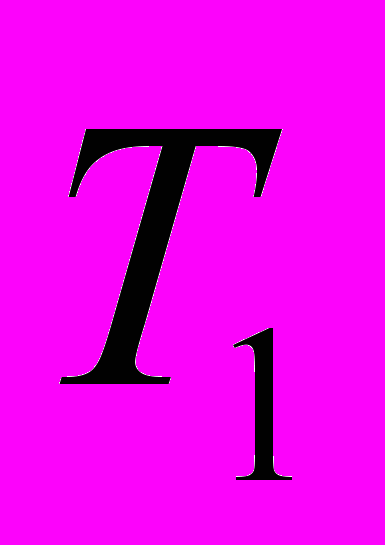 до
до 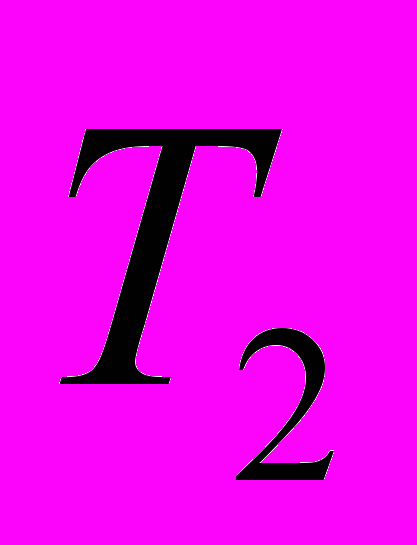 называют отношение конечного количества теплоты, сообщенного 1 молю вещества, к разности температур
называют отношение конечного количества теплоты, сообщенного 1 молю вещества, к разности температур 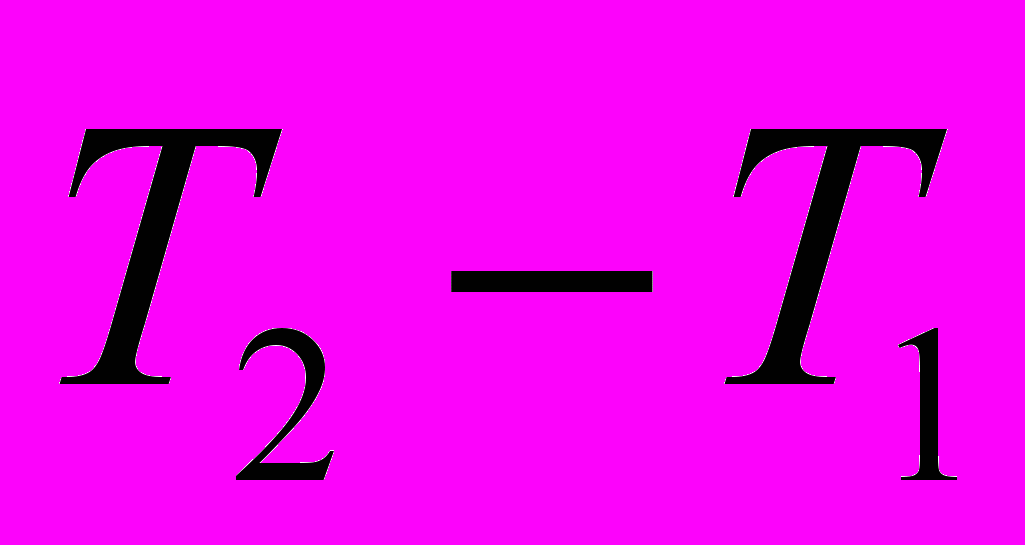
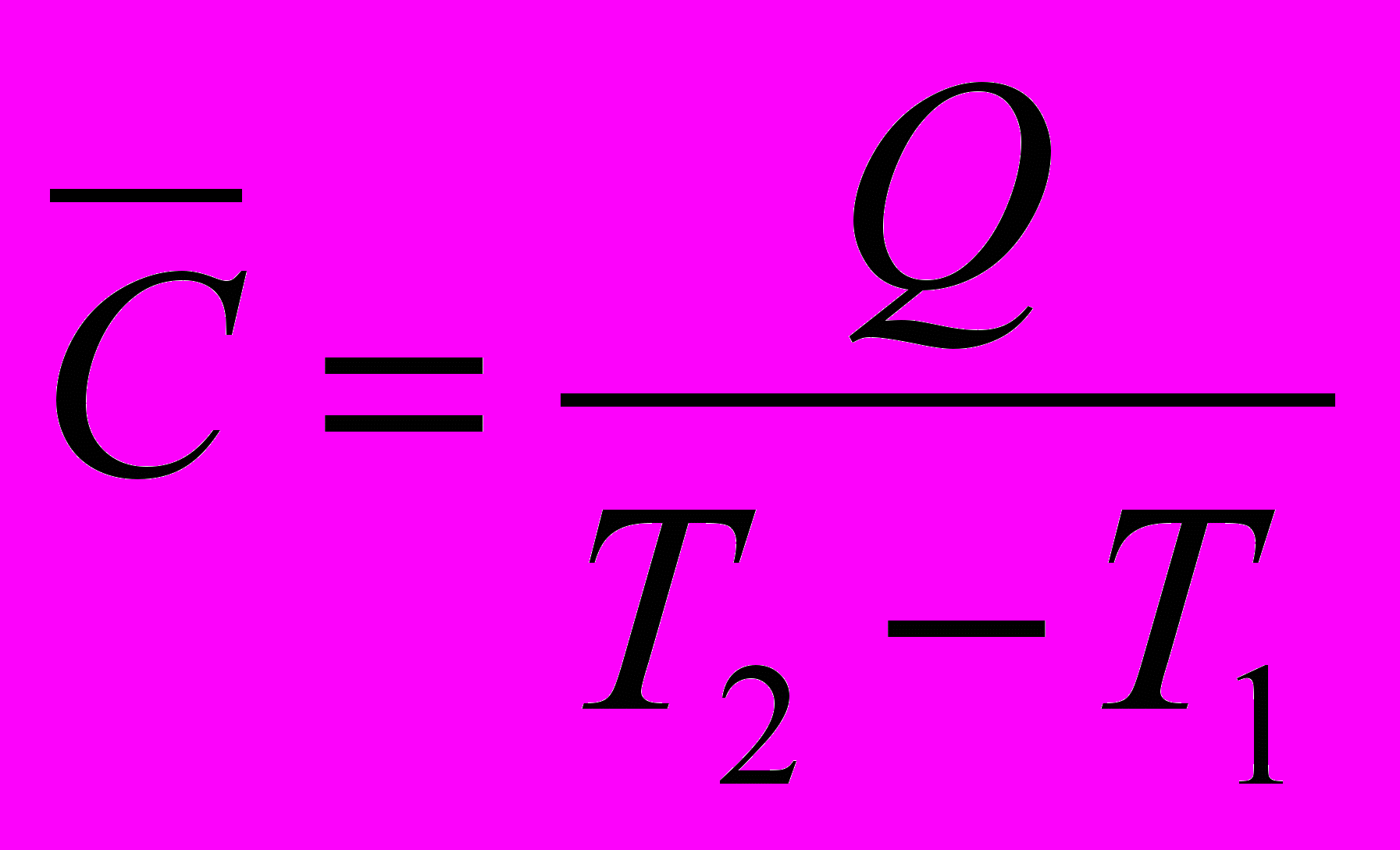
Связь средней и истинной теплоемкости
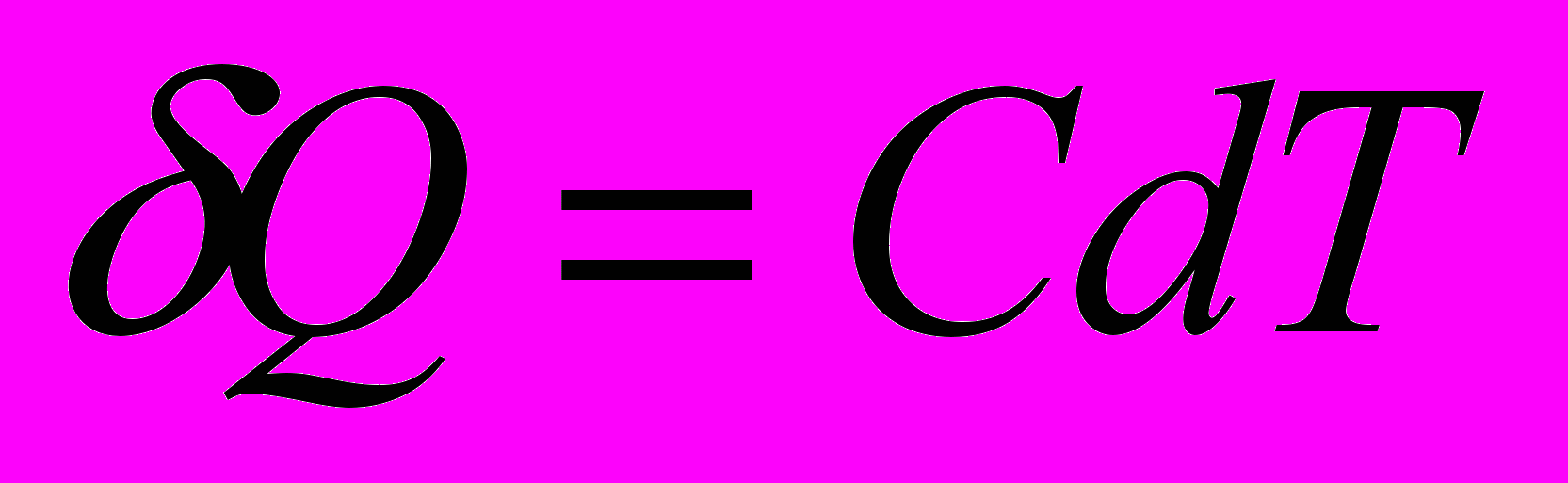
с другой стороны
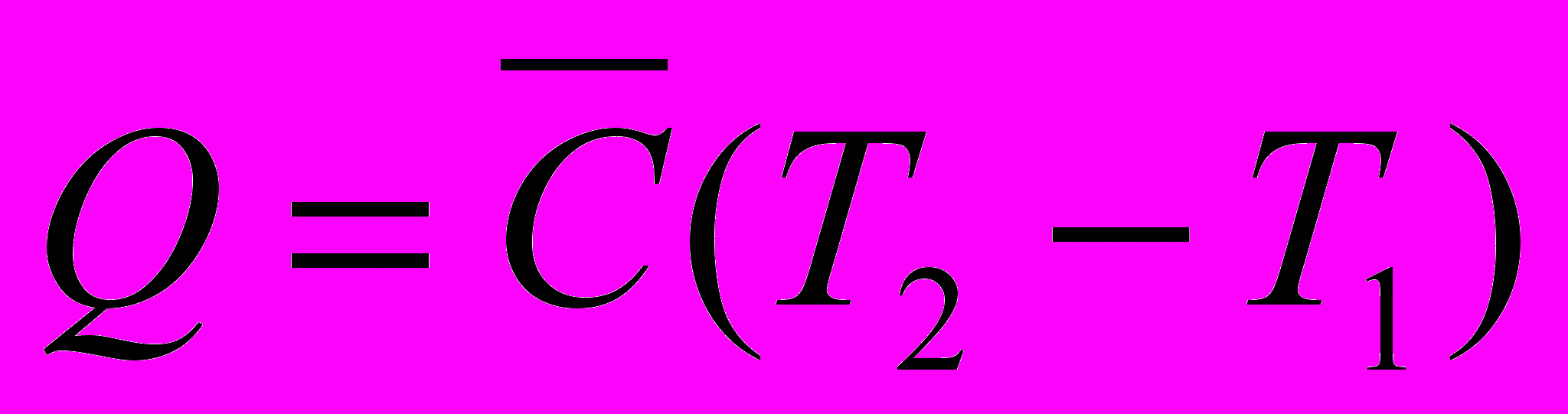
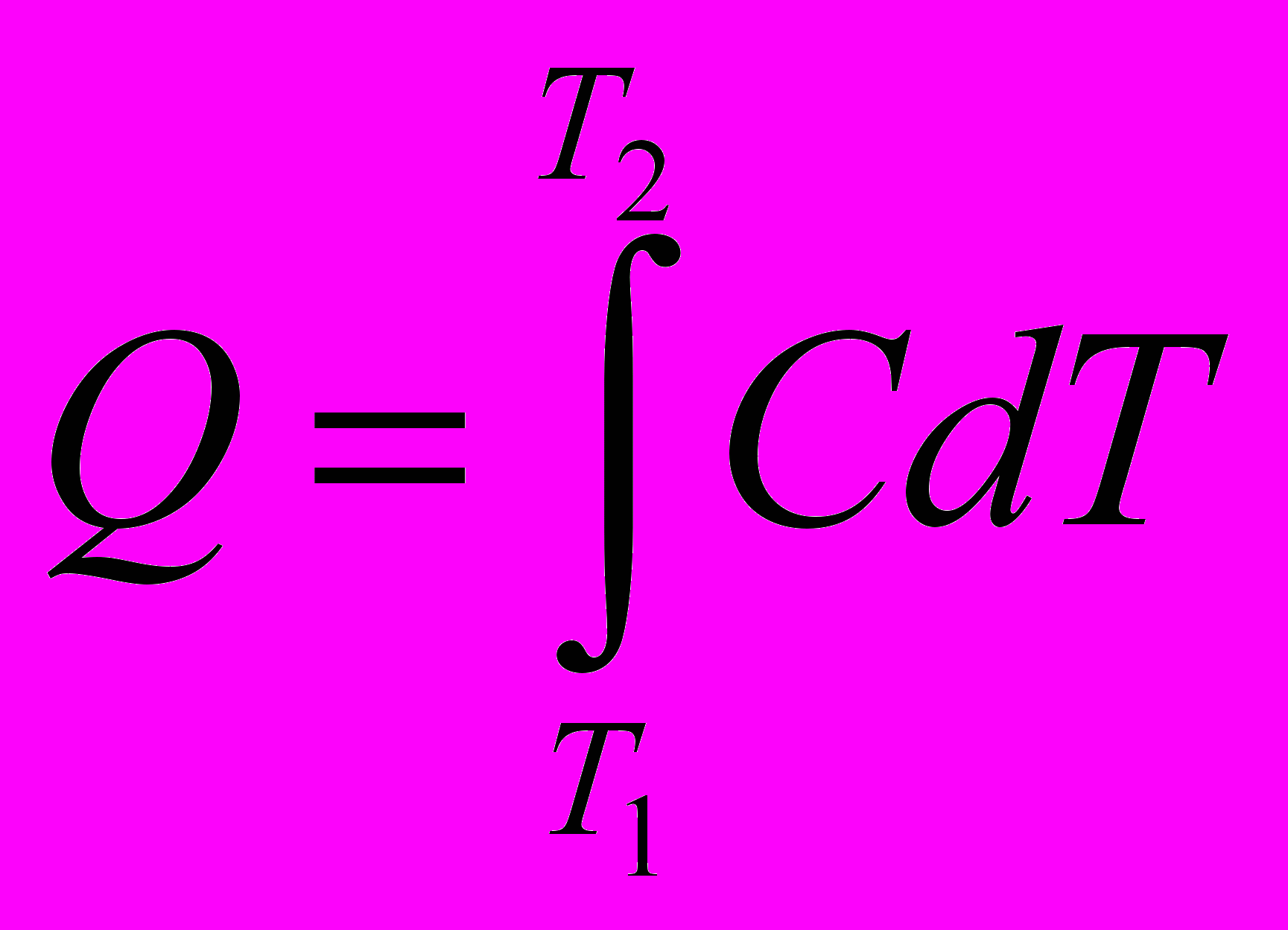
Количество тепла, необходимое для нагревания тела будет одним и тем же
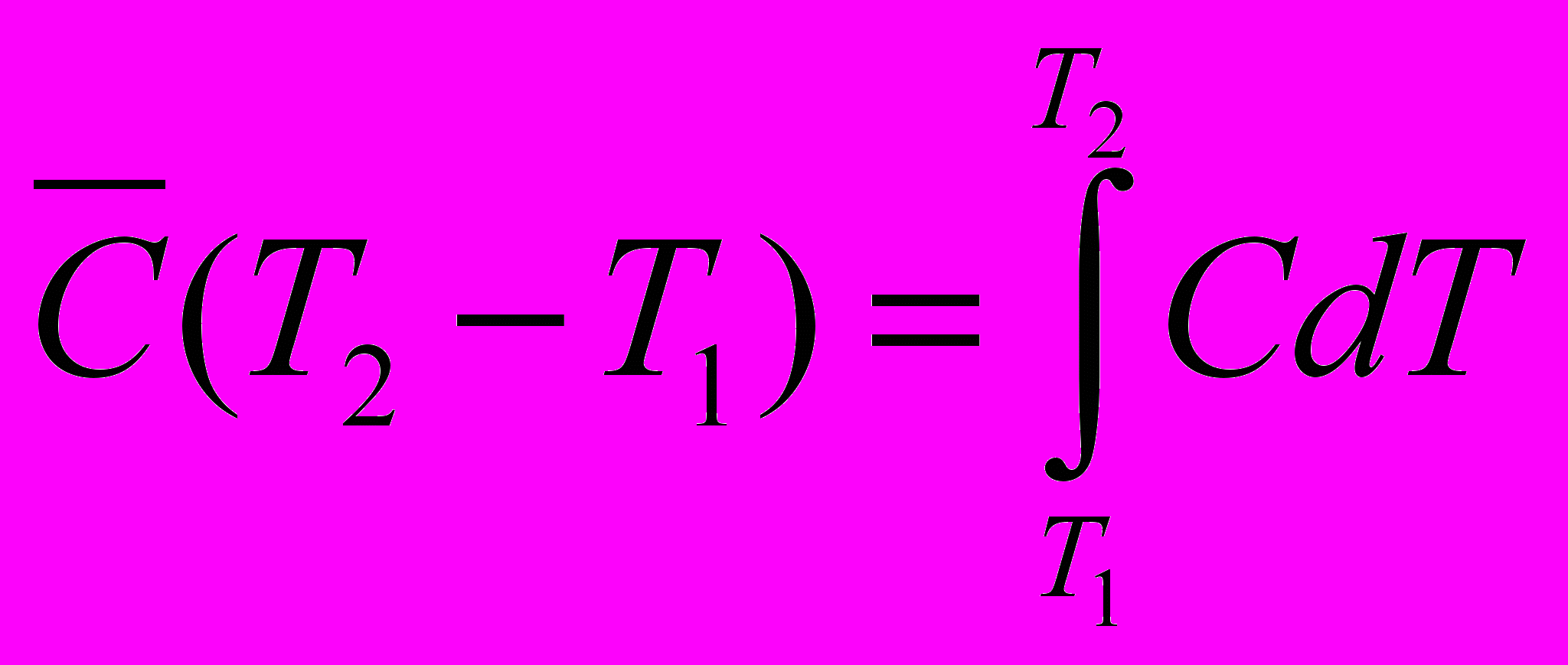
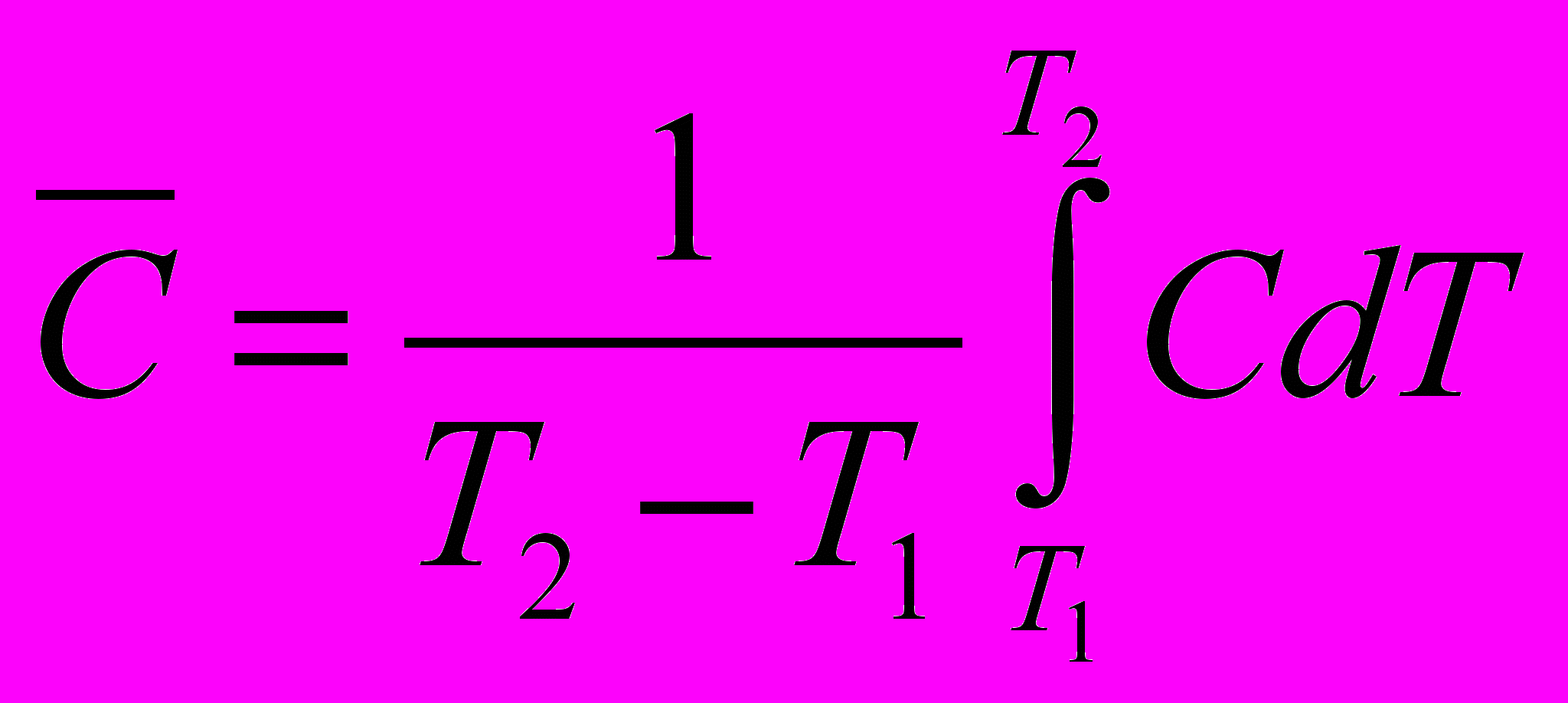
Примеры расчетов.
Пример 1
2 г воздуха изобарно нагревают от
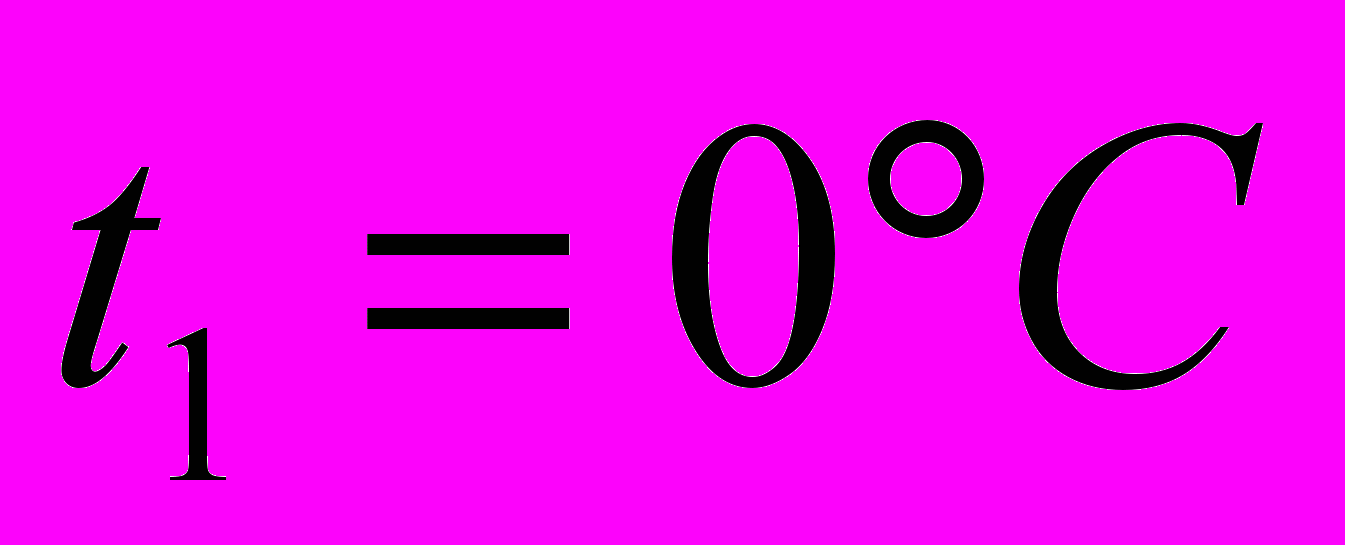 до
до 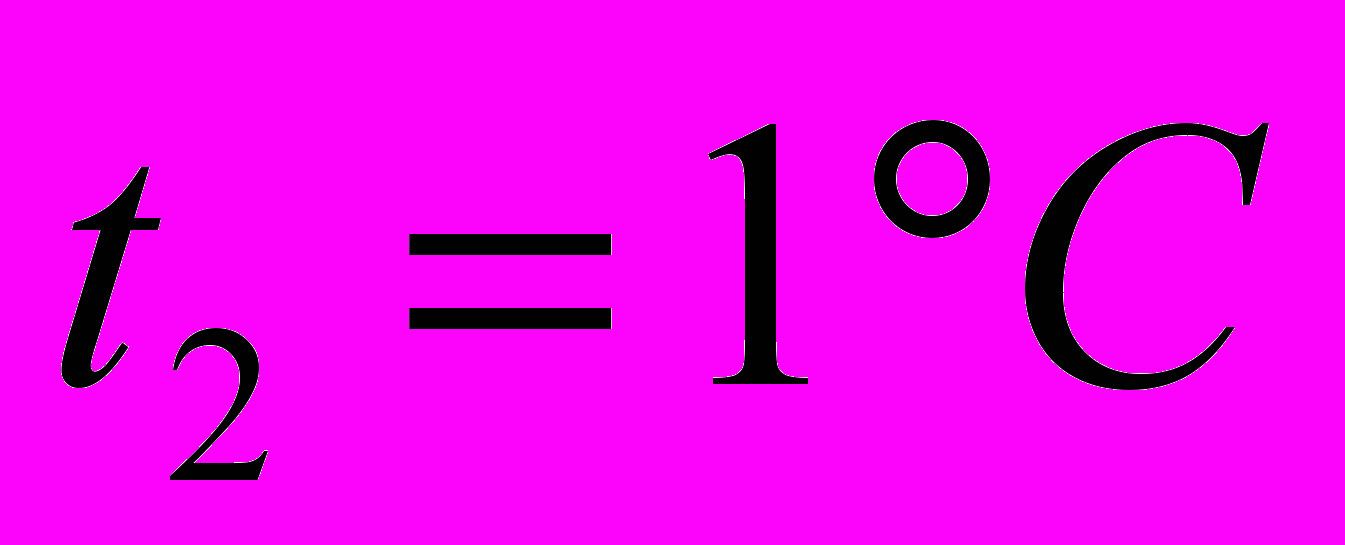 при давлении
при давлении 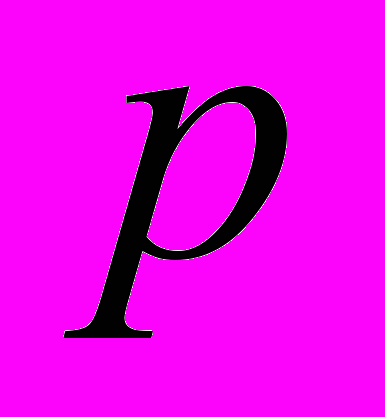 = 1 атм. Плотность воздуха при
= 1 атм. Плотность воздуха при 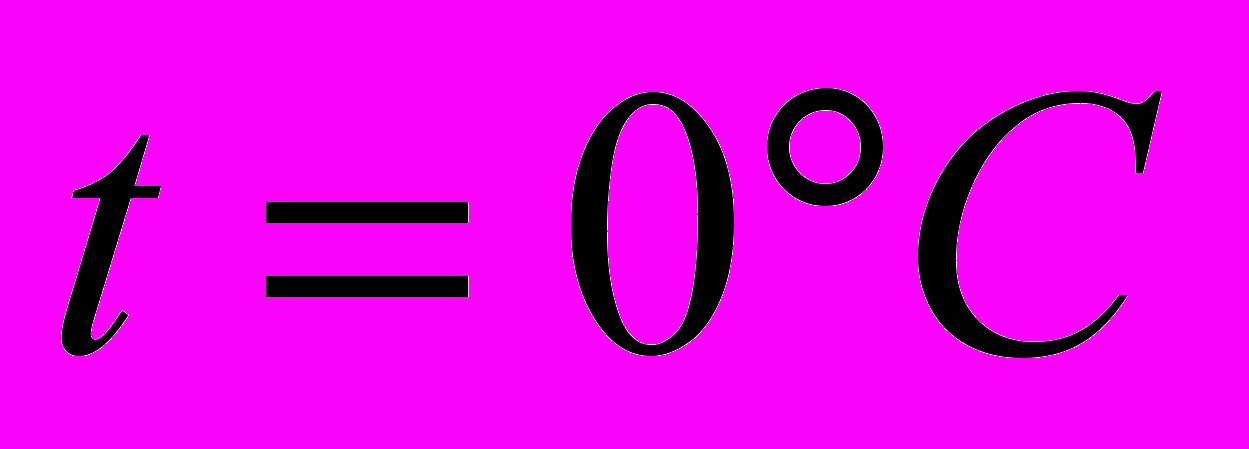 составляет
составляет 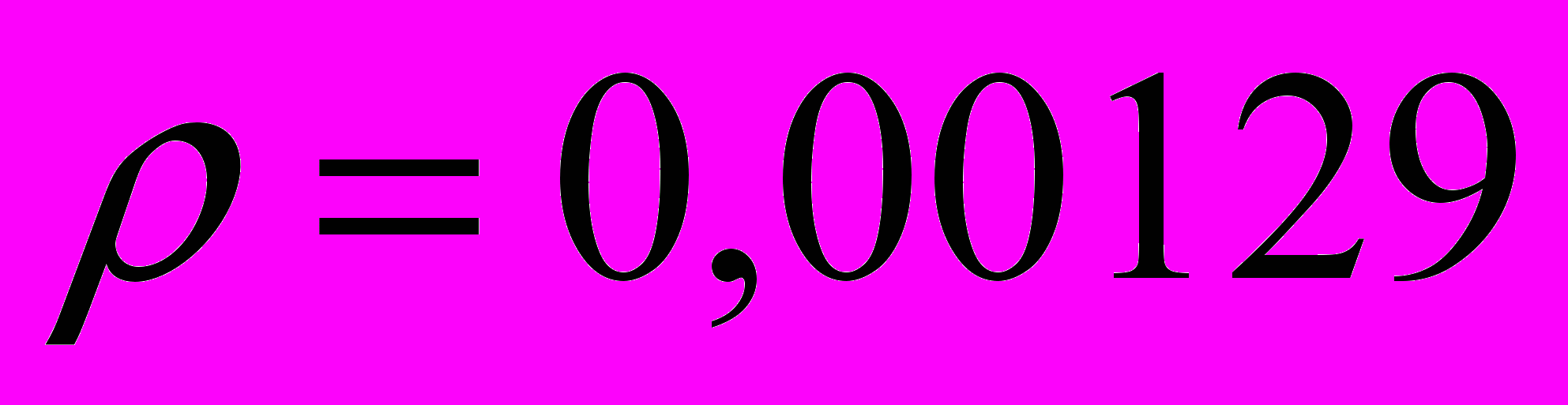 г/см3. Найдите работу расширения.
г/см3. Найдите работу расширения. 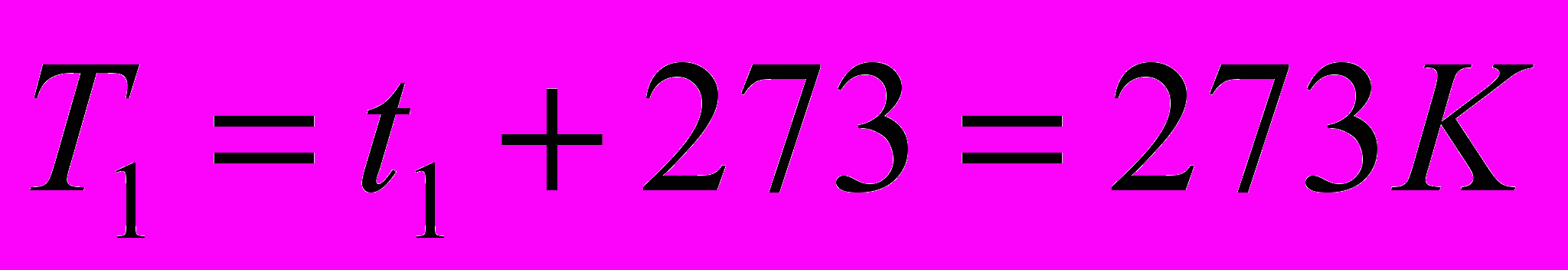  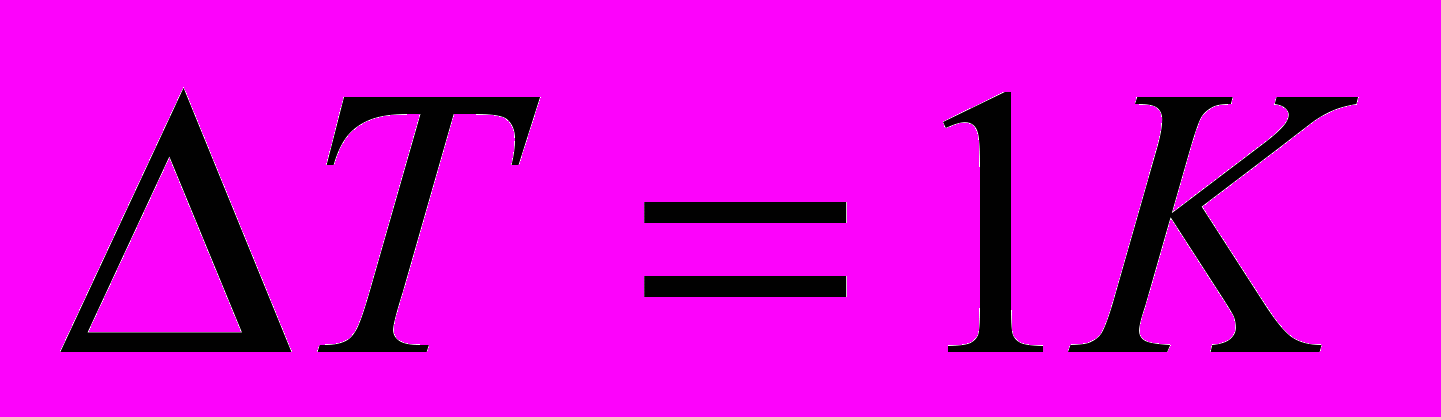 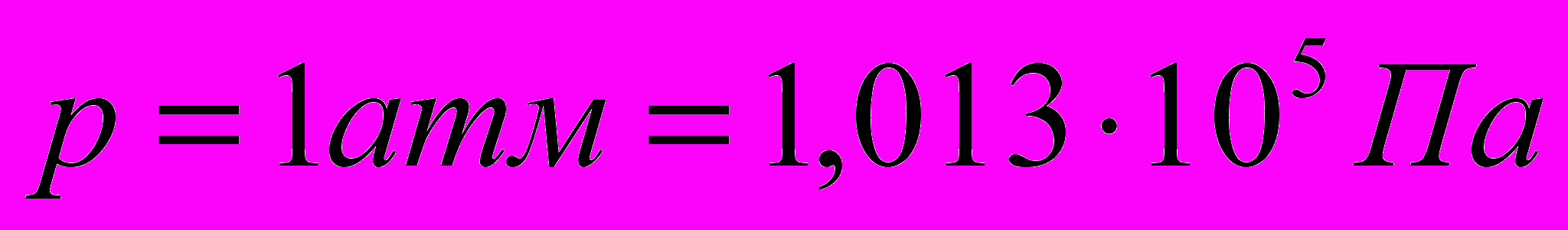 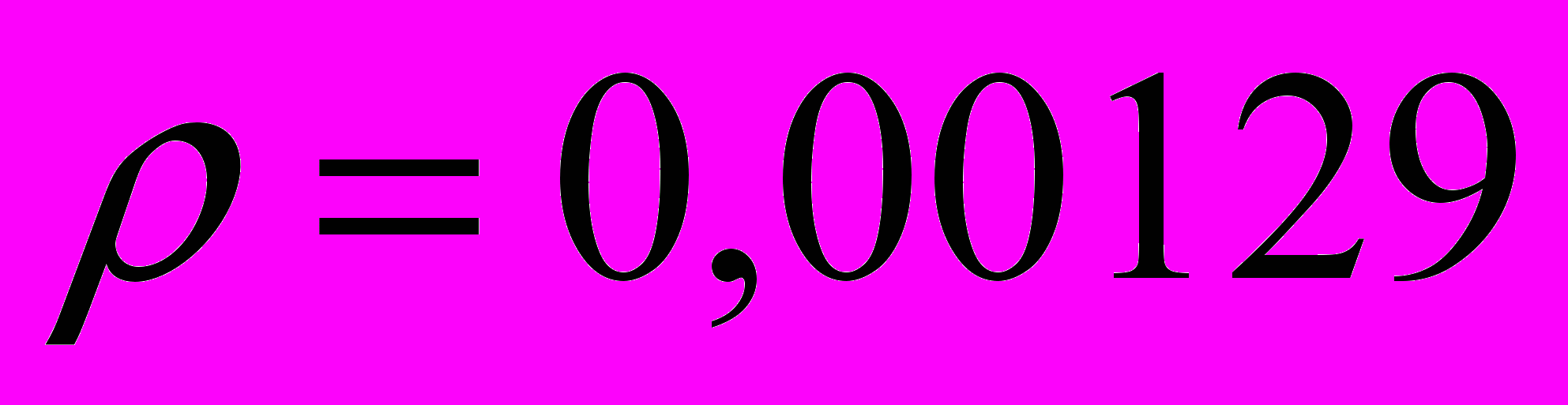 г/см3 = г/см3 = 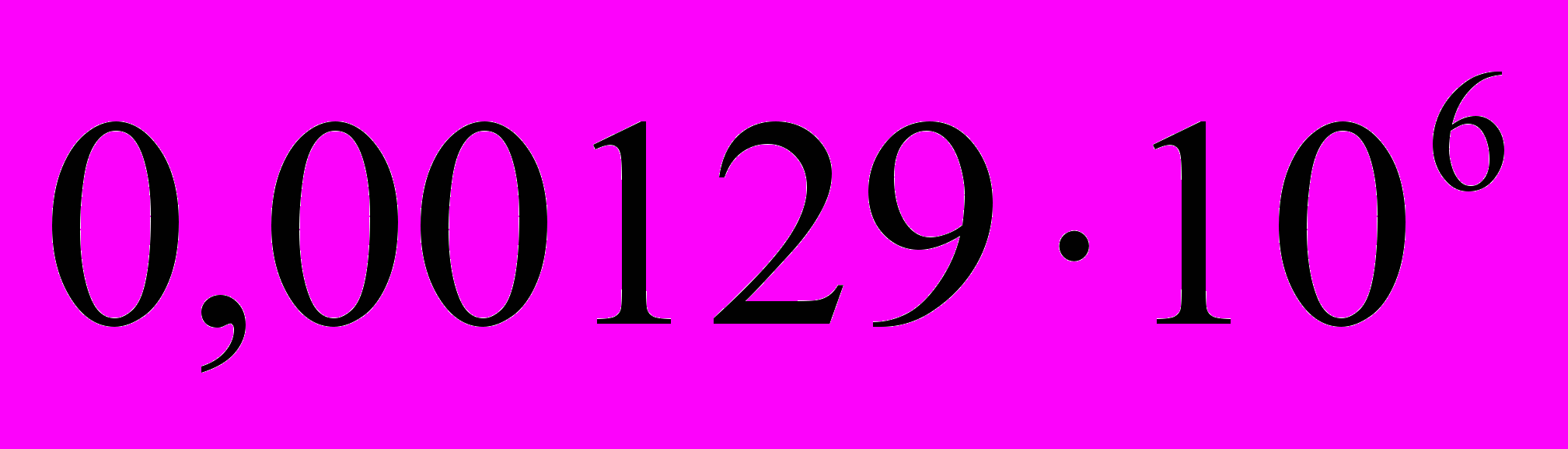 г/м3 г/м3 | 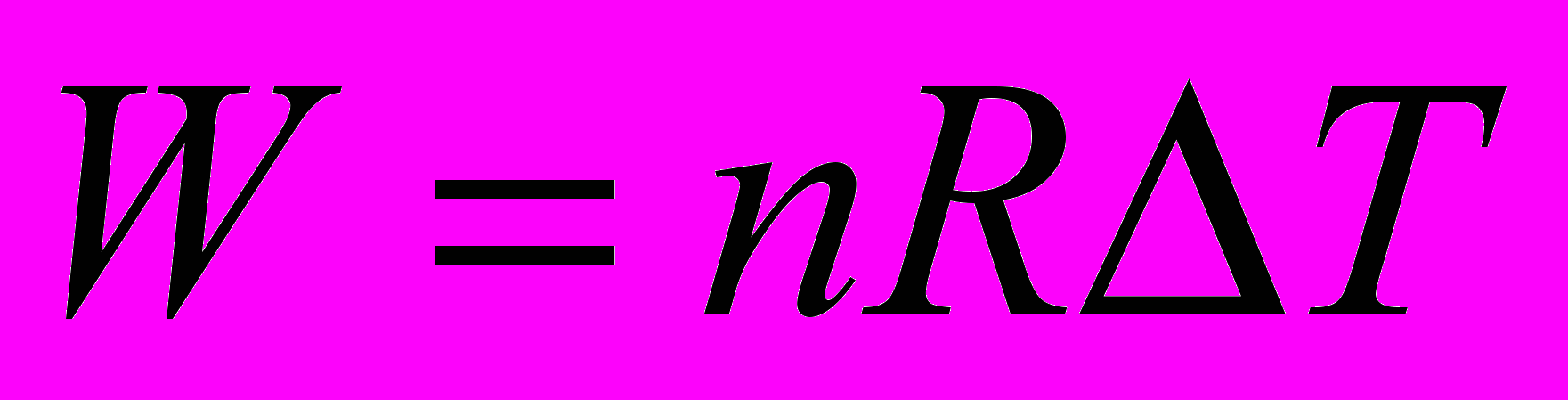 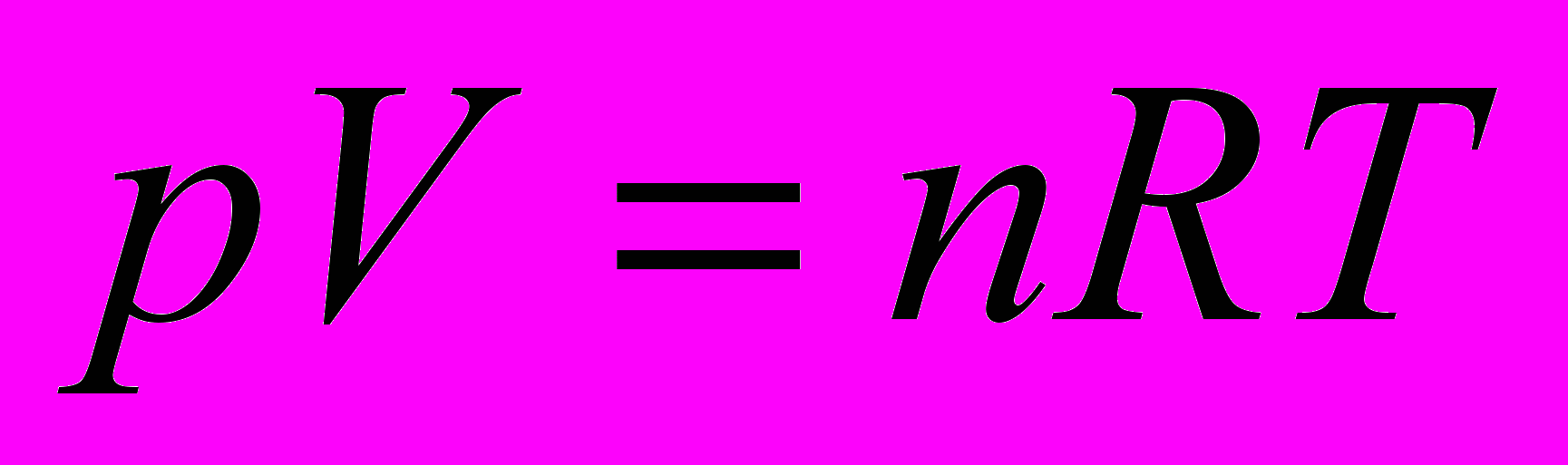 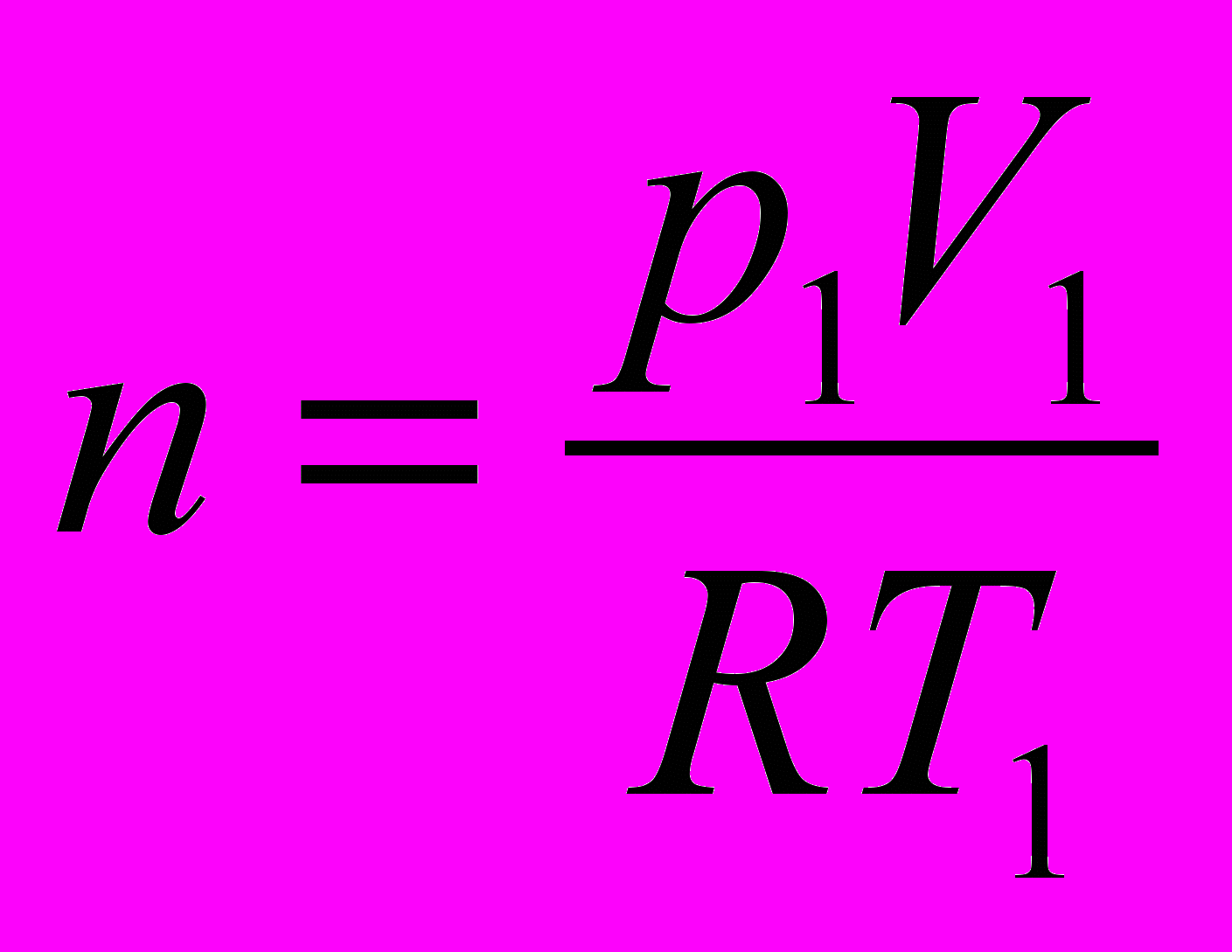 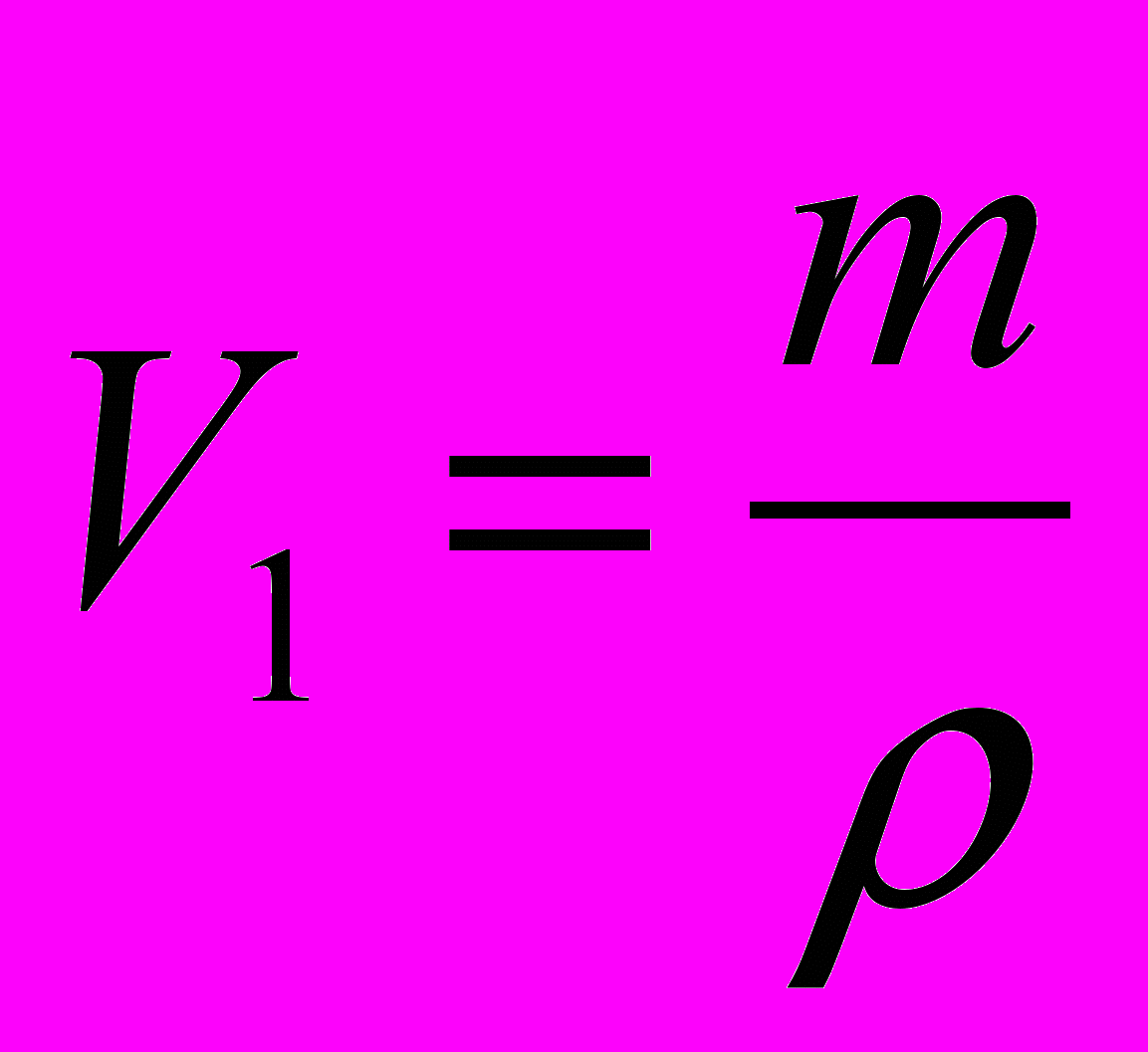 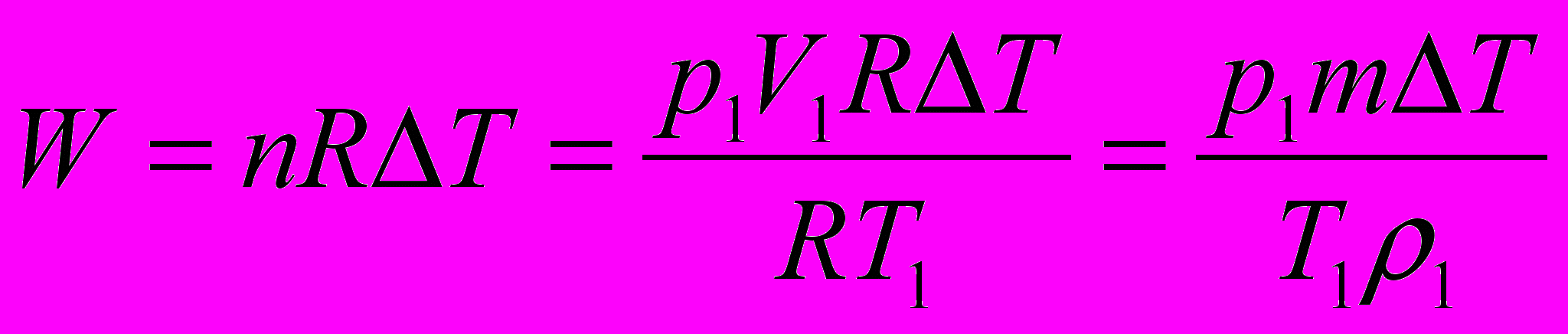 = 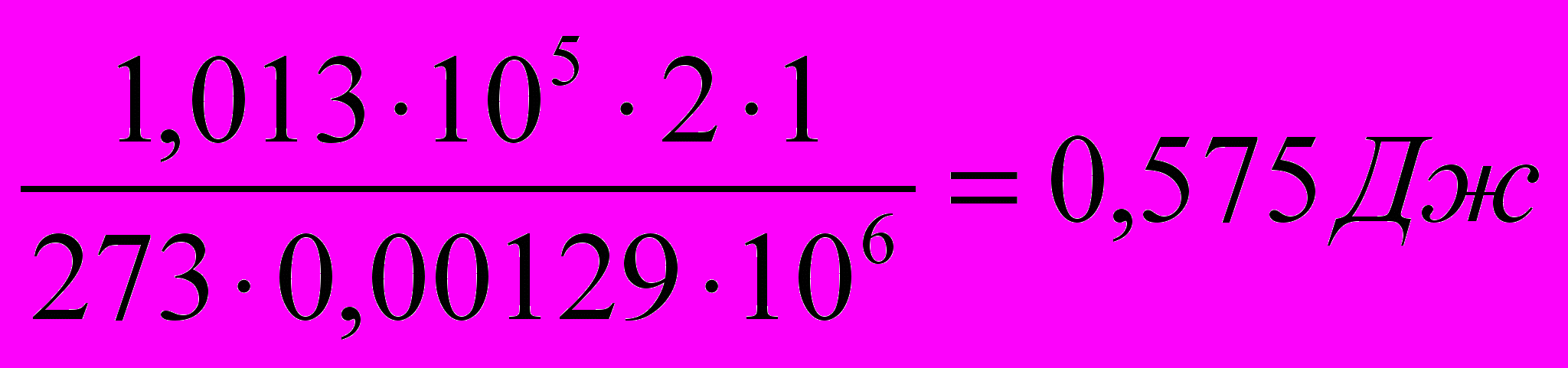 |
Пример 2
Истинная мольная теплоемкость оксида кальция выражается уравнением:
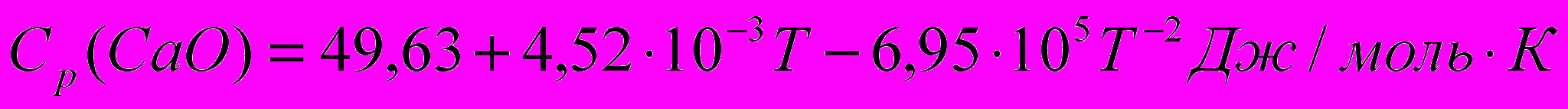
Определить количество тепла, необходимого для нагревания 10 кг СаО от 0 до 900°С
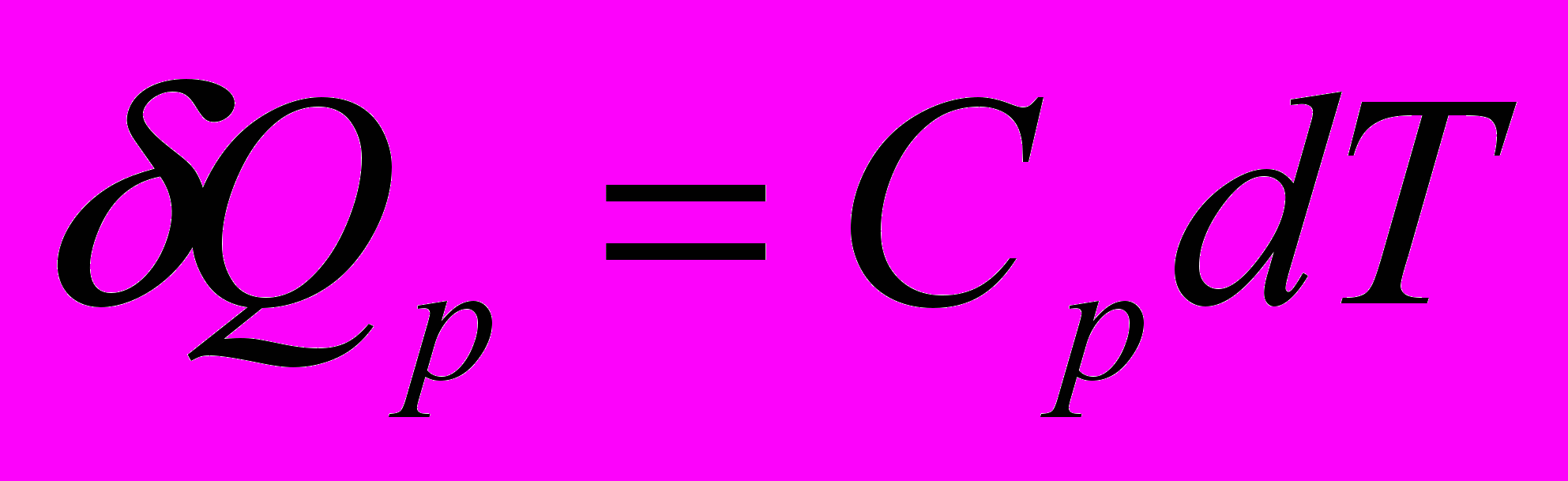
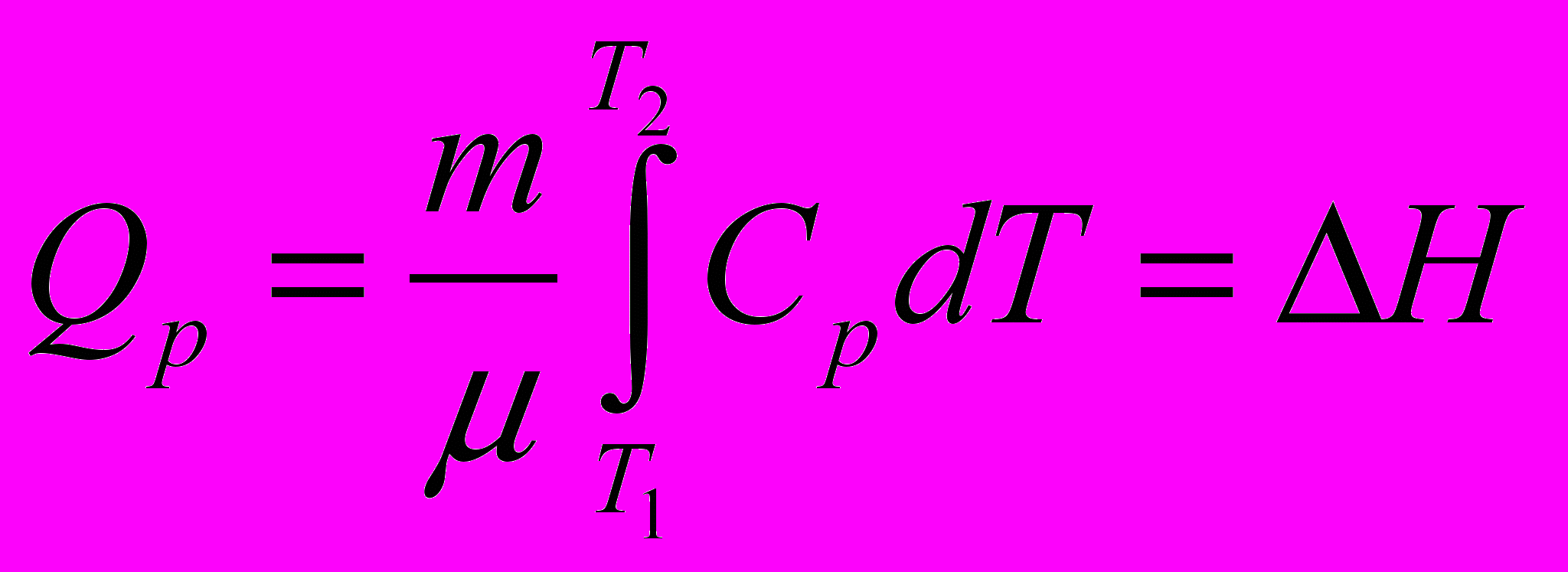
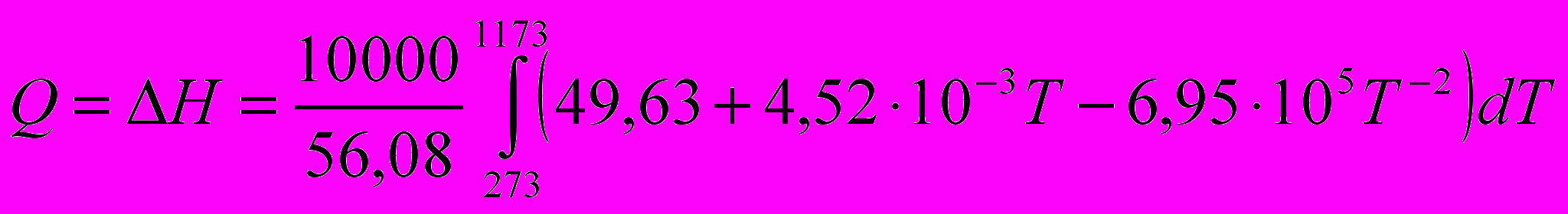 =
=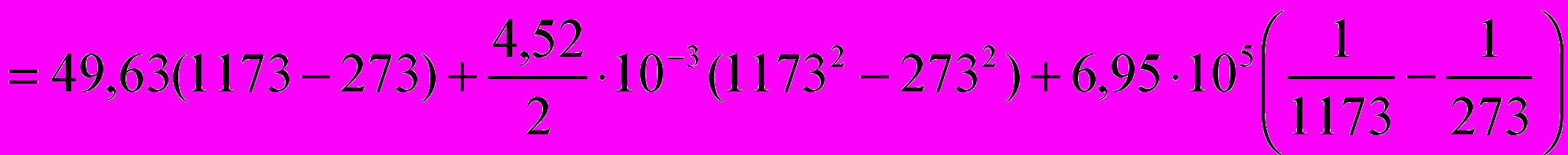
=
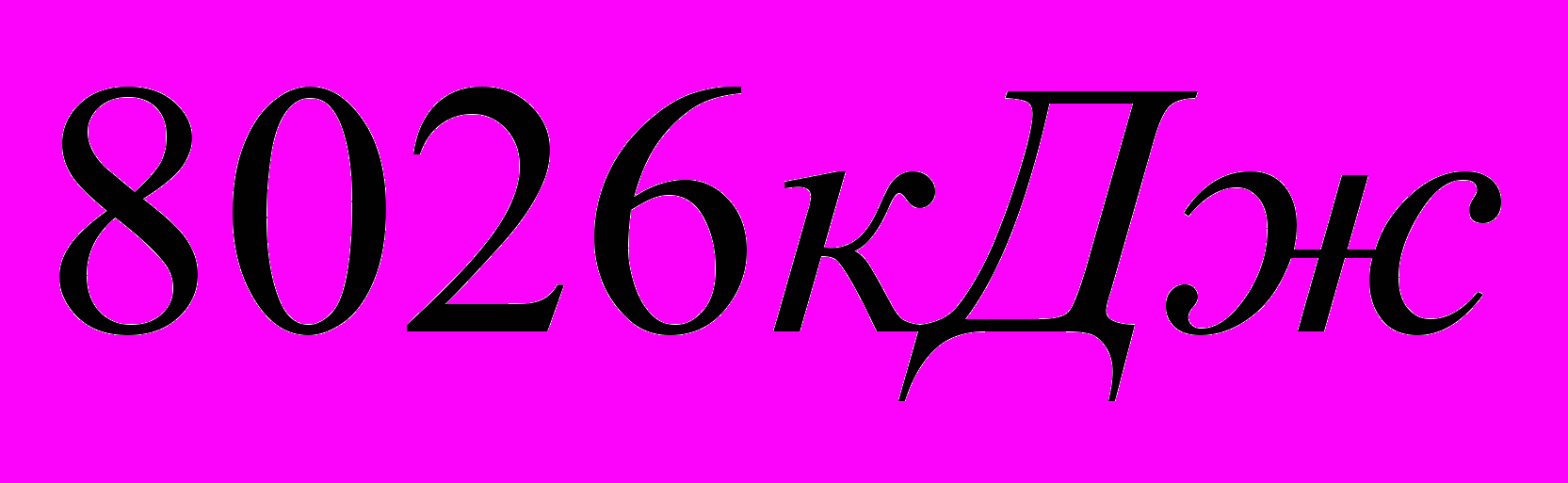
Комментарии
При расчетах необходимо учитывать, что:
- Все уравнения термодинамики относятся к 1 молю вещества.
- Температура – только по шкале Кельвина.
Выводы:
Рассмотрены:
- формулировка и математическая запись (в интегральной и дифференциальной формах) I закона термодинамики;
- интерпретация закона применительно к различным процессам в идеальном газе.
- получен ряд новых соотношений, вытекающих из I закона
- связь теплоемкостей
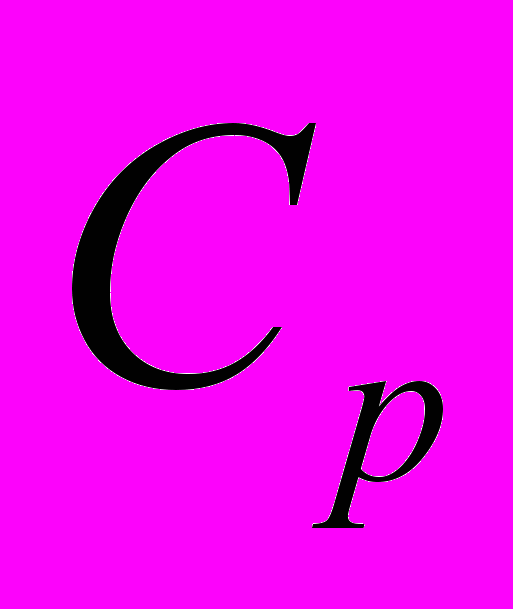 и
и 
- зависимость энтальпии индивидуального вещества от температуры
- связь теплоемкостей
Лекция №3
Термохимия
Обсуждаемые вопросы.
- Основные определения и комментарии к ним;
- Теоретическое обоснование закона Гесса
- Методы расчета теплот химических реакций
- Энтальпия образования
- Таблицы стандартных термодинамических величин
- Примеры расчетов
| Выводы |
- Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается при полном протекании реакции. При этом температуры исходных веществ и продуктов реакции должны быть одинаковы
- Системы обозначений
Термохимическая
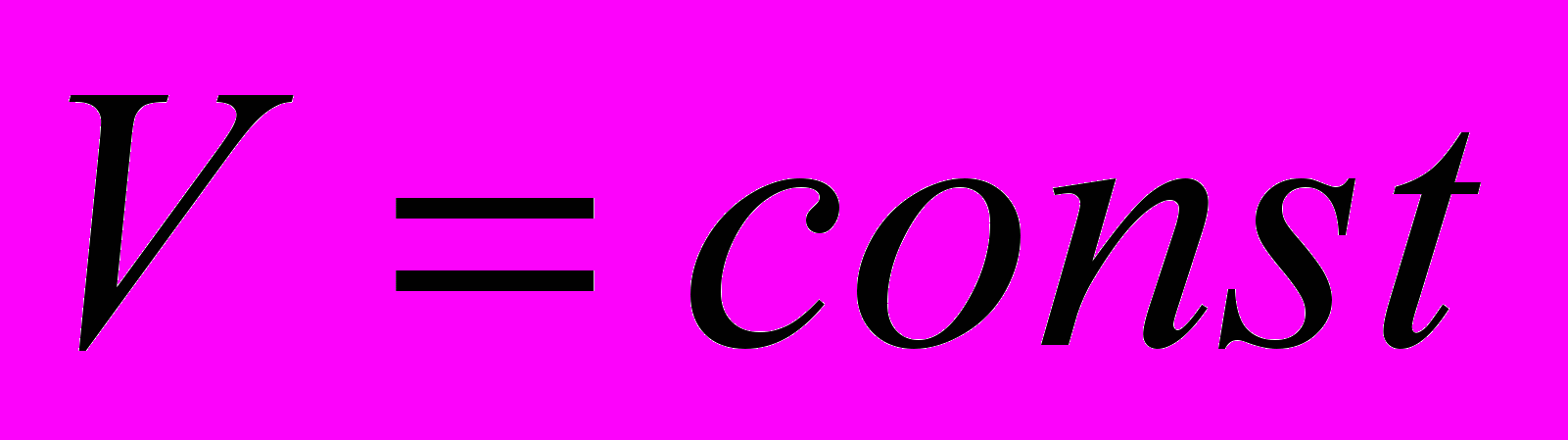
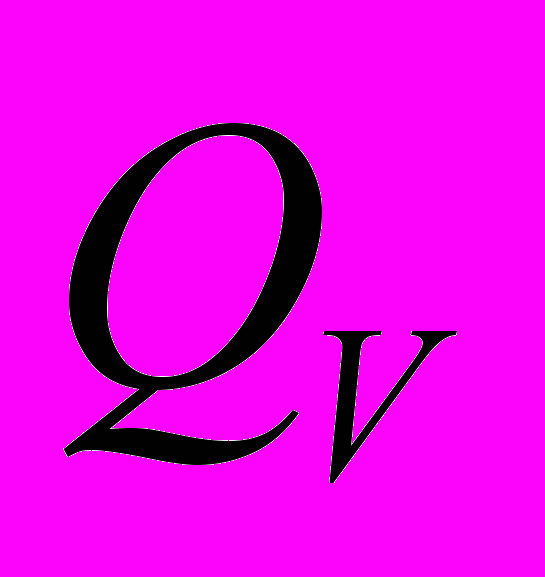 (закрытый сосуд)
(закрытый сосуд)
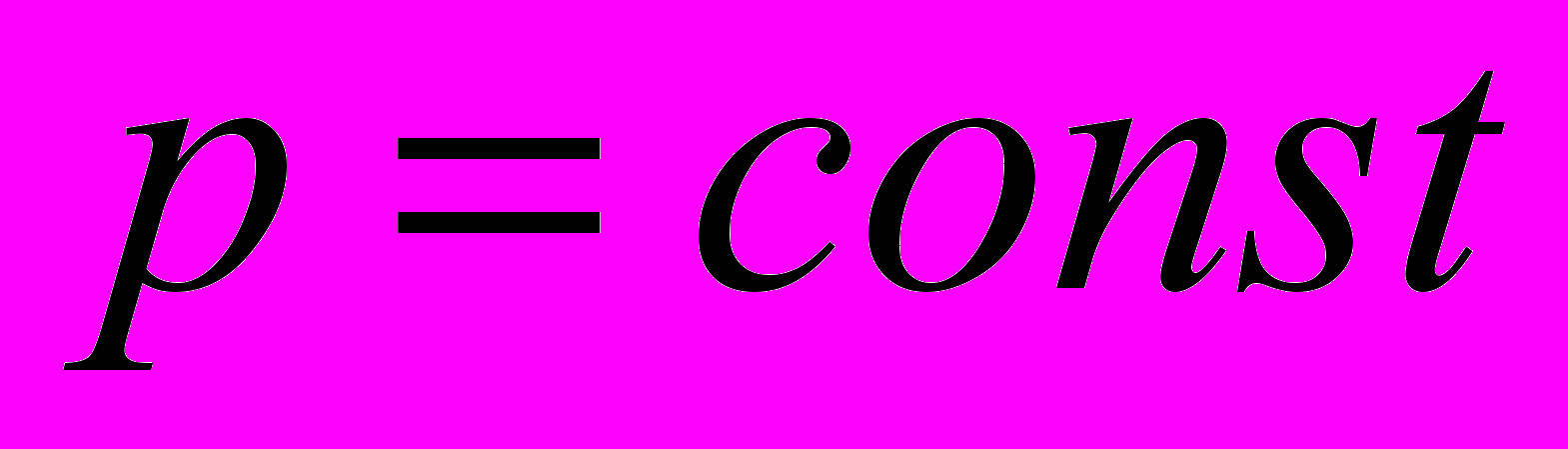
 (открытый сосуд)
(открытый сосуд)
Термодинамическая
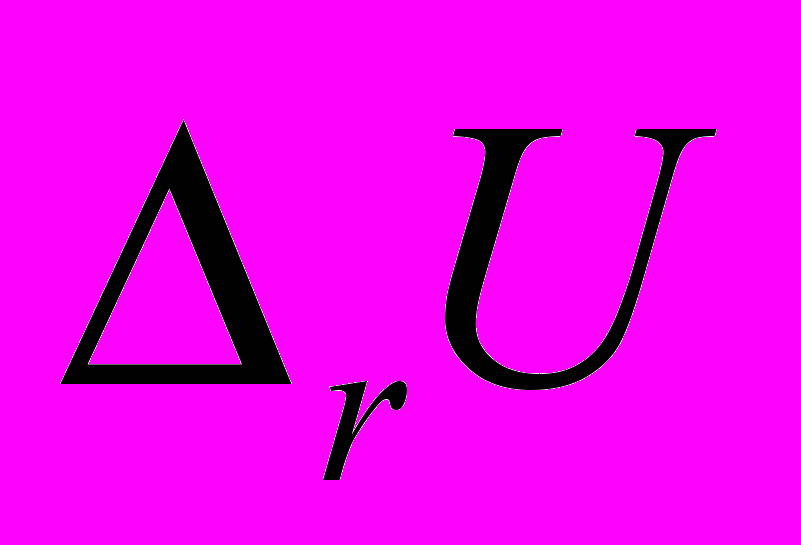 ;
; 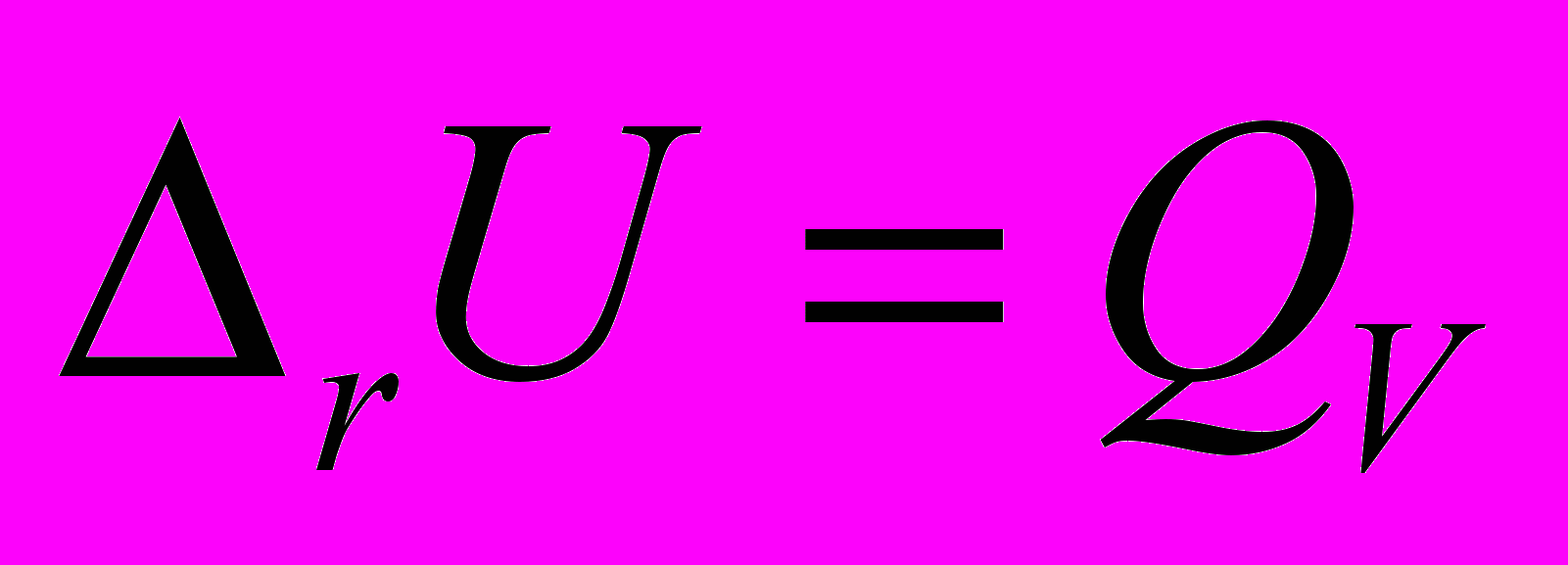
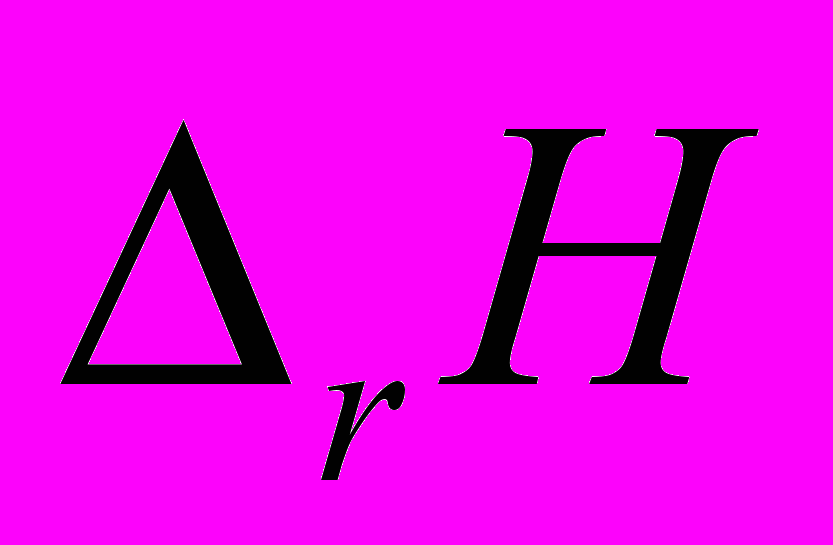 ;
; 
 - изменение энтальпии в ходе химической реакции. Кратко – энтальпия реакции.
- изменение энтальпии в ходе химической реакции. Кратко – энтальпия реакции. 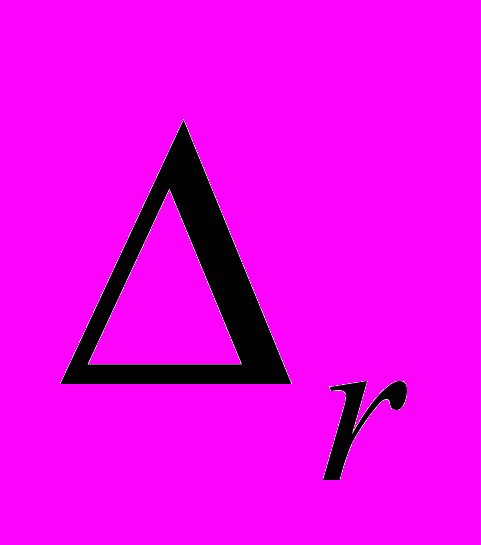 - оператор химической реакции
- оператор химической реакции
- Правило знаков.
Эндотермические реакции
(тепло поглощается)
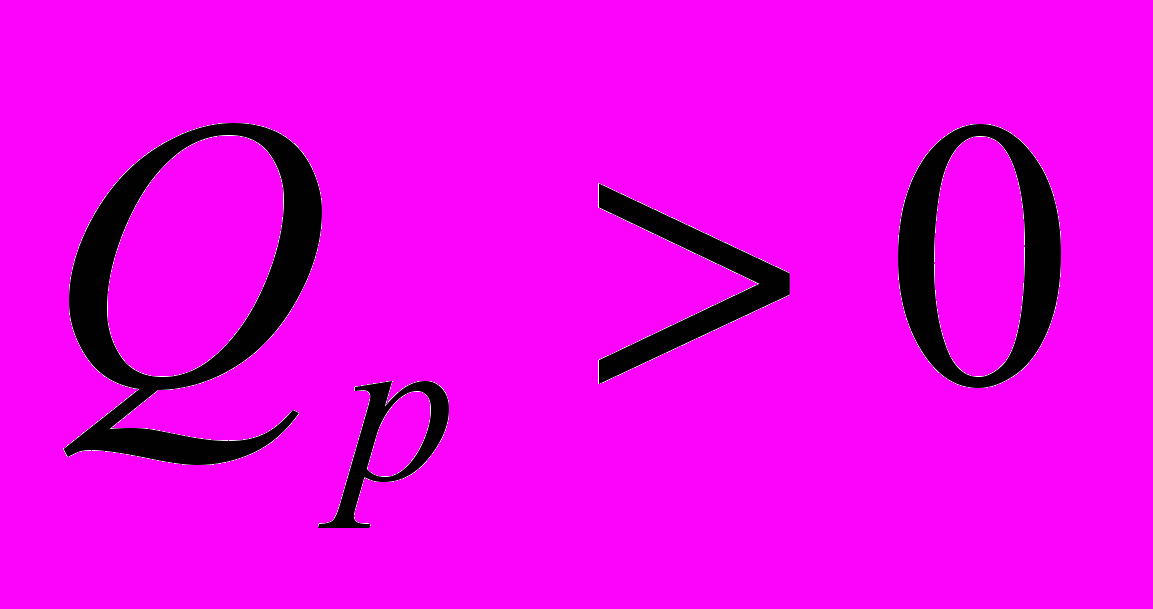
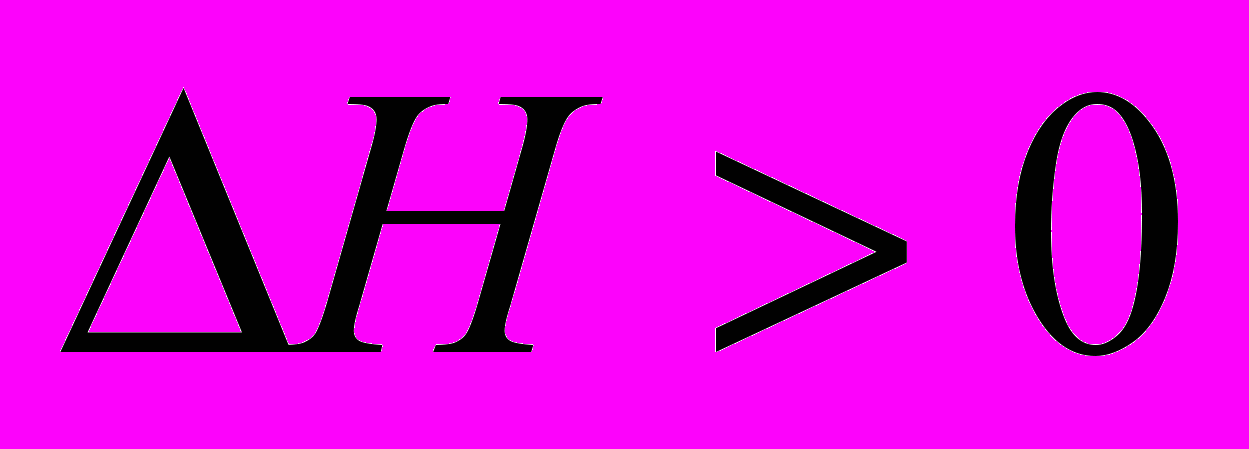
Экзотермические реакции
(тепло выделяется)
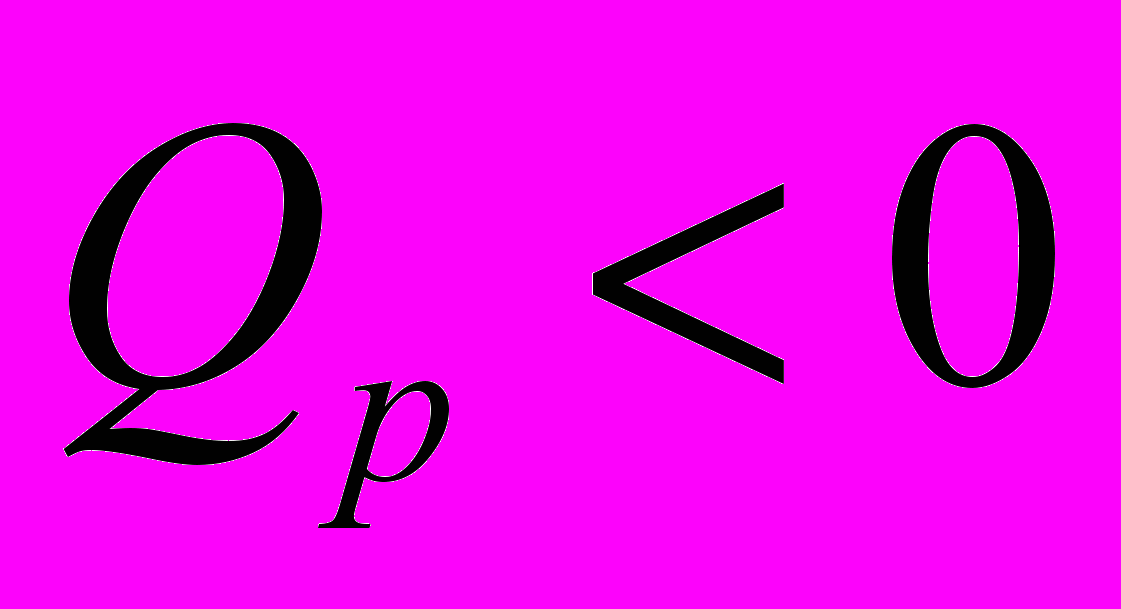
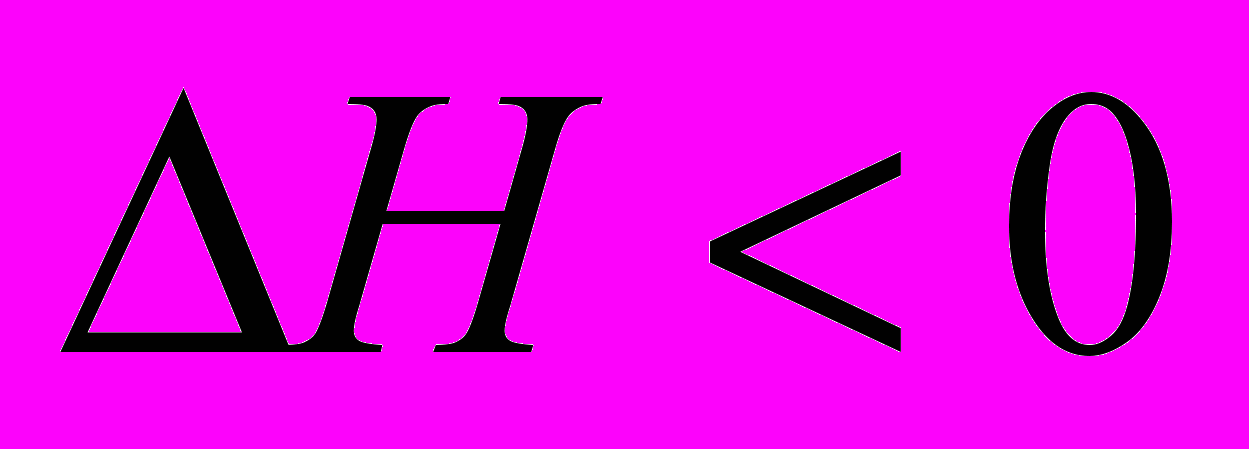
- Связь величин
 ,
,  и
и  ,
, 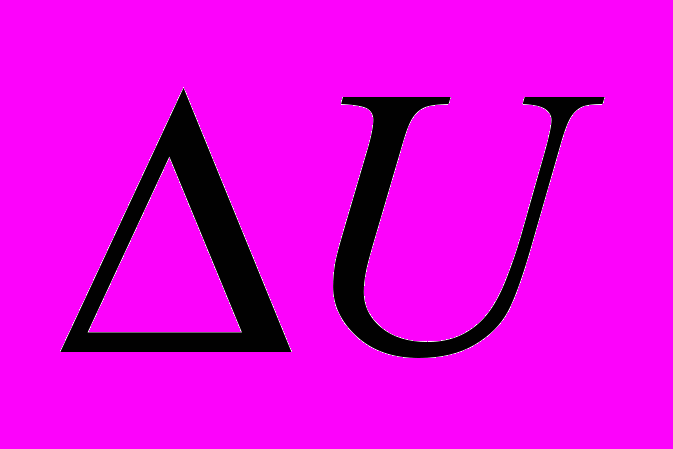 для одной и той же реакции
для одной и той же реакции
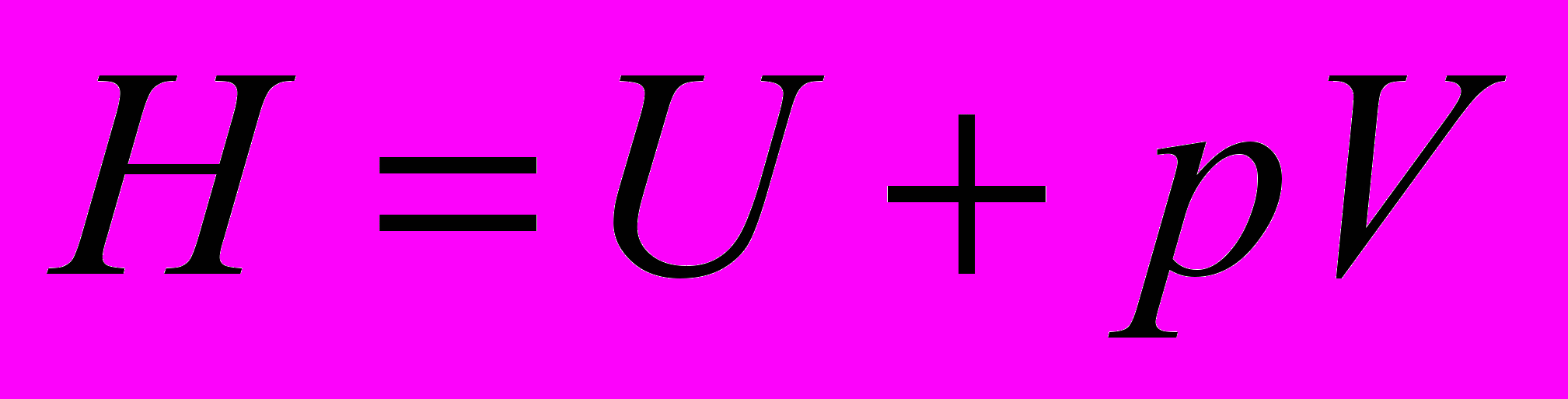
для процесса при
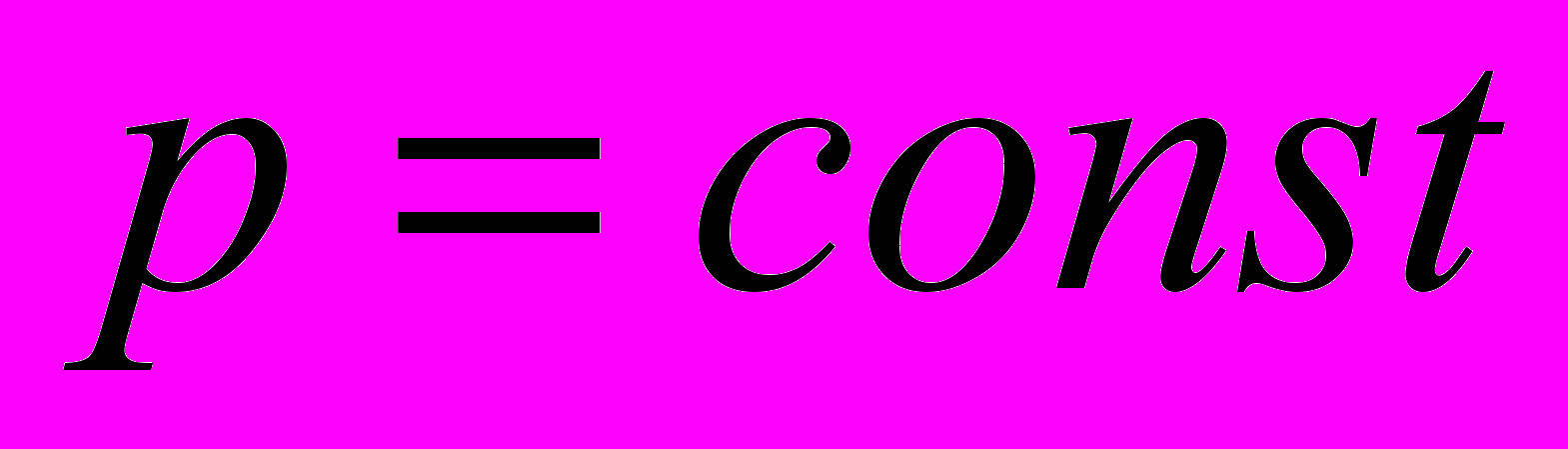
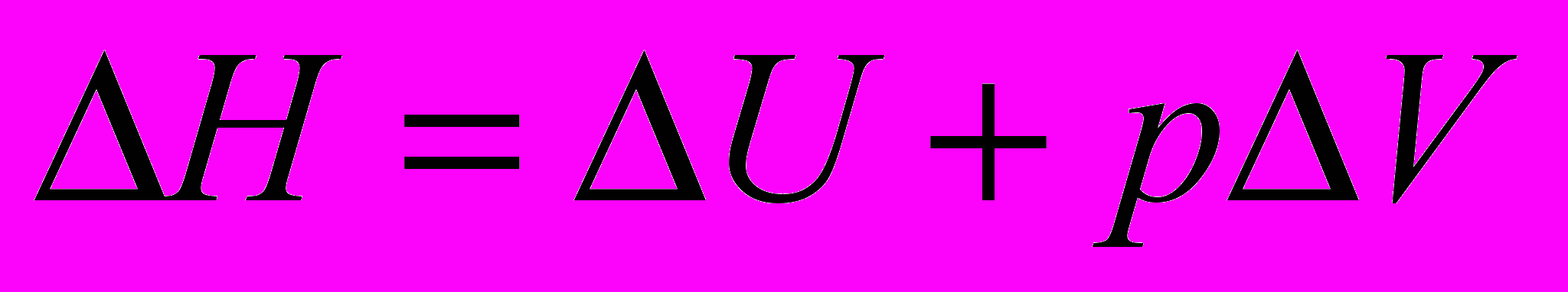
если
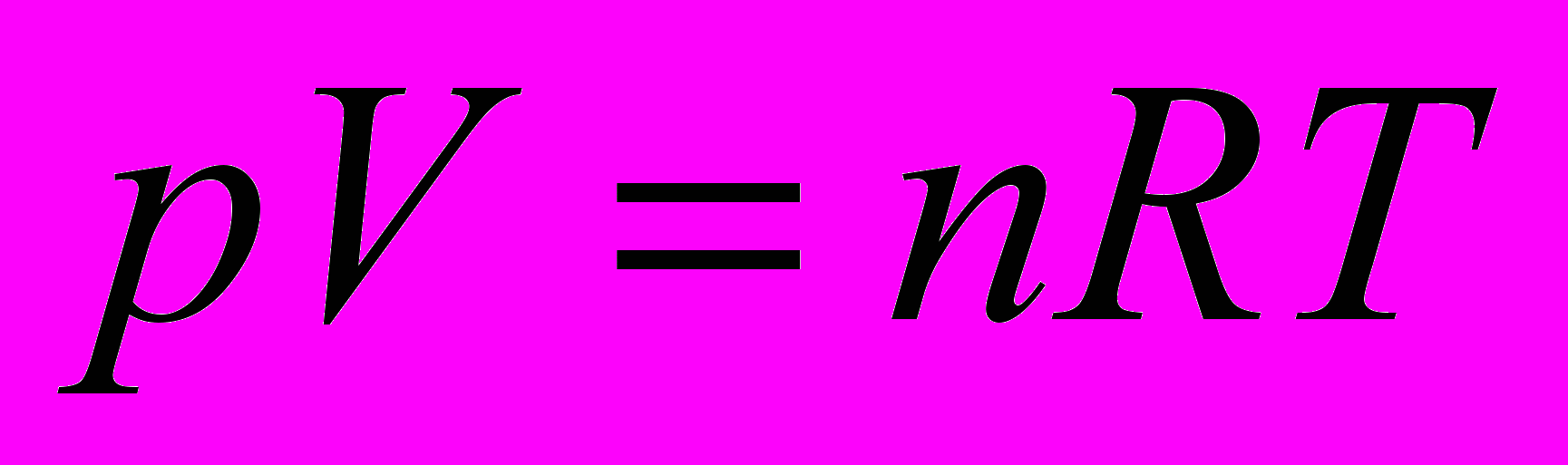 , то при
, то при 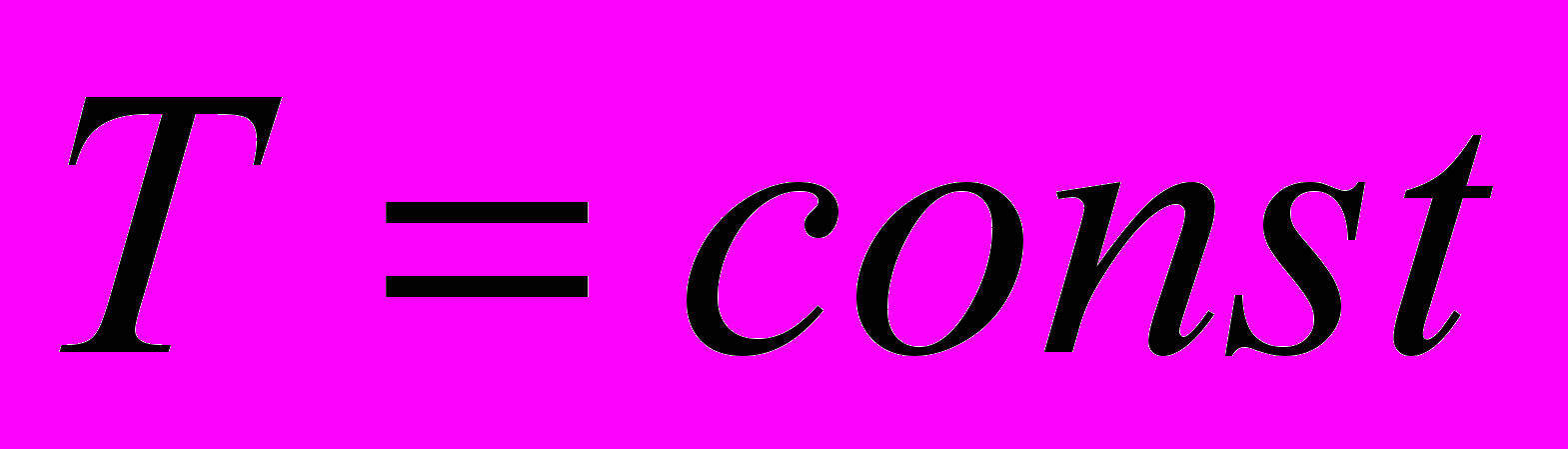
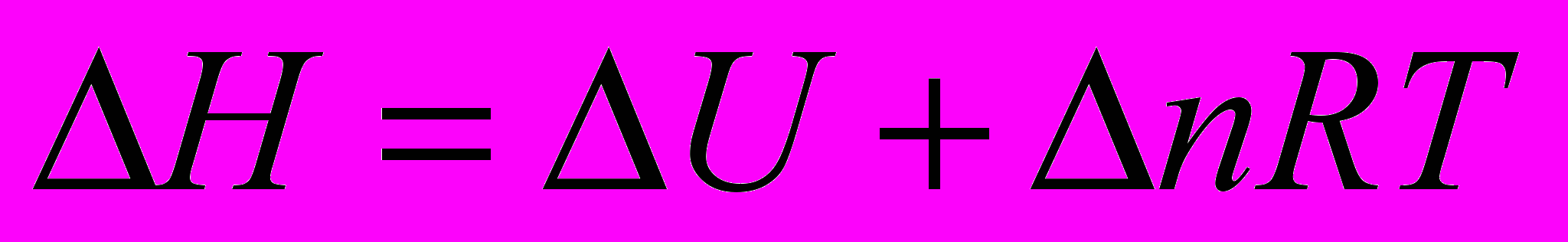
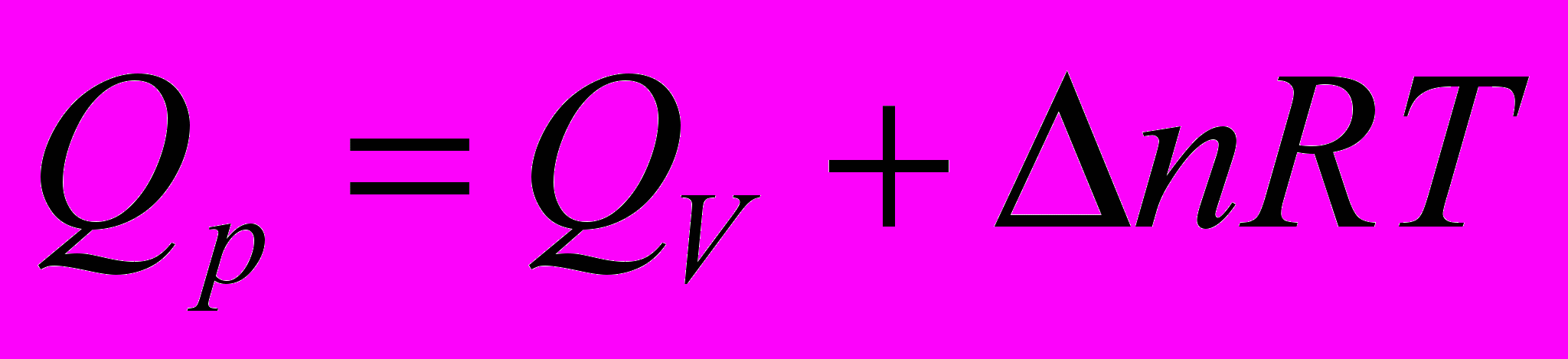
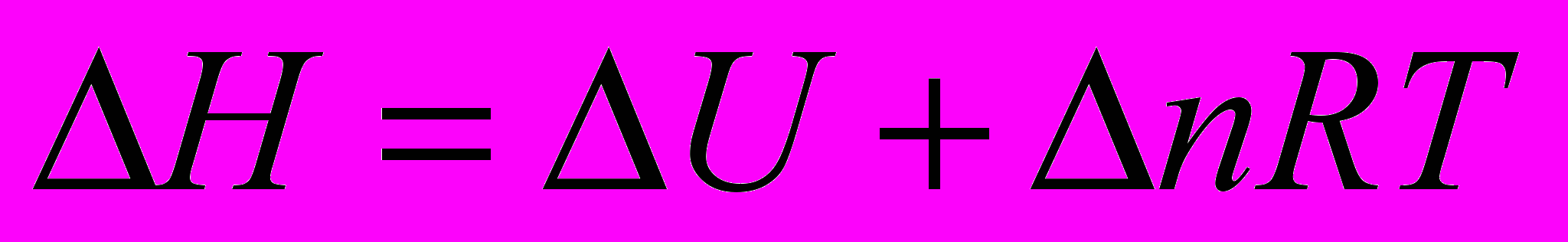
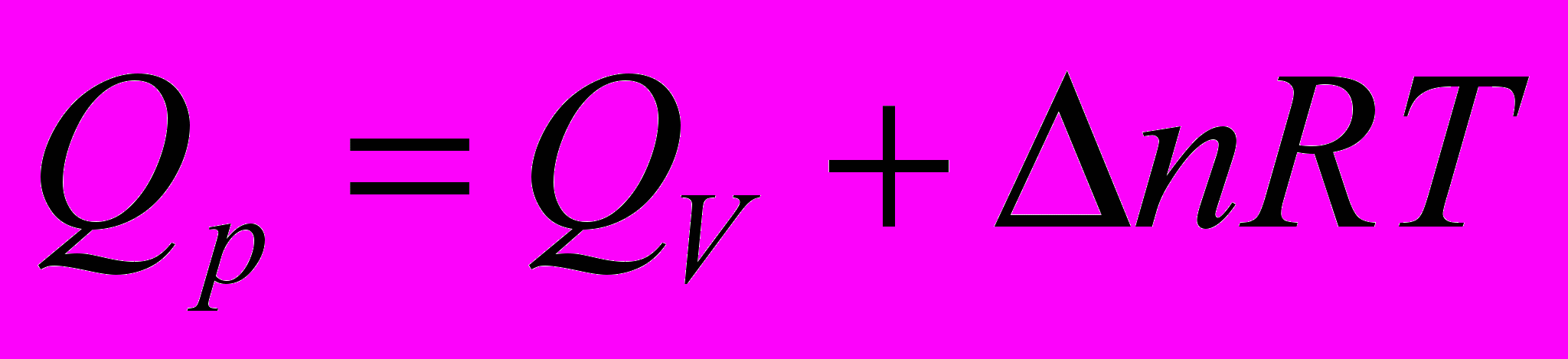
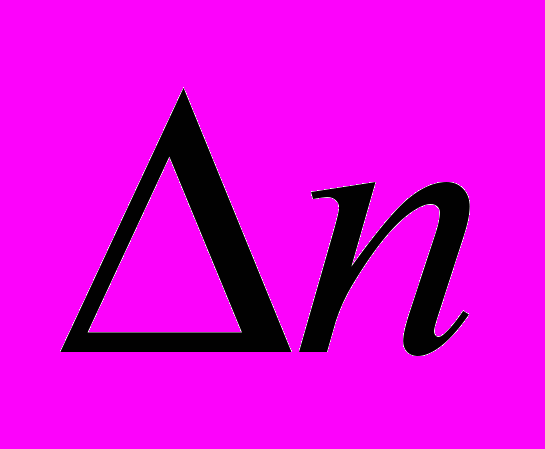 - изменение числа молей газообразных веществ в результате протекания химической реакции
- изменение числа молей газообразных веществ в результате протекания химической реакции 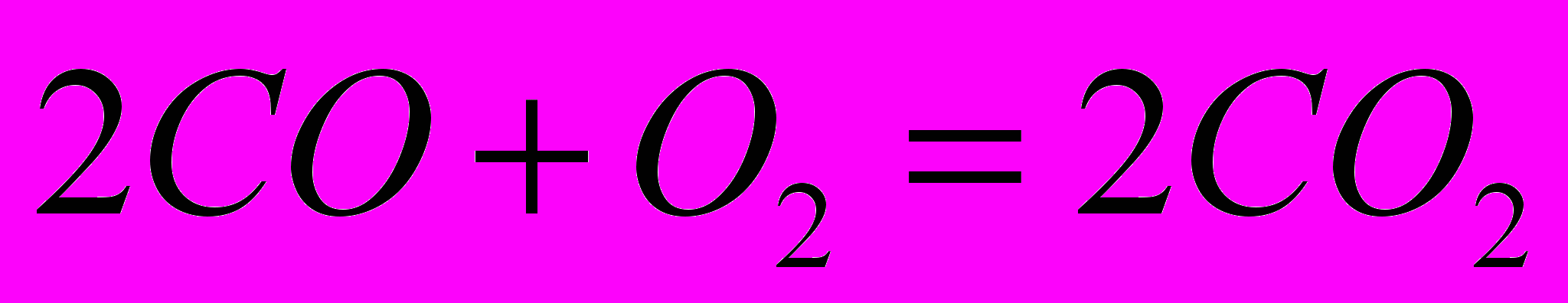   |   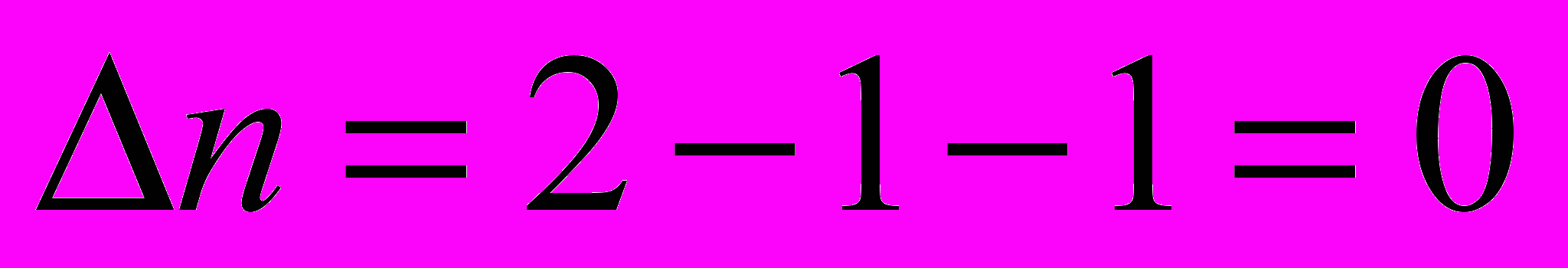 |
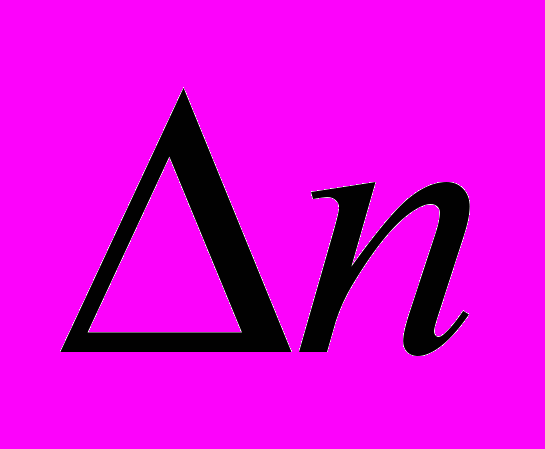 - определяется по уравнению химической реакции
- определяется по уравнению химической реакцииТермодинамическое обоснование закона Гесса
| «блок-схема – рисунок» 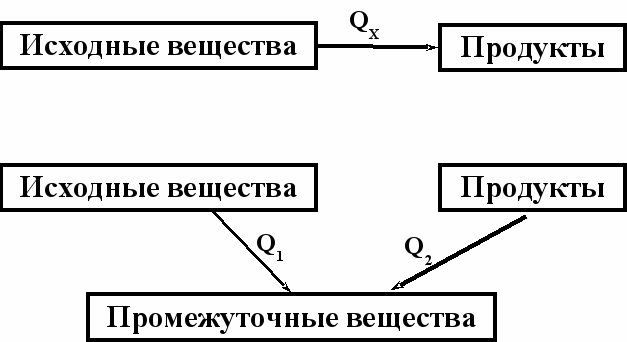 |
| 1. 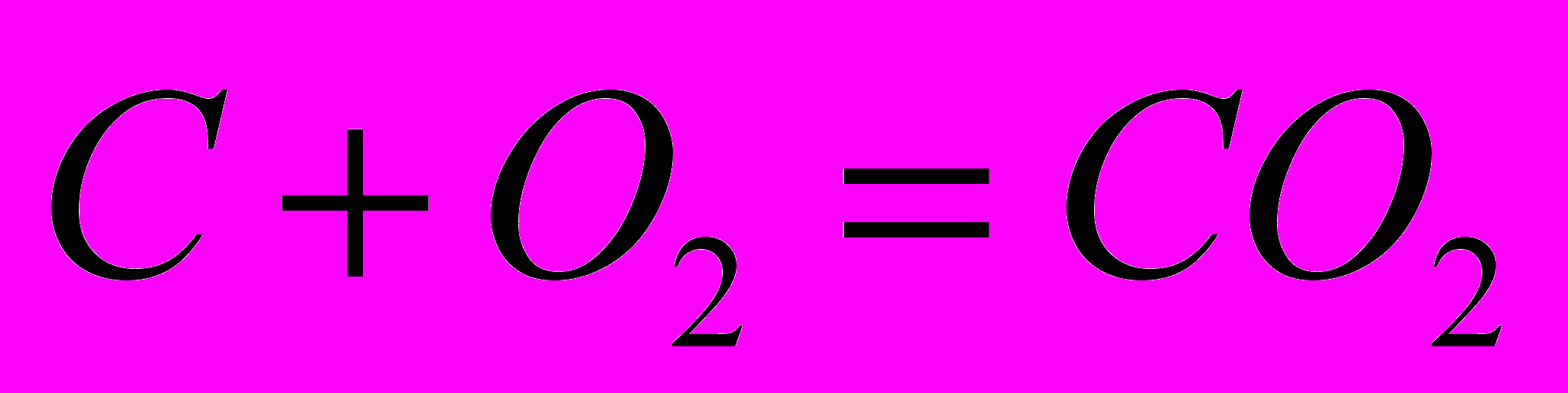 2.  | 1. 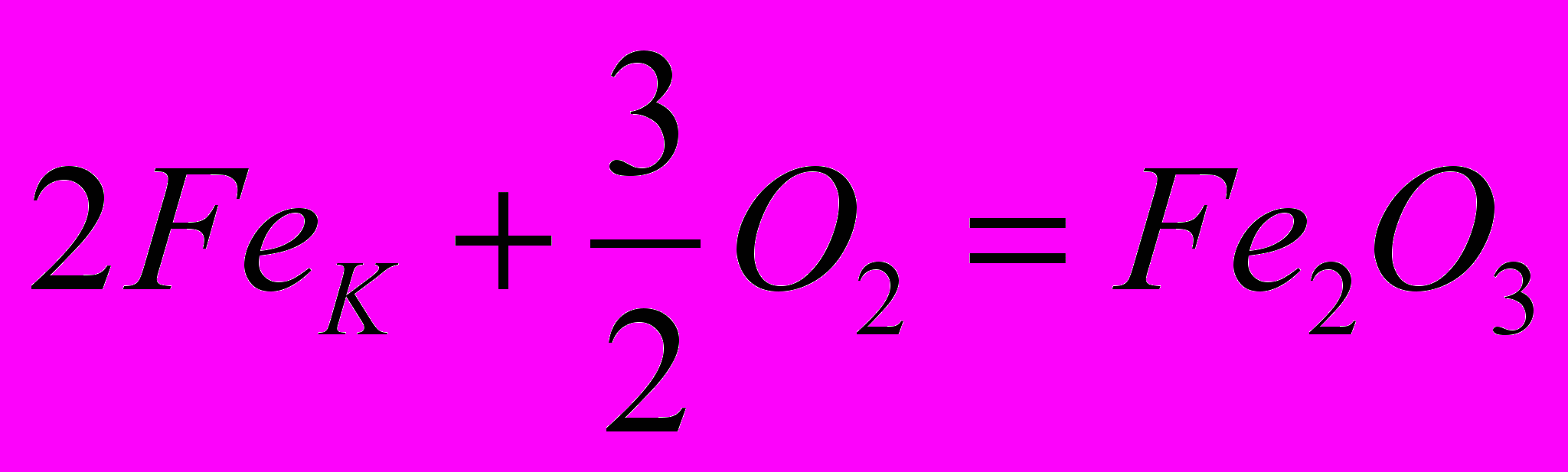  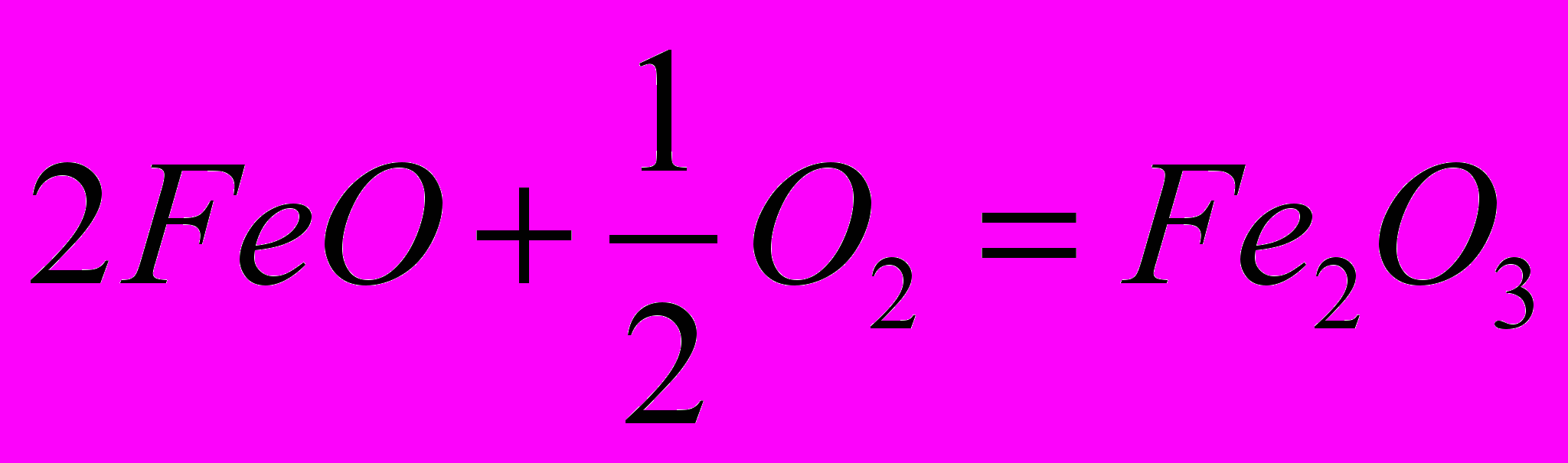 |
Докажем, что тепловой эффект реакции не зависит от пути процесса; другими словами, он будет одним и тем же независимо от того, осуществляется ли реакция непосредственно или через несколько стадий
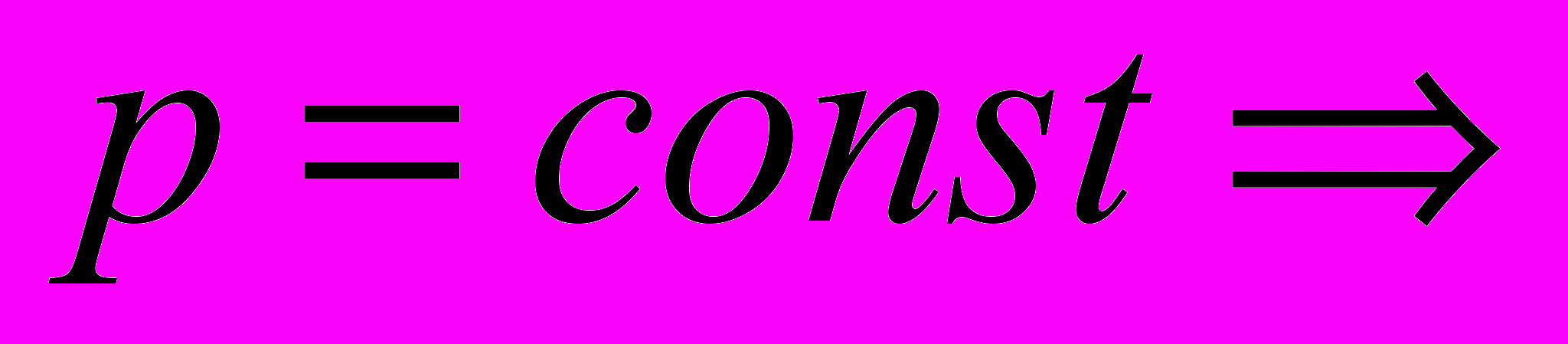 реакция протекает при постоянном давлении
реакция протекает при постоянном давленииИз I закона т/д
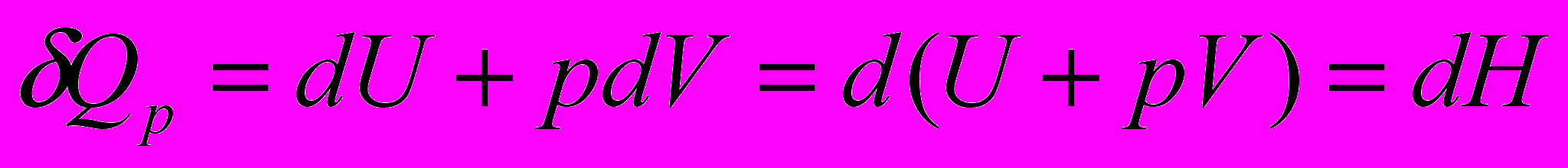

т.к. энтальпия есть функция состояния, то и тепловой эффект тоже будет функцией состояния, т.е. не будет зависеть от пути процесса.
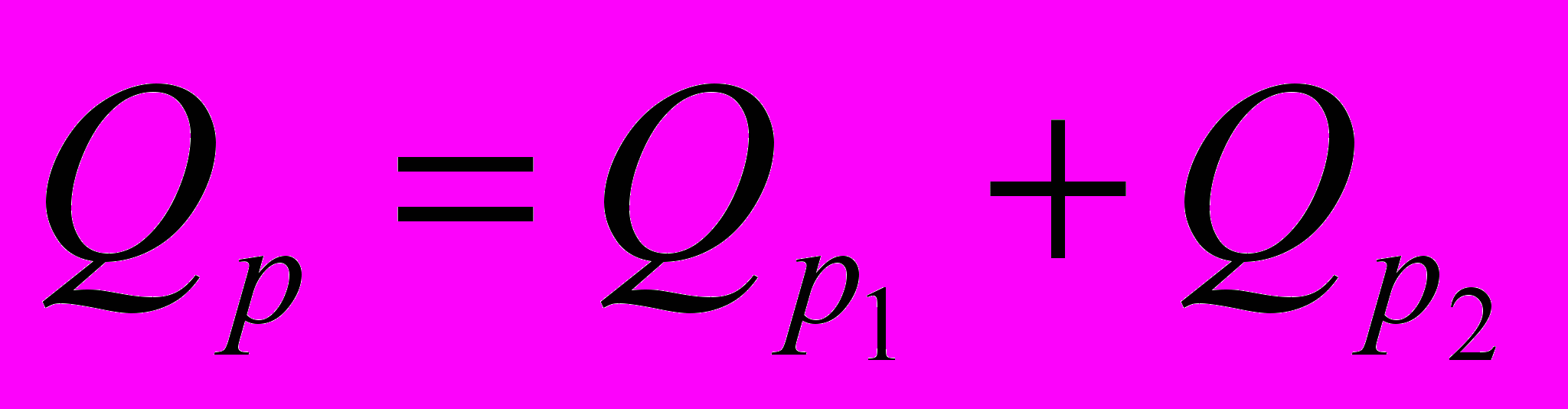
| 1. 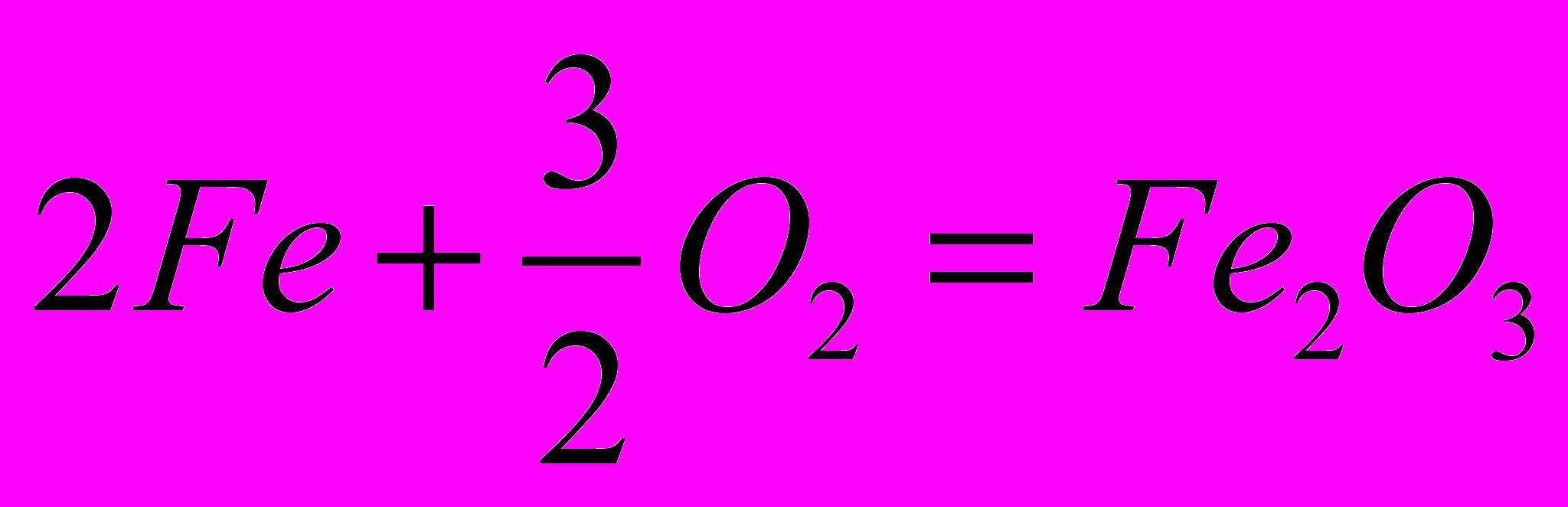 2. 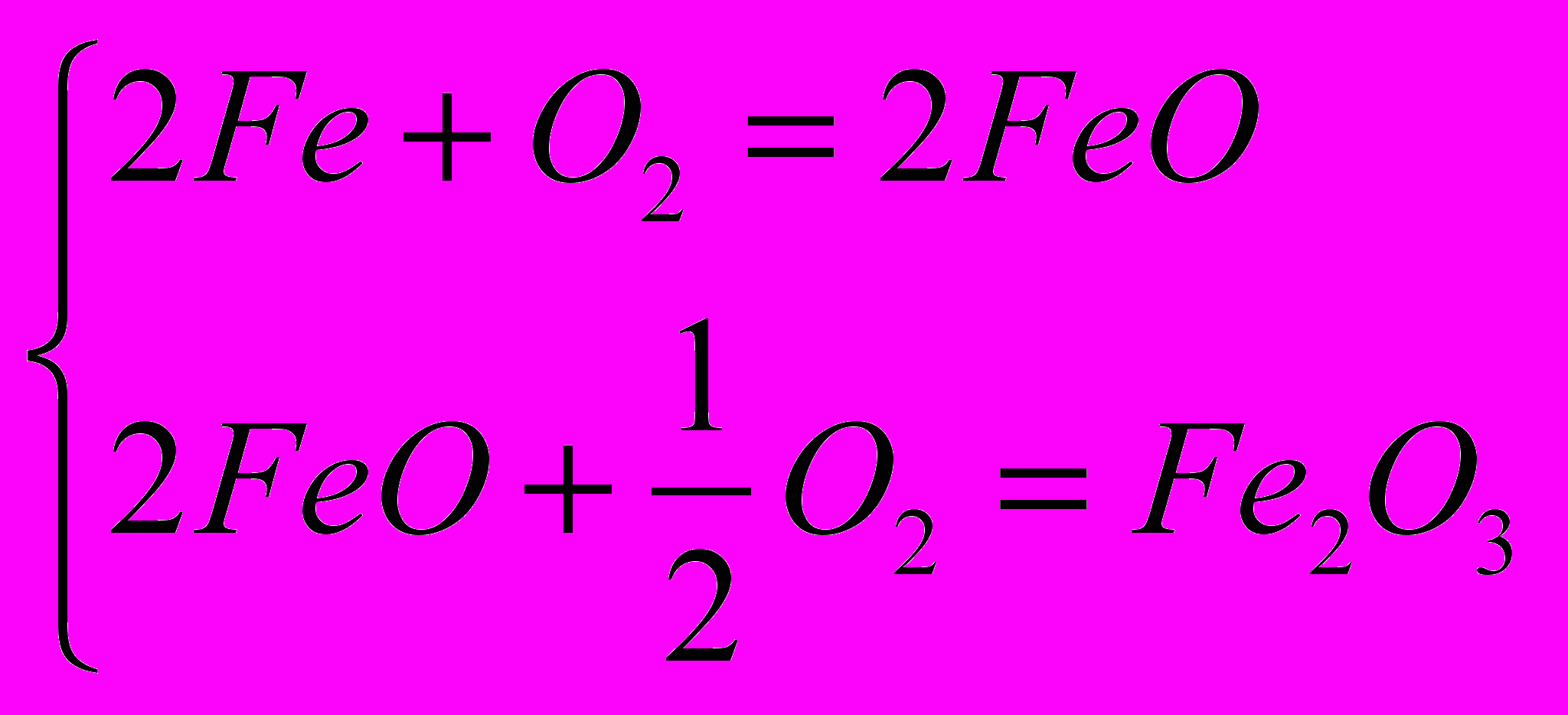 |  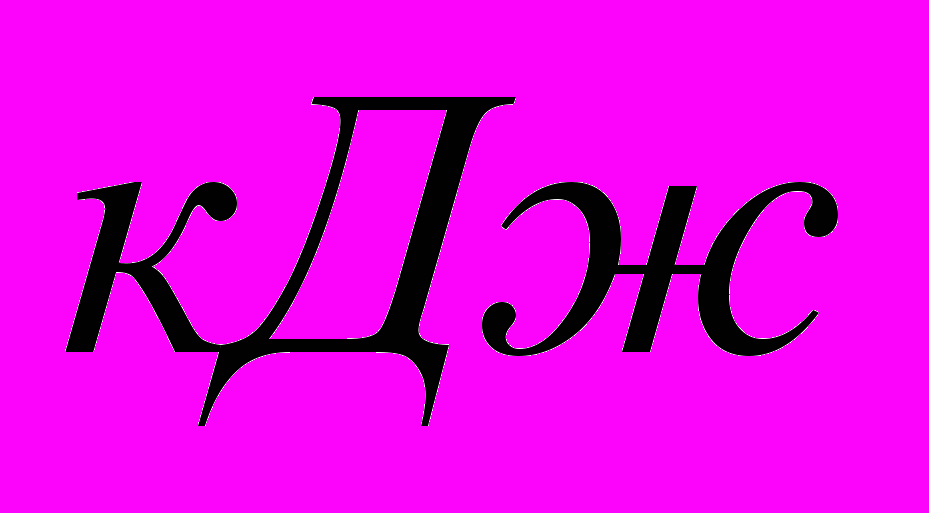 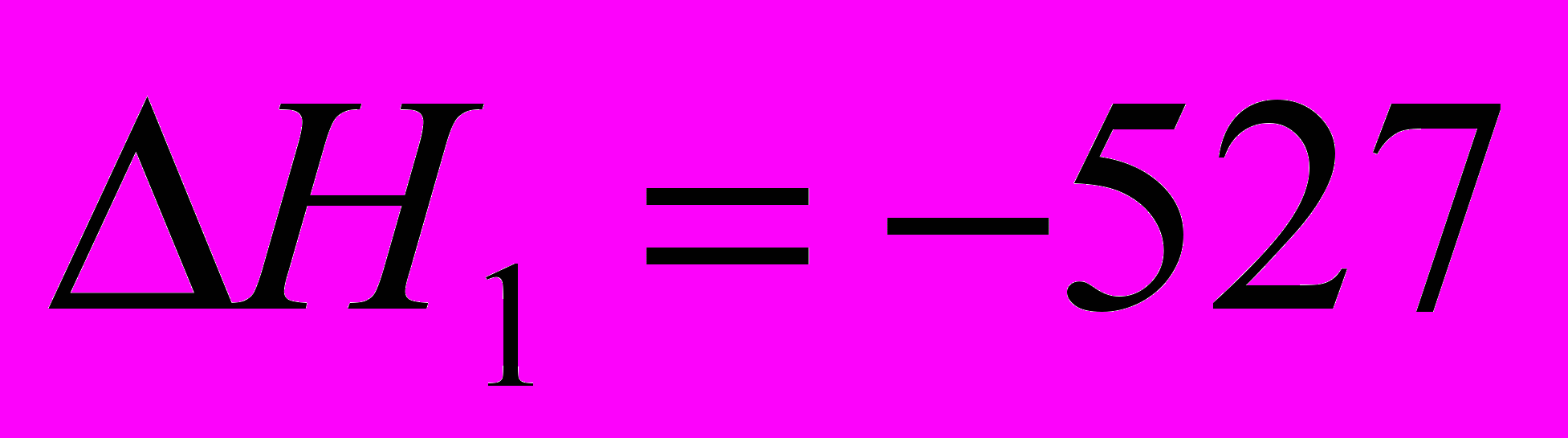 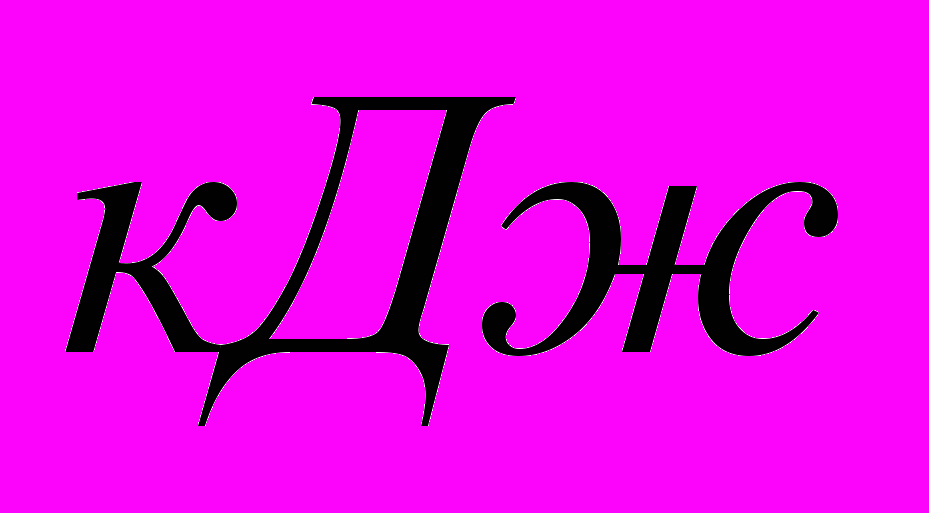 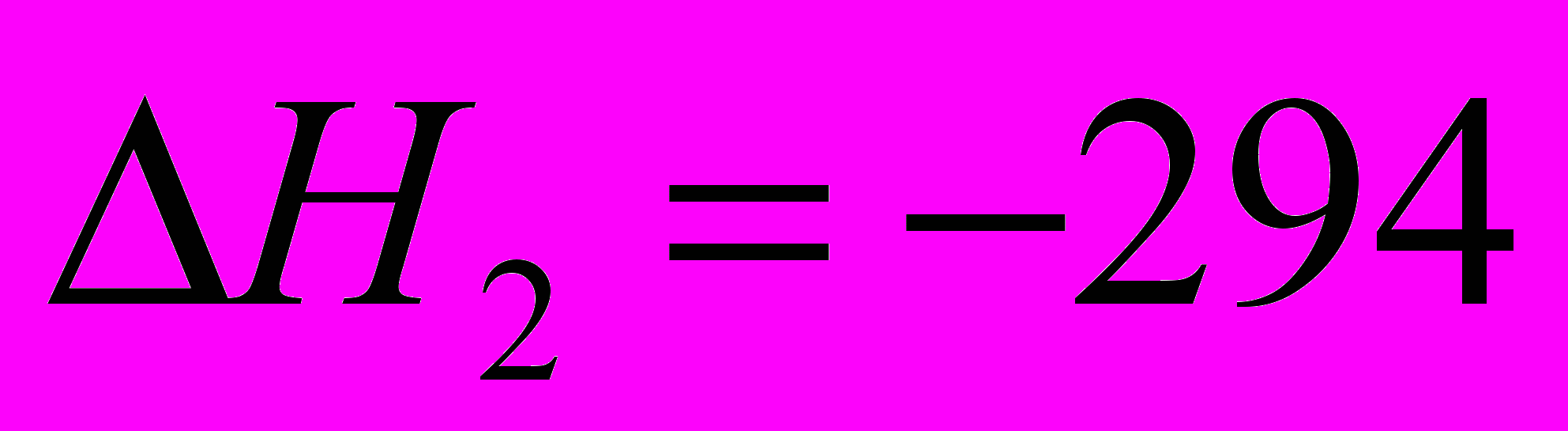  |  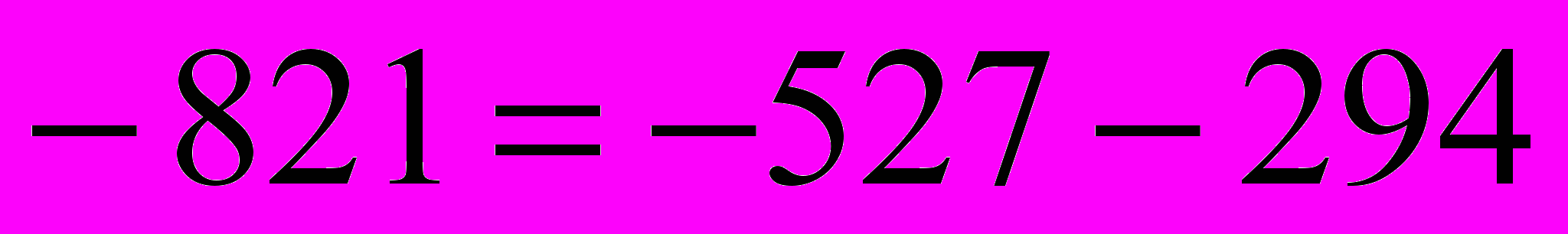  |
Закон Гесса – математическое следствие I закона термодинамики
Методы расчета теплот химических реакций:
- Метод комбинирования термохимических уравнений
- Метод, основанный на следствии из закона Гесса, оперирующий энтальпиями (теплотами образования веществ)
- Метод, основанный на следствии из закона Гесса, использующий теплоты сгорания веществ. В металлургической практике не используется.
Метод комбинирования термохимических уравнений
| I 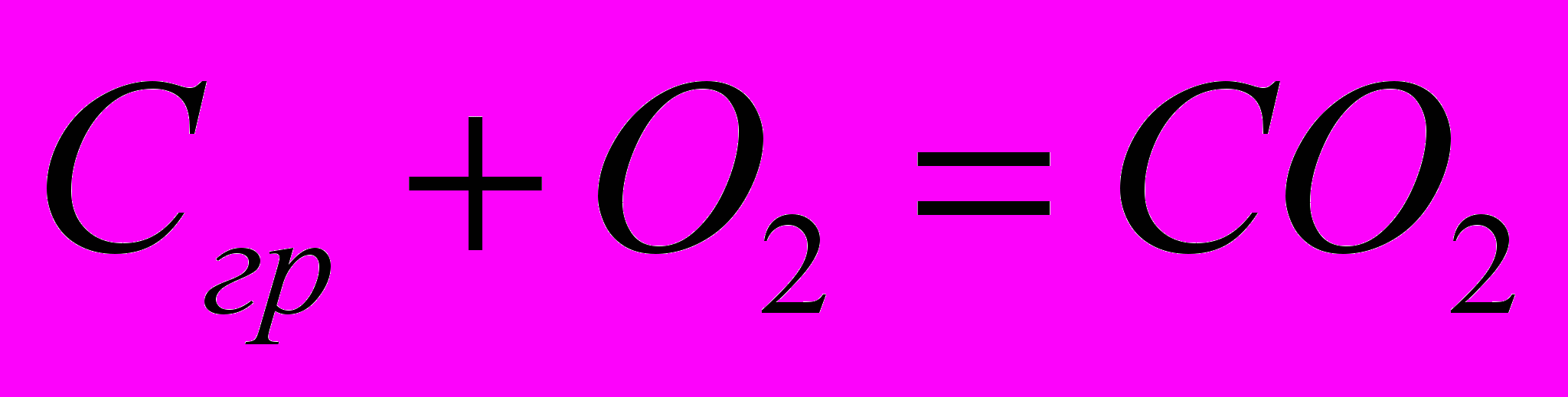 |  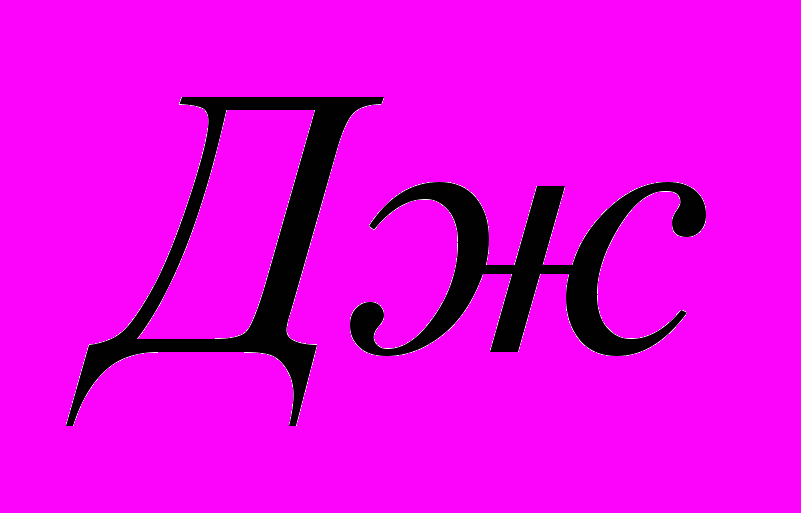 |
| II  | 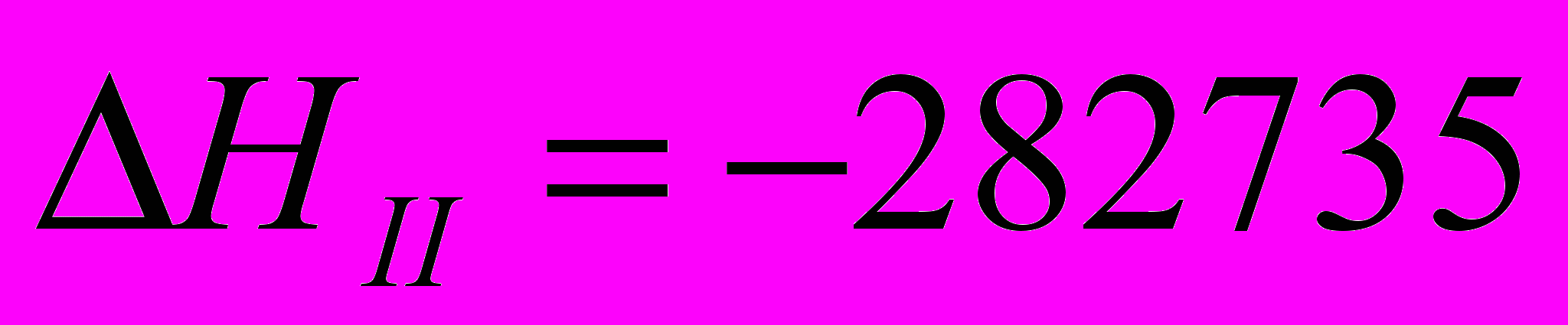 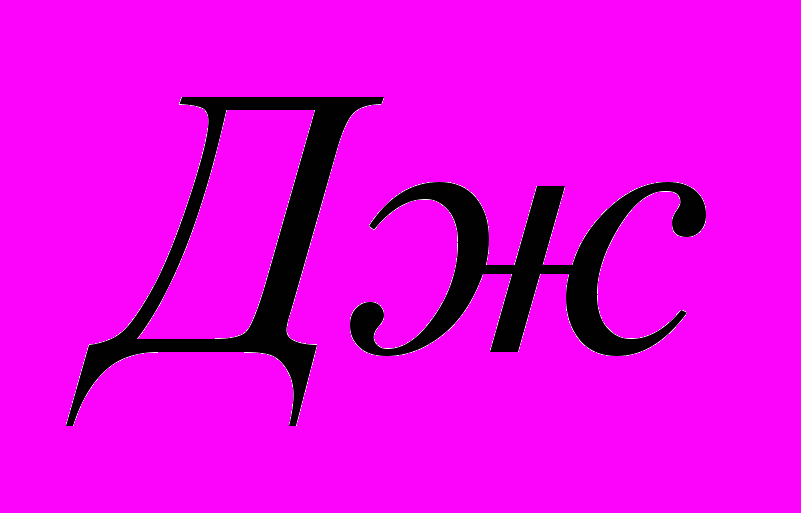 |
| III  |  |
| IV  | 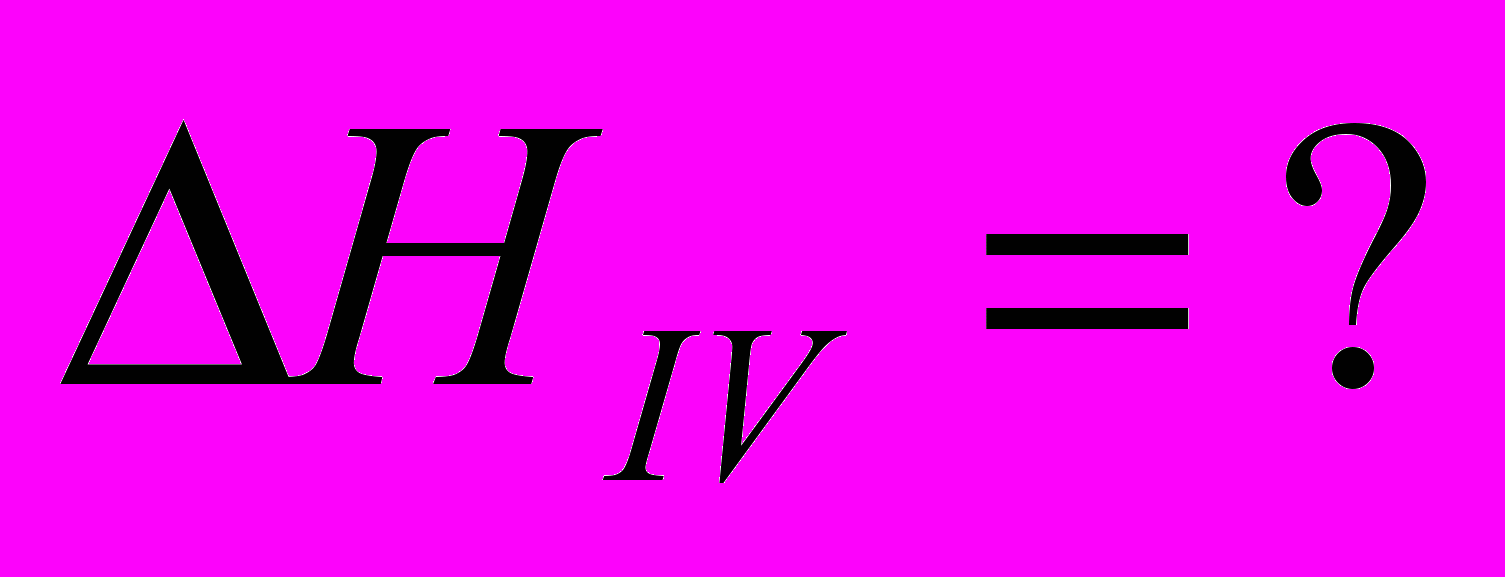 |
III=I-II
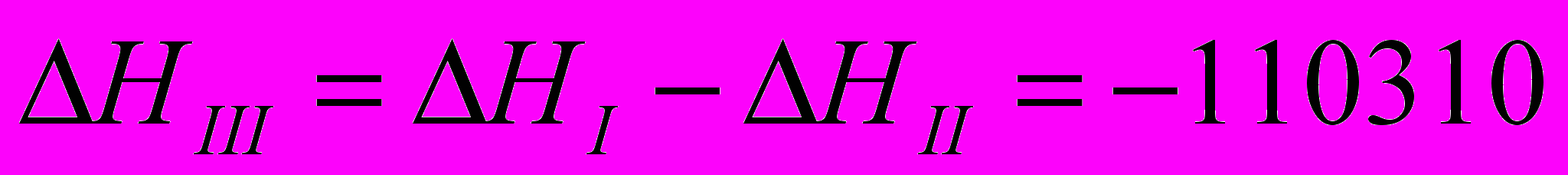
IV=I-2(II)
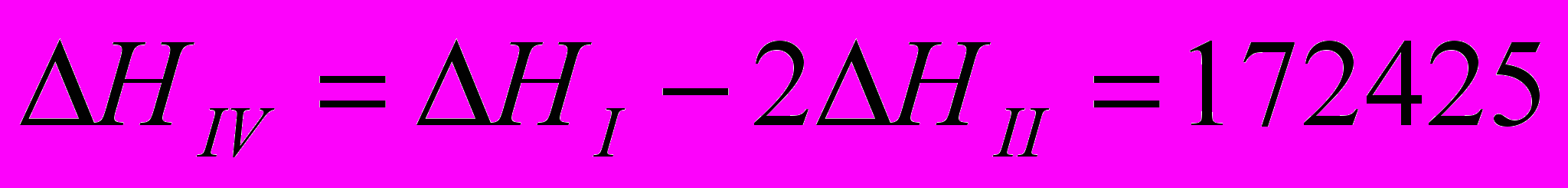
Теплоты всех реакций должны относиться к одним и тем же условиям.
Следствие из закона Гесса
Энтальпия реакции равна разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ
Для произвольной химической реакции
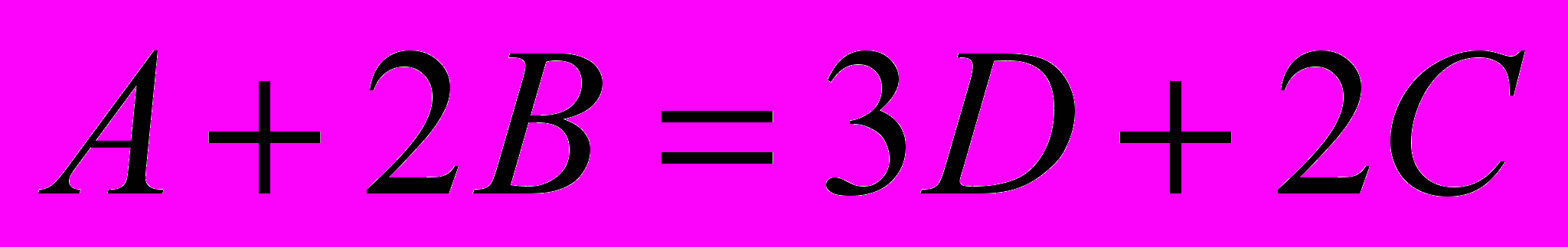
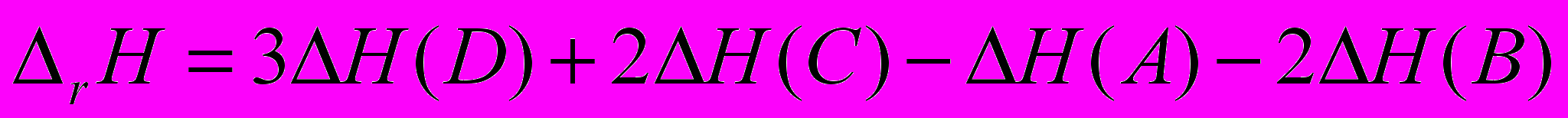
Энтальпией образования вещества называется тепловой эффект реакции образования
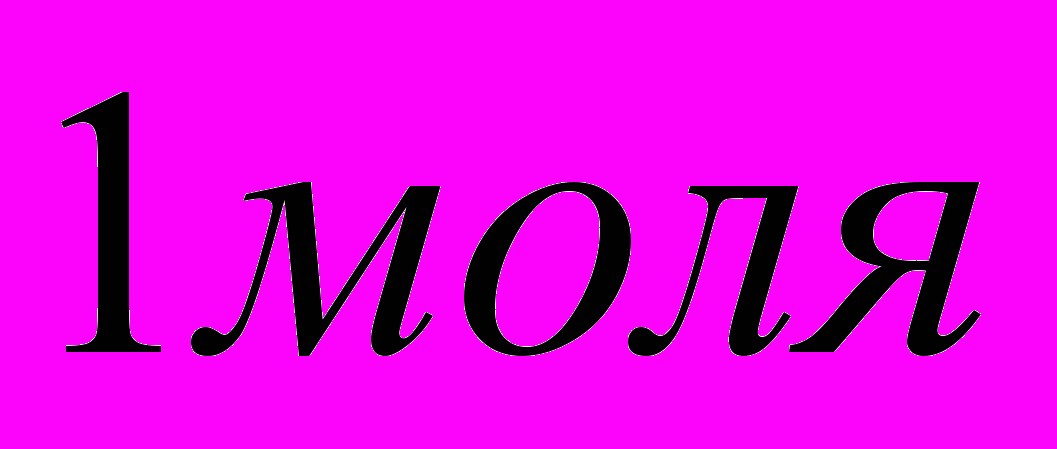 данного вещества из простых веществ
данного вещества из простых веществ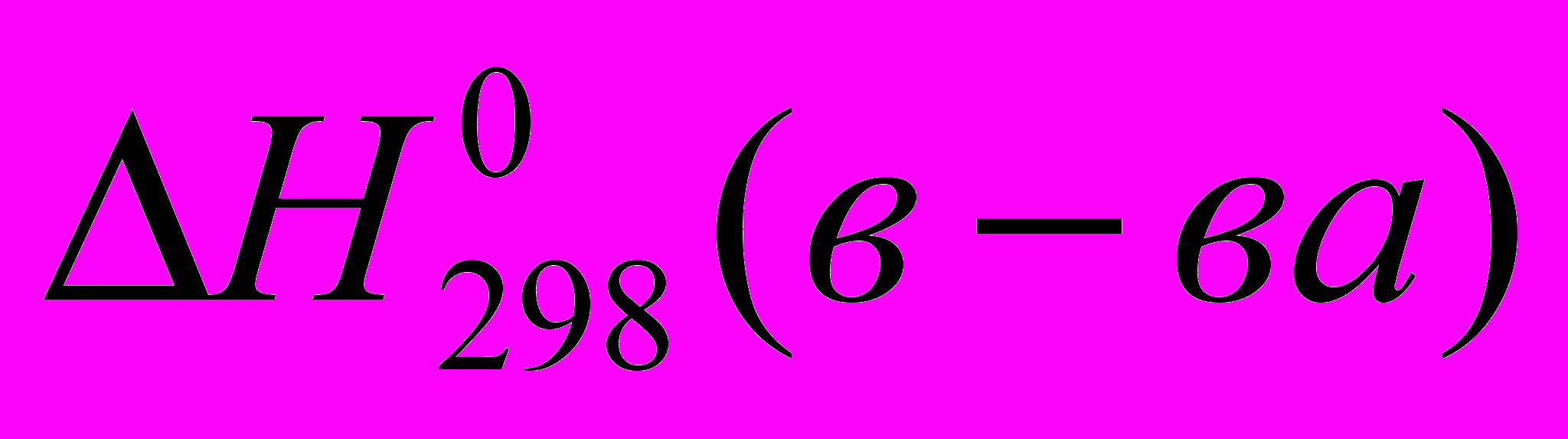 стандартная энтальпия образования вещества
стандартная энтальпия образования веществаИзмерена при
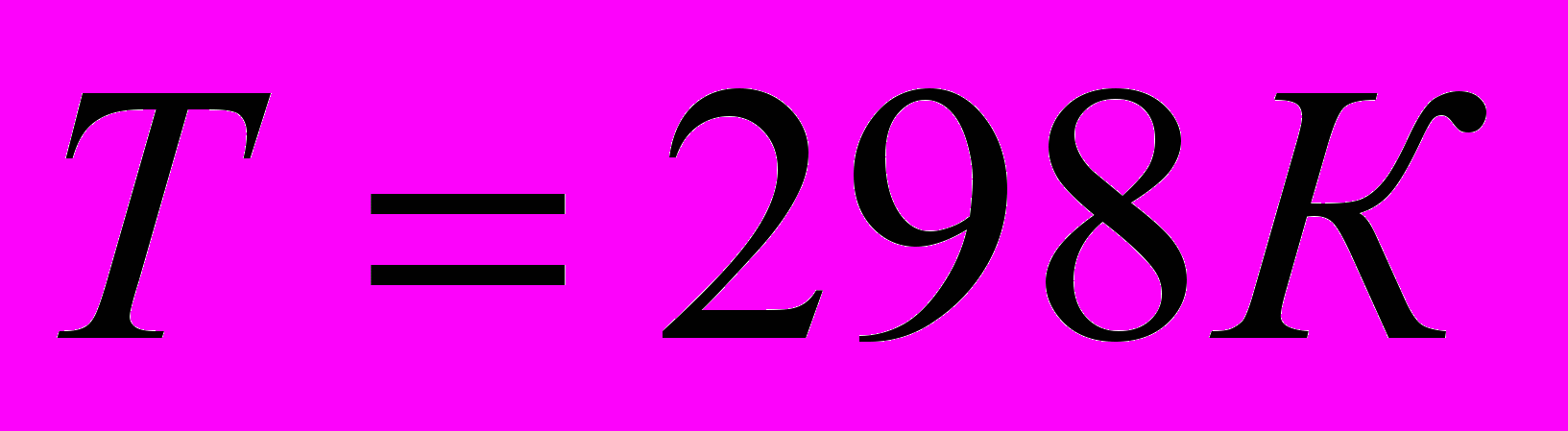 и
и 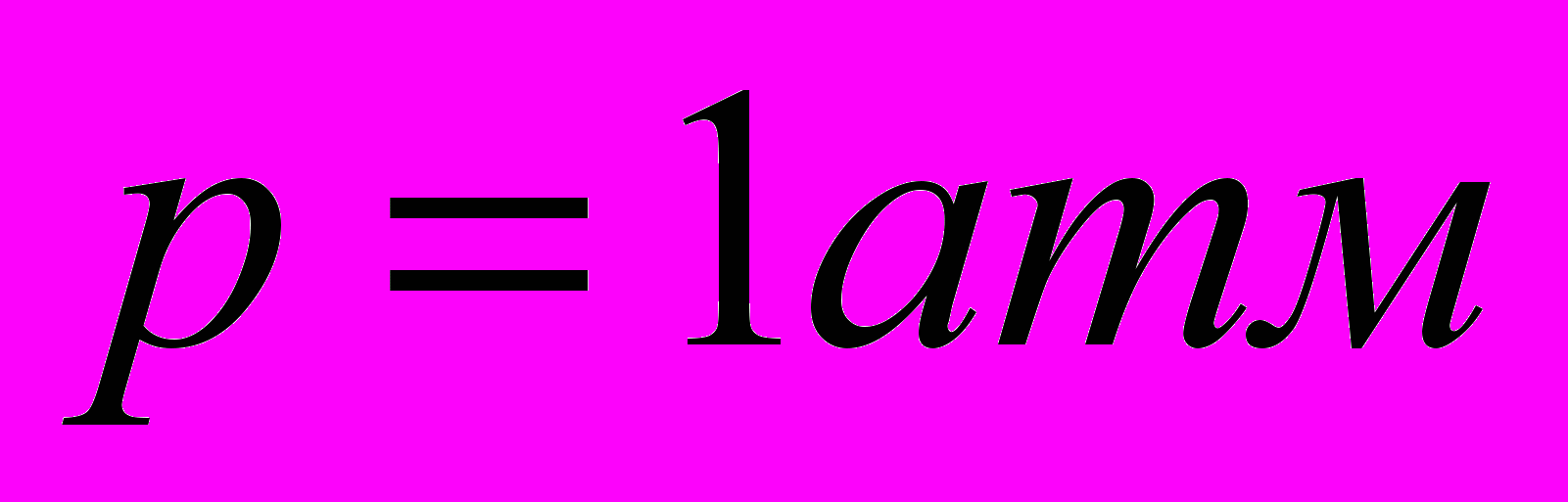 .
.| В-во | 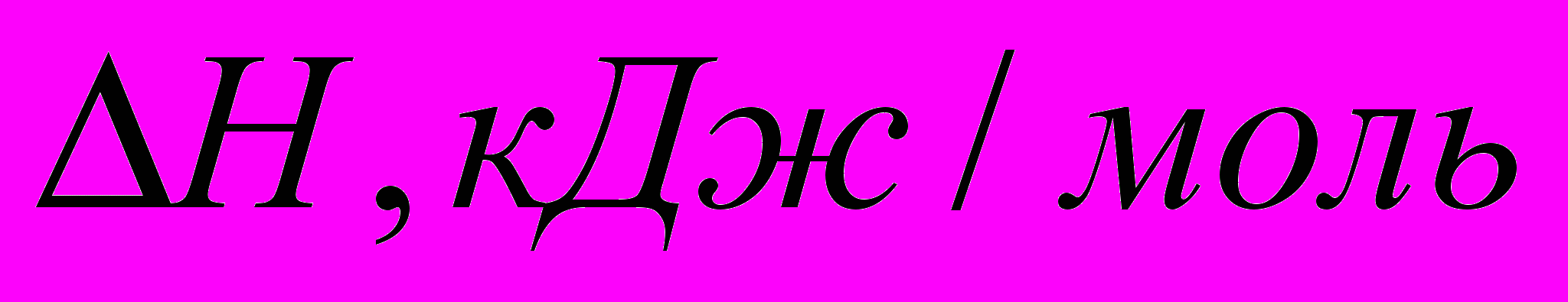 | Комментарии:
|
 | 0 | |
 | 0,3 | |
 | 0 | |
 | 129,1 | |
 | -95,40 |
Примеры расчетов
Пример 1. Найти энтальпию реакции
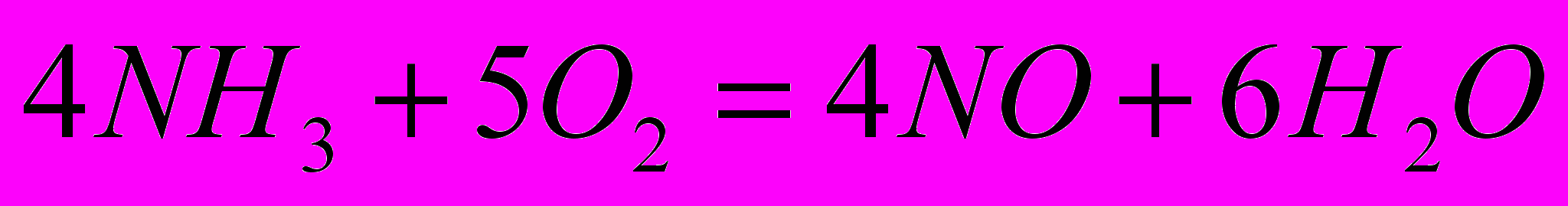

если известны энтальпии следующих реакций
1)
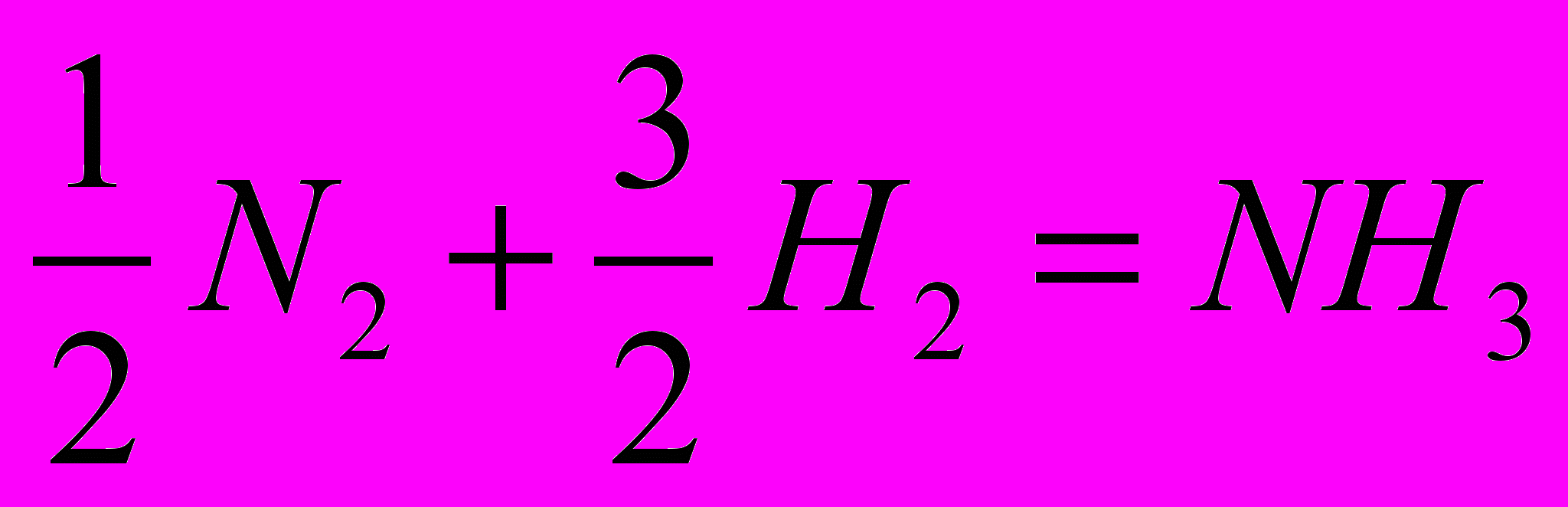

2)
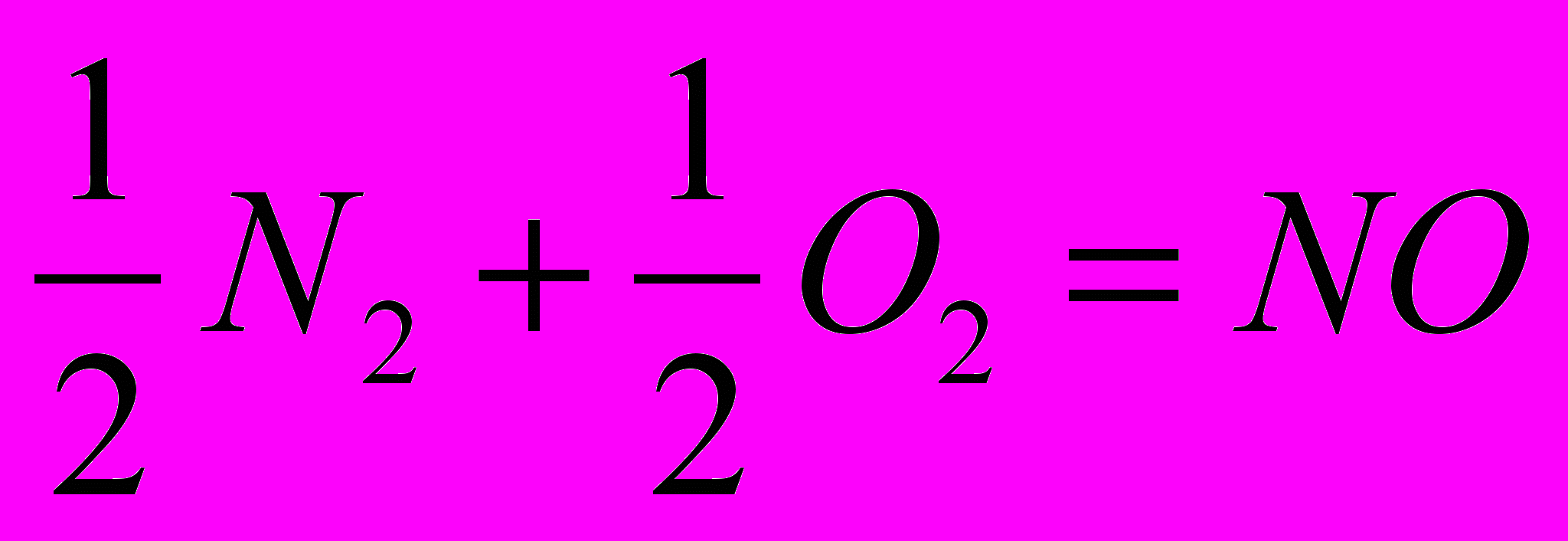
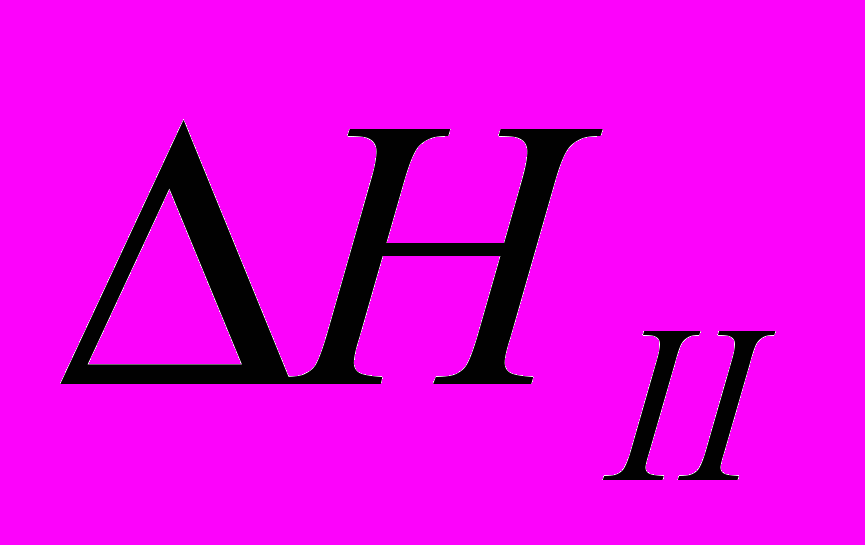
3)
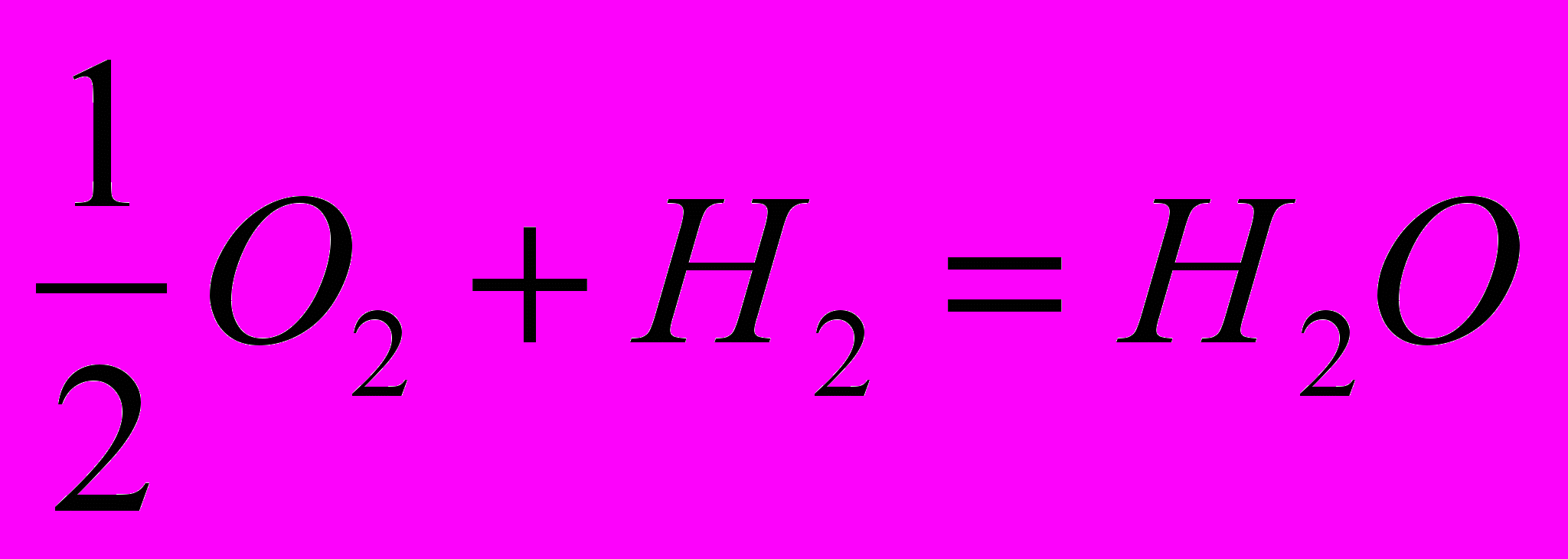
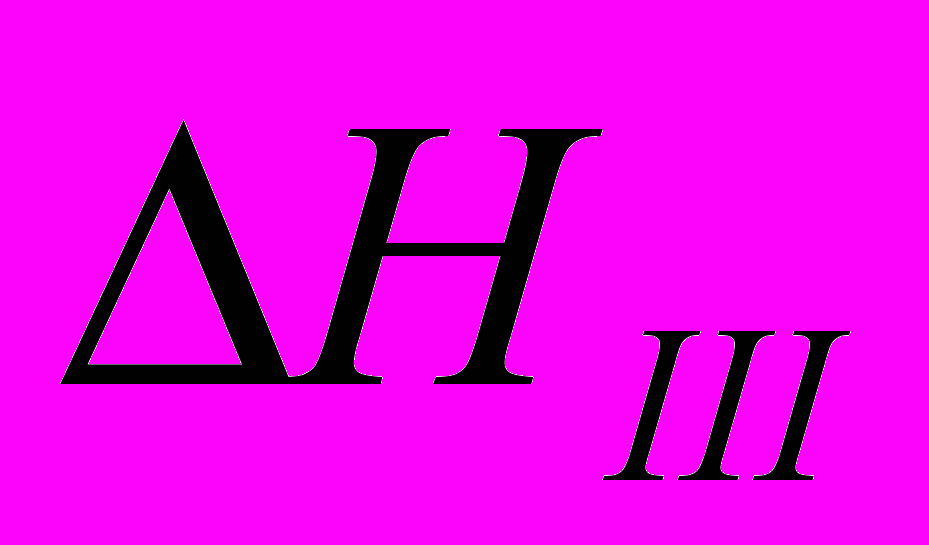
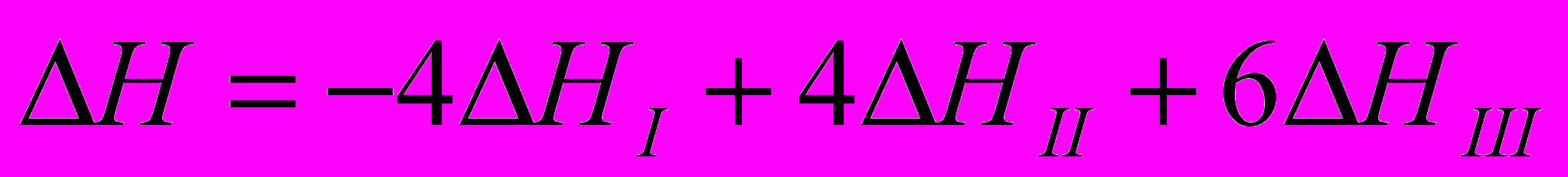
Пример 2.
Рассчитать энтальпию сгорания жидкого бензола,
пользуясь справочными данными
 | 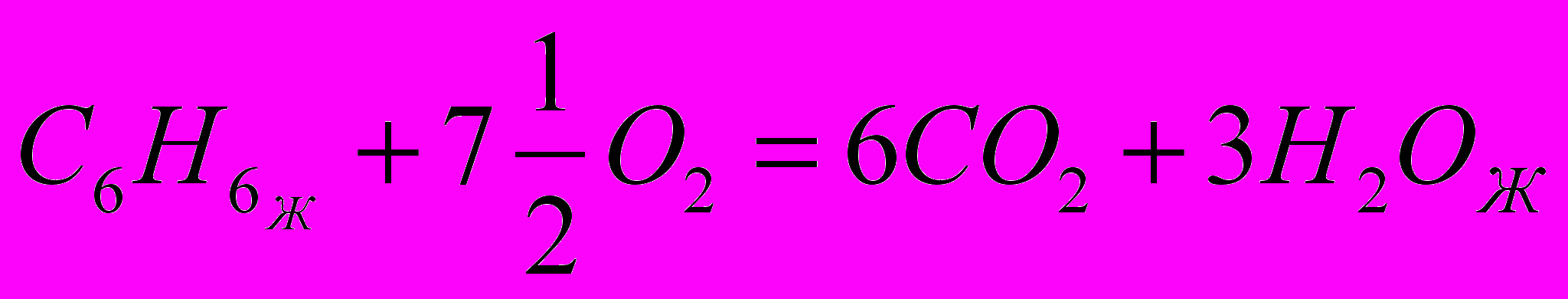 49,04 0 -393,51 -285,84  |
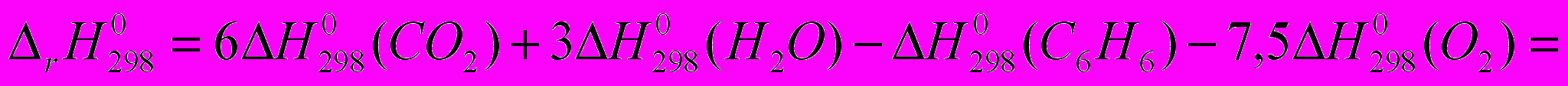
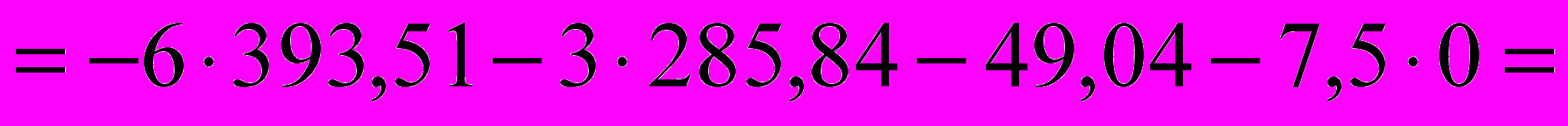
=-3267,62
 !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!Размерность энтальпии реакции?
Пример 3.
Оксид
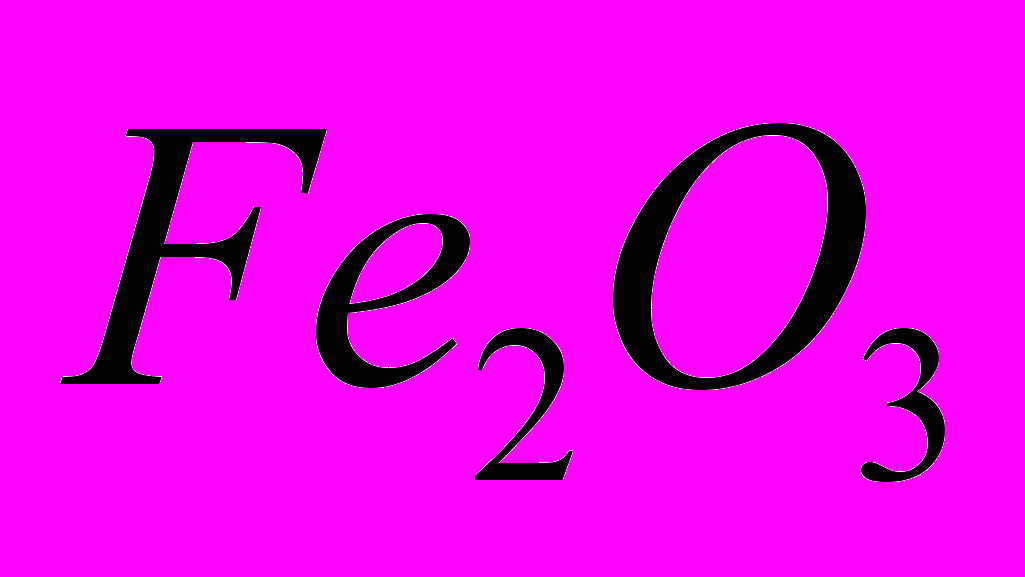 восстанавливается до
восстанавливается до 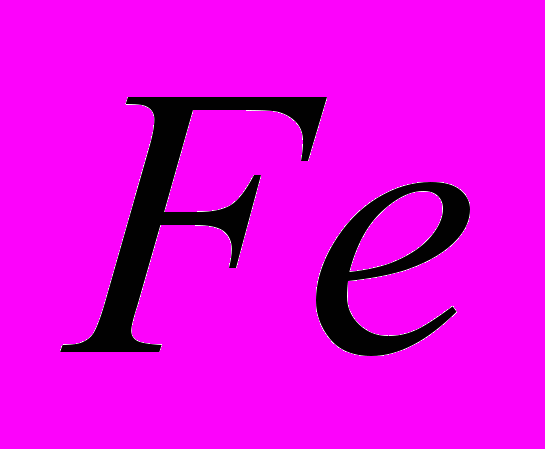 с помощью
с помощью 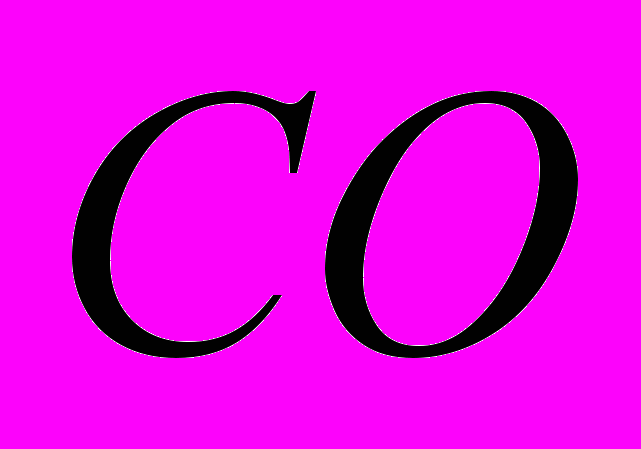 .
.Рассчитать стандартную энтальпию реакции при получении 1 г
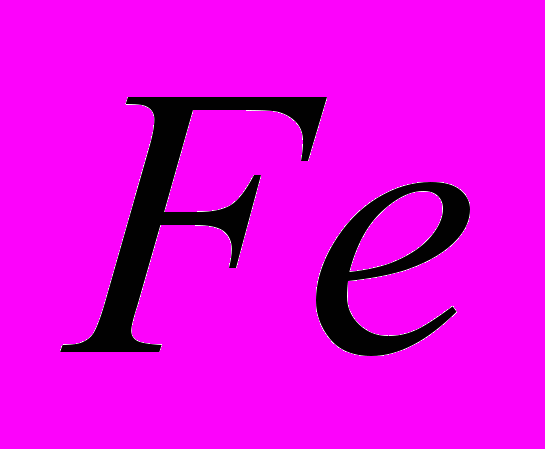
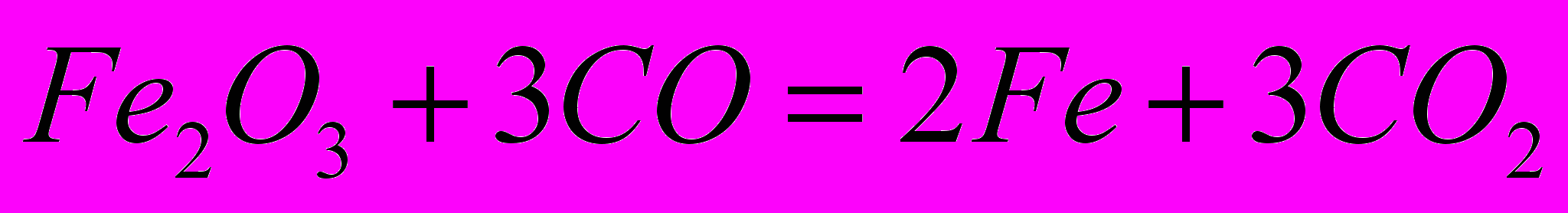
 -821,32 -110,5 0 -393,51
-821,32 -110,5 0 -393,51 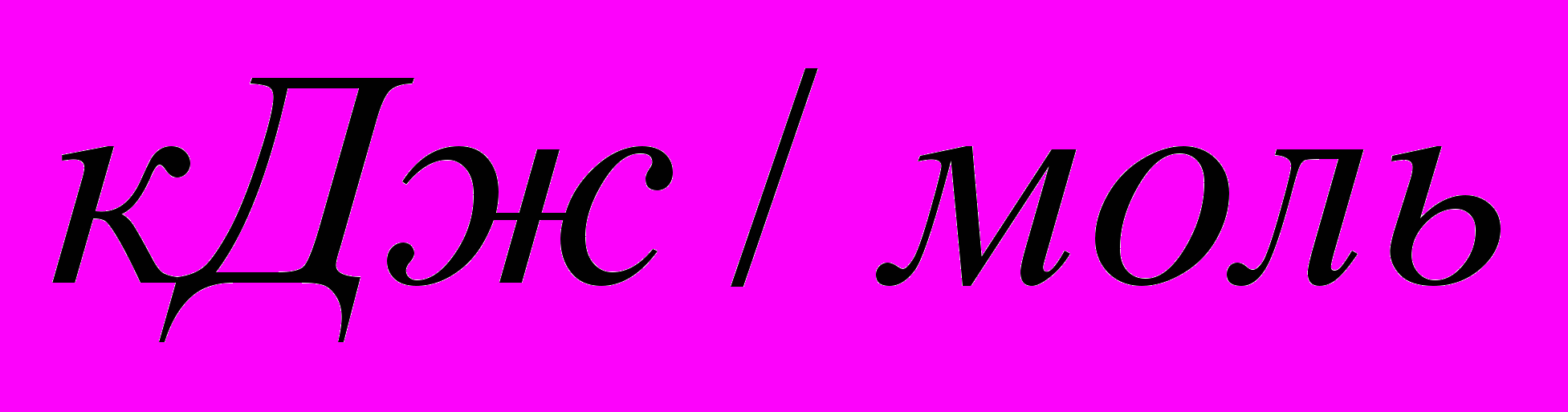
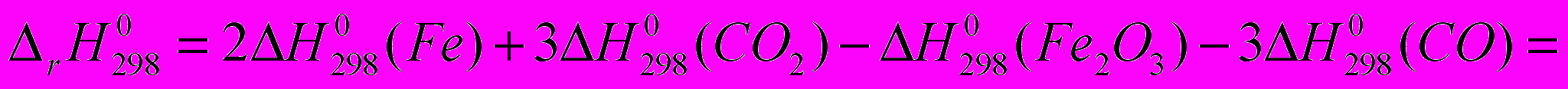
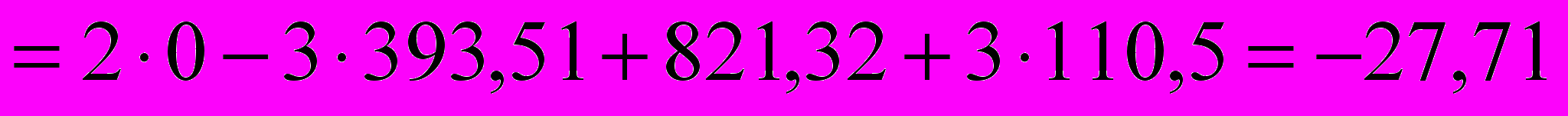
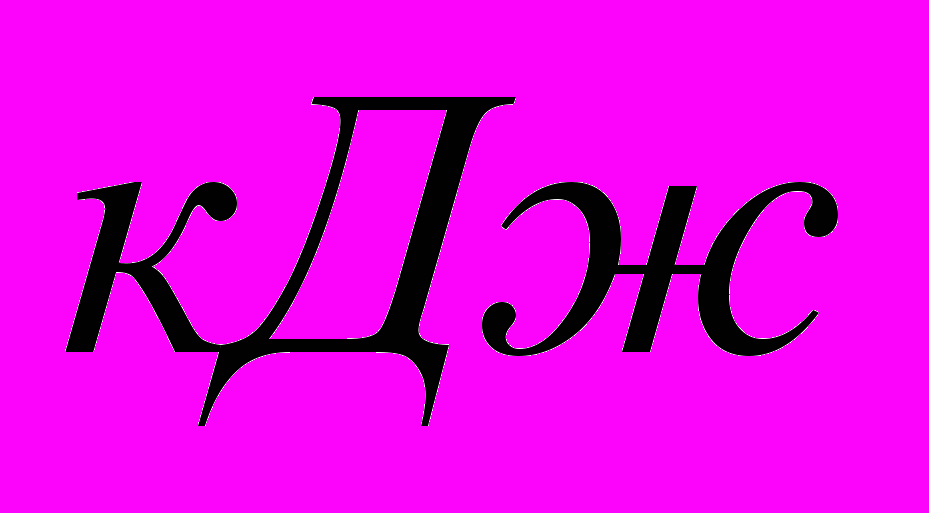
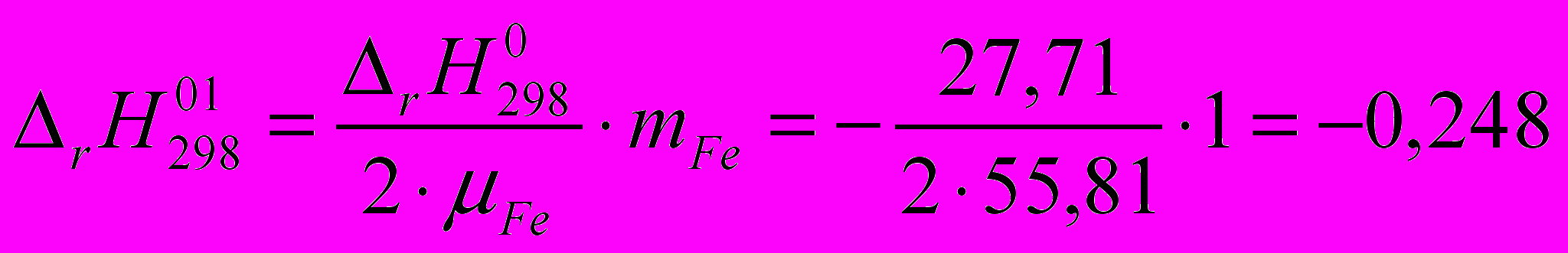
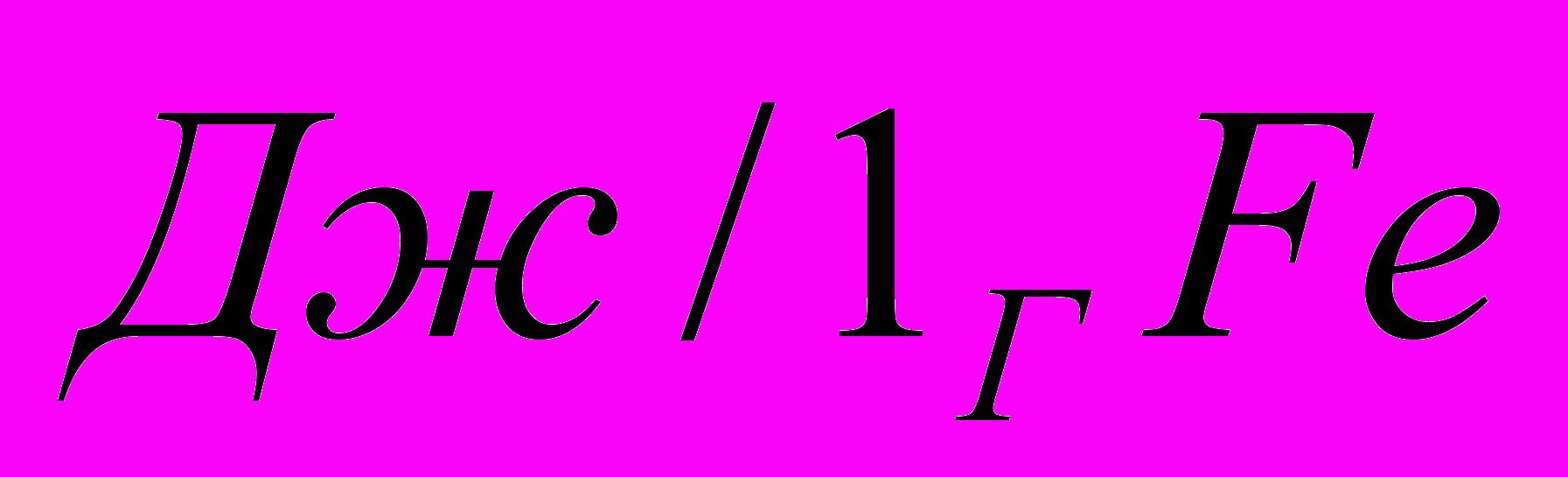
Пример 4.
Определить тепловой эффект реакции при
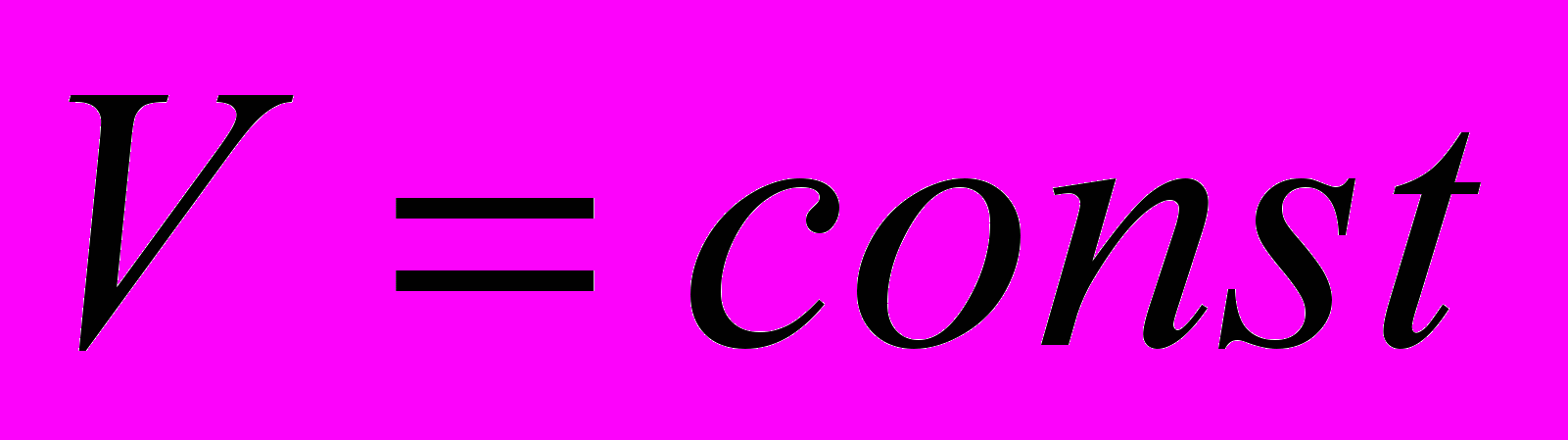 , если тепловой эффект при постоянном давлении и
, если тепловой эффект при постоянном давлении и 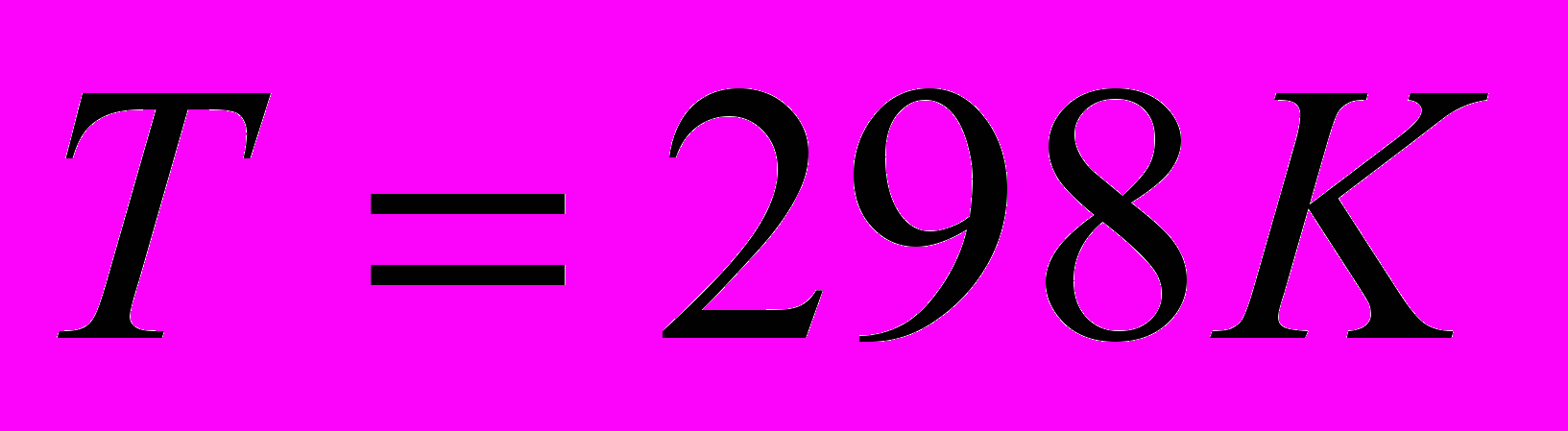 равен
равен 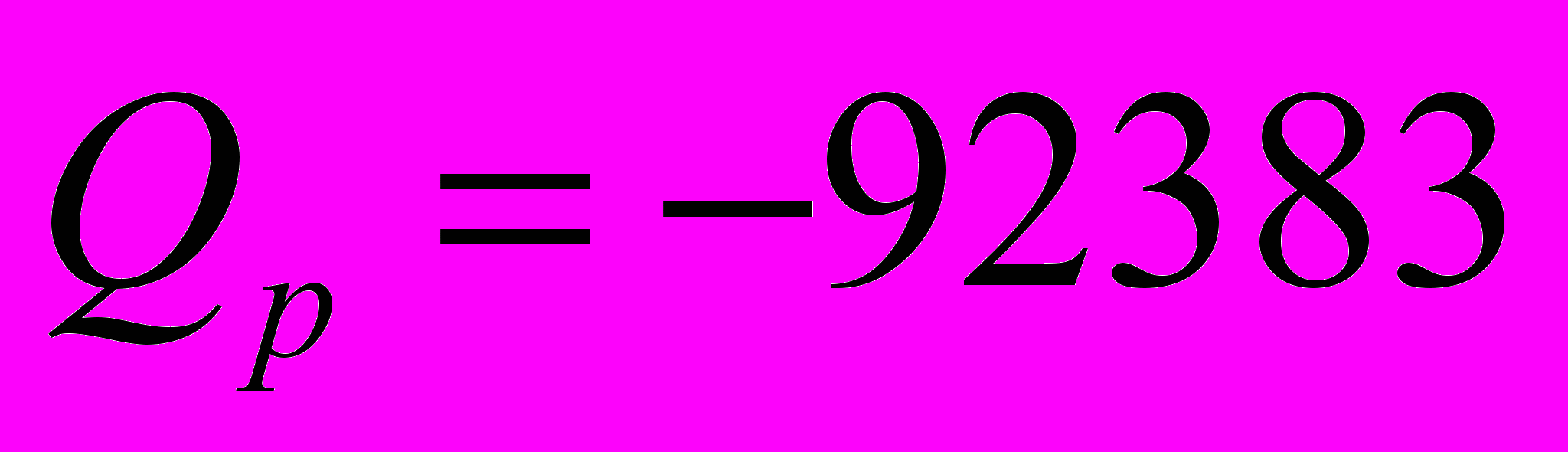
 .
.