Власов андрей Владимирович новые реакции ацилиодидов
| Вид материала | Автореферат |
- Алексеевич Власов, 5007.67kb.
- Андрей Владимирович Курпатов Средство от депрессии, 2074.53kb.
- Фрагменты истории земской статистики, 182.52kb.
- Родькина Елена Федоровна и председатель профсоюзного комитета Сисейкин Андрей Владимирович., 162.91kb.
- Роман Петрович Костюченко, Николай Владимирович Максимович, Сергей Владимирович Мыльников,, 1886.15kb.
- Курс «управление проектами» Авторы: Сооляттэ Андрей Юрьевич (Раздел I) Шулимов Андрей, 6710.07kb.
- Курс «управление проектами» Авторы: Сооляттэ Андрей Юрьевич (Раздел I) Шулимов Андрей, 6709.56kb.
- Ученого Совета Уральского государственного университета имени А. М. Горького программа, 481.82kb.
- Утверждено, 31.45kb.
- Ю. А. Ленина Список литературы Власов В. И., Крапивин О. М. Комментарий к Закон, 119.64kb.
На правах рукописи
ВЛАСОВ
Андрей Владимирович
НОВЫЕ РЕАКЦИИ АЦИЛИОДИДОВ
Специальность 02.00.08 – химия элементоорганических соединений
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Иркутск – 2010
Работа выполнена в Учреждении Российской академии наук
Иркутском институте химии им. А.Е. Фаворского
Сибирского отделения РАН
| Научный руководитель | академик |
| | Воронков Михаил Григорьевич |
| | |
| | |
| | |
| Официальные оппоненты: | доктор химических наук, профессор |
| | Барышок Виктор Петрович |
| | |
| | |
| | доктор химических наук |
| | Руссавская Наталья Владимировна |
| | |
| | |
| | |
| Ведущая организация | Институт органической химии |
| | им. Н. Д. Зелинского РАН |
Защита состоится 22 июня 2010 года в 12 часов на заседании совета по защите докторских и кандидатских диссертаций Д 003.052.01 при Иркутском институте химии им. А.Е. Фаворского СО РАН по адресу:
664033, Иркутск, ул. Фаворского, 1.
С диссертацией можно ознакомиться в библиотеке Иркутского института химии им. А.Е. Фаворского СО РАН.
Автореферат разослан 21 мая 2010 г.
Ученый секретарь совета
д.х.н. Тимохина Л. В.
^ ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Создание новых эффективных реагентов и синтонов, используемых в органическом и элементоорганическом синтезе, издавна являлось одной из ключевых проблем химии. Первый представитель ацилиодидов – бензоилиодид PhCOI был получен в 1832 г. Его простейший аналог ацетилиодид MeCOI был синтезирован четверть века спустя. В последующее столетие эти неустойчивые соединения привлекли мало внимания исследователей, и их препаративные возможности практически оказались нереализованными. За 170 лет насчитывается всего около семидесяти печатных работ, описывающих синтез и свойства ацилиодидов.
Фундаментальные исследования возможности использования ацилиодидов в органическом и элементоорганическом синтезе начались в Иркутском институте химии им. А.Е. Фаворского СО РАН (ИрИХ СО РАН) в 2000 г. научной школой академика М.Г. Воронкова и активно продолжаются в настоящее время. Они инициированы предположением М.Г. Воронкова, что ацилиодиды должны являться альтернативой или эквивалентом триметилиодсилану (Me3SiI), впервые введенному им в 1975 году в качестве реагента в органический и элементоорганический синтез. Нельзя не отметить, что способность расщеплять связи C-O-C и Si-O-C триметилиодсиланом была открыта Воронковым и Худобиным еще в 1956 г.
В начале систематических исследований ацилиодидов в ИрИХ СО РАН М.Г. Воронковым и Н.Н. Власовой был опубликован обзор, исчерпывающе обобщающий уже известные в то время методы их синтеза и физико-химические свойства. К тому времени имелись сведения, указывающие на повышенную ионность связи С-I в RCOI и ее склонность к гомолитическому распаду. Однако, сформировавшиеся к концу XX века представления об электронном строении ацилиодидов и их высокая склонность распадаться на свободные радикалы или диссоциировать на ионы к широкому изучению их реакционной способности не привели.
К настоящему времени систематические фундаментальные исследования, проводимые научной школой академика М.Г. Воронкова, позволили углубленно изучить реакционную способность ацилиодидов при взаимодействии со спиртами, простыми (ациклическими, циклическими и виниловыми) и сложными эфирами, карбоновыми кислотами, органическими и кремнийорганическими аминами, амидами, аминокислотами, замещенными гидразинами, аминосиланами, гексаметилдисилазаном, этоксисилатраном, триорганилсиланами и -германами, этинилсиланами, -германами и -станнанами. Ацилиодиды (АИ) в отличие от других ацилгалогенидов RCOX (X = F, Cl, Br) реагируют с исследованными соединениями значительно легче, при более низкой температуре и в отсутствие катализатора, а во многих случаях и в другом направлении.
В целом, по своей высокой реакционной способности, иодирующему действию и направлению взаимодействия с разнообразными органическими и элементоорганическими соединениями RCOI действительно подобны триметилиодсилану Me3SiI. Однако, более легкая доступность и дешевизна ацилиодидов по сравнению с Me3SiI сулит им более широкое использование в органическом и элементоорганическом синтезе.
^ Цель работы – дальнейшее изучение перспективы использования ацилиодидов в качестве высокоэффективных и специфических и, в то же время, дешевых и доступных реагентов и синтонов в органическом и элементоорганическом синтезе на примере ранее неизученных реакций АИ с некоторыми гетероциклическими соединениями, карбамидом, тиокарбамидом и их N,N'-производными, процессов, протекающих в фотохимических условиях.
Работа выполнена в соответствии с планом НИР Иркутского института химии им. А.Е. Фаворского СО РАН по теме “Si- и С-Функциональные производные тетраэдрического, гипо- и гипервалентного кремния, их аналоги и комплексные соединения микро- и макробиометаллов” (номер государственной регистрации 01200704817). Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант 05-03-32096) и Совета по грантам Президента РФ (НШ 4575.2006.3).
^ Научная новизна и практическая значимость работы. С целью расширения круга исследуемых ацилиодидов RCOI (R = Me, Me(CH2)3, Cl3C, Me3C, FC6H4) разработан способ получения исходных для их синтеза ацилхлоридов RCOCl, основанный на взаимодействии соответствующих карбоновых кислот RCOOH с SiCl4. Установлено, что такое взаимодействие приводит к синтезу RCOCl только в случае RCOOH c рКа > 4.7. Карбоновые кислоты с рК 4.7 реагируют с SiCl4 с образованием соответствующих тетраацетоксисиланов.
Экзотермичная реакция ацетилиодида с пиридином, подобно как и с ацетилхлоридом, протекает как процесс дегидрогалогенирования с образованием иодида пиридиния и кетена. Проведение этого процесса при -10°С в отсутствие растворителя или при -50°С в среде гексана позволило получить ранее неизвестный, весьма реакционноспособный иодид ацетилпиридиния. Последний чрезвычайно легко взаимодействует с метанолом или этанолом с образованием соответствующих алкилацетатов, и с диметилсульфоксидом с выделением исходного пиридина, уксусной кислоты и тиоацетальдегида.
Реакция хинолина с ацетилиодидом как при 20°С, так и при -10°С протекает как процесс дегидроиодирования и приводит к иодиду хинолиния и кетену.
В отличие от этого взаимодействие бензоилиодида как с пиридином, так и с хинолином в тех же условиях сопровождается образованием только иодидов бензоилпиридиния и бензоилхинолиния.
В отличие от ацетилхлорида, который реагирует с карбамидом и тиокарбамидом при нагревании и в присутствии катализатора, ацетилиодид вступает во взаимодействие с аналогичными соединениями уже при комнатной температуре с образованием соответствующих N-ацетилпроизводных.
Реакции ацетилиодида с циклическими карбамидами – имидазолидин-2-оном и 3,4,5,6-тетрагидро-(1Н)-пиримидин-2-оном приводят к иодидам и дииодидам соответствующих N-ацетил- и N,N'-диацетилпроизводных. Реакция MeCOI c N,N'-диметилентиокарбамидом (имидазолидин-2-тион) в среде cерного эфира сопровождается образованием S-аддукта – N,N'-диметиленизотиуроний иодида и является первым примером дегидроиодирования ацетилиодида под влиянием тионной серы.
Взаимодействие ацетилиодида с N,N'-бис-(3-триэтоксисилилпропил)-тиокарбамидом существенно отличается от такового для тиокарбамида и его производных. В этом случае по аналогии с алкил(алкокси)силанами изначально происходит замещение этокси группы у атома кремния на иод. В результате образуется этилацетат и резиноподобный кремнийорганический полимер состава С45Н97N6O14,5S3Si6I, интермедиатом которого является первоначально образующийся N-[3-иод(диэтокси)силилпропил]-N'-(3-триэтоксисилилпропил)]тиокарбамид.
Впервые показано, что фотолиз ацилиодидов RCOI с R = Me, Me2CH, Ph, FC6H4 при их УФ облучении в среде толуола протекает без распада ацильного радикала и является простейшим и эффективным методом синтеза соответствующих α-дикетонов RCOCOR.
Открыта реакция фотохимического ацилирования Фриделя-Крафтса ацилиодидами. В этом направлении, особенно гладко реагирует RCOI при R = Me(CH2)3 и Me3C с толуолом и МеСОI c о- и м-ксилолами.
В отличие от ацетилиодида фотолиз бензоилиодида в среде о- и п-ксилолов не приводит к ацилированию аренов, а сопровождается образованием исключительно дибензоила PhCOCOPh.
Реакция ацетилиодида с галогензамещенными аренами – хлор- и бромбензолом и дибромбензолом в условиях УФ облучения протекает как процесс замещения галогена (Cl, Br) на иод с образованием иодбензола и дииодбензола.
^ Апробация работы и публикации. По результатам работы опубликовано 4 статьи в российских журналах, тезисы 2-х докладов на Всероссийской и Международной конференциях. Результаты работы были представлены на X Молодежной конференции по органической химии (Уфа, 2007), Международной научно-практической конференции “Химия XXI век: новые технологии, новые продукты” (Кемерово, 2008).
^ Объем и структура работы. Диссертационная работа изложена на 102 страницах машинописного текста, содержит 4 таблицы. Первая глава – обзор литературных данных, касающихся особенностей реакционной способности ацилиодидов и триметилиодсилана по отношению к одним и тем же классам органических и элементоорганических соединений. Во второй главе изложены и обсуждены результаты собственных исследований. Третья глава является экспериментальной частью диссертационной работы. Завершают работу выводы и список цитированной литературы (129 ссылок).
^ ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Взаимодействие с азотсодержащими гетероароматическими соединениями
Изучено взаимодействие ацилиодидов RCOI (R = Me, Ph) с пиридином, хинолином, индолом и пирролом. Эти реакции проводились при мольном соотношении реагентов 1:1 и 2:1 как в отсутствие растворителя, так и в среде гексана, при комнатной (20-25°С) и пониженной температурах (-10°С или -50°С).
Установлено, что реакция ацетилиодида с пиридином при 20-25°С в отсутствие растворителя весьма экзотермична (температура реакционной смеси повышается от 20 до 125°С) и протекает по аналогии с ацетилхлоридом RCOCl как процесс дегидрогалогенирования, приводя к иодиду пиридиния (1) и кетену.
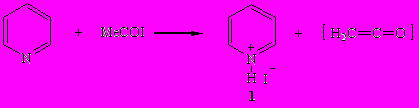
Ранее неизвестный иодид N-ацетилпиридиния (2) удалось синтезировать взаимодействием ацетилиодида с пиридином в отсутствие растворителя при -10÷-5°С и в среде гексана (при -50°С) с выходом 89 и 84% соответственно.
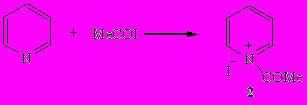
Иодид N-ацетилпиридиния (2) – желтоватые кристаллы, нерастворимые в органических растворителях. В его ИК спектре имеется характеристическая полоса ν (СО) в области 1700 см-1. При комнатной температуре он медленно распадается на кетен и иодид пиридиния (1).
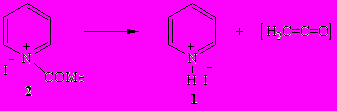
Иодид N-ацетилпиридиния (2) энергично реагирует с метанолом или этанолом в мольном соотношении 1:1 с образованием пиридина, алкилацетата и свободного иодистого водорода.
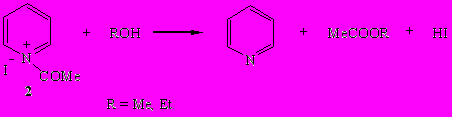
Столь же легко протекает реакция иодида N-ацетилпиридиния (2) и с ДМСО, приводящая в конечном итоге к пиридину, уксусной кислоте и тиоацетальдегиду. Наблюдаемый процесс можно рассматривать как вариант перегруппировки Пуммерера. Промежуточным продуктом этой перегруппировки является метил(иодметил)сульфид, который, отщепляя HI, далее превращается в тииран, изомеризующийся в условиях реакции в тиоацетальдегид (3).
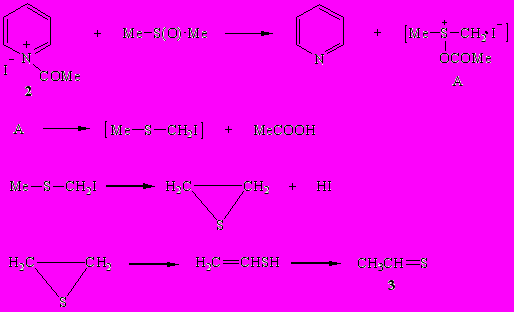
Бензоилиодид, который не способен отщеплять HI, образует с пиридином как при пониженной, так и при комнатной температурах устойчивый иодид N-бензоилпиридиния (4).
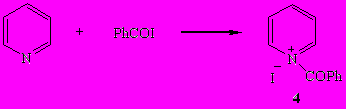
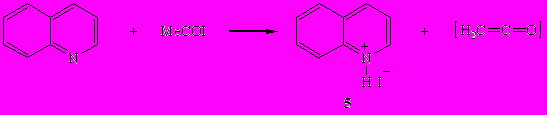
Получить иодид N-ацетилхинолиния взаимодействием ацетилиодида с хинолином во всех изученных условиях не удалось. Как при комнатной, так и при пониженной температурах (-10÷-5°С) продуктами реакции оказались иодид хинолиния (5) и кетен. Иодид хинолиния (5) – гигроскопичное, аморфное вещество, желтого цвета, нерастворимое в органических растворителях.
Бензоилиодид реагирует с хинолином аналогично пиридину, образуя как при комнатной, так и при пониженной температурах иодид N-бензоилхинолиния (6).
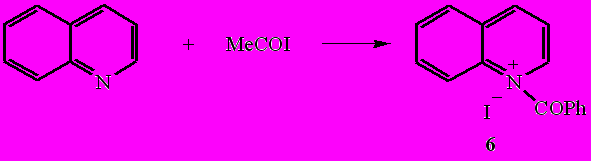
Протекающая уже при комнатной температуре экзотермическая реакция ацетилиодида с индолом, содержащим в отличие от хинолина связь NH в пиррольном цикле приводит к образованию иодида N-ацетилиндолия (7). В ИК спектре образовавшейся соли присутствует характеристическая полоса поглощения ν (СО) в области 1706 см-1.
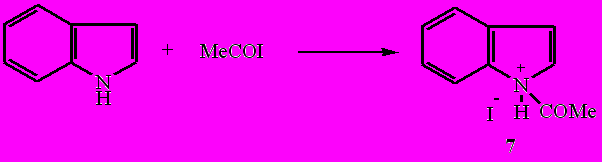
Взаимодействие пиррола с ацетилиодидом в отсутствие растворителя как при 20-25°С, так и при -10÷-5°С сопровождается процессом полимеризации, характерным для пиррола под действием протонных и апротонных кислот.
Состав образующихся порошкообразных полимеров черного цвета, отвечающий брутто-формуле C4H5NI (8), позволяет предположить, что первоначальной стадией реакции является дегидроиодирование ацетилиодида пирролом.
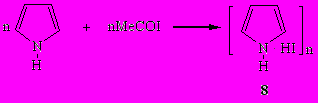
Бензоилиодид реагирует с пирролом в отсутствие растворителя как при комнатной температуре, так и при -10÷-5°С необычайно бурно (реакционная смесь разогревается до 70-115°С). Во всех изученных условиях образуются порошкообразные черные полимеры, нерастворимые в воде и органических растворителях, отвечающие составу С9-11Н8-10NI1-1.5 (9). Это свидетельствует, что полимеризуется первоначально получающийся иодид N-бензоилпирролия [С4H4NHCOPh]+I‾. Повышенное содержание в полимере иода позволяет предположить, что в структуру полимеров включаются и продукты параллельно протекающего иодирования пиррола.
^ 2. Взаимодействие ацетилиодида с карбамидом и тиокарбамидом и их N,N'-производными
Впервые изучена реакция ацетилиодида с карбамидом и тиокарбамидом и рядом их N,N'-производных, а именно имидазолидин-2-оном, 3,4,5,6-тетрагидро-(1Н)-пиримидин-2-оном, N,N'-диметилтиокарбамидом, имидазолидин-2-тионом, 3,4,5,6-тетрагидропиримидин-2-тиолом, а также с бис-N,N'-(3-триэтоксисилилпропил)тиокарбамидом.
Ацетилиодид реагирует с карбамидом и тиокарбамидом в мольном соотношении 1:1 аналогично ацилхлориду, но в отличие от последнего в отсутствие катализатора – серной кислоты. При комнатной температуре исследованные реакции протекают экзотермически и приводят к соответствующим N-ацетилпроизводным (10 и 11) с выходом 85 и 65% соответственно.

Экзотермические реакции ацетилиодида с имидазолидин-2-оном в соотношении 1:1 и 2:1 приводят к кристаллическим соединениям – иодиду N-ацетил-имидазолидин-2 она (12) и дииодиду N,N'-диацетил-имидазолидин-2-она (13).


В отличие от этого взаимодействие ацетилиодида с имидазолидин-2-тионом не носит экзотермический характер, что свидетельствует о меньшей реакционной способности имидазолидин-2-тиона по сравнению с его кислородным аналогом. При взаимодействии MeСOI c имидазолидин-2-тионом в среде cерного эфира, образуется S-аддукт – N,N'-диметиленизотиуроний иодид (14) (86%). Это первый пример дегидроиодирования ацетилиодида под влиянием тионной серы.

Проведение аналогичного процесса в мольном соотношении реагентов 2:1 приводит так же к соединению (14) (88%).
Реакция ацетилиодида с имидазолидин-2-тионом в мольном соотношении 2:1 при 50-60°С сопровождается образованием двух соединений – изомерного S-аддукту (14) N-гидроиодида N,N'-диметилентиокарбамида (15) и дииодида N,N'-диацетил-имидазолидин-2-тиона (16).

Взаимодействие MeCOI с 3,4,5,6-тетрагидро-(1Н)-пиримидин-2-оном и с 3,4,5,6-тетрагидропиримидин-2-тиолом в мольном соотношении 2:1 приводит к образованию дииодидов соответствующих N,N'-диацетилпроизводных (17, 18). При этом дииодид (18) является единственным продуктом как при проведении процесса в отсутствие растворителя при 50-60°С, так и в среде серного эфира при комнатной температуре.


Такое различие в реакционной способности циклических производных тиокарбамида обусловлено природой входящей в их состав сернистой группировки. В случае N,N'-диметилентиокарбамида – это тионная группа C=S, а в случае N,N'-триметилентиокарбамида - тиольная SH.
Реакция ацетилиодида с N,N'-бис-(3-триэтоксисилилпропил)-тиокарбамидом существенно отличается от таковой для тиокарбамида и его производных. В этом случае изначально происходит замещение этокси группы у атома кремния на иод с образованием [N-3-иод(диэтокси)силилпропил-(N'-3-триэтоксисилилпропил)]тиокарбамида (19) и этилацетата.
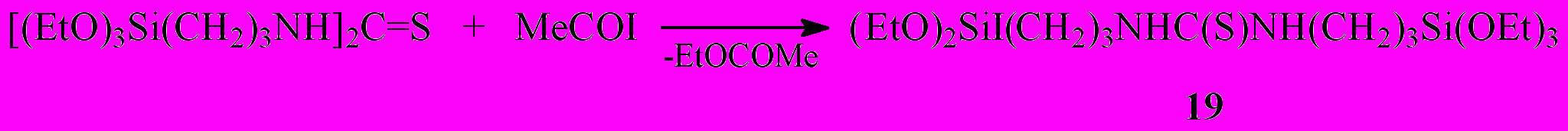
В результате последующих превращений соединения (19) при попытке его перегонки в вакууме, представленных на нижеприведенной схеме, конечным продуктом взаимодействия MeCOI c кремнийорганическим тиокарбамидом является резиноподобный кремнийорганический полимер со следующим соотношением входящих в него элементов С45Н97N6O14.5S3Si6I (24).


Полимер (24) не растворяется, но набухает в органических растворителях и содержит по данным ИК спектроскопии в своем составе фрагменты S=C=N, S-CºN, Si-O-Si.
^ 3. Фотохимические реакции ацилиодидов
3.1. Фотолиз ацилиодидов - новый метод синтеза α-дикетонов
Обнаружено, что фотолиз ацетилиодида MeCOI под влиянием УФ облучения в среде бензола или толуола, являющихся триплетными сенсибилизаторами фотохимических процессов, не сопровождается распадом ацетильного радикала, а приводит к его рекомбинации с образованием диацетила MeCOCOMe (25). При 55-часовом УФ-облучении раствора MeCOI в толуоле диацетил MeCOCOMe (25) был выделен с количественным выходом (93%).
В последующем фотолиз ацилиодидов RCOI с R = Me2CH, Ph, 2-FC6H4 в толуоле позволил синтезировать соответствующие симметричные диацилы RCOCOR с выходом 50-93%, то что является на сегодняшний день одним из самых простых методов синтеза α-дикетонов.
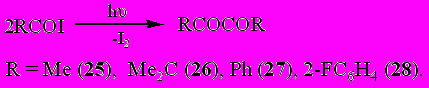
3.2. Фотополиарилирование
При фотолизе ацетилиодида в среде бензола или толуола в течение 19-20 часов наряду с диацетилом также в незначительном количестве образовывались черные, не растворяющиеся в органических растворителях, неплавкие полимеры. При использовании в качестве растворителя бензола состав полимера приближается к брутто формуле С14Н8I2O (29), а в случае толуола – С16Н15IO (30). По данным ИК спектроскопии эти полимеры содержат карбонильные группы. Об этом свидетельствует наличие в ИК спектрах полос с частотой поглощения 1720-1700 см-1.
Оба полимера являются парамагнитными полупроводниками. В их спектрах ЭПР наблюдаются синглетные сигналы с присущей высокомолекулярным соединениям хорошо развитой системой сопряжения. Полимер (29) построен из регулярно чередующихся блоков IC6H2COМе. и IC6H3, а полимер (30) – из фрагментов IC6H2Me и MeC6H2COМе. Концентрация парамагнитных центров в полимере (30) на порядок выше чем в полимере (29) (2.9.1018 и 2.1.1019 сп/г для 30 и 31 соответственно), а проводимость в 2.6 раза ниже (7.7.10-8 и 1.2. 10-10 См/cм для 29 и 30 соответственно). Это различие очевидно вызвано более высоким содержанием иода в полимере (29). Образование полимеров 29 и 30 свидетельствует, что наряду с рекомбинацией ацетильных радикалов, приводящей к диацетилу, протекают и фотохимические процессы иодирования и ацетилирования ацетилиодидом ароматических соединений, сопровождающееся фотохимическим полиарилированием образующихся ацетил- и иодзамещенных аренов.
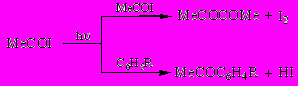
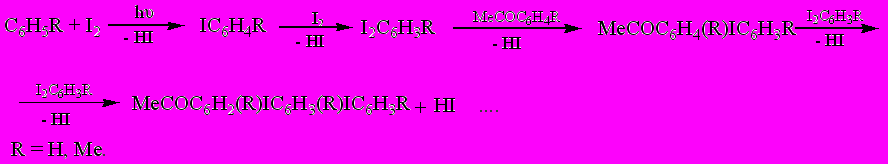
^ 3.3. Фотохимическая реакция Фриделя-Крафтса
Обнаружено, что при фотолизе ацетилиодида в среде о- и м-ксилола, обладающих повышенной π-электронной плотностью, образования диацетила не наблюдается, а протекает процесс ацилирования аренов.
Так, при фотолизе MeCOI в среде о-ксилола в качестве единственного продукта выделен 1-ацетил-2,3-диметилбензол (31) (61%), а в среде м-ксилола - 1-ацетил-2,6-диметилбензол (32) (55%).
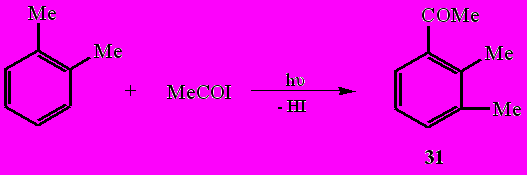
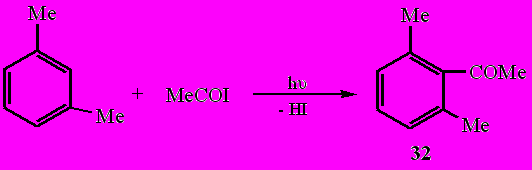
п-Ксилол в изученных фотохимических условиях ацетилиодидом не ацилируется.
Предположение, что ацилирующим агентом в исследованных процессах может служить диацетил, не подтвердилось. При УФ облучении смеси диацетила с о-ксилолом никаких продуктов реакции обнаружить не удалось.
В отличие от ацетилиодида фотолиз PhCOI в среде как о-ксилола, так и п-ксилола сопровождается образованием только соответствующего α-дикетона PhCOCOPh (27).
Наблюдаемое различие в фотохимическом поведении ацетил- и бензоилиодида, по-видимому, обусловлено стерическими факторами, а также большей легкостью рекомбинации бензоильного радикала PhCO˙ за счет большей его стабильности по сравнению с радикалом MeCO˙.
Процесс ацилирования ароматического ядра оказался практически единственным направлением реакции при фотолизе в среде толуола иодангидридов валериановой и триметилуксусной кислот RCOI (R = Bu, Me3C). Однако образующиеся в этом случае соответствующие продукты ацилирования толуола RCOC6H4Me, подвергаются дальнейшим фотохимическим превращениям, среди которых основными являются либо восстановление образующегося кетона (R = Bu) толуолом и выделяющимся иодоводородом, либо фоторасщепление кетона при R = Me3C по Норришу, тип I.
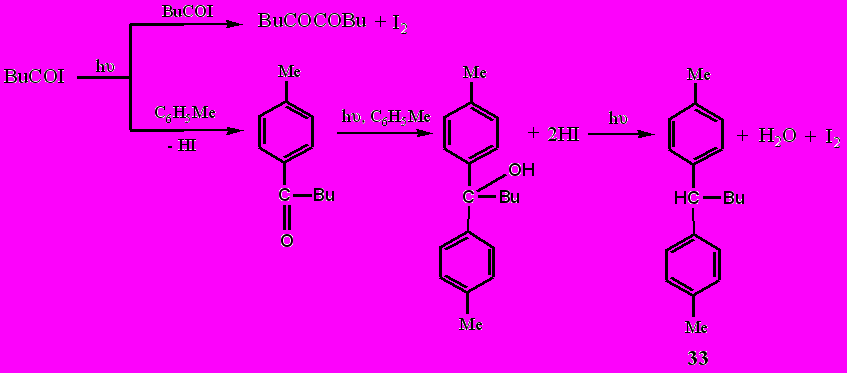
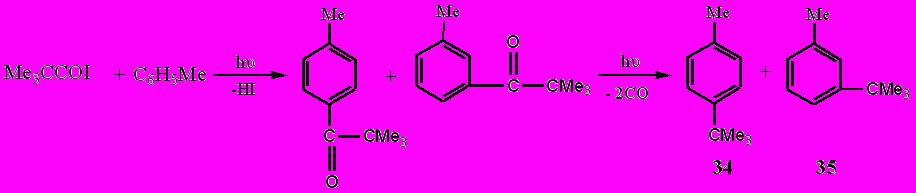
Механизм этих реакций связан с тем, что при возбуждении светом молекул первоначально образующихся кетонов RC(O)Ar (R = Me(CH2)3 и Me3C, Ar = C6H4Me), один электрон неподеленной p-пары кислорода переходит на более высокую разрыхляющую орбиталь π-электронной системы карбонильной группы, которая приобретает бирадикальный характер:
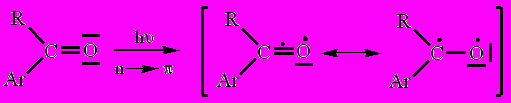 |
Образовавшийся при возбуждении бирадикал далее реагирует двояко, либо с расщеплением связи С-С во фрагменте -С-С(О)-С- и выделением монооксида углерода (α-расщепление или расщепление типа I по Норришу) как в случае R = Me3C, либо с межмолекулярным отрывом водорода от его донора, каковым является толуол, как в случае R = Me(CH2)3.
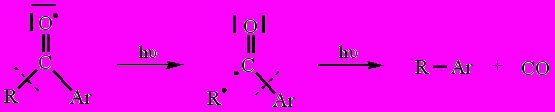 |
^ 6. Фотохимические реакции ацетилиодида с галогенбензолами и бензоилхлоридом
Обнаружено, что при УФ облучении смеси ацетилиодида с галогенбензолами C6H5X (Х = Cl, Br) протекает процесс фотохимического замещения галогена на иод. Так, в случае хлорбензола (Х = Cl, Br) продуктами реакции оказались ацетилхлорид (36) (25%), иодбензол (37) (8%), диацетил (25) (13%). Кроме того, выделяется элементный иод и наблюдается образование нерастворимого в воде и органических растворителях, неплавкого полимерного продукта.
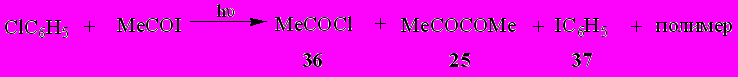
Аналогично протекает взаимодействие ацетилиодида с бромбензолом. При УФ облучении в течение 50 часов эквимолярной смеси MeCOI с C6H5Br из реакционной смеси удалось выделить ацетилбромид (38) (20%), иодбензол (37) (9%) и диацетил (25) (9%).
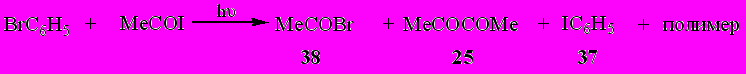
Реакция фотозамещения галогена на иод оказалась единственным направлением взаимодействия ацетилиодида с 1,4-дибромбензолом под влиянием УФ облучения. При этом ранее труднодоступный 1,4-дииодбензол (39) был получен с препаративным выходом - 74%.
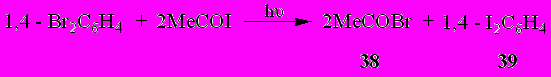
Продуктами взаимодействия под влиянием УФ облучения ацетилиодида с бензоилхлоридом явились бензоилиодид (^ 40) (42%) и ацетилхлорид (41) (62%).
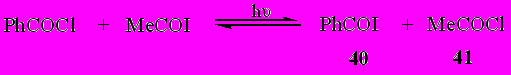
Осуществленная реакция является первым примером фотохимической реакции обмена галогенами между ацилиодидами и ацилхлоридами.
ВЫВОДЫ
Изученные реакции ацилиодидов с ранее неисследованными классами органических соединений и некоторыми их кремнийорганическими аналогами, а также осуществленные фотохимические превращения RCOI еще раз убедительно продемонстрировали высокую и специфическую реакционную способность ацилиодидов, схожую с реакционной способностью триметилиодсилана и отличающую их от других ацилгалогенидов RCOX (X = F, Cl, Br), и тем самым подтвердили перспективность их использования в качестве иодирующих, ацилирующих и деоксигенирующих реагентов.
- Ацетилиодид реагирует с карбамидом и тиокарбамидом при комнатной температуре в мольном соотношении 1:1 аналогично ацетилхлориду с образованием N-ацетилпроизводных, но в отличие от MeCOCl в отсутствие катализатора – серной кислоты. Реакция ацетилиодида с тиокарбамидом, осуществляемая при охлаждении (-5÷0С), приводит к соответствующему S-ацетилпроизводному – иодиду S-ацетилизотиурония.
- В отличие от имидазолидин-2-она, реакция ацетилиодида с которым в соотношении 1:1 и 2:1 протекает с образованием иодида N-ацетил-имидазолидин-2-она и дииодида N,N'-диацетил-2-имидазолидин-2-она, при взаимодействии MeCOI c имидазолидин-2-тионом в среде cерного эфира образуется S-аддукт – N,N'-диметиленизотиуроний иодид. Этот процесс является первым примером дегидроиодирования ацетилиодида под влиянием тионной серы.
- N,N'-бис-(3-триэтоксисилилпропил)тиокарбамид, в отличие от тиокарбамида и его органических аналогов – N,N'-диметилтиокарбамида, N,N'-диметилентиокарбамида, N,N'-триметилентиокарбамида, изначально взаимодействует с ацетилиодидом аналогично тому, как реагирует MeCOI с алкил(алкокси)силанами, с замещением этокси группы у атома кремния на иод, приводящим к выделению этилацетата и образованию [N-3-иод(диэтокси)силилпропил-(N'-3-триэтоксисилилпропил)]тиокарбамида. Последний термически лабилен и дальнейшие его превращения при нагревании - расщепление, поликонденсация, приводят в конечном итоге к образованию резиноподобного кремнийорганического полимера состава С45Н97N6O14.5S3Si6I.
- Реакция ацетилиодида с пиридином и хинолином как при комнатной, так и при пониженной (-10÷-5°С) температурах протекает по аналогии с ацетилхлоридом как процесс дегидрогалогенирования MeCOI с выделением кетена и образованием твердых, нерастворимых в органических растворителях иодидов пиридиния и хинолиния. Бензоилиодид, не способный к отщеплению HI, образует и с пиридином, и с хинолином как при пониженной, так и при комнатной температурах, устойчивые иодиды бензоилпиридиния и бензоилхинолиния.
- Иодид ацетилпиридиния удалось синтезировать с количественным выходом взаимодействием ацетилиодида с пиридином при -10÷-5°С в отсутствие растворителя или при (-50°С) в среде гексана. Иодид ацетилпиридиния оказался эффективным ацилирующим деоксигенерирующим реагентом. Это было установлено на примере его реакций с метанолом и диметилсульфоксидом, приводящим к выделению пиридина и образованию алкилацетатов, а также уксусной кислоты и тиоацетальдегида соответственно.
- Впервые установлено, что фотолиз ацетилиодида под влиянием УФ облучения в среде ароматических углеводородов (бензол, толуол) не сопровождается расщеплением ацетильного радикала МеСО˙, а приводит к рекомбинации радикалов с образованием диацетила МеСОСОМе. Этот процесс явился новым методом синтеза симметричных алифатических и ароматических α-дикетонов RCOCOR, где R = Me, Me2CH, Ph, C6H4F, с выходом 49-93%.
- Обнаружено, что ацилиодиды могут вступать в реакцию фотохимического ацилирования ароматических углеводородов. Предпочтительность протекания такого процесса обусловливается как строением исходного ацилиодида, так и природой арена. Так, процесс ацилирования толуола явился практически единственным направлением фотохимических превращений в его среде иодангидридов триметилуксусной и валериановой кислот RCOI (R = Ме3C и Ме(CH2)3). Фотолиз ацетилиодида в среде о- и м-ксилола, в отличие от его фотолиза в среде бензола или толуола, не сопровождается рекомбинацией ацетильного радикала с образованием диацетила, а приводит лишь к продуктам ацилирования ксилола - 1-ацетил-2,3-диметилбензолу и 1-ацетил-2,6-диметилбензолу.
- Взаимодействие ацетилиодида с хлор- и бромбензолом под влиянием УФ облучения протекает по аналогии с галогенсодержащими гетероароматическими соединениями как процесс фотохимического замещения атомов галогена на иод. Фотохимическая реакция ацетилиодида с 1,4-дибромбензолом явилась удобным препаративным методом синтеза ранее труднодоступного 1,4-дииодбензола.
- С целью разработки метода синтеза ацилхлоридов - исходных соединений для получения ацилиодидов, изучено взаимодействие карбоновых кислот с четыреххлористым кремнием. Установлено, что исследованная реакция может быть использована в качестве эффективного способа получения RCOCl на основе карбоновых кислот с рКа > 4.7.
Основные результаты диссертационной работы изложены в следующих публикациях:
- Воронков М.Г., Белоусова Л.И., Власов А.В., Власова Н.Н. Метод синтеза симметричных α-дикетонов // ЖОрХ. – 2008. – Т. 44, вып. 6. – С. 936.
- Воронков М.Г., Власова Н.Н., Григорьева О.Ю., Белоусова Л.И., Власов А.В. Ацилиодиды в органическом синтезе. Взаимодействие ацетилиодида с карбамидом, тиокарбамидом и их N,N'-производными // ЖОрХ. – 2009. – Т. 45, вып. 4. – С. 501-505.
- Воронков М.Г., Власова Н.Н., Власов А.В., Белоусова Л.И., Григорьева О.Ю., Албанов А.В., Мячина Г.Ф., Вакульская Т.И. Ожидаемые и неожиданные фотохимические реакции ацилиодидов // ЖОрХ. – 2009. – Т. 45, вып. 11. – С. 1627-1631.
- Воронков М.Г., Власов А.В., Белоусова Л.И., Григорьева О.Ю., Власова Н.Н. О взаимодействии карбоновых кислот с SiCl4 // ЖОрХ. – 2010. - Т. 46, вып. 3. – С. 327-329.
- Власов А.В., Власова Н.Н., Воронков М.Г. Особенности взаимодействия ацилиодидов с азотсодержащими гетероциклами // Тез. докл. X Молодежной конференции по органической химии. – Уфа, 2007. – С. 125.
- Воронков М.Г., Рахлин В.И., Цырендоржиева И.П., Белоусова Л.И., Григорьева О.Ю., Власов А.В., Власова Н.Н. Ацилиодиды – новые реагенты и синтоны для органического и элементоорганического синтеза // Тез. докл. ХI Международной научно-практической конференции «Химия-ХХI век: новые технологии, новые продукты». – Кемерово, 2008. – С. 63.
