А. В. Кравченко Федеральный научно-методический центр профилактики и борьбы со спид мз рф, Москва
| Вид материала | Документы |
- План мероприятий в рамках Всемирной кампании против спид и Всемирного дня профилактики, 356.99kb.
- Целевая программа борьбы со спид, профилактики вирусных гепатитов и внутрибольничных, 64.05kb.
- План мероприятий в рамках Всемирной кампании против спид и Всемирного дня профилактики, 885.74kb.
- План мероприятий в рамках Всемирной кампании против спид и Всемирного дня профилактики, 849.65kb.
- План мероприятий в рамках Всемирной кампании против спид и Всемирного дня профилактики, 897.38kb.
- План мероприятий в рамках Всемирной кампании против спид и Всемирного дня профилактики, 669.68kb.
- План мероприятий Пинского колледжа уо «Бр. Гу им. А. С. Пушкина» по профилактике спид, 36.68kb.
- Лауреаты XIX международного фестиваля «зодчество-2011» гран-при фестиваля – российская, 317.13kb.
- Лауреаты XIX международного фестиваля «зодчество-2011» гран-при фестиваля – российская, 340.62kb.
- Развитие региональной методической службы, 18.25kb.
ТЕРАПИЯ ХРОНИЧЕСКОГО ГЕПАТИТА С
У БОЛЬНЫХ ВИЧ-ИНФЕКЦИЕЙ
А.В. Кравченко
Федеральный научно-методический центр профилактики и борьбы со СПИД МЗ РФ, Москва
Развитие эпидемии ВИЧ-инфекции в России в последние годы было, в первую очередь, связано с ее широким распространением среди лиц, использующих внутривенное введение наркотиков. Одновременно с вирусом иммунодефицита человека в данной популяции распространялись вирусы гепатитов с парентеральным механизмом передачи (В, С и D). Частота обнаружения маркеров вирусных гепатитов у больных ВИЧ-инфекцией зависит от принадлежности пациентов к той или иной группе риска. Так, антитела к вирусу гепатита С (анти-HCV) обнаруживают, в среднем, у 30% ВИЧ-инфицированных в странах Европы и Северной Америки. В тоже время, в Испании анти-HCV выявляют почти у 90% больных ВИЧ-инфекцией, что связано с преобладанием лиц, использующих внутривенное введение психоактивных веществ [1]. На территории России анти-HCV находили у 75-95% лиц, заразившихся ВИЧ при внутривенном введении психоактивных препаратов. По данным В.Г. Канестри и соавт., у 98,5% ВИЧ-инфицированных жителей Московского региона, имеющих анти-HCV, обнаруживали РНК HCV (вирус гепатита С) [2]. Несколько реже (78,8%) регистрировали РНК HCV другие авторы, изучавшие распространение HCV-инфекции среди ВИЧ-инфицированных лиц в различных регионах России [3].
Основные принципы лечения хронического гепатита С (ХГС) у больных ВИЧ-инфекцией соответствуют таковым у пациентов, не зараженных вирусом иммунодефицита человека. Вместе с тем необходимость использования комбинированной антиретровирусной терапии для лечения ВИЧ-инфекции, а также лечение и профилактика оппортунистических заболеваний, определяют целый ряд особенностей терапевтических подходов у больных смешанной инфекцией (ВИЧ и хронический вирусный гепатит).
На бессимптомной стадии ВИЧ-инфекции подходы к лечению ХГС аналогичны схемам, применяемым для терапии этого заболевания как моноинфекции. При смешанной инфекции (ВИЧ + ХГС) показана эффективность использования комбинации интерферона-альфа и рибавирина, которая, в первую очередь, определялась исходным уровнем РНК HCV и генотипом вируса гепатита С.
В настоящее время завершается исследование, в котором в составе комбинированной терапии ХГС используется рибавирин отечественного производства (Веро-рибавирин). Стойкий полный эффект 24-недельной противовирусной терапии (после 24-недельного периода наблюдения) был зарегистрирован у 86% больных с не 1 генотипом HCV. В группе пациентов, хуже поддающихся лечению (генотип 1 с исходно высокой вирусной нагрузкой), вирусологический ответ после 48-недельной противовирусной терапии был достигнут в 33,3% случаев. Это позволяет констатировать, что эффективность Веро-рибавирина в схемах комбинированного лечения ХГС сопоставима с международными данными. Кроме того, применение Веро-рибавирина целесообразно с экономической точки зрения, что делает терапию ХГС доступной для пациентов различных социальных слоев.
Противоречивы результаты использования для лечения больных HCV-инфекцией схем, содержащих интерферон-альфа и ремантадин или амантадин. Так, по данным Berg T., применение схемы, включающей три препарата (интерферон-альфа, рибавирин и амантадин) у пациентов ХГС, ранее не получавших лечения, было более эффективно чем у больных, получавших только 2 препарата (интерферон-альфа и рибавирин) [4]. Однако добавление амантадина к терапевтической схеме, содержащей пролонгированный интерферон и рибавирин, существенно не влияло на результаты лечения [5]. По нашим данным, после окончания 12-месячного курса терапии интерфероном-альфа-2а и ремантадином РНК HCV не обнаруживали у 60,9% пациентов (у больных не с 1 генотипом HCV и умеренной концентрацией РНК HCV - в 70% случаев), а стойкий терапевтический эффект (отсутствие РНК HCV через 6 месяцев после окончания лечения) имел место у 38% пациентов [6]. Эти результаты были сопоставимы с данными Dieterich D. И соавт., полученными при использовании схем, включающих интерферон-альфа и рибавирин, у больных смешанной инфекцией ВИЧ + гепатит С - 40% устойчивого ответа [7]. В последние годы для лечения ХГС с успехом применяют схемы, включающие пролонгированный интерферон - интерферон-альфа, связанный с полиэтиленгликолем (ПЭГ), в сочетании с рибавирином. В настоящее время в России зарегистрированы 2 формы пролонгированного интерферона-альфа (ПегИнтерферон) - ПегИнтерферон-альфа-2а (Пегасис) и ПегИнтерферон-альфа-2b (Пег-Интрон). Стойкий вирусологический эффект при терапии гепатита С был отмечен у 40-80% пациентов, получавших ПегИнтерферон и рибавирин. Исследований, посвященных использованию комбинации ПегИнтерферонов и рибавирина для лечения гепатита С у больных ВИЧ-инфекцией, пока немного и продолжительность их не превышает одного года. Предварительные результаты (через 24-48 недель лечения) свидетельствуют о неплохой эффективности данной схемы у больных смешанной инфекцией. Так, по данным Voigt Е., у 15 из 32 пациентов (47%) со смешанной инфекцией (ВИЧ+ХГС) уровень РНК HCV через 24-48 недель терапии (пациенты с 2 и 3 генотипами получали лечение 24 недели) ПегИнтерфероном-альфа-2b (1,5 мкг/кг) и рибавирином (800 мг/сут) был ниже порога определения (500 копий/мл). При этом у 4 больных был 1 генотип вируса гепатита С, а у 11 - 2 или 3. Проводимая терапия существенно не влияла на уровень РНК ВИЧ, хотя было отмечено некоторое снижение абсолютного содержания CD4-лимфоцитов [8]. Pol S. и соавт. приводят данные сравнительного исследования эффективности и безопасности стандартного интерферона-альфа (3 млн. ЕД 3 раза в неделю - 1 группа) и ПегИнтерферона-альфа-2b (1,5 мг/кг в неделю - 2 группа). В обеих группах введение интерферона сочетали с приемом рибавирина (800 мг/сут). В исследование было включено 416 пациентов (79% внутривенные потребители психоактивных веществ, 80% - получали высокоактивную антиретровирусную терапию - ВААРТ). Среднее число CD4-лимфоцитов составляло 515 клеток в 1 мм3. Через 48 недель лечения у 27% пациентов 1 группы и 44% - 2 группы в крови не обнаруживали РНК HCV. При этом у пациентов, получавших ПегИнтерферон и имевших 1 или 4 генотип вируса гепатита С, вирусологическая эффективность терапии составила всего 19% (при 2 или 3 генотипе - 57%). 30% пациентов прервало лечение, причем 24% (42 больных из группы интерферона, 57 - из группы ПегИнтерферона) - в связи с серьезными нежелательными явлениями [9]. В другом исследовании применяли ПегИнтерферон-альфа-2а в дозе 180 мкг/нед в сочетании с рибавирином [10]. 144 пациента были рандомизированы на 2 группы. Больные первой группы (70 человек) получали рибавирин в дозе 800 мг/сут, а второй (74 человека) - 1000 мг/сут. До начала лечения у всех пациентов число CD4-лимфоцитов было более 200 клеток в 1 мм3. ВААРТ получали 74% пациентов первой группы и 87% - второй. Через 24 недели лечения уровень РНК HCV ниже порога определения (50 МЕ/мл) наблюдали у 55% больных первой группы и 63% - второй. Среди пациентов, имевших 2-3 генотип вируса гепатита С, после 24 недель лечения не регистрировали РНК HCV в 87% случаев, а имевших 1 или 4 генотип - в 47% и 52%, соответственно. Переносимость лечения была неплохой, поскольку лишь 9 больных прервали лечение (6%) из-за развития нежелательных явлений. У 94% пациентов с такими явлениями их течение было легким или средне-тяжелым. В связи с развитием побочных реакций в процессе терапии доза ПегИнтерферона была уменьшена у 29% больных, а доза рибавирина - у 17% [10]. С апреля 2001 г. в США начаты многоцентровые клинические испытания эффективности ПегИнтерферона-альфа-2а в сочетании с рибавирином для лечения больных смешанной инфекцией. В исследование было включено 840 пациентов, и в конце 2003 г. ожидаются сообщения о его первых результатах.
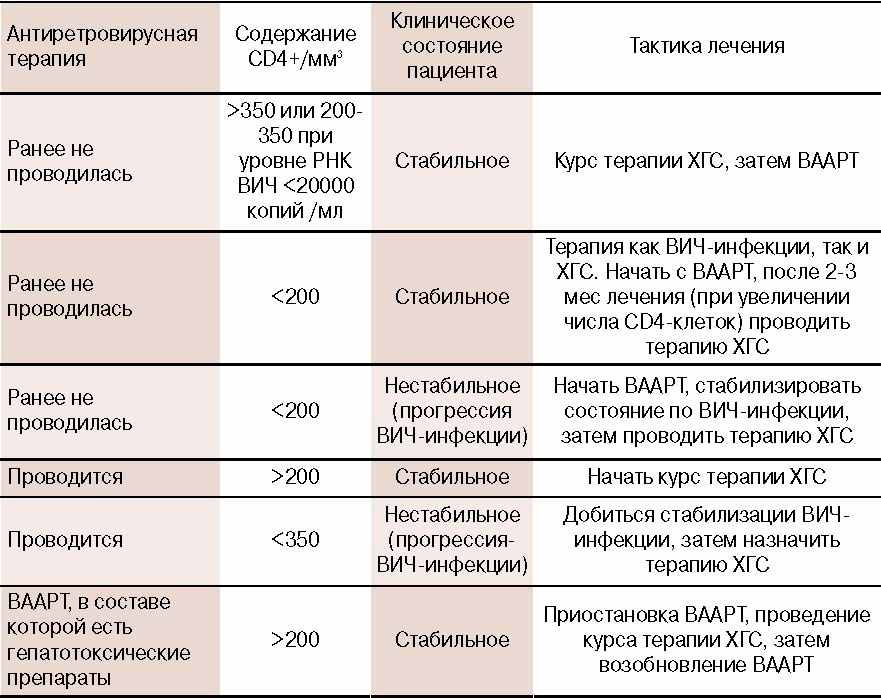
Состоявшаяся 18 апреля 2002 г. в Париже встреча экспертов определила тактику обследования и лечения больных HCV-инфекцией, в т.ч. при ее сочетании с ВИЧ-инфекцией (рис.) [11].
В соответствии с последней редакцией международных рекомендаций по проведению ВААРТ (14 июля 2003 г.), лечение больных ВИЧ-инфекцией необходимо начинать, если имеются клинические симптомы, свидетельствующие об иммунодефиците, либо при снижении числа CD4-лимфоцитов ниже 200 в 1 мм3 или увеличении уровня РНК ВИЧ выше 55000 копий в 1 мл (метод ПЦР). Если у больных бессимптомной ВИЧ-инфекцией количество CD4-лимфоцитов колеблется в пределах 200-350 клеток/мм3, то большинство специалистов полагают, что антиретровирусную терапию следует начинать при уровне РНК ВИЧ выше 20 000 копий/мл [12].
Таким образом, если у больного ВИЧ-инфекцией и хроническим гепатитом имеются клинические проявления вторичных заболеваний или существенное снижение числа CD4-клеток, перед клиницистами встает проблема подбора оптимальной схемы антиретровирусной терапии и ее сочетания с лечением хронического гепатита.
Благодаря проведению ВААРТ летальность больных ВИЧ-инфекцией вследствие оппортунистических заболеваний, начиная с 1998 г., существенно снизилась. Вместе с тем заметно возрос процент ВИЧ-инфицированных пациентов, летальный исход у которых был обусловлен хроническими заболеваниями печени ( ссылка скрыта).
Развитие гепатотоксичности при ВААРТ связано со всеми группами антиретровирусных препаратов. Использование нуклеозидных ингибиторов обратной транскриптазы (НИОТ - зидовудин, зальцитабин, ставудин, диданозин) ассоциируется с развитием митохондриальной токсичности, которая в тяжелых случаях может привести к поражению печени. Применение ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ - ифавиренц и невирапин) обусловливает повышение уровней аминотрансфераз у 8-16% пациентов. При использовании ингибиторов протеазы (ИП) гепатотоксичность 3 и 4 степени наиболее часто (30%) отмечается при лечении ритонавиром в стандартной дозировке (1200 мг/сут), поскольку этот препарат является мощным ингибитором цитохрома Р450 3А4 ( ссылка скрыта).
Альтернативной схемой ВААРТ является комбинация, состоящая из двух НИОТ (зидовудин или ставудин + ламивудин) и ИП ВИЧ нелфинавира. Применение «усиленных» ИП, т.е. сочетания ритонавира в дозе 100-200 мг/сутки с другим ИП (саквинавир, индинавир, лопинавир, ампренавир) может существенно уменьшить токсический эффект этого препарата [13].
При применении схемы ВААРТ, включавшей тимазид + хивид + саквинавир в твердых капсулах (Инвираза), мы не наблюдали существенного увеличения частоты регистрации повышенного уровня активности АлАТ. Так, если до начала терапии уровень АлАТ выше 100 МЕ/л отмечался у 6,3% пациентов, то спустя 1, 2 и 4 месяца лечения - у 3,1%, 7,1% и 3,6%, соответственно [14]. По данным Rodriguez-Rosado R. и соавт., риск повышения уровней аминотрансфераз у больных ВИЧ-инфекцией после начала ВААРТ, включавшей ИП, при наличии хронического гепатита В (ХГП) и ХГС соответственно в 2,5 и 3 раза выше, чем у пациентов без хронического вирусного поражения печени [15]. Авторы выделяют несколько возможных механизмов, объясняющих повышение уровней аминотрансфераз: 1) низкая приверженность пациентов к лечению и соответственно недостаточная эффективность терапии; 2) токсическое действие лекарственных препаратов; 3) улучшение показателей клеточного иммунитета, что может обусловить активацию HBV инфекции.
Необходимо с осторожностью включать в схему ВААРТ препараты из группы ННИОТ. Так, в спектре нежелательных эффектов ифавиренца присутствуют нарушения психики, что может усугублять расстройства психической деятельности, обусловленные приемом психоактивных веществ, а также (в 8% случаев) повышение активности аминотрансфераз. Увеличение уровней АсАТ и АлАТ характерно и при использовании в составе ВААРТ невирапина (16%) [16]. Однако при суммарной оценке результатов 12 исследований (761 пациент) схем ВААРТ, включавших невирапин, частота повышения уровня АсАТ и АлАТ составила 9,2%, а прекращения лечения вследствие поражения печени - 2,9% [17].
Под нашим наблюдением находилось 25 ВИЧ-инфицированных пациентов, которые в течение 6 месяцев получали ВААРТ, включавшую 2 НИОТ (фосфазид и диданозин) и ННИОТ (невирапин). У 12 больных имел место ХГВ или ХГС. Оценка изменений средних значений и медианы уровней АсАТ и АлАТ в процессе лечения не позволила выявить их существенных колебаний.
Вместе с тем увеличение уровней АсАТ и АлАТ 3-4 степени выраженности (в 5-10 и более чем в 10 раз выше верхней границы нормы) через 3 месяца лечения было зарегистрировано у 7 пациентов (28%). Возможно, повышение уровней АсАТ и АлАТ было обусловлено терапией невирапином. Следует учитывать, что у 5 из 7 больных до начала лечения имел место ХГВ или ХГС, а 4 пациента перед регистрацией повышенных уровней ферментов употребляли алкоголь [18].
Ряд исследователей считает, что с увеличением длительности ВААРТ возрастает гепатотоксичность препаратов. Так, при длительности ВААРТ менее 2 лет повышение уровня АлАТ имело место у 42% больных смешанной инфекцией (ВИЧ + ХГС), а при использовании ВААРТ более 2 лет - у 67%. Отметим, что у пациентов без ХГС увеличение уровня АлАТ на фоне ВААРТ регистрировали в 2 раза реже (33%) [19].
По нашим данным, применение «усиленных» ИП ВИЧ в минимальной степени сказывается на уровне аминотрансфераз. Так, у 25 пациентов, получавших лечение «усиленным» ИП (саквинавир - 1600 мг/сутки + ритонавир - 100 мг/сутки) и 2 НИОТ (фосфазид и диданозин), через 24 недели терапии повышение уровней АсАТ и АлАТ до 3 степени выраженности отмечалось лишь в 10% случаев, причем у всех больных имел место ХГВ или ХГС [20].
По мнению Bartlett и соавт., наиболее безопасная схема ВААРТ для лечения пациентов со смешанной инфекцией (ВИЧ + ХГС) включает ламивудин, ставудин и нелфинавир [21]. Проведя оценку безопасности ВААРТ, включающей ИП ВИЧ, у 1052 таких пациентов, Dieterich D. и соавт. установили, что повышение уровня АлАТ до 3-4 степени токсичности было зарегистрировано у 4% больных, получавших нелфинавир, и у 8% - другие ингибиторы протеазы ВИЧ (индинавир, ритонавир, саквинавир, ампренавир) [22].
Эффективность ВААРТ у больных ВИЧ-инфекцией без ХГС существенно выше, чем у лиц со смешанной инфекцией. Клиническую прогрессию ВИЧ-инфекции, несмотря на проведение ВААРТ в течение 3 лет, наблюдали только у 10% больных без ХГС, тогда как у пациентов со смешанной инфекцией - в 15% (при прекращении приема наркотиков) и в 20% (при продолжении инъекций психоактивных веществ). Авторы отмечают, что, несмотря на снижение содержания РНК ВИЧ ниже уровня определения, у больных смешанной инфекцией повышение числа CD4-лимфоцитов в результате ВААРТ менее существенно, чем у пациентов только с ВИЧ-инфекцией [23].
В настоящее время нет убедительных данных об эффективном подавлении репликации HCV антиретровирусными препаратами, и большинство исследователей считают, что ВААРТ существенно не влияет на уровень РНК HCV и индекс гистологической активности [24].
Пациентам со смешанной инфекцией (ВИЧ + ХГС) интерферонотерапия проводится в соответствии с имеющимися рекомендациями по лечению ХГС.
Как и любой другой лекарственный препарат, интерферон-альфа может вызывать нежелательные реакции. Снижение количества лейкоцитов и тромбоцитов, обусловленное подавлением пролиферации клеток-предшественников гемопоэза - одно из наиболее существенных нежелательных явлений для больных ВИЧ-инфекцией, у которых лейкопения может сопровождаться гранулоцитопенией, являющейся причиной развития бактериальных инфекций. Поэтому ряд исследователей предлагает использование гранулоцитарного колонии-стимулирующего фактора (G-CSF) при развитии нейтропении у больных ВИЧ-инфекцией, получавших ПегИнтерферон-альфа-2b по поводу хронического гепатита [25].
При длительном лечении интерфероном у 10-20% больных наблюдаются снижение массы тела, анорексия, бессонница, депрессия, чувство постоянной усталости, боли в мышцах, головные боли, алопеция. Токсический эффект интерферона на ЦНС в виде психопатологических реакций чаще отмечается при лечении ВИЧ-инфицированных больных [16]. Особое внимание необходимо уделять пациентам, продолжающим внутривенно применять психоактивные вещества. В последнее время исследователями описаны нарушения цветоощущения, появление на сетчатке ватообразных очагов и геморрагий у больных ВИЧ-инфекцией, получавших терапию ПегИнтерфероном-альфа-2b и рибавирином [26]. Большинство побочных реакций исчезают при уменьшении дозы применяемого препарата или его полной отмене.
Необходимо отметить, что по мере прогрессирования иммунодефицита у больных ВИЧ-инфекцией эффективность интерферонотерапии существенно снижается. Так, по данным Seqane А. и соавт., эффективность лечения больных смешанной инфекцией (ВИЧ + ХГС) интерфероном-альфа существенно снижалась у пациентов с числом CD4+ лимфоцитов менее 400 клеток в 1 мм3 (с 33,3% до 10%) [27]. Сходные данные приводят и исследователи, изучавшие у больных ВИЧ-инфекцией эффективность терапии интерфероном-альфа саркомы Капоши. Так, согласно данным Webster G.F., при уровне СD4-клеток выше 200 в 1 мм3 положительный эффект интерферона-альфа в этой группе пациентов составил 40%, а при содержании CD4+ лимфоцитов менее 200 в 1 мм3 - не более чем у 15% больных [28].
Одним из возможных механизмов снижения эффективности интерферонотерапии у больных ВИЧ-инфекцией является возрастание антиинтерфероновой активности по мере прогрессирования иммунодефицита. Проведенное нами исследование показало, что у больных ВИЧ-инфекцией с уровнем CD4+ лимфоцитов менее 350 клеток в 1 мм3 частота обнаружения антиинтерфероновой активности лейкоцитов периферической крови была в 2 раза выше, чем у пациентов с более высоким содержанием CD4-клеток [29].
В этой связи тактика лечения ХГС выбирается исходя из сведений о предшествующем лечении и состоянии пациента ( ссылка скрыта) [30]. При непереносимости рибавирина назначают монотерапию интерфероном, предпочтительнее ПегИнтерфероном.
Таким образом, основой лечения ХГС у больных ВИЧ-инфекцией является комбинация интерферона-альфа (предпочтительнее ПегИнтерферона) и рибавирина. Использование рибавирина повышает терапевтический эффект интерферона в 2-3 раза. Однако параллельно возрастает и частота побочных эффектов. Чаще всего развивается гемолиз эритроцитов, который обратим после отмены рибавирина. В связи с развитием гемолиза примерно у 10% больных приходится снижать дозу или отменять препарат. Сочетанное применение рибавирина со схемой ВААРТ, включающей азидотимидин, может увеличить частоту развития анемии - одной из наиболее частых побочных реакций, наблюдающихся при приеме последнего. Кроме того, ряд исследователей обращает внимание на возможное снижение эффективности азидотимидина, ставудина и зальцитабина при их одновременном применении с рибавирином [31], хотя в клинической практике этот препарат не оказывает существенного влияния на эффективность ВААРТ [19].
Дозировки интерферона-альфа при его сочетании в ВААРТ не отличаются от рекомендуемых для лечения ХГС как моноинфекции. Возможной альтернативой схемам, включающим интерферон-альфа и рибавирин, являются схемы, содержащие интерферон-альфа и ремантадин. При обнаружении в крови ВИЧ-инфицированного пациента высокой концентрации РНК HCV 1 генотипа, ряд исследователей считает целесообразным использовать тройную комбинацию препаратов: интерферон-альфа, рибавирин и ремантадин [32].
Помимо трудностей, с которыми врач сталкивается при определении оптимальной схемы ВААРТ и сочетании ее с лечением хронического гепатита, серьезной проблемой являются тяжелые вторичные заболевания, развивающиеся на поздних стадиях ВИЧ-инфекции (стадия СПИДа по классификации ВОЗ) и также ассоциирующиеся с поражением печени (микобактериальная, кандидозная, цитомегаловирусная и другие инфекции, онкологические заболевания). Применение препаратов для их лечения (противотуберкулезные, противогрибковые и др.) может стать еще одной причиной развития гепатита.
Таким образом, у больных ВИЧ-инфекцией лечение хронических вирусных гепатитов целесообразно начинать как можно раньше от момента постановки этого диагноза, который должен быть подтвержден не только обнаружением в крови РНК HCV или ДНК HBV и стойким повышением активности аминотрансфераз, но и результатами гистологического исследования биоптата печени. При постановке ВИЧ-инфицированного лица на учет в территориальном центре профилактики и борьбы со СПИДом необходимо обследовать пациента на серологические маркеры вирусных гепатитов В, С и D, а при обнаружении последних и стойкой гиперферментемии провести исследование при помощи метода полимеразной цепной реакции с целью обнаружения в крови генетического материала этих вирусов.
ЛИТЕРАТУРА
- De Romero J, Clavo P, Garcia S, et al. Prevalence of hepatitis C virus infection among two groups with HIV risk behaviors in Madrid (Spain). XIII International AIDS Conference. Durban, South Africa, 2000. Abstr. WePeC4452.
- Канестри В.Г., Кравченко А.В., Тишкевич О.А. и соавт. Хронический гепатит С у ВИЧ-инфицированных //Эпидемиология и инфекционные болезни. - 2001. - № 1. - С. 56-57.
- Бобкова М.Р., Самохвалов Е.И., Кравченко А.В. и соавт. Генетические варианты вируса гепатита С у ВИЧ-инфицированных наркоманов // Вопросы вирусологии. - 2002. - Т. 47. - № 3 - С. 15-20.
- Berg T., et al. Triple therapy with amantadine in treatment-naive patients with chronic hepatitis C: A placebo-controlled trial. Hepatology 2003;37:1359-67.
- Younossi ZM, et al. Triple combination of pegylated interferon alpha 2b, ribavirin and amantadine for treatment of chronic hepatitis C. Digestive Disease Week 2003, Orlando, USA. Abstr. T1280.
- Kravtchenko AV, Kanestry VG, Golokhvastova EL, et al. Therapy HIV+HCV-infected patients with alpha-interferon and rimantadine. 8-th European Conference on Clinical Aspects and Treatment of HIV-infection, Athens, 28-31 October 2001, Book of Abstracts, P287. - P.181.
- Dieterich DT, Wesz KB, Galdman DJ, et el. Combination treatment with interferon and ribavirin for hepatitis C in the HIV infected patients. 50-th Annual Meeting of the American Association for the Study of Liver Diseases, Dallas, USA, 1999. Abstr. 422.
- Voigt E. Safety and efficacy of pegylated interferon (peg IFN) alfa-2b plus ribavirin (RBV) for the treatment of chronic hepatitis C in HIV-coinfected patients: 48 week results. Digestive Disease Week 2003, Orlando, USA. Abstr. T1209.
- Pol S, et al. A randomized controlled trail of pegylated-interferon alpha-2b + ribavirin vs interferon alpha-2b + ribavirin in HIV co-infected patients. 38-th Annual Meeting of the EASL, 2003. Abstr. 3423.00.
- Parra-Ruiz J, Hernandez-Qero J, Perez-Guzman, et al. IT78047 trial. A randomized multicentre study of pegylated interferon alfa 2a plus two different doses of ribavirin in the treatment of patients with chronic hepatitis C and HIV infection. 2-th IAS, Paris, 2003. Poster 971.
- Soriano V, Sulkowski M, Bergin C, et al. Care of patients with chronic hepatitis C and HIV infection: recommendations from the HIV-HCV International Panel. AIDS;16:813-28.
- Guidelines for the use of antiretroviral agents in HIV-infected adults and adolescents. s.org (accessed 14 July 2003).
- Sulkowski MS, Thomas DL, Chaisson RE, et al. Hepatotoxicity associated with antiretroviral therapy in adults infected with human immunodeficiency virus and role of hepatitis C or B virus infection. JAMA 2000;283:74-80.
- Кравченко А.В., Серебровская Л.В., Голохвастова Е.Л. и соавт. Тимазид в сочетании с хивидом и инвиразой в комплексной терапии больных ВИЧ-инфекцией // Эпидемиол. и инфекцион. болезни. - 1998. - № 5. - С. 51-53.
- Rodriguez-Rosado R., Garcia-Samaniego J., Soriano V., et al. Hepatotoxicity after introduction of highly active antiretroviral therapy. AIDS 1998;12:1256.
- Stoll M, Tillman HL, Behrens G, et al. Response and toxicity of interferon alpha-2a treatment in chronic hepatitis C in HIV infected patients. 12-th World AIDS Conference, Geneva, 1998. Abstr.32116.
- Imperiale SM, Lanes S, Stern JO, et al. Target: Incidence of elevated ALT/AST with HAART in a large observational cohort. 6-th International Congress on Drug Therapy in HIV-infection, Glasgow, UK, 2002. Abstr. P150.
- Кравченко А.В., Саламов Г.Г., Богословская Е.В. и соавт. Трехкомпонентная комбинированная антиретровирусная терапия с применением ингибиторов обратной транскриптазы ВИЧ // Эпидемиология и инфекционные болезни. - 2001. - № 4 - С. 32-35.
- John M, Flexman J, French M. Hepatitis C virus associated hepatitis following treatment of HIV-infected patients with protease inhibitors: an immune restoration disease? AIDS 1998;12:2289-93.
- Кравченко А.В., Ситдыкова Ю.Р., Беляева В.В. и соавт. Применение «усиленных» ингибиторов протеазы ВИЧ - новое направление в антиретровирусной терапии // 2 Российская научно-практическая конференция по вопросам ВИЧ-инфекции и парентеральных гепатитов, Суздаль, 1-3 октября 2002. - С. 128-130.
- Bartlett JG, Dieterich DT, Sulkowski MS. Strategies for the Management of HIV/HCV Coinfection, Monograph, 2000, Projects in Knowledge, Inc. - 20 p.
- Dieterich DT, Fischl M, Sepulveda G. The safety and efficacy of protease inhibitors (PIs) in hepatitis C (HCV) co-infected patients. 42nd ICAAC, San Diego, USA, 2002. Abstr. H1729.
- Gymez A, Nеcez M, Soriano V, et al. Toxicity of antiretroviral therapy (ART). 9 years experience. 7-th ECAATH, 1999.- Lisbon, Portugal. Abstr. 577.
- Greub G, Ledergerber B, Battegay M, et al. Clinical progression, survival, and immune recovery during antiretroviral therapy in patients with HIV-1 and hepatitis C co-infection. Lancet 2000;356:1800-5.
- Pau A, Agyemang A, McLaughlin M, et al. Cost impact of adjunctive G-CSF and/or darbopoetin therapy in maintenance of Pegylated-interferon alpha and ribavirin doses in HIV/HCV co-infected patients. 10-th Conference on Retroviruses and Opportunistic Infection, Boston, USA, 2003. Abstr. 843.
- Farel C, Kottilil S, McLaughlin M, et al. Serious ophthalmologic pathology with visual compromise in HIV/HCV co-infected patients treated with pegylated interferon alpha-2b and ribavirin. 10-th Conference on Retroviruses and Opportunistic Infection, Boston, USA, 2003. Abstr. 844.
- Seqane A, Coll S, Sola R, et al. Treatment of hepatitis C HIV-coinfected patients with interferon. Hepatology 2000;32(suppl. 2):186.
- Webster GF. Local therapy for muculocutaneous Kaposi’s sarcoma in patients with acquired immunodeficiency syndrome. Dermatol Surg 1995;21:205-9.
- Selimova L, Kravchenko A, Serebrovskaya L, et al. Peripheral blood leukocytes derived from HIV- and HCV-infected patients inhibited alpha interferon antiviral activity. 8-th European Conference on Clinical Aspects and Treatment of HIV-infection, Athens, Greek, 2001. Abstr. P12.
- Bartlett J. The 2002 abbreviated guide to medical management of HIV-infection, Johns Hopkins University, 2002. - 154 p.
- Zylberg H, Pol S. Reciprocal interactions between human immunodeficiency virus and hepatitis C virus infections. Clin Infect Dis 1996;23:1117-25.
- Bourgeous N, Van Der Meeren O. A triple therapy of interferon alfa-2a, ribavirin and amantadine for chronic hepatitis C patients now responders to standard therapy: interim analysis of a large Belgian cohort. J Hepatology 2002;36(suppl. 1):99.
- Ивашкин В.Т., М.В. Маевская, Ч.С. Лапшин и др. Опыт применения веро-рибавирина у больным хроническим гепатитом С // Российский журнал гастроэнтерологии, гепатологии, копрологии. - 2003. - Т. 13. - № 2. - С. 1-4.
- Е. А. Климова, О.О. Знойко, С.Л. Максимов. Н.Д. Ющук. Хронический гепатит С: рациональная противовирусная терапия // Фарматека. - 2003. - № 7. - С. 10-26.
Приложения:
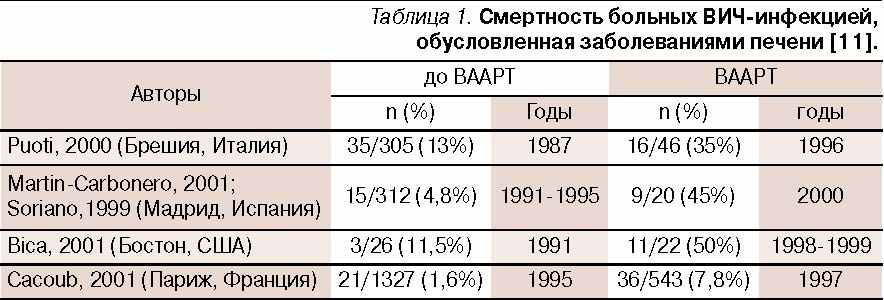
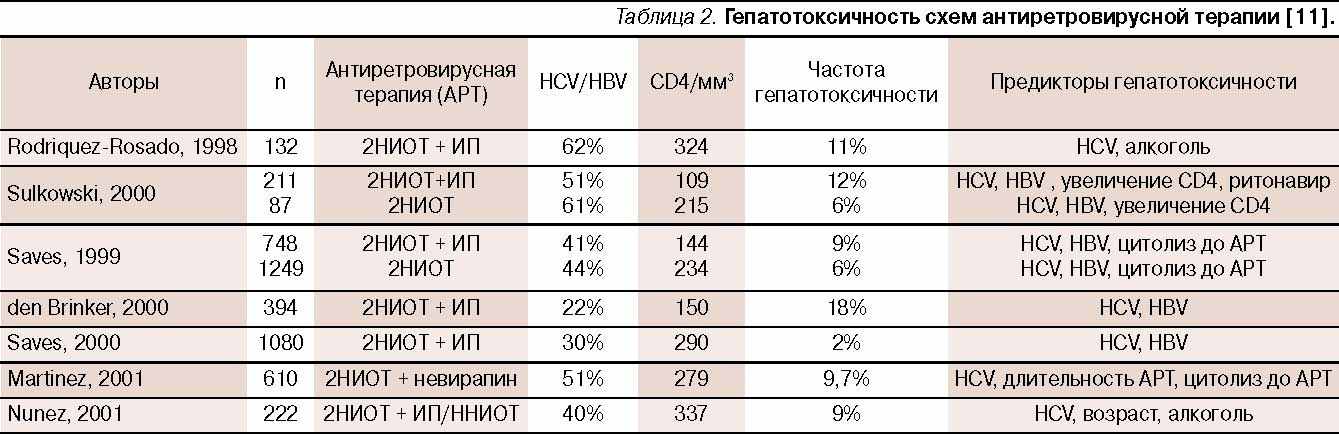
Таблица 3. Тактика терапии ХГС у пациентов с ВИЧинфекцией