Нейроны и глиальные клетки: общая характеристика, разнообразие, функции. Серое и белое вещество мозга (на примере спинного мозга)
| Вид материала | Документы |
- План лекции: Общая характеристика функций спинного мозга Нейронная организация спинного, 696.17kb.
- Серое и белое вещество головного и спинного мозга, 551.63kb.
- Острая вирусная инфекция, поражающая нервную систему (серое вещество спинного мозга), 22.2kb.
- Большие полушария головного мозга. Конечный мозг, 36.23kb.
- Программа научно-практической конференции «Актуальные вопросы хирургического лечения, 33.37kb.
- Название работы, 116.86kb.
- Название работы, 5377.92kb.
- Аневризмы сосудов головного и спинного мозга, 45.11kb.
- Цель: систематизировать полученные знания о строении и функциях головного и спинного, 39.31kb.
- План Проблема отношения психических процессов и мозга, рождение нейропсихологии. Принципы, 96.52kb.
5-2. Синтез ацетилхолина (Ацх). Ацетилхолинэстераза и инактивация Ацх. Эффекты блокаторов Ацх-эстразы. Миастения и ее лечение.
По химическому строению ацетилхолин представляет собой соединение двух молекул — азотсодержащего холина и остатка уксусной кислоты.
Синтез ацетилхолина осуществляется в основном в пресинаптических окончаниях с помощью фермента холин ацетил-трансферазы. Затем медиатор переносится в пустые везикулы и хранится в них до момента выброса.
Появление ПД запускает выброс Ацх в синаптическую щель, после чего он действует на рецепторы постсинаптической мембраны.
Инактивация Ацх происходит с помощью фермента ацетилхолинэстеразы. Ацх-эстераза расположена на постсинаптической мембране и в синаптической щели. Она очень быстро «разрывает» Ацх на холин и остаток уксусной кислоты (ацетат). На следующем шаге холин переносится с помощью особого белка-насоса обратно в пресинаптическое окончание и вновь используется для синтеза Ацх.
Блокаторы Ацх-эстеразы активируют передачу сигнала в ацетилхолиновых синапсах, вызывая в больших дозах судороги (нервно-мышечные синапсы), спазм бронхов и остановку сердца (парасимпатические синапсы).
Примеры блокаторов:
-токсин малабарских бобов эзерин (физостигмин);
-фосфорорганические инсекти-циды (хлорофос, дихлофос и т.п.; могут вызывать токсикоманию);
-боевые нервно-паралитические газы (зарин, табун).
Пиридостигмин (на основе эзерина): лекарственное средство при миастении (50 на 1 млн.; аутоиммунное заболевание: антитела атакуют никотиновые рецепторы; развивается мышечная слабость, вялость, быстрая утомляемость; характерн. признак – опущенные веки). Основное лечение – иммуносупрессия.
Пиридостигмин и сходные препараты (амиридин), а также ряд агонистов ацетилхолина используются для лечения болезни Альцгеймера – самого распространенного нейродегенеративного заболевания, при котором первыми страдают Ацх-нейроны больших полушарий.
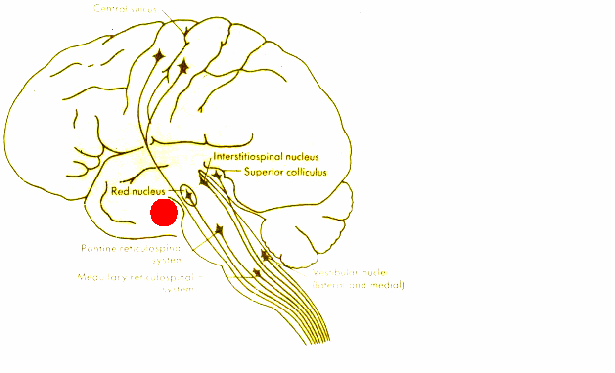
5-3. Экстрапирамидная система: функции основных структур и трактов. Рубро-, вестибуло- и ретикулоспинальные тракты. Тектоспинальный тракт.
Руброспинальный тракт – предшественник кортико-спинального (пирамидного) тракта; еще не способен обеспечить тонкое управление моторикой пальцев, может лишь вызвать совместное (си-нергичное) их сгибание. Руброспиный тракт – часть так называемой экстрапирамидной системы управления движениями, в которую входят также вестибуло-спинальный и ретикуло-спинальный тракты.
Руброспинальный тракт – сгибание конечностей (в том числе при локомоции – то есть ходьбе, беге и т.п.). Вестибулоспинальный тракт –разгибание конечностей (рефлексы, локомоция).Ретикулоспинальные тракты – идут от РФ, сгибание и разгибание туловища (самые древние двигательные тракты, с их помощью плавают рыбы).
6-1. Парасимпатическая нервная система: функции, анатомическая организация, особенности работы синапсов, примеры влияния на внутренние органы.
Парасимп. система: ганглии рядом с органами или в стенках органа.
Парасимпатическая часть иннервирует только внутренние органы, которые, таким образом, имеют двойную вегетативную иннервацию — и симпатическую, и парасимпатическую. Все остальные органы и ткани получают только симпатическую вегетативную иннервацию.
У парасимпатической части нервной системы центральный отдел расположен в стволе головного мозга в виде ядер черепных нервов (глазодвигательного, лицевого, языкоглоточного, блуждающего) и в боковых рогах крестцовых сегментов спинного мозга (с II по IV).
Периферический отдел парасимпатической части нервной системы представлен нервными волокнами в составе черепных и тазовых нервов, нервными узлами, расположенными в стенках внутренних органов или в непосредственной близости от органов, нервными окончаниями парасимпатической природы. Ко многим внутренним органам парасимпатические волокна идут в составе блуждающих нервов (X пара черепных нервов). Этот нерв иннервирует почти все органы грудной и брюшной полостей. Половые органы, мочевой пузырь и конечная часть толстой кишки получают парасимпатическую иннервацию из крестцового отдела спинного мозга.
Медиатором, образующимся в окончаниях парасимпатических нервных волокон, является ацетилхолин, который уменьшает ритм и силу сердечных сокращений, суживает
просвет бронхов, усиливает желудочно-кишечную перистальтику, активизирует секрецию желез желудка, кишечника, поджелудочной железы, суживает зрачок.
Парасимпатич. НС в ос-новном лишь урежает со-кращения сердца (вплоть до полной остановки).
6-2. Синтез моноаминов (норадреналина, дофамина, серотонина, гистамина). Инактивация моноаминов, роль МАО-А и МАО-Б, применение блокаторов МАО.
Норадреналин, дофамин, серотонин, гистамин в связи с особенностями химического строения относят к моноаминам – производ-ным аминокислот (пищевых), потерявших СО2 (декарбоксилирование). Это обуславливает сходство ряда их свойств и, прежде всего, наличие общих путей синтеза и инактивации.
На стадии дофамина реакция останавливается в нейронах:
А) черной субстанции среднего мозга
(аксоны идут в базальные ганглии)
Б) вентральной покрышки среднего
мозга (аксоны идут в кору б. п/ш.)
В) гипоталамуса (короткие аксоны,
локальные влияния и нейро-
эндокринная функция).
Жизненный цикл DA:
1. Синтез в пресинаптическом окончании и экзоцитоз при приходе ПД
2. Действие на постсинаптичес-кие рецепторы, связанные с G-белками.
3. Действие на пресинаптические рецепторы: аутоторможение экзо-цитоза (как и в случае NE).
4. Инактивация: обратный захват и последующее повторное использование либо разрушение с помощью МАО.
МАО – фермент моноаминоксидаза; расщепляет самые разные моноамины, в т.ч. медиаторы и гормоны.
Особая группа препаратов, влияющая на работу DA-синапсов: амфетамин и его производные.Эти вещества относятся к группе психомоторных стимуляторов и действуют преимущественно на пресинаптическом уровне.
Амфетамины:
- ослабляют обратный захват DA и даже обращают работу белков-насосов;
- активируют загрузку DA в везикулы (каждая везикула содержит теперь больше DA);
- частично блокируют МАО.
При введении высоких доз действие амфетаминов начинает распространяться на систему NE.
В результате появляется бодрость, прилив сил, снимается утомление, голод. Амфетамины пыта-лись использовать для похудания; они были первыми спортивными допингами; сейчас это – «наркотики дискотек» и группа лекарственных препаратов (используются при тяжелых депрессиях).
Привыкание и зависимость: через 20-30 приемов; не дают реальной энергии, а лишь заставляют мозг расставаться с «неприкосновенными запасами» DA; быстро развиваются эндокринные нарушения, страдает сердечно-сосудистая система. Как допинги давно ушли в прошлое (им далеко до EPO – эритропоэтина, увеличиваю-щего в крови содержание эритроцитов…).
Инактивация DA: обратный захват с помощью белка-насоса и далее повторная загрузка в везикулу либо разрушение с помощью МАО (находится на мембране митохондрий).
Синтез серотонина (5-НТ) идет в 2 стадии:
1. Из пищевой аминокислоты триптофана образуется 5-гидрокситриптофан; фермент триптофангидроксилаза.
2. Из 5-гидрокситриптофана образуется 5-гидрокситриптамин (5-НТ; серотонин); фермент декарбоксилаза ароматических аминокислот.
Серотонин является тканевым гормоном (увеличивает тонус гладких мышечных клеток в стенках сосудов и ряда других внутренних органов). Кроме того, серотонин – медиатор ЦНС; вырабатывают нейроны ядер шва (верхне-центральная зона среднего мозга, моста и продолговатого мозга с переходом в спинной мозг); аксоны клеток ядер шва расходятся по всей ЦНС, образуя контакты обычного и варикозного типа.
Антидепрессанты – препараты, активирующие системы NE, DA и 5-НТ (NE и DA поднимают уровень положит. эмоций, а серотонин сдерживает отрицательные эмоции).
Механизм действия: блокаторы МАО и обратного захвата.
В случае МАО выделяют 2 подтипа фермента:
МАО-А – разрушает NE и 5-НТ;
МАО-Б – разрушает дофамин.
Ранее использовали неспецифические блокаторы МАО (ниаламид); теперь – более мягко действующие блокаторы МАО-А (пиразидол). Блокаторы МАО-Б (депренил) применяют при паркинсонизме.
На фоне блокаторов МАО может возникать «сырный синдром»: тирамин, которого много в сыре, бобовых, копченостях, не разрушается и оказывает NE-подобное действие (нервное возб-е, гипертония).
В случае обратного захвата белки-насосы для каждого из медиаторов хотя и похожи, но все же разные. Используют неспецифические блокаторы обратного захвата (амитриптилин) и наиболее мягко работающие блокаторы захвата 5-НТ (флуоксетин = прозак). Прозак: применение повышает уровень оптимизма и увереннос-ти в себе.
Синтез дофамина (DA):
Уже знакомая последовательность реакций:
- Тирозин превращается в L-дофа; фермент тирозин-гидроксилаза
- L-дофа дает дофамин (декарбоксилирование v )
- Дофамин превращается в NЕ и т.д.
НОРАДРЕНАЛИН (NE).
Как и к ацетилхолину, к NЕ существует два основных типа рецепторов (альфа- и бета-адренорецепторы). К рецепторам Ацх агонисты и антагонисты создала сама природа, они издавна известны человечеству.В случае NЕ потрудиться пришлось химикам; избирательные альфа-агонисты и антагонисты, а также бета-агонисты и антагонисты стали появляться лишь после 1948 г.
Норадреналин – образуется в результате цепи химических ре-акций из пищевой аминокислоты тирозина; характерный элемент структуры – ароматическое (бензольное) кольцо.
Синтез – в пресинаптическом окончании, после чего NЕ переносится внутрь везикул и готов к экзоцитозу.
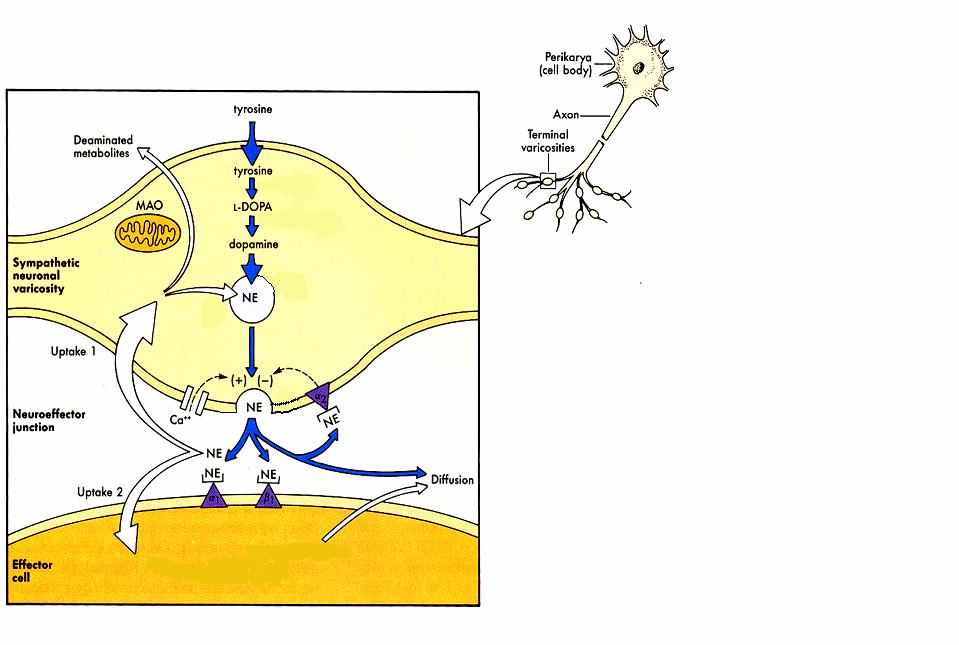
Появление ПД запускает вход Са2+ и выброс NЕ в синаптическую щель, после чего он действует на рецепторы как пост-синаптической, так и пресинаптической мембраны.
NE в головном мозге: в передней верхней части моста («голубое пятно»), на дне ромбовидной ямки; всего несколько млн. клеток (< 1% нейронов ЦНС), однако их аксоны расхо-дятся по всему головному и спинному мозгу, влияя на многие функции.
Медиатор норадреналин относится к катехоламинам — производным аминокислоты тирозина. Тирозин — одна из незаменимых аминокислот, которые мы получаем только с пищей.
Синтез норадреналина осуществляется в пресинаптических окончаниях, затем он переносится в пустые везикулы и хранится до момента выброса. Выделяясь в синаптическую щель, норадреналин действует на постсинаптические рецепторы, которые неоднородны и подразделяются на два типа — альфа- и бета-адренорецепторы. Оба они являются метаботропными, но разница состоит в том, что альфа-адренорецепторы в качестве вторичных посредников используют инозитолтрифосфат (ИТФ), диацилглицерол (ДАТ) и ионы Са2+, а бета-адренорецепторы соединены с ферментом аденилатциклазой, продуцирующей циклический аденозинмонофосфат (цАМФ).
Норадренергические (вырабатывающие норадреналин в качестве медиатора) нейроны расположены в голубом пятне и межножковом ядре среднего мозга, их аксоны образуют чрезвычайно широкую сеть проекций, в результате чего соответствующие синапсы можно обнаружить в большой концентрации в разных отделах ЦНС от спинного до конечного мозга, в том числе в коре мозжечка и больших полушарий (содержат как
альфа-, так и бета-адренорецепторы).
Обе эти группы препаратов (препараты с нейролептическими свойствами, антидепрессанты.) способны влиять на активность норадренергической системы, но ситуация осложняется тем, что в регуляции уровня эмоций и двигательной активности, кроме норадреналина, участвуют и другие медиаторы, в частности, дофамин и серотонин.
Обратный захват норадреналина осуществляется особыми белками-насосами. Попав в пресинаптическое окончание, норадреналин может повторно «загружаться» в везикулы, но может и разлагаться с помощью фермента моноаминоксидазы (МАО). Инактивация происходит внутри митохондрий, на внутренней мембране которых располагается МАО. Чрезвычайно важно, что этот фермент осуществляет разложение и других моноаминов — дофамина и серотонина. Оказалось, что использование блокаторов МАО позволяет повысить активность всех трех медиаторных систем (антидепрессантные эффекты).
Дофамин. Дофамин относится к катехоламинам. Дофаминергические нейроны встречаются в трех отделах головного мозга: черной субстанции (ее компактной части), покрышке среднего мозга и в различных ядрах гипоталамуса. В периферической нервной системе его практически нет.
Синтез дофамина протекает так же, как и норадреналина, но в дофаминергических нейронах цепочка химических превращений тирозина останавливается на одно звено раньше. Далее происходит перенос медиатора в везикулы и выброс в синаптическую щель по мере надобности.
В норме инактивация дофамина осуществляется тем же способом, который описан для норадреналина (обратный захват, а затем повторная загрузка в везикулы либо разложение с помощью МАО). Отличие состоит в функции пресинаптических рецепторов. В случае дофамина их включение тормозит активность синапса, т. е. уменьшает дальнейший выброс медиатора. Этот механизм позволяет нервным клеткам экономно расходовать запасы дофамина, но подразумевается, что чувствительность пре- и постсинаптических рецепторов к дофамину тонко сбалансирована. Смещение этого
баланса, вероятно, является причиной некоторых видов шизофрении, при которых пресинаптические рецепторы «опаздывают» с торможением выброса медиатора, поэтому оказывается полезным введение специфических агонистов пресинаптических рецепторов (например, апоморфина в малых дозах).
Серотонин. Серотонин — медиатор, относящийся к группе моноаминов, к ней же принадлежат катехоламины и гистамин. Образуется серотонин в результате химического
преобразования аминокислоты триптофана. В ЦНС серотонин синтезируют в основном нейроны, находящиеся в ядрах шва; последние расположены вдоль средней линии продолговатого мозга, моста и среднего мозга. Синтез серотонина осуществляется преимущественно в пресинаптических окончаниях. Выделяясь в дальнейшем в синаптическую щель, серотонин связывается с соответствующими рецепторами, которых в настоящее время известно 3 типа. Сокращенно они называются 5HTj-, 5HT2- и 5НТ3-ре-
цепторы. Последний слабо представлен в ЦНС, поэтому подробнее остановимся только на свойствах рецепторов первого и второго типов.
5НТГ и 5НТ2-рецепторы являются метаботропными и сопряжены соответственно с аденилатциклазои и фосфолипазои С (ферментом, с помощью которого осуществляется синтез диацилглицерола и инозитолтрифосфата). 5НТ2-рецепторы более распространены на постсинаптических мембранах мозга, особенно высока их концентрация в лобной коре; несколько меньше 5НТ2-рецепторов в поясной извилине, гипоталамусе, миндалине. 5НТ,-рецепторы чаще являются пресинаптическими. Будучи более чувствительными к серотонину, чем 5НТ2-тип, они способны эффективно блокировать его выброс в синаптическую щель. Этот механизм в целом аналогичен механизму, описанному в случае дофамина. Кроме того, активация пресинаптических рецепторов снижает синтез серотонина.
Серотонин, как и катехоламины, возвращается в пресинаптическое окончание с помощью механизма обратного всасывания. Деградация медиатора идет с помощью все той же МАО. Ослабляя обратный захват либо блокируя МАО, можно достичь активации серотонинергических синапсов. При этом воздействие на МАО приведет к параллельной активации и катехоламинергических систем. Блокаторы МАО, усиливающие работу сразу трех медиаторов-моноаминов (серотонина, норадреналина и дофамина), образуют отдельное семейство психотропных препаратов — антидепрессантов.
6-3. Центры сна и бодрствования головного мозга (ретикулярные ядра, центральное серое вещество, голубое пятно и др.) Электроэнцефаграмма сна и бодрствования.
Сон и наркоз. Мозговые центры, регулирующие смену сна и бодрствования – одни из самых древних структур НС. Засыпаем мы по многим причинам, в т.ч. при снижении сенсорного притока; это снижение имитируют снотворные препараты. Но сон – не только фаза отдыха мозга; он включает в себя т.н. парадоксальную фазу (REM-sleep), во время которой ЦНС обрабатывает накопленную за день информацию («фаза сновидений»).
Барбитураты, вызывая избыточно сильное торможение, блокируют эту фазу, мешая, прежде всего, полно-ценной «очистке» контуров памяти. Сон, вызванный бензодиазепинами, ближе к естественному, однако и в этом случае всегда есть риск привыкания и зависимости.

Снотворные – препараты для «аварийного» (но не для ежедневного) применения! Барбитураты в большей степени (чем бензодиазепины) подходят для длительного наркоза во время операций (гексенал). Сверхдозы агонистов ГАМК способны вызвать остановку дыхания (самый частый способ суицида).
Центры сна и бодрствования.
Эволюционно очень древние, постоянно конкурируют друг с другом, учитывают значительное число факторов (прежде всего, сенсорных).
1. Главный центр бодрствования: ретикулярные ядра моста; сюда поступает часть информации от всех сенсорных систем; далее происходит оценка общего уровня «сенсорного давления» на ЦНС, и чем оно больше, тем мозг активнее (нас будит сигнал, поступивший от любой сенсорной системы); аксоны (в т.ч. Ацх) расходятся по всей ЦНС, задавая ее тонус («блок питания» мозга); в тихом и темном месте, а также при торможении сенсорных потоков с помощью агонистов ГАМК мы засыпаем.
2. Главный центр сна: центральное серое вещество среднего мозга и ядра шва (5-НТ); аксоны нейронов ядер шва также расходятся по всей ЦНС, снижая ее тонус и тормозя, в числе прочего, центры бодрствования. Торможение коры происходит за счет снижения активности Glu-нейронов таламуса, чьи аксоны идут в большие полушария.
3. Голубое пятно: вспомогательный центр бодрствования, получив сигнал из [1], тормозит [2] за счет выделение NE.
При стрессе, приближении потенциально опасной ситуации трудно заснуть
(поездка, соревнования, экзамен…)
4. Супрахиазменные ядра переднего гипоталамуса: находятся напротив перекреста зрительных нервов, получают информацию об общем уровне освещенности и настраиваются на суточный ритм («биологические часы»; часть нейронов активны днем и влияют на [1], часть – ночью и влияют на [2], намекая, что пора спать). В яркой форме эффект «биологич. часов» проявляется при резкой смене часового пояса. В основе поддержания ритма – медленные цепи внутриклеточных химических реакций.
5. Вспомогательный центр сна – ретикулярные ядра продолговатого мозга: реакция на химический состав крови, появление аденозина и других «отходов обмена веществ», токсинов (при заболеваниях и отравлениях), рост концентрации инсулина и глюкозы (после еды хочется спать); оказывает постоянное возбуждающее действие на [2].
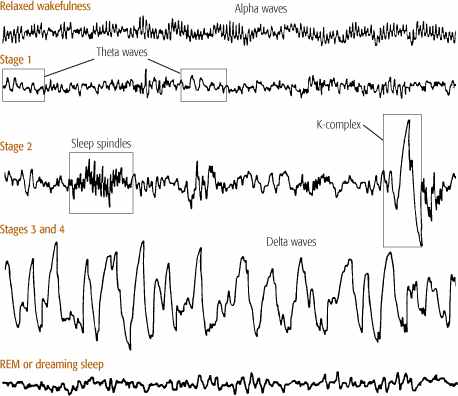
Но все еще сложнее, и выделяют стадии сна (на основе анализа ЭЭГ): Бодрствование: альфа-ритм – 10-12 Гц, бета-ритм – 15-30 Гц
Стадия 1: появление тета-ритма – 4-8 Гц
Стадия 2: сонные веретена и К-комплексы
Стадии 3 и 4: все более медленный дельта-ритм – 1-3 Гц.
REM-сон: «бодрствующая» ЭЭГ
СНЫ – «окно в бессознательное», «упорядочивание» накопленной информации, «дефрагментация», продолжение ментальных процессов в ином состоянии (творческие сны, вещие сны и т.п.). Если лишать REM-сна, то человек не высыпается, а на следующую ночь «добирает» REM-сон. Развитый REM-сон – только у млекопитающих.
Стадии 1-4 (не-REM-сон) – физиологический отдых мозга разной степени глубины.
REM-сон (парадоксальный: «бодрствующая» ЭЭГ, но порог пробуждения выше) – стадия сновидений, обработка накопленной информа-ции (в первую очередь, за текущие сутки). Око-ло 20% времени сна; 4-5 раз за ночь примерно по 20 мин; в первые 3 года жизни – 30-50%.
Наиболее выражен суточный цикл сон — бодрствование. Он реализуется как за счет безусловно-рефлекторной основы, главные компоненты которой относятся к группе витальных врожденных реакций, так и за счет определенных адаптивных процессов, которые и будут рассмотрены ниже.
Состояние бодрствования характеризуется высокой нервной активностью. В это время происходит взаимодействие организма с внешней средой, формирование и реализация различных рефлекторных реакций. Бодрствующее состояние поддерживается особыми центрами бодрствования.
Сон — это физиологическое состояние, при котором значительно снижается реакция нервной системы и всего организма на внешние раздражители. Состояние сна является следствием включения особых центров сна головного мозга и сопровождается снижением интенсивности физиологических процессов, общей неподвижностью.
Кратко охарактеризуем основные центры бодрствования и сна головного мозга. Функции главного центра бодрствования нашего мозга выполняют в ЦНС ретикулярные ядра моста. Каждая сенсорная система, помимо передачи информации в специфические зрительные, слуховые, вкусовые зоны, часть сигналов направляет именно сюда. В ретикулярных ядрах моста (ретикулярная формация моста) происходит их суммирование и оценка общего уровня сенсорного «давления» на организм. Далее сигналы от ретикулярных ядер чрезвычайно широко иррадиируют по ЦНС. Анатомическую основу для этого обеспечивают коллатерали аксонов их нейронов, которые образуют возбуждающие синапсы на самых разных уровнях — от коры больших полушарий до серого вещества спинного мозга.
В качестве ключевых центров сна рассматриваются содержащие серотонин структуры среднего мозга и моста (ядра шва) и влияющее на них центральное серое вещество среднего мозга. Функции серотонина как медиатора нервной системы уже обсуждались в разделе, посвященном общей физиологии нервной системы. Напомним, что они связаны с тормозной модуляцией сенсорных входов. Как и в случае ретикулярных
ядер моста, коллатерали аксонов серотонинергических нейронов обнаруживаются на всех уровнях ЦНС.
Между ретикулярными ядрами моста и центрами сна существуют антагонистические отношения, являющиеся частным случаем проявления принципа доминанты. При этом глутаматергические нейроны центров бодрствования нуждаются в посреднике для реализации тормозного действия на центры сна. Роль такого посредника выполняет голубое пятно — область норадренергических нейронов в верхней части моста. Стимуляция этой зоны вызывает выключение центров сна и пробуждение. Следующей важной областью, связанной с регуляцией суточных ритмов, являются супрахиазменные ядра гипоталамуса. Контактируя со зрительной системой, они оказываются настроенными на суточные колебания освещенности в окружающей среде. В результате часть нервных клеток этой области обнаруживает активность в темноте, а часть — в светлое время суток. Первые посылают свои аксоны в центры сна, вторые— в центры бодрствования. Нейроны супрахиазменных ядер обладают свойством автоматизма (будучи изолированными от всего остального мозга, продолжают поддерживать суточный ритм). Их назначение состоит в том, чтобы вовремя сообщить ретикулярным ядрам моста, что уже «пора вставать», а центральному серому веществу и ядрам шва — что уже «пора спать».
Ретикулярные ядра продолговатого мозга. Не являясь самостоятельными центрами сна, они посылают в центральное серое вещество сигналы, связанные с оценкой содержания в крови различных важных для деятельности мозга веществ (глюкозы, токсинов, отходов обмена веществ). За счет активации ретикулярной формации продолговатого мозга сонное состояние может развиться после еды, при болезнях, физическом утомлении.
В целом можно заключить, что центры сна и бодрствования находятся в постоянных конкурентных отношениях и степень доминирования тех или других зависит от многих факторов: времени суток, сенсорной нагрузки, физического состояния. Это позволяет нервной системе гибко варьировать общий уровень своей активности в зависимости от значимости текущей деятельности (ожидаемого подкрепления) и степени
утомления. В результате ЦНС, с одной стороны, функционирует в режиме максимальной экономии ресурсов, с другой — в случае необходимости может быстро переходить в состояние высокой работоспособности, быстрого и адекватного реагирования на внешние стимулы.
С помощью электрофизиологических методик установлено, что естественный ночной сон состоит из нескольких повторяющихся циклов. В течение каждого такого цикла наблюдаются закономерные изменения в электроэнцефалограмме (ЭЭГ) — электрической активности коры больших полушарий. Две основные характеристики ЭЭГ — это частота и амплитуда составляющих ее волн. Известно, что в зависимости от
функционального состояния человека характер ЭЭГ меняется: чем больше активность мозга, тем больше частота и ниже амплитуда волн ЭЭГ. В спокойном бодрствующем состоянии в ЭЭГ преобладает альфа-ритм (8—12 Гц), при активной умственной деятельности он сменяется бета-ритмом A3—30 Гц). Во время засыпания активность коры снижается и в ЭЭГ появляются сначала тета-волны D—7 Гц), а затем дельта-волны A—3 Гц). Сон с преобладанием медленных дельта-волн является основной фазой сна (около 80% общей его длительности) и называется медленным сном. В ходе медленного сна наблюдается глубокое торможение большинства областей ЦНС, происходит «физиологический отдых» — восстановление запасов химических веществ и энергии, затраченных во время бодрствования. Можно наблюдать, что в течение ночи медленный сон 4—5 раз периодически сменяется другой фазой сна. В это время дельта-волны замещаются на быструю низкоамплитудную активность, сходную с ЭЭГ в состоянии бодрствования. Кроме того, наблюдается повышение температуры, частоты дыхания
и сердцебиений, артериального давления, усиление потоотделения, но порог пробуждения в этот момент оказывается еще выше, чем при медленном сне, т. е. торможение сенсорных
входов достигает максимума. Происходит также исчезновение мышечного тонуса (полное расслабление мускулатуры). Совокупность данных признаков позволила назвать данную
фазу сна парадоксальной или быстрым сном. Во время этой стадии можно наблюдать также быстрые движения глазных яблок — отсюда третье название: стадия быстрых движений глаз, или стадия БДГ (англ. rapid eye movement — REM-сон).
Во время первого цикла (после первого интервала медленного сна) стадия БДГ еще очень короткая — примерно 5 мин. Но с каждым новым циклом ее длительность нарастает и достигает 20—25 мин (суммарно около 20% от всей длительности сна). Показано, что если человеку не позволять в течение ночи находиться в этой стадии, то утром он оказывается невыспавшимся, отмечается повышенная утомляемость и раздражительность. При длительном лишении быстрого сна могут развиться неврозы. Предполагается, что во время быстрого сна мозг осуществляет обработку информации, накопленной за прошедший период бодрствования. Судя по имеющимся данным, именно эта обработка является главной причиной сновидений.
7-1. Мозговое и корковое вещество надпочечников: выделяемые гормоны и их эффекты (в т.ч. действие на нервную систему). ЦНС и управление работой надпочечников.
Надпочечник состоит из корковой и мозговой частей.
Корковая часть, выделяя гормоны, работает под управлением гипофиза.
Мозговая часть состоит из клеток того же происхожде-ния, что и клетки симпатических ганглиев. К ним подходят преганглионарные симпатические волокна и, выделяя Ацх, через никотиновые рецепторы запускают секрецию адреналина (80%) и NE (20%).
Адреналин интенсивнее, чем NE, действует на те орга-ны, где больше β-рецепторов (бронхи, сердце, сосуды сердца – в последн. случае идет расширение сосудов, конкурирующее с влиянием NE через a1-рецепторы).
В целом мозговое вещество обеспечивает эндокринную «поддержку» симпатической НС, позволяет пролонги-ровать ее эффекты на часы, сутки, недели, месяцы (что ведет к развитию многих патологических процессов, но это уже другая история…)
Надпочечники — парные железы внутренней секреции, массой по 5—7 г, расположенные на полюсах почек. В каждом надпочечнике выделяют два слоя: корковый и мозговой. Эти слои железы совершенно различны по своему происхождению. Наружный корковый слой развивается из среднего зародышевого листка (мезодермы), а внутренний слой является видоизмененным узлом вегетативной нервной
системы. Кора надпочечников подразделяется на три зоны: клубочковую, пучковую и сетчатую. Каждая из этих зон вырабатывает характерные для нее гормоны, которые жизненно не-обходимы для организма. Общее название гормонов коры надпочечников — кортикостероиды. В клубочковой зоне образуются минералокортикоиды, в пучковой — глюкокортикоиды, в сетчатой — глюкокортикоиды и некоторое количество половых гормонов. Все эти гормоны по своей химической природе — стероиды. Минералокортикостероиды получили свое название за то, что регулируют обмен таких минеральных элементов, как натрий и калий. Основным минералокортикоидом в организме человека является альдостерон, способствующий, во-первых, задержке в организме воды и натрия и, во-вторых, выведению калия. Основной орган-мишень для альдостерона — почки. Секретируемый под действием АКТГ и ренина почек альдостерон проникает в эпителиальные клетки стенок почечных канальцев, в цитоплазме этих клеток связывается со специфическим рецептором. Комплекс гормон — рецептор проникает в
ядро клетки и приводит к синтезу фермента, приводящего к задержке выделения натрия и усилению выведения калия с мочой. Секреция альдостерона усиливается также при уменьшении объема плазмы крови: при сильной жажде или кровопотерях. Под действием альдостерона жидкость задерживается в организме и объем плазмы постепенно нормализуется. Глюкокортикоиды синтезируются в клетках пучковой зоны коры надпочечников. Основной глюкокортикоид — гидрокортизон (кортизол). Глюкокортикоиды получили свое название за то, что являются регуляторами углеводного обмена, усиливая цепь реакций, приводящих к образованию главного углевода в организме — глюкозы. Кроме того, кортизол тормозит расход глюкозы в периферических органах и тканях. Под влиянием кортизола тормозится проникновение пищевых
аминокислот из крови в различные клетки и, как следствие, стимулируются процессы распада белка в различных тканях, что при некоторых патологиях может привести к снижению мышечной массы, замедлению заживления ран. Кортизол также тормозит образование жиров. Кортизол, как и все другие глюкокортикоиды, подавляет развитие воспаления. Воспаление характеризуется тремя симптомами: во-первых, притоком крови к воспаленному участку и его покраснением; во-вторых, увеличением проницаемости стенок капилляров в воспаленном участке и поступлением жидкости из капилляров в межклеточные пространства, т. е. отеком; и, в-третьих, как следствие первых двух процессов — болевыми ощущениями. Все эти три симптома устраняются кортизолом.
Глюкокортикоиды угнетают иммунитет, подавляя образование антител к чужеродным белкам, что позволяет использовать их для торможения реакций отторжения пересаженных органов. В ряде случаев, при кратковременном выбросе кортизола в кровь, описанные реакции не опасны для организма, однако длительное повышение уровня глюкокортикоидов в крови может привести к тому, что симптомы какого-либо инфекционного заболевания будут подавлены, а болезнь от этого не станет менее опасной. Поэтому применять глюкокортикоиды в качестве лекарств нужно только по назначению врача.
Кортизол необходим для создания реакции на сильные раздражители, приводящие к развитию стресса. Стресс можно определить как угрожающую ситуацию, развивающуюся под воздействием боли, кровопотери, страха. Кортизол препятствует кровопотере и, способствуя развитию сосудосуживающего эффекта норадреналина, сужает мелкие артериальные сосуды. Он усиливает сократительную способность сердечной мышцы. Кортизол помогает лучше переносить состояние физиологического шока, он обладает также пермиссивными эффектами, облегчая эффекты тироксина и норадреналина.
Секреция глюкокортикоидов регулируется АКТГ, причем под действием этого гормона не только усиливается секреция, но и стимулируется рост коры надпочечников, т. е. увеличивается масса ткани, способной вырабатывать кортизол. В течение всей жизни человека в клетках сетчатой зоны коры надпочечников вырабатываются мужские и женские половые гормоны. Так, у мужчин две трети половых гормонов — андрогенов синтезируется в семенниках, а одна треть — в коре надпочечников. При разрушении клеток коры надпочечников развивается болезнь Аддисона. Раньше хроническая недостаточность коры являлась, главным образом, следствием туберкулезной инфекции. В настоящее время это заболевание чаще возникает из-за разрушительного воздействия на кору надпочечников антител, ошибочно вырабатываемых клетками иммунной системы. У больных с болезнью Аддисона резко повышена секреция кортиколиберина и АКТГ, за счет чего организм пытается повысить выработку гормонов коры надпочечников, что невозможно по причине ее разрушения. Но кортиколиберин является также и фактором, усиливающим секрецию меланоцитстимулирующего гормона гипофиза, который, в свою очередь, приводит к синтезу большого количества пигмента меланина и потемнению кожи. У больных, кроме того, развивается мышечная слабость, снижается масса тела, страдает память и умственные способности, ослабевает концентрация внимания, иногда развиваются депрессии. Наблюдается усиленное выведение натрия с мочой и повышение уровня калия в крови. Для лечения болезни Аддисона необходимо постоянно вводить кортикостероиды. Возможна и противоположная патология: из-за усиленной секреции кортиколиберина или АКТГ наблюдается гиперфункция коры надпочечников и возникает синдром Кушинга. Еще одно заболевание, связанное с корой надпочечников, — адреногенитальный синдром, вызываемый врожденным отсутствием ферментов, необходимых для синтеза кортизола.
На систему гипоталамус — аденогипофиз нехватка кортизола оказывает стимулирующий эффект, и усиленная секреция кортиколиберина гипоталамусом и АКТГ аденогипофизом должна бы повысить уровень кортизола, что в этой ситуации невозможно. Зато естественно усиливается синтез других стероидов коры надпочечников и очень часто — мужских половых гормонов (андрогенов). При этом у девочек, несмотря на нормальный женский генотип, происходит развитие организма по мужскому типу и формируется мужской фенотип. Очень редко кора надпочечников начинает секретировать повышенные количества андрогенов в зрелом возрасте. В этом случае у женщин наблюдается оволосение по мужскому типу, облысение, уменьшение молочных желез, увеличение клитора. В мозговом веществе надпочечников содержатся специализированные клетки, синтезирующие два гормона: адреналин и норадреналин, относящиеся к классу катехоламинов и вырабатываемые из аминокислоты тирозина. Секреторную активность клеток мозгового вещества стимулирует медиатор ацетилхолин, выделяемый из окончаний преганглионарных симпатических нейронов, подходящих к этим клеткам. Таким образом, по своему эмбриональному происхождению и иннервации мозговое вещество надпочечников — симпатический нервный узел. Из клеток мозгового вещества выделяется приблизительно 80% адреналина и 20% норадреналина. Мишенями этих гормонов являются все ткани организма. Адреналин и норадреналин призваны мобилизовать все силы человека в случае ситуаций, требующих большого физического или умственного напряжения, при травме, инфекции, испуге. Под влиянием внешних или внутренних стрессовых факторов происходит секреция этих гормонов, которые увеличивают частоту сердечных сокращений и выброс крови при каждом из них; повышают давление крови для улучшения снабжения кислородом и глюкозой; учащают дыхание и расширяют бронхи; тормозят перистальтику (сокращение) желудочно-кишечного тракта. Кроме того, адреналин и норадреналин стимулируют энергетический обмен. Так как основным источником энергии в организме служит глюкоза, то под действием этих гормонов распадается полимер глюкозы гликоген, хранящийся в печени; при этом образуется много молекул глюкозы, поступающих в кровь. Стимулируется также распад жиров для покрытия энергетических затрат. Адреналин и норадреналин вызывают повышение возбудимости структур головного мозга, что также адаптирует нервную систему к работе в условиях стресса. Таким образом, когда человек или животное
находится в опасности, то гормоны мозгового вещества создают все условия для успешной борьбы или не менее успешного бегства. Многообразие эффектов адреналина и норадреналина связано с тем, что в различных тканях они реагируют с имеющимися там несколькими видами рецепторов.
Патологии мозгового вещества надпочечников возникают редко, однако при развитии в этой области опухоли (феохромоцитомы) происходят приступообразные выбросы адреналина, причем симптомы, наблюдаемые при этом, те же, что и при избыточном возбуждении симпатического отдела вегетативной нервной системы. Клинически феохромоцитома проявляется подъемом артериального давления (злокачественная гипертензия), не поддающаяся медикаментозному лечению.
Единственный метод лечения — хирургический. Любое разрушение или искусственное удаление надпочечников (адреналэктомия) приводит к быстрой гибели. Эффекты гормонов мозгового слоя надпочечников очень близки к эффектам, возникающим при возбуждении симпатического отдела вегетативной нервной системы, и обе эти системы, каждая своими путями, обеспечивает выживание организма в неблагоприятных условиях существования.
Кора надпочечников вырабатывает кортикостероиды. Часть из них («минералокортикоиды») регулирует обмен калия и натрия в почках. Вторая часть («глюкокортикоиды», ос-новной представитель кортизол) управляет обменом глюкозы в организме, в частности, усиливает ее образование из других веществ (белков, жиров); особенно ярок этот эффект при стрессе. В целом глюкокортикоиды перестраи-вают обмен веществ на усиленное потребление энергии, «сопровождая» эффекты симпатической НС и адреналина. Глюкокортикоиды, кроме того, тормозят активность иммунной системы и развитие воспаления, что позволяет использовать их как противовоспалительные препараты.
Выделение глюкокортикоидов усиливает кортикотропин = адренокортикотропный гормон (АКТГ или АСТН). Выделение АКТГ активирует кортиколиберин (CRH). Кортизол тормозит выброс АКТГ и CRH.
АКТГ (АСТН) состоит из 39 аминокис-лот. Его фрагменты длиной 7-10 а/к способны проникать в ЦНС, оказывая ноотропное действие, улучшая обуче-ние и память, снижая проявления депрессивности (препарат СЕМАКС). Кортиколиберин (CRH) стимулирует двигательную активность и эмоциональные проявления; снижает пищевую и половую мотивации. В последнее время система CRH - АКТГ – глюкокортикоиды интенсивно исследуется в связи с возможностями управления весом организма.
7-2. Синтез, взаимопревращения и инактивация глутаминовой кислоты и ГАМК. Значение аминокислот для деятельности мозга.
Медиаторы-аминокислоты являются главными медиаторами ЦНС.
Глутаминовая кислота (Glu) – главный возбуждающий меди-атор (около 40% всех нейронов); проведение основных потоков информации в ЦНС (сенсорные сигналы, двигат. команды, память).
Гамма-аминомасляная кислота (ГАМК) – главный тормозный медиатор (также около 40% всех нейронов); запрет проведения «ненужной» информации (внимание, двигательный контроль).
Нормальная деятельность ЦНС обеспечивается тонким балансом Glu и ГАМК.
Нарушение этого баланса (как правило, в сторону уменьшения торможения) негативно влияет на многие нервные процессы – вплоть до возникно-вения мощных локальных очагов возбуждения, что ведёт к развитию эпилептических припадков.
Глутаминовая кислота и ГАМК – конкуренты и партнёры.
При нарушении баланса Glu и ГАМК:
- синдром дефицита внимания и гиперактивности детей (СДВГ);
- повышенная нервозность и тревожность взрослых;
- нарушения сна, бессонница;
- эпилепсия (чаcто врожденная патология, у 0.5% населения).
В клинических целях используют агонисты ГАМК и антагонисты Glu. Антагонисты ГАМК и агонисты Glu – яды, вызывающие судороги (конвульсанты).
Глутаминовая кислота. Пищевая аминокислота – входит в состав белков пищи и белков нашего тела; самая распространенная: потребляем с едой 5-10 г в сутки. Стандартная структура; радикал -СН2-СН2-СООН. В водных растворах существует в ионизированном виде, то есть в форме отрицательно заряженного остатка глутамата («глютамата»).
Для синтеза необходимы: a-кетоглутаровая кислота (промежуточный продукт окисления глюкозы в цикле Кребса; в больших количествах образуется в митохондриях); аминогруппа любой а/к, полученной с пищей; фермент из группы аминотрансфераз. Такой синтез идет во всех клетках организма.
Другой («быстрый») путь синтеза, характерный для нейронов: взаимные превращения Glu и очень сходной пищевой а/к глутамина: замена второй ОН-группы Glu на аминогруппу NH2.
глутамин Þ Glu (фермент глутамин синтетаза;
в пресинаптических окончаниях)
Glu Þ глутамин (фермент глутаминаза; при
инактивации Glu)
Для синтеза необходимы: a-кетоглутаровая кислота (промежуточный продукт окисления глюкозы в цикле Кребса; в больших количествах образуется в митохондриях);
аминогруппа любой а/к, полученной с пищей; фермент из группы аминотрансфераз. Такой синтез идет во всех клетках организма.
Во всех тканях организма (в т.ч. в мозге) очень много Glu. В связи с этим долгое время не могли поверить, что столь распространенное вещество является медиатором ЦНС. Однако это именно так. Дело в том, что пищевой глутамат почти не преодолевает ГЭБ, и для выпол-нения медиаторных функций Glu синтезируется непосредственно в пресинаптических окончениях из глутамина; определенный вклад вносит также образование Glu из a-кетоглутаровой кислоты (a-KG).
После синтеза Glu загружается в везикулы (◄ ), выбрасывается в синаптическую щель при приходе ПД и влияет на рецепторы ( ↓↓↓ ), запуская ВПСП.
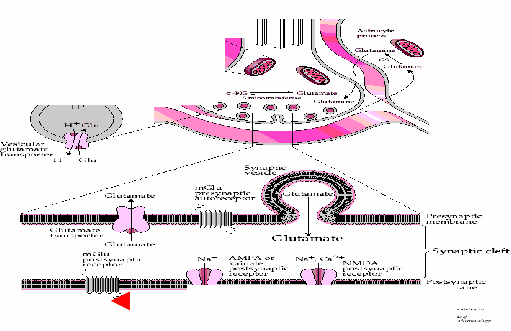
Введение Glu непосредственно в мозг (в желудочки) вызывает возбуждение ЦНС и судороги.
Сходные эффекты наблюдаются при отравлении агонистами Glu, часть из которых является токсинами растений. Пример: домоевая кислота; вырабатывается некоторыми одноклеточными водорослями; токсин накапливается в телах животных, поедающих фитопланктон (двустворчатые моллюски, некоторые рыбы) и способен отравлять птиц, млекопитающих, человека. Смертельные случаи: западное побережье Канады; «бешенство» птиц в Калифорнии (Дюморье, Хичкок).
Инактивация Glu: Из синаптический щели Glu l переносится в глиальные клетки, где превращается в глутамин (Gln) l (с помощью фермента глутаминазы).
Глутамин затем может перемещаться в пресинаптическое окончание и вновь становиться Glu в митохондриях.Часть Glu возвращается из синаптической щели прямо в пресинаптич. окончание («обратное всасывание»).
ГАМК. Непищевая аминокислота: аминогруппа в 3-м (g) положении. Синтез – из глутаминовой кислоты за счет отщепления СО2 (фермент глутамат декарбоксилаза).
ГАМК может использоваться в качестве медиатора, но может терять аминогруппу (фермент ГАМК-трансфераза) и быстро окисляться с выдел. энергии.
Именно для нейронов характерна следующая цепь реакций: глюкоза ® … ® a-кетоглутаровая кислота ® Glu ® ГАМК ® … ® энергия
ГАМК на 10% проходит ГЭБ. Однако при ее системном введении (таблетки «Аминалон») наблюдается не столько торможение ЦНС, сколько «питание» нейро-нов и улучшение их общего состояния (ноотропное действие ГАМК).
Инактивация ГАМК. В значительной мере сходна с инактивацией Glu: обратное всасывание ГАМК в пресинаптическое окончание либо всасывание глиальными клетками. В последнем случае ГАМК разрушается ферментом ГАМК трансферазой: аминогруппа ГАМК переносится на a-кетоглутаровую кислоту с образованием Glu. Далее Glu может превращаться в глутамин, который транспортируется в пресинаптическое окончание, опять становится Glu, а из Glu образуется ГАМК. Круг замкнулся.
Инактивация ГАМК происходит в основном путем обратного всасывания в пресинаптическое окончание и последующего превращения в глутаминовую кислоту. Реакцию эту осуществляет особый фермент ГАМК-трансфераза. Его блокаторами являются соли вальпроевой кислоты. Они оказывают транквилизирующее и противосудорожное действие. Вальпроаты особенно полезны при малых формах эпилепсии. Вызываемые ими побочные депрессантные изменения, как правило, минимальны.

ГАМК транс-фераза
7-3. Средний мозг: четверохолмие и реакция на новизну. Движения глаз – слежение и саккады (роль черепных нервов, черной субстанции, полосатого тела).
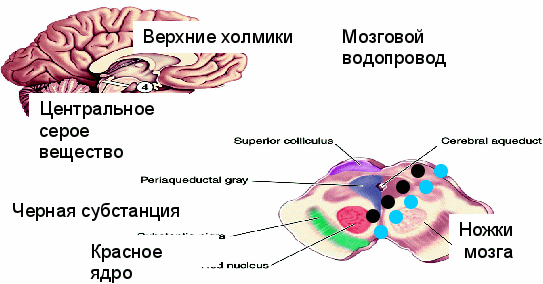
Средний мозг: четверохолмие, центральное серое вещество (ЦСВ), красное ядро, черная субстанция, покрышка.
ЦСВ – продолжение РФ продолгова-того мозга и моста, главный центр сна; управляет входящими в состав РФ ядрами шва.
Четверохолмие – анализ сенсорных сигналов, запуск реакции на новые стимулы (ориентировочный рефлекс – поворот глаз, головы и всего тела в сторону источника сигнала).
Красное ядро и черная субстанция – двигательные центры; покрышка (вентральные ядра) содержит DA-нейроны, аксоны – к коре и прилежащему ядру (один из важнейших центров положит. эмоций).
Главный центр сна: центральное серое вещество среднего мозга и ядра шва (5-НТ); аксоны нейронов ядер шва также расходятся по всей ЦНС, снижая ее тонус и тормозя, в числе прочего, центры бодрствования. Торможение коры происходит за счет снижения активности Glu-нейронов таламуса, чьи аксоны идут в большие полушария.
Центральное серое вещество: собирает большое число информационных потоков и через ядра шва влияет на уровень бодрствования, болевой чувствительности и др. (см. лекцию о DA и 5-НТ).
Четверохолмие: реакция на новизну; верхние холмики – на новые зрительные стимулы; нижние холмики – на новые слуховые стимулы.
При появлении новых стимулов четверохолмие запускает ориентировочный рефлекс – поворот глаз, головы и всего тела в сторону источника сигнала («любопытство», исследова-тельское поведение).
Четверохолмие: нейроны-детекторы новизны (ДН) – сравнение текущего сигнала с тем, который был «только что» (доли секунды назад, передается через тормозный интернейрон: ТИ). При несовпадении – запуск ориентировочного рефлекса (через глазодвигательные центры и тектоспинальный тракт; у животных – отдельно двигаются ушные раковины).
Движения глаз:
- с каждым глазом связано по 6 мышц, управляемых III, IV и IV нервами;
- два основных типа движений глаз – слежения и саккады (быстрые скачки);
- в основе врожденные программы, но мы учимся ими управлять (исходно – про-извольные движения,затем они автома-тизируются);
- тесты на рассматривание картинок – еще одно «окно в бессознательное».
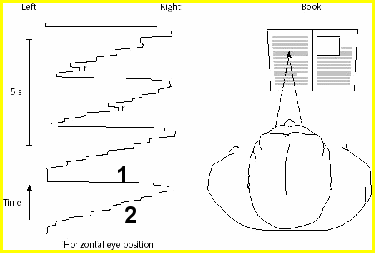
Чтение: [1] – скачок в начало строки; [2] мини-саккады (5-7 скачков вдоль строки, текст читается «в несколько приемов»).
Чёрная субстанция. Медиальная «компактная» часть l , DA-нейроны, аксоны идут в базаль-ные ганглии (полосатое тело = скорлупа, хвостатое ядро); общий уровень двигат. активности и положит. эмоции, связанные с движениями. Латеральная «ретикулярная» часть l , ГАМК-нейроны, контролирующие движения глаз (торможение «несанкционированных» реакций).
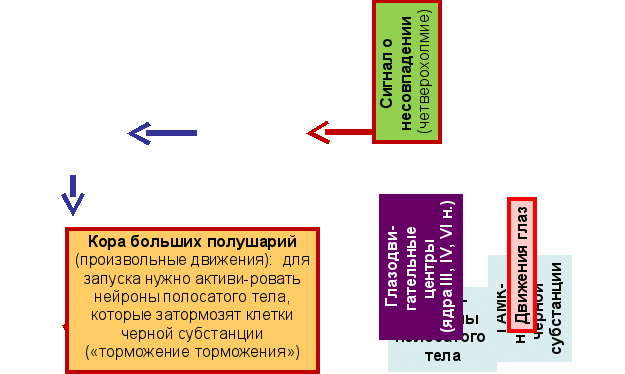
Красное ядро. Передняя мелкоклеточная часть: вместе с нижней оливой передает сигналы от коры больших полушарий к мозжечку и участвует в двигательном обучении.
Задняя (крупноклеточная) часть эволюционно более древняя, содержит Glu-нейроны; аксоны идут в спинной мозг (руброспинальный тракт; поддержание тонуса мышц, ряд сгибательных рефлексов и сгибание конечностей при локомоции).
К ядрам верхних холмиков приходят чувствительные импульсы от сетчатки глаза. Ответная (рефлекторная) реакция формируется в виде ориентировочного рефлекса — поворота глаз и головы к свету. В зависимости от яркости света изменяются величина зрачка и кривизна хрусталика. Аккомодация (приспособляемость) глаза способствует ясному видению предметов. К ядрам нижних холмиков направляются чувствительные импульсы от органов слуха. Ответная реакция заключается в повороте головы, глаз в сторону звуков.
Черная субстанция состоит из латеральной (ретикулярной) и медиальной (компактной) частей. Нейроны компактной части содержат в качестве медиатора дофамин; их аксоны направляются вперед к базальным ядрам (ганглиям) больших
полушарий. Ретикулярная часть участвует в управлении движениями глаз.
8-1. Щитовидная железа и эпифиз: выделяемые гормоны и их эффекты (в т.ч. действие на нервную систему).ЦНС и управление работой щитовидной железы и эпифиза.
Промежуточный мозг: гипофиз и эпифиз (эндокринные железы); таламус, гипоталамус, субталамус.
Начнем со щитовидной железы. Она выделяет йод-содержащие гормоны тироксины, усиливающие обмен веществ (образование энергии) во всех клетках организма, в т.ч. в мозге. Выделение тироксинов (Т4 и Т3) усиливает тиреотропный гормон передней доли гипофиза (TSH). Гипоталамус, измеряя концентрацию тироксинов в крови, усиливает выделение либо статина (его роль играет дофамин) либо либерина (тиролиберина, TRH; является также либерином пролактина). Тиролиберин активирует выброс TSH. Опасен как дефицит, так и избыток тироксинов в организме. При дефиците (например, из-за нехватки йода в пище) – снижение обмена веществ, вялось, депрессии («микседема»); у новорожденных – оставание умственного развития. При избытке – нервозность, бессонница, повышенный аппетит и худоба, гиперактивность симпатичес-кой НС, «выпученные» глаза. Причиной в обоих случаях могут быть аутоиммунные нарушения. Тиролиберин (трипептид Glu-His-Pro) значимо влияет на работу ЦНС. Он «дополняет» действие тироксинов: увеличивает уровень бодрствования, оказывает антидепрессантное действие, усиливает работу дыхательного центра (в клинике: введение недоношенным детям).
Мелатонин – гормон эпифиза. Синтезируется из триптофана (как и серотонин). «Гормон сонного состояния»: снижает активность обмена веществ во многих внутренних органах и ЦНС. Выделением управляют центры сна и бодрствования. В темноте супрахиазменные ядра (SCN) активируют выделение мелатонина; при этом они тормозят (с помощью GABA, т.е. ГАМК) паравентрикулярные ядра гипоталамуса (PVN), которые через нейроны бокового рога серого вещества спинного мозга (ILC) и шейные симпатические ганглии (SCG) сдерживают выделение мелатонина. Мелатонин используется в качестве лекарства при бессоннице (облегчает засыпание).
Главный гормон щитовидной железы — тироксин содержит четыре атома иода, и поэтому его принято обозначать как Т4. Через несколько лет после открытия тироксина был обнаружен второй гормон щитовидной железы — трииодтиронин, или Т3, который активнее Т4 приблизительно в 5 раз.
Гормоны щитовидной железы обладают внутриклеточной рецепцией, воздействуя на генетический аппарат клетки. Для этих гормонов также справедлив принцип разделения их молекул на участки с различными функциями. Показано, что у Т3 кольцо А, к которому присоединены два атома иода, является гаптоном, т. е. отвечает за прикрепление всей молекулы гормона к рецептору, а кольцо В, с одной молекулой иода, — актон, ответственный за генерацию биологического эффекта. Практически все клетки организма чувствительны к воздействию тиреоидных гормонов, эффекты которых можно
подразделить на две группы: регуляция обмена веществ и регуляция процессов роста и развития.
Итак, Т4 и Т3 воздействуют на клетки мышц, печени, сердца, почек, нейроны, усиливая в них интенсивность обмена, повышая потребление кислорода, увеличивая чувствительность клеток к медиатору норадреналину. Под воздействием этих гормонов усиливается выработка АТФ в митохондриях; Т4 и Т3 повышают уровень обмена углеводов, жиров, белков, вызывают усиление высвобождения энергии в виде тепла. Эти
эффекты гормонов развиваются медленно, и от момента повышения их концентрации в крови до возникновения обменных эффектов может проходить до 48 ч. Это связано с механизмом действия тиреоидов, связанным с таким сложным многофазным процессом, как синтез белка. Еще медленнее развиваются эффекты тиреоидов, которые относятся к гормонам регуляции роста и развития, причем эти эффекты развиваются чаще при совместном действии тиреоидов и гормона роста. Гормоны щитовидной железы стимулируют рост тела и развитие всех систем организма, и особенно нервной системы.
Эпифиз — маленькая железа, массой всего 170 мг, являющаяся выростом крыши третьего желудочка мозга и расположенная между верхними буграми четверохолмия. Гормон эпифиза — мелатонин по своему химическому строению является модификацией медиатора ЦНС серотонина, который в свою очередь синтезируется из аминокислоты
триптофана. Секреция мелатонина уменьшается на свету и усиливается в темноте. Показано увеличение секреции этого гормона у слепых людей. Мелатонин обладает мембранной рецепцией и действует через систему G-белков на активность аденилатциклазы, подавляя ее. Под воздействием мелатонина происходят изменения в обмене черного пигмента — меланина, локализованного в коже, радужке, сетчатке, некоторых структурах мозга, в результате кожа светлеет, повышается чувствительность фоторецепторов сетчатки. Мелатонин участвует в обеспечении суточных ритмов человека, в том числе и ритмов секреции ряда гормонов. Мелатонин —
антигонадотропный гормон. Его секреция снижается при половом созревании, что стимулирует замыкание системы гипоталамус — гипофиз — гонады. Мелатонин обладает целым рядом воздействий на функции мозга. Так, увеличенное образование и секреция его в темноте может приводить к депрессии у лиц, вынужденных бодрствовать и работать в темное время суток. Повышенный уровень мелатонина индуцирует сонливость, вялость, может вызвать длительный глубокий сон. По-видимому, угнетая синтез некоторых факторов, усиливающих рост тканей, ускоряющих деление клеток, мелатонин может тормозить развитие опухолей.
8-2. Два типа рецепторов ацетилхолина (Ацх), их свойства. Агонисты и антагонисты рецепторов Ацх: примеры веществ и разнообразие эффектов.
Известны 2 типа рецепторов к Ацх: первый из них реагирует на Ацх и агонист никотин (токсин табака), второй реагирует на Ацх и агонист мускарин (токсин мухомора). Классический антагонист Ацх-рецепторов первого типа («никотиновых») – курарин; классический антагонист Ацх-рецепторов второго типа («мускариновых») – атропин (курарин и атропин – Ацх-подобные растит. токсины).
Никотиновый рецептор:
- ионотропный («быстрый»)
- всегда генерирует ВПСП (вход Na+)
- пример: нервно-мышечные синапсы
- состоит из 5 белковых молекул-субъединиц (чаще всего: 2a+b+g+d; расположены по кругу и образуют пору)
- антагонисты: курарин (блокирует активный центр), a-нейротоксин яда кобры (белок, блокирует пору)
- пропускает, кроме Na+, ионы К+ и, гораздо сла-бее, Са2+ (в реальных условиях доминирует вход Na+ ; ионы Cl- оттал-киваются отрицат. заря-дами на стенках поры)
Мускариновый рецептор:
- метаботропный (через G-белки и вторичные посредники)
- могут возникать ТПСП либо ВПСП: как правило, через воздейс-твие на хемочувствительные К+-каналы (откр. либо закр.)
- пример: синапсы, образуемые нейронами парасимпатической системы (торможение либо активация работы внутренних органов)
- часть эффектов – через ослабление активности Ca2+-каналов
- «классический» антагонист – атропин
Никотиновые рецепторы являются классическим примером ионотропных рецепторов: их ионный канал входит в состав рецептора и открывается сразу после присоединения ацетилхолина. Канал этот характеризуется универсальной проницаемостью для положительно заряженных ионов, но в обычных условиях (при открытии на фоне ПП) в связи с никотиновыми рецепторами наблюдается в основном входящий Na+-TOK, вызывающий деполяризацию мембраны и возбуждение нейрона. Никотиновые рецепторы расположены на постсинаптической мембране поперечно-полосатых волокон скелетных
мышц (нервно-мышечные синапсы); в синапсах вегетативных ганглиев и в меньшем количестве, чем мускариновые рецепторы, в ЦНС. Областью, наиболее чувствительной к никотину, являются вегетативные ганглии, поэтому первые попытки курения приводят к значительным нарушениям в деятельности органов: скачкам артериального давления, тошноте, головокружению. По мере привыкания сохраняется в основном симпатический компонент действия: никотин начинает работать преимущественно как стимулятор многих систем организма. Присутствует также и центральное активирующее влияние (на головной мозг) ацетилхолина. Сверхдозы никотина E0 и более мг) вызывают резкое учащение сердцебиения, судороги и остановку дыхания. Во время курения никотин действует как слабый наркотический препарат-стимулятор, вызывая развитие не только
привыкания, но и зависимости. Наркотическая зависимость — это ситуация, когда организм включает поступающий извне препарат в свой метаболизм, т. е. начинает «рассчитывать» на его постоянный приток. При отказе от препарата происходит сбой в использующих его системах мозга: наблюдается резкое ухудшение самочувствия, депрессия {абстинентный синдром или синдром отмены)- Человеку, попавшему в зависимость, наркотик необходим уже не столько для того, чтобы почувствовать бодрость и эйфорию, сколько для возврата хотя бы к относительно нормальному уровню
жизнедеятельности. Наиболее известным антагонистом никотиновых рецепторов является тубокурарин — активное действующее начало яда некоторых южноамериканских растений. Основным «местом приложения» его влияния являются нервно-мышечные
синапсы. При этом происходит последовательное расслабление и паралич мышц пальцев, затем глаз, рук и ног, шеи, спины и, наконец, дыхательных.
Мускариновые рецепторы являются метаботропными; они связаны с G-белками, и присоединение к ним ацетилхолина приводит к синтезу вторичных посредников.
Выделяют две основные локализации мускариновых рецепторов: синапсы, образуемые постганглионарными (в основном парасимпатическими) вегетативными волокнами и ЦНС. В первом случае в качестве вторичных посредников используются инозитолтрифосфат и диацилглицерол; во втором — цГМФ. Ионные последствия возбуждения мускариновых рецепторов весьма разнообразны: в сердце наблюдается увеличение проводимости для ионов К+, что приводит к гиперполяризации и снижению частоты сокращений; в гладких мышцах отмечаются изменения проводимости как для К+, так и для Na+ (возможна гипер- или деполяризация в зависимости от конкретного органа).
Эффекты мускарина носят преимущественно парасимпатический характер: при отравлении мухоморами наблюдается тошнота, повышенное пото- и слюноотделение, слезотечение, боли в животе, снижение артериального давления и сердечной активности.
Классическим антагонистом мускариновых рецепторов является атропин — токсин белены и дурмана. Его периферические эффекты прямо противоположны действию мускарина: происходит снижение тонуса мышц желудочно-кишечного тракта, учащается сердцебиение, прекращается слюноотделение (сухость во рту), расширяются зрачки, наблюдаются и центральные эффекты (двигательное и речевое возбуждение, галлюцинации).
8-3. Средний мозг: функции красного ядра (крупноклеточной и мелкоклеточной частей) и черной субстанции (медиальной и латеральной частей).
Средний мозг: четверохолмие, центральное серое вещество (ЦСВ), красное ядро, черная субстанция, покрышка
Красное ядро и черная субстанция – двигательные центры; покрышка (вентральные ядра) содержит DA-нейроны, аксоны – к коре и прилежащему ядру (один из важнейших центров положит. эмоций).
Чёрная субстанция.Медиальная «компактная» часть l , DA-нейроны, аксоны идут в базаль-ные ганглии (полосатое тело = скорлупа, хвостатое ядро); общий уровень двигат. активности и положит. эмоции, связанные с движениями. Латеральная «ретикулярная» часть l , ГАМК-нейроны, контролирующие движения глаз (торможение «несанкционированных» реакций).


Красное ядро. Передняя мелкоклеточная часть: вместе с нижней оливой передает сигналы от коры больших полушарий к мозжечку и участвует в двигательном обучении.
Задняя (крупноклеточная) часть эволюционно более древняя, содержит Glu-нейроны; аксоны идут в спинной мозг (руброспинальный тракт; поддержание тонуса мышц, ряд сгибательных рефлексов и сгибание конечностей при локомоции).