Работа выполнена в отделе вирусологии им. А. А
| Вид материала | Автореферат |
- -, 260.28kb.
- -, 428.63kb.
- -, 219.49kb.
- Автореферат диссертации на соискание ученой степени, 348.21kb.
- Архитектура стран Закавказья VII в.: формирование и развитие традиции, 671.39kb.
- Восточнославянский мифологический текст: семантика, диалектология, прагматика, 970.28kb.
- Биологические основы создания пробиотиков направленного действия для медицины, сельского, 625.36kb.
- О. А. Панфиленко Общая характеристика работы, 470.75kb.
- Восточноманычская катакомбная культура (анализ погребальных памятников) Исторические, 398.66kb.
- Момент окончания преступления, 253.06kb.
Реинфекцию высокопатогенным вирусом А(H5N1) проводили на 21 день после первичной иммунизации в случае однократной вакцинации или на 21 день после последней иммунизации – в случае двукратного введения вакцины. После введения заражающего вируса в контрольной группе гибель животных наблюдалась, начиная с 6-го дня инфекции, и достигала 100% к 9-му дню. Иммунизация ЖГВ из штамма Лен 17/Н5 оказалась наиболее эффективной: двукратное введение защищало 87% иммунизированных животных против 27 ЛД50 заражающего вируса (р<0,001), а однократная иммунизация ЖГВ была эффективной на 57% (р=0,006). У животных, выживших после введения летальной дозы вируса A(H5N1), были также собраны сыворотки крови на 21 день после заражения. Показано, что титры антигемагглютинирующих антител после инфекции ВП вирусом подтипа А(H5N1) были всего в 2 раза выше (1:160), чем после двукратной иммунизации ЖГВ подтипа A(H5N2) (1:80). Таким образом, была продемонстрирована корреляция более высокого уровня создаваемой защиты против ВП вируса А(H5N1) при двукратном применении ЖГВ Лен 17/Н5 с более высоким уровнем сывороточных перекрестно-реагирующих антител.
БЕЗВРЕДНОСТЬ И ИММУНОГЕННОСТЬ ЖГВ «ОРВАКС» ПОДТИПА А(H5N2) В ОГРАНИЧЕННОМ КЛИНИЧЕСКОМ ИЗУЧЕНИИ
С целью разработки модели для клинической оценки вакцинных препаратов потенциально пандемического подтипа Н5 ФГУП НПО «Микроген» были подготовлены экспериментальные серии ЖГВ «Орвакс» из реассортантного штамма Лен 17/Н5. Клинические исследования проводили в сотрудничестве с зам. начальника ВЦ НИИМ МО РФ по научной работе к.м.н., ст. науч. сотр. В.И. Марковым и нач. отдела к.б.н., ст. науч. сотр. С.А. Мельниковым в соответствии с Протоколом исследования № ВГЖ-00/004/2006 «Оценка иммуногенных и протективных свойств вакцины гриппозной аллантоисной интраназальной живой, лиофилизат для приготовления раствора для интраназального введения (Орвакс)», согласованным с директором ФГУН ГИСК им. Л.А. Тарасевича. Изучение препарата, проводимое на клинической базе Военного госпиталя № 1137 Минобороны России, включало 2 этапа. Первый этап проводился на 20 добровольцах и согласно рекомендации «Комитета по этике при федеральном органе контроля качества лекарственных средств» в исследование не была включена группа плацебо. Во время второго этапа изучения в исследование была включена группа плацебо.
Безвредность. В ходе первого этапа испытаний показана безвредность и ареактогенность ЖГВ из реассортантного штамма Лен 17/Н5 для 20 вакцинируемых. ЖГВ вводили в дозе 6,9 lg ЭИД50/0,5 мл. Регулярная термометрия в течение 42 суток после вакцинации не выявила повышения температуры тела ни у одного добровольца (табл. 13).
Таблица 13
Клинические реакции у волонтеров, привитых живой гриппозной вакциной «Орвакс» после первой и второй вакцинации
| Вакцинация | Температурная реакция | Интоксикация | Катаральные явления в носоглотке | |||||||||
| 37,0 ºС | 37,1 – 37,5 ºС | 37,6 – 38,5 ºС | ≥ 38,6 ºС | |||||||||
| абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | абс. | % | |
| Первая (n=20) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8 | 40 |
| Вторая (n=20) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
Катаральные явления, наблюдаемые только после первичной иммунизации, были очень слабо выражены, возникали на 3-4 день после вакцинации и проходили самопроизвольно к 6-му дню, их развитие не коррелировало с выделением вакцинного вируса из ВДП привитых (r=-0,29, р>0,05) и последующим приростом специфических антител в сыворотке крови добровольца.
Результаты клинического обследования добровольцев врачами-специалистами разного профиля и проведенные лабораторно-инструментальные исследования свидетельствовали об отсутствии отклонений в самочувствии и в результатах анализов после иммунизации вакциной «Орвакс» в сравнении с фоновыми значениями.
Генетическая стабильность. У вакцинированных волонтеров были получены мазки из носа на различные сроки после первичной иммунизации и ревакцинации. Всего было получено 33 реизолята, 16 - от 11 добровольцев после первичной вакцинации, и 17 - от 14 добровольцев после ревакцинации. Все реизоляты были выделены либо после 3-х пассажей в РКЭ, либо после 1-2 пассажей в культуре клеток MDCK в присутствии 2 мкг/мл трипсина TPCK c последующим пассажем в РКЭ. В отличие от выделения реизолятов реассортантов современных эпидемических вирусов на основе донора аттенуации А/Ленинград/134/17/57(H2N2), которые ранее не удавалось получить в сроки более 3 суток после иммунизации (Egorov et al., 1993, Klimov et al., 2000), средняя продолжительность выделения вакцинного вируса Лен 17/Н5 после 1-й вакцинации и ревакцинации составила 5,5 суток, что согласуется с ранее полученными данными о замедленной репродукции ХА реассортантов птичьих вирусов в клетках млекопитающих (Suguitan et al., 2006). Ввиду того, что у нескольких волонтеров положительный результат выделения вакцинного вируса был получен несколько раз на разные сроки после прививки, интерес представляло изучение возможных изменений фенотипических и генотипических признаков этих реизолятов. Показано, что реизоляты, полученные от одних и тех же добровольцев на разные сроки после вакцинации, сохранили ts фенотип и все мутации в генах внутренних и неструктурных белков, охарактеризованные для донора аттенуации А/Ленинград/134/17/57(H2N2).
Иммуногенность. РТГА проводили с использованием в качестве антигенов гомологичного вируса Лен 17/Н5 и реассортантного штамма подтипа А(H5N1) А/Индонезия/05/2005 c модифицированным методом обратной генетики НА, полученного на основе штамма А/PR/8/34. После первичной иммунизации выявлено 5,9% 4-х кратных приростов специфических антител (рис.4) к вирусу А(H5N2). Повторная иммунизация с интервалом в 21 день значительно усиливала иммунный ответ, приросты гомологичных антител после ревакцинации были выявлены в 47,1% случаев (р=0,02). Показатели приростов среднегеометрических титров антител (СГТ) возрастали с большей интенсивностью у повторно привитых по сравнению с первично привитыми и составили 1,3-2,8 (р=0,005).
4-х кратные и более поствакцинальные сероконверсии нейтрализующих антител к вирусу А(H5N2) были выявлены у 4-х волонтеров после первой прививки (20%) и у 10 (50%) - после повторной вакцинации (рис. 4).
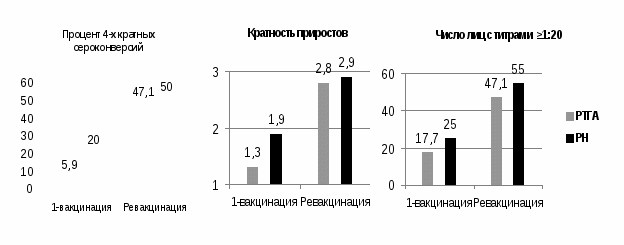 Рис. 4. Иммунный ответ на введение вакцины «Орвакс», n=20.
Рис. 4. Иммунный ответ на введение вакцины «Орвакс», n=20. Прирост СГТ нейтрализующих антител после первичной иммунизации составил в среднем 1,9, после ревакцинации этот показатель увеличился до 2,9 (р=0,01). Число лиц с титрами ≥1:20 антигемагглютинирующих и нейтрализующих антител к гомологичному вирусу А(H5N2), составил после первичной вакцинации 17,7 и 25% соответственно. После ревакцинации эти показатели составили 47,1% и 55% (рис. 4).
У волонтеров было выявлено образование перекрестно-реагирующих антител к реассортантному штамму подтипа A(H5N1), принадлежащему к антигенно и генетически удаленной линии вирусов подтипа Н5. Поствакцинальные титры антигемагглютинирующих антител ≥1:20 к вирусу A(H5N1) были выявлены среди 11,8% обследованных после первой прививки и у 29,4% - после ревакцинации (р<0,05), приросты СГТ к вирусу A(H5N1) составили 1,2 после первичной вакцинации и 1,6 – после ревакцинации.
Для непрямого варианта ИФА 96-луночные панели покрывали 0,5 мкг/мл очищенного НА штамма Лен 17/Н5, предоставленного ФГУП НПО «Микроген». Применение ИФА позволило выявить в сыворотках крови 4-кратные сероконверсии вирус-специфических IgG у 35% волонтеров после первой прививки и у 55% - после повторной вакцинации. При этом 4-кратные сероконверсии вирус-специфических IgА наблюдались у 45% волонтеров после первой прививки и у 60% - после повторной вакцинации. Средняя кратность приростов IgG составила 1,6 после первой прививки (р=0,03) и 2,5 – после ревакцинации (р<0,001). В отношении сывороточных IgА этот показатель составил соответственно 1,9 (р=0,02) и 3,2 (р=0,002). Необходимо отметить, что специфичность данного метода при оценке иммунного ответа к гриппу у взрослых людей может быть недостаточной, поскольку в этом случае часто наблюдается неспецифическое реагирование, в частности с ревматоидным фактором или аутоантителами (Salonen et al., 1992, Huang et al, 1992). При этом могут выявляться также антитела к антигенным детерминантам внутренних белков вирусов гриппа (в случае, если в качестве антигена используется цельный вирус). Если же в качестве антигена использовать очищенный или рекомбинантный НА, то неспецифическое реагирование может объясняться наличием общих антигенных эпитопов в НА вирусов подтипов Н1, Н2 и Н5 (Rowe et al., 1999) или конформационными изменениями в молекуле НА в процессе адсорбции на твердой фазе, делающими консервативные эпитопы более доступными для распознавания. В обоих случаях при исследовании сывороток взрослых людей наблюдается высокий иммунологический фон до прививки. Так, средний уровень сывороточных IgG до прививки в нашем исследовании составил 1:5000. В этом отношении более показательным оказалось изучение сывороточных IgА, средний титр которых до прививки составил 1:100. После вакцинации и ревакцинации эти показатели возросли соответственно до 1:256 и 1:400, при этом наблюдалась корреляция с уровнем локальных IgА в носовых секретах. Показано значительное (р=0,03) увеличение числа 4-х кратных сероконверсий секреторных IgA (SIgA) после ревакцинации (65%) по сравнению с первичной вакцинацией (30%). СГТ секреторных антител после ревакцинации составили 1:16.
Были проанализированы суммарные данные вирусологического подтверждения выделения вакцинного вируса от привитых и развития сероконверсий антител к гомологичному вирусу A(H5N2) по данным различных серологических тестов. Частота 4-х кратных сероконверсий по данным РТГА, РН и ИФА (IgG) не зависела от положительного или отрицательного результата выделения вакцинного вируса из носовых ходов привитых ни после первичной иммунизации, ни после ревакцинации (р>0,05).
Таким образом, результаты 1 фазы клинических испытаний показали, что количество реакций после введения вакцины «Орвакс» не превышало регламентированных норм, установленных Фармакопейной статьей на ЖГВ. Для получения реизолятов вакцинного вируса от привитых потребовалось не менее 2-3 пассажей на чувствительных культурах, что говорит о крайне незначительном содержании вируса в мазках из полости носа и свидетельствует о безопасности вакцины для окружающих. Показатели иммунного ответа после однократной иммунизации гриппозной вакциной подтипа Н5 были несколько ниже, чем при иммунизации сезонными гриппозными вакцинами, что является вполне закономерным в серонегативной популяции. Двукратная иммунизация значительно усиливала показатели иммуногенности вакцины «Орвакс». Европейским комитетом по контролю медицинских препаратов были установлены следующие критерии иммуногенности вакцинных препаратов на основе как эпидемических, так и потенциально пандемических вирусов гриппа: кратность приростов антител не менее 2,5 для лиц 18-60 лет и развитие достоверных сероконверсий у 40% привитых. Как видно из вышеприведенных данных, вакцина «Орвакс» подтипа А(H5N2) при двукратном введении соответствовала Европейским критериям иммуногенности по числу сероконверсий (47,1%) и по кратности приростов антигемагглютинирующих антител (2,8). В отношении числа лиц с защитным титром антител после прививки, до сих пор остается не выясненным вопрос, какой титр антигемагглютинирующих антител можно считать защитным в отношении потенциально пандемических вирусов - 1:20 или 1:40.
Тест микронейтрализации, который ранее был рекомендован для изучения антительного ответа в сыворотках лиц, перенесших инфекцию вирусами А(H5N1) (ВОЗ, 2005), оказался достаточно чувствительным и специфичным в выявлении поствакцинальных штаммоспецифических вирус-нейтрализующих антител после иммунизации ЖГВ. Необходимо отметить, что при оптимизации теста микронейтрализации желательно использовать клеточные линии MDCK, поддерживающие оптимальную репродукцию используемого в тесте вируса (Rowe et al., 1999), прошедшие не более 20-25 пассажей до замораживания в жидком азоте.
Изучение поствакцинального секреторного иммунитета показало, что вакцина способна вызывать значительный уровень иммунного ответа вирус-специфических IgA в ВДП, то есть непосредственно во входных воротах инфекции.
Необходимо отметить, что обычно рекомендуемая инфекционная активность ЖГВ из реассортантных штаммов вирусов гриппа А подтипов А(H1N1) и А(H3N2) составляет не менее 7,5 lg ЭИД50/0,2 мл. Однако, учитывая, что это был первый опыт применения среди людей ЖГВ подтипа H5, была использована сниженная доза вакцинного вируса (6,9 lg ЭИД50/0,5 мл). При этом после двукратной вакцинации с интервалом в 21 день удалось вызвать выраженный иммунный ответ. При проведении 2-го этапа клинических испытаний на 42 добровольцах, дважды получивших вакцину с интервалом в 21 день, доза вакцинного вируса была увеличена до 8,3 lg ЭИД50/0,5 мл. Данные по безвредности и реактогенности препарата полностью подтвердили ранее полученные показатели: отсутствовали температурные реакции и не было выявлено какого-либо неблагоприятного действия на организм привитых по данным инструментального и лабораторного обследования. По результатам иммуногенности за два года исследования был проведен суммарный анализ поствакцинального иммунного статуса привитых по данным двух серологических тестов (РТГА и РН) с учетом кратности вакцинации и дозы вакцинного вируса. Было показано, что после первичной иммунизации ЖГВ в дозе 6,9 lg ЭИД50/0,5 или 8,3 lg ЭИД50/0,5 мл общее число 4-х кратных сероконверсий сывороточных антител составило 23-50% соответственно, а после ревакцинации – 71-74% (рис. 5). При этом число сочетанных конверсий у одних и тех же лиц было относительно невысоким 0-2,4% после первой вакцинации и 14-24% после ревакцинации (r=-0,64-0,12, р>0,05).
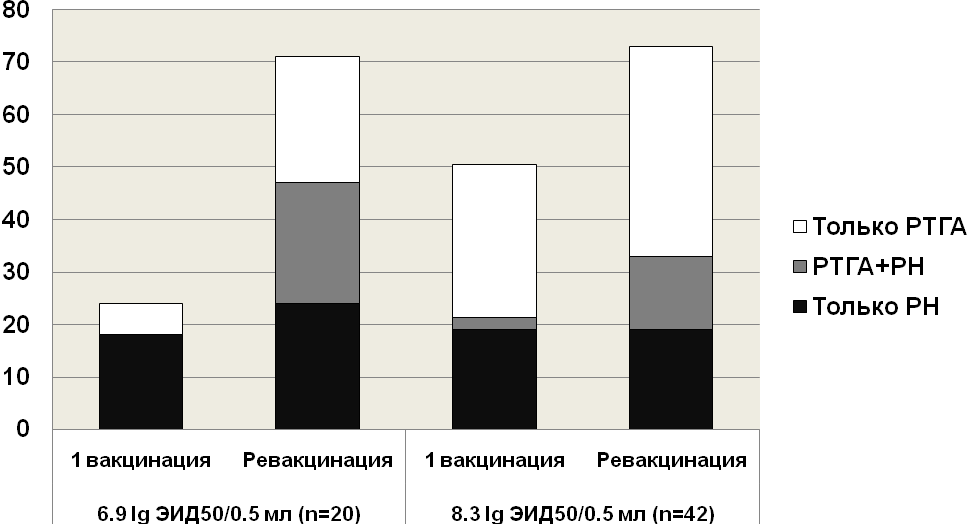
Рис. 5. Суммарный уровень сероконверсий в сыворотках крови привитых вакциной «Орвакс» по данным РТГА и РН.
Таким образом, по результатам 2-х исследований было установлено, что при оценке ЖГВ подтипа Н5 сочетанное применение тестов РТГА и МН для изучения гуморального иммунного ответа позволяет получить наиболее полную информацию о развитии сероконверсий в ответ на прививку.
РАЗРАБОТКА СТРАТЕГИИ И ТАКТИКИ ВАКЦИНОПРОФИЛАКТИКИ ГРИППА С ПОМОЩЬЮ ЖГВ В ИНТЕРПАНДЕМИЧЕСКИЙ ПЕРИОД И ПРИ ПОДГОТОВКЕ К ОЧЕРЕДНОЙ ПАНДЕМИИ
Вакцинация против гриппа во всем мире в первую очередь рекомендована лицам с высоким риском возникновения осложнений, в том числе пожилым людям старше 60 лет и лицам, страдающим хроническими соматическими заболеваниями, а также тем, кто в наибольшей степени подвержен риску заболевания гриппом и заражения других лиц. Из 3-х пандемий 20-го столетия две (1957 и 1968 гг.) вызвали наибольшую заболеваемость и смертность среди маленьких детей, пожилых и хронически больных людей (Potter, 2001).
Применение ЖГВ в группах высокого риска последствий заболевания гриппом. В настоящее время доля лиц в возрасте старше трудоспособного в общей численности населения России составляет 20,5% (26,8 млн. человек), а к 2025 г по прогнозам она возрастет до 26,7%. По программе ВОЗ совместно со специалистами из Центра по контролю и предупреждению заболеваний США на базе домов престарелых Санкт-Петербурга и Ленинградской области были разработаны схемы иммунизации лиц преклонного возраста и больных, страдающих хроническими заболеваниями сердечно-сосудистой системы и нарушениями обмена веществ, с использованием ХА реассортантной ЖГВ. Всего под наблюдением находилось 1177 человек в возрасте от 65 до 90 лет с различными диагнозами и уровнями функциональной активности Полученные данные клинического и лабораторного обследования престарелых и хронически больных, привитых ЖГВ, показали, что ХА тривакцина не вызывала каких-либо неблагоприятных реакций у этой группы лиц. Наиболее эффективным методом иммунизации в пожилом возрасте признано сочетанное введение ЖГВ+ИГВ с последующей ревакцинацией ЖГВ. Изучение особенностей поствакцинального ответа на введение ЖГВ у лиц пожилого возраста показало, что в этой возрастной группе живой антиген не уступает инактивированному в стимуляции циркулирующих сывороточных антител. У пожилых людей ЖГВ стимулировала образование секреторных IgA в титрах не ниже, чем у лиц молодого возраста, при этом их концентрация в секретах ВДП не снижалась на протяжении 3-х месяцев. В соавторстве с А.Н. Найхиным и др. (2002) было изучено влияние возрастных изменений на функцию клеточного иммунного ответа при иммунизации гриппозными вакцинами. Показано, что ЖГВ активно индуцировала продукцию Th1-маркерных цитокинов (ИЛ-2 и ИФН-γ) лимфоцитами периферической крови, стимулированными in vitro вирусом A(H1N1), как у молодых людей, так и у пожилых, тогда как ИГВ – только у молодых. Результаты продукции Th1-маркерных цитокинов хорошо согласуются с данными об индукции клеточного иммунного ответа в ответ на введение ЖГВ. Показатели ПАЛ у пожилых и молодых людей оказались соответственно в 2 и 1,5 раза выше после введения ЖГВ по сравнению с ИГВ, при введении которой увеличение этого показателя составило у пожилых не более 1,3, а у молодых людей отсутствовало.
Оценка эффективности вакцинации против гриппа в домах престарелых показала, что в эпидемический по гриппу период среди лиц, привитых ЖГВ, имело место снижение заболеваемости в 1,6-2,0 раза по сравнению с непривитыми.
Таким образом, было показано, что иммунизация ЖГВ лиц пожилого возраста является не только безвредной, но и имеет преимущество в отношении стимуляции локального и клеточного компонентов иммунного ответа. По данным проведенных исследований были разработаны методические рекомендации «Вакцинопрофилактика гриппа с помощью живой гриппозной вакцины среди лиц пожилого возраста».
Применение тривалентной ЖГВ, включающей реассортантные вакцинные штаммы на основе донора аттенуации А/Ленинград/134/17/57(H2N2), среди детей дошкольного возраста. По данным ВОЗ, начиная с 1997 г. 50% всех заболевших гриппом А(H5N1) составили лица до 18 лет, а 90% - лица до 37 лет (ВОЗ, 2007). По прогнозам ВОЗ, в случае возникновения пандемии, вызванной вирусами А(H5N1), наибольшему риску заболевания могут подвергнуться дети, подростки и люди молодого возраста. Дети дошкольного и школьного возраста являются основными распространителями гриппозной инфекции в обществе. В то же время имеются данные о том, что при массовой вакцинации детей резко снижается заболеваемость невакцинированных лиц более старшего возраста (Monto et al., 1999).
Для вакцинации детей в детских садах Ленинградской области применялась коммерческая тривалентная ЖГВ для взрослых, включающая реассортантные штаммы, подготовленные в отделе вирусологии НИИЭМ РАМН на основе штаммов, рекомендованных ВОЗ на 1999-2001 эпидемические сезоны: A/17/Пекин/95/25 (H1N1), A/17/Новая Каледония/99/50 (H1N1), A/17/Сидней/97/76 (H3N2) и B/60/Петербург/95/20. Данный раздел работы был выполнен в рамках совместной с ГИСК им. Л.А. Тарасевича «Программы исследований по оценке безвредности и иммуногенности живой гриппозной вакцины для детей в возрасте 3-6 лет как единого препарата для взрослых и детей». Исследования проводили в сотрудничестве с руководителем клиники НИИ гриппа РАМН проф., д.м.н. В.П. Дриневским и руководителем лаборатории испытаний новых средств защиты против вирусных инфекций д.м.н. М.К. Ерофеевой.
В течение 2-х эпидемических сезонов было обследовано и привито 369 детей. По суммарным данным 2-х лет исследования показано, что ЖГВ, включающая реассортантные вакцинные штаммы на основе донора аттенуации А/Ленинград/134/17/57 (H2N2), была ареактогенной при применении у детей 3-6 лет. ЖГВ не оказывала какого-либо побочного влияния на организм детей по данным частоты соматической и аллергологической патологии в течение 6 месяцев после прививки. Во время прививочного сезона 1999-2000 г. титры антигемагглютинирующих антител к вирусам гриппа А 1:40 после вакцинации наблюдались у 45-53% вакцинированных (к вирусу В – у 30 %), кратность приростов СГТ антител к вирусам гриппа А и В у привитых детей составила 3,2-3,6. Анализ не выявил статистически значимых различий между количественными параметрами иммунного ответа в группах привитых однократно и двукратно.
В 2000 г. в состав вакцины был включен штамм А(H1N1) новой антигенной разновидности - A/17/Новая Каледония/99/50. Перед началом вакцинации подавляющее большинство детей (98%) были серонегативными к этому штамму. Сероконверсии сывороточных антител к вирусу А(H1N1) наблюдались в 26,4% случаев, при этом 4-х кратные приросты секреторных IgA к этому антигену наблюдались у 44% обследованных. Таким образом, даже при условии, что подавляющее большинство детей перед прививкой были серонегативными, при однократном применении взрослого варианта ЖГВ удалось стимулировать выраженный иммунный ответ. По данным 2-х эпидемических сезонов вакцинация привела к значительному снижению заболеваемости ОРЗ и гриппом в период эпидемического подъема среди привитых, коэффициент эффективности вакцинации ЖГВ в отношении гриппа и ОРЗ составил 64 %.
На основании полученных результатов тривалентная ЖГВ для взрослых, включающая реассортантные штаммы современных эпидемических вирусов на основе доноров аттенуации А/Ленинград/134/17/57(H2N2) и В/СССР/60/69, рекомендована для применения среди детей от 3-х лет и взрослых без ограничения возраста, в связи с чем внесены изменения в фармакопейную статью на ЖГВ ФСП 42-0504-4097-04.
Изучение на экспериментальной модели оптимальной схемы иммунизации реассортантным штаммом подтипа Н5. В случае формирования пандемического штамма одним из важнейших условий эффективности вакцины нового подтипа будет являться разработка стратегии и тактики ее применения как во время пандемического подъема, так и после него, в период стабилизации эпидемиологической ситуации, а именно: кратность применения, целесообразность включения в состав существующей поливалентной вакцины и возможности сочетания с другими профилактическими средствами. В связи с этим необходимо проводить исследования в направлении изучение взаимодействия вакцинных штаммов подтипа Н5 с реассортантными штаммами современных эпидемических вирусов, изучение иммуногенности и эффективности при различных схемах введения, включающих в себя комбинированное введение с ИГВ. На экспериментальной модели были изучены прививочные свойства вакцинного штамма Лен 17/Н5 при введении в составе поливалентной вакцины. Для оценки на мышах линии CBA инфекционной активности и иммуногенности реассортантного штамма Лен 17/Н5 при смешанном введении с реассортантами современных эпидемических вирусов было проведено интраназальное заражение ХА реассортантными штаммами Лен 17/Н5, А/17/Новая Каледония/99/145(H1N1), А/17/Висконсин/05/84(H3N2) и В/60/Малайзия/04/898 раздельно и в сочетании при заражающей дозе 6 lg ЭИД50 каждого вируса. Репродуктивную активность в легких определяли на 3-и сутки после инфекции по результатам титрования суспензии органов в РКЭ. Сыворотки крови для оценки иммуногенности были собраны через 28 дней после иммунизации. Результаты представлены в таблице 14.
